Задание с ответами: химия. ЕГЭ — 2018
При нагревании образца нитрата алюминия часть вещества разложилась, при этом выделилось 6,72 л газов (в пересчете на н. у.). Остаток массой 25,38 г полностью растворили в минимальном объеме 24 %-ного раствора гидроксида натрия. Определите массовую долю нитрата натрия в конечном растворе. В ответе напишите уравнения реакций, которые указаны в условии задачи, и приведите все необходимые вычисления.
При разложении нитрата алюминия (соли амфотерного металла) образуются оксид алюминия, бурый газ — диоксид азота (IV) и кислород:
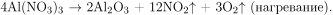
Поскольку в условии задачи речь идет о полном растворении остатка, состоящего из оксида и нитрата алюминия, то в итоге образуется комплексная соль алюминия — тетрагидроксоалюминат натрия:
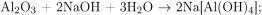
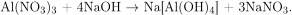
Вычислим количество вещества газа, выделившегося при разложении нитрата алюминия:
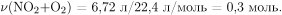
По уравнению реакции разложения нитрата алюминия 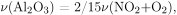 следовательно,
следовательно,
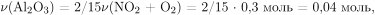
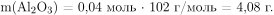
Вычислим массу и количество вещества оставшегося нитрата алюминия:
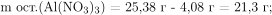
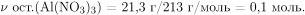
Вычислим количество вещества и массу взаимодействующего с оксидом и нитратом алюминия гидроксида натрия:
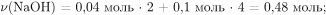
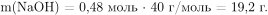
Масса 24%-ного раствора гидроксида натрия равна:
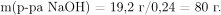
Вычислим количество вещества и масса образовавшегося в результате реакции нитрата алюминия со щелочью нитрата натрия:
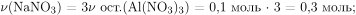
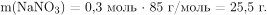
Вычислим массу образовавшегося раствора равна и массовую долю нитрата натрия:
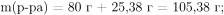
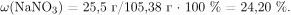
Правильный ответ: 24,20 %.