Совершенствование лекарств и новые фармацевтические технологии
Министерство здравоохранения Украины
Луганский Государственный медицинский университет
Кафедра технологии и организации экономики фармации.
Зав.каф. Гудзенко А.П.
Курсовая работа
с аптечной технологии лекарств
на тему: «Совершенствование лекарств и новые фармацевтические технологии»
Выполнил студент: 3 курса, 58 гр., фарм.факультета, Юрчило В.А
Научный руководитель:Кучеренко Н.В.
Луганск
2007
ПЛАН
Введение
1.Создание, доклиническое изучение и доклинические испытание лекарств.
1.1.Пути поиска и разработки новых средств.
1.2.Экспериментальное изучение и клинические испытания лекарств.
2.Пути совершенствования традиционных лекарств.
2.1.Биотехнология традиционных лекарств и лекарств будущего.
2.2.Состояние и перспективы развития производства терапевтических систем.
3.Фитотерапия и пути совершенствования производства экстракционных лекарств.
4.Основные направления усовершенствования технологии и качества мазей.
5.Основные направления усовершенствования супозиторных лекарств.
6.Новые твёрдые лекарственные формы пролонгированного действия.
Вывод
Список литературы
Введение
Перспективы развития фармацевтической технологии тесно связаны с влиянием научно-технического прогресса. На базе новейших научных открытий создаются принципиально новые, более совершенные и производительные технологические процессы, резко увеличивающие производительность труда и повышающие качество готовой продукции.
Технология оказывает значительное влияние на будущие экономические показатели производства, требует разработки малооперационных, ресурсосберегающих и безотходных процессов, их максимальной механизации, автоматизации и компьютеризации.
Для прогнозирования и оптимизации технологических процессов успешно применяется математическое планирование эксперимента, прочно вошедшее в технологическую науку и практику. Этот метод позволяет получать математические модели, связывающие параметр оптимизации с влияющими на него факторами, и дает возможность без длительного процесса выявлять их оптимальные технологические режимы.
Таким образом, технологии получили новые современные методы определения оптимальных конечных результатов с наименьшими затратами, что является наглядным примером того, как наука превращается в непосредственную производительную силу.
В результате возросшей роли и возможностей технологии необычно сокращаются сроки от возникновения идеи, первых результатов научных исследований до их реализации в промышленном производстве.
Перспективы развития фармацевтической технологии определяются требованиями современной фармакотерапии, которые предполагают создание максимально эффективных с лечебной точки зрения лекарственных препаратов при содержании в них минимума лекарственных субстанций, не обладающих побочными действиями. В основе решения этой задачи лежат положения и принципы биофармации, базирующиеся на оптимальном подборе состава и вида лекарственной формы и использовании оптимальных технологических процессов. Этим объясняется широкое распространение и углубление биофармацевтических исследований во многих странах.
Однако изучение биофармацевтических аспектов получения и назначения лекарственных препаратов, изучение "судьбы" лекарственных средств в организме — это лишь первый этап решения сформулированной выше задачи. Дальнейшие усилия должны быть направлены на реализацию полученных сведений в процессе производства и применения лекарственных препаратов с целью ликвидации таких их недостатков, как короткий срок действия; неравномерное поступление лекарственных веществ в патологический очаг; отсутствие избирательного действия; недостаточная стабильность и др.
Лишь те лекарства могут считаться рациональными, которые обеспечивают оптимальную биологическую доступность действующих веществ. Следовательно, к современным лекарствам могут относиться и традиционные, например, таблетки, мази, суппозитории и др., если они обеспечивают рациональную фармакотерапию.
К первоочередным задачам фармацевтической технологии следует отнести повышение растворимости труднорастворимых лекарственных веществ в воде и липидах; увеличение стабильности гомогенных и гетерогенных лекарственных систем; продление времени действия лекарственных препаратов; создание лекарств направленного действия с заданными фармакологическими свойствами.
Совершенствование регулируемости и направленности действия биологически активных веществ является основным направлением в развитии фармацевтической технологии. Разработанные лекарственные системы с регулируемым высвобождением действующих веществ позволяют быстро достичь лечебного эффекта, длительно удерживать постоянный уровень их терапевтической концентрации в плазме крови. Как показала практика, использование таких лекарственных систем дает возможность уменьшить курсовую дозу, устранить раздражающее действие и передозировку лекарственных веществ, уменьшить частоту проявлений побочных эффектов.
Особого внимания заслуживают так называемые терапевтические системы для перорального и трансдермального применения (см. гл. 9), номенклатура которых во многих странах с каждым годом расширяется.
Наиболее перспективны в области современной фармакотерапии терапевтические системы с направленной доставкой лекарственных веществ к органам, тканям или клеткам. Направленная доставка позволяет значительно снизить токсичность лекарственных веществ и экономно их расходовать. Около 90% лекарственных веществ, применяемых в настоящее время, не достигает цели, что свидетельствует об актуальности данного направления в фармацевтической технологии.
Терапевтические системы с направленной доставкой лекарственных веществ принято подразделять на три группы:
носители лекарственных веществ первого поколения (микрокапсулы, микросферы) предназначены для внутрисосудистого введения вблизи определенного органа или ткани;
носители лекарственных веществ второго поколения (нанокап-сулы, липосомы) размером менее 1 мкм объединяются в одну группу под названием коллоидных носителей. Они распределяются преимущественно в селезенке и печени — тканях, богатых клет-
коми ретикуло-эндотелиальной системы. Разработаны методы получения нанокапсул с фенобарбиталом, диазепамом, преднизо-лоном, инсулином, простагландинами; наносфер с цитостатика-ми, кортикостероидами; изучаются липосомы для доставки ферментов, хелатирующих и химиотерапевтических, противовоспалительных, противовирусных и белковой природы (инсулина) веществ;
носители лекарственных веществ третьего поколения (антитела, гликопротеиды) открывают новые возможности обеспечения высокого уровня избирательного действия и направленной их доставки.
Для транспорта и локальной доставки лекарственных веществ к органу-мишени могут быть использованы магнитоуправляемые системы. Создавая в органе депо лекарственного вещества, они могут пролонгировать его действие.
1.Создание, доклиническое изучение и доклинические испытание лекарств.
Основной источник получения лекарств из растительного, животного и минерального сырья, существовавший с древних времен, в середине XIX века вытесняется лекарственными субстанциями, полученными с помощью химического синтеза, существующего по сегодняшний день. В начале XX века приобрел распространение способ получения субстанций в виде антитоксических, антимикробных сывороток и профилактических вакцин. В 40-х годах была разработана технология антибиотиков и сульфаниламидов. 70-е годы ознаменовались развитием биотехнологии, которая, стремительно развиваясь, в настоящее время выдвинулась на передний край научно-технического прогресса.
За последние 20 лет значительно расширились возможности и эффективность лекарственной терапии, что обусловлено созданием и внедрением в медицинскую практику большого количества новых лекарственных средств и, в первую очередь таких высокоэффективных, как антибиотики и сульфаниламиды нового поколения, а также психотропные, гипотензивные, противодиабетические и др. Номенклатура лекарств, применяющихся в медицинской практике, обновилась на 60-80% и насчитывает свыше 40 тыс. наименований индивидуальных и комбинированных составов. Этому способствовали прежде всего фундаментальные успехи химических, фармацевтических, медико-биологических и других смежных наук, обеспечивших дальнейшее развитие фармацевтической отрасли.
1.1. Пути поиска и разработки новых лекарственных средств (препаратов)
Создание новых лекарственных субстанций и препаратов — процесс весьма трудоемкий и дорогостоящий, в котором участвуют представители многих профессий: химики, фармацевты, фармакологи, токсикологи, врачи-клиницисты, биологи и др. Эти совместные усилия специалистов не всегда завершаются успешно. Так, из 7 тысяч синтезированных соединений только одно становится лекарственным средством.
Для поиска новых синтетических лекарственных субстанций или субстанций из лекарственного растительного сырья еще не разработаны устойчивые теории.
Общепринятым каноном целенаправленного поиска синтезированных лекарственных средств является установление связей между фармакологическим действием и структурой с учетом их физико-химических свойств. В настоящее время поиск новых лекарственных средств (по А.Н.Кудрину) ведется по следующим направлениям.
Э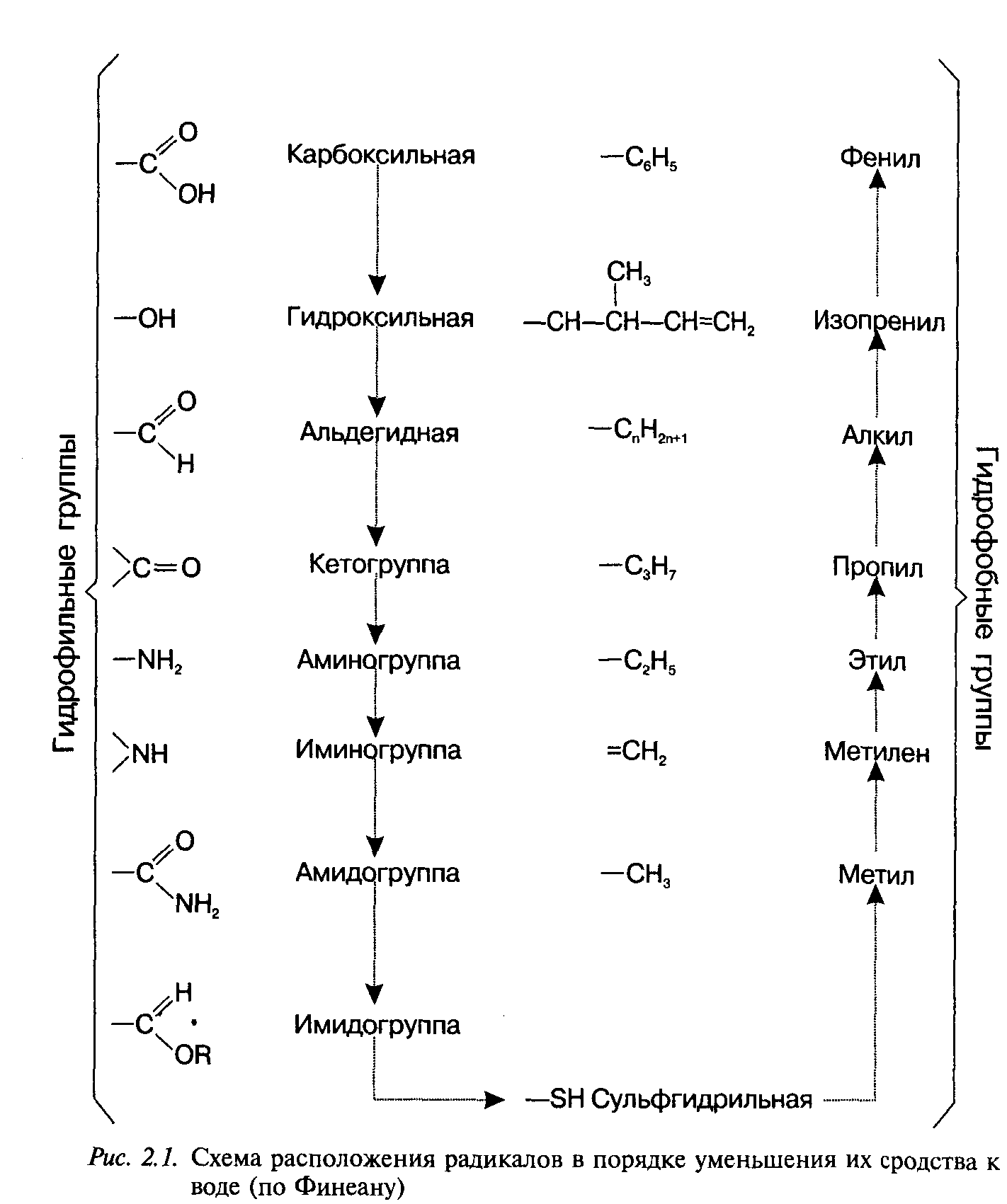
мпирическое
изучение БАВ основано на представлении,
что многие вещества обладают определенной
фармакологической активностью. В
основе этого изучения лежит метод "проб
и ошибок", с помощью которого
фармаколог определяет принадлежность
полученных веществ к той или иной
фармакотерапевтиче-ской группе. Затем
среди них отбираются наиболее активные
вещества и устанавливается степень их
специфической активности и токсичности
по сравнению с существующими лекарственными
средствами — аналогами по действию.
Такой путь отбора фармакологически
активных веществ получил название
скрининга. Это весьма дорогой и
трудоемкий метод, так как приходится
иметь дело с большим количеством
различных биологически активных веществ.
Объем первичных исследований изучаемого вещества зависит от его природы. Если оно является производным известного ряда соединений, то, как правило, ограничиваются лишь сравнительным изучением его специфического действия. Если вещество оригинальное, то планируется целенаправленное всестороннее его изучение. Рассматривается такое соединение как потенциальное лекарственное вещество. Уже на начальной стадии планирования в исследования включают изучение химических и физических свойств, разработку методов стандартизации и контроля за его качеством. Последующие экспериментальные исследования должны проводиться только с сериями вещества, полученного по технологии, обеспечивающей его стандартные качественные и количественные характеристики.
Модификация структур существующих лекарственных средств — весьма распространенное направление. Химики заменяют в существующем соединении один радикал другим, например, метальный этильным, пропильным и другими алкильными радикалами с более высокой молекулярной массой или, наоборот, вводят в состав исходной молекулы новые химические элементы, в частности галогены, нитрогруппы, или производят иные модификации основной структуры. Этот путь позволяет изменить структуру молекулы вещества, что приводит к изменению его активности, уменьшению отрицательных свойств и токсичности, придает совершенно новую направленность терапевтическому действию.
По мере развития науки стало совершенно очевидным, что оптимальный поиск новых лекарственных средств должен базироваться на выявлении БАВ, участвующих в процессах жизнедеятельности, на раскрытии патофизиологических и патохимиче-ских процессов, лежащих в основе патогенеза различных заболеваний, а также на углубленном изучении механизмов фармакологического эффекта. В подходах к скрининговым исследованиям должен лежать не метод случайных наблюдений, а направленный синтез веществ с улучшенными свойствами и предполагаемой активностью.
Целенаправленный синтез лекарственных веществ означает поиск веществ с заранее заданными фармакологическими свойствами. Синтез новых структур с предполагаемой активностью чаще всего проводится в том классе химических соединений, где уже найдены вещества, обладающие определенной направленностью действия в нужном для исследователя аспекте. Целенаправленный синтез веществ труднее осуществлять в новых химических классах соединений ввиду отсутствия необходимых первоначальных сведений о связи фармакологической активности со структурой вещества. Далее в избранное основное вещество вводят различные радикалы. Очень важно получить вещество, растворимое в воде и жирах, чтобы оно могло всосаться в кровь, перейти из нее через гематотканевые барьеры в органы и затем вступить в связь с клеточными мембранами или проникнуть через них внутрь клетки и соединиться с биомолекулами. представлены наиболее часто встречающиеся в лекарственных веществах радикалы и их сродство к воде и липидам. С помощью указанных и аналогичных им радикалов можно повысить лечебную активность липотропных веществ. Например, введение фтора в молекулу психотропных средств фенотиазинового ряда и в молекулу глюкокортикоидных гормонов существенно повышает их активность. Поиск новых биологически активных веществ дает удовлетворительные результаты при синтезе антагонистов тех веществ, которые участвуют в жизнедеятельности организма (медиаторы, витамины, гормоны) или являются незаменимыми участниками биохимических процессов (субстраты ферментов, коферменты и др.).
При синтезе новых лекарственных веществ их фармакологическая активность определяется не только размерами и формой молекулы, но и в значительной степени стерическими факторами, кото которые влияют на положение молекул в пространстве. Например, транс-амин (транилципромин) оказывает антидепрессивное действие

с возбуждающим эффектом. Его геометрический изомер — цис-амин сохраняет антидепрессивное действие, но при этом у него исчезает возбуждающий эффект и появляется противоположный ему транквилизирующий компонент действия, являющийся весьма ценным в практическом отношении.
У изомеров может изменяться не только фармакологическая активность, но и токсичность. Токсичность цис-амина по показателю LDso (на мышах) в 6 раз меньше, чем у транс-амина, поэтому при целенаправленном синтезе нового лекарственного вещества возникает необходимость изучения его изомеров.
Рондомизированный скрининг позволяет получить принципиально новые синтетические или природного происхождения вещества на основании скринингового исследования на животных с помощью набора тестов по изучению эффективности и безопасности новых соединений. В последнее время с помощью этого сложного скринингового исследования в медицинскую практику были внедрены психотропное средство антидепрессант — пиразидол, противовирусный препарат — арбидол и др.
Велика значимость в медицинской практике лекарственных субстанций, полученных из растительного сырья, которые имеют ряд преимуществ по сравнению с синтетическими веществами (более мягкое, часто пролонгированное действие); они, как правило, не вызывают аллергических осложнений .
Ход и содержание эксперимента (поиск, изучение и постановка на производство) с новым лекарственным средством, выделенным из растительного сырья, могут быть определены стандартом предприятия .
Следует отметить, что поиск оригинальных лекарственных субстанций не всегда экономически выгоден, особенно для слаборазвитых стран, поскольку требует больших затрат на доведение их до производства, а высокая стоимость лекарств, изготовленных на основе этих субстанций, делает их недоступными для потребителя. Поэтому многие фармацевтические фирмы для создания лекарственных препаратов используют импортные субстанции, хорошо себя
зарекомендовавшие в медицинской практике и время патентной защиты которых истекло. Эти препараты называют генериками (ge-nerics). Примером такого подхода может быть производство септри-ма (английской фирмы "Welcome") и бисептола (польской фирмы "Polfa") на базе сульфаметоксазола (0,4 г) и триметоприма (0,08 г). Такой путь создания лекарств позволяет быстрее насытить ими рынок, значительно снизить экономические затраты на их создание, улучшив качество за счет более оптимального подбора вспомогательных веществ и технологических приемов.
Необходимо отметить, что стоимость препаратов-генериков иногда составляет 20-60% от стоимости аналогичных импортных лекарств.
Выявление новых свойств у лекарственных препаратов, уже применяющихся в клинике, путем тщательного наблюдения за их действием на различные системы организма. Таким образом было установлено гипотензивное свойство р-адреноблокаторов, проти-вотромбическая активность ацетилсалициловой кислоты.
Составление композиций комбинированных препаратов — один из путей поиска новых лекарств. Принципы, на основе которых создаются эти лекарства, могут быть различными.
Чаще всего в комбинированные препараты включают лекарственные вещества, оказывающие адекватное действие на причину заболевания и основные звенья патогенеза болезни. В комбинированный препарат обычно включают лекарственные вещества в малых или средних дозах, когда между ними существуют явления синергизма — взаимного усиления действия в виде потенцирования или суммирования. Комбинированные препараты интересны тем, что принципы синергизма, на основе которых они созданы, позволяют добиться лечебного эффекта при отсутствии или минимуме отрицательных явлений. Кроме того, введение малых доз лекарственных веществ не нарушает естественных защитных или компенсаторных механизмов, развивающихся в организме в ответ на болезнь. К средствам, подавляющим отдельные звенья патологии, желательно добавлять лекарственные вещества, стимулирующие защитные силы организма.
В комбинированные препараты, регулирующие деятельность центральной нервной системы, необходимо включать вещества, соответственно влияющие на деятельность исполнительных органов — сердце, сосуды, почки и др.
Комбинированные препараты противомикробного действия составляются из таких ингредиентов, каждый из которых повреждает разные системы размножения и жизнеобеспечения микробов.
В комбинированные препараты очень часто включаются дополнительные ингредиенты, которые усиливают (расширяют) эффективность основного вещества или устраняют его отрицательное действие. Так, комбинированный препарат "Солпадеин R", содержащий парацетамол и кодеин, обеспечивает более выраженный анальгизирующий эффект по сравнению с используемыми субстанциями, взятыми отдельно, поскольку болевые импульсы "перекрываются" на всем протяжении от периферии до центра и наоборот (кодеин оказывает центральное действие, а парацетамол наряду с этим — периферическое). Кроме того, такое сочетание двух субстанций позволяет уменьшить их дозу, сохранив продолжительность и эффективность действия.
Для профилактики и лечения многих заболеваний, а также для повышения сопротивляемости организма к инфекциям и во многих других случаях используются поливитаминные препараты, часто содержащие микроэлементы. Их составы формируются с учетом назначения: поливитамины общего назначения ("Альвитил", "Вит-рум", "Дуовит", "Мегавит", "Мульти-табс", "Олиговит", "Супра-дин", "Юникап Ю" и др.); для профилактики заболеваний нервной и сердечно-сосудистой системы ("Биовиталь", "Мультивитамины плюс", "Желе Роял"); для профилактики кариеса ("Ви-Дайлин Ф", "Ви-Дайлин Ф-АДС с железом", "Витафтор"); для профилактики онкозаболеваний ("Детский антиоксидант", "Супрантиоксидант", "Триовит"); для применения в период беременности ("Гравинова", "Матерна", "Поливит нова вита", "Прегнавит"). Они имеют различные лекарственные формы (таблетки, таблетки шипучие, драже, сиропы, капли, капсулы, растворы и т.д.), различный режим дозирования и условия применения.
Широкий ассортимент комбинированных витаминных составов позволяет осуществить индивидуальный подбор лекарств для каждого конкретного случая.
1.2.Экспериментальное изучение и клинические испытания лекарств.
Реализация жесткого требования современной фармакотерапии — минимальной дозой лекарства обеспечить оптимальный терапевтический эффект без побочных явлений — возможна лишь при тщательном изучении новых лекарственных препаратов на доклиническом и клиническом этапах.
Доклиническое (экспериментальное) изучение биологически активных веществ принято условно подразделять на фармакологическое и токсикологическое. Эти исследования взаимозависимы и строятся на одних и тех же научных принципах. Результаты изучения острой токсичности потенциального фармакологического вещества дают информацию для проведения последующих фармакологических исследований, которые в свою очередь определяют степень и продолжительность изучения хронической токсичности вещества.
Целью фармакологических исследований является определение терапевтической эффективности исследуемого продукта — будущего лекарственного вещества, его влияния на основные системы организма, а также установление возможных побочных эффектов, связанных с фармакологической активностью.
Очень важно установить механизм действия фармакологического средства, а при наличии — и не основных видов действия, а также возможное взаимодействие с другими лекарственными средствами.
Фармакологические исследования проводятся на моделях соответствующих заболеваний или патологических состояний с применением однократно вводимых, постоянно возрастающих доз веществ с целью поиска необходимого эффекта. Данные начальных фармакологических исследований уже могут дать некоторые представления о токсичности вещества, которые должны быть углублены и расширены при специальных исследованиях.
При токсикологических исследованиях фармакологического средства устанавливается характер и выраженность возможного повреждающего воздействия на организм экспериментальных животных. Выделяются четыре этапа исследований.
1. Изучение основного вида фармакологической активности на нескольких экспериментальных моделях у животных, а также установление фармакодинамики лекарственного средства.
2.Изучение
острой токсичности средства при
однократном при
менении (введении)
проводят с целью определения наличия
побоч
ных реакций при однократном
приеме увеличенной дозы и установ
лении
причин летальности; широты терапевтического
действия или
терапевтического индекса
Эрлиха (отношение максимально перено
симой
дозы к максимальной терапевтической),
что невозможно
установить в клинических
условиях. При изучении острой токсич
ности
определяют показатель DLso для различных
видов животных
и рассчитывают
коэффициент видовой чувствительности
по отно
шению DL50max/DE50min. Если этот
коэффициент равен 1 или
близок к ней,
то это свидетельствует об отсутствии
видовой чувст
вительности. Если
же коэффициент значительно отличается
от
единицы, это указывает на различную
выраженность токсического
действия
фармакологического средства на разные
виды млекопита
ющих, что необходимо
учитывать при пересчете
экспериментальной
эффективной дозы
для человека.
3.Определение
хронической токсичности соединения,
которое
включает в себя повторные
введения фармакологического средства
на
протяжении определенного времени в
зависимости от предпола
гаемого
курса его применения в клинике. Исследуемое
средство
обычно вводят ежедневно в
трех дозах: близкой к
терапевтической,
предполагаемой
терапевтической и максимальной с целью
выявле
ния токсичности. Во время
эксперимента определяется объем
по
требления животными корма и
воды, динамика их массы, изменение
общего
состояния и поведения (реакций); проводятся
гематологи
ческие и биохимические
исследования. По окончании
эксперимента
животных забивают и
проводят патоморфологические
исследования
внутренних органов,
мозга, костей, глаз.
4.Установление
специфической токсичности
фармакологи
ческого средства
(канцерогенное™, мутагенности,
эмбриотоксич-
ности, гонадотоксичности,
аллергизирующих свойств, а также
спо
собности вызывать лекарственную
зависимость, иммунотоксичес-
кого
действия).
Выявление повреждающего действия испытуемого средства на организм экспериментальных животных дает исследователям информацию о том, какие органы и ткани наиболее чувствительны к потенциальному лекарственному средству и на что следует обратить особое внимание при проведении клинических испытаний.
Исследование новых фармакологических средств на животных основывается на данных о существовании определенной корреляции между влиянием этих соединений на животных и человека, физиологические и биохимические процессы которых во многом сходны. В связи с тем, что между животными имеются существенные видовые различия в интенсивности обмена веществ, активности ферментных систем, чувствительных рецепторов и т.д., исследования проводят на нескольких видах животных, включая кошек, собак, обезьян, которые в филогенетическом отношении стоят ближе к человеку.
Следует отметить, что аналогичная схема проведения лабораторных (экспериментальных) исследований приемлема как для простого, так и для сложного лекарственного препарата, в эксперименте с которым планируются обязательные дополнительные биофармацевтические исследования, подтверждающие оптимальный выбор вида лекарственной формы и ее состава .
Экспериментальное доклиническое изучение нового средства (его фармацевтических, фармакологических и токсикологических свойств) проводится по стандартным унифицированным методикам, которые обычно описываются в методических рекомендациях Фармакологического комитета, и должно отвечать требованиям Good Laboratory Practice (GLP) — Надлежащей лабораторной практики (НЛП).
Доклинические исследования фармакологических веществ позволяют разработать схему рациональных испытаний лекарственных препаратов в условиях клиники, повысить их безопасность. Несмотря на большую значимость доклинических исследований новых веществ (препаратов), окончательное суждение об их эффективности и переносимости складывается только после проведения клинических испытаний, а нередко, и после определенного периода их широкого применения в медицинской практике.
Клинические испытания новых лекарственных средств и препаратов должны проводиться с максимальным соблюдением требований международного стандарта "Надлежащая клиническая практика" (Good Clinical Practice (GCP)), который регламентирует планирование, проведение (дизайн), мониторинг, длительность, аудит, анализ, отчетность и ведение документации исследования.
При проведении клинических испытаний лекарственных препаратов используются специальные термины, в содержание которых вкладывается определенный смысл. Рассмотрим основные термины, принятые GCP.
Клинические испытания — систематическое изучение исследуемого препарата на людях в целях проверки его лечебного действия или выявления нежелательной реакции, а также изучение всасывания, распределения, метаболизма и выведения из организма для определения его эффективности и безопасности.
Исследуемый продукт — фармацевтическая форма активного вещества или плацебо, изучаемого или используемого для сравнения в клиническом испытании.
Спонсор (заказчик) — физическое или юридическое лицо, которое принимает на себя ответственность за инициативу, управление и/или финансирование клинических испытаний.
Исследователь — лицо, ответственное за проведение клинического испытания.
Субъект испытания — лицо, участвующее в клинических испытаниях исследуемого продукта.
Гарантия качества клинических испытаний — комплекс мер, обеспечивающих соответствие проводимых испытаний требованиям GCP, основанных на нормах общей и профессиональной этики, стандартных операционных процедурах и отчетности.
Для проведения клинических испытаний заводом-изготовителем нарабатывается определенное количество препарата, контролируется его качество в соответствии с требованиями, заложенными в проекте ВФС, затем он фасуется, маркируется (указывается "Для клинических испытаний") и направляется в медицинские учреждения. Одновременно с лекарственным препаратом в адрес клинических баз направляется следующая документация: представление, решение ГНЭЦЛС, программа клинических испытаний и др.
Решение о проведении клинических испытаний с правовой точки зрения и их оправданность в этическом отношении основывается на оценке экспериментальных данных, полученных в опытах на животных. Результаты экспериментальных, фармакологических и токсикологических исследований должны убедительно свидетельствовать о целесообразности проведения испытаний нового лекарственного препарата на людях.
В соответствии с существующим законодательством клинические испытания нового лекарственного препарата проводятся на больных, страдающих теми заболеваниями, для лечения которых предназначено данное лекарство.
Министерством здравоохранения утверждены методические рекомендации по клиническому изучению новых лекарств, относящихся к различным фармакологическим категориям. Они разрабатываются ведущими учеными медицинских учреждений, обсуждаются и утверждаются Президиумом ГНЭЦЛС. Применение этих рекомендаций гарантирует безопасность больных и способствует повышению уровня клинических испытаний.
Любое исследование на человеке должно быть хорошо организовано и проводиться под контролем специалистов. Неправильно проведенные испытания признаются неэтичными. В связи с этим большое внимание уделяется планированию клинических испытаний.
Для того чтобы в работе врачей не проявлялись узкопрофессиональные интересы, которые не всегда отвечают интересам больного и общества, а также с целью обеспечения прав человека, во многих странах мира (США, Великобритания, Германия и др.) созданы специальные этические комитеты, призванные контролировать научные исследования лекарств на людях. Этический комитет создан и в Украине.
Приняты международные акты об этических аспектах проведения медицинских исследований на людях, например, Нюрнбергский кодекс (1947), в котором отражены вопросы защиты интересов человека, в частности, неприкосновенности его здоровья, а также Хельсинская декларация (1964), содержащая рекомендации для врачей по биомедицинским исследованиям на людях. Изложенные в них положения носят рекомендательный характер и в то же время не освобождают от уголовной, гражданской и моральной ответственности, предусмотренной законодательствами этих стран.
Медико-правовые основы этой системы гарантируют как безопасность и своевременное адекватное лечение больных, так и обеспечение общества наиболее эффективными и безопасными лекарствами. Только на основе официальных испытаний, методически верно спланированных, объективно оценивающих состояние больных, а также научно проанализированных экспериментальных данных можно сделать правильные выводы о свойствах новых лекарств.
Программы клинических испытаний для различных фармакоте-рапевтических групп лекарственных препаратов могут значительно отличаться. Однако имеется ряд основных положений, которые всегда отражаются в программе: четкая формулировка целей и задач испытания; определение критериев выбора для испытаний; указание методов распределения больных в испытуемую и контрольную группы; число больных в каждой группе; метод установления эффективных доз лекарственного препарата; длительность и метод проведения испытания контролируемого препарата; указание препарата сравнения и/или плацебо; методы количественной оценки действия используемого препарата (подлежащие регистрации показатели); методы статистической обработки полученных результатов (рис. 2.3).

Программа клинических испытаний проходит обязательную экспертизу в комиссии по вопросам этики.
Участвующие в испытании нового препарата пациенты (добровольцы) должны получить информацию о сути и возможных последствиях испытаний, ожидаемой эффективности лекарства, степени риска, заключить договор о страховании жизни и здоровья в порядке, предусмотренном законодательством, а во время испытаний находиться под постоянным наблюдением квалифицированного персонала. В случае возникновения угрозы здоровью или жизни пациента, а также по желанию пациента или его законного представителя, руководитель клинических испытаний обязан приостановить испытания. Кроме того, клинические испытания приостанавливаются в случае отсутствия или недостаточной эффективности лекарства, а также нарушения этических норм.
Клиническая апробация генерических препаратов в Украине проводится по программе "Ограниченные клинические испытания" по установлению их биоэквивалентности.
В процессе клинических испытаний лекарства выделяют четыре взаимосвязанные фазы: 1 и 2 — дорегистрационные; 3 и 4 — пострегистрационные.
Первая фаза исследования проводятся на ограниченном числе больных (20-50 человек). Цель — установление переносимости лекарственного препарата.
Вторая фаза — на 60-300 больных при наличии основной и контрольной групп и использовании одного или нескольких препаратов сравнения (эталонов), желательно с одинаковым механизмом действия. Цель — проведение контролируемого терапевтического (пилотного) исследования препарата (определение диапазонов: доза — режим применения и, если возможно, доза — эффект) для оптимального обеспечения дальнейших испытаний. Критериями оценки обычно служат клинические, лабораторные и инструментальные показатели.
Третья фаза — на 250-1000 человек и более. Цель — установить краткосрочный и долгосрочный баланс безопасность — эффективность лекарственного препарата, определить его общую и относительную терапевтическую ценность; изучить характер встречающихся побочных реакций, факторы, изменяющие его действие (взаимодействие с другими лекарственными препаратами и др.). Испытания должны быть максимально приближенными к предполагаемым условиям использования данного лекарственного препарата.
Результаты клинического испытания заносятся в индивидуальную стандартную карту каждого больного. В конце испытания полученные результаты суммируются, обрабатываются статистически и оформляются в виде отчета (в соответствии с требованиями ГНЭЦЛС), который заканчивается аргументированными выводами.
Отчет о клинических испытаниях лекарственного препарата направляется в ГНЭЦЛС, где подвергается тщательной экспертизе. Конечным результатом экспертизы всех поступивших в ГНЭЦЛС материалов является инструкция по применению лекарственного препарата, регламентирующая его применение в клинических условиях.
Лекарственный препарат может быть рекомендован к клиническому применению в том случае, если он эффективнее известных лекарств аналогичного типа действия; обладает лучшей переносимостью по сравнению с известными препаратами (при одинаковой эффективности); эффективен при состояниях, когда применение имеющихся лекарств безуспешно; экономически более выгоден, имеет более простую методику применения или более удобную лекарственную форму; при комбинированной терапии повышает эффективность уже существующих лекарств, не увеличивая их токсичности.
Четвертая фаза (постмаркетинговая) исследований проводится на 2000 и более человек после разрешения лекарственного препарата к медицинскому применению и промышленному производству (после поступления лекарства в аптеку). Основная цель — сбор и анализ информации о побочных эффектах, оценка терапевтической ценности и стратегии назначения нового лекарственного препарата. Исследования в четвертой фазе осуществляются на основе информации в инструкции по применению препарата.
При проведении клинических испытаний новых лекарственных препаратов важнейшей задачей является обеспечение их качества. Для достижения этой цели осуществляется мониторинг, аудит и инспекция клинических испытаний.
Мониторинг — деятельность по контролю, наблюдению и проверке клинического испытания, осуществляемая монитором. Монитор является доверенным лицом организатора клинических испытаний (спонсора), на которого возлагается обязанность непосредственно контролировать ход исследования (соответствие полученных данных данным протокола, соблюдение этических норм и др.), оказывать помощь исследователю в проведении испытания, обеспечивать его связь со спонсором.
Аудит — независимая проверка клинического испытания, которая проводится службами или лицами, не участвующими в нем.
Аудит может проводиться также представителями государственных органов, отвечающих за регистрацию лекарственных препаратов в стране. В этих случаях аудит называется инспекцией.
Работая параллельно для достижения единой цели, монитор, аудиторы и официальные инспекции обеспечивают необходимое качество клинических испытаний.
При проведении клинических испытаний с участием большого количества пациентов возникает необходимость в оперативной обработке результатов исследования. С этой целью корпорацией "Pfizer" разработаны новые методы информатики (компьютерная программа "Q-NET" для обработки базы данных, полученных при исследовании препарата "Viagra"), позволяющие ознакомиться в течение суток с результатами клинических испытаний с участием 1450 пациентов, которые проводятся в 155 клинических центрах, находящихся в различных странах. Создание таких программ позволяет сократить до минимума время продвижения новых препаратов на этапе клинических испытаний.
Таким образом, эффективность и безопасность лекарств гарантируется:
испытаниями в условиях клиники;
постмаркетинговыми клиническими исследованиями при широком медицинском применении лекарств;
тщательной экспертизой результатов на всех указанных выше этапах.
Наличие комплексной оценки эффективности и безопасности лекарств и экстраполяции результатов на трех этапах позволяет выявить механизмы возможного побочного действия, уровня ток сичности лекарства, а также разработать наиболее оптимальные схемы его применения.
Вырисовывается перспектива комплексного подхода, основанного на оптимальном сочетании принципов биофармации, новейших достижений химических и фармацевтических технологий, с широким привлечением клинического опыта к созданию и производству новых лекарственных препаратов. Такой подход к этой проблеме является качественно новым в фармацевтической практике и, очевидно, позволит раскрыть новые возможности в сложном процессе создания и использования лекарственных препаратов.
2. Пути совершенствования традиционных лекарств
При разработке новых лекарственных средств с уже известным действием предпринимаются попытки увеличить их специфичность. Так, сальбутанол — одно из новых бронхорасширяющих средств — стимулирует р-адренорецепторы в дозах, которые оказывают незначительное действие на адренергические рецепторы сердца. Предни-золон является более ценным стероидом, чем кортизон, так как при одинаковом противовоспалительном эффекте он в меньшей степени задерживает соли в организме.
С целью преодоления таких нежелательных свойств лекарственных веществ, как горький или кислый вкус, неприятный запах, раздражающее действие желудочно-кишечного тракта, боль при инъекциях, незначительная абсорбция, медленный или быстрый процессы метаболизма, нестабильность и другие, в фармакотерапии
используются различные модификации лекарственных веществ (биологическая, физико-химическая, химическая). Для того чтобы показать наличие изменения структуры лекарственного вещества, введен термин "пролекарство", который обозначает химическую модификацию субстанции. В организме это новое соединение подвергается ферментации и высвобождается в виде его немодифицированной формы. В настоящее время за рубежом выпускается более 100 наименований лекарственных препаратов, содержащих антибиотики, стероидные гормоны, простагландины в виде пролекарств.
Особого внимания заслуживают так называемые комбинированные лекарственные препараты, в которых сочетание составных компонентов осуществляется на базе обоснованного научного эксперимента.
Поскольку патогенез (причина возникновения и развития болезненного процесса в организме) вирусных респираторных инфекций представляет собой сложный комплексный процесс, затрагивающий разные участки верхних дыхательных путей, то и противопростудные препараты должны быть комплексными и обладать полифармакоте-рапевтическими эффектами. Другими словами, в комплексный препарат должны входить вещества, действующие на различные звенья патогенетической цепи и устранять основные симптомы простудных заболеваний.
Таблетки "Колдрекса" состоят из 500 мг парацетамола, 5 мг фенилэфрина гидрохлорида (метазона), 25 мг кофеина, 20 мг тер-пингидрата, 30 мг кислоты аскорбиновой.
Парацетамол обладает обезболивающим и жаропонижающим действием, близок по химической структуре к фенацетину и является его активным метаболитом, обусловливающим анальгетический эффект. Однако в отличие от фенацетина он не вызывает метгемогло-бинемии, не оказывает токсического действия на канальцевый аппарат почек. Кроме того, в отличие от аспирина парацетамол не обладает ульцерогенным действием, не вызывает желудочно-кишечных кровотечений и может применяться даже больными с язвенной болезнью; в отличие от анальгина не вызывает осложнений со стороны крови в виде гранулоцитопений и гранулоцитоза.
Фенилэфрин гидрохлорид (метазон) путем воздействия на альфа-адренорецепторы вызывает сужение артериол в слизистой оболочке носа, способствуя снятию отека и устранению слизи, ощущения заложенности носа, уменьшению ринорреи и нормализации носового дыхания.
Кофеин потенцирует обезболивающее действие парацетамола, оказывает общетонизирующее действие, улучшает самочувствие больного.
Терпингидрат способствует разложению секрета в бронхах и более легкому его отхаркиванию; освобождая от закупорки дыхательные пути, способствует облегчению дыхания; обладает противовоспалительным действием.
Аскорбиновая кислота восполняет дефицит витамина С в организме, активирует иммунную систему, нормализует тканевое дыхание, способствуя таким образом усилению защитных механизмов организма.
Известны и другие комбинированные препараты "Колдрекса": "Колдрекс хот рем" (порошок в пакетах для растворения в горячей воде) и "Колдрекс найт" (сироп), которые содержат, кроме парацетамола, прометазин гидрохлорид, обладающий седативным и жаропонижающим эффектами, а также антиаллергическими свойствами, и декстраметорфан гидробромид, оказывающий противокашлевое действие. Он в отличие от кодеина не угнетает дыхание, не вызывает привыкания. Прием этих комбинированных препаратов целесообразен при болях в горле или затрудненном дыхании. Их прием в вечернее время обеспечивает противокашлевый эффект в течение ночи, что способствует нормализации сна.
Примером комбинированного препарата может служить также "Солпадеин солюбл", выпускаемый той же фармацевтической компанией в виде таблеток (500 мг парацетамола, 8 мг кодеина, 30 мг кофеина). Благодаря быстрому многонаправленному воздействию на периферические и центральные болевые рецепторы, препарат рекомендуется для купирования послеоперационного болевого синдрома. По эффективности превосходит анальгин.
Комбинированный препарат "Пафеин", выпускаемый в виде таблеток, содержащих 500 мг парацетамола и 50 мг кофеина (производитель ФФ "Дарница"), обладает мягким обезболивающим, жаропонижающим и противовоспалительным действием. Кофеин, входящий в состав "Пафеина", повышает, пролонгирует и ускоряет фармацевтическое действие парацетамола. Под действием "Пафеина" уменьшаются катаральные явления (слезотечение, першение в горле, насморк), быстро исчезают симптомы интоксикации (слабость, потливость и др.). "Пафеин" особенно эффективен при проявлении первых признаков заболевания.
Комбинированный препарат "Панадол экстра" содержит 500 мг парацетамола и 65 мг кофеина, является эффективным анальгетиком.
В последние годы на рынке лекарств реализуются многочисленные комбинированные препараты, содержащие парацетамол и анти-гистаминные, отхаркивающие, противокашлевые, бронхорасширя-ющие и противовоспалительные лекарственные средства. Так в "Томапирине" (производитель фирма "Берингер Инчельхайм") парацетамол (200 мг) сочетается с ацетилсалициловой кислотой (250 мг), что приводит к потенцированию анальгетического и жаропонижающего эффектов этих веществ. Сочетание этих веществ с кофеином (50 мг) приводит к повышению эффективности комбинации данного состава примерно на 40%, за счет чего появляется возможность уменьшения дозы парацетамола и ацетилсалициловой кислоты. Кроме того, это приводит к улучшению переносимости комбинированного препарата.
Димедрол и другие антигистаминные средства в сочетании с парацетамолом применяются для облегчения симптомов заболевания при бронхитах, аллергических ринитах. Такие лекарственные средства, как фенилэфрин, эфедрин, псевдоэфедрин и др. являются эффективными сосудосуживающими препаратами, снижающими отек слизистой оболочки носовых ходов. В комбинации с парацетамолом они используются для купирования головной боли, лихорадки, застойных явлений в слизистой оболочке верхних дыхательных путей у детей с ринитами, острыми респираторными заболеваниями. Противокашлевые средства (дифенгидрамин) в сочетании с парацетамолом используются для облегчения головной боли, лихорадки, боли в горле и при кашле у больных гриппом и простудными заболеваниями.Консультативной комиссией по безрецептурным лекарственным препаратам при ВДА США допускаются комбинированные составы, содержащие парацетамол и три дополнительных компонента, в случае их использования для облегчения симптоматики, связанной с простудой, гриппом, аллергическим ринитом, бронхитом.
Известный комбинированный препарат "Гиналгин" в виде вагинальных таблеток (производитель "Польфа") содержит хлорхиналь-дол и метронидазол. Благодаря этому имеет широкий спектр действия в отношении анаэробных грамотрицательных и грамположи-тельньгх бактерий. "Гиналгин" обладает высокой эффективностью при лечении вагинитов, вызванных бактерилаьной флорой, вагинального трихомониаза и вагинитов, вызванных одновременным воздействием бактерий, трихомонад и грибов.
В последнее время в медицинской практике широко применяются научно обоснованные составы комбинированных препаратов в виде мазей .
Использование комбинированных лекарственных препаратов, обладающих многонаправленным действием на симптомы того или иного заболевания позволяет максимально реализовать требования современной фармакотерапии, повысить ее эффективность и избежать многих, часто непредвиденных, побочных явлений.
Важным вопросом фармацевтической технологии является повышение растворимости труднорастворимых лекарственных веществ в воде и липидах, поскольку их биологическая доступность в значительной степени зависит от размера частиц. Известно также, что процесс растворения вещества связан с явлениями фазового перехода на границе твердое вещество — раствор. Интенсивность этого процесса зависит от площади поверхности раздела фаз. Однако диспергирование, даже микронизация веществ не всегда приводит к увеличению скорости их растворения и абсорбции. Увеличение межмолекулярных сил сцепления, наличие электрического заряда частиц ведет к их укрупнению — агрегации. Все это не позволяет получить водные растворы труднорастворимых веществ, а значит, и избежать таких нежелательных явлений, как абсцессы, денатурация белков, некрозы, обезвоживание тканей, эмболии, и прочих осложнений, которые наблюдаются при применении масляных и спиртовых растворов в виде инъекций.
Повышение растворимости лекарственных веществ в воде и других растворителях предполагает значительное повышение их эффективности. Добиться этого можно за счет использования:
сорастворителей (бензил-бензоат, бензиловый спирт, пропилен-гликоль, полиэтиленоксиды и др.);
гидротропных средств (гексаметилентетрамин, мочевина, натрия бензоат, натрия салицилат, новокаин и др.);
явления солюбилизации, например, витаминов A, D, Е, К, стероидных гормонов, барбитуратов, антибиотиков, сульфаниламидов, эфирных масел и т.д., которое позволяет повысить не только растворимость веществ, но и значительно увеличить их стабильность. Примером может служить лекарственная система в аэрозольной упаковке "Ингалипт ";
явления комплексообразования, например, иод хорошо растворяется в концентрированных растворах калия иодида, полиеновые антибиотики — в присутствии поливинилпирролидона. Кроме повышения растворимости лекарственных веществ, явление комплексообразования может значительно уменьшить раздражающую способность лекарственного вещества на слизистую или кожу. Например, такой антисептик, как иод, образуя комплексное соединение с поливиниловым спиртом, теряет присущее ему прижигающее действие, что и используется при получении "Иодинола ". В некоторых случаях образование комплексных соединений приводит к заметному повышению биологической доступности образовавшегося продукта и одновременно — к значительному повышению его терапевтической эффективности. Так, комплекс левомицетин — поли-этиленоксид эффективнее самого антибиотика в 10-100 раз.
Значительному увеличению скорости растворения труднорастворимых веществ может способствовать использование так называемых твердых дисперсных систем, представляющих собой лекарственное вещество, диспергированное путем сплавления или растворения (с последующей отгонкой растворителя) в твердом носителе-матрице. Так, растворимость аймалина увеличивается в 40 раз, цинаризина — в 120 раз, резерпина — 200 раз и т.д. Кроме того, изменяя физико-химические свойства полимеров-носителей (молекулярную массу, растворимость), можно регулировать биодоступность лекарственной субстанции, создавать лекарственные формы направленного действия.
Важнейшей проблемой в фармацевтической технологии является стабилизация лекарственных систем. Связано это с тем, что лекарственные вещества, главным образом в процессе приготовления лекарственных препаратов и их хранения, под воздействием химических (гидролиз, омыление, окисление, полимеризация, рацемизация и др.), физических (испарение, изменение консистенции, расслаивание, укрупнение частиц) и биологических (прокисание и др.) явлений изменяют свои свойства. С этой целью для стабилизации гомогенных лекарственных систем (растворов для инъекций, глаз ных капель и др.) широко используют различные химические (добавление стабилизаторов, антиоксидантов, консервантов и т.д.) или физические методы (использование неводных растворителей, ампу-лирование в токе инертного газа, параконденсационный способ, нанесение защитных оболочек на таблетки и драже, микрокапсули-рование и др.).
Для стабилизации гетерогенных лекарственных систем (суспензии, эмульсии) используют загустители и эмульгаторы в виде ПАВ и ВМС.
Здесь уместно привести пример "иммобилизованных" лекарственных средств: ферментов, гормонов, мукополисахаридов, железо-производных декстранов и альбумина для лечения анемии; гамма-глобулинов, нуклеиновых кислот, интерферона и др., которые создаются с целью стабилизации и пролонгации их действия (см. подразд. 9.2).
Не менее важной проблемой фармацевтической технологии является продление времени действия лекарственных средств, так как во многих случаях необходимо длительное поддержание строго определенной концентрации препаратов в биожидкостях и тканях организма. Это требование фармакотерапии особо важно соблюдать при приеме антибиотиков, сульфаниламидов и других антибактериальных лекарств, при снижении концентрации которых падает эффективность лечения и вырабатываются резистентные штаммы микроорганизмов, для уничтожения которых требуются более высокие дозы лекарства, а это, в свою очередь, ведет к увеличению побочного действия.
Пролонгированного действия лекарств можно достигнуть использованием различных методов:
физиологического, который обеспечивает изменение скорости всасывания или выведения вещества из организма. Это наиболее часто достигается путем охлаждения тканей в месте инъекции лекарства, использования кровососной банки или путем введения гипертонических или сосудосуживающих растворов, подавления выделительной функции почек;
химического — посредством изменения химической структуры лекарственного вещества (путем комплексообразования, полимеризации, этерификации и пр.);
технологического — за счет подбора носителя с определенными свойствами, изменения вязкости раствора, подбора вида лекарственной формы и т.п. Например, глазные капли с пилокарпином гидрохлоридом, приготовленные на дистиллированной воде, вымываются с поверхности роговицы глаза через 6-8 мин. Эти же
капли, приготовленные на 1% растворе метилцеллюлозы и имеющие большую вязкость, а значит, и адгезию к поверхности всасывания, удерживаются на ней в течение 1 ч.
Заменив глазные капли мазью, можно увеличить время действия последней по сравнению с водным раствором пилокарпина гидрохлорида почти в 15 раз. Таким образом, изменяя такой технологический показатель, как вязкость или вид лекарственной формы, можно увеличить время действия препарата и его эффективность.
Существуют и другие проблемы в фармацевтической технологии, решение которых может привести к созданию более совершенных лекарственных препаратов, а следовательно, и к более высокой их терапевтической эффективности, например, создание возрастных лекарств, повышение микробной чистоты лекарств, создание более прогрессивной тары и тароукупорочных материалов, внедрение малоотходных и экологически чистых технологий, дальнейшее развитие биотехнологии и т.д., что, в свою очередь, шаг за шагом будет повышать качество и терапевтическую эффективность лекарств.
В последнее время фармакотехнологов и других специалистов привлекает проблема создания лекарств принципиально нового типа, так называемых лекарств направленного действия с заданными фар-макокинетическими свойствами, которые в отличие от традиционных или классических лекарств характеризуются:
пролонгированным действием;
контролируемым высвобождением действующих веществ;
их целевым транспортом к мишени.
Лекарства нового поколения принято называть терапевтическими системами, которые частично или полностью отвечают вышеуказанным требованиям.
Терапевтическая лекарственная система (ТЛС) — это устройство, содержащее лекарственное вещество или вещества, элемент, контролирующий высвобождение лекарственного вещества, платформу, на которой размещена система, и терапевтическую программу.
ТЛС обеспечивает постоянное снабжение организма лекарственными веществами в строго определенный промежуток времени. Они используются как для местного, так и для системного лечения. Примером таких лекарств могут быть "Окусерт", "Прогестасерт", "Трансдерм" и другие, которые являются пассивными системами (см. подразд. 9.9). Имеются образцы активных терапевтических систем, действие которых запрограммировано извне или самолро-граммируется. Такие терапевтические системы создаются за рубежом, дорогостоящие и поэтому не получили широкого распространения в медицинской практике.
Следует отметить, что оптимальную стратегию по созданию современных лекарственных препаратов можно выработать только на базе тщательно спланированных технологических и биофармацевтических экспериментальных исследований и квалифицированной интерпретации полученных данных.
2.1. Биотехнология традиционных лекарств и лекарств будущего
С целью улучшения лечебных свойств традиционных лекарств усилия всех специалистов, разрабатывающих лекарственные препараты, направлены на использование новых технологий их получения, совершенствование составов, повышение специфичности и изучение как можно более полного механизма их действия на различные системы и органы человека. Продвижения в этом направлении все ощутимее и появляется надежда, что лекарственные препараты в следующем тысячелетии станут более действенными и эффективными средствами лечения многих заболеваний. Широко будут применяться лекарственные препараты в виде терапевтических систем и биопродуктов, особенно таких, как пептиды и пробелки, которые практически невозможно получить синтетически. Поэтому становится понятным возрастающее значение биотехнологии для фармацевтической промышленности.
Сегодня биотехнология стремительно выдвигается на передний край научно-технического прогресса. Этому, с одной стороны, способствует бурное развитие современной молекулярной биологии и генетики, опирающихся на достижения химии и физики, а с другой стороны, — острая потребность в новых технологиях, способных улучшить состояние здравоохранения и охраны окружающей среды, а главное — ликвидировать нехватку продовольствия, энергии и минеральных ресурсов.
В качестве первоочередной задачи перед биотехнологией стоит создание и освоение производства лекарственных препаратов для медицины: интерферонов, инсулинов, гормонов, антибиотиков, вакцин, моноклональных антител и других, позволяющих осуществлять раннюю диагностику и лечение сердчено-сосудистых, злокачественных, наследственных, инфекционных, в том числе вирусных заболеваний.
По оценкам специалистов мировой рынок биотехнологической продукции уже к середине 90-х годов составил около 150 млрд долларов. По объему выпускаемой продукции и числу зарегистрированных патентов Япония занимает первое место среди стран, преуспевающих в области биотехнологии, и второе — по производству фармацевтической продукции. В 1979 году на мировой рынок было выпущено 11 новых антибиотиков, 7 из них синтезировано в Японии. В 1980 году фармацевтическая промышленность Японии освоила производство веществ широкой номенклатуры: пеницилли-нов, цефалоспорина С, стрептомицина, полусинтетических антибиотиков второго и третьего поколений, противоопухолевых препаратов и иммуномодуляторов. Среди десяти ведущих мировых производителей интерферона — пять японских. С 1980 года фирмы активно включились в разработку технологий, связанных с иммобилизованными ферментами и клетками. Проводятся активные исследования, направленные на получение термостойких и кислотоустойчивых ферментов. 44% новых продуктов, полученных с помощью биотехнологий, нашли применение в фармации и только 23% — в пищевой или химической промышленности.
Биотехнология оказывает воздействие на различные отрасли промышленности Японии, включая производство вино-водочных изделий, пива, аминокислот, нуклеидов, антибиотиков; рассматривается как одно из самых перспективных направлений развития пищевого и фармацевтического производства и на этом основании включена в исследовательскую программу по созданию новых промышленных технологий. Существует государственная программа, направленная на разработку новых технологий получения гормонов, интерферонов, вакцин, витаминов, аминокислот, антибиотиков и диагностических препаратов.
Второе место после Японии по объему продуктов биотехнологии и первое место по производству фармацевтической продукции принадлежит США. На антибиотики приходится 12% мировой продукции. Значительные успехи достигнуты в области синтеза инсулина, гормона роста человека, интерферона, фактора свертывания крови VIII, диагностических тестов, вакцины против гепатита В и других лекарственных препаратов, а также непрерывного процесса конверсии сахара в этиловый спирт. В 1983 году был синтезирован лейкоцитарный интерферон человека высокой чистоты. Методами генной инженерии овладели многие фармацевтические фирмы США. Быстро развиваются средства информации, связанные с биотехнологией. Определенные успехи в области биотехнологии имеются и в других странах мира.
Понятие "биотехнология" собирательное и охватывает такие области, как ферментационная технология, применение биофакторов с использованием иммобилизованных микроорганизмов или энзимов, генная инженерия, иммунная и белковая технологии, технология с использованием клеточных культур как животного, так и растительного происхождения.
Биотехнология — это совокупность технологических методов, в том числе и генной инженерии, использующих живые организмы и биологические процессы для производства лекарственных средств, или наука о разработке и применении живых систем, а также неживых систем биологического происхождения в рамках технологических процессов и индустриального производства.
Современная биотехнология — это химия, где изменение и превращение веществ происходит с помощью биологических процессов. В острой конкуренции успешно развиваются две химии: синтетическая и биологическая. Синтетическая химия, сочетая и перетасовывая атомы, переделывая молекулы, создавая новые вещества, неведомые в природе, окружила нас новым миром, который стал привычным и необходимым. Это — лекарства, моющие средства и красители, цемент, бетон и бумага, синтетические ткани и меха, пластинки и драгоценные камни, духи и искусственные алмазы. Но чтобы получить вещества "второй природы" необходимы жесткие условия и специфические катализаторы. Например, связывание азота происходит в промышленных прочных аппаратах при высокой температуре и огромном давлении. При этом в воздух выбрасываются столбы дыма, а в реки — потоки сточных вод. Для азотофиксирующих бактерий этого совсем не требуется. Имеющиеся в их распоряжении энзимы осуществляют эту реакцию в мягких условиях, образуя чистый продукт без отходов. Но самое неприятное заключается в том, что пребывание человека в окружении "второй природы" стало оборачиваться аллергией и другими опасностями. Неплохо бы держаться поближе к природе-матери. И если делать искусственные ткани, пленки, то хотя бы из микробного белка, если применять лекарственные препараты, то прежде всего те, которые вырабатываются в организме. Отсюда вырисовываются перспективы развития и использования в фармацевтической промышленности биотехнологий, где применяются живые клетки (в основном такие микроорганизмы, как бактерии и дрожжевые грибки или отдельные энзимы, выполняющие роль катализаторов только определенных химических реакций). Обладая феноменальной избирательностью, энзимы осуществляют одну-единственную реакцию и позволяют получить чистый продукт без отходов.
Однако энзимы нестойкие и быстро разрушаются, например, при повышении температуры трудно выделяются, их нельзя использовать многократно. Это и обусловило, главным образом, развитие науки об обездвиженных (иммобилизованных) ферментах. Основа, на которую "сажают" фермент, может иметь вид гранул, волокон, пленок из полимеров, стекла, керамики. Потери энзима при этом минимальны, а активность сохраняется месяцами. В настоящее время научились получать иммобилизованные бактерии, которые вырабатывают энзимы. Это упростило их использование в производстве и сделало метод более дешевым (не надо выделять энзим, очищать его). Кроме того, бактерии работают в десять раз дольше, что сделало технологический процесс экономичнее й проще. Традиционная ферментационная технология превратилась в биотехнологию со всеми признаками передовой технологии.
Ферментные технологии с большим экономическим эффектом стали применять для получения чистых аминокислот, переработки крахмалосодержащего сырья (например, кукурузного зерна в сироп, состоящий из глюкозы и фруктоы). За последние годы это производство превратилось в многотоннажное. Развиваются производства по переработке опилок, соломы, бытовых отходов в кормовой белок или спирт, который используют для замены бензина. Ферменты сегодня широко используются в медицине как фиброиолитические препараты (фибринолизин + гепарин, стрептолиаза); при расстройствах пищеварения (пепсин + хлористоводородная кислота, пепси-дил, абомин, панкреатин, ораза, панкурмен, фестал, дигестал, три-фермент, холензим и др.); для лечения гнойных ран, При образовании спаек, рубцов после ожогов и операций и т.д. Биотехнология позволяет получать большое количество ферментов медицинского назначения. Их используют для растворения тромбов, лечения наследственных заболеваний, удаления нежизнеспособных, денатурированных структур, клеточных и тканевых фрагментов, освобождения организма от токсических веществ. Так, с помощью тромболи-тических ферментов (стрептокиназы, урокиназы) спасена жизнь многим больным с тромбозом конечностей, легких, коронарных сосудов сердца. Протеазы в современной медицине применяются для освобождения организма от патологических продуктов, для лечения ожогов.
Известно около 200 наследственных заболеваний, обусловленных дефицитом какого-либо фермента или иного белкового фактора. В настоящее время делаются попытки лечения этих заболеваний с применением ферментов.
В последние годы все больше внимания уделяют ингибиторам ферментов. Ингибиторы протеаз, получаемые из актиномицетов (лейпептин, антипаин, химостатин) и генноинженерных штаммов E.coli (эглин) и дрожжей (ос-1 антитрипсин) эффективны при септических процессах, инфаркте миокарда, панкреатите, эмфиземе легких. Концентрацию глюкозы в крови больных диабетом можно уменьшить путем использования ингибиторов кишечных инвертаз и амилаз, отвечающих за превращение крахмала и сахарозы в глюкозу. Особой задачей является поиск ингибиторов ферментов, с помощью которых патогенные микроорганизмы разрушают антибиотики, вводимые в организм больного.
Новые возможности открывает генная инженерия и другие методы биотехнологии в производстве антибиотиков, обладающих высокой избирательной физиологической активностью по отношению к определенным группам микроорганизмов. Однако антибиотики имеют и ряд недостатков (токсичность, аллергенность, устойчивость патогенных микроорганизмов и др.), которые существенно можно ослабить за счет их химической модификации (пеницилли-ны, цефалоспорины), мутасинтеза, генной инженерии и других способов. Многообещающим подходом может служить инкапсулирование антибиотиков, в частности, включение их в липосомы, что позволяет прицельно доставлять лекарственное вещество только к определенным органам и тканям, повышает его эффективность и снижает побочное действие.
С помощью генной инженерии можно заставить бактерии вырабатывать интерферон — белок, выделяемый клетками человека в низких концентрациях при попадании в организм вируса. Он усиливает иммунитет организма, подавляет размножение аномальных клеток (противоопухолевое действие), используется для лечения болезней, вызываемых вирусами герпеса, бешенства, гепатитов, цитомегаловирусом, вызывающим опасное поражение сердца, а также для профилактики вирусных инфекций. Вдыхание аэрозоля интерферона позволяет предупредить развитие ОРЗ. Интерфероны оказывают лечебное действие при заболевании раком груди, кожи, гортани, легких, мозга, а также рассеяного склероза. Они полезны при лечении лиц, страдающих приобретенными иммунодефицитами (рассеянной миеломой и саркомой Капоци).
В организме человека вырабатывается несколько классов интерферона: лейкоцитарный (а), фибробластный (р-интерферон, удобный для массового производства, поскольку фибробласты в отличие от лейкоцитов размножаются в культуре), иммунный (у) из Т-лим-фоцитов и е-интерферон, образуемый эпителиальными клетками.
До введения методов генной инженерии интерфероны получали из лейкоцитов донорской крови. Технология сложная и дорогостоящая: из 1 л крови получали 1 мг интерферона (одна доза для инъекций).
В настоящее время а-, (3- и у-интерфероны получают с применением штамма E.coli, дрожжей, культивируемых клеток насекомых (Dro-zophila). Очищают с использованием моноклональных (клон — совокупность клеток или особей, произошедших от общего предка путем бесполого размножения) антител или другими способами.
Биотехнологическим методом получают и интерлейкины — сравнительно короткие (около 150 аминокислотных остатков) полипептиды, участвующие в организации иммунного ответа. Образуются в организме определенной группой лейкоцитов (микрофагами) в ответ на введение антигена. Используются как лечебные средства при иммунных расстройствах. Путем клонирования соответствующих генов в E.coli или культивирования лимфоцитов in vitro получают интерлейкин-L (для лечения ряда опухолевых заболеваний), фактор крови VIII (культивированием клеток млекопитающих), фактор IX (необходим для терапии гемофилии), а также фактор роста [3-лим-фоцитов, фактор активизации макрофагов, Т-заместительный фактор, активатор тканевого плазминогена. Осуществлен биосинтез инсулина, в котором нуждаются миллионы больных во всем мире. Диабет, для лечения которого необходим инсулин, характеризуется избирательной гибелью клеток (островков Лангерганса поджелудочной железы), синтезирующих этот пептидный гормон.
До недавнего времени инсулин получали из поджелудочной железы быка и свиньи, первое производство которого освоила американская компания "Эли Лилли" (1922). Поджелудочная железа крупного рогатого скота и свиней извлекалась из туш животных, быстро замораживалась и в вагонах-рефрижераторах направлялась на фармацевтические предприятия, где и производилась экстракция гормона. 100 г кристаллического инсулина получали из 800-1000 кг сырья (поджелудочаня железа быка весит 200-250 г).
В 1935 году был разработан инсулин пролонгированного действия путем добавления цинка (Дания), а в 1946 году — нейтральный кристаллический инсулин. Медицина получила в свое распоряжение пролонгированный (поглощается в течение 48 ч) и быстродействующий инсулины. В 60-е годы удалось разработать методы очистки гормона от глюкагона (антагонист инсулина) и соматостатина (подавляет выделение инсулина).
Инсулин состоит из двух полипептидных цепей А и В длиной 20 и 30 аминокислот. Инсулин животный отличается от человеческого 1-3 аминокислотными радикалами, что является причиной возникновения аллергических реакций, особенно у детей, хотя по активности и времени действия они идентичны. Широкомасштабное применение инсулина в терапии сдерживалось его высокой стоимостью и ограниченностью сырьевых ресурсов.
В результате напряженных генноинженерных поисков компанией "Эли Лилли" в 1982 году был произведен инсулин на основе раздельного синтеза E.coli его А- и В-цепей. Этому достижению предшествовали широкомасштабные и дорогостоящие исследования по биосинтезу проинсулина, упрощению технологической схемы получения инсулина (на этапе экстракции и выделения), а также повышения выхода гормона, синтезируемого клетками специально сконструированных штаммов кишечной палочки. Стоимость готового продукта значительно снизилась, получаемый инсулин был идентичен человеческому, фармацевтическое производство освободилось от перебоев в поставках животного сырья с боен, а главное, человеческий инсулин при длительном применении не вызывал неприятных последствий: нарушений работы почек, расстройств зрения и аллергических реакций.
В настоящее время заслуживают внимания генноинженерные человеческие инсулины — хумулины фирмы "Эли Лилли", различ ной продолжительности действия и инсулины германской фирмы "Хьост Мэрлон Руссель", используемые во всем мире миллионами людей. На базе завода эндокринно-ферментативных препаратов (Киевский мясокомбинат) планируется производство украинского инсулина по лицензии фирмы "Хьост" в объеме, позволяющем полностью обеспечить годовую потребность в этом препарате. Инсулин по качеству будет отвечать международным стандартам.
Для лечения диабета используется также технология инкапсулирования: клетки поджелудочной железы в капсуле, введенные однократно в организм больного, продуцируют инсулин в течение года. В настоящее время актуальным является вопрос промышленного синтеза олигопептидных гормонов нервной системы — энкефалинов (построенных из 5 аминокислотных остатков), нейропептидов (вырабатываемых мозгом) и эндорфинов (аналогов морфина). Эти биологически активные вещества — продукты биотехнологии по праву называют лекарствами XXI века. При рациональном применении эти пептиды создают хорошее настроение, повышают работоспособность, концентрируют внимание, улучшают память, приводят в порядок режим сна и бодрствования. Они с успехом могут использоваться для лечения трудноизлечимых заболеваний: ожирения, нарушения процессов пищеварения, снимают болевой синдром.
Моноклональные антитела в сочетании с токсичными веществами для раковых клеток доставляют яд точно по адресу, избегаяпоражения здоровых клеток. В современной фармацевтической промышленности моноклональные антитела используются также для очистки лекарственных веществ.
Короткие фрагменты ДНК и РНК, несущие радиоактивную или иную метку (ДНК- или РНК-пробы), также используются для диагностики заболеваний (радиоиммунные методики).
Большое экономическое и социальное значение имеют разработки вакцин. Современные биотехнологические разработки предусматривают создание рекомбинатных вакцин, вакцин-антигенов, основанных на генноинженерном подоходе: в ДНК известной основак-цины встраивают чужеродные гены, кодирующие иммуногенные белки возбудителей вирусов гриппа, герпеса, гепатита В и получают вакцину против соответствующей инфекции. В последние годы стало возможным создание поливалентной вакцины на основе объединения участков ДНК различных патогенов. Открывается возможность одномоментной комплексной иммунизации против многих опасных инфекций.
Вакцины-антигены получают, клонируя гены возбудителя болезни E.coli, в дрожжах. Вакцины-антигены стабильны при хранении, содержат минимальное количество белка и поэтому малоопасны как аллергены. Однако они имеют низкую иммунногенность. Для повышения иммуногенности прибегают к иммобилизации или включают их в липосомы.
Отмечая несомненные успехи разработок в области фармации и медицины, нельзя не упомянуть об успехах биотехнологии в пищевой промышленности, где ее интересы тесно переплетены с медициной и связаны с поиском низкокалорийных, не опасных для больных диабетом заменителей сахара (сахароза), перспективным применением корригентов типа аспартама
2.2. Состояние и перспективы развития производства терапевтических систем
В последние годы фармацевтическая технология, в частности, разработка и производство лекарств с контролируемым высвобождением и направленной доставкой лекарственных веществ, развивается исключительно быстрыми темпами, и можно смело прогнозировать появление новых, еще более современных лекарственных форм.
Следует отметить, что в настоящее время во всем мире большое значение придается разработке новых целенаправленных систем доставки препарата к органу-мишени. В качестве примера можно привести новые системы доставки иммуномодуляторов, факторов роста костной ткани, интерферона, применяемых для лечения злокачественных новообразований, переломов костей я рака легкого соответственно.
В настоящее время используются следующие технологические приемы для получения систем, обеспечивающих оптимальные условия транспорта белков к органам-мишеням:
заключение лекарственных и вспомогательных веществ в оболочку или гранулу для защиты от преждевременного всасывания;
инкапсулирование белков, вакцин и других средств в липосомы, где они располагаются между двумя фосфолипидными слоями системы;
связывание субстанции с моноклональными антителами, молуча-емыми методами генной инженерии;
использование интраназалъной системы доставки, когда белки вводят в кровяное русло через слизистую оболочку носа (например, инсулин);
введение в организм предшественников лекарственных веществ, способных превращаться в биологически активные субстанции под действием ферментов;
использование биодеградируемых систем доставки, состоящих из комплекса лекарственных и полимерных вспомогательных веществ, способных к биодеградации с заданной скоростью;
применение трансдермальных систем доставки (включая пластыри), действие которых основано на всасывании лекарственных веществ через кожу;
включение лекарственных веществ в природные и синтетические эритроциты; в этом случае лекарственные препараты достаточно долго находятся в кровотоке и эффективно доставляются к мишени.
Японские фармацевты отмечают, что наиболее эффективными системами доставки противоопухолевых средств являются трансдер-мальная или моноклониальная система, а гормонов — липосомаль-ная и интраназальная системы.
В ближайшие годы ожидается быстрый рост производства новых систем доставки лекарственных средств. Причем большую часть рынка будут составлять новые системы с сердечно-сосудистыми препаратами, оральные осмотические системы (ОРОС) с противоаллергическими, диуретическими, противопростудными, противо-астматическими средствами. Разрабатываются так называемые электротранспортные системы доставки лекарственных веществ.
3.Фитотерапия и пути совершенствования производства экстракционных лекарств.
Использование различных извлечений из растительного сырья известно с глубокой древности и не потеряло своего значения до настоящего времени. Препараты из растений являются основными средствами для лечения многих заболеваний. На долю препаратов растительного происхождения приходится 90% лекарств, применяемых для лечения сердечно-сосудистой системы, 80% средств для лечения гинекологических заболеваний и 79% — для лечения дыхательных путей.
Возросший в последнее время интерес к фитотерапии неслучаен, поскольку лекарства растительного происхождения имеют ряд преимуществ перед химиотерапевтическими препаратами. В состав лекарственных растений входят природные вещества, необходимые организму для нормальной жизнедеятельности: витамины, углеводы, макро- и микроэлементы, ферменты, гормоны и др. Комплекс веществ, содержащийся в растениях, действует поливалентно, стимулируя различные системы организма или компенсируя их недостаточную функцию. Это действие (более мягкое, пролонгированное), как правило, не вызывает аллергических заболеваний и осложнений. Кроме того, лекарственные растения обладают антиокси-дантным действием и способностью выводить токсические вещества и продукты метаболизма. За счет диуретического действия большинство из них может повышать антитоксическую функцию печени, стабилизировать мембраны клеток желудочно-кишечного тракта. Весьма важными моментами являются простота и дешевизна способов получения лекарств из растений, а также доступность лекарственного растительного сырья. Сложность применения фитотерапии заключается в том, что не всегда известно действие лекарственных растений на молекулярном уровне (в сравнении с химиотерапией) и химический состав биологически активных веществ. Вместе с тем химический состав растений непостоянен и зависит от климатических, почвенных, экологических условий произрастания. При сушке и неправильном хранении растения теряют биологически активные вещества, а их фармакологическая ценность резко падает. Водные извлечения нестабильны при хранении; в них возможны явления гидролитического расщепления, окислительно-восстановительные реакции, микробная порча; их трудно стандартизировать.
Однако нельзя противопоставлять лечение лекарственными растениями или препаратами из них терапии синтетическими веществами. В острой стадии заболевания, когда необходимо срочное воздействие лекарства, следует применять синтетические препараты. Затем больному назначают лекарственные препараты растительного происхождения. Применение лекарств растительного происхождения (фитопрепаратов) совместно с синтетическими дает возможность уменьшить или полностью нивелировать побочные действия последних.
Различают фитопрепараты из свежих растений (натуральные и сгущенные соки и извлечения) и высушенного сырья (настойки, экстракты, максимально очищенные препараты и индивидуальные вещества).
В настоящее время, несмотря на определенные успехи в области получения экстракционных средств, многие традиционные технологические процессы, широко используемые на фармацевтических производствах (особенно на фармацевтических фабриках), малоэффективны, длительны по времени и требуют больших расходов сырья. Отсутствие инженерных расчетов процесса экстрагирования, несовершенство используемой аппаратуры и методов экстракции снижает качество экстракционных лекарств и создает условия для загрязнения окружающей среды. Указанное выше определяет пути совершенствования производства экстракционных средств. Это, прежде всего, дальнейшая разработка теоретических основ процесса экстрагирования растительного сырья, создание методик инженерного расчета процесса экстрагирования и использование математических методов для расчета оптимальных условий технологий; поиск и применение новых экстрагентов, интенсификация методов экстракции и использование более совершенной аппаратуры, а также внедрение безотходных технологий производства лекарственных средств.
Одним из путей совершенствования производства экстракционных средств из растительного сырья является поиск и применение новых экстрагентов.
Экстракция сжиженными газами известна давно, но не получила пока широкого применения в фармацевтическом производстве по ряду причин, в том числе из-за отсутствия специальной аппаратуры для экстракции. Сжиженные газы, обладая хорошей смачивающей и проникающей способностью, а также низкой вязкостью, способны легко и быстро проникать в сырье и извлекать до 88-98% действующих веществ, что значительно больше, чем при использовании известных методов экстрагирования: мацерации, перколяции и др. Кроме того, сжиженная углекислота легко и быстро отгоняется из экстракта при комнатной температуре, что особенно важно при производстве экстрактов из сырья, содержащего термолабильные вещества и эфирные масла. Высокая избирательная способность сжиженных газов позволяет получать нативные экстракты. Процесс извлечения проходит в несколько раз быстрее, чем при использовании других экстрагентов, что экономически более выгодно и часто характеризуется почти полным отсутствием водорастворимых балластных веществ. Поскольку процесс идет в замкнутом пространстве, это позволяет предохранить окружающую среду от вредных выбросов.
Однако биологически активный комплекс, извлекаемый сжиженными газами, отличается от извлекаемого классическими растворителями, характеризуется повышенным содержанием жирорастворимых и меньшим содержанием водорастворимых веществ. Поэтому сжиженные газы чаще используют для извлечения липофильных комплексов из растительного сырья (например, для производства облепихового масла). Чтобы получить извлечение комплексного состава, включающего все биологически активные вещества, присутствующие в исходном сырье, предлагается использовать смесь растворителей на базе сжиженных газов или же после экстрагирования сжиженным газом оставшийся шрот подвергать дополнительному извлечению водой с последующим упариванием и объединением извлечений.
Поскольку многие традиционные методы экстрагирования, получившие практическое применение, неоптимальны, а потери действующих веществ и связанные с ними потери лекарственного сырья из-за несовершенства технологии весьма существенны, то основной задачей экстракционных производств является интенсификация и оптимизация технологии экстрагирования сырья. ,
Как отмечалось ранее, гидродинамические условия оказывают существенное влияние на процесс экстрагирования.
Метод вихревой экстракции или турбоэкстращш является одним из видов гидродинамического воздействия, сущность которого заключается в перемешивании смеси экстрагента и сырья с очень высокой скоростью. Быстроходные мешалки, снабженные острыми лопастями, осуществляют не только перемешивание, но и частичное измельчение сырья в процессе экстрагирования. Высокая скорость перемешивания создает условия неравномерного давления на поток обрабатываемой смеси, и возникающие эффекты пульсации и кавитации в системе повышают скорость внутренней диффузии. Время экстрагирования сырья сокращается до нескольких минут.
Использование роторно-пульсационного аппарата (РПА) совмещает операции экстрагирования и диспергирования сырья. Экстрагирование с применением РПА основано на циркуляции обрабатываемой среды при различной кратности твердой и жидкой фаз. При использовании РПА происходит интенсивное механическое воздействие на частицы сырья, возникает эффективная турбулизация и пульсация потока, процесс повторяется до получения концентрированного извлечения. Повышается производительность процесса и увеличивается выход действующих веществ. Применение РПА эффективно в производстве облепихового масла, настоек валерианы, календулы, комплекса каротиноидов из плодов шиповника, оксиме-тилантрахинонов из коры крушины, танина из листьев скумпии и т.д.
Установлено, что кратковременное (5-10 мин) воздействие электрического тока на 30-40% увеличивает выход резерпина по сравнению с его экстракцией методом мацерации. При этом выход алкалоидов из сырья в количестве 93,5% достигался через 2 ч 10 мин. А для выхода алкалоидов в количестве 90% с применением метода противотока и периодического настаивания необходимо 4 дня.
Основные преимущества этого способа перед другими — возможность ведения процесса при небольшом соотношении сырья и экстрагента (1:2,1:2); отсутствие движущихся металлических частей, приводящих к дезактивации ферментов и гормонов; уменьшение в 10 раз микробной обсемененности обрабатываемого сырья, что весьма важно при производстве органопрепаратов; совмещение в одном процессе нескольких технологических стадий (измельчения, извлечения и т.д.), сокращение в 1,5-2 раза энергозатрат.
Обработка растительного сырья электрическим током низкой и высокой частоты (электроплазмолис) заключается в разрушающем действии электрического тока на белково-липидные мембраны растительных тканей с сохранением целостности клеточных оболочек. Электрический ток нарушает протоплазматическую проницаемость клеток, максимально увеличивая ее проницаемость как для ионов, так и для неэлектролитов при полном разрушении всех белково-ли-пидных мембран.
Электроплазмолис перспективен при получении извлечений из свежего растительного и животного сырья.
К нетрадиционным методам обработки лекарственного сырья относятся электродиализ — диффузия электролитов через полупроницаемую пористую перегородку под действием электрического тока. Движущей силой процесса является разность концентраций экстрагируемых веществ по обе стороны полупроницаемой мембраны, роль которой выполняют оболочки клеток. Ионы биологически активных веществ, которые представляют собой электролиты (соли алкалоидов, кислоты, макро- и микроэлементы, сапонины, некоторые витамины и др.), в результате наведенной поляризации ускоряют свое движение внутри клеток и частиц сырья. При этом увеличивается внешняя и внутренняя диффузия.
Использование метода электродиализа для экстракции алкалоидов из семян и плодов дурмана индийского дает возможность увеличить их выход почти на 20%. Используя этот метод, можно осуществлять селективное выделение чистых алкалоидов (атропина, термопсиса, аконита и др.) из суммарных экстрактов, полученных любым способом экстракции, биогенных стимуляторов, а также очищать вытяжки.
Использование ультразвука для интенсификации экстракционного процесса дает не только значительное ускорение производственного процесса во времени, но и увеличение выхода основного продукта по сравнению с другими способами экстрагирования.
Под действием ультразвука сокращается время замачивания сырья с нескольких часов (для корневищ с корнями валерианы, девясила, аира оно равно 6-8 ч) до нескольких минут (30 мин замачивания и 10 мин обработки ультразвуком) для его полного набухания. Ультразвуковые волны создают знакопеременное давление, кавитацию и "звуковой ветер", в результате чего увеличивается растворение содержимого клетки, повышается скорость обтекания частиц сырья, в пограничном диффузионном слое экстрагента образуются турбулентные и вихревые потоки. Ультразвук увеличивает коэффициент внутренней диффузии. Изменяя мощность ультразвукового поля при экстрагировании растительного сырья, можно регулировать
скорость диффузии веществ из клеток, что имеет определенное практическое значение. В качестве средств, задерживающих кавитацию и связанные с ней деструктивные изменения, практикуется добавление к экстрагенту глицерина или ПАВ. Добавление к экстрагенту твина-80 в количестве 0,1% в 4 раза увеличивало выход производных антрагликозидов из корня ревеня, а добавление 0,3% твина-80 увеличивало в 2,5 раза выход алкалоидов спорыньи.
Использование ультразвуковой установки для экстракции алкалоидов из коры раувольфии дало 25% экономии сырья и сократило время экстракции со 120 ч до 5. Такого рода установки целесообразно использовать на многотоннажных производствах.
Загрязнение окружающей среды при производстве экстракционных лекарств (использование минеральных удобрений и пестицидов для выращивания растительного сырья, широкое использование вредных химических экстрагентов и растворителей, загрязнение вод и выбросы в атмосферу) играет немаловажную роль в общей проблеме экологии и взаимоотношений человека с природой.
Проблема защиты окружающей среды решается, помимо прочего, комплексным использованием растительного сырья и внедрением безотходной технологии производства лекарств. Примерами служат производства препаратов "Ликвиритон" из солодки голой, "План-таглюцид" из подорожника большого, "Фламин" из бессмертника песчаного и другие.
4.Основные направления усовершенствования технологии и качества мазей.
Многовековая конкуренция лекарственной формы в виде мазей отшлифовала их номенклатуру, технологию и способ применения. Обеспечение мазями высокой концентрацими лекарственных средств непосредственно на участке всасывания и очень низкой в других органах и тканях организма отвечает требованиям современной фармакотерапии.
Однако появление новых научных данных в области приготовления и применения мазей определило ряд направлений возможного дальнейшего их усовершенствования. Основная тенденция развития производства мягких лекарственных форм, очевидно, связана с использованием все более эффективных лекарственных субстанций и создания на их основе комбинированных мазей или мазей, предназначенных для лечения определенных заболеваний, например, для лечения трофических язв, мокнущих и сухих дерматитов, инфицированных ран, осложненных возбудителями аэробной микрофлоры, а также мазей для профилактики некоторых заболеваний. Примером могут быть предложенные за последнее десятилетие гидрофильные мази, которые проявляют многонаправленное действие на инфицированную рану, мази для регуляции деятельности сердечнососудистой системы, мази для профилактики "морской болезни" и т.д. Перспективным, на наш взгляд, является создание самостерилизующихся хирургических ректальных мазей, которые могут обеспечивать высокую локальную концентрацию действующих веществ при различных проктологических заболеваниях.
Таким образом, варьируя различные сочетания вспомогательных веществ, можно регулировать силу и продолжительность терапевтического действия мази, регулировать биодоступность лекарственных веществ; влиять на их накопление в тканях и на процесс элиминации.
Окончательно не решен вопрос стабильности мазей, несмотря на то что мази более стабильны, чем лекарства с жидкой дисперсной фазой. Использование современных стабилизаторов (загустителей, эмульгаторов и других вспомогательных веществ) может значительно повысить физическую стойкость суспензионных и эмульсионных мазей. Для повышения химической и микробиологической стабильности мазей и мазевых основ перспективным является добавление антиоксидантов и консервантов.
В связи с современными требованиями к уровню микробной контаминации нестерильных лекарств актуальной остается проблема упаковки мазей. Научные достижения последних лет показали, что создание комбинированных материалов (алюминиевой фольга, полимеров, бумаги) объединяет лучшие свойства отдельных материалов, а их использование при упаковке мазей и подобных им продуктов может оказаться очень полезным, так как возможно положительное влияние на стабильность и другие показатели фармацевтической продукции, а также послужить материалом для создания упаковки одноразового использования. Не утратила своей актуальности также замена стеклянной тары на тубы.
Актуальным направлением является разработка объективных методов оценки потребительских (структурно-механических) и других показателей мазей, их биодоступности, а также дальнейшая разработка и введение элементов механизации технологических процессов производства мягких лекарственных форм.
Следует отметить, что вышеуказанные направления усовершест-вования мазей себя не исчерпывают, так как мази являются сложной лекарственной формой, на качество которой влияют многочисленные факторы и прежде всего — выбор технологического метода их приготовления и его профессиональное выполнение специалистами.
5. Основные направления усовершенствования суппозиторных лекарств
Усовершенствование суппозиторных лекарств, как показывают научные исследования, осуществляются в основном по двум направлениям: 1) поиск и расширение ассортимента вспомогательных веществ, которые могут использоваться как суппозиторные основы; 2) создание новых лекарственных форм.
В последнее время идет активный поиск по разработке методов приготовления двухслойных суппозиториев, которые состоят из оболочки и стержня. Это дает возможность использовать вспомогательные вещества с разной температурой плавления, а также совмещать лекарственные вещества с разными свойствами.
Перспективным направлением является также разработка составов и технологий суппозиториев для использования в педиатрической практике, что обусловлено значительно меньшим уровнем аллергических реакций на введенные ректальным путем лекарственные препараты. Ректальные лекарства могут найти широкое использование в гериатрии при регуляции работы кишечника и лечении запоров.
В связи с низкой эффективностью суппозиториев со слабительным действием, а также раздражающим действием глицерина на слизистую прямой кишки проводятся исследования по созданию новых прописей шипучих суппозиториев методом прессования. Как газообразующие компоненты используют кальция глюконат, кальция лактат, железа лактат, натрия гидрокарбонат, кислоту аскорбиновую, ревеня экстракт и др. Такие суппозитории приготавливают и контролируют их качество подобно таблеткам. Создание желатиновых ректальных капсул, которые содержат лекарственные средства с разнообразными физико-химическими свойствами и различным фармакологическим действием, также вызывает большой интерес. Разрабатьшаются методы приготовления ректальных мазей, клизм и лекарственных форм в аэрозольной упаковке.
6. Новые твердые лекарственные формы пролонгированного действия
Твердые лекарственные формы пролонгированного действия многообразны, создаются на основании различных технологических принципов, а также с применением широкой гаммы новых вспомогательных веществ.
К твердым лекарственным формам пролонгированного действия следует отнести следующие: слоистые (многослойные) таблетки и драже, таблетки с нерастворимым скелетом; таблетки с ионитами; "просверленные" таблетки и драже; таблетки, построенные на принципе гидродинамического баланса и "осмотического насоса"; таблетки пролонгированного действия с покрытием; таблетки, гранулы и драже, действие которых обусловливается матрицей или наполнителем; имплантируемые таблетки с регулируемым высвобождением лекарственного вещества и др.
Многослойные (слоистые) таблетки и драже дают возможность сочетать лекарственные вещества, несовместимые по физико-химическим свойствам, пролонгировать действие лекарственных веществ, регулировать последовательность всасывания лекарственных веществ в определенные промежутки времени. Популярность многослойных таблеток возрастает по мере совершенствования оборудования и накопления опыта в их приготовлении и применении.
Сухое напрессование позволило также разделить несовместимые вещества, поместив одно лекарственное вещество в ядро, а другое в оболочку (например, витамины Bi и Вг от витамина С). Устойчивость к действию желудочного сока можно придать добавляя к грануляту, образующему оболочку, 20% раствор ацетилфталлилцел-люлозы.
В этих таблетках слои лекарственного вещества чередуются со слоями вспомогательного веещства, которые препятствуют высвобождению действующего вещества до своего разрушения под действием различных факторов ЖКТ (рН, ферментов, температуры и др.).
Разновидностью многослойных таблеток пролонгированного действия являются таблетки, которые прессуют из гранул, имеющих покрытие различной толщины, что и обусловливает их пролонгирующий эффект. Такие таблетки могут прессоваться из частиц лекарственного вещества, покрытых оболочкой из полимерных материалов, или же из гранул, покрытие которых отличается не своей толщиной, а временем и степенью разрушения под влиянием различных факторов ЖКТ. В таких случаях используют покрытия из жирных кислот с различной температурой плавления.
Весьма оригинальными являются многослойные таблетки, содержащие в медиальном слое микрокапсулы с лекарственным веществом, а во внешнем слое, защищающем микрокапсулы от повреждения при прессовании, — альгинаты, метилкарбоксицеллюлозу, крахмал.
С помощью многослойных таблеток можно добиться пролонгирования действия лекарственного вещества. Если в слоях таблетки будут находиться разные лекарственные вещества, то их действие проявится дифференцированно, последовательно, в порядке растворения слоев.
Перспективны также таблетки с нерастворимым скелетом, из которого лекарственное вещество постепенно высвобождается вымыванием. Такую таблетку сравнивают с губкой, поры которой заполнены растворимой субстанцией (смесью лекарственного вещества с растворимым наполнителем — сахаром, лактозой, полиэти-леноксидом и т.д.). Эти таблетки не распадаются в пищеварительным тракте и сохраняют геометрическую форму. Материалом для скелета служат некоторые неорганические (сульфат бария, гипс, двух- и трехзамещенный фосфат кальция, титана диоксид) и органические (полиэтилен, полихлорвинил, трудноплавкие воски и др.) вещества.
Скелетные таблетки могут быть получены путем простого прессования лекарственных веществ, образующих скелет. Они могут быть также многослойными, например, трехслойными, причем лекарственное вещество находится преимущественно в среднем слоеРастворение его начинается с боковой поверхности таблетки, в то время, как с больших поверхностей (верхней и нижней) вначале диффундируют только вспомогательные вещества (например, лактоза, натрия хлорид). По истечении определенного времени начинается диффузия лекарственного вещества из среднего слоя через капилляры, образовавшиеся в наружных слоях.
Большой интерес представляют таблетки, гранулы и драже, пролонгированное действие которых обусловливается матрицей или наполнителем. Пролонгированное высвобождение лекарственного вещества из таких таблеток достигается путем использования техники литья под давлением, при которой лекарственное вещество заключается в матрицу, например, при использовании в качестве матрицы катионо- или анионозависимых пластмасс. Начальная доза заключается в растворимый в желудочном соке термопласт из эпоксидной смолы, а запаздывающая доза — в нерастворимый в желудочном соке сополимер. В случае же использования инертной, нерастворимой матрицы (например, полиэтиленовой) высвобождение лекарства из нее происходит путем диффузии. Используются биодегради-рующие сополимеры: воск, ионообменные смолы; оригинальным матричным препаратом является система, состоящая из компактного материала, не всасываемого организмом, в котором находятся полости, связанные с поверхностью каналами. Диаметр каналов, по крайней мере, в два раза меньше диаметра молекулы полимера, в котором расположено активное вещество.
Продление действия лекарства в форме таблеток возможно путем увеличения молекулы лекарственного вещества, например, осаждением его на ионообменной смоле. Вещества связанные с ионообменной смолой, становятся нерастворимыми и высвобождение их в пищеварительном тракте основано исключительно на обмене ионов. Скорость высвобождения лекарственного вещества изменяется в зависимости от степени измельчения ионита (чаще используют зерна размером 300-400 мкм), а также от количества его разветвленных цепей. Вещества, дающие кислую реакцию (анионную), например, производные барбитуратовой кислоты, связываются с аниони-тами, а в таблетках с алкалоидами (эфедрина гидрохлорид, атропина сульфат, резерпин и др.) используются катиониты (вещества со щелочной реакцией). Таблетки с ионитами поддерживают уровень лекарственного вещества в крови обычно в течение 12 ч.
Для производства таблеток и гранул пролонгированного действия используют различные наполнители, которые по мере своего разрушения освобождают лекарственное вещество. Так, в качестве наполнителя для гранул пролонгированного действия предложена смесь субстрата с ферментом. Ядро содержит активный компонент, кото рый покрывается оболочкой. Оболочка препарата содержит фармакологически приемлемый, водонерастворимый, пленкообразующий микромолекулярный компонент и водорастворимый порообразова-тель (эфиры целлюлозы, акриловые смолы и другие материалы). Создание таблеток такого типа дает возможность высвобождать из них макромолекулы действующих веществ в течение недели.
Некоторыми зарубежными фирмами в настоящее время разрабатываются так называемые "просверленные" таблетки и драже пролонгированного действия. Такие таблетки формируются с одной или двумя плоскостями на ее поверхности и содержат растворимый в воде ингредиент. "Просверливание" плоскостей в таблетках создает дополнительную поверхность раздела между таблетками и средой. Это в свою очередь обусловливает постоянную скорость высвобождения лекарственного вещества, так как по мере растворения действующего вещества скорость высвобождения уменьшается пропорционально уменьшению площади поверхности таблетки. Создание таких отверстий и увеличение их по мере растворения таблетки компенсирует уменьшение площади таблетки по мере ее растворения и поддерживает скорость растворения постоянной. На такую таблетку наносится покрытие из вещества, которое не растворяется в воде, но пропускает ее.
По мере продвижения таблеток по ЖКТ всасываемость лекарственного вещества уменьшается, поэтому для достижения постоянной скорости поступления вещества в организм для препаратов, которые подвергаются резорбции на протяжении всего ЖКТ, скорость высвобождения лекарственного вещества необходимо сделать возрастающей. Этого можно достигнуть варьированием глубины и поперечника в "просверленных" таблетках, а также изменением их формы.
Созданы таблетки пролонгированного действия, основанного на принципе гидродинамического баланса, действие которых проявляется в желудке. Эти таблетки гидродинамически сбалансированы так, что они обладают плавучестью в желудочном соке и сохраняют это свойство вплоть до полного высвобождения из них лекарственного вещества. Например, за рубежом выпускают таблетки, понижающие кислотность желудочного сока. Данные таблетки двухслойные, причем гидродинамически сбалансированы таким образом, что при контакте с желудочным соком второй слой приобретает и сохраняет такую плотность, при которой он плавает в желудочном соке и сохраняется в нем до полного высвобождения из таблетки всех антикислотных соединений.
Одним из основных методов получения матричных носителей для таблеток является прессование. При этом в качестве материалов
матриц используются самые различные полимерные материалы, со временем распадающиеся в организме на мономеры, т.е. практически полностью разлагающиеся. По режиму высвобождения лекарственного вещества все эти таблетки можно подразделить на три основные категории:
0 формы с замедленным выделением, когда процесс высвобождения лекарственного вещества из таблетки начинается по истечении определенного времени с момента ее введения в организм; 0 формы с пролонгированным выделением, когда постепенное высвобождение действующего вещества начинается с момента приема таблетки;
0 формы повторного действия, когда в соответствии с диагнозом введение лекарства в организм показано производить двухкратно. К таким таблеткам пролонгированного действия можно отнести такие импортные препараты, как ферроградумет, пекто-рекс, фористарлонтаб, полярамин и др.. В Украине методом прессования приготавливаются таблетки ■ пролонгированного действия, которые содержат сальбутамол, а в качестве вспомогательного вещества — акриловую смолу.
Ч
асто
высвобождение лекарственного вещества
из таблеток пролонгируют покрытием
их полимерной оболочкой. Для этой цели
применяют различные акриловые смолы
вместе с нитроцеллюлозой, полисилоксан,
винилпирролидон, винилацетат,
карбоксиметилцел-люлозу с
карбоксиметилкрахмалом, поливинил
ацетат и этилцеллю-лозу. Используя для
покрытия пролонгированных таблеток
полимер и пластификатор, можно так
подобрать их количество, что из данной
лекарственной формы будет осуществляться
высвобождение лекарственного вещества
с запрограмированной скоростью..
Однако при их использовании необходимо помнить, что при этом возможны проявления биологической несовместимости имплантантов, явления токсичности; при их введении или удалении необходимо хирургическое вмешательство, связанное с болевыми ощущениями. Немаловажны также их значительная стоимость и сложность процесса изготовления. Кроме этого, необходимо применять специальные меры безопасности для исключения утечки лекарственных веществ при введении этих систем.
Таким образом, в настоящее время у нас в стране и за рубежом разрабатываются и выпускаются различные виды твердых лекарственных форм пролонгированного действия от более простых таблеток, гранул, драже, спансул до более сложных имплантируемых таблеток, таблеток системы "Oros", терапевтических систем с саморегуляцией. При этом необходимо отметить, что развитие лекарственных форм пролонгированного действия связано с широким использованием новых вспомогательных веществ, в том числе полимерных соединений.
Вывод
Согласно прогнозу в начале XXI века следует ожидать значительного прогресса в разработке новых лекарственных препаратов, содержащих новые субстанции, а также с использованием новых систем введения и доставки в организм человека с их программированным распределением.
Таким образом, не только широкий ассортимент лекарственных веществ, но и многообразие их лекарственных форм позволит проводить эффективную фармакотерапию с учетом характера заболевания.
Следует также отметить необходимость изучения и использования в фармацевтической технологии последних достижений коллоидной химии и химической технологии, физико-химической механики, коллоидной химии полимеров, новых способов диспергирования, сушки, экстракции, применения нестехиометрических соединений.
Совершенно очевидно, что решение этих и других вопросов, стоящих перед фармацией, потребует разработки новых технологий производства и методов анализа лекарственных препаратов, использования новых критериев оценки их эффективности, а также изучения возможностей внедрения в практическую фармацию и медицину.
Список литературы
проф И.И. Перцева и проф. И.А. Зупанца „Фармацевтические и медико-биологические аспекты лекарств”.Харьков.1999г .
Интернет
Краснюк И.Н. Фармацевтическая технология: Технология лекарственных форм. М.: Издательский центр «Академия», 2004.
Милованова Л.Н. Технология изготовления лекарственных форм. Ростов на Дону: Медицина, 2002 .
Муравьев И.А. Технология лекарств. 2-е издание перераб. и дополн. – М.: Медицина, 1988 .
Саканян Е.И. Методические указания к лабораторным занятиям по аптечной технологии лекарств. СПб.: Медицина, 1997 .
1