Роль эндофрина в нейроэндокринной регуляции функций иммунной системы
На правах рукописи
Гейн Сергей Владимирович
РОЛЬ -ЭНДОРФИНА В НЕЙРОЭНДОКРИННОЙ РЕГУЛЯЦИИ ФУНКЦИЙ ИММУННОЙ СИСТЕМЫ
14.00.36 Аллергология и иммунология
Автореферат диссертации на соискание ученой степени доктора медицинских наук
Пермь - 2007
Работа выполнена в аналитической лаборатории Института экологии и генетики микроорганизмов УрО РАН, Пермь.
Научный консультант:
академик РАН и РАМН, д.м.н., профессор
Черешнев Валерий Александрович
Официальные оппоненты:
доктор медицинских наук, профессор Сибиряк Сергей Владимирович,
доктор медицинских наук, профессор Кузнецов Валериан Фёдорович,
доктор медицинских наук, профессор Юшков Владимир Викторович
Ведущая организация: Институт экспериментальной медицины РАМН, Санкт-Петербург.
Защита состоится «__»__________ 2007 г. в ____ часов на заседании диссертационного совета Д 004.019.01 в Институте экологии и генетики микроорганизмов УрО РАН по адресу: 614081, г. Пермь, ул. Голева, 13. Факс (342)2446711.
С диссертацией можно ознакомиться в библиотеке Института экологии и генетики микроорганизмов УрО РАН, Пермь.
Автореферат разослан «___» _______________2007 г.
Ученый секретарь диссертационного совета,
чл.-корр.РАН Ившина Ирина Борисовна
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Поддержание внутреннего гомеостаза определяется взаимодействием нервной, эндокринной и иммунной систем организма. Известно, что иммунная система многокомпонентна, ее функционирование обеспечивается сложной сетью взаимосвязанных сигналов. Одними из важнейших посредников во взаимодействии нервной и иммунной систем выступают эндогенные опиоидные пептиды, представляющие собой группу факторов и играющих ключевую роль в процессах адаптации организма (Корнева, Шхинек, 1988; Зозуля, Пшеничкин, 1990; Корнева, 2007; Maier, 2003; Pruett, 2003; Bodnar, Klein, 2006; Sharp, 2006; Wilbert-Lampen et al., 2007). Несмотря на то, что в последние годы изучению влияния эндогенных опиоидных пептидов на процессы регуляции иммунитета в литературе уделяется достаточно много внимания (Panerai, Sacerdote, 1997; Tomassini et al., 2003, 2004; Sacerdote, 2003), вопрос о механизмах реализации эффектов биорегуляторных пептидов данного класса остается крайне актуальным.
Основной источник опиоидных пептидов в организме - центральная нервная система. Основная группа пептидных гормонов (адренокортикотропный гормон, -липотропин, меланоцитстимулирующий гормон, -эндорфин) образуется в результате расщепления большой молекулы – предшественника проопиомеланокортина. При этом наиболее активным и полифункциональным представителем пептидов группы проопиомеланокортина является -эндорфин. Основной источник -эндорфина в центральной нервной системе – аркуатное ядро гипоталамуса, на периферии – промежуточная доля гипофиза, из которой пептид секретируется в кровь при стрессе, шоке, травмах и физических нагрузках. -эндорфин является ключевым фактором, осуществляющим контроль стрессиндуцированных изменений иммунитета со стороны эндогенной опиоидной системы (Зозуля, Пшеничкин, 1990; Pedersen, Hoffman-Goetz, 2000). Роль других соединений из семейства эндогенных опиоидных пептидов, в частности энкефалинов, при стрессе значительно более скромна, а по мнению отдельных авторов (Owens, 1987) вообще отрицается.
Известно (Panerai, Sacerdote, 1997), что изменение концентрации -эндорфина в головном, спинном мозге и гипофизе часто сочетается с неврологическими и аутоиммунными нарушениями (мигрень, рассеянный склероз, болезнь Крона). Важную роль -эндорфин играет в патогенезе инфекционных заболеваний, модулируя функции клеток адаптивного и естественного звеньев иммунной системы при их контакте с микроорганизмами и вирусами (Ляшев, 2000; Plotnikoff, 1999; Sitte et al., 2007). В связи с этим изучение роли -эндорфина в регуляции иммуногенеза представляет большой интерес.
Широкий спектр биологической активности -эндорфина определяется его способностью взаимодействовать с различными по своей природе сайтами связывания, к которым относятся опиоидные (налоксон-чувствительные) и неопиоидные (налоксон-нечувствительные) рецепторы. Экспрессия опиатных рецепторов трёх основных классов (µ, , ) и неопиоидного рецептора на клетках различных органов и тканей, в том числе и клетках иммунной системы, доказана методами радиолигандного связывания и детекции соответствующей РНК (Наволоцкая и др., 2004; Madden, 1995; Plotnikoff, 1999; Bidlack, 2000; Kraus et al., 2006; Lotsch et al., 2006; Sharp, 2006). Подобное распределение участков связывания -эндорфина объясняет широкий спектр активности данного пептида и указывает на возможность как прямого, так и опосредованного влияния на формирование иммунного ответа (Зозуля, Пшеничкин 1990; Bidlack, 2000; Stanojević et al., 2006).
Нерешенными остаются вопросы, касающиеся изучения роли эндогенной опиоидной системы в стрессиндуцированных изменениях гуморального и клеточноопосредованного иммунитета; различных рецепторов в регуляции выраженности иммунных процессов, индуцируемых эндогенными опиоидами при стрессе, а также на фоне введения двух основных стрессреализующих факторов – глюкокортикоидов и катехоламинов. Малоизученными остаются молекулярные и клеточные механизмы иммунорегуляторного действия -эндорфина, связанные с эффектами данного гормона на процессы пролиферации, кооперации и дифференцировки клеток иммунной системы, продукцию ряда ключевых цитокинов (-IFN, IL-4, IL-10, IL-12), являющихся маркерными для регуляторных Т-лимфоцитов 1 и 2 типа (TH2/TH3) и определяющих выбор типа иммунного ответа. В литературе имеются довольно противоречивые данные о влиянии -эндорфина на функции клеток естественного иммунного ответа (Van den Bergh et al., 1994; Peterson et al., 1998; Voccarino, Kastin, 2000; Sacerdote, 2003; Bodnar, Klein, 2006).
Цель настоящей работы – изучение роли опиатергических механизмов в нейроэндокринной регуляции иммуногенеза с оценкой эффектов -эндорфина на процессы пролиферации, дифференцировки и кооперации клеток иммунной системы.
Основные задачи исследования
1. Изучить роль основных компонентов эндогенной опиоидной системы в регуляции процессов иммуногенеза в условиях острого стресса.
2. Исследовать возможность опосредованности иммунорегуляторных эффектов глюкокортикоидов и катехоламинов через взаимодействие с эндогенной опиоидной системой.
3. Оценить влияние -эндорфина на функции клеток адаптивного иммунитета и исследовать механизм действия пептида на процессы пролиферации, кооперации и Th1/Th2-дифференцировки лимфоцитов.
4. Изучить роль -эндорфина в регуляции функций клеток естественного иммунитета.
Научная новизна работы. Экспериментально обоснована интегральная роль эндогенной опиоидной системы в нейроэндокринной регуляции иммуногенеза в норме, в условиях стрессорного воздействии и при введении стрессреализующих гормонов – глюкокортикоидов и катехоламинов. Впервые изучено влияние -эндорфина на процессы активации, пролиферации, кооперации и Th1/Th2-дифференцировки Т-лимфоцитов с оценкой роли различных клеточных фракций. Выявлен характер участия опиатных рецепторов различных типов в регуляции иммунных реакций под воздействием -эндорфина и синтетических лигандов опиатных рецепоров пептидной природы. В экспериментах in vivo и in vitro подтверждено, что основной мишенью -эндорфина является гуморальное звено иммунного ответа, при этом выявлена зависимость эффектов -эндорфина от фазы развития иммунной реакции. В модели пролиферативного ответа лимфоцитов обнаружена зависимость эффекта -эндорфина и селективных агонистов - и -рецепторов от концентрации митогена и концентрации исследуемых пептидов. Выявлена ключевая роль -рецепторов в реализации стимулирующего эффекта -эндорфина на пролиферацию и продукцию IL-4. Впервые установлена зависимость стимулирующего эффекта опиоидных пептидов на пролиферацию лимфоцитов и продукцию IL-4 от присутствия моноцитов в клеточной культуре. Обнаружено, что -эндорфин снижает степень выраженности реакции бласттрансформации лимфоцитов при удалении моноцитов из клеточной культуры. Показано, что -эндорфин стимулирует фагоцитарную активность эффекторов естественного иммунитета и оказывает модулирующее влияние на цитокинпродуцирующую функцию моноцитов и нейтрофилов. Изучен характер участия опиатных рецепторов в регуляции этих процессов.
Теоретическая и практическая значимость. Полученные данные расширяют представление о роли -эндорфина и опиатных рецепторов разных типов в регуляции иммуногенеза. Обосновано, что формирование иммунного ответа в норме и при стрессе, а также регуляция адаптивного и естественного иммунного ответа реализуется за счёт механизмов, связанных с синтезом опиоидных пептидов. Выявлен механизм влияния опиоидных пептидов на процессы Th1/Th2-дифференцировки Т-лимфоцитов. Полученные экспериментальные данные подтверждают целесообразность использования иммуномодулирующих свойств -эндорфина в терапии ряда аутоиммунных заболеваний (рассеянный склероз, болезнь Крона и пр.). В связи с широким использованием агонистов опиатных рецепторов в практической медицине, необходим учет последствий их применения. Результаты работы используются в лекционном курсе «Экспериментальная иммунопатология и иммунотерапия» на кафедре микробиологии и иммунологии Пермского государственного университета (614990, Пермь, Букирева 15).
Основные положения, выносимые на защиту
1. В условиях блокады опиатных рецепторов выявляется выраженная модификация иммунорегуляторных эффектов ротационного стресса, глюкокортикоидов и катехоламинов.
2. -эндорфин в высоких дозах угнетает, в низких - стимулирует гуморальное звено иммунитета, и при этом не влияет на выраженность реакции гиперчувствительности замедленного типа. В клеточных культурах -эндорфин стимулирует пролиферацию лимфоцитов и продукцию IL-4, не влияет на синтез IL-2 и IFN-, при этом усиливает степень поляризации Т-хелперов в направлении Th2-клеток. В реализации стимулирующих эффектов -эндорфина на пролиферацию и продукцию IL-4 доминирующая роль принадлежит -рецепторам.
3. Клетки моноцитарно-макрофагального ряда играют важную регуляторную роль в направленности эффектов -эндорфина в отношении функциональной активности CD4+ лимфоцитов.
4. -эндорфин стимулирует фагоцитарную активность эффекторов естественного иммунитета и оказывает модулирующее влияние на цитокинпродуцирующую функцию моноцитов и нейтрофилов.
Связь работы с крупными программами. Работа проводилась в течение 2000-2007 гг. в соответствии с планом НИР ИЭГМ УрО РАН (номер госрегистрации темы НИР 01.9.009927); в рамках Программы фундаментальных исследований Президиума РАН «Молекулярная и клеточная биология»; гранта РФФИ № 06-04-49001, а также грантов молодых учёных Президиума УрО РАН 2003, 2005 гг.
Апробация работы. Материалы диссертации доложены и обсуждены на Международном симпозиуме «Взаимодействие нервной и иммунной систем в норме и патологии», Санкт-Петербург, 2007; V-VIII конференциях с международным участием «Дни иммунологии в Санкт-Петербурге», Санкт-Петербург, 2001-2007; ХIХ Российском съезде физиологического общества им. И.П. Павлова с международным участием, Екатеринбург, 2004; VI Международной конференции «Проблемы загрязнения окружающей среды», Пермь-Казань, 2005; III съезде Российского научного общества иммунологов, Екатеринбург, 2004; I-V конференциях иммунологов Урала, Екатеринбург, 2001; Пермь, 2002; Челябинск, 2003; Уфа, 2005; Оренбург, 2006; I-II конференциях молодых учёных «Современные проблемы микробиологии, иммунологии и экологии», Пермь, 1999, 2002.
Публикации. Материалы диссертационной работы обобщены в 46 печатных работах, в том числе 15 экспериментальных статьях и 31 материалах конференций.
Объем и структура работы. Диссертация изложена на 251 странице, содержит 35 таблиц, 49 рисунков и состоит из введения, литературного обзора, описания объектов и методов исследования, 5 глав результатов собственных исследований, обсуждения, выводов, списка цитируемой литературы, включающего 448 наименований, в том числе 124 на русском и 324 на английском языках.
Место проведения работы. Работа является частью исследований, выполняемых в аналитической лаборатории ИЭГМ УрО РАН (зав. – к.г.-м.н. М.А. Шишкин) совместно с лабораторией экологической иммунологии (зав. – к.м.н. Б.А. Бахметьев) по изучению механизмов иммуномодулирующих эффектов гормонов, продукция которых изменяется на фоне экологического воздействия. Исследования по проблеме нейроэндокринной регуляции иммуногенеза были инициированы профессором, заслуженным деятелем науки РФ Н.Н. Кеворковым. Научные положения диссертации и выводы, вытекающие из анализа полученного экспериментального материала, базируются на результатах собственных исследований автора.
Автор выражает искреннюю благодарность М.А. Шишкину, к.х.н. С.П. Тендряковой, профессору М.В. Черешневой, за внимание и моральную поддержку. Автор особо признателен сотрудникам группы радиоизотопных исследований к.б.н. Т.А. Баевой, инженеру Е.Г. Чижовой, магистрантам кафедры микробиологии и иммунологии Пермского государственного университета К.Г. Горшковой и И.Л. Шаравьёвой, способствующим завершению настоящей работы и чей вклад в определённые разделы исследований отражён в приведённых в списке литературы публикациях. Автор благодарит главного специалиста Муниципального управления здравоохранением Ростехнадзора, к.м.н. В.Г. Рыжаенкова за помощь в проведении иммуноферментного анализа.
Глубокую благодарность и признательность автор выражает своим учителям и наставникам академику РАН и РАМН В.А. Черешневу и доценту Ю.И. Шилову, оказавшим большое влияние на выбор целей научного поиска и формирование научного мировоззрения автора.
СОДЕРЖАНИЕ РАБОТЫ
Материалы и методы исследования. В работе использовали белых беспородных мышей массой 20-22 г и лейкоциты периферической венозной крови, полученной от здоровых людей – добровольцев мужского пола в возрасте 19-35 лет.
Для экспериментального моделирования реакции стресс использовали ротационную модель. Ротация мышей производилась в течение 60 мин по 10 мин с перерывами по 5 мин при 78 об/мин. Роль опиатных рецепторов в постстрессорных изменениях иммунных реакций исследовали путем их блокады налоксоном гидрохлоридом и налтриндолом гидрохлоридом. Налоксона гидрохлорид (DuPont, США) в разовой дозе 0,2 мг/кг массы тела и селективный антагонист -опиатных рецепторов налтриндола гидрохлорид (ICN, США) в дозе 0,1 мг/кг вводили животным подкожно однократно за 20 мин до ротации (Ашмарин, 1988; Михайлова и др., 1992; Croock et al., 1992). В дальнейших экспериментах в системе in vivo дозы опиатных антогонистов не изменялись. Иммунизацию животных производили через 1 ч после окончания ротации.
При исследовании иммунорегуляторных эффектов опиоидных пептидов in vivo β-эндорфин (Sigma, США) в диапазоне доз от 100 мкг/кг до 0,0005 мкг/кг вводили однократно внутрибрюшинно в объеме 0,2 мл. Контролем для животных, получавших β-эндорфин, служили мыши, которым вводили по той же схеме 0,9% NaCl. μ-агонист DAGO (d-Ala2,N-Me-Phe4,Gly5-ol-энкефалин и δ-агонист DADLE (d–Ala2,d-Leu5 - энкефалин) (Sigma, США) в диапазоне 10 – 0,0001 мкг/кг вводили по схеме аналогичной введению β-эндорфина. Иммунизацию животных производили через 1 ч после введения опиоидных пептидов.
Гидрокортизона ацетат (Гедеон Рихтер, Венгрия) в дозе 50 мг/кг массы тела вводили однократно внутрибрюшинно. Адреналина гидрохлорид (Московский эндокринный завод, Россия) вводили подкожно однократно в дозе 1 мг/кг. Налоксон и селективный антагонист -опиатных рецепторов налтриндол вводили подкожно за 20 мин до введения гормонов (3 инъекции через 2,5 ч в группе с гидрокортизоном и 1 инъекция в группе с адреналином). Контролем служили интактные мыши, подвергшиеся иммунизации, но не получавшие препаратов. Дополнительным контролем для животных, получавших гидрокортизон и опиоидные пептиды, служили мыши, получавшие по той же схеме изотонический раствор хлорида натрия. Иммунизацию опытных и контрольных мышей проводили одномоментно через 3 ч от начала эксперимента в группах с гидрокортизоном, через 30 мин - в группах с адреналином.
Для моделирования локального иммунного ответа животных иммунизировали эритроцитами барана (108 клеток вводили подкожно в подошвенную поверхность правой стопы). На 4-е сутки вводили разрешающую дозу антигена (108 клеток). На 5-е сутки оценивали выраженность иммунного воспаления при реакции ГЗТ путём регистрации толщины (инженерным микрометром) и массы (на торсионных весах) опытной и контрольной стопы; количество ядросодержащих клеток (ЯСК); интенсивность антителогенеза методом локального гемолиза в геле агарозы (Jerne, Nordin, 1963). Оценку фагоцитарной активности клеток периферической крови, селезенки, регионарного и отдаленного подколенных лимфатических узлов проводили методом В.Н. Каплина с соавт. (Каплин, 1992, 1996) в модификации (Шилов и др., 1997, 1998).
Нефракционированную клеточную взвесь получали путём отстаивания верхнего слоя плазмы крови с лейкоцитами. Выделение фракции мононуклеаров и нейтрофилов проводили на градиенте плотности фиколл-верографин. Разделение моноцитов и лимфоцитов проводили методом адгезии на чашках Петри. CD4+ Т-клетки выделяли при помощи набора магнитных бус Dynabeads M-450 CD4 (Invitrogen, США). Культивирование клеток проводили в течение 24, 48 и 72 ч в пластиковых 24 и 96-луночных планшетах (Orange Scientific, Бельгия) в соответствии с традиционными методиками с использованием полной питательной среды, приготовленной на основе RPMI 1640 или среды 199 (Биолот, Россия) с добавлением 10 mM HEPES, 2 mM L-глутамина (Sigma, США), 100 мкг/мл гентамицина и 10% эмбриональной телячьей сыворотки (Биолот, Россия) или аутоплазмы во влажной атмосфере с 5% СО>2> при 370С.
Пролиферативную активность оценивали по включению 3H-метилтимидина. Радиоактивность проб определяли на жидкостном сцинтилляционном счетчике Guardian (Wallac, Финляндия). Для определения концентрации IL-1β, TNF-, IL-6, IL-8, IL-1ra, IL-2, IL-4 и IFN-γ в супернатантах культур клеток использовали спектрофотометр Униплан (Пикон, Россия) и иммуноферментные тест-системы производства ООО Протеиновый контур, ООО Цитокин, Санкт-Петербург, Вектор-Бест, Новосибирск. В экспериментах in vitro использовали агонист δ,μ-опиатных рецепторов β-эндорфин в концентрациях 10-7-10-12М; меланотропин потенцирующий фактор (MPF) - фрагмент 88-91 β-липотропина (Lys-Lys-Gly-Glu) в концентрациях 10-7-10-12М; μ-агонист опиатных рецепторов DAGO (d-Ala2,N-Me-Phe4,Gly5-ol-энкефалин) в концентрациях 10-7– 10-12М; δ-агонист опиатных рецепторов DADLE (d–Ala2,d-Leu5-энкефалин) в концентрациях 10-7–10-12М; неселективный антагонист опиатных рецепторов налоксона гидрохлорид и селективный антагонист δ-рецепторов налтриндола гидрохлорид в концентрациях 10-6, 10-8, 10-10М; липополисахарид (ЛПС) Escherichia coli O26:B6 - 0,1 мкг/мл (Sigma, США), фитогемагглютинин (ФГА) – 1,25; 2,5; 5,0; 10,0; 20,0 мкг/мл (Sigma, США), диклофенак натрия (ДН) 25 мкг/мл, моноклональные анти-IL-1 антитела – 2 мкг/мл.
Полученные данные обрабатывали с помощью многофакторного дисперсионного анализа для парных данных и корреляционного анализа. Достоверность различий между группами оценивали с помощью t-критерия Стьюдента и критерия Фишера наименьшей значимой разницы. Сортировку и обработку данных проводили на компьютере IBM PC c использованием программ Statistica for Windows 6.0 (Statsoft, Inc., США) и DIASTA (Московский государственный университет, Россия).
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЙ И ИХ ОБСУЖДЕНИЕ
Влияние ротационного стресса на показатели иммунитета. Роль опиатных рецепторов. В большинстве опубликованных работ, посвященных изучению влияния стресса на иммунный ответ, исследуются изменения системного иммунного ответа в условиях внутривенной или внутрибрюшинной иммунизации. Принимая во внимание разные компоненты внутрисистемной регуляции общих и локальных форм иммунного ответа, представлялось целесообразным исследование эффектов стресса и блокады опиатных рецепторов в условиях развития локальной формы иммунного ответа.
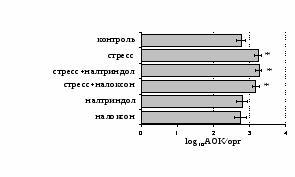
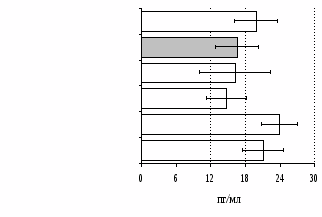
Как видно из рис. 1, в индуктивную фазу иммунного ответа на фоне стресса наблюдается увеличение числа АОК в лимфатическом узле (ЛУ) и усиление степени выраженности реакции ГЗТ. Блокада δ-опиатных рецепторов приводит к ещё более выраженной активации антителогенеза, в то время как
А Б
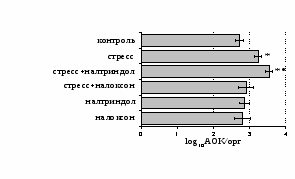
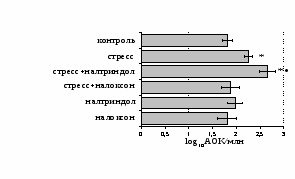
В Г
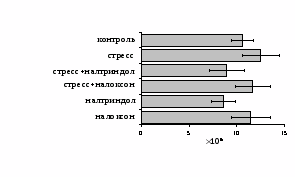
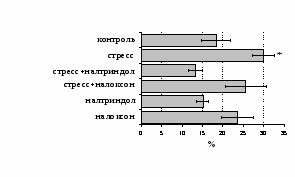
Рис. 1. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в индуктивную фазу иммунного ответа. Здесь и на рис. 2: * - p<0,05 к контролю; • - p<0,05 к стрессу.
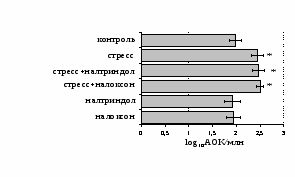
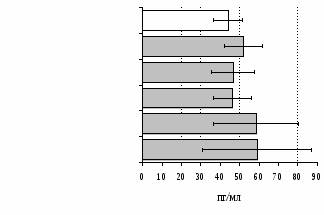
на фоне налоксона стимулирующий эффект ротационного стресса на антителогенез отменяется. Стрессиндуцированное усиление выраженности реакции ГЗТ отменяется как налоксоном, так и налтриндолом. Изолированное введение животным налтриндола или налоксона на количество АОК и степень выраженности ГЗТ влияния не оказывает. В эффекторную фазу иммунного ответа ротационный стресс (рис. 2) стимулирует как клеточный, так и гуморальный ответ, однако, в отличие от индуктивной фазы, на фоне блокады опиатных рецепторов эффекты стресса не модифицируются. Таким образом, стимуляция опиатных рецепторов в индуктивную фазу иммунного ответа играет важную роль в стрессиндуцированных изменениях иммуногенеза и ответственна за активацию функций иммунной системы при стрессе.
Влияние гидрокортизона и адреналина на локальный иммунный ответ в условиях блокады опиатных рецепторов. В процессе развития стрессреакции основные стрессреализующие факторы глюкокортикоиды,
А Б
В Г
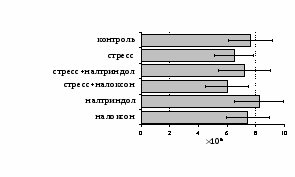
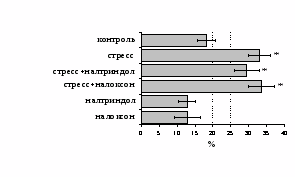
Рис. 2. Влияние ротационного стресса в условиях блокады опиатных рецепторов на абсолютное (А) и относительное (Б) число АОК, количество ЯСК в регионарном лимфатическом узле (В) и выраженность реакции ГЗТ (Г) в эффекторную фазу иммунного ответа.
Таблица 1. Влияние гидрокортизона в условиях блокады - и -опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
|
Экспериментальное воздействие |
Лимфатический узел |
||
ЯСК на орган(106) |
log>10> АОК на 106 ЯСК |
log>10> АОК на орган |
|
|
Интактные животные (контроль), n=19 |
8,931,35 |
2,150,15 |
3,010,17 |
|
(142) |
(1014) |
||
|
Физиологический |
7,791,08 |
2,270,16 |
3,100,13 |
|
раствор, n=16 |
(186) |
(1252) |
|
|
Гидрокортизон, n=19 |
4,980,68*# |
1,640,23 |
2,170,25*# |
|
(43) |
(149) |
||
|
Гидрокортизон |
6,710,75a |
0,960,21*#a |
1,500,31*# |
|
+Налоксон, n=15 |
(9) |
(32) |
|
|
Гидрокортизон |
5,870,71 |
0,550,14*#a |
1,070,22*#a |
|
+налтриндол, n=17 |
(4) |
(12) |
|
|
Налоксон, n=10 |
7,761,27 |
2,240,08 |
3,070,14 |
|
(173) |
(1187) |
||
|
Налтриндол, n=12 |
8,381,37 |
1,930,11 |
2,790,11 |
|
(86) |
(622) |
Примечание. Здесь и в табл. 2, 3, 4 в скобках указана средняя геометрическая числа АОК (антилогарифм из средней арифметической log>10> числа АОК). * - p<0,05 к контролю; # - p<0,05 к физиологическому раствору; а - p<0,05 к гидрокортизону по непарному t-критерию Стъюдента..
катехоламины и эндогенные опиоиды находятся в тесной взаимосвязи и оказывают друг на друга взаимное регуляторное влияние (O`Connor, 2000). Как видно из табл. 1, в индуктивную фазу иммунного ответа гидрокортизон снижает количество ядросодержащих клеток в лимфатическом узле и абсолютное число АОК. При введении гидрокортизона на фоне блокады опиатных рецепторов налоксоном и налтриндолом регистрируется отмена индуцированного гидрокортизоном снижения количества ЯСК и ещё более выраженное угнетение антителогенеза по абсолютным и относительным показателям,
Таблица 2. Влияние адреналина в условиях блокады - и -опиатных рецепторов на число АОК, количество ЯСК в лимфатическом узле и выраженность реакции ГЗТ в индуктивную фазу иммунного ответа
|
Экспериментальное воздействие |
Лимфатический узел |
||
ЯСК наорган (106) |
log>10> АОК на 106 ЯСК |
log>10> АОК на орган |
|
|
Интактные животные (контроль) n=11 |
6,291,04 |
2,430,16 |
3,150,22 |
|
(268) |
(1403) |
||
|
Адреналин, n=9 |
5,710,74 |
2,070,14 |
2,790,16 |
|
(118) |
(618) |
||
Адреналин |
7,372,08 |
1,940,15* |
2,730,24 |
|
+Налоксон, n=6 |
(86) |
(541) |
|
|
Адреналин |
6,621,30 |
1,780,25* |
2,450,32 |
|
+налтриндол, n=11 |
(60) |
(283) |
|
|
Налоксон, n=10 |
7,761,27 |
2,240,08 |
3,070,14 |
|
(173) |
(1187) |
||
|
Налтриндол, n=9 |
8,071,82 |
2,081,97 |
2,900,13 |
|
(121) |
(803) |
особенно ярко проявляющееся в условиях блокады -рецепторов. Изолированное введение экспериментальным животным налтриндола и налоксона на исследуемые показатели влияния не оказывает. В эффекторную фазу иммунного ответа гидрокортизон угнетает количество ядросодержащих клеток в лимфатическом узле, абсолютное число АОК, однако в отличие от индуктивного периода на фоне блокады опиатных рецепторов эффекты гидрокортизона на показатели клеточности и антителогенеза не модифицируются.
Несколько иная картина наблюдается при анализе эффектов адреналина. Как видно из табл. 2, в индуктивную фазу адреналин оказывает статистически достоверный эффект на антителогенез по относительным показателям (F=5,28; p<0,03), несмотря на то, что при межгрупповом сравнении по отношению к контролю угнетение относительного количества АОК имеет место только при комбинации адреналина с опиатными
Таблица 3. Влияние β-эндорфина на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле
|
Экспериментальное воздействие (β-эндорфин) |
Число живот-ных |
Лимфатический узел |
Интенсив-ность ГЗТ |
||
|
ЯСК на орган (*106) |
Log>10> АОК на 106 ЯСК |
Log>10> АОК на Орган |
ИР по массе стопы, % |
||
|
Контроль |
9 |
4,620,89 |
2,430,10 |
3,040,01 |
17,222,41 |
|
(271,28) |
(1088,94) |
||||
|
100 мкг/кг |
9 |
4,330,71 |
1,980,22* |
2,570,26* |
19,843,68 |
|
(95,28) |
(370,54) |
||||
|
10 мкг/кг |
8 |
5,25±0,70 |
2,06±0,26 |
2,76±0,25 |
23,92±3,46 |
|
(115,56) |
(569,35) |
||||
|
1 мкг/кг |
9 |
4,87±1,06 |
2,46±0,18 |
3,05±0,16 |
20,25±4,25 |
|
(286,09) |
(1128,59) |
||||
|
0,1 мкг/кг |
8 |
7,55±1,35 |
2,25±0,18 |
3,08±0,13 |
18,82±6,17 |
|
(117,27) |
(1198,91) |
||||
|
0,01 мкг/кг |
9 |
5,33±1,13 |
2,68±0,09 |
3,34±0,13 |
26,72±3,88 |
|
(474,99) |
(2192,95) |
||||
|
0,001 мкг/кг |
8 |
5,90±1,73 |
2,62±0,73 |
3,21±0,13 |
21,27±4,88 |
|
(421,49) |
(1607,54) |
||||
|
0,0005 мкг/кг |
9 |
5,820,81 |
2,870,08* |
3,610,07* |
28,724,10 |
|
(743,72) |
(4031,74) |
Примечание. Здесь и в табл. 4: - индекс реакции (ИР): И.Р. = (Ро–Рк)/Рк·100%, где Ро и Рк - показатели массы в опытной и контрольной конечностях. * - p<0,05 к контролю по t-критерию Фишера наименьшей значимой разницы.
антагонистами. В эффекторную фазу иммунного ответа адреналин на антителогенез в лимфатическом узле не влияет. Таким образом, блокада опиатных рецепторов в индуктивную фазу иммунного ответа приводит к существенной модификации иммунорегуляторных эффектов глюкокортикоидов и катехоламинов, связанной с изменениями секреции β-эндорфина в ответ на введение гидрокортизона или адреналина (Mougey et al., 1986; Bagdy et al., 1989; Goodwin et al., 1992).
Влияние β-эндорфина на показатели клеточного и гуморального иммунитета. Степень выраженности эффектов β-эндорфина в системе in vivo
Таблица 4. Влияние β-эндорфина в условиях блокады опиатных рецепторов на число АОК, клеточность и выраженность реакции ГЗТ в регионарном лимфатическом узле в индуктивную фазу иммунного ответа
|
Экспериментальное воздействие |
Чис-ло жи-во-тных |
Лимфатический узел |
Интенсив-ность ГЗТ |
||
|
ЯСК на орган (106) |
log>10> АОК на 106 ЯСК |
log>10> АОК на орган |
ИР по массе стопы, % |
||
|
Контроль |
18 |
5,34±0,62 |
2,35±0,10 |
3,02±0,11 |
22,43±3,19 |
|
(223,55) |
(1043,31) |
||||
|
β-эндорфин |
18 |
4,71±0,51 |
1,99±0,14* |
2,36±0,15* |
22,16±2,73 |
|
(100 мкг/кг) |
(98,80) |
(423,03) |
|||
|
β-эндорфин |
17 |
5,98±0,66 |
2,67±0,07* |
3,40±0,08* |
27,95±2,73 |
|
(0,0005 мкг/кг) |
(465,21) |
(2519,33) |
|||
|
β-эндорфин |
11 |
5,64±0,97 |
2,21±0,14 |
2,87±0,18 |
23,79±4,27 |
|
(100 мкг/кг) + |
(161,61) |
(747,62) |
|||
|
налоксон |
|||||
|
β-эндорфин |
12 |
5,95±0,66 |
2,16±0,12 |
2,90±0,14 |
28,57±6,77 |
|
(0,0005 мкг/кг) + |
(143,12) |
(798,77) |
|||
|
налоксон |
|||||
|
β-эндорфин |
11 |
7,18±41,24 |
2,50±0,07 |
3,29±0,05* |
23,32±4,17 |
|
(100 мкг/кг) + |
(314,71) |
(1945,42) |
|||
|
налтриндол |
|||||
|
β-эндорфин |
11 |
9,07±1,24* |
2,52±0,09 |
3,43±0,12* |
25,67±3,12 |
|
(0,0005 мкг/кг) + |
(327,67) |
(2673,98) |
|||
|
налтриндол |
|||||
|
Налоксон |
12 |
6,40±0,73 |
2,23±0,09 |
3,01±0,11 |
16,08±2,02 |
|
(170,40) |
(1013,98) |
||||
|
Налтриндол |
8 |
6,98±0,55 |
2,04±0,24 |
2,87±0,21 |
18,36±1,92 |
|
(110,87) |
(755,38) |
Примечание. * - p<0,05 к контролю по непарному t-критерию Стьюдента.
напрямую зависит от вводимой дозы пептида (табл. 3). Пептид оказывает разнонаправленный эффект на гуморальный иммунный ответ, угнетающий в дозе 100 мкг/кг и стимулирующий в дозе 0,0005 мкг/кг образование АОК в регионарном ЛУ. При этом статистически достоверного влияния β-эндорфина на клеточность ЛУ и степень выраженности реакции ГЗТ не обнаруживается. Таким образом, β-эндорфин в системе in vivo в зависимости от дозы как усиливает, так и угнетает образование антителопродуцентов.
Данные о влиянии β-эндорфина на фоне блокады опиатных рецепторов представлены в табл. 4. Блокада рецепторов неселективным антагонистом налоксоном отменяет как угнетающий эффект дозы 100 мкг/кг, так и стимулирующий эффект дозы 0,0005 мкг/кг на относительное и абсолютное количество АОК. В то же время введение мышам β-эндорфина на фоне блокады δ-рецепторов налтриндолом по абсолютным показателям не отменяет стимулирующего эффекта низкой (0,0005 мкг/кг) дозы пептида и приводит к увеличение числа АОК в ответ на введение животным высокой дозы (100 мкг/кг). Кроме этого, введение пептида в дозе 0,0005 мкг/кг на фоне налтриндола приводит к статистически достоверному увеличению клеточности ЛУ по сравнению с контролем. На степень выраженности иммунного воспаления комбинация β-эндорфина с антагонистами опиатных рецепторов влияния не оказывает. Таким образом, β-эндорфин в зависимости от дозы оказывает разнонаправленное влияние на образование антителопродуцентов, не влияя
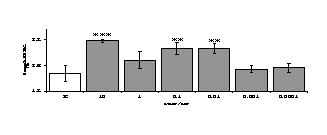
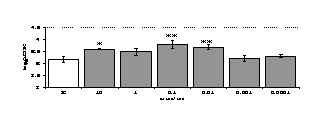
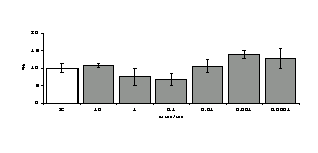
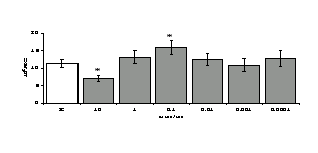
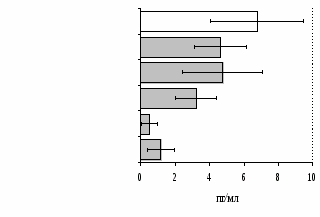
Рис. 3. Влияние DADLE на относительное и абсолютное число АОК, выраженность реакции ГЗТ и клеточность в регионарном лимфатическом узле в индуктивную фазу иммунного ответа.
* - p<0,05; ** - p<0,01; *** - p<0,001 к контролю по t-критерию Фишера наименьшей значимой разницы.
на клеточноопосредованный ответ. Способность пептида взаимодействовать с -рецептором проявилась только при введении высокой дозы, что, в свою, очередь указывает на возможность реализации через -рецептор иммуносупрессивных эффектов, напротив блокада -рецепторов отменяет эффекты пептида независимо от вводимой дозы. В эффекторную фазу влияния β-эндорфина на иммунный ответ не выявляется.
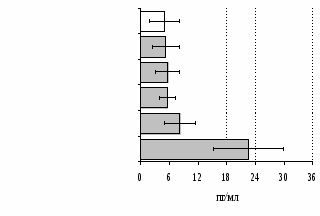
Параллельно нами изучалось сравнительное влияние селективных и -агонистов на выраженность локального иммунного ответа. Как видно из рис. 3, в индуктивную фазу иммунного ответа введение -агониста DADLE в дозах 10,0; 0,1; 0,01 мкг/мл стимулирует количество АОК по абсолютным и относительным параметрам, не влияет на степень выраженности иммунного воспаления (ГЗТ) и оказывает разнонаправленное действие на клеточность регионарного лимфатического узла, при этом в дозе 10 мкг/кг угнетая, а в дозе 0,1 мкг/кг - увеличивая содержание ЯСК. Введение -агониста DAGO статистически достоверно влияет только на относительное число АОК и клеточность регионарного лимфатического узла. В дозах 10,0; 1,0; 0,0001 мкг/кг пептид активирует образование антителопродуцентов по относительным показателям и в диапазоне доз 10-
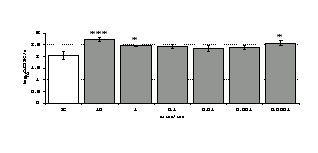
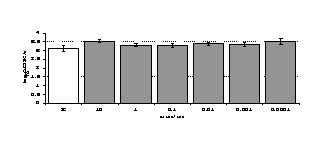
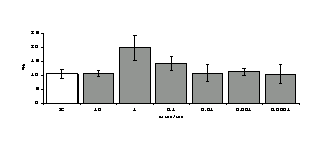
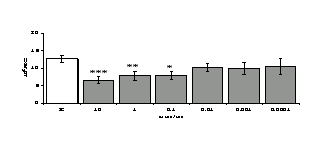
Рис. 4. Влияние DAGO на относительное и абсолютное число АОК, выраженность реакции ГЗТ и клеточность в регионарном лимфатическом узле в индуктивную фазу иммунного ответа.
* - p<0,05; ** - p<0,01; *** - p<0,001 к контролю по t-критерию Фишера наименьшей значимой разницы.
0.1 мкг/кг угнетает количество ЯСК (рис. 4). Таким образом, по нашим данным, в системе in vivo эффекты -эндорфина и аналогов энкефалинов с ,-селективным спектром связывания DAGO и DADLE значительно варьируют по направленности действия, эффективному диапазону доз, взаимодействию с опиатных рецепторов различных типов, а так же зависят от этапа, на котором конкретный опиоидный пептид вмешивается в развитие иммунных реакций. В то же время наиболее выраженное активирующее влияние наблюдается при введении экспериментальным животным селективного агониста -рецепторов DADLE.
Влияние β-эндорфина, 88-91 фрагмента липотропина MPF, селективных лигангдов DAGO, DADLE на пролиферативный ответ лимфоцитов. Степень выраженности эффектов исследуемых опиоидных пептидов в системе in vitro зависит от их концентрации и присутствия митогена в культуральной среде. Все лиганды опиатных рецепторов проявляют активность только на стимулированных митогеном культурах. Как видно из рис. 5, -эндорфин в концентрации 10-7М статистически значимо усиливает пролиферативный ответ лимфоцитов в культурах с ФГА 5 мкг/мл. Внесение пептида в культуры
A
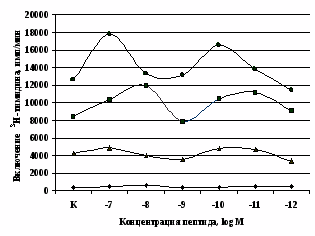
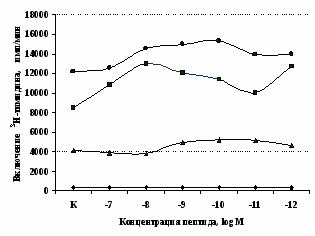
Рис. 5. Влияние -эндорфина (A) и DAGO (Б) на ФГА-индуцированный пролиферативный ответ лимфоцитов.
Здесь и на рис. 6: I - ФГА 5 мкг/мл, II - ФГА 2,5 мкг/мл, III - ФГА 1,25 мкг/мл, IV – без внесения ФГА. Число наблюдений в группах с -эндорфином n=9, в группах с DAGO - n=8. * - р<0.05 к контролю по парному t-критерию Фишера наименьшей значимой разницы..
в концентрации 10-8М приводит к стимуляции реакции бласттрансформации в присутствии ФГА 2,5 мкг/мл. Низкие (10-10, 10-11М) концентрации -эндорфина стимулируют пролиферативный ответ в культурах с ФГА 5,0 и 2,5 мкг/мл соответственно. Внесение -эндорфина в концентрации 10-12М, отражающей фоновый уровень пептида в плазме крови, не оказывает существенного влияния на пролиферацию лимфоцитов. А.А. Зозулей и С.Ф. Пшеничкиным (1990) высказано предположение, что иммуномодулирующие эффекты -эндорфина могут проявляться через С-концевой участок пептидной цепи, невзаимодействующий с -, -рецепторами. В связи с этим представлял интерес анализ эффектов С-концевого тетрапептида -эндорфина MPF (меланотропин-потенциирующего фактора) на пролиферативную активность лимфоцитов периферической крови. Как видно из рис. 6, MPF ни в одной из исследуемых концентраций статистически значимых эффектов на спонтанную и индуцированную митогеном пролиферацию лимфоцитов не оказывает. Это позволяет предположить, что выявленный стимулирующий эффект -эндорфина на пролиферативную активность лимфоцитов не опосредуется через его С-концевой участок.
В связи с тем, что -эндорфин N-концевой последовательностью связывается как с -, так и -опиатными рецепторами и не ясно, какой тип рецепторов в данном случае является основным проводником сигнала с поверхности клетки, мы сопоставили его эффекты на
A
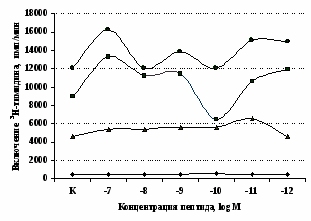
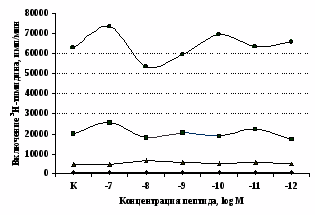
Рис. 6. Влияние DADLE (А) и MPF (Б) на ФГА-индуцированный пролиферативный ответ лимфоцитов.
Число наблюдений n=8. пролиферацию с эффектами селективных - и -агонистов. Данные о влиянии синтетического селективного агониста μ-опиатных рецепторов DAGO на пролиферативную активность лимфоцитов периферической крови представлены в рис. 5. Анализ зависимости эффектов от концентрации показал, что DAGO в высоких и низких концентрациях достоверно усиливает пролиферативный ответ лимфоцитов исключительно в присутствии субоптимальной концентрации (2,5 мкг/мл) митогена. На спонтанный пролиферативный ответ DAGO подобно -эндорфину влияния не оказывает.
Аналогичные результаты получены при анализе влияния селективного -агониста DADLE на пролиферацию лимфоцитов (см. рис. 6). Выявлено, что DADLE усиливает включение 3Н-тимидина лимфоцитами по сравнению с контролем в присутствии ФГА 2,5 мкг/мл и высокой концентрации (10-7 М) данного пептида.
В дальнейшем проводилась сравнительная оценка влияния β-эндорфина на пролиферативный ответ на фоне блокады опиатных рецепторов в нефракционированных и фракционированных, очищенных от моноцитов, лимфоцитарных культурах. Как видно из рис. 7, в нефракционированной лейкоцитарной суспензии стимулирующий эффект -эндорфина на пролиферативный ответ не отменяется, а напротив, усиливается. При удалении моноцитов из фракции мононуклеаров -эндорфин (F=13,07; p=0,006) и налоксон (F=10,21; p=0,011) оказывают высоко достоверные
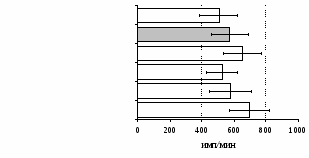
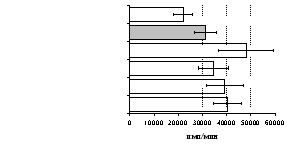
Рис. 7. Эффекты -эндорфина на фоне блокады опиатных рецепторов, DAGO и DADLE на спонтанную (A) и индуцированную ФГА 2,5 мкг/мл (Б) пролиферативную активность лимфоцитов в нефракционированных клеточных культурах.
* - р<0,05 к контролю по парному t-критерию Стъюдента.
самостоятельные эффекты на ФГА-индуцированную пролиферацию, не проявляя статистически значимого взаимодействия между собой (F=4,08; p=0,074). Последующее сравнение средних величин показало, что направленность эффектов опиоидных пептидов противоположна влиянию, оказываемому -эндорфином и налоксоном в присутствии фракции моноцитов (рис. 8). В частности, выраженное угнетение пролиферации лимфоцитов как по сравнению с контролем, так и с -эндорфином наблюдается при совместном внесении в культуры -эндорфина и налоксона. Угнетающий эффект на захват 3Н-тимидина лимфоцитами оказывает селективный -агонист DAGO. Селективный агонист -рецепторов DADLE на ФГА-индуцированную пролиферативную активность лимфоцитарной фракции не влияет. При этом эффекты исследуемых опиоидов в аналогичных культурах без митогена не обнаруживаются. Проведенный корреляционный анализ выявил статистически достоверную (r=0,73; р<0,05) зависимость между интенсивностью пролиферации лимфоцитов в нефракционированных культурах под воздействием -эндорфина и в аналогичных культурах, очищенных от фракции моноцитов.
Анализ роли -рецепторов в регуляции пролиферативного ответа в нефракционированной лейкоцитарной суспензии и фракции лимфоцитов (рис. 9) показал отмену стимулирующего эффекта -эндорфина налтриндолом во фракции лейкоцитов. Во фракции лимфоцитов -эндорфин и налтриндол на степень выраженности пролиферации не влияют, что свидетельствует о возможной
А Б
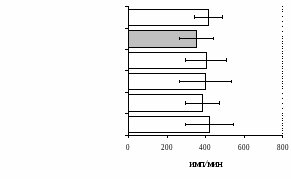
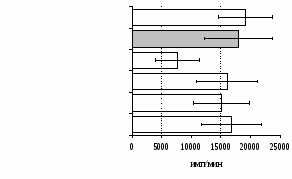
Рис. 8. Эффекты -эндорфина на фоне блокады опиатных рецепторов, DAGO и DADLE на спонтанную (A) и индуцированную ФГА 2,5 мкг/мл (Б) пролиферативную активность лимфоцитов в клеточных культурах, очищенных от фракции моноцитов.
* - р<0,05 к контролю по парному t-критерию Стъюдента.
А Б
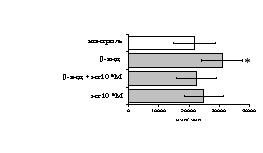
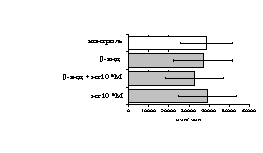
Рис. 9. Эффекты -эндорфина на фоне блокады -опиатных рецепторов на индуцированную ФГА 2,5 мкг/мл пролиферативную активность лимфоцитов во фракции лейкоцитов (А) и фракции лимфоцитов (Б).
* - р<0,05 к контролю по парному t-критерию Стъюдента.
реализации стимулирующего эффекта пептида через -рецептор, но только в присутствии моноцитов.
Учитывая важную регуляторную роль моноцитов, в дальнейшем мы попытались оценить роль IL-1 и продуктов циклооксигеназного цикла в -эндорфинопосредованной регуляции пролиферативного ответа лимфоцитов в присутствии ФГА (рис. 10А). Все обследованные здоровые доноры были разделены по индивидуальной чувствительности к -эндорфину на две группы: у 1-й группы пептид стимулировал
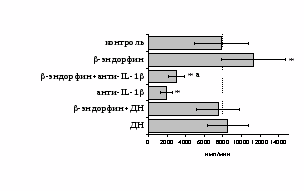
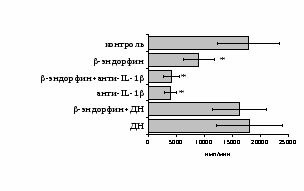
Рис. 10. Влияние -эндорфина на ФГА-индуцированный пролиферативный ответ лимфоцитов в присутствии анти-IL-1 антител и на фоне блокады синтеза простагландинов ДН у доноров 1-й (А, n=9) и 2-й (Б, n=11) групп.
* - р<0,05 к контролю; а - р< 0,05 к анти-IL-1 по парному t-критерию Стъюдента.
пролиферативный ответ, а у 2-й – угнетал. В первой группе доноров на фоне моноклональных антител к IL-1 наблюдается резкое снижение пролиферативной активности, в то же время при внесении в культуры анти-IL-1-антител в присутствии -эндорфина наблюдается некоторое усиление пролиферативного ответа, достоверно отличающееся от культур с анти-IL-1-антителами, но по сравнению с контролем уровень захвата метки был так же достоверно ниже. Как видно рис. 10Б, у второй группы доноров на фоне анти-IL-1-антител интенсивность пролиферативного ответа в присутствии -эндорфина не изменяется.
А
без ФГА ФГА 2,5 мкг/мл
Б
без ФГА ФГА 2,5 мкг/мл
Рис. 11. Влияние -эндорфина, DAGO, DADLE на продукцию IFN- в нефракционированной (А) и фракционированной культурах (Б).
Здесь и на рис. 12 число наблюдений n=10. * - р<0,05 к контролю по парному t-критерию Стъюдента.
А
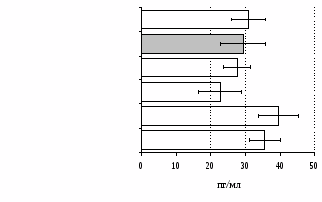
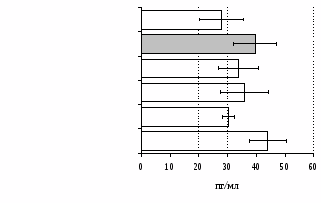
без ФГА ФГА 2,5 мкг/мл
Б
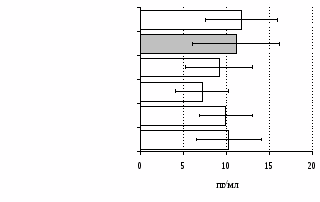
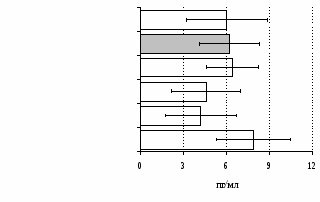
без ФГА ФГА 2,5 мкг/мл
Рис. 12. Влияние -эндорфина, DAGO, DADLE на продукцию IL-4 в нефракционированной (А) и фракционированной клеточных культурах (Б).
* - р<0,05 к контролю по парному t-критерию Стъюдента.
При культивировании лейкоцитов в присутствии диклофенака натрия как стимулирующий, так и угнетающий эффект -эндорфина на пролиферативный ответ нивелируется, что подтверждает данные о возможном участии простагландинов (простагландина E>2> (PGЕ>2>), в частности) в регуляции функциональной активности лимфоцитов под воздействием опиоидных пептидов. Таким образом, регуляция функциональной активности лимфоцитов -эндорфином может опосредоваться как системой IL-1, так и простагландинами.
Влияние β-эндорфина и селективных лигандов опиатных рецепторов на процессы клеточной кооперации и переключение Th1/Th2 цитокинового профиля. Следующим этапом исследований являлось изучение роли -эндорфина в регуляции продукции IL-4 и IFN- в супернатантах нефракционированной лейкоцитарной взвеси, лимфоцитарной фракции и культуре CD4+ клеток. Как показано на рис. 11, уровень -IFN в супернатантах под воздействием -эндорфина, а также в случае комбинации -эндорфина с налоксоном не отличается от контроля как в нефракционированных культурах, так и в культурах, очищенных от моноцитов, независимо от присутствия ФГА в среде культивирования. Однако в фракционированных клеточных культурах, стимулированных митогеном, регистрируется эффект селективного -агониста DADLE на продукцию IFN-, что, очевидно, обусловлено его прямым эффектом на рецепторные структуры клеточной поверхности лимфоцитов.
На рис. 12 приведены результаты исследования влияния -эндорфина, DAGO, DADLE на продукцию IL-4 в нефракционированной лейкацитарной суспензии и фракции лимфоцитов. По нашим данным, под воздействием налоксона и DAGO в культурах без митогена регистрируются угнетающий и стимулирующий эффекты соответственно. Выраженный стимулирующий эффект на ФГА-индуцированную продукцию IL-4 оказывают -эндорфин, налоксон и DADLE. В очищенной фракции лимфоцитов значимых эффектов исследуемые соединения на продукцию IL-4 не выявляется, за исключением угнетающего эффекта
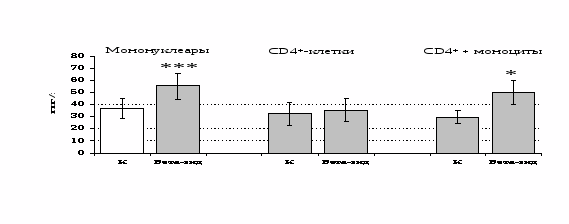
Рис 13. Влияние -эндорфина 10-7 М на продукцию IL-4 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
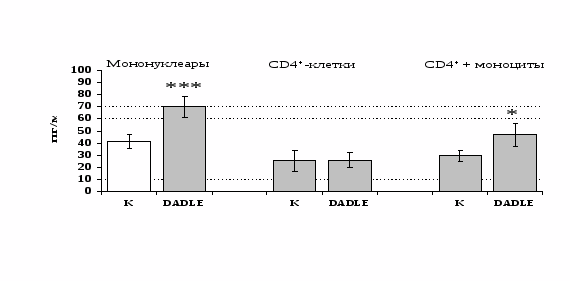
Рис 14. Влияние DADLE 10-7 М на продукцию IL-4 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
налоксона, зарегистрированного в культурах без добавления митогена. Корреляционный анализ выявил отрицательную зависимость (r=-0,68; р<0,05) между интенсивностью пролиферации и уровнем IL-4 в культурах с совместным внесением -эндорфина и налоксона в присутствии ФГА. Таким образом, -эндорфин, налоксон и селективный агонист δ-рецепторов DADLE, усиливая пролиферацию, способствуют изменению соотношения Т-хелперов в сторону TH3-клеток.
Учитывая, что во фракции лимфоцитов находятся Т-, В-лимфоциты, NК-клетки, присутствие которых может оказывать влияние на конечный результат, дальнейшие эксперименты проводились с использованием CD4+-клеток, основных продуцентов IL-4. Как видно из рис. 13, -эндорфин усиливает продукцию IL-4 во фракции мононуклеаров и не влиет на уровень IL-4в культуре CD4+-клеток. Добавление к CD4+-лимфоцитам моноцитов приводит к восстановлению уровня продукции IL-4 под воздействием -эндорфина. Аналогичный по силе и направленности эффект на продукцию IL-4 CD4+-лимфоцитами оказывает селективный -агонист DADLE (рис. 14). Анализ влияния -агониста DAGO выявил тенденцию
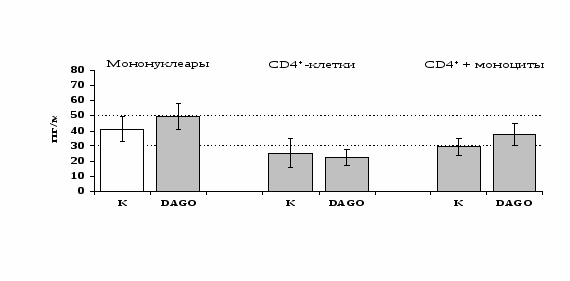
Рис 15. Влияние DAGO 10-8 М на продукцию IL-4 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
к усилению продукции IL-4 фракцией мононуклеаров (рис. 15), однако статистически достоверного эффекта достичь не удалось. Как видно из рис. 16, внесение -эндорфина на ФГА-индуцированную продукцию IL-2 мононуклеарами, CD4+-лимфоцитами и комбинацией CD4+-лимфоциты+моноциты влияния не оказывает. Таким образом, полученные данные свидетельствуют о том, что от присутствия моноцитов зависит направленность влияния -эндорфина и -агониста DADLE на Th1/Th2-поляризацию лимфоцитов. Учитывая важное участие -рецепторов в регуляции синтеза IL-4 была проанализирована их роль в эффекте -эндорфина на продукцию данного цитокина. В условиях блокады -рецепторов нивелируется усиливающее действие пептида на уровень IL-4 в нефракционированных клеточных культурах. Во фракции лимфоцитов -эндорфин и налтриндол на продукцию IL-4 не влияют (рис. 17).
Таким образом, результаты проведённых исследований свидетельствуют о важной роли моноцитов в регуляции секреторной активности клеток адаптивного иммунитета, при этом как агонисты, так и антагонисты опиатных рецепторов оказывают самостоятельные эффекты на активность клеточных популяций.
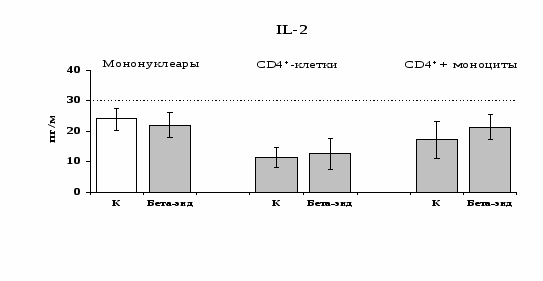
Рис 16. Влияние -эндорфина 10-7 М на продукцию IL-2 фракцией мононуклеаров, CD4+-лимфоцитами и CD4+-лимфоцитами в присутствии моноцитов в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
А Б
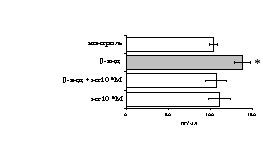
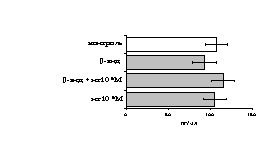
Рис. 17. Эффекты -эндорфина на фоне блокады -опиатных рецепторов на продукцию IL-4 в нефракционированной клеточной взвеси (А) и фракции лимфоцитов (Б) в присутствии ФГА 2,5 мкг/мл.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента.
Роль -эндорфина в регуляции фагоцитарной активности клеток естественного звена иммунитета. По нашим данным, β-эндорфин в концентрациях 10-7 и 10-8 М (46,251,57 в контроле – 51,31,66 - β-эндорфин 10-7 М; P<0,001 к контролю) увеличивает процент фагоцитоза и фагоцитарное число нейтрофилов (0,610,02 в контроле - 0,680,03 β-эндорфин 10-7 М; P<0,001 к контролю). Помимо нейтрофилов пептид усиливает фагоцитарную активность моноцитов в концентрациях 10-7 – 10-8 М, увеличивая процент фагоцитоза (36,92,75 в контроле – 47,74,8 - β-эндорфин 10-7 М; P<0,05 к контролю) и фагоцитарное число (0,440,03 в контроле - 0,670,08 β-эндорфин 10-7 М; P<0,05 к контролю). Так же -эндорфин стимулирует общий (суммарный) фагоцитоз. На фагоцитарную активность эозинофилов β-эндорфин не влияет.
Роль -эндорфина в регуляции цитокинпродуцирующей функции моноцитов и нейтрофилов. Как видно из табл. 5, 6, ЛПС усиливает продукцию IL-1, TNF-, IL-6 только в культурах с фракцией моноцитов, в то время как в культуре лейкоцитов эффект ЛПС на синтез IL-1, TNF-, IL-6 отсутствует. В тоже время уровень IL-8 в ответ на ЛПС усиливается в нефракционированной клеточной фракции и не изменяется в очищенной моноцитарной фракции. В нефракционированной клеточной культуре -эндорфин (10-7-10-11М) активирует LPS-индуцированную продукцию IL-1, не влияя на синтез IL-6, TNF- и угнетая продукцию IL-8 в концентрациях 10-7 и 10-11М. -эндорфин в концентрациях 10-7 - 10-11М усиливает продукцию IL-1ra, рецепторного антагониста IL-1. Значительно менее выраженный стимулирующий эффект пептид оказывает на спонтанную продукцию IL-1 в концентрациях 10-7 и 10-9М. На индуцированную субоптимальной дозой ФГА продукцию исследуемых цитокинов, а так же на их спонтанный и ЛПС-индуцированный синтез в очищенной фракции моноцитов -эндорфин не влияет.
Данные, представленные на рис. 18 указывают на отсутствие отмены стимулирующего эффекта -эндорфина на уровень IL-1 в условиях блокады опиатных рецепторов неселективным антагонистом налоксоном (, ) и селективным -антагонистом налтриндолом в течение 24 ч культивирования. Также обнаруживается самостоятельный стимулирующий эффект налтриндола на продукцию IL-1. Выявленная динамика сохраняется в течение 48 ч культивирования. Действие -эндорфина на продукцию антагониста IL-1 IL-1ra (рис. 19) имело картину, схожую с полученной нами при анализе продукции IL-1. -эндорфин и налтриндол
Таблица 5. Влияние b-эндорфина на продукцию IL-1, TNF-, IL-6 в нефракционированной лейкоцитарной суспензии
|
Цитокин, |
Экспериментальное |
Концентрация b-эндорфина, M |
|||
|
пг/мл |
воздействие |
контроль |
10-7 |
10-9 |
10-11 |
|
IL-1, |
Без индуктора |
193,01 |
271,66 |
266,57 |
238,22 |
|
n=8 |
39,16 |
77,96* |
49,18* |
50,19 |
|
|
ЛПС 0,1 мкг/мл |
190,87 |
305,76 |
300,95 |
279,41 |
|
|
54,43 |
49,50*** |
76,95** |
62,40* |
||
|
TNF-, |
Без индуктора |
253,72 |
286,79 |
277,46 |
290,90 |
|
n=8 |
52,60 |
61,43 |
67,08 |
62,32 |
|
|
ЛПС 0,1 мкг/мл |
269,59 |
297,93 |
295,42 |
295,49 |
|
|
53,90 |
66,45 |
68,59 |
60,45 |
||
|
IL-6, |
Без индуктора |
1115,41 |
1084,09 |
1101,83 |
1109,70 |
|
n=8 |
30,54 |
50,23 |
56,55 |
46,66 |
|
|
ЛПС 0,1 мкг/мл |
1094,73 |
1082,85 |
1051,07 |
1115,41 |
|
|
36,40 |
28,72 |
36,16 |
33,88 |
||
|
IL-8, |
Без индуктора |
1353,68 |
1340,28 |
1664,63 |
1313,30 |
|
n=4 |
114,42 |
104,42 |
44,10 |
156,25 |
|
|
ЛПС 0,1 мкг/мл |
1699,20 |
1278,40 |
1635,43 |
1364,28 |
|
|
68,25а |
31,34*** |
68,31 |
59,85** |
||
|
IL-1ra, |
Без индуктора |
1811,38 |
1840 |
1817,25 |
1932,5 |
|
n=4 |
272,30 |
275,54 |
431,75 |
297,55 |
|
|
ЛПС 0,1 мкг/мл |
1957,13 |
2346,5 |
2168,13 |
2175,13 |
|
|
232,16 |
198,97*** |
261,74* |
198,06* |
Примечание. Здесь и в табл. 6: * - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Фишера наименьшей значимой разницы, a – р <0,05 – к спонтанной продукции.
стимулируют продукцию IL-1ra по сравнению с контролем как на 1-е, так и на 2-е сутки культивирования. Отмены стимулирующего влияния пептида на фоне блокады опиатных рецепторов не наблюдается. Анализ влияния пептида на продукцию IL-8 показал статистически достоверный угнетающий эффект как на 24, так и на 48 ч культивирования. В условиях блокады опиатных рецепторов налоксоном и налтриндолом угнетающее влияние -эндорфина нивелируется. Внесение налоксона и налтриндола на продукцию IL-8 не влияет.
Таблица 6. Влияние b-эндорфина на продукцию IL-1, TNF-, IL-6 в очищенной фракции моноцитов
|
Цитокин, |
Экспериментальное |
Концентрация b-эндорфина, M |
|||
|
пг/мл |
воздействие |
контроль |
10-7 |
10-9 |
10-11 |
Без индуктора |
153,22 |
121,65 |
249,92 |
118,71 |
|
|
IL-1, |
33,48 |
19,83 |
84,88 |
28,97 |
|
|
n=8 |
ЛПС 0,1 мкг/мл |
230,26 |
202,84 |
223,97 |
235,21 |
|
42,25а |
36,47 |
71,16 |
53,29 |
||
|
Без индуктора |
137,52 |
153,81 |
148,31 |
133,20 |
|
|
TNF-, |
51,33 |
58,24 |
57,56 |
55,31 |
|
|
n=8 |
ЛПС 0,1 мкг/мл |
163,21 |
178,81 |
174,97 |
178,73 |
|
60,48а |
69,78 |
68,63 |
70,21 |
||
|
Без индуктора |
1204,61 |
1174,58 |
1281,19 |
1243,46 |
|
|
IL-6, |
354,15 |
356,34 |
357,40 |
332,03 |
|
|
n=8 |
ЛПС 0,1 мкг/мл |
1435,55 |
1442,89 |
1346,26 |
1414,19 |
|
379,02а |
340,04 |
342,73 |
367,26 |
||
|
Без индуктора |
1198,38 |
1230,63 |
1294,63 |
1148,68 |
|
|
IL-8, |
153,25 |
85,79 |
219,75 |
200,81 |
|
|
n=4 |
ЛПС 0,1 мкг/мл |
1307,22 |
1422,48 |
1159,64 |
1228,32 |
|
213,04 |
90,89 |
121,80 |
154,70 |
||
|
Без индуктора |
280,38 |
364,25 |
352,83 |
359,05 |
|
|
IL-1ra, |
90,82 |
128,06 |
133,52 |
146,50 |
|
|
n=4 |
ЛПС 0,1 мкг/мл |
302,13 |
343,40 |
377,35 |
348,80 |
|
88,60 |
115,95 |
148,54 |
141,58 |
При оценке влияния опиатов на уровень TNF- выявлено угнетение продукции TNF- по сравнению с контролем при совместном внесение в культуры b-эндорфина и антагонистов опиатных рецепторов на 24 и 48 ч культивирования (см. рис. 18). На продукцию IL-6 на 24 ч культивирования b-эндорфин не влияет. На 48 ч культивирования продукцию IL-6 стимулирует налтриндол как при изолированном внесении, так и в комбинации с b-эндорфином. Учитывая, что во фракции лейкоцитов помимо моноцитов, основных продуцентов провоспалительных цитокинов, присутствуют гранулоциты, преимущественно нейтрофилы (Abraham et al., 2003; Fujiharaa et al., 2003; Xing, Remick, 2004), так же способные продуцировать IL-1 и IL-8, мы
24 ч 48 ч
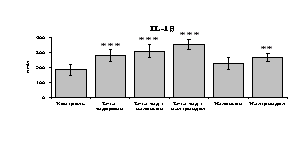
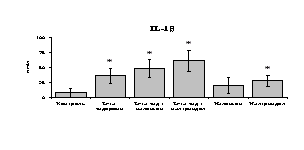
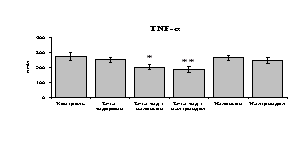
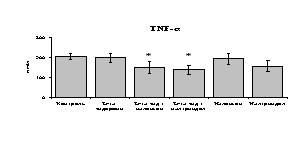
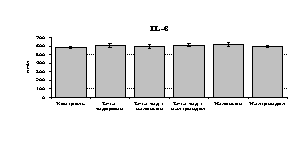
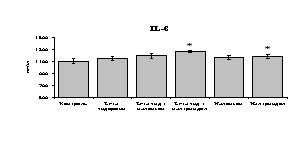
Рис. 18. Влияние -эндорфина 10-7М в условиях блокады опиатных рецепторов на продукцию IL-1, TNF-, IL-6 в нефракционированной клеточной суспензии в присутствии ЛПС.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента..
исследовали влияние -эндорфина на продукцию IL-1 и IL-8 во фракциях мононуклеаров и нейтрофилов.
Результаты исследований влияния b-эндорфина на продукцию IL-1 и IL-8 во фракциях мононуклеаров и нейтрофилов представлены на рис. 20. b-эндорфин 10-7М стимулирует спонтанную и ЛПС-индуцированную продукцию IL-1b мононуклеарами. Аналогичная картина наблюдается во фракции нейтрофилов. На фоне LPS наблюдается статистически значимое усиление продукции IL-1b. b-эндорфин 10-7М стимулирует как спонтанную, так и LPS-индуцированную продукцию IL-1b нейтрофилами. ЛПС-индуцированная продукция IL-8 мононуклеарами и нейтрофилами под воздействием b-эндорфина снижается. В культурах без ЛПС пептид уровень IL-8 не изменяет.
При анализе влияния b-эндорфина на продукцию исследуемых цитокинов мононуклеарами в присутствии ФГА были получены следующие результаты (рис. 21). Во фракции мононуклеаров ФГА, как и ЛПС, усиливает выработку IL-1b и не влияет на уровень IL-8. b-эндорфин стимулирует как спонтанную, так и ФГА-индуцированную продукцию IL-1b мононуклеарами. Уровень IL-8 под воздействием пептида в нестимулированных ФГА пробах не изменяется, а в стимулированных - снижается. Как следует из полученных данных, продукцию цитокинов семейства IL-1 нефракционированными лейкоцитами, нейтрофилами и мононуклеарами (но не очищенными моноцитами) -эндорфин активирует, а продукцию IL-8 угнетает, таким образом, оказывая двоякое действие, с одной стороны, активируя процессы пролиферации и дифференцировки, а, с другой, угнетая хемотаксис. При этом в отличие от IL-1, депрессия IL-8
24 ч 48 ч
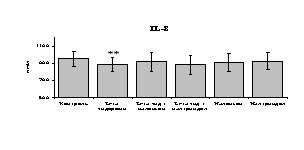

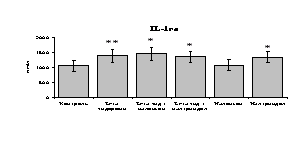
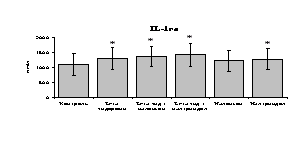
Рис. 19. Влияние -эндорфина 10-7М в условиях блокады опиатных рецепторов на продукцию IL-8 и IL-1ra в нефракционированной клеточной суспензии в присутствии ЛПС.
* - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю по парному t-критерию Стъюдента..
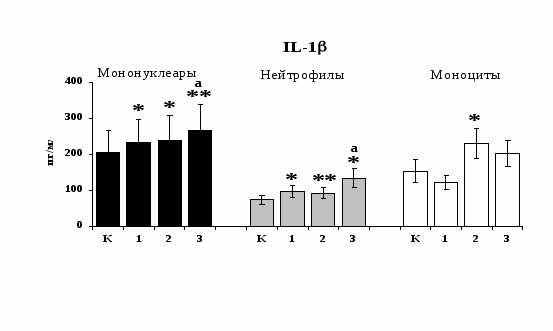
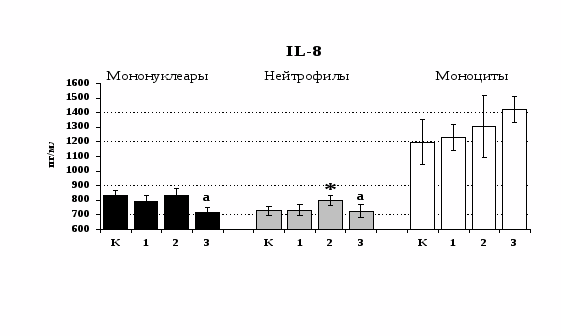
Рис. 20. Влияние -эндорфина 10-7М на продукцию IL-1 и IL-8 во фракциях мононуклеаров, нейтрофилов и моноцитов, стимулированных ЛПС.
К – контроль, 1 - -эндорфин, 2 – ЛПС, 3 – ЛПС+-эндорфин. * - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю, а - р < 0,05 к ЛПС по парному t-критерию Стъюдента..
проявляется только в ЛПС и ФГА-индуцированных культурах и нивелируется опиатными антагонистами, что указывает на вовлечённость различных рецепторных механизмов в регуляцию синтеза IL-1 и IL-8 -
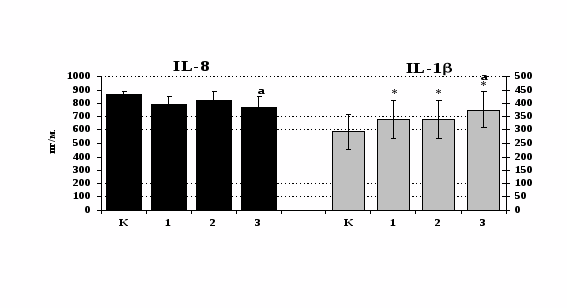
Рис. 21. Влияние -эндорфина 10-7М на продукцию IL-1 и IL-8 мононуклеарами, стимулированными ФГА 2,5 мкг/мл в течении 24 ч культивирования.
К – контроль, 1 - -эндорфин, 2 – ФГА, 3 – ФГА+-эндорфин. * - р < 0,05; ** - р < 0,01; *** - р < 0,001 к контролю, а - р < 0,05 к ФГА по парному t-критерию Стъюдента.
эндорфином. Ранее (Nandhra, 2000) был зарегистрирован угнетающий блокируемый налоксоном, эффект b-эндорфина на продукцию IL-8 клетками хориодецидуальной оболочки. Н.Л. Елизарова с соавт. (2001) установили, что аминокислотная последовательность β-эндорфина в молекуле препарата тимуса – тактивина обусловливает активацию функциональной активности лимфоцитов, усиление фагоцитоза и снижение способности моноцитов к адгезии, последняя функция отменялась налоксоном, в то время как усиление фагоцитоза налоксоном не отменялось. По нашим данным, депрессия продукции IL-8 отменяется селективным -антагонистом налтриндолом, что свидетельствует о возможности реализации эффектов b-эндорфина через -рецептор. В то же время, как показано в работе B.M. Sharp (2006), в зависимости от экспериментальной модели и объекта исследования -рецептор может опосредовать проведение как стимулирующих, так и угнетающих сигналов.
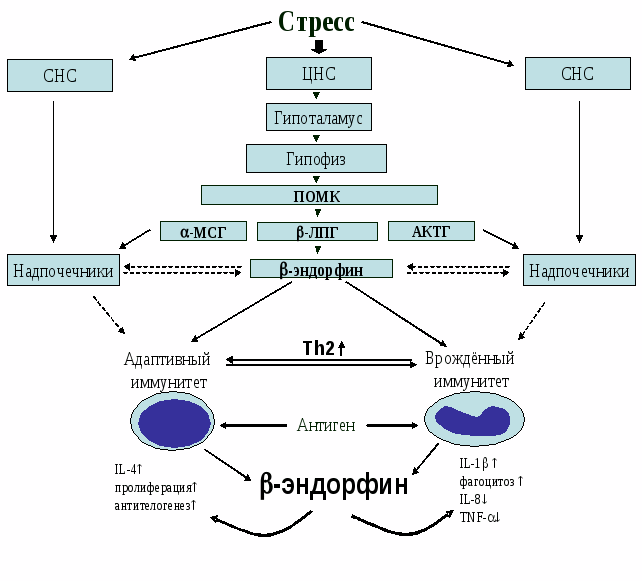
Рис. 22. Схема возможного механизма влияния -эндорфина на процессы иммуногенеза.
Заключение
Результаты проведённых исследований представлены в виде схемы возможного механизма влияния -эндорфина на процессы иммуногенеза (рис. 22). Установлено, что -эндорфин является важным фактором в поддержании внутреннего гомеостаза. Приведённые в данные, свидетельствуют о том, что -эндорфин поддерживает гомеостаз иммунной системы через балансирование Th1 и Th2 ответа, смещая поляризацию Т-хелперов в сторону Th2-клеток, параллельно усиливая естественную резистентность. Следовательно, -эндорфин является кофактором, опосредующим переключение дифференцировки Т-хелперов с Th1 на Th2 тип и играющим решающую роль при целом ряде иммунопатологических состояний, а иммуномодулирующие функции опиоидных пептидов могут представлять значительный терапевтический интерес.
Оценивая роль эндогенных нейропептидов в стрессиндуцированных изменениях иммунной системы необходимо отметить, что полученные данные прямо указывают на непосредственное участие эндогенных опиатов в активации иммунной системы. Направленность ряда физиологических эффектов эндогенных опиоидных пептидов при стрессе противоположна эффектам глюкокортикоидов и катехоламинов. Ранее глюкокортикоиды и катехоламины рассматривались исключительно как стрессреализующие факторы, в то же время их основная биологическая роль может заключаться в ограничении опасной для организма стрессиндуцированной активации иммунных процессов.
ВЫВОДЫ
1. Подтверждена интегральная роль эндогенной опиоидной системы в нейроэндокринной регуляции иммуногенеза в норме, введении глюкокортикоидов и катехоламинов и в условиях стрессорного воздействия. Основные компоненты эндогенной опиоидной системы принимают непосредственное участие в активации иммунной системы при стрессе.
2. Установлено, что в условиях блокады , -опиатных рецепторов в период индукции иммунного ответа повышается степень выраженности иммуносупрессивного действия гормонов стресса (глюкокортикоидов и катехоламинов) на антителогенез и регистрируется снижение степени выраженности угнетающего действия глюкокортикоидов на количество ядросодержащих клеток в регионарном лимфатическом узле.
3. Впервые показано, что -эндорфин в высоких (100 мкг/мл) дозах угнетает, в низких (0,0005 мкг/кг) дозах стимулирует гуморальное звено иммунитета и при этом не влияет на степень выраженности реакции гиперчувствительности замедленного типа. В клеточных культурах -эндорфин стимулирует пролиферацию лимфоцитов и продукцию IL-4, не влияет на синтез IL-2, IFN- и при этом усиливает степень поляризации Т-хелперов в направлении Th2-клеток. Доминирующая роль в реализации стимулирующих эффектов -эндорфина на пролиферацию и продукцию IL-4 принадлежит -рецепторам.
4. Впервые обнаружена зависимость стимулирующего эффекта опиоидных пептидов на пролиферацию лимфоцитов и продукцию IL-4 от присутствия моноцитов в клеточной культуре.
5. Показано, что -эндорфин стимулирует фагоцитарную активность клеток естественного иммунитета и оказывает модулирующее действие на цитокинпродуцирующую функцию моноцитов и нейтрофилов. В условиях блокады , -опиатных рецепторов отмены стимулирующего влияния -эндорфина на продукцию IL-1 не наблюдается, при этом угнетение продукции IL-8 опиатными антагонистами отменяется.
Список работ, опубликованных по теме диссертации
Экспериментальные статьи
1. Шилов Ю.И., Гейн С.В. Адренергическая регуляция пролиферативного ответа лимфоцитов в культурах с Т-клеточными митогенами // Бюллетень экспериментальной биологии и медицины. - 1999. - Т. 128, № 8. - С. 207-209.
2. Шилов Ю.И., Гейн С.В, Черешнев В.А. Влияние блокады b-адренергических рецепторов при стрессе на антителообразование, гиперчувствительность замедленного типа, функции фагоцитирующих клеток при локальной форме иммунного ответа // Russian Journal of Immunology. - 2001. - V. 6, № 3. - P. 301-308.
3. Гейн С.В., Симоненко Т.А., Черешнев В.А. Влияние -эндорфина и селективного агониста -опиатных рецепторов DAGO на пролиферативную активность лимфоцитов // Доклады академии наук. - 2003. - Т. 391, № 1. - С. - 127-129.
4. Гейн С.В., Симоненко Т.А., Тендрякова С.П. Влияние агонистов опиатных рецепторов на процесс антителообразования и гиперчувствительность замедленного типа при локальном иммунном ответе // Вестн. Пермск. университета. Серия Биолгия. - 2004. - Вып. 2. - С. 166-168.
5. Гейн С.В., Тендрякова Т.А. Иммуномодулирующие эффекты гидрокортизона и адреналина в условиях блокады опиатных рецепторов // Докл. Академии наук. - 2004. - Т. 399, № 3. - С. 412-414.
6. Gein S.V., Simonenko T. A., Tendryakova S. P. The effects of rotation stress on measures of immunity. The role of opiate receptors // Neuroscience and Behavioral Physiology. - 2004. - V. 34, № 9. - P. 935-938.
7. Гейн С.В., Баева Т.А. Роль опиоидных пептидов в регуляции пролиферации лимфоцитов и изменении ТH2/ТH3 цитокинового профиля // Проблемы эндокринологии. - 2005. - № 5. - С. 49-51.
8. Гейн С.В., Шаравьёва И.Л, Баева Т.А., Тендрякова Т.А. Роль блокады различных типов опиатных рецепторов в регуляции иммуномодулирующих эффектов ротационного стресса // Вестник Уральской медицинской академической науки. - 2005. - № 3. - С. 70-73.
9. Гейн С.В., Баева Т.А., Гейн О.Н., Черешнев В.А. Роль моноцитов в реализации эффектов -эндорфина и селективных агонистов - и -опиатных рецепторов на пролиферативную активность лимфоцитов периферической крови // Физиология человека. - 2006. - Т. 32, № 3. – С. 111-116.
10. Гейн С.В., Шаравьёва И.Л, Тендрякова Т.А. Роль -опиатных рецепторов в регуляции гуморального и клеточноопосредованного иммунного ответа при ротационном стрессе // Доклады Академии наук. - 2006. - Т. 407, № 1. - С. 127-129.
11. Гейн С.В., Баева Т.А., Кичанова О.А. Влияние -эндорфина на антителогенез и продукцию ИЛ-4 в условиях блокады опиатных рецепторов // Бюллетень экспериментальной биологии и медицины. - 2006. - Т. 142, № 8. – С. 192-195.
12. С.В. Гейн, Е.Г. Чижова, С.П. Тендрякова Влияние гидрокортизона и адреналина в условиях блокады - и -опиатных рецепторов на развитие локального иммунного ответа у мышей // Российский физиологический журнал им. Сеченова. - 2006. - Т. 92, № 7. - С. 827-834.
13. Горшкова К.Г., Гейн С.В., Тендрякова С.П. Роль бета-эндорфина в регуляции продукции IL-1 и IL-8 моноцитами и нейтрофилами периферической крови // Вестник Уральской медицинской академической науки. - 2006. - № 3-1(14). - С. 46-47.
14. Гейн С.В., Баева Т.А., Чижова Е.Г., Кичанова О.А., Шаравьева И.Л. Эндогенная опиоидная система и гормоны стресса в сочетанной регуляции иммунных реакции при остром стрессе // Вестник Уральской медицинской академической науки. - 2006. - № 3-1(14). - С. 38-40.
15. Гейн С.В., Горшкова К.Г., Тендрякова С.П.. Роль b-эндорфина в регуляции продукции провоспалительных цитокинов моноцитами периферической крови in vitro // Бюллетень экспериментальной биологии и медицины. - 2007. - Т. 143, № 2. - С. 175-178.
Труды конференций
16. Shilov Ju.I., Gein S.V., Chereshnev V.A.. Adrenergic and cAMP-dependent regulation of mitogen-induced lymphocyte proliferative responses // Annual Meeting of AAAAI. J. Allergy and Clin. Immunol. - 1998. - V. 101, № 1. - S. 38-38.
17. Gein S.V., Shilov Ju.I. Influence of stress on expression of immune reactions // Межд. конф. "Проблемы загрязнения окружающей среды-98". Москва, 1998. - С. 238-238.
18. Шилов Ю.И., Гейн С.В. Влияние блокады бета-адренергических рецепторов и иммобилизационного стресса на реакции клеточноопосредованного и гуморального иммунитета // Научная сессия Пермской государственной медицинской академии. Пермь, 1998. - С. 68-68.
19. Гейн С.В., Шилов Ю.И. Адренергическая и цАМФ-зависимая регуляция пролиферативного ответа лимфоцитов в культурах с митогенами // Научная сессия Пермской государственной медицинской академии. Пермь, 1998. - С. 69-69.
20. Гейн С.В., Шилов Ю.И. Адренергическая и цАМФ-зависимая модуляция пролиферативного ответа лимфоцитов в культурах с митогенами // V Российский национальный конгресс "Человек и лекарство". Москва, 1998. - C. 330-330.
21. Шилов Ю.И., Гейн С.В. Модуляция пропранололом стресс-индуцированных изменений иммунных реакций // Там же. - C. 340-340.
22. Гейн С.В., Шилов Ю.И., Черешнев В.А. Влияние адренергических соединений на пролиферативный ответ лимфоцитов // II-й Национальный конгресс Российской Ассоциации аллергологов и клинических иммунологов «Современные проблемы аллергологии, клинической иммунологии и иммунофармакологии». Москва, 1998. - С. 345-345.
23. Шилов Ю.И., Гейн С.В. Влияние иммобилизационного стресса и блокады b-адренергических рецепторов на антителообразование и реакции гиперчувствительности замедленного типа в регионарных лимфатических узлах и селезенке при подкожной иммунизации // Иммунология. - 1998. - № 6. - С. 25-26.
24. Шилов Ю.И., Гейн С.В. Влияние адреналина и селективных антагонистов a>1>- и a>2>-адренорецепторов на пролиферативный ответ лимфоцитов периферической крови // Матер. III Всерос. научного Форума «Дни иммунологии в Санкт-Петербурге». Медицинская иммунология. - 1999. - Т. 1, № 3-4. - С. 28-29.
25. Гейн С.В., Шилов Ю.И. Роль адренорецепторов в регуляции пролиферативного ответа лимфоцитов в культурах с Т-клеточными митогенами // Всероссийской научно-практической конференция "Актуальные вопросы эндокринологии". Пермь, 1999. - С. 101-102.
26. Шилов Ю.И., Гейн С.В., Орлова Е.Г., Черешнев В.А. Влияние блокады b-адренергических рецепторов на иммунный ответ и функциональную активность фагоцитирующих клеток в условиях стресса // Аллергология и иммунология. - 2000. - Т. 1, № 2. - С. 116-117.
27. Шилов Ю.И., Гейн С.В. Иммуномодулирующие эффекты адренергических соединений в системах in vivo и in vitro // Труды российской научной конференции «Факторы клеточного и гуморального иммунитета при различных физиологических и патологических состояниях». Челябинск, 2000. - С. 134-135.
28. Кеворков Н.Н., Шилов Ю.И., Бахметьев Б.А., Ширшёв С.В., Куклина Е.М., Гейн С.В., Сидоров Д.В., Заморина С.А., Орлова Е.Г., Лихачева Н.С., Груздева Е.А., Харитонова А.В. Нейроэндокринная регуляция некоторых функций фагоцитирующих и иммунокомпетентных клеток // Тез. докл. научной конференции «Актуальные проблемы фундаментальных исследований в области биологии и медицины». Санкт-Петербург, 2000. - С. 67-68.
39. Гейн С.В. Роль b-адренергических механизмов в регуляции реакций клеточноопосредованного и гуморального иммунного ответа при стрессе // II конференция молодых ученых России с международным участием “Фундаментальные науки и прогресс клинической медицины”. Москва. - Т. 1. - С. 191-191.
30. Гейн С.В., Симоненко Т.А., Тендрякова С.П., Шилов Ю.И. Влияние блокады -,-опиатных рецепторов при стрессе на показатели клеточноопосредованного, гуморального иммунитета в условиях развития локальной формы иммуного ответа // I конференция иммунологов Урала. Екатеринбург, Иммунология урала. – 2001. - №1. – С. 2-3.
31. Гейн С.В., Симоненко Т.А., Тендрякова С.П. Участие -, , -опиатных рецепторов в развитии реакции гиперчувствительности замедленного типа и изменении числа антителообразующих клеток в модели принудительного головокружения // Труды международной научной конференции «Перспективы развития естественных наук в высшей школе». Пермь, 2001. - Т. 3. - С.120-124.
32. Гейн С.В., Симоненко Т.А., Тендрякова С.П. Роль -,-,-опиатных рецепторов в регуляции функций иммунокомпетентных и фагоцитирующих клеток при стрессе // II конференция иммунологов Урала. Пермь, Иммунология Урала. – 2002. – №1. – С. 4.
33. Гейн С.В., Симоненко Т.А. Участие -эндорфина и селективных лигандов , -опиатных рецепторов в регуляции пролифератив-ной активности лимфоцитов in vitro // III конференция иммунологов Урала. Челябинск, Иммунология урала. – 2003. - № 1. - С. 5.
34. Гейн С.В., Симоненко Т.А. Роль -эндорфина и опиодных пептидов в регуляции пролиферации лимфоцитов и изменении Тh1/Тh2 цитокинового профиля // Матер. VIII Всерос. научного Форума с международным участием «Дни иммунологии в Санкт-Петербурге». Медицинская иммунология. - 2004. - V. 6, № 3-5. - P. 226-227.
35. Гейн С.В., Симоненко Т.А. Опиоидная регуляция пролиферативного ответа лимфоцитов in vitro // Rus. J. Immunol. - 2004. - V. 9, № 1. - P. 38-38.
36. Гейн С.В., О.Н. Гейн, Т.В. Гаврилова Механизмы стрессорных нарушений функций иммунной системы и их коррекция // XIX Съезд физиологического общества им. И.П. Павлова 19-24 сентября 2004. Тез. докл. – Российский физиологический журнал им. Сеченова. - 2004. - Т. 90, №8. - С. 106-107.
37. Гейн С.В., Чижова Е.Г. Влияние гидрокортизона на фоне блокады опиатных рецепторов на развитие локального иммунного ответа // IX международная Пущинская школа-конференция молодых ученых «Биология-наука XXI века». Пущино, 2005. - С. 174.
38. Гейн С.В., Баева Т.А. Роль опиодных пептидов в регуляции пролиферации лимфоцитов и изменении Th1/Th2 цитокинового профиля // Там же. - С. 69.
39. Баева Т.А., Гейн С.В., Шаравьева И.Л., Тендрякова С.П. Роль блокады различных типов опиатных рецепторов в регуляции иммуномодулирующих эффектов ротационного стресса // Международная конференция "Проблемы загрязнения окружающей среды-2005". Пермь, 2005. - С. 56.
40. Гейн С.В., Баева Т.А., Черешнев В.А. Лиганды опиатных рецепторов в регуляции пролиферативной активности лимфоцитов in vitro // Международная конференция "Проблемы загрязнения окружающей среды-2005". Пермь, 2005. - С. 94.
41. Шилов Ю.И., Шилов С.Ю., Ланин Д.В., Гейн С.В., Орлова Е.Г., Черешнев В.А. Адренергические механизмы регуляции иммунного ответа и функций неспецифических эффекторных клеток при стрессе // Матер. IX Всерос. научного Форума с международным участием «Дни иммунологии в Санкт-Петербурге». Медицинская иммунология. - 2005. - Т. 7, № 2-3. - С. 127-127.
42. Гейн С.В., Баева Т.А., Черешнев В.А. Роль моноцитов в опиатэргической регуляции процессов пролиферации лимфоцитов и цитокинового синтеза // Там же. - С. 110-110.
43. Гейн С.В., Баева Т.А., Черешнев В.А. Роль -эндорфина в регуляции процессов пролиферации и продукции IL-4 лимфоцитами периферической крови in vitro // IV конференция иммунологов Урала. Уфа, Иммунология Урала. - 2005. - № 1 (4). - С. 4-5.
44. Гейн С.В., Чижова Е.Г., Тендрякова С.П. Влияние гидрокортизона на фоне блокады -, -опиатных рецепторов на иммунный ответ // Там же. - С. 5-6.
45. Гейн С.В., Горшкова К.Г. Влияние -эндорфина на продукцию IL-1, TNF-, IL-6 моноцитами периферической крови // V конференция иммунологов Урала. Оренбург, Иммунология урала. - 2005. - № 1. - с. 6-7.
46. Gein S.V., Gorshkova K.G., Baeva T.A. -endorphin-induced modulation of cytokine production by peripheral blood leukocytes // International symposium «Interaction of the nervous and immune systems in health and disease» Saint-Petersburg, 2007. - Р. 26-27.
Список основных сокращений
АКТГ - адренокортикотропный гормон
АОК - антителообразующая клетка
ГЗТ - гиперчувствительность замедленного типа
ЛПС - липополисахарид
ПОМК - проопиомеланокортин
РБТЛ - реакция бласттрансформации лимфоцитов
СНС - симпатическая нервная система
ФГА - фитогемагглютинин
ЦНС - центральная нервная система
ЯСК - ядросодержащая клетка
CD - маркеры дифференцировки лимфоцитов
DADLE - δ-агонист (d–Ala2,d-Leu5 - энкефалин
DAGO - -агонист (d-Ala2,N-Me-Phe4,Gly5-ol-энкефалин
IFN - интерферон
IL - интерлейкин
MPF - меланотропин потенцирующий фактор
TNF - фактор некроза опухоли