Порок сердца: сужение левого предсердно-желудочкового отверстия
Реферат
на тему: «Порок сердца: сужение левого предсердно-желудочкового отверстия»
Сужение левого предсердно-желудочкового отверстия
Сужение левого предсердно-желудочкового отверстия создает препятствие движению крови из левого предсердия в левый желудочек. Впервые описал этот порок Вьессен; клиника его была наиболее тщательно изучена в 19 в. Дюрозье (1861—1877), затем Потеном, С. П. Боткиным, Л. И. Поповым и др. Более или менее «чистая» форма митрального стеноза отмечается почти в трети случаев поражения митрального клапана. Ориентировочные подсчеты указывают, что на 100 000 населения имеется 500—800 случаев митрального стеноза [Хальхабер], таким образом, например, в Англии или во Франции этот порок имеется примерно у 250 000 чел., из них 40% могут быть оперированы. По данным клиники В. X. Василенко, митральный стеноз отмечается в 0,5% всех секций (И. Н. Рыбкин).
Этиология. Сужение левого атриовентрикулярного отверстия возникает вследствие ревматизма, длительно протекающего ревматического эндокардита. В развитии митрального порока зачастую прослеживается определенная закономерность — вначале появляются признаки недостаточности митрального клапана, стенозирование же митрального отверстия развивается в течение ряда лет. Потен, а затем Вакез наблюдали, как у больного с детского возраста прогрессировал митральный порок и через 12 лет выявились все типичные признаки митрального стеноза. Клинические наблюдения подтверждают, что выраженный митральный стеноз выявляется только через несколько лет после первой атаки ревматизма [Г. Ф. Ланг, Н. Д. Стражеско, Уайт]. В некоторых случаях возможно непосредственное развитие митрального стеноза без стадии недостаточности [И. С. Богословский, Брок и др.]. Почти всегда митральный стеноз развивается и прогрессирует медленно и скрыто; очень часто (в 30—40% случаев) в анамнезе не удается выявить начало ревматического процесса, т. е. он протекает без заметных для больного симптомов (висцеральная медленно текущая форма ревматизма) и порок нередко обнаруживается неожиданно для больного при диспансерном исследовании (И. Н. Рыбкин и др.). Естественно, что митральный стеноз очень редко отмечается в детском возрасте, а наиболее - часто у лиц старше 18—20 лет.
Очень редко причиной митрального стеноза может быть септический эндокардит. Еще реже бывает врожденный митральный стеноз. Сужение пли закрытие митрального отверстия могут быть вызваны также тромбом, полипом или миксомой левого предсердия.
Патогенез и механизм развития порока. Сужение левого атриовентрикулярного отверстия происходит при ревматическом вальвулите вследствие сращения либо створок клапана, либо; нередко сочетаются оба процесса, но с преобладанием одного из них. При сращении краев фиброзно утолщенного клапана образуется диафрагма с щелевидным отверстием — стеноз в виде «пуговичной петли; такой ригидный клапан не может вполне закрываться во время систолы желудочка, что обусловливает некоторую степень недостаточности митрального клапана.
Подобный тип митрального стеноза наблюдается почти в 85% всех случаев. Если воспалительный процесс был сосредоточен гл. обр. в сухожильных нитях, то происходит их сращение, утолщение и укорочение, вследствие чего подвижность клапана, даже если он и не ригидный, резко ограничивается; клапан приобретает вид воронкообразного втяжения в желудочек — форма «рыбьего рта»; такого рода стеноз является «чистым», т. е. не сопровождается недостаточностью митрального клапана.
Наконец, в части случаев имеет место двойное сужение—срастание створок и сращение сухожильных нитей (А. Н. Бакулев, И. К. Зенкова и др.); иногда створки настолько деформированы, что утрачивается какое-либо сходство с клапаном [Гловер]. При длительном существовании порока в ткани пораженного клапана откладываются соли кальция — происходит обызвествление клапана. В редких случаях большого расширения левого желудочка движение крови из предсердия в желудочек происходит с образованием вихревых движений, которые могут быть причиной диастолического шума; в таких случаях можно считать, что имеется относительный стеноз вследствие диспропорции между атриовентрикулярным отверстием и увеличенной полостью желудочка; это может наблюдаться, напр., при остром ревматическом миокардите у детей. При чистой форме митрального стеноза левый желудочек не увеличен, а чаще уменьшен; правый желудочек, оттесняя его кзади, обусловливает верхушечный толчок.
Левое предсердие расширено, стенки его гипертрофированы, нередко имеются пристеночные тромбы; увеличение левого предсердия может достигать иногда огромных размеров: емкость его возрастает до ½—1л; может образоваться аневризма предсердия. Гемодинамика. У человека площадь левого атриовентрикулярного отверстия колеблется от 4 до 6 см, длина окружности— от 9 до 11 см [Карлотти, Горлин, Бейли, Т. С. Воропаев и др.].
Атриовентрикулярные отверстия обладают значительным резервом площади; только уменьшение этой площади более чем на половину может вызвать заметные нарушения гемодинамики. Уменьшение площади отверстия ниже 1 см ведет к появлению очень тяжелых симптомов. У большинства больных митральным стенозом, нуждающихся в лечебной помощи, площадь левого атриовентрикулярного отверстия колеблется в пределах от 1,1 до 0,5 см [Льюис, А. Н. Бакулев]; 1,0—1,5 см является «критической площадью». В эксперименте значительные изменения гемодинамики наступают лишь при уменьшении площади отверстия до ¼ нормальной. Сужение отверстия до '/5 и даже '/10 нормальной величины совместимо с жизнью [Макдонелд и др.]. Чем меньше площадь отверстия, тем тяжелее клинические проявления митрального порока. Горлин обнаружил такие отношения между степенью стеноза и физической активностью.
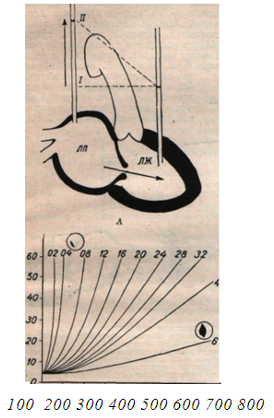
Рис. 1. Градиенты давления: А—схема градиентов между левым предсердием (ЛТ1) и левым желудочком (ЛЖ) в норме (I) и при митральном стенозе; В —кривые градиентов давления между левым предсердием и левым желудочком при сушении митрального отверстия: по вертикали — градиент давления (в мм рт. ст.); по горизонтали — скорость кровотока (в см3/сек диастолы); цифры по концам кривых—площадь митрального отверстия (в см).
Влияние сужения митрального отверстия на гемодинамику изучено благодаря измерениям давления в левом предсердии и других отделах сердечнососудистой системы и определениям минутного объема сердца. Прогрессирующие расстройства кровообращения при митральном стенозе можно представить в виде стадий. При сокращении левого предсердия кровь направляется в левый желудочек или в легочные вены в зависимости от того, в каком направлении сопротивление кровотоку меньше. Сокращение мышечных волокон в легочных венах вблизи предсердия может задерживать ретроградный ток крови; кроме того, обратный ток уменьшается при повышенном давлении в легочных венах, растяжимость которых уменьшена. Прогрессирующее уменьшение площади митрального отверстия ведет ко все большему повышению давления в левом предсердии, мускулатура которого сокращается сильнее и постепенно гипертрофируется. В левом предсердии давление повышается вследствие препятствия току крови, возрастающего по мере сужения атриовентрикулярного отверстия; одновременно повышается давление в легочных венах и капиллярах. При физической нагрузке, сопровождающейся увеличением притока крови, возрастает и давление в предсердии и капиллярах. Если в норме даже при очень значительном увеличении кровотока давление в левом предсердии не повышается, то у больного митральным стенозом при сужении атриовентрикулярного отверстия до 1,5 см2 давление остается нормальным или слегка повышенным только в покое и заметно увеличивается при физической нагрузке. При сужении отверстия до 1 см2 среднее давление в левом предсердии и легочных капиллярах в покое колеблется между 15—26 мм рт. ст. (в норме оно ниже 10 мм рт. ст.), а при физическом напряжении достигает 35 мм рт. ст., причем дальнейшее его повышение может привести к отеку легких (если кровяное давление в капиллярах превышает онкотическое давление плазмы и фильтрация из капилляров превышает отток по лимфатическим сосудам). Поэтому 1—1,5 см2 считают «критической площадью» левого атриовентрикулярного отверстия и сужение его до таких размеров служит абсолютным показанием для операции (Уолтер и др.). При тяжелом митральном стенозе с уменьшением площади отверстия ниже 0,5 см2 среднее давление в левом предсердии приближается к 35 мм рт. ст. и почти такого же уровня достигает давление в легочных капиллярах [Фридберг].
Повышение давления в левом предсердии обусловливает по законам гидродинамики повышение давления в легочных капиллярах. Однако особенно важно то, что увеличение давления в предсердии и легочных венах вследствие раздражения барорецепторов вызывает рефлекторно сужение артериол и легочной артерии (рефлекс Ф. Я. Китаева, 1931).
Рефлекс Китаева представляет собой «защитный сосудосуживающий рефлекс легких» (Вуд, П. И. Шмарин), предохраняющий капилляры от чрезмерного повышения давления. Рефлекторное сужение артериол может, однако, временами исчезать вследствие торможения рефлекса Китаева. В связи с этим на данной стадии функциональных изменений легочных сосудов при митральном стенозе можно иногда наблюдать частые кратковременные (по нескольку раз в день) приступы острого, отека легких иногда без видимых причин, при полном покое, но чаще при необычных физических напряжениях: во время родов, тяжелых волнений. Длительный спазм конечных ветвей легочной артерии сопровождается пролиферацией гладких мышц артериол, утолщением средней оболочки и уменьшением просвета сосудов. С течением времени наряду с утолщением средней оболочки артериол развиваются диффузные склеротические изменения разветвлений легочной артерии, т. е. наступает
Основная жалоба больных: крайняя утомляемость и слабость при физических нагрузках. При митральном стенозе довольно рано развивается клиническая картина застойного легкого. Сопротивление в легочных артериолах при тяжелом митральном стенозе повышается в 50— 500 раз (по сравнению с нормой) и достигает 1500 дин-сек\см2. Давление в легочной артерии возрастает в следующих пределах: систолическое до 40—120 мм рт. ст., диастолическое до 15—50, среднее до 20—85 мм рт. ст., в то время как в норме среднее давление составляет около 15 мм рт. ст., систолическое — около 30 и диастолическое— около 10 мм рт. ст. Резкое стенозирование левого атрио-вентрикулярного отверстия ведет к уменьшению минутного объема сердца (В. В. Соловьев, Я. И. Мазель, А. С. Сметнев, А. В. Весельников и др.). В норме сердечный индекс составляет в среднем 3,2 л\мин на 1 м2 поверхности тела, а у больных митральным стенозом, нуждающихся в оперативном лечении, составляет от 1,5 до 2,5 л\мин на 1 мг, причем физическое напряжение у них почти не сопровождается повышением минутного объема до нормы [Фостер, Волл и др.]. При митральном стенозе резко ограничена возможность увеличения кровообращения при напряжениях и увеличение потребления О2 происходит главным образом за счет повышенного извлечения его из крови, поэтому увеличивается артерио-венозная разница кислорода, что является компенсаторным фактором. При тяжелом митральном стенозе, сопровождающемся уменьшением минутного объема, артерио-венозная разница почти всегда увеличена, составляя вместо 4,2% в норме от 5,0 до 9,0%.
Компенсация порока. Умеренная степень митрального стеноза может быть компенсирована левым предсердием. Компенсация происходит благодаря тому, что к оставшейся в левом предсердии крови притекает из легочных вен нормальное количество крови, в связи с чем диастолический объем и давление в предсердии повышаются (В. С. Савельев, В. Л. Кариман и др.), увеличивается атриовентрикулярный градиент, что обусловливает усиленный ток крови в желудочек в ранний период диастолы; в конце диастолы желудочка левое предсердие вследствие повышенного диастолического растяжения сокращается сильнее.
Компенсаторные возможности левого предсердия вследствие относительной слабости его мускулатуры и возможности возникновения мерцаний весьма ограничены; кроме того, оно может быть поражено при рецидиве ревматического процесса; тахикардия, сопровождающаяся укорочением диастолы, также может нарушить компенсацию. Резкое сужение отверстия до площади 0,7—0,5 см2 не позволяет сколько-нибудь длительное время поддерживать нормальный минутный объем даже в покое.
Прогрессирующее сужение митрального отверстия вызывает рост давления в легочных венах и капиллярах, повышение сопротивления току крови в артериолах и венах малого круга кровообращения. Преодолевая возросшее сопротивление в сосудах легких, правый желудочек сокращается сильнее и может поддерживать нормальный минутный объем. При этом систолическое давление в легочной артерии и в правом желудочке повышается; желудочек гипертрофируется, а затем, работая против чрезмерно повышенного сопротивления, ослабевает; тогда повышается диастолическое давление в желудочке, правом предсердии и нарастает давление в венозной системе. Часто ослабление правого желудочка связано с обострением ревматического процесса или с интеркуррентными заболеваниями.
Значительно изменены при митральном стенозе функция и структура легких; причем степень одышки и симптомов застоя в легких зависит прежде всего от тяжести митрального стеноза и состояния миокарда. Кроме развития атеросклероза, могут происходить и ревматические изменения сосудов легких (Н. А. Краевский), а затем развивается кардиогенный пневмосклероз (М. К. Баранович, Т. Ф. Когай и др.). При незначительной степени митрального стеноза общая и жизненная емкость легких, дыхательный, минутный и остаточный объем остаются в пределах нормы. Изменения функций легких наступают с развитием застоев и гипертонии в сосудах малого круга кровообращения, при которых понижается эластичность легких, уменьшается их общая и жизненная емкость, а также дыхательный объем.
При тяжелом митральном стенозе общая и жизненная емкость легких (для воздуха) уменьшена в соответствии с возросшим количеством крови в сосудах и увеличением левого предсердия и правого желудочка, а при ослаблении сердца—также вследствие механического влияния гидроторакса и асцита. Увеличенное левое предсердие может вмещать 200—500 мл и более (до 2000 мл) крови. Кровь из капилляров альвеол и большинства бронхиальных капилляров переходит в легочные вены; повышение давления в левом предсердии и в легочных венах сопровождается застоем в тех сосудах бронхов, которые дренируются легочными венами. Застой в слизистой оболочке бронхов вызывает ее набухание, отек и сужение воздухоносных путей, что сопровождается образованием слизи и появлением кашля с мокротой. В таких условиях для достаточной вентиляции легких необходимо большее мышечное напряжение. При хроническом застое в слизистой оболочке бронхов могут развиваться варикозные расширения вен, которые могут стать источником кровотечения [Фергесон].
Застой развивается одновременно в сосудистой сети альвеол и бронхов. Растянутые бронхиальные капилляры могут разрываться, и мокрота становится кровянистой. Застой и отек слизистой бронхов, увеличивая сопротивление току воздуха, могут нарушать дыхание, вызывать состояния, напоминающие приступы бронхиальной астмы. Одышка первично вызывается рефлекторно в результате раздражения барорецепторов растянутых легочных сосудов; развитию одышки способствуют повышенная ригидность легких и нарушение газообмена вследствие интерстициального отека и скопления жидкости в альвеолах. Диффузный цианоз при митральном стенозе — непостоянное явление, если отсутствует значительный отек легких или выраженный кардиогенный пневмосклероз (М. К. Баранович, Т. Ф. Когай и др.).
Тягостное ощущение затруднения дыхания зависит от утомления дыхательных мышц, выполняющих большую работу. Эластичность легких ограничена значительно; растяжимость их понижена, эластическое сопротивление повышено. Эти изменения наступают рано, еще до появления существенных расстройств вентиляции; в дальнейшем развивается так наз. бурая индурация легких. Уменьшение эластичности легких нарастает во время физических напряжений и при увеличении легочного застоя и недостаточности сердца. При митральном стенозе работа дыхательных мышц повышена вследствие ригидности легких, определяемой по понижению их эластичности [Маршалл], определяющей в значительной мере степень затруднения дыхания; часто отмечается более пли менее выраженная гипервентиляция; дыхание обычно частое, поверхностное. При мышечных напряжениях падает потребление О>2> в расчете на 1 л вентиляции легких. При легочном застое обычно уменьшены как жизненная, так и максимальная дыхательная емкость легких, но не до таких величин, которые соответствовали бы степени дыхательных расстройств [Керти и др.].
Поэтому можно считать, что одышка при митральном стенозе связана главным образом с рефлекторными влияниями. Утолщение альвеолярно-капиллярного промежуточного слоя при далеко зашедшем митральном стенозе должно нарушать диффузию кислорода из альвеол в легочные капилляры. Керролл, Кон, Райли нашли, что только у 7 из 29 больных митральным стенозом альвеолярная вентиляция, легочное кровообращение и альвеолярно-капиллярная диффузия кислорода сохранились нормальными.
Повышенная ригидность легких и связанная с этим напряженная работа дыхательных мышц ведут к развитию одышки. Утолщение же альвеолярно-капиллярной мембраны с понижением диффузии кислорода представляет вторичное проявление тяжелого и долго длящегося застоя. Насыщение артериальной крови кислородом и напряжение 02 в ней при митральных стенозах даже у больных с одышкой часто не выходит за пределы нормы (95—98%); лишь в части случаев оно ниже нормы и заметно нарастает во время мышечного напряжения [Эллис и др.].
В некоторых случаях при незначительном уменьшении насыщения артериальной крови кислородом имеется значительное падение напряжения 02, как это видно из кривых диссоциации гемоглобина. Уменьшение насыщения артериальной крови кислородом при митральном стенозе и особенно при декомпенсации обусловлено недостаточной альвеолярной вентиляцией или пониженной альвеолярно-капиллярной диффузией, отчасти же является следствием примеси венозной крови [Керролл и др.; Фаулер и др.]. У некоторых больных насыщение О2 падает ниже 90% вследствие отека легких, инфаркта или пневмонии. Значительное падение насыщения О2 служит причиной разлитого цианоза. Блант и др., напр., нашли у 18 больных митральным стенозом нормальное напряжение О2 в альвеолах, но пониженное напряжение О2 в артериальной крови. Это повышение кислородного градиента между альвеолами и артериальной кровью, по-видимому, обусловлено в большей степени примесью венозной крови, чем падением диффузии.