Ліпофільні глікозиди мурамоїлдипептиду: синтез і антиінфекційна протективна дія
НацIональна академія наук України
Фiзико-хiмiчний iнститут iм. О.В. Богатського
Цикалова Вікторія Миколаївна
УДК 547.963.1
Ліпофільні глікозиди мурамоїлдипептиду: синтез і антиінфекційна протективна дія
02.00.10 - біоорганічна хімія
Автореферат
дисертації на здобуття наукового ступеня
кандидата хімічних наук
Одеса – 2008
Дисертацією є рукопис.
Робота виконана на кафедрі органічної і біологічної хімії Таврійського національного університету ім. В.І. Вернадського Міністерства освіти та науки України.
Науковий керівник: доктор хімічних наук, професор
ЗЕМЛЯКОВ Олександр Євгенович,
Таврійський національний університет
ім. В.І. Вернадського, професор
кафедри органічної і біологічної хімії
Офіційні опоненти: доктор хімічних наук, професор
ЯРМОЛЮК Сергій Миколайович,
Інститут молекулярної біології і
генетики НАН України,
завідувач відділу комбінаторної хімії
кандидат хімічних наук, доцент
ІЩЕНКО Валентина Василівна,
Київський національний університет
ім. Тараса Шевченка,
доцент кафедри органічної хімії
Захист відбудеться « 22 » травня 2008 р. о 10.00 годині на засіданні спеціалізованої вченої ради Д 41.219.02 у Фiзико-хiмiчному інституті iм. О.В. Богатського НАН України за адресою: 65080, Одеса, Люстдорфська дорога, 86.
З дисертацією можна ознайомитись у бібліотеці Фiзико-хiмiчного інституту iм. О.В. Богатського НАН України.
Автореферат розісланий « 11 » квітня 2008 р.
Вчений секретар спеціалізованої
вченої ради, кандидат хімічних наук,
старший науковий співробітник Л.О. Литвинова
Загальна характеристика роботи
Актуальність теми. Похідні N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну (мурамоїлдипептид, MDP) мають широкий діапазон імуномоделюючої дії. З декількох сотень синтезованих модифікацій мурамоїлдипептиду дотепер чотири препарати дозволено до медичного застосування і ще декілька знаходяться на завершенні клінічних випробувань. До високоактивних похідних MDP належать багато ліпофільних модифікацій мурамоїлдипептиду, зокрема, -октадециламід MDP-L-лізину (ромуртид) і фосфатидилетаноламід MDP-L-аланіну (МТР-РЕ), які використовують як лікарські засоби для лікування вторинних імунодефіцитів і ряду пухлин.
Співробітниками кафедри органічної і біологічної хімії ТНУ було запропоновано використовувати O-глікозидування MDP для зміни гідрофільно-ліпофільних властивостей. При цьому глікозидний спосіб модифікації дозволяє виключити стадії постановки і видалення тимчасового захисту аномерного гідроксилу, що робить синтез коротшим і економічним; а також закріплює конфігурацію у С1 і, отже, у водних розчинах не утворюється аномерна суміш, яка характерна для мурамоїлдипептидів з вільним глікозидним гідроксилом. В результаті проведених досліджень було встановлено, що в-глікозиди мурамоїлдипептиду, аглікони яких додають глікопептидам амфіфільні властивості, мають порівняну імуностимулюючу дію в різних тестах in vitro та in vivo, що перевищує дію самого мурамоїлдипептиду і відповідних -аномерів.
Також було встановлено, що на результати досліджень імуностимулюючої дії ліпоглікопептидів в тестах in vitro, значно впливає низька розчинність цих сполук у воді і схильність їх до агрегації. Тому вплив ліпофільних мурамоїлдипептидів на імунну систему коректніше оцінювати in vivo, наприклад, в тесті стимуляції антибактеріальної резистентності у мишей з внутрішньочеревинним введенням як збудника, так і глікопептиду.
Хоча окремі раніше отриманні ліпофільні глікозиди MDP, наприклад, в-гексадецил-, в-холестерил- або в-(адамантил-1-метил)-глікозиди MDP, показали високий імуностимулюючий ефект в деяких тест-системах, але систематичного вивчення цієї групи глікопептидів не було проведено. Тому направлений синтез ліпоглікопептидів, вивчення їх імуностимулюючої дії і встановлення взаємозв'язків між структурою глікозидів MDP та їх біологічною активністю є актуальним науковим завданням.
Зв'язок роботи з науковими програмами, планами, темами. Наукова робота виконувалась відповідно до координаційних планів Міністерства освіти і науки України в рамках кафедральних досліджень за програмою «Вивчення будови і біологічних властивостей вуглеводів і вуглеводовмісних сполук і біополімерів» (№ Держ. реєстрації 0101U005083 - 2001-2005 рр., 0106U003974 - 2006-2010 рр.). Частина досліджень виконана в рамках проекту Ф7/376-2001 «Створення нових імуномодуляторів, що володіють захисною дією проти вірусу імунодефіциту людини і опортуністичних інфекцій» Державного фонду фундаментальних досліджень (№ Держ. реєстрації 0101U005981 - 2003-2005 рр.).
Мета і завдання дослідження. Метою роботи є синтез нових ліпофільних О- і S-глікозидів N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну з різною структурою агліконів і конфігурацією глікозидного зв'язку, а також встановлення впливу структури глікозидів MDP і їх ліпофільності на протективну антиінфекційну активність.
Для досягнення поставленої мети необхідно було вирішити ряд завдань:
здійснити синтез двох груп нових ліпофільних О-в-глікозидів MDP з первинними і симетричними вторинними аліфатичними агліконами;
синтезувати нові ліпофільні О-в-глікозиди MDP з агліконами аліциклічної, арилаліфатичної і алкілароматичної будови;
отримати нові ліпофільні О--глікозиди MDP з агліконами аліфатичної і аліциклічної будови, ізомерні відповідним в-глікозидам;
розробити схему і провести синтези нових S-в-арилглікозидів MDP;
вивчити протективну дію синтезованих сполук при поразці мишей грампозитивними і грамнегативними бактеріями, а також вірусом грипу.
Об'єкт дослідження - O- і S-глікозиди N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну.
Предмет дослідження - реакції глюкозамідування спиртів, фенолів і тіофенолів; розробка методик синтезу ліпоглікопептидів; скринінг біологічної активності отриманих сполук.
Методи дослідження - органічний синтез, тонкошарова хроматографія, 1Н ЯМР спектроскопія (одновимірна, двовимірні COSY и NOESY), біологічні випробування in vivo.
Наукова новизна.
Здійснено синтез нових ліпофільних в-алкілглікозидів MDP з різною довжиною вуглецевого ланцюга.
Запропоновано новий тип ліпофільних похідних мурамоїлдипептиду - діалкілметилглікозиди MDP. Отримано ряд глікопептидів цього типу, що відрізняються ліпофільністю.
Синтезовано алкілфенільні і арилетильні глікозиди мурамоїлдипептиду: в-п-толіл-, в-п-трет-бутилфеніл- і в-п-ди-трет-бутилфеніл-, в-2,2-дифенілетил- і в-2-п-біфенілетил-MDP.
Отримані в-глікозиди мурамоїлдипептиду з агліконами, що містять аліциклічни компоненти: в-2-(адамантил-1)етил-, в-циклододецил- і 4-трет-бутилциклогексил-MDP.
Здійснено синтез нових ліпофільних б-глікозидів мурамоїлдипептиду: -додецил-, -(ундецил-6) - і -циклододецил-MDP.
Вперше здійснено синтез в-арилтіоглікозидів MDP.
Встановлено, що на відміну від глікозидів MDP, які мають переважно амфіфільні властивості, у ліпофільних глікозидів MDP з різною конфігурацією аномерного центру не спостерігається достовірних відмінностей в стимуляції протективної дії проти бактерійних інфекцій.
Практичне значення отриманих результатів.
Результати роботи можуть знайти застосування в синтезі вуглеводів і вуглеводовмісних комплексів. Відпрацьовано методики синтезу глікозидів N-ацетилглюкозаміну з агліконами різноманітної будови.
Виявлені ліпофільні глікозиди MDP, які стимулюють стійкість мишей до поразки грампозитивними і грамнегативними бактеріями.
Встановлено, що в-децил-MDP має протективний ефект відносно заражених грипом мишей.
Особистий внесок дисертанта. Особистий внесок автора в роботи, які виконані в співавторстві, полягає у виконанні синтетичного експерименту, аналізу і трактуванні отриманих результатів, формулюванні висновків. Співавторами робіт є Земляков О.Є., Чирва В.Я., Цикалов В.В.(визначення напряму дослідження, вибір об'єктів синтезу, керівництво експериментом і участь в узагальненні результатів). Дослідження біологічної активності проводили спільно з Малигіною В.Ю., Кацевим А.М., Криворутченко Ю.Л. (Кримський державний медичний університет ім. С.І. Георгієвського), Мулик Є.Л., Кузовлевим Ф.М., Калюжиним О.В. (Інститут морфології людини РАМН, м. Москва), Киселевським М.В. (НДІ експериментальної діагностики і терапії пухлин Російського онкологічного наукового центру ім. М.М. Блохіна РАМН, м. Москва).
1Н ЯМР дослідження виконані спільно з к.х.н., с.н.с. Пироженко В.В. (Інститут органічної хімії НАН України, м. Київ), експерименти COSY і NOESY - спільно з д.х.н., с.н.с. Туровим O.В. і д.х.н., проф. Брусиловцем А.I. (Київський національний університет ім. Тараса Шевченка).
Апробація результатів дисертації. Основні результати роботи були представлені на XX і XXI Українських конференціях з органічної хімії (Одеса, 2004 р., Чернігів, 2007 р.); на Міжнародному симпозіумі “Advanced science in organic chemistry” (Судак, 2006 р.); на XVIII Менделєєвському з'їзді з загальної і прикладної хімії (Москва, 2007); а також на науково-практичних семінарах Координаційної ради відділення хімії НАН України з проблеми «Наукові основи створення лікарських засобів» (Гурзуф, 2003-2005 рр.) і професорсько-викладацьких наукових конференціях ТНУ (2003-2006 рр.).
Публікації. За темою дисертації опубліковано 5 статей і тези 4 доповідей.
Обсяг і структура роботи. Дисертація складається зі вступу, огляду літератури, обговорення результатів, експериментальної частини, висновків і списку цитованої літератури (165 найменувань). Робота викладена на 148 стор. і включає 24 рисунка, 13 таблиць і 8 схем.
Зміст роботи
Стартовими сполуками в синтезі глікозидів MDP 9a-i,k-s, 16b,f,l, 23r,s (рис. 1) служили відповідні перацетильовані глікозиди N-ацетилглюкозаміну. Подальша схема включала послідовне дезацетилювання сполук 3a-i,k-s, 10b,f,l, 17r,s за Земпленом і введення 4,6-О-ізопропіліденового захисту в триоли 4a i,k s, 11b,f,l, 18r,s дією 2,2-диметоксипропану.
Алкілювання С3-ОН групи в ацеталях 5a-i,k-s, 12b,f,l, 19r,s проводили L-2-бромопропіоновою кислотою у діоксані у присутності гідриду натрію в умовах, сприяючих зверненню конфігурації асиметричного центру в похідному пропіонової кислоти. Отримані захищені мурамові кислоти 6a-i,k-s, 13b,f,l, 20r,s активували дією дициклогексилкарбодііміду (DCC) і N-гідроксисукциніміду (HOSu) і конденсували з бензиловим естером дипептиду. У глікопептидах 7a-i,k-s, 14b,f,l, 21r,s ацетальний захист віддаляли нагріванням з 70% оцтовою кислотою, а бензилові естери в похідних 8a-i,k-s, 15b,f,l – каталітичним гідрогенолізом. У разі тіоглікозидів 21r,s проводили омилення естерного захисту.
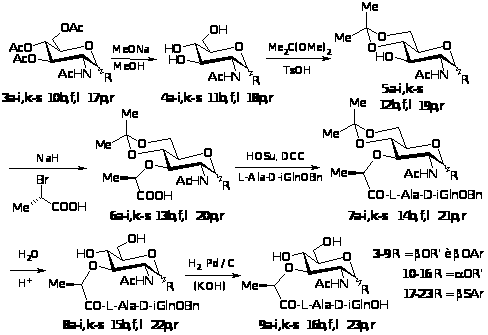
Рис. 1. Загальна схема синтезу глікозидів MDP.
Синтез в-глікозидів MDP з агліконами аліфатичної, аліциклічної і арилаліфатичної природи
На імуностимулюючу дію ліпофільних похідних MDP значно впливає структура ліпофільної компоненти. Тому разом з синтезом в-глікозидів MDP 9а-е з лінійними ліпофільними агліконами з різною довжиною вуглецевого ланцюга нами отримано нові ліпоглікопептиди 9f-i, для яких агліконами використані симетричні вторинні аліфатичні спирти (діалкілметаноли).
Глікозиди 9f-i подібно до таких високоактивних ліпоглікопептидів, як фосфатидилетаноламід MDP-L-аланіну і 6-О-(2-тетрадецилгексадеканоїл)-MDP, здатні за рахунок вуглецевих ланцюгів, що зближуються в просторі, утворювати в розчинах відносно жорсткі гідрофобні стрижнеподібні структури. Присутність такого «ліпідного якоря» сприяє вбудовуванню цих глікопептидів в аналогічним чином організовані фосфоліпідні мембрани імунних клітин.
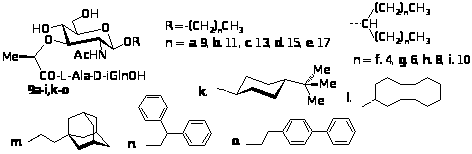
У третю групу синтезованих нами глікопептидів увійшли в-4-трет-бутилциклогексил-, в-циклододецил-, в-2-(адамантил-1)етил-, в-2,2-дифенілетил- і в-2-п-бифенілетилглікозиди MDP (9k-o), що містять у якості аглікону аліциклічні і ароматичні спирти з числом атомів Карбону від 10 до 14. Не дивлячись на невеликі відмінності в числі атомів Карбону, ліпофільність цих агліконів значно відрізняється: значення СlogP змінюється від 2,77 у 2,2-дифенілетанолу до 4,52 у циклододеканолу.
Для вибору методу глікозилювання первинних і вторинних спиртів було проведено порівняльне вивчення реакцій глікозилювання додеканолу-1, ундеканолу-6 і циклододеканолу найбільш простими і доступними глікозил-донорами - -D-глюкопіранозилхлоридом 1 в умовах реакції Кенігса-Кнорра у присутності промоторів меркурій(II) ціаніду або іодиду і оксазоліном 2.
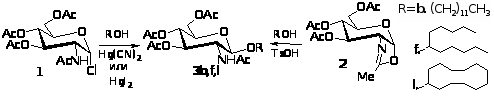
Глікозил-донор і глікозил-акцептор бралися в еквімольних кількостях. На підставі результатів цих експериментів (табл. 1) був вибраний оксазоліновий метод. Він разом з більш високими виходами глікозидів відрізняється отриманням виключно 1,2-транс-глікозидів, тоді як при використанні Hg(CN)>2 >спостерігалося додаткове утворення оксазоліну 2, а у разі HgI>2>. - відповідних -аномерів.
Препаративну кількість перацетильованих в-глікозидів N-ацетилглюкозаміну 3а-i,k-o отримали дією на спирти надлишку оксазоліну 2. Виходи склали 62-88% для первинних спиртів, 26-68% для вторинних аліфатичних спиртів і 45-81% для циклододеканолу і заміщених етанолів.
Таблиця 1
Глікозилювання спиртів хлоридом 1 і оксазоліном 2
|
Умови реакції |
Тривалість реакції, г* |
Глікозид; вихід, %** |
|||
|
Глікозил-донор |
Розчинник |
Промотор (каталізатор) |
Температура |
||
|
1 |
С>2>Н>4>Сl>2> |
Hg(CN)>2> |
20 C |
24 |
3b; 48,9±9,4 |
|
1 |
С>2>Н>4>Сl>2> |
HgI>2> |
20 C |
24 |
3b; 39,8±0,8 |
|
2 |
С>2>Н>4>Сl>2> |
TsOH |
90 C |
1,5 |
3b; 42,7±7,5 |
|
1 |
С>2>Н>4>Сl>2> |
Hg(CN)>2> |
20 C |
84 |
3f; 15,6±1,2 |
|
1 |
С>2>Н>4>Сl>2> |
HgI>2> |
20 C |
108 |
3f; 15,6±4,8 |
|
2 |
С>2>Н>4>Сl>2> |
TsOH |
90 C |
2 |
3f; 30,3±0,5 |
|
1 |
С>2>Н>4>Сl>2> |
Hg(CN)>2> |
20 C |
28 |
3l; 29,4±1,3 |
|
1 |
С>2>Н>4>Сl>2> |
HgI>2> |
20 C |
72 |
3l; 15,6±0,9 |
|
2 |
С>2>Н>4>Сl>2> |
TsOH |
90 C |
2 |
3l; 23,9±2,1 |
* До зникнення за даними ТШХ глікозил-донорів 1 і 2.
** Середнє значення з трьох експериментів.
Будова глікозидів 3а-i,k-o підтверджена даними 1Н ЯМР спектрів. . Проведено повне віднесення сигналів протонів глікозидного залишку і агліконів. Наявність дублетів аномерних протонів з хім. зсувом 4,67-4,85 м.ч. і КССВ 8,0-8,5 Гц підтверджує утворення в-D-глюкозамінідів.
У разі цис-,транс-4-трет-бутилциклогексанолу глікозилювання проводили недостатністю оксазоліну 2. У реакційній суміші за даними ТШХ знаходяться два продукти глікозилювання: більш рухомий мінорний глікозид 3j і основний компонент – глікозид 3k, які були виділені колонковою хроматографією. Виходячи з більшої реакційної здатності транс-4-трет-бутилциклогексанолу з екваторіальним розташуванням гідроксильної групи для сполуки 3k запропонована транс-конфігурація циклогексанового циклу, а для його ізомеру 3j - цис-конфігурація.
Протони сполук 3k,j мають близькі значення хімічних зсувів і КССВ (рис. 2), що підтверджує їх ізомерну будову. Основні відмінності пов'язані із зсувом в слабкіше поле сигналів Н2 в глікозидному залишку і метинового протона аглікону для глікозиду 3j.
Попередньо запропоновані конфігурації замісників в циклогексановому фрагменті агліконів сполук 3j,k підтверджуються даними спектрів COSY і 2D NOESY. Зокрема, в спектрі 2D NOESY (рис. 3) глікозиду 3k присутні крос-піки між аксіальними протонами Н1’ і Н3’, Н5’, що є просторово зближуючими.
Будова глікопептидних похідних 8а-i,k-o і 9а-i,k-o підтверджувалася 1Н ЯМР спектроскопією. Ідентифіковані характеристичні сигнали, що відносяться до протонів аглікону, вуглеводного залишку і лактилдипептидного фрагмента (наприклад, рис. 4). Спектр COSY (рис. 5) сполуки 8b дозволив точніше віднести ряд сигналів протонів глікопептидів, зокрема аномерного протона і метинових протонів лактилпептидного залишку.
Синтез ліпофільних -глікозидів мурамоїлдипептиду
З метою вивчення впливу конфігурації аномерного центру, а також структури і природи агліконів глікозидів мурамоїлдипептиду на їх імуностимулюючу дію нами на додаток до в-додецил-, в-(ундецил-6) - і в-циклододецилглікозидів мурамоїлдипептиду 9b,f,l були синтезовані відповідні -аномери 16b,f,l, які містять аліфатичні лінійний первинний і симетричний вторинний, а також циклоаліфатичний аглікони.
Ці аглікони, з одного боку, мають близьку ліпофільність – СlogP для відповідних спиртів 4,95, 4,20 і 4,52, а з іншого, в цьому ряду агліконів зменшується конформаційна рухливість вуглеводневих ланцюгів і ефективна поверхня, що може впливати на взаємодію з біомембранами.
Вихідні перацетильовані -N-ацетилглюкозамініди 10b,f,l синтезували взаємодією відповідних спиртів з -глюкозамінілхлоридом 1 в нітрометані при температурі ~90°С у присутності меркурій(II) іодиду. Структура глікозидів 10b,f,l підтверджується даними 1Н ЯМР спектрів (рис. 6).
Рис. 6. Фрагменти 1Н ЯМР спектрів - і -(ундецил-6)глікозидів 10f (А) і 3f (В).
Для -D-глюкозамінідів дублети аномерного протона зміщені в слабкіше поле ( 4,75-4,87 м.ч.) в порівнянні з відповідними сигналами -D-аномерів 3b,f,l ( 4,68-4,77 м.ч.) і мають КССВ 3,5 Гц, властиву 1,2-цис-глікозидам, на відміну від КССВ 8,5 Гц, характерної для 1,2-транс-глікозидного зв'язку. Крім того, для -ізомерів спостерігається характерний зсув в слабке поле сигналу протона у С2 ( 4,25-4,27 м.ч. в порівнянні з 3,64-3,80 м.ч. у відповідних в-аномерів) і амідного протона ( 5,56-5,59 і 5,45-5,50 м.ч. відповідно).
Далі за розглянутою вище схемою (див. рис. 1) синтезували -глікозиди MDP 16b,f,l. Будова глікопептидів 15b,f,l і 16b,f,l підтверджувалася 1Н ЯМР спектроскопією.
Синтез О- і S-в-п-алкілфенілглікозидів мурамоїлдипептиду
Раніше (Земляков А.Е. и др. // Биоорган. химия. - 2001.- С .439) було встановлено, що в-фенілмурамоїлдипептид має високу імуностимулюючу дію в тестах in vitro та in vivo. У розвитку цих робіт, а також для визначення впливу природи аглікону на імуностимулюючу дію глікозідних похідних мурамоїлдипептиду, нами виконаний синтез в-п-толіл-, в-п-трет-бутилфеніл- і в-п-(1,1,3,3-тетраметилбутил)фенілглікозидів MDP 9p-s - нових алкілфенілглікозидів мурамоїлдипептиду з агліконами різної ліпофільності.
На відміну від широко досліджуваних О-глікозидів мурамоїлдипептиду дотепер було отримано тільки три S-в-алкілтіоглікозиди MDP (Hasegawa A., et al // J. Carbohydr. Chem.-1982-1983.- P.317), ад'ювантна активність яких поступалася MDP. Нами з метою вивчення впливу природи гетероатома біля глікозидного центру на біологічну активність здійснено синтез раніше не описаних в-п-толілтіо- і в-п-трет-бутилфенілтіоглікозидів MDP 23p,r.
У попередньому експерименті оцінювалися найбільш прості і доступні методи отримання перацетильованих О- і S-в-арилглюкозамінідів (табл. 2). п-трет-Бутилфенол і п-тіокрезол глікозилювали еквімолярною кількістю -хлориду 1 в умовах міжфазного каталізу (МФК) четвертинними амонієвими солями в системі «рідина - рідина», а також каталізу краун-етером в системі «рідина - тверде тіло». Для п-тіокрезолу глікозилювання також проводили у присутності надлишку триетиламіну.
Зважаючи на те, що у всіх вивчених методах глікозилювання виходи продуктів 3r і 17p достатньо великі, в препаративних цілях використовували надлишок фенолів, які глікозилювали -хлорідом 1 в більш економічних умовах МФК четвертинними амонієвими солями, а реакцію тіофенолів з -хлоридом 1 проводили при кімнатній температурі у присутності триетиламіну, а також в умовах МФК з BnEt>3>NCl. Після кристалізації з ізопропілового спирту отримали арилглікозиди 3p-s з виходами 61-77%, а арилтіоглікозиди 17p,r - з виходами 78 і 52%, відповідно. Будова сполук 3p-s і 17p,r була доведена 1Н ЯМР спектроскопією (рис. 7).
Таблиця 2
Глікозилювання п-трет-бутилфенолу і п-тіокрезолу хлоридом 1
|
Умови реакції |
Тривалість реакції, г* |
Глікозид; вихід %** |
||
|
Каталізатор |
Основа |
Розчинник |
||
|
BnEt>3>NCl |
NaOH |
Н>2>О / CHCl>3> |
16 |
3r; 34,5±1,4 |
|
Bu>4>NBr |
NaOH |
Н>2>О / CHCl>3> |
1 |
3r; 37,1±2,4 |
|
15-краун-5 |
К>2>СО>3> |
MeCN |
4 |
3r; 42,5±8,0 |
|
BnEt>3>NCl |
NaOH |
Н>2>О / CHCl>3> |
1 |
17p; 65,1±6,8 |
|
15-краун-5 |
К>2>СО>3> |
MeCN |
4 |
17p; 50,9±3,7 |
|
- |
Et>3>N |
MeCN |
5 |
17p; 49,4±6,3 |
* До зникнення за даними ТШХ глікозил-донору 1.
** Середнє значення з трьох експериментів.
Сигнали аномерного протона тіоглікозидів ( 4,78-4,82 м.ч.) зміщені в сильне поле в порівнянні з відповідними сигналами О-в-глікозидів ( 5,20-5,24 м.ч.). КССВ складає 10-10,5 Гц, що характерно для S-1,2-транс-D-глюкозамінідів і суттєво відрізняється від J>1,2> 8 Гц у О-в-арилглікозидів.
Подальший синтез глікопептидів проводився звичайним шляхом відповідно до схеми, представленої на рис. 1. Структура глікопептидів 8p-s, 22p,r і 23p,r підтверджена 1Н ЯМР спектроскопією.
Вивчення антивірусної дії в-алкілглікозидів MDP
Моделі інфекцій людини на лабораторних тваринах, зокрема грипу, широко використовуються для вивчення антиінфекційної дії та імунотоксичних характеристик різних речовин. На кафедрі мікробіології Кримського державного медичного університету ім. С.І. Георгіївського (завідувач проф. Криворутченко Ю.Л.) було досліджено вплив на експериментальну грипозну інфекцію мишей чотирьох похідних MDP 9а-d (рис. 8).
в-Децил-MDP 9а в профілактичній схемі в дозі 2 мкг/мишу сприяв виживанню тварин, надаючи помірний протективний ефект. У дозі 20 мкг/мишу речовина прискорювала загибель тварин, але до кінця експерименту різниця в числі тварин, що вижили, в контрольній і експериментальній групі зникала. Введення речовини за терапевтичною схемою демонструвало помірний протективний ефект.
в-Додецил-MDP 9b при обох формах введення і концентраціях має імунотоксичний ефект. Профілактичне введення в-тетрадецил-MDP 9с приводило до імунотоксичної дії в обох концентраціях, а для в-гексадецил-MDP 9d порівнянна імунотоксична дія спостерігалася в концентрації 2 мкг/мишу. У вищій дозі глікозид 9d практично не впливав на летальність заражених тварин, що, напевно, було пов'язано з його практичною нерозчинністю у вказаній концентрації. Таким чином з цієї групи глікопептидів захисний ефект спостерігався тільки для в-децил-MDP 9а.
Вивчення антибактеріальної протективної дії глікозидів MDP
У Інституті морфології людини РАМН (м. Москва) під керівництвом проф. О.В. Калюжина було вивчено дія ліпофільних мурамоїлдипептидів на імунну систему в тесті стимуляції антибактеріальної резистентності у мишей при внутрішньочеревинному введенні свідомо летальної дози бактерійного збудника. Перший експеримент включав вивчення протективної дії 15 глікозидів MDP (9а-е,k-s, 16b,l) при зараженні мишей Staphylococcus aureus (рис. 9).
Всі досліджені глікозиди мурамоїлдипептиду мають захисну дію на мишей при внутрішньочеревинному введенні препаратів. Так п'ять в-алкілглікозидів MDP 9а-е в досліджуваних дозах знижували летальність практично до нуля у всіх експериментах.
Найбільша захисна дія для мурамоїлдипептидів з агліконами аліциклічної і арилаліфатичної природи спостерігалася для в-циклододецил-MDP 9l. Слід зазначити опозитний вплив доз двох ізомерних арилетилглікозидів MDP на стимуляцію антиінфекційної резистентності - для в-2-п-біфенілетил-MDP 9о активність із зменшенням кількості імуномодулятора зменшувалася, а для в-2,2-дифенілетил-MDP 9n навпаки різко зростала. в-2-(Адамантил-1)етил-MDP 9m показав помірний протективний ефект, а найменшу з цієї групи сполук імуностимулюючу активність проявив в-4-трет-бутилциклогексил-MDP 9k.
Не виявлено достовірної відмінності в імуностимулюючій дії - і -додецил-MDP 16b, 9b та - і -циклододецил-MDP 16l, 9l. Мабуть, вплив ліпофільності аглікону на протективну дію перевершує над впливом конфігурації його глікозидного центру.
Із О-в-п-алкілфенілглікозидів MDP найбільший протективний ефект показали в-п-толіл-MDP 9p і в-п-(1,1,3,3-тетраметилбутил)феніл-MDP 9s. До того ж глікозид 9s був активніше відповідних арилалкільних глікозидів мурамоїлдипептиду - в-2-п-біфенілетил-MDP 9о і в-2,2-дифенілетил-MDP 9n, що також містять 14 атомів Карбону в агліконі. Захисний ефект навіть найменш активного в цій групі сполук - в-4-трет-бутилфеніл-MDP 9r був більший, ніж у відповідного аліциклічного аналога - в-4-трет-бутилциклогексил-MDP 9k.
З огляду на те, що дослідження захисної дії першої групи глікопептидів для значної частини похідних не виявило відмінностей в діапазоні доз 2-200 мкг/мишу, другий експеримент проводили з меншими дозами і двадцятикратним кроком розбавлення (рис. 10). Дані експерименту свідчать про те, що з групи в-діалкілметилглікозидів MDP 9f-i найбільша стимуляція резистентності спостерігалася для в-(нонадецил-10)- і в-(трикозаніл-12)глікозидів MDP 9h,i в дозі 2 мкг/мишу. Для в-(ундецил-6)-MDP 9f навпаки в цій дозі стимулююча активність не виявлялася.
З метою виявлення впливу природи глікозиду спільно з S-глікозидами MDP 23p,r вивчалися відповідні О-арилглікозиди 9p,r. У разі менш ліпофільних О- і S-в-п-толілглікозидів MDP 9p і 23p не виявлено відмінностей в біологічній дії. Тоді як більш ліпофільний в-п-трет-бутилфенілтіо-MDP 23r (СlogP 4,36 у п-трет-бутилтіофенолу у порівнянні з СlogP 3,30 у п-трет-бутилфенолу) був декілька активніше свого О-аналога 9r.
Третій експеримент проводили в умовах сепсису, викликаного грамнегативними бактеріями Escherichia coli. Як і в другій серії експериментів, для того, щоб виявити відмінності в імунотропній активності досліджуваних глікозидів MDP, були використані нижчі дози препаратів в ширшому діапазоні (рис. 11).
Це тестування багато в чому контрастувало з результатами першого експерименту. Наприклад, один з найбільш активних препаратів у разі використання S. aureus в-циклододецил-MDP 9l при ураженні мишей грамнегативною інфекцією в досліджуваному діапазоні доз не мав захисної дії. Не виявлено чіткого впливу ліпофільності агліконів на протективну антиінфекційну дію для більшості сполук з вивченої групи глікозидів мурамоїлдипептиду. Можливо, це пов'язано з тим, що в умовах моделі in vivo тестовані речовини в різних дозах починають діяти в синергізмі/антагонізмі з різними бактерійними продуктами і компонентами, наприклад, ліпополісахаридом.
Суттєве зниження летальності було виявлено тільки для в-тетрадецил-MDP 9с, в-4-трет-бутилфеніл-MDP 9r і в-п-(1,1,3,3-тетраметилбутил)-феніл-MDP 9s (доза 1 мкг/мишу), а також для в-децил-MDP 9а і в-(ундецил-6)-MDP 9f (доза 20 мкг/мишу).
Результати, що отримані для аномерних пар - і в-додецил- (16b, 9b), - і в-(ундецил-6)- (16f, 9f) та - і в-циклододецил- (16l, 9l) MDP, як і у разі дослідження глікозидів MDP при ураженні мишей грампозитивною бактерією, не дозволило виявити чіткого впливу ні конфігурації глікозидного центру, ні введення ліпофільних агліконів на протективну антиінфекційну дію глікозидів MDP.
Нами була зроблена спроба оцінити вплив ліпофільності аглікону глікопептидів на виживаність тварин при ураженні S. aureus у разі найменшої з досліджених доз препарату, для якої найменше вірогідні дозозалежні ефекти (рис. 12, 13).
Для більшості вивчених речовин спостерігається тенденція до зростання протективної дії із збільшенням ліпофільності агліконів. З цього ряду випадають в-децил- (9а) і в-2,2-дифенілетил- (9о) мурамоїлдипептиди, для яких в даній дозі спостерігається максимальний ефект.
Аналогічно оцінювалося і вплив ліпофільності агліконів на виживання тварин при дії глікозидів MDP 9f-i,p,r, 23p,r, які тестувалися другою групою (рис. 13). Чітка кореляція спостерігається тільки для в-діалкілметилглікозидів MDP 9f-i.
На основі результатів тестування протективної активності ліпофільних глікопептидів найбільш перспективними сполуками для проведення розширених біологічних випробувань є в-децил-, в-тетрадецил- і в-п-(1,1,3,3-тетраметилбутил)феніл-MDP.
висновки
В рамках дисертаційної роботи застосування напівемпіричних підходів до дизайну глікозидів мурамоїлдипептиду дозволило отримати нові типи модифікацій: б- і в-діалкілметил-, в-п-алкілфеніл- і в-арилтіоглікозидів MDP, а також розширити ряди похідних MDP по аномерному центру новими ліпофільними глікозидами на основі лінійних аліфатичних і аліциклічних спиртів, 2-(адамантил-1)- і арилетанолів. Дослідження стимуляції глікозидами MDP антиінфекційної резистентності у мишей дозволило виявити вплив структури аглікону глікопептидів на їх біологічну активність.
1. Показано, що з вивчених прямих методів синтезу N-ацетил-D-глюкозамінідів оксазоліновий метод є найбільш ефективним для препаративного отримання в-алкілглікозидів, а глікозилювання перацетатом б-D-глюкопиранозилхлориду в умовах міжфазного каталізу у присутності бензилтриетиламонійхлориду – для в-п-алкіларилтіоглікозидів.
2. На підставі даних спектроскопії 2D 1H ЯМР вперше встановлено, що при глікозилюванні цис-,транс-4-трет-бутилциклогексанолу оксазоліновим методом переважно утворюється транс-4-трет-бутилциклогексил-в-D-глюкозамінід.
3. Вперше показано, що збільшення ліпофільності аглікону глікозидів MDP приводить до отримання похідних MDP, що проявляють більш високі імуностимулюючі властивості. Знайдені лідери у ряду похідних MDP: в-децил-, в-додецил-, в-тетрадецил-, в-гексадецил-, в-октадецил-, в-(трикозаніл-12) -, в-циклододецил-, в-п-толіл- і в-п-(1,1,3,3-тетраметилбутил)феніл-MDP, що індукують високий протективний ефект до внутрішньочеревинного зараження мишей S. aureus, а також в-тетрадецил-, в-4-трет-бутилфеніл- і в-п-(1,1,3,3-тетраметилбутил)феніл-MDP, що стимулюють резистентність мишей до зараження Е. coli.
4. Встановлено, що конфігурація аномерного центра істотно не впливає на протективний ефект ліпофільних глікозидів MDP на відміну від амфіфільних глікозидів MDP, захисна дія яких відрізняється для б- і в-аномерів.
5. В результаті скринінга ряду ліпофільних в-алкілглікозидів мурамоїлдипептиду виявлено, що тільки в-децил-MDP проявляє чітку захисну дію відносно заражених грипом мишей.
Основний зміст роботи викладений в наступних публікаціях:
Земляков А.Е., Цикалова В.Н., Цикалов В.В., Чирва В.Я. Синтез -п-алкилфенилгликозидов N-ацетилмурамоил-L-аланил-D-изоглутамина // Журн. орг. та фарм. хімії. – 2004. – Т. 2, Вип. 3(7). – С. 17–20. (Виконання синтетичного експерименту, аналіз і трактування отриманих результатів).
Земляков А.Е., Цикалова В.Н., Цикалов В.В., Чирва В.Я., Малыгина В.Ю., Кацев А.М., Криворутченко Ю.Л. Синтез и биологическое действие липофильных -алкилгликозидов мурамоилдипептида // Журн. орг. та фарм. хімії. – 2005. – Т. 3, Вип. 3(11). – С. 52–57. (Виконання синтетичного експерименту, аналіз і трактування отриманих результатів).
Земляков А.Е., Цикалова В.Н., Цикалов В.В., Чирва В.Я., Мулик Е.Л., Калюжин О.В. Синтез и протективная активность -гликозидов N-ацетилмурамоил-L-аланил-D-изоглутамина с агликонами алкилалициклической и арилалифатической природы // Биоорган. химия. – 2005. – Т. 31, № 6. – С. 637–644. (Виконання синтетичного експерименту, аналіз і трактування отриманих результатів).
Земляков А.Е., Цикалова В.Н., Цикалов В.В., Чирва В.Я., Мулик Е.Л., Калюжин О.В. Синтез и протективное антиинфекционное действие аномеров липофильных гликозидов N-ацетилмурамоил-L-аланил-D-изоглутамина // Биоорган. химия. – 2006. – Т. 32, № 4. – С. 424–431. (Виконання синтетичного експерименту, аналіз і трактування отриманих результатів).
Земляков А.Е., Цикалова В.Н., Цикалов В.В., Чирва В.Я., Мулик Е.Л., Кузовлев Ф.Н., Калюжин О.В., Киселевский М.В. -Диалкилметилгликозиды N-ацетилмурамоил-L-аланил-D-изоглутамина: синтез, протективное антиинфекционное и цитотоксическое действие // Биоорган. химия. – 2008. – Т. 34, № 1. – С. 114–120. (Виконання синтетичного експерименту, аналіз і трактування отриманих результатів).
Земляков А.Е., Цикалова В.Н., Чирва В.Я. Синтез гликозидов мурамоилдипептида с агликонами различной природы // XX Українська конф. з органiчної хiмiї. Одеса, 20–24 вересня 2004 р. – Одеса, 2004. – Ч. 2. – С. 412. (Виконання синтетичного експерименту, аналіз і інтерпретація отриманих результатів, участь в підготовці доповіді).
Цикалова В.Н., Цикалов В.В., Земляков А.Е., Чирва В.Я. Синтез О- и S--арилгликозидов N-ацетилмурамоил-L-аланил-D-изоглутамина // Int. Symp. “Advanced science in organic chemistry”. Sudak, June 26–30, 2006. – Moscow, 2006. – Р. 186. (Виконання синтетичного експерименту, аналіз і інтерпретація отриманих результатів, участь в підготовці доповіді).
Земляков А.Е., Цикалова В.Н., Чирва В.Я. Синтез и протективная антиинфекционная активность липофильных гликозидов мурамоилдипептида // XXI Українська конф. з органічної хімії. Чернігів, 1–5 жовтня 2007 р. – Київ, 2007. – С. 169. (Виконання синтетичного експерименту, аналіз і інтерпретація отриманих результатів, участь в підготовці доповіді).
Земляков А.Е., Цикалова В.Н., Калюжин О.В., Чирва В.Я. Синтез и тестирование in vitro и in vivo О-в-алкил-, О- и S-в-арилгликозидов N-ацетилмурамоил-L-аланил-D-изоглутамина. // XVIII Менделеевский съезд по общей и прикладной химии. Москва, 23–28 сентября 2007 г. – Москва, 2007. – Т. 4. – С. 536. (Виконання синтетичного експерименту, аналіз і інтерпретація отриманих результатів, участь в підготовці доповіді).
Анотація
Цикалова В.М. Ліпофільні глікозиди мурамоїлдипептиду: синтез і антиінфекційна протективна дія. - Рукопис.
Дисертація на здобуття вченого ступеня кандидата хімічних наук за спеціальністю 02.00.10 - біоорганічна хімія. Фізико-хімічний інститут ім. А.В. Богатського НАН України, Одеса, 2008.
Дисертація присвячена синтезу нових ліпофільних глікозидів N-ацетилмурамоїл-L-аланіл-D-ізоглутаміну (мурамоїлдипептид, MDP) з різноманітною структурою аглікону, зокрема з різним типом і конфігурацією глікозидного зв'язку, а також встановленню впливу структури глікозидів MDP і їх ліпофільності на протективну антиінфекційну активність.
Здійснено синтез нових в-глікозидів MDP з первинними і вторинними симетричними аліфатичними, аліциклічними, алкілфенільними, алкілтіофенільними, 2-(адамантил-1) - і арилетильними агліконами. Отримані нові ліпофільні -глікозіди мурамоїлдипептиду: -додецил-, -(ундецил-6) - і -циклододецил-MDP.
Виявлені глікозиди MDP стимулюючі стійкість мишей до поразки грампозитивнимі (S. aureus) і грамнегативнимі (Е. coli) бактеріями. Встановлено протективний ефект в-децил-MDP відносно заражених грипом мишей.
Ключові слова: глікопептиди, мурамоїлдипептид, О- і S-глікозиди, глікозилювання, антибактеріальна і вірусна резистентність.
Анотация
Цикалова В.Н. Липофильные гликозиды мурамоилдипептида: синтез и антиинфекционное протективное действие.- Рукопись.
Диссертация на соискание ученой степени кандидата химических наук по специальности 02.00.10 – биоорганическая химия. Физико-химический институт им. А.В. Богатского НАН Украины, Одесса, 2008.
Диссертация посвящена синтезу новых липофильных гликозидов N-ацетилмурамоил-L-аланил-D-изоглутамина (мурамоилдипептид, MDP) с различной структурой агликона, в том числе с разной природой соединительного гетероатома, и конфигурацией гликозидной связи, а также установлению влияния структуры гликозидов MDP и их липофильности на протективную антинфекционную активность.
Стартовыми соединениями в синтезе липогликопептидов послужили соответствующие перацетилированные гликозиды N-ацетилглюкозамина (GlcNAc). Дальнейшая схема включала последовательное дезацетилирование соединений по Земплену, и введение 4,6-О-изопропилиденовой защиты и алкилирование свободной С3–ОН группы L-2-бромпропионовой кислотой в диоксане в присутствии гидрида натрия. Полученные защищенные D-мурамовые кислоты конденсировали с бензиловым эфиром дипептида N-гидроксисукцинимидным методом. В гликопептидах ацетальные защиты удаляли нагреванием с 70% уксусной кислотой, а бензиловые эфиры подвергли каталитическому гидрогенолизу или в случае тиогликозидов проводили омыление сложноэфирной защиты.
В первую группу производных мурамоилдипептида вошли -гликозиды MDP с первичными и вторичными симметричными алифатическими, алициклическими, 2-(адамантил-1)- и арилэтильными агликонами. Исходные перацетилированные -гликозиды GlcNAc получили оксазолиновым методом с выходами 62-88% для первичных спиртов, 28-68% для вторичных алифатических спиртов и 45-81% для циклододеканола и замещенных этанолов. Строение этих гликозидов подтверждено данными 1Н ЯМР-спектроскопии.
В случае цис-,транс-4-трет-бутилциклогексанола гликозилирование проводили недостатком оксазолина. Из реакционной смеси колоночной хроматографией были выделены два продукта гликозилирования: более подвижный минорный гликозид 3j и основной компонент – гликозид 3k.
Исходя из большей реакционной способности транс-4-трет-бутилциклогексанола с экваториальным расположением гидроксильной группы для соединения 3k предложена транс-конфигурация циклогексанового цикла, а для его изомера 3j – цис-конфигурация. Предложенная конфигурация заместителей в циклогексановом фрагменте агликонов соединений 3j,k подтверждается данными спектров COSY и NOESY.
Строение гликопептидных производных подтверждалось 1Н ЯМР-спектроскопией. Идентифицированы характеристические сигналы, относящиеся к протонам агликонов, углеводного остатка и лактилдипептидного фрагмента. Спектр COSY бензилового эфира -додецил MDP позволил более точно отнести сигналы аномерного протона и метиновых протонов лактилпептидного фрагмента.
Для выявления влияния конфигурацией гликозидной связи на биологическую активность в дополнение к соответствующим -гликозидам мурамоилдипептида получены их -аномеры: -додецил-, -(ундецил-6)- и -циклододецил-MDP. Исходные перацетилированные -N-ацетилглюкозаминиды были получены с выходами 34-43% взаимодействием соответствующих спиртов с -глюкозаминилхлоридом 1 в нитрометане при температуре ~90 С в присутствии йодида ртути(II). Структура -гликозидов GlcNAc и синтезированных на их основе гликопептидов соответствует их спектрам 1Н ЯМР.
Третью группу липофильных гликозидов MDP составили -алкилфенил- и -алкилфенилтиогликозиды мурамоилдипептида. Перацетилированные -п-толил-, -п-трет-бутилфенил- и -п-(1,1,3,3-тетраметилбутил)фенилгликозиды GlcNAc синтезировали с выходами 61-77% гликозилированием фенолов перацетатом -глюкозаминилхлорида в условиях межфазного катализа в системе «1,25 н. раствор NaOH – CHCl>3>» при катализе BnEt>3>NCl. Аналогично гликозилировали п-тиокрезол. Альтернативно с выходами 78 и 52%, соответственно, -п-толил- и -п-трет-бутилфенилтиогликозиды GlcNAc получили при действии -глюкозаминилхлорида на тиофенолы в присутствии избытка триэтиламина.
Было исследовано влияние на экспериментальную гриппозную инфекцию мышей четырех мурамоилдипептидов с линейными алифатическими агликонами. Из группы -децил-, -додецил-, -тетрадецил- и -гексадецил-MDP протективный эффект выявлен только для -децил-MDP.
Было изучено воздействие липофильных мурамоилдипептидов на иммунную систему в тесте стимуляции антибактериальной резистентности у мышей при внутрибрюшинном введении заведомо летальной дозы бактериального возбудителя. Исследованы две группы гликозидов MDP на стимулирование устойчивость мышей к поражению грамположительными (S. aureus) и одна - грамотрицательными (Е. coli) бактериями.
Установлено, что наиболее высокий протективный эффект к внутрибрюшинному заражению мышей S. aureus индуцируют -алкил-, -(трикозанил-12)-, -циклододецил-, -п-толил- и -п-(1,1,3,3-тетраметилбутил)фенилгликозиды MDP. В эксперименте с Е. coli не выявлено четкого влияния липофильности или структуры агликонов на протективное антиинфекционное действие для большинства соединений из изученной группы гликозидов мурамоилдипептида. Наиболее достоверное снижение летальности, вызванноее грамотрицательными бактериями, было выявлено для -тетрадецил-MDP, -4-трет-бутилфенил-MDP и -п-(1,1,3,3-тетраметилбутил)фенил-MDP (доза 1 мкг/мышь), а также для -децил-MDP и -(ундецил-6)-MDP (доза 20 мкг/мышь).
Не выявлено достоверного различия в иммуностимулирующем действии - и -гликозидов MDP.
Для большинства изученных липогликопептидов наблюдалось увеличение иммуностимулирующего действия при возрастании липофильности агликона.
Ключевые слова: гликопептиды, мурамоилдипептид, О- и S-гликозиды, гликозилирование, антибактериальная и вирусная резистентность.
SUMMARY
Tsikalova V.N. Lipophylic glycosides of muramyldipeptide: synthesis and antiinfection protective action. – Manuscript.
Thesis for Ph.D. degree on speciality 02.00.10 – bioorganic chemistry. A.V. Bogatsky Physico-Chemical Institute of the National Academy of Sciences of Ukraine, Odessa, 2008.
Thesis devotes of synthesis of new N-acetylmuramoyl-L-alanyl-D-isoglutamine (muramyldipeptide, MDP) lipophylic glycosides with various structures of aglycone, different types, and configurations of glycoside bond, and establishments of effects of structure and lipophility of MDP glycosides on their protective antiinfection action. Synthesis of new glycosides with primary and secondary symmetrical aliphatic, alicyclic, alkylphenyl, alkylphenylthio, 2-(adamantyl-1)- and arylethyl aglycons was accomplished. New lipophilic б-glycosides of muramyldipeptide, namely -dodecyl, -(undecyl-6), -cycldodecyl-MDP were derived.
Glycosides of MDP, which stimulation resistance of mouse’s in the presence of gram-positive (S. aureus) and gram-negative (Е. coli) bacterium’s, were revealed. It was founded that -decyl-MDP have protective effect against influenza virus infection in mice.
Key words: glycopeptide, muramyldipeptide, O- and S-glycosides, glycosylation, antibacterial and antivirus resistance.
розрахункове значення коефіцієнту розподілу н-октанол - вода, одержане за допомогою програми Chem Drow Ultra 9.0 trial version