Исследование апоптотической активности лимфоцитов периферической крови in vitro при инфекционном мононуклеозе и мононуклеозоподобном синдроме
СИБИРСКИЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ
КАФЕДРА БИОФИЗИКИ
(зав. кафедрой – д.м.н., профессор. аков)
Допущена к защите
«___»_____________2001г.
Дипломная работа
ИССЛЕДОВАНИЕ АПОПТОТИЧЕСКОЙ АКТИВНОСТИ ЛИМФОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ IN VITRO ПРИ ИНФЕКЦИОННОМ МОНОНУКЛЕОЗЕ И МОНОНУКЛЕОЗОПОДОБНОМ СИНДРОМЕ
Работа выполнена:
кафедра патофизиологии СГМУ зав. - чл.- корр. РАМН, профессор В.В. Новицкий
ЦНИЛ СГМУ лаборатория молекулярной биологии зав.- к.м.н. И.И. Иванчук
Научные руководители:
чл.-корр. РАМН, профессор В.В. Новицкий, к.м.н. О.И.Уразова
Томск-2001
Оглавление
Список сокращений..............................................................……..…3
Введение.............................................................................………….4
Глава 1. Обзор литературы..................................................……......7
Инфекционный мононуклеоз
(краткие сведения)……………………………………………...…….7
Картина крови при инфекционном
мононуклеозе……………………………………………………..….11
Апоптоз………………………………………………………..…16
1.3.1. Апоптоз как форма гибели
клетки……………………………………………………………...16
1.3.2. Морфологические и биохимические проявления
апоптоза………………………………………………………..…18
Распознавание апоптотирующей клетки
макрофагом……………………………………………….……....20
Гены, участвующие в апоптозе………………………..….21
Необходимость изучения апоптоза…………………….....22
Заключение……………………………………………….……24
Глава 2. Материалы и методы……………………………………...25
Глава 3. Результаты…………………………………….…………...30
Глава 4. Обсуждения полученных результатов………...………....42
Выводы…………………………….………...………………………53
Список литературы……………………………………..…………...55
Список сокращений
АМ - “атипичные мононуклеары”
ВИЧ - вирус иммунодефицита человека
ДНК- дезоксирибонуклеиновая кислота
фДНК- фрагментированная дезоксирибонуклеиновая кислота
EBV– вирус Эпштейна-Барр
ИМ - инфекционный мононуклеоз
КОЕ-ГМ – колониеобразующая единица грануломоноцитопоэза
ОИЗ с МПС - острые инфекционные заболевания с мононуклеозоподобным синдромом
РНК- рибонуклеиновая кислота
мРНК- матричная рибонуклеиновая кислота
СПИД - синдром приобретенного иммунодефицита
ЭТС - эмбриональная телячья сыворотка
Введение
Актуальность проблемы: В патогенезе вирусных инфекций чрезвычайно важную роль играет гибель клеток, реализующаяся в форме некроза или апоптоза. Некроз является результатом травматического повреждения клетки, приводящего к нарушению целостности клеточных мембран. Апоптоз, запрограммированная или “физиологическая” форма клеточной гибели, реализуется посредством заложенных в генотипе клетки механизмов самоуничтожения и морфологически характеризуется уменьшением размеров клетки, уплотнением и фрагментацией хроматина [Погорелов В.М., Козинец Г.И., 1995; Ярилин А.А., 1996; Маянский А.Н. и соавт., 1997; Утешев Д.Б. и соавт., 1998].
Инфекционный мононуклеоз (ИМ) – лимфопролиферативное заболевание, возбудителем которого является вирус Эпштейна-Барр (EBV), относящийся к семейству герпесвирусов [Дранкин Д.И., Заяц Н.А., 1982]. Уникальность EBV заключается в его способности не разрушать, а стимулировать пролиферацию зараженных им лимфоцитов путем изменения соотношения между ростовыми и апоптозными потенциями клеток [Дранкин Д.И., Заяц Н.А.,1982].
Известно более десятка вирусных генов, которые кодируют факторы, усиливающие апоптозный процесс. Имеются они и у герпесвирусов. Некоторые вирусы способны блокировать апоптозный ответ на собственную инфекцию. Это достигается с помощью двух механизмов – повышения экспресии антиапоптозных (рост-стимулирующих) генов клетки и инактивации эффекторных молекул апоптоза. К первому механизму можно отнести стимуляцию протоонкогена типа Вcl-2, которая наблюдается, в частности, при персистенции EBV в В-лимфоцитах [Uehara T. e.a., 1992; Akbar A.N. e.a., 1993].
Однако необходимо отметить, что несмотря на проведение достаточно большого количества исследований, посвященных изучению процессов клеточной гибели, сведения, касающиеся особенностей апоптоза клеток крови при действии EBV, в доступной литературе крайне немногочисленны и фрагментарны, что и послужило причиной настоящего исследования.
Цель исследования: Установить особенности апоптотической активности лимфоцитов периферической крови при инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом.
Задачи исследования:
Охарактеризовать количественные показатели периферической крови у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Провести оценку жизнеспособности лимфоцитов периферической крови у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Оценить содержание фрагментированной ДНК в лимфоцитах периферической крови у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Оценить содержание лимфоцитов периферической крови с морфологическими признаками апоптоза у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Установить особенности и оценить степень изменений апоптотической активности лимфоцитов при инфекционном мононуклеозе и мононуклеозоподобном синдроме в зависимости от сроков исследования.
Глава 1. Обзор литературы.
1.1. Инфекционный мононуклеоз.
Инфекционный мононуклеоз (ИМ) представляет собой острое, обычно доброкачественное лимфопролиферативное заболевание, чаще всего встречающееся в детском юношеском возрасте (реже у взрослых), сопровождающееся иногда серьезными осложнениями, а в редких случаях даже приводящее к летальному исходу [Живица Л.В. и соавт.,1987; Дунаевский О.А., Постовит В.А.,1982]. Заболевание вызывается EBV, что впервые было показано Henle и соавторами [Купчинский Р.А.,1994].
Вирус EBV представляет собой В-лимфотропный вирус человека, относится к семейству Herpesviridae, подсемейства Gammaherpesviridae, рода Lymphocryptovirus [Львов Н.Д., Мельниченко А.В.,1999]. Для него характерна сферическая форма и наличие 4 структурных компонентов: сердцевина, капсида, внутренние оболочки, внешние оболочки. Сердцевина содержит линейную двунитчатую вирусную ДНК, которая состоит из 80 генов. Размер вириона у основного возбудителя ИМ колеблется от 100 до 150 нм [Бисярина В.П. и соавт.,1980; Shuster W. e.a.,1993]. В составе вирионов обнаружено более 30 гликопротеидов, которые находятся на поверхности и вызывают образование вируснейтрализующих антител [Albeck H. e.a.,1985]. Вирус чувствителен к воздействию эфира, весьма специфичен в отношении роста: размножается в культурах лимфобластов опухоли Беркитта, крови больных ИМ, лейкемических клетках и в культуре клеток мозга здорового человека. [Дранкин Д.И., 1982;]. Устойчивость EBV во внешней среде низкая. Он быстро погибает при высыхании, высокой температуре, обработке всеми дезинфицирующими средствами [Imai S.,1990].
EBV отличается от других вирусов семейства герпеса способностью вызывать не цитолиз, а размножение пораженных клеток – В-лимфоцитов. Вирус способен к длительной персистенции в них [Khanna R. e.a.,1995].
Проникновение EBV в клетку хозяина является сложным многоступенчатым процессом и включает в себя прикрепление вирионов к клеточным рецепторам, эндоцитоз и слияние мембран вирионов и клетки. В результате этого капсид освобождается от белков внешней оболочки, а комплекс ДНК-белок вируса проникает в ядро [Wutzler P.,1993]. Вирионная ДНК выходит в нуклеоплазму и транскрибируется клеточной РНК-полимеразой, затем проходит процессинг мРНК, синтез кодируемых продуктов и частичный обратный транспорт их в ядро, репликация ДНК и формирование дочерних молекул [Wilson A.D. e.a.,1998]. Образовавшиеся в ядрах клеток незрелые капсиды попадают в цитоплазму, где заканчивается формирование зрелых капсидов и внешней оболочки вируса с последующим транспортом к поверхности и выходом их из клетки [Nikolas J.C. e.a.,1998; Straus S.E. e.a.,1993].
При проникновении в организм человека первоначально EBV поражает эпителиальные клетки носо- и ротоглотки, а затем инфицирует В-лимфоциты, участвующие в диссеминации возбудителя по организму [Дранкин Д.И., Заяц Н.А., 1982].
Эпителиальные клетки могут быть инфицированы EBV через EBV-специфичный С2- рецептор. При этом процессы деления, дифференцировки и созревания клеток эпителиального слоя протекают параллельно с процессом активного вирусного воспроизводства [Taga H. e.a.,1995; Wakasugi N. e.a.,1990]. Таким образом, как считают авторы, "эпителиальная EBV-инфекция" - играет решающую роль в воспроизводстве и пожизненной персистенции вируса в организме человека [Foss H.D.1995; Ritter S., Schroder S.,1996].
По современным данным, EBV является возбудителем ИМ в 90% случаев заболевания. К гипердиагностике ИМ у детей могут привести острые инфекционные заболевания с мононуклеозоподобным синдромом (ОИЗ с МПС). Так МПС может наблюдаться при цитомегалии, иерсинеозе, токсоплазмозе и различных формах ангин (фоликулярная, лакунарная, некротическая).
Считается, что во всех случаях EBV играет свою роль совместно с другими факторами, вызывающими иммуносупрессию. В этой связи, заслуживают внимание работы, касающиеся связи EBV и ВИЧ. EBV выявляется в ротовой полости у ВИЧ-инфицированных больных [Жданов В.М.,1984; Anderson J. e.a.,1986]. Механизм взаимодействия EBV с ВИЧ не установлен, хотя известно, что оба вируса поражают одни и те же рецепторы лимфоидных клеток. Высказывается предположение о том, что EBV может блокировать проникновение ВИЧ в клетку [Зуев В.А.,1988]. С другой стороны, имеются сообщения о том, что продукты деятельности EBV активируют экспрессию вируса СПИД [Йегер Л.,1990].
Определяющими проявлениями заболевания являются: клиническая картина (высокая температура, ангина, увеличение лимфоузлов, печени, селезенки), характерные гематологические изменения (увеличение общего количества мононуклеарных клеток и атипичных лимфоцитов) и положительная реакция на гетерофильные антитела [Bevinck J.N.B. e.a.,1993; Cozad J.,1996; Moss D.J. e.a.,1992]. Следует, однако, отметить, что ни один из указанных признаков не является специфичным для ИМ [Титов и соавт.,1999; Kube D. e.a.,1995]. Диагноз заболевания ставится по совокупности клиники и лабораторных данных. [Гаспарян М. О. 1972; Жибурт и соавт.,1996; Titov L.P. e.a.,1995,1996].
Инкубационный период длится от 2 до 30 дней, чаще 4-7 дней. Заболевание обычно начинается остро, с озноба и повышения температуры до 38-39 С. У некоторых больных в течение 2-3 дней отмечаются продромальные явления в виде слабости, недомогания, потери аппетита [Di Giuseppe J.A. e.a.,1995; Matter L. e.a.,1987]. Заболевание может давать рецидивы. Больные обычно бледны, конъюнктивы умеренно гиперемированы [Мусабаева И.К.,1982; Леенман Е.Е. и соавт.,1999; Verdium C.M. e.a.,1995]. На 2-3 день болезни иногда возникает скарлатиноподобная, узелковая или папулезная сыпь, а у детей при тяжелом течении заболевания геморрагическая сыпь. Исчезновение сыпи может сопровождаться отрубевидным шелушением [Уразова Л.Н. и соавт.,1989; Schuster V. e.a.,1992]. Постоянным симптомом первых дней болезни является увеличение передне- и заднешейных лимфоузлов, одновременно увеличиваются и другие группы лимфоузлов: подмышечные, паховые. Лимфоузлы плотноватые, болезненные, никогда не спаиваются с окружающей клетчаткой и кожей, не наблюдается их нагноения [Серебряная и соавт.,1998; Hinderer W. e.a.,1990]. Может наблюдаться изолированное увеличение внутригрудных лимфоузлов, что вызывает серьезные дифференциально-диагностические затруднения. Реакция лимфоузлов брюшной полости может проявляться болями в животе, особенно в правой подвздошной области (симптом Корсакова) [Wising P.J.,1939,1942]. Процесс обратного развития в лимфоузлах начинается с нормализации температуры, но обычных размеров они достигают в течение 1-2 недель периода реконвалесценции, а иногда и через несколько месяцев [Чирешкина Н.М.,1973; Naher H. Petzoldt D.,1992].
Заболевание обычно сопровождается ангиной, которая по своему характеру бывает лакунарной, катаральной, фолликулярной и язвенно-дифтеритической. В первые дни болезни ангина, как правило, односторонняя и носит характер катаральной, а с 3-4 дня отмечается ангина, которая рассматривается как результат аллергизации организма [Murtagh J.,1990; Toren A.,1996; Wolf Y. e.a.,1993]. Если в этот период присоединяется вторичная инфекция, у больного повышается температура и ухудшится самочувствие. Изменения в зеве исчезают через 1-2 недели после начала заболевания [Grasi G. e.a.,1993]. Иногда ангина отсутствует, часто она сопровождается резкой гиперемией слизистой оболочки зева и носоглотки (“пылающий зев”) [Mayer I. e.a.,1992; Wurtzler P.,1993].
К важным симптомам относятся увеличение печени и селезенки. Печень плотная, в ряде случаев нарушается ее функция, появляется желтуха. Селезенка плотная, чувствительна при пальпации, иногда достигает больших размеров, приводящих к ее разрыву [Kanegane H. e.a.,1995,1997]. Поражение других органов и систем наблюдается редко. Имеются единичные указания на развитие пневмоний в начале заболевания, но диагностировать их можно только рентгенологически. У больных отмечается приглушение тонов сердца, в ряде случаев на ЭКГ регистрируется диффузное поражение миокарда [Блюмкин В.Н., Жданов В.М.,1973].
Язык обычно обложен белым налетом, влажный, иногда бывает тошнота, рвота. Большинство больных жалуются на вялость, головную боль, бессонницу [Мордовец В. И, Рудакова Р. И., Гуськова Т. Б.1986; Gosselin J. e.a.,1991].
У больных ОИЗ с МПС наблюдается подобная картина заболевания: лихорадка, аденопатия, нарушение носового дыхания, ангина, увеличение размеров печени и селезенки. Ангина с наложениями на миндалинах, как правило, сопровождалась реакцией регионарных лимфоузлов, степень увеличения которых соответствовала поражению зева.
1.2. Картина крови при ИМ
Картина крови при ИМ является самым достоверным диагностическим критерием [Anagnostopoulos I. e.a.,1995]. Общепринятым является мнение о том, что для ИМ характерна триада симптомов со стороны белой крови: умеренный лейкоцитоз, резкий мононуклеоз и качественное изменение мононуклеаров - появление атипичных клеток (АМ) [Gratama J.W. e.a.,1994].
Анемия не характерна для болезни Филатова, но в разгар заболевания гемоглобин обычно падает на 10-15 единиц [Гаспарян М.О., Шиленкова В.И.,1972; De Paoli P. e.a.,1990]. Общее количество лейкоцитов либо оставалось нормальным на протяжении всего заболевания, либо умеренно повышалось. Чаще всего лейкоцитоз отмечался на 1 день болезни. Иногда у детей раннего возраста незначительно повышалось количество эозинофилов. Эозинофилия наиболее отчетливо выявляется на 2, 3 и 4 неделе болезни [Joseph G. e.a.,1994].
Отмечается небольшое увеличение количества палочкоядерных нейтрофилов. Палочкоядерный сдвиг наблюдается у детей всех возрастных групп, однако если у детей раннего возраста он отмечался в 60% случаев, то у детей более старшего возраста (после трех лет) в 83% [Балашева Т.Б. и соавт.,1996]. Количество сегментоядерных нейтрофилов у большинства больных оставалось в пределах нормы, реже количество этих клеток снижалось. Нейтропения наблюдалась главным образом у детей старшего возраста. У детей раннего возраста в период реконвалесценции (4-5 неделя болезни) нередко выявлялся нейтрофилез [Imreh M.P. e.a.,1995]. Количество нормальных лимфоцитов при ИМ у большинства детей уменьшалось. Наиболее часто уменьшение количества лимфоцитов отмечалось на 1 и 2 неделе болезни. Увеличение количества нормальных лимфоидных клеток наблюдалось значительно реже, чем лимфопении и нормальное их содержание [Гаспарян М.О., Шиленкова В.И.,1972]. Количество моноцитов у большинства детей, на протяжении всего заболевания, оставалось в пределах нормы. В 20-40% случаев наблюдается уменьшение количества моноцитов. Моноцитоз отмечался только в 15-30% случаев, наиболее отчетливо был выражен на 1 неделе болезни и чаще наблюдался у детей старшего возраста. Моноцитоз является одним из симптомов раздражения ретикуло-эндотелиальной системы [Котельников В.М. и соавт.,1982]. АМ обнаруживаются у всех обследованных. Чаще всего они выявляются на 1 неделе заболевания- 76-85% случаев, на 2 неделе- в 62-79%, на 3- в55-74% и на 4- в 20-50% случаев [Жибурт Е.Б. и соавт.,1996]. Более длительно АМ сохранялись в периферической крови у детей в возрасте от 1 до 3 лет [Beaulieur A.D. e.a.,1996].
Для детей с ОИЗ с МПС выявлена схожая гематологическая картина заболевани. Повышение АМ носило более сглаженный характер. В результате сравнительного изучения белой крови при ОИЗ с МПС и ИМ у детей в момент максимальной выраженности симптомов выявили ряд отличий [Мазурина Н.А. и соавт., 1996]. Так, при ОИЗ с МПС общее количество лейкоцитов было меньше, чем при ИМ, число сегментоядерных нейтрофилов почти в 2 раза больше, а содержание АМ в 2 раза меньше, чем при ИМ. При ОИЗ с МПС чаще всего наблюдается увеличение общего количества нейтрофилов и снижение содержания мононуклеаров. В то же время при ИМ всегда отмечается общий мононуклеоз и уменьшение общего количества нейтрофилов [Баринский И.Ф. и соавт., 1994]. Таким образом, несмотря на наличие АМ, при ОИЗ с МПС гематологические сдвиги отличаются от таковых при ИМ и могут быть использованы при дифференциации этих заболеваний [Выдумкина С.П. и соавт., 1999].
Электронно-микроскопическое исследование показало, что в периферической крови больных ИМ преобладают элементы лимфоцитарного и моноцитарного рядов. Специальное изучение морфологии АМ с помощью светового микроскопа показало, что ядро их чаще всего имеет неправильную форму, расположено эксцентрично. Структура ядра в одних клетках грубая, с просветлениями между глыбками хроматина, а в других ядерное вещество распределено равномерно, нередко с 1-2 нуклеолами [Lewin N. e.a.,1990]. Цитоплазма, как правило, обильная, в части клеток с неровными контурами, разнообразная по степени базофильности- от едва выраженной (“обесцвеченная цитоплазма”) до интенсивной, с перинуклеарной зоной или без нее. Иногда встречались клетки с выраженной “пенистостью” цитоплазмы [Nakata M. e.a.,1992]. Исследование поверхностной архитектоники моноцитов у больных ИМ проводилось в период развернутой клинико-гематологической картины заболевания (4-15 сутки) [Anagnostopoulos I. e.a.,1995]. Исследование рельефа поверхности моноцитов у детей с ИМ выявило снижение содержания клеток с пузыреподобными структурами и переходным типом клеточной поверхности. Обращает на себя внимание значительное уменьшение в крови больных числа моноцитов с ворсинками и относительно гладкой поверхностью [Ютенко А.К. и соавт.,1994; Ribera E. Ocana I.,1989]. Количество же моноцитов с совершенно гладкой поверхностью мембраны, напротив, превышало нормальные значения. Кроме того, в крови детей с ИМ в большом количестве обнаруживаются моноциты с гребнеподобными структурами [Уразова О. И., Новицкий В. В., Помогаева А. П., Жукова О. Б., 2000]. Отличительной особенностью клеточного состава периферической крови у больных ИМ явилось присутствие клеток с неглубокими точечными впадинами на поверхностной мембране, которые не обнаруживались в крови здоровых детей [Турковская Н. Н.,1977]. Следует отметить также, что распределение моноцитов по типу их поверхностной мембраны у детей с легкой и средней степенью тяжести заболевания носило аналогичный характер. Таким образом, заболевание ИМ сопровождается выраженными перестройками структурной организации мембран моноцитов и появлением в крови инфицированных детей атипичных клеток, не встречающихся в норме [Новицкий В. В.,Уразова О. И., Антоненко Н. М., Жукова О. Б., 1999].
Методом сканирующей электронной микроскопии исследовали поверхностную архитектонику лимфоцитов у больных ИМ. Исследование проводилось в период развернутой клиникогенной картины заболевания (4-15 день) [Masucci M.C. e.a.,1987]. В крови детей, больных ИМ, среди лимфоцитов со сглаженной формой поверхностной мембраны преобладала популяция клеток с относительно гладкой поверхностью, а среди клеток с выраженным рельефом поверхности доминировали лимфоциты с ворсинками, что соответствовало показателям здоровых детей. Незначительно увеличивалось число гладких клеток и лимфоцитов с раффлами на поверхности мембраны [Beaulieur A.D. e.a.,1996]. Однако, содержание лимфоидных клеток со складчатой поверхностью существенно превышало их количество в контроле. Число же лимфоцитов с углублениями на поверхности мембраны у больных детей снижалось. Значительно реже обнаруживались клетки с пузыреподобными образованиями, переходным и комбинированным типом поверхностной мембраны [Жибурт Е.Б. и соавт.,1996; Joseph G. e.a.,1994]. У детей со средней степенью тяжести заболевания содержание клеток со складками значительно превышало значения аналогичного показателя у детей с легким течением инфекции. Особый интерес представляет факт увеличения в крови больных ИМ, особенно у детей со средней степенью тяжести заболевания, числа лимфоцитов со складчатой поверхностью [Lewin N. e.a.,1990]. По-видимому, наряду с нормальными лимфоцитами в эту группу клеток были отнесены “атипичные мононуклеары”, имеющие аналогичную структуру поверхностной мембраны.
Особый интерес представляет выявление в крови клеток, отличающихся по своей морфологической структуре присутствием на поверхности ворсинок, неправильной формой ядра с компактно расположенным хроматином, гипертрофией ядрышек, многочисленными рибосомами, повышенным количеством лизосом и митохондрий, вакуолизированной цитоплазмой. В ядрах ряда таких измененных клеток были обнаружены вакуоли правильной округлой формы, что позволяет предположить наличие вируса в данных клетках [Ютенко А.К. и соавт.,1994; Ribera E. Ocana I.,1989]. По всей видимости, данные клеточные элементы представляют собой так называемые “атипичные мононуклеары”, являющиеся трансформированными вирусом лимфоцитами, имеющими аналогичную структуру клетки [Gibbons D.L. e.a.,1994]. В крови больных ИМ превалировали макрофагоподобные моноциты, отличавшиеся от аналогичных клеток здоровых детей повышенным количеством вторичных лизосом, содержащих деструктивный материал, увеличением числа и величины митохондрий, повышенным содержанием и увеличением диаметра вакуолей комплекса Гольджи [Уразова О. И., Новицкий В. В., Помогаева А. П., Жукова О. Б., 2000].
Учитывая тот факт, что ИМ представляет собой реактивное заболевание, охватывающее всю ретикулогистиоцитарную систему, тщательному анализу была подвергнута система иммуноглобулинов [Gogusev J. e.a.,1988]. Показано, что гетерофильные антитела относятся к Ig M. синтез которых значительно повышен у больных ИМ; синтез IgG повышен незначительно, а IgA не изменены [Bnuin de P.S. e.a.,1995; Garrido F. e.a.,1995].
1.3.Апоптоз
1.3.1.Апоптоз как форма гибели клеток
Апоптоз впервые был описан J.F.R.Kerr и сотрудниками в 1972 году [Барышников А.Ю., Шишкин Ю.В.,1996]. В 1987 A.H.Wyllie сформулировал четыре основных элемента апоптоза:
Уменьшение объема апоптотирующей клетки;
Конденсация и фрагментация хроматина на ранних стадиях апоптоза с формированием апоптотических телец;
Изменение мембраны апоптотирующей клетки, приводящее к распознаванию ее фагоцитами;
Сопряженность апоптоза с активным белковым синтезом [Уманский С.Р., 1996; Ярилин А.А., 1996]
В расширенном смысле апоптоз является гибелью клетки, которая включает в себя генетическую или геноопосредованную программу, не зависящую от природы пускового сигнала. Другими словами апоптозу присуща экспрессия генов de novo, а пусковые сигналы сами по себе не являются гибельными для клетки.
Апоптоз - активный процесс реализации программы гибели клетки: он может быть вызван действием поступающих извне сигналов, которые сами по себе не являются токсическими или деструктивными. Этот тип гибели иногда обозначают как самоубийство клетки. Апоптоз является обязательным компонентом жизни многоклеточных организмов (их развития, нормального функционирования, осуществления регуляторных процессов), одновременно внося вклад в реакцию клеток на внешние воздействия (например, ионизирующие излучения) и проявления иммунной защиты [Jiang C. e.a.,1993]. В соответствии с современными представлениями апоптоз - явление неоднородное. В зависимости от индукторных факторов различают несколько его вариантов, которые можно дифференцировать по биохимическим проявлениям. Как правило, все эти разновидности имеют идентичные заключительные этапы развития и одинаковые морфологические проявления. В иммунной системе чаще других реализуются три формы апоптоза: гибель клеток вследствие дефицита ростовых факторов, апоптоз, вызванный глюкокортикоидами и другими агентами со сходным действием и “активационный апоптоз”, развивающийся вследствие дисбаланса активационных сигналов или по другим причинам, обуславливающим включение программы гибели клетки при их активации [Барышников А.Ю., Шишкин Ю.В.,1996; Marmur J.,1961].
1.3.2. Морфологические и биохимические проявления апоптоза
Прежде всего это морфологические признаки апоптоза, состоящие в уменьшении размеров, сморщивании клетки, уплотнении и фрагментации хроматина. В ядре формируются осмиофильные скопления хроматина, обычно прилежащие к ядерной оболочке. Эти изменения служат самым ранним проявлением апоптоза, предшествующим процессам деградации [Демин А.А. и соавт.,1983]. На этой стадии прогрессирования апоптоза может быть приостановлено действие ингибиторов, всвязи с чем данная стадия развития клеточной гибели обозначается как преапоптоз. Затем в ядерной мембране образуются инвагинации, и хроматиновые фрагменты отшнуровываются от ядра. Такие фрагменты, окруженные мембраной, называют апоптотическими тельцами. В цитоплазме происходит конденсация и сморщивание гранул без их разрушения, расширение эндоплазматического ретикулума. Для апоптоза характерна потеря клеточной мембраной микроворсинок и нормальной складчатости, отделение клетки от субстрата, формирование на ее поверхности пузырей [Барышников А.Ю. и соавт.,1994].
В отличие от некроза, когда одновременно гибнут массы соседствующих клеток, апоптоз развивается изолированно в единичных клетках. Если в случае некроза из клеток в среду поступает внутриклеточное содержимое, в частности лизосомы, что нередко приводит к развитию или прогрессированию воспаления, то при апоптозе подобные проявления отсутствуют [Мушецяну К и соавт.,1965]. Клетки, подвергшиеся апоптозу (а иногда и находящиеся в процессе апоптоза), и апоптотические тельца быстро фагоцитируются, причем не только макрофагами, но и “непрофессиональными” фагоцитами (например, мезангиальными клетками почек) [Bnuin de P.S. e.a.,1995; Garrido F. e.a.,1995].
Одно из основных проявлений апоптоза на биохимическом уровне реализуется в ядре клетки и состоит в фрагментации ДНК. Сначала происходит образование крупных фрагментов ДНК, содержащих 700, 200-250, 50-70 тысяч пар оснований (т.п.о.), позже 30-50 т.п.о. Уже на этой стадии регистрируется конденсация хроматина и выпячивание ядерной мембраны, характерные для апоптоза. Полагают, что именно эти начальный этап фрагментации хроматина является ключевым событием апоптоза, после осуществления которого процесс становится необратимым [Погорелов В.М., Козинец Г.И.,1995].
Следующий этап фрагментации ДНК - ее межнуклеосомная деградация, т.е. расщепление в результате формирования разрывов (в основном двунитевых) между нуклеосомами с формированием фрагментов, содержащих 180-190 п.о. Именно эти фрагменты выявляются в виде “лесенки” при электрофорезе ДНК апоптотических клеток, который широко используется для идентификации апоптоза [Казанова Л.И.,1979; Marmur J.,1961].
Деградация хроматина при апоптозе является активным процессом, она зависит от температуры, требует синтеза РНК и белка de novo. Осуществление различных этапов деградации ДНК связывают с проявлением активности разных ферментов. Считают, что межнуклеосомная деградация при апоптозе обусловлена активацией резидентной ядерной Са2Мg2зависимой эндонуклеазы [Исаева М.П. и соавт.,1998]. Выделена эндонуклеаза с молекулярной массой 18 кД. Мало сведений о ферментах, обеспечивающих появление крупных разрывов ДНК. По одним сведениям, они не зависят от Са2+ (хотя и зависят от Мg2+), по другим данным, формирование крупных фрагментов ДНК так же зависит от Са2+. Феномен апоптоза неоднороден и при действии различных его индукторов, события, по крайней мере до определенного этапа, могут развиваться по разнообразным сценариям, и лишь достигнув определенной точки конвергенции, различные пути сходятся, а механизмы реализации гибели оказываются идентичными. К ключевым дистальным механизмам реализации апоптоза относят активацию цистеиновых и сериновых протеиназ. Ингибиторы сериновых протеиназ подавляют апоптоз, индуцированный глюкокортикоидами [Bnuin de P.S. e.a.,1995; Garrido F. e.a.,1995].
Наблюдаемые при апоптозе уплотнение и деформация наружной и внутриклеточной мембран, формирование устойчивого к действию детергенов покрова, сморщивание цитоплазматических гранул связывают с перекрестным сшиванием белков, обусловленным активацией Са2-зависимой трансглутаминазы типа II, что служит обязательным и характерным биохимическим признаком апоптоза. Непосредственной причиной гибели клеток при апоптозе, вероятно, служит истощение пула АТФ, являющееся следствием активации поли (ADP- рибоза)полимеразы в ответ на повреждение ДНК [Барышников А.Ю., Шишкин Ю.В.,1996; Marmur J.,1961].
1.3.3. Распознавание апоптотирующей клетки макрофагами
К настоящему времени расшифровано три механизма, с помощью которых макрофаги распознают клетки, подвергающиеся апоптозу, и удаляют их.
Распознавание, а следовательно и адгезия макрофагов к клеткам, вступившим на путь апоптоза, почти полностью блокируется при добавлении в среду N-ацетилгалактозамина и галактозы. Из этого следует, что ранним мембранным проявлением апоптоза является специфическая перестройка углеводных компонентов мембраны с потерей сиаловых кислот, наружной экспрессией сахаров и снижением общего отрицательного потенциала наружной поверхности мембраны. Потеря терминальных сиаловых кислот с боковых цепей мембранных гликопротеидов влечет за собой то, что экранированные в обычных условиях ацетилглюкозамин, N-ацетилгалактозамин и галактоза приобретают возможность взаимодействовать с лектинами макрофагов [Taga H. e. a. , 1994]
Другой тип распознавания апоптотирующих клеток осуществляется с помощью макрофагального 43 интегринового рецептора. Тромбоспондин, синтезируемый и выбрасываемый в микроокружение макрофагами, выполняет роль молекулярной скрепки между апоптотирующей клеткой и макрофагом. Существенную роль в этом процессе играет мембранный мономер 88кД, больше известный как CD36. Третий механизм распознавания клеток, вступивших на путь апоптоза, состоит в том, что на самых ранних этапах программированной гибели клеток, еще до формирования апоптотических телец, происходит инверсия мембранных фосфолипидов. В обычных условиях наружный лепесток мембранного бислоя содержит, в основном, нейтральные фосфолипиды, сфингомиелин и фосфатидилхолин, в то время как отрицательно заряженные фосфолипиды структурированы на внутреннем лепестке мембранного бислоя. У апоптотирующих клеток эта мембранная асимметрия нарушается, и они экспрессируют наружу фосфатидсерин, который распознается специфическим макрофагальным рецептором [Taga H. e. a., 1994; T. Uehara e. a., 1992].
Следует отметить, что тип распознавания апоптотирующих клеток макрофагами может сильно зависеть от типа клеток и от стадии процесса программированной гибели [Исаева М.П. и соавт.,1998].
1.3.4. Гены, участвующие в апоптозе
Некоторые гены важны для программирования клеток к гибели, другие необходимы для окончательного удаления мертвых клеток и, наконец, четыре гена непосредственно участвуют в процессе апоптоза [Akbar A. N. e. a., 1993].
Продукт гена nuc-1 является эндонуклеазой, расщепляющей ДНК в мертвых клетках. Клетки с мутацией в nuc-1 погибают без деградации ядерной ДНК. Неизвестно существует ли сходство между продуктом nuc-1 и Са2Мg2зависимой нуклеазой [Барышников А.Ю., Шишкин Ю.В.,1996; Marmur J.,1961].
Два гена- ced-3 и ced-4- необходимы для клеточной гибели. При мутациях в этих генах клетки, обычно запрограммированные на гибель, выживают. Показано, что ced-3 является протеазой, а ced-4 содержит Са2Мg2связывающий домен. ced-9 кодирует белок, предотвращающий гибель клеток, индуцированную ced-3 и ced-4 [Akbar A. N. e. a., 1993,].
1.3.5. Необходимость изучения апоптоза
Отметим ряд наиболее важных для фармакологии направлений для изучения апоптоза.
Во-первых, поиск и разработка препаратов, угнетающих апоптоз. Клиническую перспективность могут иметь препараты, блокирующие апоптоз, индуцированный некоторыми вирусами и суперантигенами. Очевидно, что такие антиапоптотические препараты будут представлять собой первый класс иммуностимуляторов. Теоретически, ингибиторы апоптоза пригодны для лечения ряда нейродегенеративных заболеваний, таких как рассеянный склероз, инсульт, травмы мозга, инфаркт миокарда [Marmur J.,1961]. Индукторы апоптоза необходимы прежде всего для лечения злокачественных новообразований, аутоиммунных расстройств [Исаева М.П. и соавт.,1998]. Особый интерес представляют исследования, касающиеся изучения процессов запрограммированной клеточной гибели при ИМ. Исследование морфологии и анализ ДНК Т-лимфоцитов позволили установить, что вирусный интерлейкин-10 (продукт репликации EBV) ингибирует потерю клетками объема, уплотнение хроматина и фрагментацию ДНК, характеризующие апоптоз [Taga H. e. a., 1994; T. Uehara e. a., 1992], напротив, при остром ИМ было зарегистрировано повышение Т-клеток с признаками апоптоза. Известно, что некоторые цитокины типа интерлейкинов 2, 5, 6 могут препятствовать апоптозу Т-лимфоцитов [Исаева М.П. и соавт.,1998]. Исходя из этого, авторы предположили, что апоптотическая гибель большинства Т-лимфоцитов была связана с их миграцией из участков, активно продуцирующих данные факторы, в результате антигенного воздействия, то есть апоптоз Т-клеток представляется авторами как механизм антигенуправляемой селекции лимфоцитов [Барышников А.Ю., Шишкин Ю.В.,1996; Marmur J.,1961]. Увеличение числа апоптотических Т-лимфоцитов (APS) при ИМ также наблюдали Y. Matsuoka e. a. [1997]. Уровень APS повышался на ранней стадии ИМ и нормализовался с уменьшением числа атипичных лимфоцитов. Авторы предполагают, что апоптоз Т-клеток при ИМ способствует восстановлению части поврежденных вирусом В-лимфоцитов [Taga H. e. a. , 1994].
Wagner e. a. [1995] показано, что стимуляция апоптоза в EBV-преобразованных лимфоцитах осуществляется Т-лимфоцитами, экспрессирующими BLT-экстеразу. Защиту В-лимфоцитов от апоптотической гибели обеспечивают экспрессируемые ими мембранные белки -LMP1 и BHRF1, кодируемые EBV [Исаева М.П. и соавт.,1998]. Защита осуществляется через регуляцию bcl-2-экспрессии лимфоцитами. Bcl-2 proto-oncogen кодирует внутренние митохондриальные белки, блокирующие запрограммированную гибель клеток, в связи с чем регулирование LMP1 и BHRF1 экспрессии. bcl-2 определяет живое состояние и гибель клетки. LMP1 предотвращает апоптоз, индуцируемый анти-fas-антителами, а BHRF1- анти-Pa8-антителами и TNF- [Akbar A. N. e. a., 1993].
Исходя из вышеизложенного, можно предположить, что апоптоз при ИМ служит механизмом, регулирующим численное соотношение В- и Т-клеток в популяции лимфоцитов на разных стадиях инфекционного процесса.
ЗАКЛЮЧЕНИЕ.
Таким образом, ИМ- доброкачественное лимфопролиферативное заболевание, достоверным диагностическим критерием которого являются изменения в системе крови. Своеобразным маркером заболевания служат “атипичные мононуклеары”, представляющие собой трансформированные под действием вирусных антигенов лимфоидные клетки. Одним из механизмов ограничения лимфопролиферативности процесса при ИМ является апоптоз, который регулирует численное соотношение В- и Т-клеток в популяции лимфоцитов на разных стадиях инфекционного процесса.
Однако литературные данные, касающиеся апоптотических реакций клеток в норме и при патологическом состоянии, и при ИМ в частности, немногочисленны и фрагментарны, что и послужило причиной настоящего исследования.
Глава 2. МАТЕРИАЛЫ И МЕТОДЫ
2.1. Материал и объект исследования
Нами были обследованы дети, в возрасте от 7 до 14 лет, больные ИМ (инфекцией, вызванной вирусом Эпштейна-Барр) средней степени тяжести, острым и гладким течением и ОИЗ с МПС (цитомегаловирусная инфекция, инфекция, вызванная вирусом герпеса, иерсиниоз, различные формы ангин-фоликулярная, лакунарная, некротическая) в период развернутой клинико-гематологической картины заболевания (1 группа больных), в период реконвалесценции (2 группа больных) и в катамнезе (3 группа больных). Диагноз заболевания устанавливали по характерной клинико-гематологической картине заболевания и лабораторным данным. Диагноз ИМ во всех случаях подтверждали выявлением в сыворотке больных ДНК вируса Эпштейна-Барр методом полимеразной цепной реакции (отдел молекулярной биологии ЦНИЛ СГМУ) и антител к антигену вируса Эпштейна-Барр (Ig A, M, G к вирусному капсидному антигену, Ig G к раннему антигену) с помощью непрямой иммунофлюоресценции (лаборатория онковирусологии НИИ онкологии ТНЦ СО РАМН).
Все дети, больные ИМ находились на лечении в инфекционных отделениях в 3 горбольницы г.Томска и в больницы им. Г.Е.Сибирцева.
Контрольную группу составили условно здоровые дети аналогичного возраста. Материал исследования – периферическая кровь. Забор крови осуществляли из локтевой вены, утром, натощак.
Распределение обследованных детей в зависимости от методов и сроков исследования можно наблюдать в табл. 1.
2.2. Исследование апоптоза лимфоцитов
2.2.1. Индукция апоптоза лимфоцитов in vitro
В пробирку вносили 0,4 мл плазмы гепаринизированной крови( 25 Ед/мл) и 2 мл солевого раствора Дульбекко, не содержащего Ca2 и Mg2(‘Sigma’, США). Контролем служила суспензия, состоящая из 0,4 мл плазмы гепаринизированной крови(25 Ед/мл) и 2 мл солевого раствора Дульбекко с 10 % ЭТС. Пробы инкубировали при 37 С в течение 6 часов.
2.2.2. Выделение ДНК лимфоцитов
В чистые полипропиленовые пробирки типа “Eppendorf” объемом 1,5 мл вносили 3 мкл носителя и 450 мкл денатурирующего раствора. Добавляли 450 мкл исследуемой сыворотки или плазмы крови, используя наконечники с фильтрами. Тщательно перемешивали на вортексе в течение 10 секунд. Затем инкубировали при комнатной температуре 10 минут. После этого центрифугировали 15 секунд при 12 тыс. об/мин, добавляли 100 мкл хлороформа и перемешивали на вортексе 5 секунд. Далее вновь центрифугировали при 12 тыс. об/мин 10 минут. Переносили до 300 мкл верхней фазы в чистую полипропиленовую пробирку, содержащую 300 мкл изопропилового спирта, перемешивали на вортексе 5 секунд. Чтобы избежать контаминации, данную процедуру проводили используя наконечники с фильтрами. После этого центрифугировали при 12 тыс. об/мин 15 минут. Удаляли супернатант, используя водоструйный насос, в колбу-ловушку. К осадку добавляли 1 мл промывочного раствора, перемешивали и вновь центрифугировали при 12 тыс. об/мин 5 минут. Далее как можно тщательнее удаляли супернатант, осадок подсушивали 10-20 минут, добавляя 30 мкл деионизированной воды, закрывали пробирки, инкубировали 10 минут при комнатной температуре, перемешивали встряхиванием.
2.2.3. Исследование фрагментации ДНК лимфоцитов
15 мкл суспензии ДНК каждой пробы использовали для электрофоретической идентификации апоптоза клеток, 35 мкл для оценки содержания фрагментированной ДНК в лимфоцитах.
2.2.4. Электрофорез ДНК лимфоцитов
Электрофорез проводили в 1,5 % агарозном геле с добавлением 1 мкг/мл бромистого этидия при напряжении 20 В/см в течение 30 минут. Полученные гели просматривали и фотографировали в УФ-свете.
На электрофореграммах апоптотическая фрагментация ДНК выявлялась в виде “лесенки” из фрагментов ДНК различной длины. Некроз клеток обуславливал “размазанный” характер зоны миграции ДНК. Полоса свечения интактной ДНК находилась в районе старта.
2.2.5. Определение содержания фрагментированной ДНК в лимфоцитах
Содержание ДНК в пробах определяли дифениламиновым методом [Шаткин А., 1972]. К 1 мл гидролизованной ДНК добавляли 2 мл реактива Дише (1 г дифениламина, 100 ледяной уксусной кислоты, 2,75 мл концентрированной серной кислоты) и инкубировали в течение 16-20 часов при 30С. После инкубировали в кипящей водяной бане 10 минут для развития окраски. После этого пробы охлаждали и исследовали с помощью спектрофотометра СЭФ-46 при длине волны 600 нм. В качестве раствора сравнения использовали аналогичный раствор без ДНК.
Содержание ДНК (мкг) в лимфоцитах рассчитывали по калибровочной кривой с использованием стандартного раствора ДНК клеток тимуса теленка (1 мг/мл), 0,5 мл которого предварительно смешивали с равным объемом 0,1 Н раствора и> >гидролизовали в течение 10 минут в> >кипящей водяной бане и разбавляли 0,5 Н раствором HCIO>4 >до необходимой концентрации.
2.3. Исследование морфологии апоптоза лимфоцитов
После инкубации пробы центрифугировали 10 минут при 1000 об/мин, надосадочную жидкость удаляли, а из осадка готовили мазки, которые окрашивали азур-эозином в течение 40-50 минут. Для оценки морфологии апоптотических изменений лимфоцитов использовали цитопатологические критерии, предложенные S. G. Martin e.a. [Маянский А. Н., 1997]
2.4. Статистическая обработка результатов
П

 олученные
данные обрабатывали на Statistica
for Windows
(версия 6.0) и пакета программ Microsoft
Excel (1997). Для всех имеющихся
выборок данных проверена гипотеза
нормальности распределения (по критерию
Колмогорова-Смирнова). Для каждой выборки
вычисляли средневыборочные характеристики.
олученные
данные обрабатывали на Statistica
for Windows
(версия 6.0) и пакета программ Microsoft
Excel (1997). Для всех имеющихся
выборок данных проверена гипотеза
нормальности распределения (по критерию
Колмогорова-Смирнова). Для каждой выборки
вычисляли средневыборочные характеристики.
Х - среднее арифметическое;
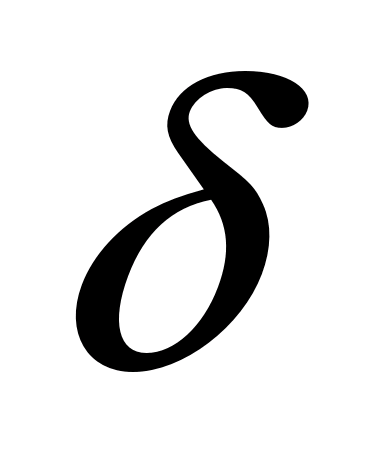 -
среднее квадратичное отклонение;
-
среднее квадратичное отклонение;
m – ошибка среднего;
по формуле:
Х = а / n (1);
 =
=
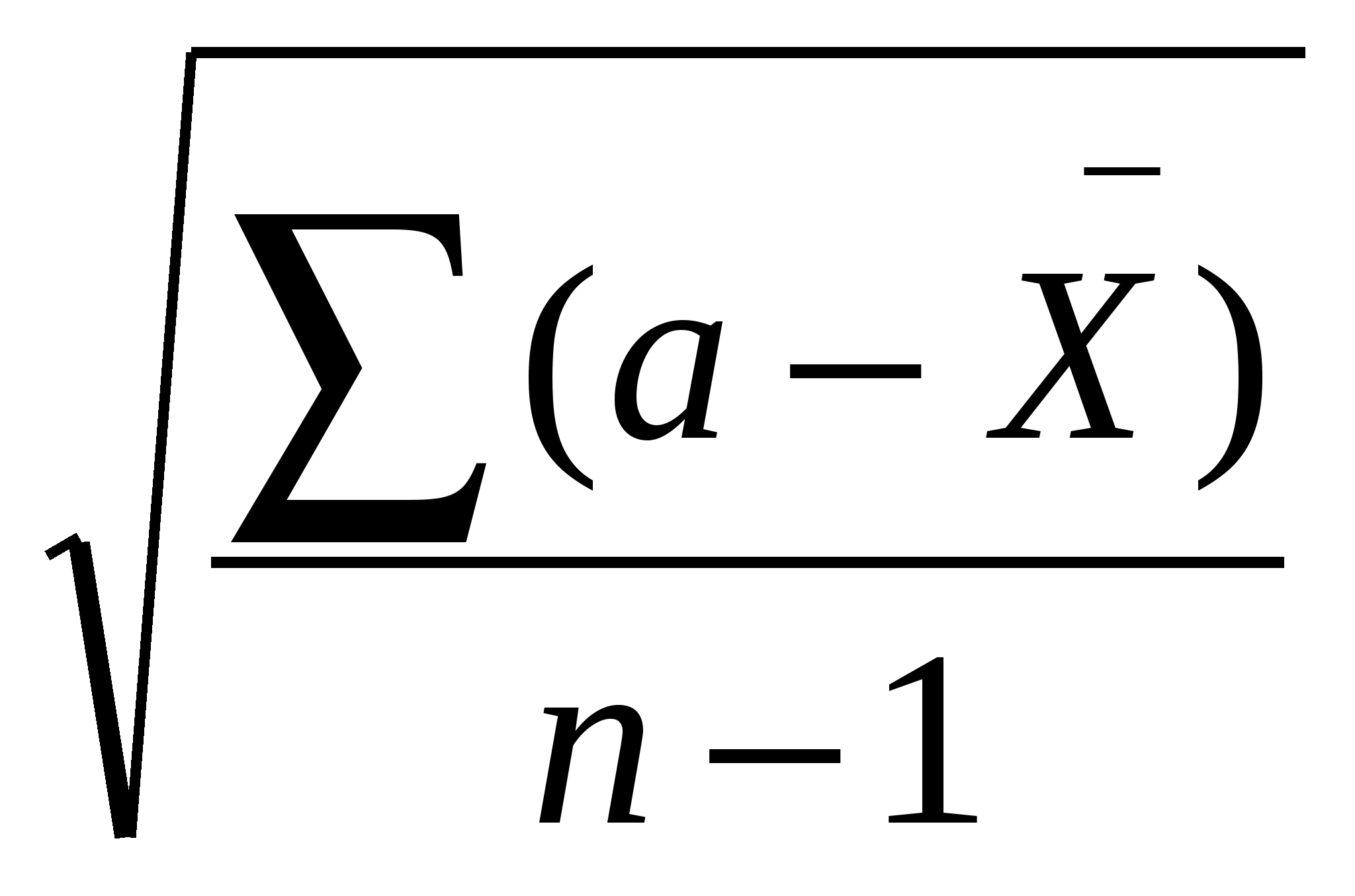 (2);
(2);
m
=
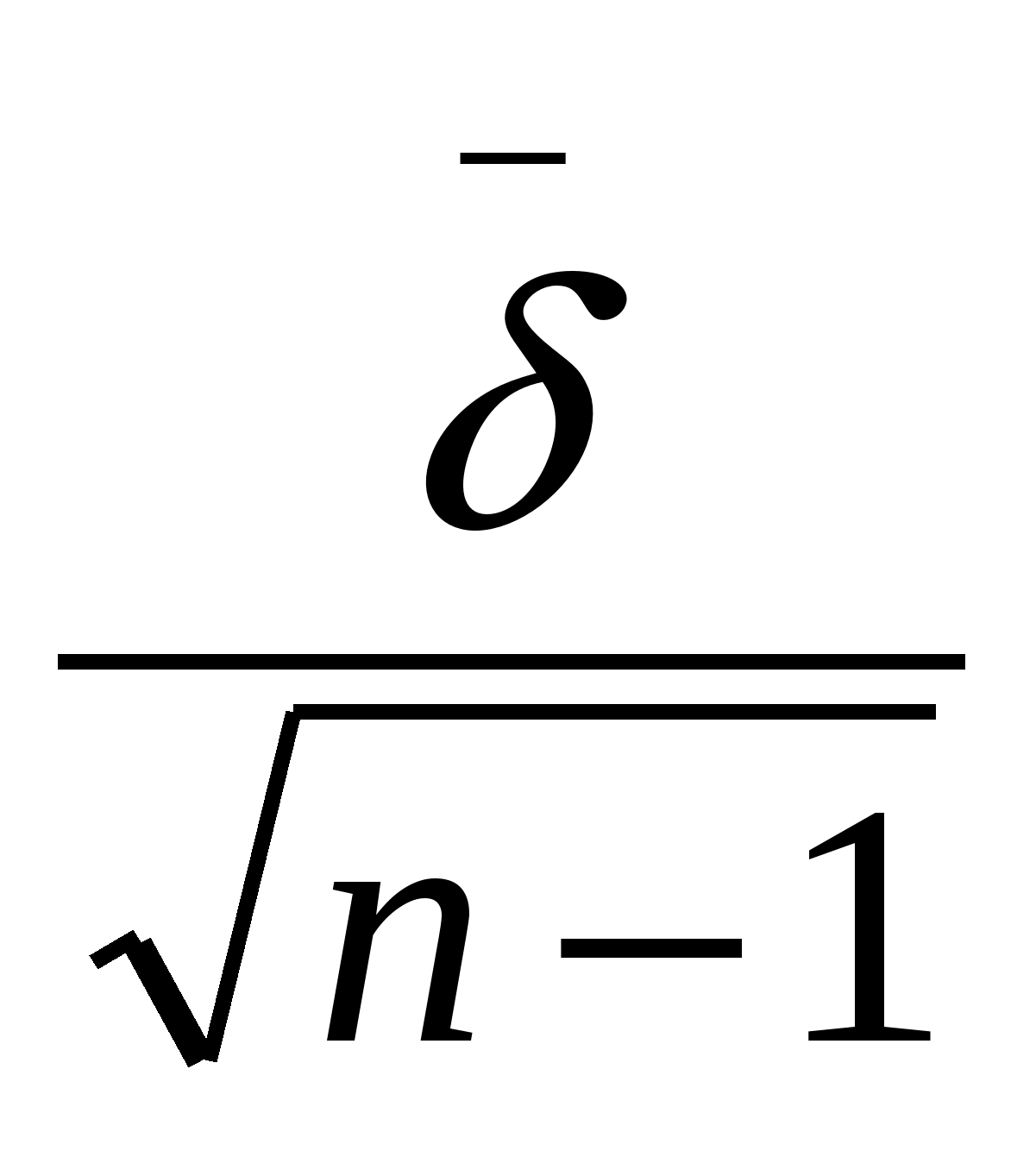 (3);
(3);
где а – величины, полученные при исследовании;
n – число исследований.
При соответствии нормальному закону распределения признака в исследуемых выборках, проверка гипотезы о равенстве средних выборочных величин производилась с использованием t-критерия Стьюдента. Для оценки достоверности различий выборок, не подчиняющихся критерию нормального распределения, использовали непараметрический критерий Манна-Уитни. Различия считали достоверными, при уровне значимости p<0,05 [Лакин А.В.,1989].
Глава 3. Результаты исследований
3.1 Количественные показатели периферической крови у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом
3.1.1 Количественные показатели периферической крови у детей, больных инфекционным мононуклеозом в различные периоды течения и через 16-18 месяцев после болезни
При исследовании количественных показателей периферической крови у детей, больных ИМ, в развернутую стадию клинико-гематологических проявлений наблюдалось достоверное увеличение общего количества лейкоцитов (10,150,67 Г/л, p>1>0,001), обусловленное достоверным увеличением абсолютного содержания лимфоцитов (5,130,42 Г/л, p>1>0,001) и моноцитов (0,730,13 Г/л, p>1>0,001) (табл. 2), при этом относительное количество лимфоцитов и моноцитов существенно не превышало значений нормы.
Как следует из табл. 2, у больных ИМ, в острый период заболевания, в периферической крови отмечалось значительное повышение относительного и абсолютного содержания атипичных мононуклеаров (АМ) (в среднем в 14,3, p>1>0,001 и в 8, p>1>0,001 раз соответственно) (табл. 2).
Кроме того, отмечалось достоверное повышение относительного (2,430,5 %, p>1>0,001) и абсолютного (0,290,07 Г/л, p>1>0,001) количества палочкоядерных нейтрофилов (табл. 2).
На фоне достоверного снижения в периферической крови, у данной группы больных, относительного содержания эозинофильных (1,030,28 %, p>1>0,05) и сегментоядерных (20,292,28 %, р>1>0,001) гранулоцитов, их абсолютное число существенно не изменялось по сравнению с контролем (табл. 2).
В период реконвалесценции, у больных ИМ, наблюдалось снижение общего количества лейкоцитов периферической крови (7,380,79 Г/л, р>2>0,01) по сравнению с 1 группой, превышая аналогичный показатель нормы в 1,2 раза (р>1>0,001) (табл.2).
В данный период исследования относительное и абсолютное количество лимфоцитов периферической крови оставалось повышенным (59,982,55 %, р>1>0,01) и (4,310,46 Г/л, р>1>0,001) по сравнению с группой здоровых детей, кроме того, отмечалась незначительная тенденция к повышению относительного, но при этом к снижению абсолютного содержания лимфоцитов периферической крови, по сравнению с 1 группой детей (табл.2).
Также, в крови больных ИМ, отмечалось достоверное снижение относительного и абсолютного количества АМ периферической крови, в 4,0 (р>2>0,001) и 5,0 (р>1>0,001) раза соответственно, по сравнению с аналогичными показателями 1 группы, при этом данные показатели существенно превышали уровень нормальных значений (табл. 2)
Отмечалось восстановление до уровня нормы абсолютного и относительного числа моноцитов, эозинофилов и палочкоядерных нейтрофилов (табл. 2). Кроме того, количество сегментоядерных гранулоцитов периферической крови, в период выздоровления и через 16-18 месяцев после перенесенного заболевания, также оставалось сниженным, что составляло 64% (р>1>0,001) и 66% (р>1>0,001) от уровня нормы (табл.2).
Через 16-18 месяцев после ИМ, общее количество лейкоцитов оставалось незначительно повышенным по сравнению с нормой, и отмечалась тенденция к снижению данного показателя при сравнении с периодом выздоровления (табл. 2).
В катамнезе, абсолютное и относительное содержание в периферической крови АМ, продолжало достоверно снижаться по сравнению со 2 периодом (0,380,05 Г/л, р>3>0,05) и (5,520,7 %, р>3>0,05), соответственно, по прежнему значимо превышая контрольные значения (табл.2).
В отдаленном периоде после болезни отмечалась незначительная тенденция к повышению палочкоядерных нейтрофилов по сравнению с нормой и периодом выздоровления (табл. 2).
Через 16-18 месяцев после заболевания абсолютное и относительное число моноцитов существенно не изменялось, по сравнению с аналогичным показателем в период выздоровления, однако все еще превышая показатели контроля (табл.2).
Таким образом, у детей, больных ИМ, наблюдалась следующая динамика изменений количественных показателей периферической крови: в острый период наблюдалось достоверное увеличение общего количества лейкоцитов, обусловленное повышением, как относительного, так и абсолютного содержания отдельных клеточных форм (лимфоцитов, моноцитов, атипичных мононуклеаров), при этом отмечалось значимое снижение количества нейтрофильных гранулоцитов; в период выздоровления наблюдалось снижение общего количества лейкоцитов, атипичных мононуклеаров, моноцитов, на фоне нейтропении; в катамнезе количество
3.2. Количественные показатели периферической крови у детей, больных острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные периоды течения и через 16-18 месяцев после болезни
У больных с МПС в острый период наблюдалось: достоверное увеличение общего количества лейкоцитов (9,670,7 Г/л, р>1>0,001); значительное повышение абсолютного количества лимфоцитов (5,14 0,52 Г/л, р>1>0,001) и моноцитов (0,50,08 Г/л, р>1>0,05) по сравнению с нормой (табл. 2).
Кроме того, в группе острых больных отмечалось статистически значимое повышение абсолютного (1,340,21 Г/л, р>1>0,001) и относительного (13,271,8 %, р>1>0,001) числа АМ, по сравнению с показателями группы здоровых детей (табл. 2).
Как следует из таблицы 2, относительное количество сегментоядерных нейтрофилов периферической крови в острый период достоверно снижалось, что составило 58 % (р>1>0,001) от нормального значения; при этом абсолютное количество значимо не изменялось во все последующие периоды заболевания (табл. 2)
Кроме того, в данный период в крови больных с МПС, выявлено достоверное повышение относительного (2,760,57%, р>1>0,001) и абсолютного (0,250,06 Г/л, р>1>0,001) числа палочкоядерных нейтрофилов (табл. 2).
Исследование показало, что абсолютное и относительное количество моноцитов и эозинофилов практически не изменялось во всех группах обследуемых (табл.2).
У больных с МПС, в период клинического выздоровления наблюдалась тенденция к незначительному снижению общего количества лейкоцитов, по сравнению с 1 группой больных, однако оставалось повышенным (7,730,7 Г/л, р>1>0,001) относительно нормы (табл. 2).
В период реконвалесценции и в катамнезе, сохранялось повышенным относительное и абсолютное количество лимфоцитов по сравнению с нормой, незначительно снижаясь по сравнению с 1 и 2 периодом, соответственно (табл.2). Кроме того, отмечалась тенденция к снижению относительного и абсолютного и количества АМ по сравнению с 1 группой, но эти показатели в 5,3 (р>1>0,001) и 4,1 (р>1>0,001) раза превышали значения в контроле (табл.2).
Как следует из таблицы 2 в период выписки наблюдалось значительное снижение относительного и абсолютного значения палочкоядерных нейтрофилов (1,50,34%, р>2>0,001) и (2,150,34 Г/л, р>2>0,001), соответственно, по сравнению с аналогичными показателями в острый период, существенно превышая показатели нормы (табл. 2).
У детей, перенесших МПС, через год после болезни прослеживалась тенденция к дальнейшему снижению общего количества лейкоцитов (7,000,62 Г/л) по сравнению со 2 группой больных, при этом, этот показатель оставался незначительно повышенным по сравнению с нормой (табл. 2)
Через 16-18 месяцев после перенесенного заболевания, наблюдалась тенденция к снижению абсолютного и относительного количества АМ по сравнению со 2 группой, но данный показатель оставался значимо высоким по сравнению с контролем (0,660,15Г/л, р>1>0,001) и (8,921,33 %, р>1>0,001), соответственно (табл.2).
3.3. Исследование апоптотической активности лимфоцитов периферической крови у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом
3.3.1. Исследование апоптоза лимфоцитов периферической крови у детей, больных инфекционным мононуклеозом
В острый период, у больных ИМ, наблюдалось достоверное увеличение числа погибших клеток как при спонтанной (14,251,6%, р>1>0,001), так и при индуцированной in vitro (17,581,73%, р>1>0,001) гибели клеток, по сравнению с доинкубационным периодом, не отличаясь существенно от аналогичных показателей нормы (табл. 3).
Кроме того, в данный период наблюдалось достоверное снижение фДНК при индуцированном апоптозе (38,483,8%, р>1>0,05) по сравнению с показателем нормы (48,852,12%) (табл. 4).
При спонтанном апоптозе содержание фДНК существенно не изменялось во все сроки исследования (табл. 4).
В период развернутых клинико-гематологических проявлений, при анализе морфологии апоптоза отмечалось достоверное снижение апоптотически измененных клеток (27,752,54%, р>1>0,05) и наблюдалась тенденция к уменьшению апоптозных телец при индуцированном апоптозе, по сравнению контролем (табл. 5).
В случае спонтанного апоптоза, во все сроки исследования не наблюдалось существенных изменений в морфологии апоптоза (табл. 5).
Как следует из табл. 3, в период реконвалесценции отмечалось статистически значимое повышение числа мертвых клеток при спонтанном и индуцированном апоптозе, по сравнению с доинкубационным периодом (в среднем в 2,1, р>1>0,01 и в 4,1, р>1>0,001 раза, соответственно), не имея значимых изменений по сравнению с аналогичными показателями в контроле (табл. 3).
Во 2-ой период болезни регистрировалось значительное снижение количества фДНК на 13% (р>1>0,01), числа апоптотически измененных клеток (26,883,06, р>1>0,01) при индукции гибели клеток in vitro, по сравнению с контролем (табл. 4,5).
В отдаленный период после перенесения заболевания полученные данные свидетельствуют о повышении количества мертвых клеток при спонтанном и индуцированном апоптозе, на 64,2% (р>1>0,001) и на 76,1%, по сравнению со значениями в доинкубативном периоде, при этом не отмечалось существенных различий по сравнению с аналогичными показателями в группе здоровых детей (табл. 3). Кроме того, наблюдалось достоверное увеличение содержания фДНК в пробах с индукцией апоптоза in vitro (52,292,34%, р>3>0,05), по сравнению со 2-ой группой, однако не отличаясь существенно от нормы (табл.4). При этом не регистрировалось существенных изменений при исследовании морфологии апоптоза при спонтанной и индуцированной гибели клеток in vitro в данный период исследования, по сравнению с аналогичными показателями в группе здоровых детей (табл. 5).
3.3.2. Исследование апоптоза лимфоцитов периферической крови у детей, больных острыми инфекционными заболеваниями с мононуклеозоподобным синдромом
При исследовании жизнеспособности лимфоцитов in vitro у больных острыми инфекционными заболеваниями с МПС в разные сроки исследования при индуцированном и спонтанном апоптозе в разные сроки исследования наблюдалось достоверное повышение соответствующих значений мертвых клеток по сравнению с доинкубативным периодом (табл. 3).
В результате анализа динамики ДНК-фрагментации лимфоцитов периферической крови, у больных с МПС, в период поступления при индуцированном апоптозе отмечалось достоверное снижение содержания фДНК (40,732,51 %, р>1>0,05), по сравнению с аналогичным показателем нормы (табл. 4). В период выздоровления регистрировалось повышение уровня фДНК на 19% (р>1>0,05), по сравнению с показателями 1 группы больных (табл. 4). В 3 периоде исследования (через 16-18 месяцев после болезни), количество фДНК не изменялось при сравнении с показателем во 2 периоде, также существенно не отличаясь от нормы (табл. 4).
При исследовании морфологии апоптоза у детей, больных острыми респираторными инфекциями с МПС, в острый период наблюдалось значительное снижение количества апоптозных клеток (27,891,94%, р>1>0,05) при индуцированной гибели клеток по сравнению с нормой; данный показатель не изменялся в последующие сроки исследования (табл. 5). При спонтанном апоптозе различий во все сроки исследования не наблюдалось.
Глава 4. Обсуждение полученных результатов.
Инфекционный мононуклеоз (ИМ) – острое инфекционное лимфопролиферативное заболевание, возбудителем которого является вирус Эпштейна-Барр, относящиийся к семейству Y-герпесвирусов [Дранкин Д.И., Заяц Н.А., 1982; Учайкин В.Ф., 1999]. Уникальность EBV заключается в его способности не разрушать, а стимулировать пролиферацию зараженных им лимфоцитов путем изменения соотношения между ростовыми и апоптозными потенциями клеток [Дранкин Д.И., Заяц Н.А., 1982; Ронин В.С., 1992].
Несмотря на достаточно большое число работ, посвященных изучению ИМ, растущий интерес ученых к этому заболеванию, патогенез ИМ остается во многом неясным и до настоящего времени. Известно, что проникший в организм EBV, персистирует пожизненно в эпителиальных клетках назофарингиальной области и В-лимфоцитах и способен вызывать выраженные нарушения гемопоэтических процессов.
Проведенное нами исследование количественных показателей периферической крови у детей, больных ИМ, подтверждает данные литературы об изменениях в периферической крови при данной патологии. Так, в период развернутых клинико-гематологических проявлений, отмечалось достоверное увеличение общего количества лейкоцитов (в среднем в 1,7 раза, р>1>0,001), абсолютного и относительного числа лимфоцитов (в среднем в 1,7 раза), моноцитоз и нейтропения, по сравнению с контрольными значениями. Установленно, что EBV содержится и продуцируется в В-лимфоцитах (Ронин В.С.,1992). Под влиянием вируса, В-лимфоциты трансформируются в крупные АМ. Как следует из полученных данных, наблюдалось увеличение количества АМ периферической крови (в среднем в 10 раз) по сравнению с таковым значением у здоровых детей. Это можно объяснить тем, что пролиферация В-клеток контролируется Т-лимфоцитами, которые влияют и на пролиферацию гранулоцитов и моноцитов. Вероятно, активированные Т-лимфоциты, выделяют специфические лимфокины, стимулирующие выработку элементами гемопоэтического микроокружения колониестимулирующего фактора (КСФ) и продуцируют интерлейкин-3 (мультиКСФ). КСФ, воздействуя на предшественники грануломоноцитопоэза (КОЕ-ГМ), усиливает процессы пролиферации и дифференцировки в направлении, преимущественно, моноцитопоэза, что по видимому, и объясняет развитие моноцитоза в периферической крови у больных ИМ. Кроме того, может иметь место выход моноцитоидных элементов из лимфотока в периферическую кровь, что объясняется ведущей ролью моноцитов в обеспечении неспецифической резистентности организма, а именно в фагоцитарном захвате и инактивации чужеродных агентов.
В острый период, у больных ИМ, нами было выявлено уменьшение относительного количества сегментоядерных нейтрофилов, что составляло 51% от контроля, на фоне увеличения числа палочкоядерных форм, что можно объяснить компенсаторным поступлением незрелых элементов из костного мозга на периферию, необходимого для пополнения пула зрелых гранулоцитов, недостаток которых может формироваться в результате миграции лейкоцитов в очаг воспаления, имеющий место при данной патологии, так как известно, что течение ИМ сопровождается развитием катара верхних дыхательных путей и различных форм ангины (табл. 2, рис.1).
В период клинического выздоровления, у больных ИМ, отмечалось достоверное снижение общего количества лейкоцитов, на 28% по сравнению с I группой, но оставалось повышенным по сравнению с нормой в 1,2 раза. В данный период исследования наблюдалась незначительная тенденция к повышению относительного, и уменьшению абсолютного количества лимфоцитов по сравнению с острым периодом. Относительное содержание АМ, несмотря на достоверное снижение (на 47 %) по сравнению со значением в период поступления, в 4 раза превышало уровень контрольного показателя (табл. 2, рис.1).
Выявленные нами изменения, вероятно, обусловлены эффективностью проведенной симптоматической терапии. Моноцитоз, возможно, связан с сохраняющейся в этот период болезни избирательной дифференцировкой КОЕ-ГМ в сторону элементов моноцитарного ряда, необходимой для обеспечения в организме достаточного числа фагоцитирующих элементов, способных элиминировать поврежденные вирусом клетки.
У детей, переболевших ИМ, через 16-18 месяцев, наблюдалась нормализация общего количества лейкоцитов периферической крови. Содержание лимфоцитов оставалось высоким и в отдаленный период после болезни. Отмечалась тенденция к снижению относительного и абсолютного числа моноцитов по сравнению со 2 группой, на фоне снижения данного показателя в 1,8 и 1,6 раз, соответственно, по сравнению с контолем (табл. 2, рис.1).
Содержание АМ, в данный период исследования, оставалось более высоким, чем у здоровых детей. Нейтропения сохранялась и в отдаленном периоде после перенесения болезни (табл. 2, рис.1).
Данные изменения, возможно, обусловлены персистенцией и репродукцией EBV в организме, что подтверждается исследованиями, проведенными в лаборатории онковирусологии НИИ онкологии ТНЦ СО РАМН (Л.Н. Уразова, 1989), результаты которых свидетельствуют о повышенных титрах вирусспецифичных антител к антигенам EBV и в отдаленном периоде после перенесения ИМ.
Для детей, больных острыми инфекционными заболеваниями с МПС в период поступления так же, как и у детей с ИМ, отмечалось увеличение общего количества лейкоцитов, абсолютного и относительного числа лимфоцитов, моноцитоз и нейтропения. Так же наблюдалось увеличение АМ (в среднем в 6 раз) по сравнению с таковым у здоровых детей. В острый период, у больных с МПС, нами было выявлено достоверное уменьшение относительного количества сегментоядерных нейтрофилов, что составило 58% от нормы, при этом регистрировалось значительное увеличение палочкоядерных форм клеток (табл. 2, рис.2).
В период клинического выздоровления, у больных с МПС, отмечалась тенденция к снижению общего количества лейкоцитов и лимфоцитов, по сравнению с острым периодом, но не восстанавливаясь до нормальных значений (табл. 2, рис.2).
В данный период прослеживалась тенденция к снижению количества палочкоядерных, и повышению сегментоядерных нейтрофилов по сравнению с показателями 2 периода (табл. 2, рис.2).
. Содержание АМ, несмотря на снижение, в 5 раз превышало контрольные значения. В период реконвалесценции количество моноцитов снижалось и достигало контрольных значений (табл. 2, рис.2).
У детей, переболевших МПС через 16-18 месяцев, наблюдалась нормализация общего числа лейкоцитов. В катамнезе, уровень лимфоцитов и атипичных мононуклеаров, оставался по прежнему высоким по сравнению с показателями здоровых детей (табл. 2, рис.2).
Относительное и абсолютное содержание моноцитов периферической крови, у детей с ОИЗ с МПС, достоверно снижалось по сравнению со значениями в период реконвалесценции, на 37% и 23% соответственно, при этом наблюдалась тенденция к снижению данного показателя относительно нормы (табл. 2, рис.2).
Количество сегментоядерных нейтрофилов не восстанавливалось в отдаленный период после болезни (табл. 2, рис.2).
Таким образом, у больных с ИМ и ОИЗ с МПС, отмечаются аналогичные изменения количественных показателей периферической крови во все периоды исследования сопровождающиеся: увеличением в острый период заболевания общего количества лейкоцитов, лимфоцитов, моноцитов, атипичных мононуклеаров, палочкоядерных гранулоцитов, на фоне снижения содержания сегментоядерных нейтрофилов; в период реконвалесценции, и через 16-18 месяцев после болезни, у больных ИМ и ОИЗ с МПС регистрируется частичная нормализация выше перечисленных показателей, при сохраняющейся нейтропении.
В патогенезе вирусных инфекций чрезвычайно важную роль играет гибель клеток, реализующаяся в форме некроза или апоптоза. Апоптоз, запрограммированная или “физиологическая” форма клеточной гибели, реализуется посредством заложенных в генотипе клетки механизмов самоуничтожения и морфологически характеризуется уменьшением размеров клетки, уплотнением и фрагментацией хроматина [Погорелов В.М., Козинец Г.И., 1995; Ярилин А.А., 1996; Маянский А.Н. и соавт., 1997; Утешев Д.Б. и соавт., 1998]. Электрофоретический анализ ДНК, погибших лимфоцитов у большинства обследованных больных, свидетельствовал о наличии регулярных фрагментов ДНК, характерных для апоптотического типа гибели клеток.
Известно более десятка вирусных генов, которые кодируют факторы, усиливающие апоптозный процесс. Имеются они и у герпесвирусов. Некоторые вирусы способны блокировать апоптозный ответ на собственную инфекцию. Это достигается с помощью двух механизмов – повышения экспресии антиапоптозных генов клетки и инактивации эффекторных молекул апоптоза. К первому механизму можно отнести стимуляцию протоонкогена типа Вcl-2, которая наблюдается, в частности, при персистенции EBV в В-лимфоцитах [Uehara T. e.a., 1992; Akbar A.N. e.a., 1993].
Однако, необходимо отметить, что, несмотря на проведение достаточно большого количества исследований, посвященных изучению процессов клеточной гибели, сведения, касающиеся особенностей апоптоза лимфоцитов периферической крови при действии EBV, в доступной литературе крайне немногочисленны и фрагментарны, что и послужило причиной настоящего исследования.
При оценке жизнеспособности и спонтанной апоптотической активности лимфоцитов при ИМ и МПС во все периоды обследования значимых изменений выявлено не было. Вместе с этим, в острый период исследования, у больных ИМ, при индукции апоптоза in vitro, отмечалось достоверное снижение количества апоптотически измененных клеток (в среднем на 17 %) и фДНК (в среднем на 32%) по сравнению с нормой (табл. 3,4,5, рис.3).
Полученные результаты вероятно, можно объяснить данными литературы, согласно которым, в случае гибели клетки путем апоптоза, индуцированного лишением сыворотки, подавлялась фрагментация ДНК и гибель клеток, кроме того, известно, что EBV, обладает уникальными способностями не разрушать, а стимулировать пролиферацию инфицированных им лимфоцитов путем изменения соотношения между ростовыми и апоптозными потенциями, в сторону подавления апоптоза.
Среди морфологических форм апоптоза обнаруживались преимущественно карликовые клетки и элементы с фрагментозом ядра, которые мы отнесли к апоптозным клеткам. Кроме того, в период поступления у детей с ИМ существенно сниженным по сравнению с нормой оказалось содержание апоптозных тел. При ИМ данные изменения сохранялись в период реконвалесценции. В отдаленном периоде после перенесенного заболевания показатели индуцированного апоптоза соответствовали нормальным значениям (табл. 5, рис.3).
Снижение апоптотической активности лимфоцитов вероятно объясняется тем, что некоторые вирусы способны блокировать апоптозный ответ на собственную инфекцию. Это достигается разными способами, но их принцип сводится к двум механизмам – повышение экспрессии антиапоптозных (рост-стимулирующих) генов клетки или инактивация эффекторных молекул апоптоза. В случае инфицирования EBV, происходит стимуляция протоонкогенов типа bcl-2, подавляющих апоптоз.
В период развернутой клинико-гематологической картины заболевания, у больных ОИЗ с МПС, отмечалось снижение апоптотически измененных клеток (в среднем на 16 %) и фДНК (в среднем на 17 %). в лимфоцитах периферической крови по сравнению с нормой. Кроме того, в период поступления, у детей с МПС, отмечалось снижение апоптозных тел на 20 % по сравнению с нормой оказалось содержание апоптозных тел. В период реконвалесценции восстанавливались содержание апоптозных тел и уровень ДНК-фрагментации. В отдаленный период, после перенесенного заболевания, показатели индуцированного апоптоза, у больных с ОИЗ с МПС соответствовали нормальным значениям (табл. 3,4,5, рис.3).
Исходя из полученных данных, можно предположить, что возможным механизмом снижения апоптотической активности лимфоцитов периферической крови, у больных ОИЗ с МПС, является то, что к ОИЗ с МПС мы относим, в основном, цитомегаловирусную и герпетическую инфекции (и в меньшей степени бактериальные инфекции (токсоплазмоз, иерсиниоз)), которые по-видимому, обладают аналогичным действием на процессы апоптоза, так как принадлежат к семейству герпес-вирусов, куда относится и EBV.
Таким образом, при ИМ и МПС наблюдается угнетение апоптотической активности лимфоидных клеток, по сравнению с таковой у здоровых детей, что проявляется снижением числа апоптотически измененных клеток и ДНК-фрагментации. У больных ИМ данные изменения носят более выраженный характер, сохраняются в фазу реконвалесценции, и восстанавливаются лишь в отдаленном периоде после болезни (табл. 3,4,5, рис.3).
Выводы:
У детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом, в острый период болезни на фоне повышения общего количества лейкоцитов, обусловленного увеличением содержания моноцитов, палочкоядерных нейтрофилов, АМ и абсолютного числа лимфоцитов, содержание сегментоядерных нейтрофилов снижается.
В период клинического выздоровления у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом содержание лимфоцитов и АМ остается повышенным, количество моноцитов и гранулоцитов нормализуется. Данные изменения сохраняются в катамнезе. У детей, перенесших ИМ развивается моноцитопения.
Жизнеспособность и спонтанная апоптотическая активность лимфоцитов периферической крови у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом не изменяется.
Количество апоптотически измененных клеток и содержание фрагментированной ДНК, при индукции апоптоза лимфоцитов периферической крови in vitro у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом снижено.
В период реконвалесценции у детей, больных острыми инфекционными заболеваниями с мононуклеозоподобным синдромом, количество апоптотически измененных клеток и содержание фрагментированной ДНК нормализуется, в то время как у больных ИМ сохраняется сниженным.
В отдаленном периоде после болезни у детей с инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом показатели апоптотической активности лимфоцитов периферической крови соответствуют норме.
При ИМ и МПС наблюдается угнетение Апоптотическая активность лимфоидных клеток при инфекционном мононуклеозе и мононуклеозоподобном синдроме ниже таковой у здоровых детей, что проявляется снижением числа апоптотически измененных клеток и ДНК-фрагментации. У больных ИМ данные изменения носят более выраженный характер, сохраняются в фазу реконвалесценции, и восстанавливаются лишь в отдаленном периоде после болезни.
Список литературы
Мордовец В.И., Рудакова Р.И., Гуськова Т.Б. Особенности клиники инфекционного мононуклеоза у детей первого года жизни // Научные труды Новосибирского мед. ин-та. – 1986. – Т.125. – С. 75-78.
Мушецяну К., Мушецяну В., Вишнеску Д. Роль феномена ядерной фрагментации моноцитов в диагностике атипичных форм инфекционного мононуклеоза // Проблемы гематологии и переливания крови. – 1965. - Т.10. – №2. – С.35-36.
Новицкий В.В., Уразова О.И., Антоненко Н.М.,Жукова О.Б. Особенности поверхностной архитектоники лимфоцитов и моноцитов у больных с инфекционным мононуклеозом//Актуальные вопросы экспериментальной морфологии. Томск-1999.-с.14-16.
Погорелов В.М., Козинец Г.И. Морфология апоптоза при нормальном и патологическом гемопоэзе//Гематология и трансфузиология. –1995. –Т.40, №5. –с.21-25.
Руководство по воздушно-капельным инфекциям / Под ред. Мусабаева И.К. –Ташкент, 1982. –Ч.2. –с.408-433.
Руководство по инфекционным болезням у детей//Бисярина В.П., Блюменталь К.В., Брагинская В.П. и др. –М, 1980. –с.261-274.
Серебряная Н.Б., Жибурт Е.Б., Новик А.А., Волошин С.В., Криволапов Ю.А., Каткова И.В., Дьякова В.В., Зюзькин И.С., Санжаревский В.А. Связь инфекции вирусом Эпштейна-Барр с HLA-фенотипом и оссобенностями цитокинового статуса у больных со злокачественными неходжкинскими лимфомами//Вопросы вирусологии. –1998. -№2. –с.79-82.
Титов Л.П., Самойлович Е.О., Кочановский Б., Вольф Х.И. Серологические и эпидемиологические особенности инфекции, вызванной вирусом Эпштейна-Барр, в республике Беларусь//Вопросы вирусологии. –1999. -№1. –с.21-24.
Турковская Н.Н., Старшинова В.С., Плотникова Н.М. Цитохимические показатели лейкоцитов при инфекционном мононуклеозе // Клиническая медицина. – 1977. – Т.55. - №8. – С.119-123.
Уманский С.Р. Апоптоз: молекулярные и клеточные механизмы//Молекулярная биология. –1996. –Т.30, вып.3. – с.487-498.
Уразова Л.Н., Подоплекин В.Д., Одинцова Л.Н. Диагностическое значение определения антител к антигенам вируса Эпштейна-Барр при инфекционном мононуклеозе // Лабораторное дело. – 1989. - №5. – С.73-74.
Уразова Л.Н., Подоплекин В.Д., Одинцова Л.Н., Лепехин А.В. Диагностическое значение определения антител к антигенам вируса Эпштейна-Барр при инфекционном мононуклеозе//Лабораторное дело. –1989. -№5.-с.73-74.
Уразова О.И., Помогаева А.П., Новицкий В.В.,Жукова О.Б. Ультраструктура мононуклеаров периферической крови у детей, больных инфекционным мононуклеозом. // Актуальные вопросы медицины.-Томск, 2000.-с.74-75.
Утешев Д.Б., Сергеев А.В., Утешев Б.С. Апоптоз: фармакологические аспекты//Экспериментальная и клиническая фармакология. –1998. –Т.61, №4. –с.57-65.
Чирешкина Н.М. Инфекционный мононуклеоз (болезнь Филатова) у детей. –М., 1973 – 246 c.
Ютенко А.К., Смирнова И.А., Кишинская Е.Г. Определение генома вируса Эпштейна-Барр в клетках лимфатических узлов и крови больных злокачественными лимфомами из Чернобыльского региона // Экспер.онкол. – 1994. - №2-3. – С. 164-169.
Ярилин А.А. Апоптоз и его место в иммунных процессах//Иммунология. –1996. –№6. –с.10-21
Ярилин А.А. Апоптоз. Природа феномена и его роль в целостном организме//Патологическая физиология и экспериментальная терапия. –1998. -№2. –с.38-48.
Балашева Т.Б., Казарин В.С., Суханова И.А. Активность щелочной фосфатазы нейтрофильных лейкоцитов как вспомогательный тест в дифференциальной диагностике ангин и инфекционного мононуклеоза//Вопросы охраны материнства и детства. – 1966. -Т.11, №2. –с.30-36.
Баринский И.Ф., Носик Д.Н., Кальнов С.Л., Никитина А.А., Львов Н.Д., Петров М.С., Цибезов В.В. Активация репродукции вирусов при смешанной инфекции вирусом иммунодефицита человека и герпес-вирусов//Вопросы вирусологии. –1994. -№5. –с.223-226.
Барышников А.Ю., Заботина Т.Н., Седяхина Н.П., Хорошко Н.Д., Туркина А.Г., Палкина Т.Н., Лобанова В.В., Шишкин Ю.В., Кадагидзе З.Г. Коэкспрессия антигена СD34 ранних гемопоэтических предшественников и антигена FAS/APO-1 (CD95), опосредующего апоптоз//Экспериментальная онкология. –1994. -№4-6. –с.343-345.
Барышников А.Ю., Шишкин Ю.В. Програмированная клеточная смерть (апоптоз)//Российский онкологический журнал. –1996. -№1. –с.58-60.
Блюмкин В.Н., Жданов В.М. Влияние вирусов на хромосомный аппарат и деление клеток / М., Медицина, 1973 –128 с.
Выдумкина С.П., Зазиленко Л.А., Кузенкова А.К. Частота острой цитомегаловирусной инфекции среди лиц разных возрастных групп//Вопросы вирусологии. –1999. -№1. –с.19-20.
Гаспарян М.О., Шиленкова В.И. Лейкоцитарный профиль при инфекционном мононуклеозе у детей//Педиатрия. –1972. -№8.-с.74-77.
Демин А.А., Салганин Р.И. Терапевтическая эффективность дезоксирибонуклеазы при инфекционном мононуклеозе // Сов. медицина. –1983. –с.91-92.
Дранкин Д.И., Заяц Н.А. Эпидемиология инфекционного мононуклеоза//Журнал микробиологии, эпидемиологии и иммунобиологии. –1982. –№1. –с.26-33.
Дунаевский О.А., Постовит В.А. Особенности инфекционных болезней у лиц пожилого и старческого возраста. –Л., 1982. –с.190-212.
Ждaнoв В. М. Канцерогенез: вирусы и транспозоны // Вопросы онкологии - 1984. - N 1. - С. 98-104.
Жибурт Е.Б., Серебрянная Н.Б., Ионова А.И. и др. Метод диагностики инфекции вирусом Эпштейна-Барр // Вопросы Вирусологии – 1996. - №4. – с. 185-187.
Жибурт Е.Б., Серебрянная Н.Б., Каткова И.В., Дьякова В.В. Цитокины в кроветворении, иммуногенезе и воспалении // Terra med. – 1996. - №3. – С. 38-41.
Живица Л.В., Пономаренко Г.Ф., Предеина В.А. Особенности течения инфекционного мононуклеоза у детей и взрослых// Клиническая медицина. –1987. -№10. –с.121-123.
Зуев В. А. Медленные вирусные инфекции человека и животных. — М., 1988 – 437 с.
Исаева М.П., Леонова Г.Н., Кожемяко В.Б., Борисевич В.Г., Майстровская О.С., Рассказов В.А. Апоптоз как механизм цитопатического действия вируса клещевого энцефалита// Вопросы вирусологии. –1998. -№4. -с.182-186.
Казанова Л.И. Цитофотометрия ДНК как метод оценки пролиферативной активности клеток злокачественных лимфом//I Всесоюзный съезд гематологов и трансфузиологов. Тезисы докл. 22-26 окт. 1979 г., г. Баку. - Москва, 1979. – С.117.
Клиническая иммунология и аллергология / Под ред. Л. Йегера: Пер. с нем. — М., 1990. — Т. 1. — С. 450—460.
Котельников В.М., Модестова Е.В., Касаткина В.В. Комбинированное радиоавтографическое и цитофотометрическое исследование состава и кинетики клеточных популяций при инфекционном мононуклеозе//Проблемы гематологии и переливания крови. –1982. -№9. –с.39-42.
Купчинский Р.А. Значение вируса Эпштейна-Барр и других вирусов в эволюции систем гомеостаза человека-хозяина//Журнал эволюционной биохимии и физиологии.- 1994.- Т30.- №3. –С.15-19.
Леенман Е.Е., Афанасьев Б.В., Пожарисский Н.М. О роли вируса Эпштейн-Барр в патогенезе лимфогранулематоза//Архив патологии. –1999. -№1. –с.15-22.
Львов Н.Д., Мельниченко А.В. Вирусы герпеса человека 6, 7 и 8-го типов – новые патогены семейства Herpesviridae// Вопросы вирусологии. –1999. –№3. -с.105-111.
Мазурина Н.А., Егорова Н.Ю., Чижикова И.Н., Мамедова Е.А., Долгина Е.И. Мононуклеозоподобный синдром цитомегаловирусной этиологии у ребенка раннего возраста// Педиатрия. –1996. -№1. –с.88-89.
Маянский А.Н., Маянский Н.А., Абаджиди М.А., Заславская М.И. Апоптоз: начало будущего//Журнал микробиологии. –1997. –№2. –с.88-94.
Akbar A.N., Borthwick N., Salmon M. The significance of low bcl-2 expression by CD45RO T cells in nirmal individuals and patients with acute viral infections. The role apoptosis in T cell memory // J. Exp. Med. – 1993. – Vol.178, №2. – P. 427-438.
Albeck H., et.al. (1985). Epstein-Barr virus infection and serological profile in Greenland eskimo children// Acta Ped. Scand. –1985. -№74. – P.691-696.
Anagnostopoulos I., Hummel М., Kreschel С. et al. Morphology, immunophenptype and distribution of latently and or productively Epstein—Barr virus// Blood. — 1995. — Vol. 85. N3. — P. 744-750.
Andersson J. e.a. Effut of A cyclovir on infectious mononucleosis// J. Infect. Dis. –1986. –153: 283-290.
Beaulieur A. D., Paquin R., Gosselin J. et al. Epstein—Barr virus modulate de novo protein synthesis in human neutrophils // Blood. - 1996. - Vol. 86, N 7. - P. 2789-2798.
Bevinck J.N.B., Gissmann L., Claas F.H. J. et.al. Relation between skin cancer humoral responses to human papillomaviruses and HLA class II molecules in renal transplant recipients // J. Immunol. – 1993. – Vol. 151, N3. – P. 1579-1586.
Bnuin de P. С., Gruss H. J., Van Der Valk P. CD30 expression in normal and neoplastic lymphoid tissue: biological aspect and clinical implication // Leukemia. — 1995. — Vol. 9. N 10, P. 1620-1627.
Cozad J. Infectious mononucleosis // Nurse Pract. – 1996. – Vol.21, №3. – P14-16, 23, 27-28.
De Paoli P., Gennari D., Martelly. Gamma delta T cell receptor-bearing lymphocytes during Epstein-Barr virus infection // J. Infect. Dis. – 1990. - Vol.161, №5. – P.1013-1016.
Di Giuseppe J. A., Wu T. C., Zehnbauer B. A. et. ai. Erstein—Barr virus and progression of non-Hodgkin's lymphoma to Ki-I-positive, anaplastic large cell phenotype // Mod. Pathol. —- 1995. - Vol. 8, N 5. - P. 553-559.
Epstein—Barr virus silver anniversary // Lancet. — 1989. — W Vol. I, N 8648. - P. 1171-1173.
Epstein—Barr virus// Blood. — 1995. — Vol. 85. N3. — P. 744-750.
Foss H. D., Anagnostopoulos /., Herbst H. et al. Patterns of cytokine gene expression in peripheral T-cell lymphoma of angioimmunoblastic lymphadenopathy type // Blood. — 1995. - Vol. 85, N 10. - P. 2862-2869.
Garrido F., Caberra Т.. Lopes-Nevot M. A., Ruiz-Cabello F. HLA-class I antigens in human tumors // Adv. Cancer Res. — 1995. - Vol. 67, N 1. - P. 155-185.
Gibbons D. L., Rowe M., Cope A. P. et al. Lymphotoxin acts an autocrine growth factor for Epstein—Barr virus transformed B-cells and differentiated Burkitt lymphoma cell line // Eur. J. Immunol. - 1994. - Vol. 24, N 8. - P. 1879-1885.
Gogusev J., Tentsch В., Morin M. T. Inhibition of HLA class 1 antigen and m-RNA expression induced by Rons sarcoma virus in transformed human fibroblasts // Proc. natl. Acad. Sci. USA. - 1988. - Vol. 85. N 1. - P. 203-209.
Gosselin J., Menezes J. et al. Inhibition of tumor necrosis factor-alfa transcription by Epstein—Barr virus // Eur. J. Immunol. - 1991. - Vol. 21, N 1. - P. 203-208.
Grasi G., Balistreri М., Schito G. C. Recombinant antigens in the serodiagnosis of EBV-infections // Biotest Bull. — 1993. —Vol.5, N 1.- P. 47-50.
Gratama J.W., Oosterveer M.A., Weimar W. Detection of multiple “Ebnotypes” in individual Epstein-Barr virus carriers following lymphocyte transformation by virus derived from peripheral blood and oropharynx // J. Gen. Virol. – 1994. – Vol.75, №1. – P.85-94.
Hinderer W., Nebel-Schicel Н., Horn S. et al. The Biotest Anti-EBV recombinant ELISA system recent studies, progress in interpretation, and future trends// Ibid. — P. 33—46.
Imai S. Virological and immunological studies on inapparent Epstein-Barr virus infection in healthy individuals: in comparison to immunosuppressed patients and patients with infectious mononucleosis // Hokkaido Igaku Zasshi. – 1990. - Vol.65, №5. – P.481-492.
Imreh M. P., Zhang Q. J., de-Campos-Lima P. 0. et al. Mech-anisms of alele-selective down-regulation of HLA class 1 in Burkitt's lymphoma // Int. J. Cancer. — 1995. — Vol. 62, N 1. - P. 90-96.
Jiang C., Lu J., Garia G. Dezoxyribonuclease induction in apoptotic cytotoxic T-lymphocytes // Biochem. Biophys. Res. Commun. – 1993. – Vol.194. – P.836-841.
Joseph G., Smith K., Penn I. HLA-antigens and posttransplantant lymphoproliferative disorders // Blood. — 1994. — Vol. 84, N 10 - Suppl. - P. A 614.
Kanegane H., Kanegane C., Yachie A. Infectious mononucleosis as a disease of early childhood in Japan caused by primary Epstein-Barr virus infection // Acta Paediatr. Jpn. – 1997. – Vol.39, №2. - P.166-171.
Kanegane H., Shintani N., Miyamori C. Peripheral blood lymrhosytes sub>populations in three infants with hepatosplenomegaly caused by cytomegalovirus infection // Acta Paediatr. Jpn. – 1995. – Vol.37,№3. - P.370-373.
Khanna R., Burrows S.R., Moss D.J. Immune regulation in Epstein-Barr virus-associated diseases // Microbiol. Rev. – 1995. – Vol.59,№3. – P.387-405.
Kube D., Platzer C., von Knethen A. et. al. Isolation of the human interleukin 10 promoter. Characterization of the promoter activity in Burkitt's lymphoma cell line // Cytokine. — 1995. -Vol. 7. N 1. - P. 1-7.
Lewin N., Aman P., Akerlund B. Epstein-Barr virus-carrying B cells in the blood during acute infectious mononucleosis give rise to lymphoblastoid lines in vitro by release of transforming virus and by proliferation // Immunol. Lett. – 1990. - Vol.26,№1. – P.59-65.
Marmur J. Electrophoresis DNA on a agarose gel // J. Molec. Biol. – 1961. - №3. – Р.208-218.
Masucci M. C., Torsteindottir S., Colimbani J. et al. Down regulation of class 1 HLA antigens of the Epstein—Barr virus-encoded latent membrane protein in Burkit lymphoma lines // Proc. natl. Acad. Sci. USA. - 1987 - Vol. 84. N 3. -P. 4567-4571.
Matter L., Gorgievski М., Montandon A. et al. Epstein—Barr virus (EBV) antibody patterns and circulating EBV in innuno compromised hosts // Ibid. — P. 27—32.
Mayer I., Schwarzmann F., Reischl U., Wolf Н. Pathobiology of Epstein-Barr virus and related diseases // Ibid. — P. 3—12.
Moss D.J., Burrows S.R., Khanna R. Immune surveillance against Epstein-Barr virus // Semin. Immunol. – 1992. – Vol.4, №2. – P.97-104.
Murtagh J. Acute sore throat // Aust. Fam. Physician. – 1990. - Vol.19, №7. – P.1111-1115.
Naher H., Petzoldt D. Epstein-Barr virus infection — a lympho-andepitheliotropic infection // Hautarzt. – 1992. - Vol.43, №3. – P.114-119.
Nakata M., Kawasaki A., Azuma M. Expression of perforin and cytolytic potential of human peripheral blood lymphocyte sub>populations // Int. Immunol. – 1992. – Vol.4, №9. – P.1049-1054.
Nicolas J.C., Marechai V., Dehee A. Epstein-Barr virus // Bull. Acad. Natl. Med. – Vol. 181, №6. – P.981-996.
Paull J.R., Bunnell W. The presente of heterophile antibodies in infectious mononucleosis// Am.J.Med.Sci. –1932. –183-190.
Ribera E., Ocana I., Almirante B. Autoimmune neutropenia and thrombocytopenia associayed with development of antibodies to human immunodeficiecy virus // Immunol. Cell. Biol. – 1989. – Vol.67, №1. – P.49-55.
Ritter S., Schroder S., Uy A. Haemolisis in hepatitis A infections coinciding with the occurrence of autoantibodies aganst triosephosphate isomerase and the reactivation of latent persistent Epstein-Barr virus infection // J. Med. Virol. – 1996. – Vol.50, №3. – P.272-275.
Schuster V., Seidenspinner S., Kreth Н. W. Epstein—Barr virus related diseases in childhood // Ibid. — P. 13—20.
Shuster V., Kreth N.W. Epstein-Barr virus infection and associated diseases in children. II. Diagnostic and theraeutic strategies // Eur. J. Pediatr. – 1992. – Vol.151, №11. – P.794-798.
Straus S.E., Cohen J.I., Tosato G. Epstein-Barr virus infections: biology, pathogenesis and menegement // Ann. Intern. Med. – 1993. – Vol.1118, №1. – P45-58.
Taga H., Taga K., Wang F. Human and viral interleukin-10 in acute Epstein-Barr virus-induced infectious mononucleosis // J. Infect. Dis. – 1995. – Vol.171, №5. – P.1347-1350.
Titov L. P., Gourmanchuk I. Е., Ignatenko S. I., IgE biosyntesis children from Belarus region contaminated with radionuclides after the Chernobyl disaster // American College of Allergy, Asthma, Immunology: Abstract Book: Boston, 1996. — P. 53.
Titov L. P., Kharitonic G. D., Gourmanchuk I. Е., Ignatenko S. I. Effects of radiation on the production of innunoglobulins in children sub>sequent to the Chernobyl disaster // Allergy Proc. - 1995. - Vol. 16, N 4. - P. 185-193.
Toren A., Don-Bassat I., Rechavi G. et al. Infectious agent and environmental factors in lymphoid malignancies // Blood Rev. - 1996. - Vol. 10, N 2. - P. 89-94.
Uehara T., Miyawaki T., Ohta K. Apoptotic cell death of primed CD45RO+T lymphocyte in Epstein-Barr virus-induced infectious mononucleosis // Blood. – 1992. – Vol.80, №2. – P.452-458.
Verdium C. M., Watson D. A., Van Dijk H., Verhoef J. Constitutional Resistance to Infection. — New York, 1995.
Wakasugi N.. Tagaya Y., Mitsui A. et al. Adult T-cell leukemia factor/thiredoxin, produced by both human HTLV type I and Epstein—Barr virus-transformed lymphocytes. acts as an autocrine growth factor and synergise with interleukin I and interkeukin 2 // Proc. Natl. Acad. Sci. USA. — 1990. — Vol. 87, N 2. - P. 8282-8286.
Wilson A.D., Redchenko I., Williams N.A. CD4+T cells ingibit grows of Epstein-Barr virus-transformed B cells through CD95-CD95 ligand-mediated apoptosis // Int. Immunol. - 1998. – Vol.10,№8. – P.1149-1157.
Wising P.J. Some experiments with lymph gland material from cases of infectious mononucleosis// Acta Med. Scand. –1939. –98:328.
Wising P.J. Successful transmission of infectious mononucleosis to man bu transfusion of heparininized blood// Acta Med. Scand. –1942. –109:507.
Wolf Н.. Bogedan C., Schwarzman F. Epstein—Barr virus and its interaction wirh the host // Intervirology. — 1993. — Vol. 35, N 1. - P. 26-39.
Wurtzler P. Diagnosis of Epstein-Barr virus infections // Biotest Bull.-1993.- Vol.5, №1.- P.21-26.
Wutzler P. Diagnosis of Epstein—Barr virus infections // Biotest Bull. - 1993. - Vol. 5, N1. - P. 21-26.
Таблица 3.
Оценка жизнеспособности лимфоцитов периферической крови у детей с инфекционным мононуклеозом и мононуклеозоподобным синдромом (% мертвых клеток), Хm
-
Группы
исследования
До инкубации
После инкубации
Спонтанный апоптоз
Индуцированный апоптоз
Здоровые дети
5,170,25
13,150,98; p0,001
18,891,07; p0,001
Дети, больные ИМ
1 группа
5,920,6
14,251,60; p0,001
17,581,73; p0,001
2 группа
5,520,68
11,711,72; p0,01
20,711,58; p0,001
3 группа
5,110,46
14,322,98; p0,01
21,473,19; p0,001
Дети, больные МПС
1 группа
6,000,46
13,421,02; p0,001
18,541,32; p0,001
2 группа
5,460,66
13,461,30; p0,001
16,151,97; p0,001
3 группа
5,730,47
14,822,14; p0,001
19,731,88; p0,001
Примечание: Р – достоверность различий по сравнению с показателями той же группы в доинкубационном
периоде.
Таблица 5.
Морфологические формы апоптоза лимфоцитов периферической крови у детей с инфекционным мононуклеозом и мононуклеозоподобным синдромом (%), Хm
-
Группы исследования
Апоптозные клетки
Апоптозные тела
Спонтанный апоптоз
Индуцированный апоптоз
Спонтанный апоптоз
Индуцированный апоптоз
Здоровые дети
26,381,73
33,171,52
9,550,78
11,000,94
Дети, больные ИМ
1 группа
22,702,85
27,752,54; p>1>0,05
7,801,11
9,450,93
2 группа
21,252,82
26,883,06; p>1>0,01
8,060,92
9,631,50
3 группа
24.313,14
30,293,54
7,821,49
8,791,63
Дети, больные МПС
1 группа
22,461,95
27,891,94; p>1>0,05
7,970,96
8,791,03
2 группа
23,083,21
31,003,14
9,501,23
11,171,46
3 группа
31,623,71
31,162,45
10,982,55
12,052,39
Таблица 4.
Содержание фрагментированной ДНК в лимфоцитах периферической крови с у детей с инфекционным мононуклеозом и мононуклеозоподобным синдромом (%), Хm
-
Группы
исследования
Спонтанный апоптоз
Индуцированный апоптоз
Здоровые дети
50,121,72
48,852,18
Дети, больные ИМ
1 группа
47,682,67
38,483,80; p>1>0,05
2 группа
47,912,06
40,721,81; p>1>0,01
3 группа
49,501,70
52,292,34; p>3>0,05
Дети, больные МПС
1 группа
50,242,79
40,732,51; p>1>0,05
2 группа
49,471,36
49,211,91; p>2>0,05; p>4>0,01
3 группа
45,622,60
48,213,09
Таблица 1.
Распределение обследованных детей в зависимости от методов и сроков исследования, чел.
-
Группы
исследования
Показатели периферической крови
Оценка жизнеспособности лимфоцитов
Содержание фрагментированной ДНК
Морфологические формы апоптоза
Здоровые дети
58
48
31
29
Дети, больные ИМ
1 группа
35
12
17
20
2 группа
26
21
26
16
3 группа
23
19
9
10
Дети, больные МПС
1 группа
42
26
28
29
2 группа
16
13
10
12
3 группа
12
11
6
10
Примечание: здесь и в таблицах 2,3,4 и 5 приняты сокращения: ИМ- инфекционный мононуклеоз;
МПС- мононуклеозоподобным синдромом.
Таблица 2.
Показатели периферической крови у у детей с инфекционным мононуклеозом и мононуклеозоподобным синдромом, Хm
|
Общее количество лейкоцитов |
Лимфоциты |
Атипичные мононуклеары |
Моноциты |
Сегментоядерные нейтрофилы |
Палочкоядерные нейтрофилы |
Эозинофилы |
|||
Здоровые дети |
Абс.,Г/л |
5,980,22 |
2,89 0,17 |
0,13 0,03 |
0,31 0,03 |
2,38 0,15 |
0,05 0,01 |
0,12 0,02 |
|
|
Отн., % |
49,051,87 |
2,07 0,32 |
5,60 0,58 |
40,12 1,82 |
0,79 0,15 |
1,87 0,26 |
|||
|
Дети, больные ИМ |
1 группа |
Абс.,Г/л |
10,150,67 p>1>0,001 |
5,13 0,42 p>1>0,001 |
1,87 0,31 p>1>0,001 |
0,73 0,13 p>1>0,001 |
2,01 0,26 |
0,29 0,07 p>1>0,001 |
0.09 0,02 |
|
Отн., % |
52,09 3,04 |
16,80 2,36 p>1>0,001 |
7,00 1,07 |
20,29 2,28 p>1>0,001 |
2,43 0,50 p>1>0,001 |
1,03 0,28 p>1>0,05 |
|||
|
2 группа |
Абс., Г/л |
7,38 0,79 p>1>0,05 p>2>0,01 |
4,31 0,40 p>1>0,001 |
0,63 0,10 p>1>0,001; p>2>0,01 |
0,30 0,06 p>2>0,01 |
1,92 0,32 |
0,05 0,01 p>2>0,01 |
0,51 0,03 |
|
|
Отн., % |
59,98 2,55 p>1>0,01 |
8,61 1,17 p>1>0,001; p>2>0,01 |
3,69 0,66 p>2>0,05 |
24,67 2,70 p>1>0,001 |
0,58 0,14 p>2>0,01 |
1,91 0,32 p>2>0,05 |
|||
|
3 группа |
Абс.,Г/л |
6,75 0,65 |
4,01 0,40 p>1>0,01 |
0,38 0,05 p>1>0,001; p>3>0,05 |
0,20 0,03 p>1>0,05 |
1,84 0,34 |
0,11 0,05 |
0,18 0,05 |
|
|
Отн., % |
60,13 2,59 p>1>0,01 |
5,52 0,70 p>1>0,01; p>3>0,05 |
3,17 0,54 p>1>0,05 |
26,52 2,97 p>1>0,001 |
1,74 0.74 |
2,39 0,54 |
|||
|
Дети, больные МПС |
1 группа |
Абс.,Г/л |
9,67 0,70 p>1>0,001 |
5,14 0,52 p>1>0,001 |
1,34 0,21 p>1>0,001 |
0,50 0,08 p>1>0,05 |
2,22 0,33 |
0,25 0,06 p>1>0,001 |
0,15 0,03 |
|
Отн., % |
53,50 3,09 |
13,27 1,80 p>1>0,001 |
4,79 0.59 |
23,42 2,71 p>1>0,001 |
2,76 0,57 p>1>0,001 |
1,65 0,33 |
|||
|
2 группа |
Абс.,Г/л |
7,73 0,70 p>1>0,01 |
4,14 0,36 p>1>0,01 |
0.69 0,19 p>1>0,001 |
0,51 0,08 p>1>0,01; p>4>0,05 |
2,15 0,34 |
0,14 0,04 p>1>0,01; p>4>0,05 |
0,09 0,02 |
|
|
Отн., % |
55,06 2,99 |
8,06 1,79 p>1>0,001 |
6,06 0,74 p>4>0,05 |
27,81 3,61 p>1>0,01 |
1,50 0,34 p>1>0,05; p>4>0,01 |
1,31 0,34 |
|||
|
3 группа |
Абс.,Г/л |
7,00 0,62 |
4,32 0,52 p>1>0,01 |
0,66 0,15 p>1>0,001; p>4>0,05 |
0,24 0,04 p>3>0,05 |
1,56 0,31 |
0,06 0,02 |
0,13 0.05 |
|
|
Отн., % |
61,08 3,32 p>1>0,01 |
8,92 1,33 p>1>0,001; p>4>0,05 |
3,50 0,57 p>3>0,05 |
23,5 3,84 p>1>0,001 |
0,92 0,26 |
1,75 0,51 |
Примечание; здесь и в таблицах 4и 5 p>1 >– достоверность различий по сравнению с показателями здоровых детей;
р>2 >- достоверность различий по сравнению с показателями 1 группы больных;
р>3>- достоверность различий по сравнению с показателями 2 группы больных;
р>2 >- достоверность различий по сравнению с больными ИМ соответствующей группы.
ИССЛЕДОВАНИЕ АПОПТОТИЧЕСКОЙ АКТИВНОСТИ ЛИМФОЦИТОВ ПЕРИФЕРИЧЕСКОЙ КРОВИ IN VITRO ПРИ ИНФЕКЦИОННОМ МОНОНУКЛЕОЗЕ И МОНОНУКЛЕОЗОПОДОБНОМ СИНДРОМЕ
Научные руководители: чл.-корр. РАМН, профессор В.В. Новицкий, к.м.н. О.И.Уразова
Цель исследования: Установить особенности апоптотической активности лимфоцитов периферической крови при инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом.
Задачи исследования:
Охарактеризовать количественные показатели периферической крови у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Провести оценку жизнеспособности лимфоцитов периферической крови у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Оценить содержание фрагментированной ДНК в лимфоцитах периферической крови у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Оценить содержание лимфоцитов периферической крови с морфологическими признаками апоптоза у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом в различные фазы течения и в отдаленном периоде после болезни;
Установить особенности и оценить степень изменений апоптотической активности лимфоцитов при инфекционном мононуклеозе и мононуклеозоподобном синдроме в зависимости от сроков исследования.
Выводы:
У детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом, в острый период болезни на фоне повышения общего количества лейкоцитов, обусловленного увеличением содержания моноцитов, палочкоядерных нейтрофилов, АМ и абсолютного числа лимфоцитов, содержание сегментоядерных нейтрофилов снижается.
В период клинического выздоровления у больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом содержание лимфоцитов и АМ остается повышенным, количество моноцитов и гранулоцитов нормализуется. Данные изменения сохраняются в катамнезе. У детей, перенесших ИМ развивается моноцитопения.
Жизнеспособность и спонтанная апоптотическая активность лимфоцитов периферической крови у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом не изменяется.
Количество апоптотически измененных клеток и содержание фрагментированной ДНК, при индукции апоптоза лимфоцитов периферической крови in vitro у детей, больных инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом снижено.
В период реконвалесценции у детей, больных острыми инфекционными заболеваниями с мононуклеозоподобным синдромом, количество апоптотически измененных клеток и содержание фрагментированной ДНК нормализуется, в то время как у больных ИМ сохраняется сниженным.
В отдаленном периоде после болезни у детей с инфекционным мононуклеозом и острыми инфекционными заболеваниями с мононуклеозоподобным синдромом показатели апоптотической активности лимфоцитов периферической крови соответствуют норме.
При ИМ и МПС наблюдается угнетение Апоптотическая активность лимфоидных клеток при инфекционном мононуклеозе и мононуклеозоподобном синдроме ниже таковой у здоровых детей, что проявляется снижением числа апоптотически измененных клеток и ДНК-фрагментации. У больных ИМ данные изменения носят более выраженный характер, сохраняются в фазу реконвалесценции, и восстанавливаются лишь в отдаленном периоде после болезни.