Денервация и регенерация синаптических связей
Денервация и регенерация синаптических связей
Денервация и регенерация синаптических связей
В нервной системе позвоночных при нарушении целостности аксона происходит дегенерация дистальной части этого отростка. Кроме того, развивается комплекс дегенеративных явлений в самом поврежденном нейроне, в иннервируемой им клетке, а также в нейроне, являющемся пресинаптическим по отношению к поврежденному. Изменения происходят вследствие нарушения аксонального транспорта трофических факторов, которые контролируют нейрональную дифференцировку и выживание нейронов, а также как результат перестройки паттерна электрической активности.
Волокна скелетной мышцы позвоночных после денервации становятся более чувствительными к ацетилхолину и начинают экспрессировать ацетилхолиновые рецепторы по всей своей поверхности. Прямая электрическая стимуляция денервированных гиперчувствительных мышц приводит к сужению участка, чувствительного к ацетилхолину, до размеров исходной концевой пластинки. Активность мышцы влияет также на скорость оборота ацетилхолиновых рецепторов. Эффекты активности опосредуются входом ионов кальция в клетку и активацией внутриклеточных вторичных посредников. В отличие от иннервированных мышечных волокон, денервированные мышцы допускают иннервацию в любом месте своей поверхности. Денервированные мышечные волокна не только обладают повышенной склонностью к реиннервации, но даже стимулируют неповрежденные нервные окончания к разрастанию и формированию новых отростков (спраутинг). Подобным же образом нейроны, лишенные иннервации, становятся гиперчувствительными к трансмиттерам и стимулируют развитие близлежащих нервных окончаний.
Способность поврежденных аксонов к регенерации и реиннервации исходных мишеней колеблется в широких пределах от вида к виду. У безпозвоночных и низших позвоночных, таких как лягушки и тритоны, поврежденные аксоны успешно регенерируют и с высокой точностью восстанавливают исходные синаптические контакты. К этому способны и аксоны у эмбрионов и новорожденных высших позвоночных, включая млекопитающих. У высших позвоночных аксоны периферической нервной системы взрослых животных также отрастают после их повреждения. Если периферический нерв был передавлен, регенерирующие аксоны направляются к их исходным периферическим мишеням с помощью эндоневрия и базальной мембраны шванновских клеток. В результате этого возможно полное восстановление потерянной функции. Если же периферический нерв был перерезан, реиннервация мишеней бывает часто неполная и неточная. Аргин и другие факторы, ассоциированные с синаптической частью базальной мембраны мышечного волокна, инициируют образование специализированных пре--и постсинаптической структур в регенерирующем нерве и мышечных клетках.
Для центральной нервной системы взрослых млекопитающих способность к регенерации весьма ограничена. Нейроны ЦНС взрослых млекопитающих обладают способностью к спраутингу и формированию новых синапсов только на коротких дистанциях. Рост аксонов на большие расстояния может происходить или через трансплантаты, полученные из периферических нервов, или через неповрежденные участки ЦНС. Кроме того, эмбриональные нейроны и стволовые клетки, имплантированные в ЦНС взрослых животных, способны к дифференцировке, удлинению отростков и могут адекватно интегрироваться в сохранившиеся нейрональные сети. Техника трансплантации позволяет надеяться на преодоление функционального дефицита, возникающего в результате повреждений ЦНС и нейродегенеративных заболеваний.
Нервная система многих видов имеет поразительную способность успешно восстанавливать специфические синаптические соединения, которые были нарушены в результате травмы. Регенеративные способности нейронов ЦНС впервые были продемонстрированы Матти, который в 1920-х годах рассек оптический нерв тритона и обнаружил, что зрение у этого животного было восстановлено в течение нескольких недель после операции1). В начале 1940-х годов Сперри, Стоун и их коллеги, используя эти регенеративные возможности, исследовали, по какому механизму формируются специфические соединения в нервной системе. Их эксперименты по регенерации зрительной системы лягушек и рыб подтвердили идею, согласно которой нейроны селективно иннервируют свои мишени уже во время регенерации, а не создают первичные случайные контакты, реорганизуемые позднее2). Позже детальные исследования, проведенные на пиявках, сверчках и речных раках, убедительно продемонстрировали, что аксоны идентифицированных нейронов безпозвоночных после перерезки способны найти и точно соединиться с исходными синаптическими партнерами, игнорируя множество других потенциальных мишеней. В противоположность этому, регенерация поврежденных нервных соединений в нервной системе взрослого млекопитающего либо является лишь частичной, либо отсутствует вовсе.
В этой главе мы опишем изменения, которые происходят в нейроне и окружающих глиальных клетках после пересечения аксона, а также эффекты денервации, развивающиеся в постсинаптических клетках-мишенях. Затем мы рассмотрим способность нейронов развивать новые аксоны, восстанавливать синаптические контакты с клетками-мишенями и компенсировать утраченные функции. Наконец, мы обсудим возможность восстановления нейронов, утраченных в результате травмы или заболевания.
Изменения в аксотомированных нейронах и окружающих глиальных клетках
Валлеровская дегенерация
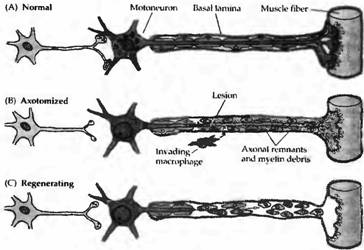
После перерезки чувствительных или двигательных волокон периферического нерва наблюдается характерная очередность морфологических и функциональных изменений (рис. 1). Прежде всего дегенерации подвергается листальная часть этого волокна, а также небольшой участок проксимальной части нерва. Шванновские клетки, формирующие миелиновую оболочку дистального сегмента нерва, дегенерируют, пролиферируют и вместе с макрофагами фагоцитируют аксональные и миелиновые остатки. Такая реакция названа перерождением Валлера по имени анатома девятнадцатого столетия Августа Валлера, впервые описавшего ее. Клеточное тело и ядро разбухают, ядро перемешается из своего типичного положения в центре на периферию. Кроме того, нарушается упорядоченное строение части шероховатого эндоплазматического ретикулума, которая называется субстанцией Ниссля Снижение интенсивности окраски субстанции Ниссля, следующее за аксотомией, известно как хроматолиз.
|
Рис. 1. Дегенеративные изменения после аксотомии. (А) Типичный мотонейрон взрослого позвоночного. (В) После аксотомии нервное окончание, дистальный участок аксона и короткий отрезок проксимального участка аксона подвергаются дегенерации. Шван новские клетки утрачивают способность к дифференцировке, пролиферируют и вместе с вторгшимися микроглиальными клетками и макрофагами фагоцитируют аксональные и миелиновые остатки. Аксотомирован ный нейрон подвергается хроматолизу, пресинаптические окончания подвергаются ретракции. Дегенеративные изменения могут происходить в пре- и постсинаптических клетках. (С) Аксон регенерирует вдоль |
колонок шванновских клеток внутри эндоневральной трубки и базальной мембраны, окружавшей исходный аксон. |
Через несколько часов после перерезки начинается рост новых аксональных отростков, происходящих от перерезанного конца нервного волокна, и процесс регенерации. Если нейрон успешно восстановил контакт с мишенью, клеточное тело приобретает исходный внешний вид. Хроматолиз происходит не только в периферических нервах, но также и после повреждения аксонов в центральной нервной системе.
В организме взрослых животных реакция нейронов, не восстановивших контактов со своими мишенями, может быть различной. Пересечение аксонов оптического нерва приводит к быстрой гибели ганглиозных клеток сетчатки. Большинство клеток переднего базального таламуса выживают после повреждений коры, хотя при этом они существенно атрофируются. Чувствительные нейроны задних корешков спинного мозга и мотонейроны после перерезки их аксонов в периферическом нерве, как правило, погибают. Немногие выжившие при этом клетки в значительной степени атрофируются. Большинство аксотомированных клеток автономного ганглия выживают, но они уменьшаются в размерах и становятся менее чувствительными к ацетилхолину.
Ретроградные транссинаптические эффекты аксотомии
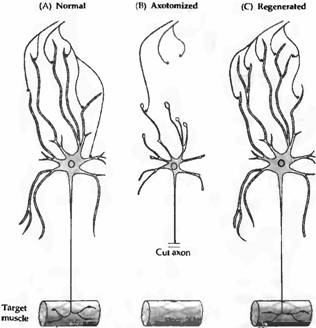
Аксотомия может также вызывать изменения в нейронах, посылающих синаптический сигнал к поврежденной клетке. Например, после аксотомии клеток автономного ганглия цыпленка, крысы или морской свинки, синаптические сигналы в клетках ганглия становятся менее эффективными. Это отчасти является результатом сниженной чувствительности аксотомированной клетки к нейротрансмиттеру ацетилхолину. Кроме того, как результат ретроградных транссинаптических влияний, происходит ретракция пресинаптических окончаний, а оставшиеся терминали освобождают меньше квантов трансмиттера (рис. 2). Таким образом, повреждение нейрона нарушает его способность поддерживать высокоэффективный пресинаптический сигнал. Ротшенкер показал и другой пример ретроградного транссинаптического влияния, наблюдаемый в мотонейронах лягушки и мыши. После перерезки моторного нерва на одной стороне тела происходит формирование новых синапсов и спраутинг аксонов интактных мотонейронов, иннервируюших соответствующую мышцу другой стороны тела. Сигнал распространяется от аксотомированных нейронов, пересекает спинной мозг и воздействует на неповрежденные мотонейроны на другой стороне животного. Важно отметить, что мотонейроны, иннервирующие другие мышцы, при этом не затрагиваются.
Трофические субстанции и эффекты аксотомии
Ряд эффектов аксотомии — хроматолиз, атрофия нейронов и гибель клеток — является результатом утраты трофических веществ, продуцируемых тканями-мишенями и транспортируемых по аксону ретроградно с периферии по направлению к телу клетки. Хорошим примером этого является действие фактора роста нервов (NGF) на сенсорные и симпатические нейроны. Так, в автономном ганглии морской свинки эффекты аксотомии воспроизводятся подкожными инъекциями антител к фактору роста нервов или блокированием ретроградного транспорта в постганглионарных нервах. Напротив, эффекты аксотомии в значительной мере предотвращаются аппликацией NGF на ганглий. Подобным же образом ретроградная транссинаптическая атрофия может быть результатом снижения продукции трофических факторов поврежденными нейронами.
|
Рис. 2. Атрофия клеток аксотомированного автономного ганглия и потеря пресинаптических входов. (А) Нормальный нейрон. (В) Через несколько дней после аксотомии нейроны атрофируются большая часть дендритов приобретает варикозные расширения. Многие пресинаптические окончания подвергаются ретракции, а оставшиеся освобождают меньше трансмиттера. (С) Если постганглионарный аксон регенерирует и реиннервирует свою периферическую мишень, свойства клетки и синаптических входов восстанавливаются. |
|
Эффекты денервации на постсинаптические клетки
Нервно-мышечный синапс является удобной моделью для изучения механизмов синаптической передачи, которые приложимы не только к периферическим, но и к центральным синапсам. Сходным образом процессы, происходящие в денервированных мышцах, могут быть хорошим аналогом того, к чему приводит устранение синаптических входов в нейронах ЦНС.
Денервированная мышечная мембрана
В конце девятнадцатого столетия в денервированной скелетной мышце был обнаружен феномен спонтанных асинхронных сокращений, названных фибрилляциями. Фибрилляции инициировались самой мышечной мембраной, а не АХ, хотя большинство спонтанных потенциалов действия, вызывающих фибрилляцию, исходило из участка бывшей концевой пластинки. Начало фибрилляций у крыс, морских свинок или кроликов наблюдалось через 2-5 дней после денервации, тогда как у обезьян и человека этот латентный период занимал более недели.
К моменту начала фибрилляций волокна мышц млекопитающих становятся гиперчувствительными к различным химическим агентам. Это значит, что концентрация веществ, требуемых для возбуждения мышцы, снижается в сотни или тысячи раз. Например, денервированная скелетная мышца млекопитающего примерно в 1000 раз более чувствительна к АХ, добавленному непосредственно в омывающий раствор или инъецированному в артерию, снабжающую мышцу, чем нормально иннервированная мышца17). Потенциал действия в денервированных мышцах также меняется, становясь более устойчивым к тетродотоксину, яду рыбы футу, который блокирует натриевые каналы . Это изменение обусловлено повторным появлением тетродотоксин-резистентных натриевых каналов, которые являются превалирующей формой каналов в незрелой мышце. В денервированной мышце происходят и другие изменения, такие как постепенная атрофия или опустошение мышечных волокон19
-
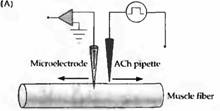
Рис. 3. После денервации в мышце кошки появляются новые АХ рецепторы. (А) Порции АХ наносятся из пипетки, заполненной АХ, на разные участки поверхности мышечного волокна, изменения мембранного потенциала при зтом регистрируются внутриклеточным микроэлектродом. (В) В мышечном волокне с интактной иннервацией АХ вызывает ответ только вблизи концевой пластинки. (С) После 14 дней денервации мышечное волокно отвечает на АХ по всей своей длине.
Появление новых АХ рецепторов после денервации или длительной инактивации мышцы
Гиперчувствительность к ацетилхолину объясняется повышением числа и изменением распределения АХ рецепторов в денервированной мышце. Этот факт был установлен в результате экспериментов, в которых записывали изменения мембранного потенциала мышечного волокна во время ионофоретической аппликации АХ из микропипетки на небольшие участки мышечной мембраны. В нормально иннервированной мышце лягушки, змеи или млекопитающего чувствительным к АХ был только участок концевой пластинки — там, где нервное волокно образует синапс. Остальная мышечная мембрана имела очень низкую чувствительность к медиатору. После денервации область, реагирующая на АХ, значительно увеличивалась, достигая практически равномерной чувствительности поверхности мышцы к АХ (рис. 3). У млекопитающих это занимало около недели; в мышце лягушки изменения были выражены меньше и развивались заметно дольше.
Рецепторы АХ, появляющиеся во внесинаптических областях, не просто диффундируют от области исходной концевой пластинки. Этот факт впервые был установлен в экспериментах Катца и Миледи, в которых мышца лягушки была разрезана на две части. Содержащие ядра фрагменты мышцы, физически отделенные от исходной концевой пластинки, не только выживали, но и развивали повышенную чувствительность к АХ. Главный вывод, который следует из этих экспериментов, заключается в том, что новые АХ рецепторы способны синтезироваться в экстрасинаптических участках денервированных мышц.
Синтез и деградация рецепторов в денервированной мышце
Ценным методом для изучения распределения и реорганизации АХ рецепторов является их мечение радиоактивным бунгаротоксином, который прочно и с высокой специфичностью связывается с АХ рецепторами. Мечение нормальной и денервированной мыши бунгаротоксином подтвердило, что число и распределение центров связывания токсина изменяется после денервации. В постсинаптической мембране нормальной мышцы определяется около 104 сайтов связывания токсина на мкм2, в сравнении с менее чем 10/мкм2 во внесинаптической области. После денервации число АХ рецепторов во внесинаптических участках возрастает до 103/мкм2, тогда как в синаптической зоне плотность центров связывания бунгаротоксина меняется незначительно.
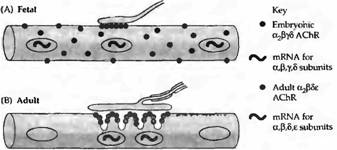
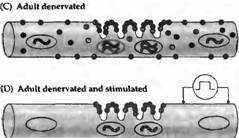
Рост числа АХ рецепторов в денервированной мышце может быть обусловлен их усиленным синтезом. Действительно, скорость появления новых рецепторов заметно повышается после денервации, и вещества, блокирующие синтез белка (такие как актиномицин или пуромииин), предупреждают этот эффект. Нозерн блоттинг и гибридизация in situ показывают, что в нормальной мышце мРНК для субъединиц АХ рецептора синтезируют только несколько ядер, локализующихся в непосредственной близи от концевой пластинки. В противоположность этому, при денервации гены АХ рецептора активируются по всей протяженности мышечного волокна (рис. 4).
Денервация оказывает также влияние на композицию субъединиц и скорость деградации АХ рецепторов. Во взрослой мышце синаптические и экстрасинаптические АХ рецепторы содержат субъединицу с периодом полураспада около 10 дней. После денервации период полураспада рецепторов, содержащих субъединицу и сохраняющихся в области концевой пластинки, уменьшается до 3 дней. Оборот рецепторов может быть вновь замедлен реиннервацией или повышением концентрации внутриклеточного цАМФ и последующей активацией протеинкиназы А.
Новые рецепторы, синтезированные в денервированной мышие (синаптические или внесинаптические), похожи на эмбриональные. Они содержат субъединицу и имеют оборот с периодом полураспада 1 день. Эта скорость оборота АХ рецепторов может быть снижена экзогенным АТФ, действующим через пуринергические рецепторы.
Роль инактивации мышцы в денервационной гиперчувствительности
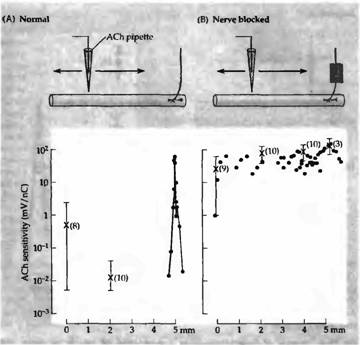
Каким образом перерезка двигательного нерва приводит к появлению новых АХ рецепторов — через инактивацию мышцы или через какие-то другие механизмы? Для исследования этой проблемы Ломо и Розенталь блокировали проведение импульсов по двигательному нерву крысы аппликацией местного анестетика или дифтерийного токсина. Вещества апплицировались с помощью манжеты, наложенной на участок нерва на некотором расстоянии от мышцы. Этот метод приводил к эффективной инактивации мышцы, так как двигательные импульсы не проводились дальше манжеты. Тестовая стимуляция нерва дистальнее блокированного участка приводила к обычному сокращению мышцы. Кроме того, происходила нормальная генерация миниатюрных потенциалов концевой пластинки, свидетельствуя, что синаптическая передача была интактна. После 7 дней блока нерва мышца становилась гиперчувствительной (рис. 5). Другими экспериментами было показано, что новые внесинаптические рецепторы появляются тогда, когда нервно-мышечная передача блокирована долговременной аппликацией кураре или бунгаротоксина. Эти результаты показали, что денервационная гиперчувствительность связана с потерей синаптической активации мышцы.
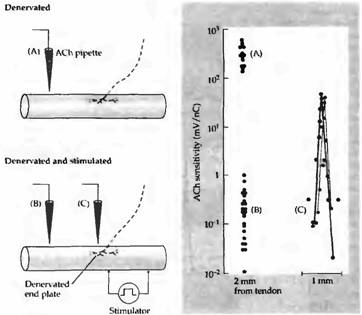
Важность мышечной активности как фактора, контролирующего реакцию мышцы на АХ, была подтверждена в экспериментах, в которых гиперчувствительные денервированные мышцы крысы прямо стимулировали через имплантированные электроды. Повторяющаяся в течение нескольких дней стимуляция мышц сокращала область, чувствительную к АХ, до уровня исходного синаптического участка (рис. 4D и 6). Спонтанная сократительная активность мышцы в этих условиях была слишком низкой для того, чтобы обратить эффекты денервации на распределение АХ рецепторов
|
Рис. 4. Синтез и распределение АХ рецепторов в мышце крысы. (А) В эмбриональных мышцах АХ рецептора экспрессируется в ядрах по всей протяженности мышечного волокна. Эмбриональная форма рецептора определяется по всей поверхности мышечного волокна и аккумулируется в зоне иннервации. (В) Во взрослых мышцах мРНК экспрессируется только в ядрах, располагающихся непосредственно под концевой пластинкой. . (С) В денервированных взрослых мышцах ядра непосредственно под концевой пластинкой экспрессируют; все другие ядра экспрессируют эмбриональную. Эмбриональные АХ рецепторы найдены на всей поверхности мышечных волокон (обеспечивая таким образом денервационную гиперчувствительность), включая постсинаптическую мембрану; взрослая форма рецептора ограничена участком концевой пластинки. (D) При прямой стимуляции денервированных мышц |
паттерн экспрессии АХ рецептора напоминает таковой в иннервированном мышечном волокне. |
|
Рис. 5. В мышце крысы блокирование нервной проводимости приводит к появлению новых АХ рецепторов. (А) В нормальной мышце чувствительность к АХ ограничена участком концевой пластинки. (В) После блокады двигательного нерва в течение 7 дней местным анестетиком чувствительность к АХ распространяется по всей поверхности мышечного волокна. |
|
|
|
Рис. 6. Устранение гиперчувствительности в денервированной мышце крысы прямой стимуляцией мышечных волокон. (А) Увеличение чувствительности во внесинаптической части мышечного волокна после 14 дней денервации. (В) Чувствительность внесинаптического участка денервированной мышцы, сохранявшейся в течение 7 дней без стимуляции, а затем стимулированной с перерывами в последующие 7 дней. Эта процедура устраняла денервационную гиперчувствительность. (С) Чувствительность к АХ двух стимулированных волокон той же мышцы рядом с денервированными участками концевой пластинки. В стимулированной мышце высокая чувствительность к АХ ограничена этим участком. |
|
Роль ионов кальция в развитии гиперчувствительности в денервированной мышце
Каким же образом недостаток мышечной активности приводит к развитию гиперчувствительности? Считается, что ключевым фактором здесь выступает изменение концентрации внутриклеточного кальция. Электрическая активность иннервированной мышцы сопровождается притоком ионов кальция через потенциал-активируемые кальциевые каналы клеточной мембраны. Возросшая концентрация внутриклеточного кальция активирует протеинкиназу С, которая, в свою очередь, фосфорилирует и ингибирует миоген. Миоген является фактором транскрипции, который индуцирует экспрессию генов субъединиц АХ рецептора, а также регулирует ряд других процессов дифференцировки мышцы. Таким образом, в иннервированной мышце приток ионов кальция ингибирует экспрессию генов, контролирующих синтез АХ рецептора, сохраняя общую экспрессию АХ рецепторов на низком уровне. Дополнительные сигналы, которые специфически индуцируют экспрессию АХ рецепторов в ограниченном числе мышечных ядер, располагающихся непосредственно под постсинаптической мембраной, обсуждаются в следующем разделе. В инактивированной (денервированной) мышце приток ионов кальция является сниженным, что устраняет ингибирование и приводит к повышению экспрессии АХ рецепторов.
Изменение времени полураспада АХ рецептора, происходящее в денервированной мышце, также является результатом снижения мышечной активности. Скорость деградации рецептора возрастает как в мышцах, парализованных денервацией, так и в тех, которые обездвижены продолжительной аппликацией тетродотоксина. Наоборот, прямая электрическая стимуляция денервированной мышцы восстанавливает число АХ рецепторов в синаптических зонах до исходного нормального уровня. И в этом процессе вход ионов кальция в мышечное волокно через потенциал-активируемые кальциевые каналы играет важную роль. Снижение скорости деградации АХ рецепторов, индуцированное мышечной активностью, воспроизводится обработкой инактивированных мышц кальциевым ионофором А23187. Напротив, стабилизация АХ рецептора в мембране предупреждается блокаторами кальциевых каналов. Повышение концентрации внутриклеточного цАМФ также замедляет деградацию рецепторов в инактивированных мышцах. Последний факт свидетельствует о том, что приток ионов кальция в мышечное волокно вызывает стабилизацию рецептора через активацию аденилатциклазы и последующие процессы фосфорилирования белка.
Нервные факторы регуляции синтеза АХ рецептора
Мышечная активность является не единственным фактором, поддерживающим нормальное число и композицию рецепторов в скелетных мышцах. Об этом свидетельствуют эксперименты по частичной денервации мышцы, в которых медленно развивающиеся денервационные изменения наблюдались, несмотря на сохранение мышечной активности. Сделать это заключение помогло то, что волокна
длинной портняжной мышцы лягушки иннервируются более чем одним синапсом. Если эта мышца частично денервировалась перерезкой внутримышечных разветвлений нерва, в денервированных участках развивалась типичная гиперчувствительность мышечных волокон к АХ. Однако в целом эти мышечные волокна были активными и сохраняли сократимость по всей длине. Гибридизация in situ в интактной, денервированной и парализованной токсином мышцах крысы показала, что распределение мРНК, кодирующей синтез АХ рецепторов, независимо от мышечной активности, зависит, по крайней мере, от двух нервных факторов. Один из этих факторов стимулирует экспрессию взрослой субъединицы в ядрах, примыкающих к концевой пластинке, а другой фактор угнетает экспрессию субъединицы и подавляет образование мРНК для других субъединиц.
Одним из нервных факторов, регулирующих экспрессию АХ рецептора, является АРМА (ацетилхолиновый рецептор, индуцирующий активность), который был исходно выделен из мозга цыпленка. АРИА синтезируется и секретируется мотонейронами и стимулирует экспрессию всех пяти субъединиц АХ рецептора, и среди них наиболее заметно — синтез субъединицы. АРИА принадлежит к семейству белков, называемых нейрорегулинами. Рецепторы для нейрорегулинов относятся к семейству рецепторов тирозинкиназ, родственных с рецептором I типа для эпидермального фактора роста. Установлено, что несколько субъединиц этого рецептора (erbВ2, erbВЗ и erbВ4) аккумулируется в нервно-мышечном соединении. Стимуляция erbВ рецепторов в мышце активирует два внутриклеточных сигнальных каскада, таких как киназу Ras/митоген-активирующего белка (Ras/MAP) и фосфатидилинозитол 3-киназу (PI-киназа), вызывая, таким образом, усиление экспрессии гена АХ рецептора.
Литература
Sanes, J. R and Lichtman, J.W.. Development of the vertebrate neuromuscular junction. Annu. Rev. Neurosci. 22: 389-442.
Song, H-J., and Poo, M-M.. Signal -tion underlying growth cone gudance by diffusible factors. Curr. Opin. Neurobiol. 9: 355-363.
Walsh, F. S, P. 1997. Neural cell adhesion molecules of the immunoglobulin super-family: Role in axon growth and guidance. Annu Rev. Cell Dev. ВЫ. 3: 425-456.
Zigmond, M., Bloom, F. E., Landis, S., Roberts, J., and Squire, L. R. . Fundamental Neuroscience. Academic Press, New York.