Диагностика и лечение рефрактерной стенокардии
Диагностика и лечение рефрактерной стенокардии
Д.м.н. В.П. Лупанов
Институт клинической кардиологии им. А.Л. Мясникова РКНПК МЗ РФ, Москва
Рефрактерная стенокардия характеризуется следующими признаками:
– наличие объективных показателей ишемии миокарда;
– тяжелые клинические симптомы;
– все известные (и общепринятые) терапевтические средства лечения больных в максимально переносимых дозах должны быть исчерпаны [1].
Больной с рефрактерной стенокардией имеет выраженное ограничение обычной физической активности или не способен ее выполнять без дискомфорта (ФК по Канадской классификации III–IV). У больных имеются объективные доказательства ишемии миокарда (проба с физической нагрузкой, стресс–эхокардиография, сцинтиграфия миокарда с 201–Tl и др.) Симптомы тяжелой стенокардии сохраняются, несмотря на максимально переносимую «агрессивную» антиангинальную терапию (некоторые больные не способны переносить традиционную антиангиальную терапию из–за появления побочных эффектов препаратов).
Рефрактерная стенокардия бывает двух видов: острая и хроническая. Известно, что атеросклероз не является линейным процессом, это, скорее заболевание, имеющее фазы стабильности и нестабильности. Внезапные и непредсказуемые изменения симптоматики являются следствием различной степени деструкции бляшки.
Патогенез острой рефрактерной стенокардии во многих случаях связан с неокклюзирующим просвет сосуда тромбом на поверхности разрушенной или эрозированной атеросклеротической бляшки, поэтому на первое место в лечении в этих случаях выходят антикоагулянты (например, низкомолекулярный гепарин). Следует отличать рефрактерную стенокардию от острого коронарного синдрома, который включает в себя нестабильную стенокардию и инфаркт миокарда. Причиной острого коронарного синдрома считают разрыв атеросклеротической бляшки и образование тромба в месте развившегося дефекта и дистальную окклюзию пораженного коронарного сосуда. Причем наиболее важными детерминантами развития обусловленных тромбозом острых коронарных синдромов являются состав и предрасположенность к разрыву бляшки, а не ее объем и соответствующая тяжесть стеноза.
Стратегия лечения острой формы рефрактерной стенокардии должна базироваться на патогенезе, тяжести симптомов, степени выраженности миокардиальной ишемии, выраженности поражения коронарных артерий, а также на оценке функции левого желудочка, наличии или отсутствии сопутствующих заболеваний.
У больных с рефрактерной стенокардией наиболее вероятно наличие многососудистого поражения коронарных артерий (возможно, поражение основного ствола левой коронарной артерии), чаще определяется дисфункция левого желудочка. Некоторым больным с рефрактерной стенокардией ранее была проведена коронарная ангиопластика (со стентированием), которая осложнилась рестенозом, либо больные перенесли предшествующее коронарное шунтирование, которое в настоящее время осложнилось окклюзией или несостоятельностью шунтов (причем эти пациенты не являются кандидатами для повторных процедур), что и вызвало появление рефрактерных симптомов.
У больных с рефрактерной стенокардией методы реваскуляризации миокарда (аорто–коронарное шунтирование, транслюминальная баллонная коронарная ангиопластика, коронарное стентирование), как правило, невозможны. А попытки максимальной терапии и изменений жизненного статуса больного, включая рациональную комбинацию антиангинальных препаратов, исключение возможной толерантности к нитратам, прекращение курения и лечебных динамических «нагрузочных» программ, не приводят к положительному результату [2,3].
Последствия преходящей ишемии при рефрактерной стенокардии отражают неадекватную оксигенацию миокарда и локальное накопление продуктов метаболизма. Во время ишемии миоциты переключаются с аэробного на анаэробный путь метаболизма. Сниженная продукция АТФ нарушает взаимодействие между сократительными белками и приводит к транзиторному снижению как систолической сократимости, так и диастолической релаксации левого желудочка. К тому же происходит местное накопление продуктов анаэробного метаболизма (например, лактата, серотонина, аденозина). Считается, что одна или несколько из этих субстанций активируют периферические болевые рецепторы сегментов С7–Th4 и вызывают стенокардию. Во время болевого синдрома, сопровождающего острый приступ ишемии, генерализованная симпатическая и парасимпатическая стимуляция может вызвать тахикардию, потливость, тошноту. Поскольку ишемия приводит к внезапному нарушению диастолического расслабления миокарда, транзиторно повышается жесткость левого желудочка и растет внутрижелудочковое диастолическое давление. Повышенное давление передается на легочное сосудистое русло и может вызвать одышку и отек легких. Кроме того, преходящие нарушения транспорта ионов в кардиомиоцитах и локальное накопление метаболитов могут вызывать опасные желудочковые нарушения ритма. После разрешения острого ишемического эпизода (т.е. после восстановления баланса между доставкой кислорода и потребностью в нем) симптомы стенокардии полностью исчезают, а в случае кратковременности ишемии, стойкие повреждения миокарда отсутствуют.
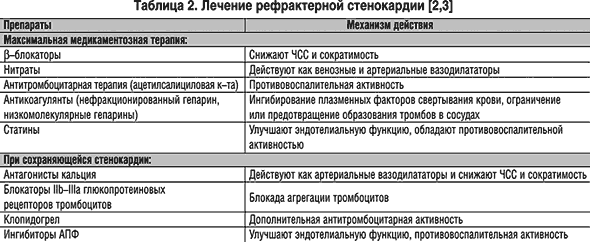
Алгоритм лечения рефрактерной стенокардии включает (табл. 1): 1) использование максимальной медикаментозной терапии (табл. 2): -блокаторы, нитраты (чаще внутривенные инфузии нитроглицерина), антитромбоцитарные (ацетилсалициловая кислота), антикоагулянты (низкомолекулярные гепарины, нефракционированный гепарин), статины.
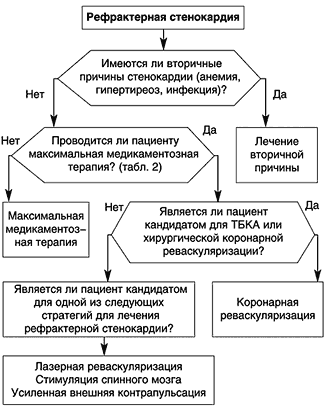
Лечение рефрактерной стенокардии следует начинать с исключения вторичных причин стенокардии. При этом необходимо исключить те вторичные причины (экстракардиальные факторы), которые могут вызывать стенокардию, несмотря на «агрессивную» медикаментозную терапию: неконтролируемую гипертензию, тахикардию, анемию, гипоксию вследствие хронических легочных заболеваний, тиреотоксикоз, инфекции с лихорадкой и другие системные заболевания, которые могут увеличивать потребность миокарда в кислороде.
Антиангинальные и антиишемические препараты. При рефрактерной стенокардии применяются три основных класса антиангинальных препаратов, и чаще их назначают в комбинациях. Однако следует с осторожностью сочетать -блокатор с недигидропиридиновым антагонистом кальция (верапамилом и дилтиаземом), поскольку суммация их отрицательных хронотропных эффектов может привести к чрезмерной брадикардии, а суммация отрицальных инотропных эффектов – к застойной сердечной недостаточности. С целью восстановления баланса между доставкой кислорода к миокарду и потребностью в нем назначаются -блокаторы и нитраты (часто внутривенно). У пациентов, которые ранее не получали -блокаторы, их назначение уменьшает вероятность рефрактерной стенокардии и предотвращает развитие инфаркта миокарда. Применение -блокаторов, особенно бисопролола (Бисогамма) не только уменьшает выраженность симптоматики, но и улучшают прогноз. Результаты последних исследований бисопролола показали, что у больных со стенокардией количество и продолжительность преходящих эпизодов ишемии могут быть значительно уменьшены, лечение сопровождается снижением таких показателей, как летальность и заболеваемость, а также улучшением общего состояния больных. Также Бисогамма уменьшает сердечно–сосудистую летальность и риск развития фатального инфаркта миокарда у больных высокого риска, подвергаемых кардиохирургическим вмешательствам.
Бисогамма способствует повышению толерантности к физической нагрузке в большей степени, чем при применении атенолола и метопролола, вызывает значимое повышение физической нагрузки и дозозависимое действие на переносимость этой нагрузки.
Также бисопролол в значительно большей степени, чем атенолол и метопролол улучшает качество жизни и снижает тревожность, утомление. Международные исследования свидетельствуют, что бисопролол в большей степени повышает качество жизни.
Дозу -блокатора необходимо подбирать таким образом, чтобы ЧСС снизилась до 50–60 в минуту. Напротив, на антагонисты кальция преимущество в лечении не распространяется, т.к. они практически не предотвращают развитие инфарктов и не снижают смертность при нестабильной стенокардии. Поэтому антагонисты кальция при острой рефрактерной стенокардии, как и при нестабильной стенокардии, использовать не следует, отдавая предпочтение препаратам длительного действия, как средствам второго ряда для купирования боли у пациентов, не отвечающих на -блокаторы и нитраты.
Триметазидин показан больным в качестве дополнительного средства в тех случаях, когда не удается достигнуть эффекта при лечении традиционными антиангинальными средствами, а также при наличии побочных эффектов препаратов гемодинамического действия. Триметазидин применяют при рефрактерной стенокардии с диффузной ишемией миокарда вследствие тяжелого атеросклеротического поражения коронарных артерий. У некоторых больных ИБС выявляются циркадные ритмы меняющейся частоты возникновения и продолжительности эпизодов ишемии миокарда (например, в ранние утренние часы), на которые может оказывать влияние триметазидин.
Ингибиторы АПФ дополнительно рекомендуется назначать пациентам с дисфункцией левого желудочка, перенесенным в анамнезе инфарктом миокарда, при сердечной недостаточности, при сопутствующем сахарном диабете, но в отсутствие гипотензии.
Статины. Несмотря на контроль симптомов стенокардии, ни один из классов антиангинальных препаратов не позволяет замедлить или обратить атеросклеротический процесс, лежащий в основе хронической коронарной болезни. Однако имеются свидетельства, что эта цель достигается медикаментозным снижением холестерина ЛПНП с помощью статинов (симвастатин, аторвастатин и др.). Длительная терапия статинами приводит к стабилизации и «укреплению» атеросклеротической бляшки, уменьшению риска ее разрыва и соответственно – риска нестабильности состояния.
Антиагрегантная терапия ацетилсалициловой кислотой является стандартным дополнением к схеме лечения больных коронарной болезнью сердца (КБС). Агрегация тромбоцитов и тромбоз задействованы в патогенезе инфаркта миокарда и нестабильной стенокардии. Ацетилсалициловая кислота ингибирует агрегацию тромбоцитов (соответственно уменьшает последующее высвобождение из них прокоагулянтов и вазоконстрикторов) и обладает доказанным снижением риска инфаркта миокарда у больных с нестабильной стенокардией. При отсутствии противопоказаний (аллергии, патологии желудка) ацетилсалициловая кислота назначается больным с подтвержденной КБС пожизненно, особенно после перенесенного инфаркта миокарда. Учитывая ключевую роль агрегации тромбоцитов и тромбоза в патогенезе коронарных синдромов, разработаны новые и более мощные антитромбоцитарные агенты – тиенопиридиновые производные (тиклопидин, клопидогрел).
При сохраняющейся ишемии миокарда у больных с рефрактерной стенокардией дополнительно назначают антагонисты кальция (верапамил, дилтиазем), блокаторы гликопротеиновых II-IIIa рецепторов тромбоцитов, клопидогрел (часто в сочетании с ацетилсалициловой кислотой). Поскольку агрегация тромбоцитов и формирование тромба играют центральную роль в патофизиологии стенокардии, стандартом лечения является антиагрегантная (ацетилсалициловая кислота) и антикоагулянтная (внутривенный гепарин и др.) терапия. При комбинации или в виде монотерапии ацетилсалициловая кислота и гепарин существенно уменьшают прогрессирование нестабильной стенокардии, возникновение инфаркта миокарда. Напротив, тромболитические агенты, которые эффективны при остром инфаркте миокарда, не показали способности уменьшать при нестабильной стенокардии смертность или число осложнений и не должны применяться в этой ситуации [4]. Если пациент не отвечает достаточно быстро на лечение ацетилсалициловой кислотой, гепарином, -блокаторами и нитратами, следует провести экстренную коронароангиографию, за которой часто следует реваскуляризация миокарда.
У большинства пациентов с рефрактерной стенокардией имеется распространенное атеросклеротическое поражение, осложненное формированием тромбоцитарного тромба, который частично окклюзирует коронарную артерию и/или сопровождается дополнительной вазоконстрикцией. Эффективная антиангинальная терапия как раз направлена против этих факторов.
Пациент с симптомами острой рефрактерной (либо нестабильной) стенокардии должен быть госпитализирован в кардиологическое отделение, он должен соблюдать постельный режим (для снижения потребности миокарда в кислороде).
С целью дифференциации рефрактерной стенокардии от необратимого некроза, т.е. инфаркта миокарда, необходимо проводить серийную регистрацию ЭКГ и определять сывороточные маркеры повреждения миокарда, включая изоформы КФК–МВ и кардиальный тропонин (I или T). Больным с рецидивирующим болевым синдромом, выраженным снижением физической активности или резко положительными результатами стресс–теста при адекватной медикаментозной терапии следует проводить коронарографию для определения показаний к инвазивному лечению.
Если пациент является кандидатом для транслюминальной баллонной коронароангиопластики (ТБКА) или аорто–коронарного шунтирования (АКШ), проводится коронарная реваскуляризация. Некоторым больным показано минимальное инвазивное прямое шунтирование коронарных артерий (MIDCAB) на работающем сердце после небольшой торакотомии либо стернотомии с малым разрезом. При этом методе коронарные артерии шунтируют через небольшой разрез с помощью эндоскопа. Существенным недостатком малоинвазивной хирургии является невозможность реваскуляризации коронарных ветвей второго порядка и риск закрытия шунта вследствие развития тромбоза и гиперплазии интимы.
Если пациент не является кандидатом для указанной выше стратегии лечения рефрактерной стенокардии, то может применяться:
– трансмиокардиальная лазерная реваскуляризация;
– стимуляция спинного мозга (spinal cord stimulation);
– усиленная внешняя контрапульсация (enchanced exernal counterpulsation);
– стимуляция ангиогенеза – введение в область ишемии ангиогенных факторов или их генов (кДНК) для стимуляции развития сосудов и улучшения кровотока в тканях.
Трансмиокардиальная лазерная реваскуляризация (ТМЛР) проводится при торакотомии как одновременно с аортокоронарным шунтированием, так и в качестве самостоятельной процедуры. Метод ТМЛР достаточно эффективен и современен, он снижает ФК стенокардии, улучшает перфузию, функцию и метаболизм миокарда левого желудочка. Причем улучшение перфузии отмечается только в зонах лазерного воздействия при наличии жизнеспособного миокарда. Результаты 5–летнего наблюдения 80 больных с тяжелой рефрактерной стенокардией показали, что у 20% после ТМЛВ с использованием высокоэнергетического СО>2>–лазера стенокардия полностью исчезает, а приблизительно у 90% больных ИБС функциональное состояние больного улучшается (уменьшается, по крайней мере, на один класс согласно Канадской классифакации) [5]. Однако связанная с операцией смертность составляет 5–10%, а дополнительная смертность в течение 1 года – еще 10%. Высокий риск смертности больных в связи с этой операцией разрешает ее проведение по ограниченным показаниям: больным стенокардией III–IV ФК, которым невозможно проведение других методов хирургической реваскуляризации (т.е. с анатомической невозможностью выполнения прямых методов реваскуляризации миокарда по данным коронарографии из–за распространенности и тяжести поражения коронарных артерий, диффузного поражения коронарных артерий, поражения дистального русла, мелких (нешунтабельных) артерий). При планировании процедуры ТМЛР у этой категории больных следует подтвердить наличие жизнеспособности миокарда с помощью методов ядерной медицины (планарная сцинтиграфия с 201–Tl, однофотонная эмиссионная компьютерная томография, позитронная эмиссионная томография) [6].
Чрескожная лазерная реваскуляризация миокарда – минимальной степени инвазивная процедура реваскуляризации, однако ее эффективность несколько ниже, чем ТМЛР.
Усиленная внешняя контрапульсация (EECP) – вспомогательный метод лечения рефрактерной стенокардии, заключается в последовательном нагнетании воздуха в манжеты, наложенные на нижние конечности. Весь процесс синхронизирован с ЭКГ. Во время диастолы манжеты последовательно и быстро раздуваются от голеней к бедрам и ягодицам. Это приводит к увеличению диастолического давления и, следовательно, к увеличению коронарного перфузионного давления и усилению кровоснабжения миокарда. Также происходит увеличение венозного возврата к правому сердцу. Мгновенное откачивание воздуха из манжет в начале сокращения желудочков (систолы) снижает сосудистое сопротивление и, следовательно, разгружает работу сердца (снижает постнагрузку). Отсроченными эффектами процедур является увеличение доставки кислорода и снижение потребности миокарда в кислороде, а конечным результатом является увеличение перфузионного коронарного давления и коллатерального кровотока, возможно, увеличение ангиогенеза и теоретически – уменьшение стенокардии.
В рандомизированном плацебо–контролируемом мультицентровом исследовании у 139 больных с рефрактерной стенокардией и положительным нагрузочным тестом внешняя (наружная) контрапульсация в группе активного лечения (75 чел., давление в манжете – 300 мм рт.ст.) в обшей сложности в течение 35 часов (от 4 до 7 часов в неделю) по сравнению с группой плацебо (67 чел., тот же 35–часовой курс лечения, давление в манжете – 75 мм рт.ст.) снижала частоту приступов стенокардии, увеличивала время нагрузки до появления стенокардии [7]. В недавно проведенном международном исследовании у 978 больных с рефрактерной стенокардией III–IV ФК при использовании этой методики улучшение состояния, по крайней мере, на I ФК было получено у 81% больных, кроме того, качество жизни больных существенно улучшалось [8]. Клинические эффекты курса процедур EECP включали: урежение приступов стенокардии, повышение толерантности к физической нагрузке, улучшение кровоснабжения ишемизированного участка миокарда по данным радионуклидной сцинтиграфии миокарда с таллием.
При гемодинамической нестабильности, а также при выраженности клинических проявлений используются системы механической поддержки миокарда, такие как внутриаортальный баллонный контрапульсатор [9]. Внутриаортальная баллонная контрапульсация повышает давление в восходящей аорте в момент диастолы, тем самым увеличивает перфузионное давление в коронарных артериях. В период систолы левого желудочка баллон резко спадается, что облегчает выброс крови из ЛЖ в аорту за счет уменьшения гидравлического сопротивления крови. Методика применяется в специализованных учреждениях при тяжелой и часто рецидивирующей ишемии и неэффективности медикаметозной терапии, при гемодинамической нестабильности пациентов (острой левожелудочковой недостаточности, кардиогенном шоке). Однако указанные методики контрапульсации требуют специального оборудования, доступны только крупным медицинским центрам, имеют свои противопоказания (застойная сердечная недостаточность, тяжелые поражения легочных сосудов), не всегда хорошо переносятся больными.
Нейростимуляция. Стимуляция спинного мозга (spinal cord stimulation) приводит к снижению болевой чувствительности, симпатических влияний, а также к перераспределению миокардиального кровотока к ишемическим областям [10]. Высокочастотная стимуляция снижает активацию центральных болевых рецепторов. Однако инвазивный характер нейростимуляции может вызывать серьезные побочные эффекты, что ограничивает ее применение в клинике.
Генная терапия. Терапия, основанная на использовании переносчиков различных генов, предложена для лечения больных с рестенозом после ТБКА или АКШ и при рефрактерной стенокардии. В стадии разработки находятся методы стимуляции ангиогенеза или роста новых коллатеральных кровеносных сосудов, которые могут ограничить зону ишемии и улучшить отдаленный прогноз при ИБС. Терапевтический ангиогенез – это усиление естественных процессов организма по развитию коллатеральных сосудов в ишемизированных тканях [11]. В одной из работ стимуляция ангиогенеза, при которой необходимо повысить кровоснабжение тканей, достигалась с помощью введения интрамиокардиально (после торакотомии) сосудистого эндотелиального фактора роста (plasmid VEGF), что позволило у 5 больных уменьшить ишемию через 1–2 мес., увеличить коллатеральный кровоток [12]. В другой работе при рефрактерной стенокардии у 59 больных внутрикоронарно (45 чел.) или внутривенно (14 чел.) вводили другой эндотелиальный фактор роста – рекомбинантный базисный фактор роста фибробластов (bFGF). Через 3 мес. у больных отмечали увеличение миокардиальной перфузии при сцинтиграфии миокарда (SPECT) как в покое, так и при нагрузке [13]. Продолжаются исследования по введению больным специальных факторов, стимулирующих ангиогенез, что, в свою очередь, улучшает кровоснабжение миокарда, способствует появлению участков сокращения в зоне некроза и расширяет возможности лечения больных ИБС [14 ].
Список литературы
1. Conti C.R. The management of refractory angina. Eur Heart J 2000; 21: 1909–1910.
2. Conti R.C. Refractory angina: current options. ACC Current J Review 2001; jul/aug: 10–14.
3. Kim M.C., Kini A., Sharma S.K. Refractory angina pectoris. Mechanism and therapeutic options. J Am Coll Cardiol 2002; 39: 923–934.
4. Грацианский Н.А. Лечение и предупреждение обострений ишемической болезни сердца (острых коронарнызх синдромов). Межд. журнал мед. практики 2000; №11: 44–55.
5. Horvath K.A., Conh L.H., Cooley D.A. et al. Transmyocardial laser revascularization may relieve angina and improve myocardial perfusion among patients with angina refractory to medical treatment. J Thorac Cardiovasc Surg 1997; 113: 645–653.
6. Айткожин Г.К., Исраилова В.К. Трансмиокардиальная реваскуляризация миокарда – новый метод хирургического лечения ишемической болезни сердца. Кардиология 2002; № 1: 103–108.
7. Arora R., Chou T., Jain D. et al. The Multicenter Study of Enhanced External CounterPulsation ( MUST–EECP): effect of EECP on exercise induced myocardial ischemia and anginal episodes. J Am Coll Cardiol 1999; 33: 1833–1840.
8. Barsness G., Feldman A.M., Holmes D.R. et al. The International EECP Patient Registry (IEPR): disign, methods, baseline characteristics, and acute results. Clin Cardiol 2001; 24: 435–442.
9. Чернов В.А., Миронков А.Б. Хирургические аспекты лечения острого коронарного синдрома без стойких подъемов сегмента ST на ЭКГ. Сердце 2003; том 2, № 2: 91–94.
10. Latif O.A., Nedeljkovic S.S., Stevenson L.W. Spinal cord stimulation for chronic intractable angina pectoris: a unified theory on its mechanism. Clin Cardiol 2001; 24: 533–541.
11. Бузиашвили Ю.И., Picano E., Амбатьелло С.Г., Мацкеплишвили С.Т. Ангиогенез как антиишемический механизм. Кардиология 2000: 12; 82–86.
12. Isner J. M., Pieczek A., Schainfeld R. et al. Clinical evidence of angiogenesis after arterial gene transfer of ph VEGF 165 in patients with ischaemic limb. Lancet 1996; 348: 370–374.
13. Udelson J.E., Dilsizian J., Laham R.J. et al. Therapeutic angiogenesis with recombinant fibroblast growth factor–2 improves stress and rest myocardial perfusion abnormalities in patients with severe symptomatic chronic coronary artery disease. Circulation 2000; 102: 1605–1610.
14. Беленков Ю. Н. Пути развития отечественной кардиологии: итоги, планы, надежды. АтмосферА. Кардиология 2002; № 4; 2–4.