Общие представления о патогенезе увеитов
Общие представления о патогенезе увеитов
Н.А. Ермакова
МНИИ глазных болезней им. Гельмгольца
Увеиты представляют собой тяжелые воспалительные процессы в глазу, наиболее часто встречающиеся у лиц молодого возраста и нередко заканчивающиеся резким снижением зрительных функций или слепотой. По данным Н.С. Зайцевой с соавт., инвалидность по зрению при увеите составляет 30%. [1].
Увеит был известен еще в древности, хотя осмотр глазного дна стал возможен только во второй половине девятнадцатого столетия. Название это прижилось благодаря тому, что хориоидея часто была местом внутриглазного воспаления. И хотя в настоящее время известно, что не всегда воспалительный процесс локализуется только в хориоидее, этот термин широко используется для названия различных типов внутриглазного воспаления.
Явный прогресс в изучении увеитов произошел в последние десятилетия, и связано это с достижениями в иммунологии, гематологии, биохимии, фармакологии и других смежных науках.
В настоящее время достаточно хорошо известно, что любое воспаление опосредуется иммунной системой. Поэтому трудно переоценить роль иммунологических реакций в развитии и течении внутриглазного воспаления. С раскрытием механизмов иммунного реагирования пришло и понимание развития тех или иных видов воспалительных процессов в глазу, а также возможность их адекватного лечения.
В течение ряда лет глаз рассматривался в качестве привилегированного иммунологического органа, и объяснялось это тем, что иммунная система была или не знакома, или толерантна к антигенам глаза. Это явление связано с комбинацией различных факторов, одним из которых является отсутствие нормального лимфатического дренажа в глазу, что предполагает изменение иммунного ответа.
Окружение, в котором предъявляется антиген, имеет огромное значение в развитии того или иного иммунного ответа. Так, например, антиген, помещенный в зону с хорошим лимфатическим оттоком, вызывает иммунную реакцию с образованием антител и клеточно–опосредованную реакцию. Тот же антиген, вводимый внутривенно, может вызывать посредством Т–супрессорных клеток совсем другой иммунный ответ, направленный на возникновение иммунной толерантности.
Замечено, что при помещении аллогенных имплантов в переднюю камеру, нарушается развитие клеточно–опосредованных иммунных реакций при сохранении гуморального ответа. Этот феномен назван приобретенной иммунной девиацией передней камеры. Точный механизм этого явления пока не известен, но, по–видимому, важным в данном случае является медленное выведение антигена через дренажную систему угла передней камеры прямо в венозные сосуды. В результате активируются Т–супрессорные клетки, не развивается клеточно–опосредованная реакция замедленного типа, хотя антигенспецифические супрессорные клетки образуются. Нетрудно предположить, что данный феномен должен играть определенную роль в развитии аутоиммунного ответа, а также и при инфекционных поражениях.
Особое значение на развитие воспалительного процесса в глазу оказывает строение оболочек глаза и их кровоснабжение. Глаз имеет анатомические особенности, которые защищают его от возникновения микробного увеита. Компоненты этой системы защиты, не позволяющей микробам проникнуть непосредственно в глаз, состоят из век, тока слезной жидкости, наличия лизоцима и лактоферрина в периокулярной пленке, образуемой слезной жидкостью, наличия интактного эпителия конъюнктивы и роговицы, присутствия фагоцитирующих клеток в пленке, создаваемой слезной жидкостью. Влага передней камеры, стекловидное тело, увеальная оболочка свободны от микробов, и связано это с наличием циркулирующих фагоцитарных клеток, компонентов комплемента, интерферона, а также плотных связей эндотелия сосудов сетчатки и пигментного эпителия, так называемого гематоофтальмического барьера. При воспалении этот барьер нарушается, приводя к значительному нарушению функций сетчатки. Все эти факторы препятствуют эндогенному проникновению микробов.
Хориоидея имеет кровоснабжение, отличное от всех других органов и тканей, и его можно сравнить разве только с гломерулами почек. Хорошее кровоснабжение хориоидеи предполагает к отсеву в ней гематогенно распространяемой инфекции, особенно грибковой. Поэтому чаще всего грибковая инфекция проявляется в виде хориоидита. Хориоидея обладает способностью действовать как депо иммуноактивных клеток, беря на себя в экстремальных случаях функцию лимфатического узла. Поэтому хориоидея может быть центром иммунных реакций. Большая концентрация тучных клеток в хориоидее и высвобождение ими иммунных факторов способствуют входу и выходу Т–лимфоцитов из этого депо.
Тот факт, что сетчатка является мозговой тканью, вынесенной наружу, делает возможным ее поражение нейротропными организмами, такими как токсоплазма и многие вирусы герпетической группы. Следует помнить также, что в сетчатке высок уровень окислительных реакций, поэтому при определенных условиях возможно возникновение аутотоксичности из–за повышенного образования недоокисленных радикалов.
Иммунная система оказывает протекцию против увеитов, вызванных микробами, однако компоненты этой же системы могут играть существенную роль в увеальном процессе. Клетки памяти, представленные В и Т–лимфоцитами, в течение довольно длительного времени персистируют в стекловидном теле, радужной оболочке, цилиарном теле и хориоидее. Эти клетки могут участвовать в рецидивах внутриглазного воспаления посредством 3–х механизмов:
– повторная встреча с микробом, вызвавшим в прошлом иммунную реакцию, приводит к анамнестическому ответу;
– неспецифическая адъювант/поликлональная активация внутриглазных В–клеток, как результат внеглазной стимуляции иммунной системы;
– аутоиммунная внутриглазная воспалительная реакция вследствие молекулярной мимикрии (хламидии, иерсинии, клебсиеллы).
Интересным является факт взаимодействия резидуальных глазных клеток с клетками иммунной системы. Очевидно, что некоторые клетки глаза, включая пигментный эпителий сетчатки, мюллеровские клетки и эндотелий сосудов, имеют функциональную схожесть с клетками иммунной системы или могут нести маркеры, позволяющие им участвовать в иммуноопосредованных событиях.
Способность отвечать иммунным ответом на специфический иммунный стимул генетически детерминирована. В эксперименте показана неодинаковая чувствительность различных линий мышей к одной и той же бактериальной инфекции. Главная система гистосовместимости и контролируемые ею антигены (Iа) являются ключевыми факторами в иммунологическом распознавании и взаимодействии клеток в иммунном ответе.
Понятие о главной системе гистосовместимости возникло в 40–е годы после установления генетических законов совместимости тканей и обоснования наличия групп тесно сцепленных генов, различия по которым обусловливают наиболее резкую несовместимость тканей при пересадках и наиболее выраженные реакции отторжения. Впоследствии оказалось, что в пределах главной системы гистосовместимости локализованы не только гены, контролирующие главные трансплантационные антигены, но и гены, определяющие высоту иммунного ответа на тот или иной конкретный антиген, так называемые гены иммунного ответа (Ir–гены). Ir–гены были открыты в 1967 году Benacerraf В. c соавт. при определении иммунного ответа у морских свинок на введение аминокислотного полимера [2]. Эта же система ответственна за синтез поверхностных структур иммунных клеток, обеспечивающих их взаимодействие. Продукты генов Iа играют ключевую роль при первичном контакте клеток с чужеродными антигенами, обеспечивая механизм двойного распознавания. Главная система гистосовместимости локализуется в 6 хромосоме человека и подразделена на 3 класса:
Антигены, контролируемые I классом (локусы А, В, С), находятся практически на всех ядерных клетках.
Антигены, контролируемые II классом (HLA–D/DR), находятся только на иммунокомпетентных клетках, с их помощью осуществляется механизм двойного распознавания при взаимодействии иммунных клеток. Идентификация продуктов поверхностных клеточных антигенов D–системы происходит посредством смешанной культуры лимфоцитов, в то время как DR–системы определяется серологическими методами. Локус HLA–D/DR считается эквивалентом гена иммунного ответа, а контролируемые ими молекулы на поверхности клеток названы Ia антигенами.
Значение Ir–гена трудно переоценить, поскольку иммунный ответ может состояться только в том случае, если клетки, участвующие в нем, несут на себе идентичные D/DR антигены. Это означает, что макрофаги одного человека могут представить антиген Т–клеткам только в том случае, если они несут на своей поверхности подобные D/DR антигены. Наличие этих антигенов на резидуальных клетках глаза (пигментный эпителий сетчатки, мюллеровские клетки, эндотелий сосудов) указывает на их потенциальную роль, как иммунологически компетентных клеток.
Антигены, контролируемые III классом, это компоненты каскада комплемента.
Наибольший теоретический и практический интерес для клиницистов представляют данные о связи некоторых заболеваний с наличием в генотипе того или иного человеческого лейкоцитарного антигена (HLA). Особенно это относится к заболеваниям с неизвестной этиологией, заболеваниям с тенденцией к хроническому течению и иммунологическим нарушениям. Они носят характер количественных корреляций, но это вовсе не означает, что человек, несущий специфичность HLA–В27, обречен на анкилозирующий спондилоартрит, однако вероятность того или иного заболевания среди лиц с разными генотипами HLA различна. Относительный риск определенных заболеваний у носителей некоторых генов возрастает в 1,7–90 раз (табл. 1).
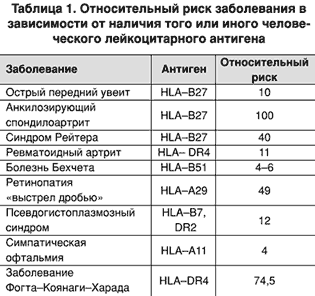
Связь наличия того или иного гена системы HLA с повышенной чувствительностью к инфекционным, в частности, к вирусным агентам, дала возможность высказать весьма продуктивные гипотезы. Наиболее интересные из них относятся к некоторым болезням с невыясненной этиологией и сложным неразгаданным патогенезом, включающим подозрение на вирусную этиологию, с несомненной ролью наследственности и наличием аутоиммунного компонента. К таким заболеваниям относятся ревматоидный артрит и системная красная волчанка, а в последнее время и рассеянный склероз.
Механизм развития воспалительного процесса в глазу остается до конца не выясненным, однако уже сейчас очевидно различие между передним и задним увеитами.
Передний увеит очень часто ассоциируется с HLA–B27. В кишечнике больных с B27 ассоциированными заболеваниями часто определяются некоторые грамотрицательные бактерии. Считается, что компоненты клеточной стенки грамотрицательных бактерий и, в частности, эндотоксин, вызывают передний увеит. Этот факт подтверждается экспериментальными работами.
Ранее предполагалось, что преобладающим механизмом при глазном воспалении является третий тип реагирования, т.е. образование иммунных комплексов, однако последние наблюдения показывают, что иммунные комплексы не играют главной роли в развитии заднего или интермедиарного увеитов. Воспалительный процесс при этих формах опосредуется Т–клетками, главным образом происходит нарушение функции неспецифических супрессорных клеток. Однако иммунные комплексы все–таки могут играть определенную роль при воспалительных процессах в глазу. Отмечено, что пациенты, имеющие иммунные комплексы, обычно обладают лучшим прогнозом заболевания по сравнению с больными, у которых их нет [6]. Это объясняется, по–видимому, тем, что данный иммунный комплекс состоит из двух антител: одного (идиотипического антитела), оказывающего повреждающее действие, и другого (антиидиотипического антитела), нейтрализующего первое. Комплекс, состоящий из идиотипического и антиидиотипического антитела, оказывает протектирующее действие. Помимо этого, антиидиотипические антитела активируют супрессорные клетки. Идиотип/антиидиотип часто встречается в иммунном механизме заболеваний. Так, например, при поликлональной стимуляции некоторые идиотипические антитела могут восприниматься как чужеродные и вызвать синтез антиидиотипических антител.
Примером предполагаемого антитело–опосредованного глазного заболевания является канцер–ассоциированная ретинопатия. У этих пациентов образуются антитела, которые перекрестно реагируют с опухолью и элементами сетчатки. Атака этими антителами сетчатки может приводить к процессу, похожему на увеит или ангиит сетчатки.
Большая роль в возникновении воспалительных процессов отводится аутоиммунным реакциям. Под аутоиммунитетом понимается иммунный ответ, направленный против самого хозяина. В норме незначительные количества аутоантигенов циркулируют в организме, не вызывая нарушений из–за существующей толерантности Т–эффекторных клеток. При срыве этого механизма возникает заболевание. Возможен также другой механизм развития аутоиммунных реакций, основанный на молекулярной мимикрии, когда инфекционный агент имеет одинаковые антигенные детерминанты с клетками тканей хозяина. В таком случае иммунный ответ против внедрившегося агента будет также направлен и против тканей самого хозяина. Неспецифическая поликлональная активация иммунной системы вирусами или другими иммуностимулирующими агентами, такими как компоненты клеточной стенки грамотрицательных бактерий, также может приводить к подобным реакциям.
Кроме того, антигены главной системы гистосовместимости комплексуются с вирусными антигенами, и именно этот комплекс распознается Т–лимфоцитами как чужеродный. Накапливающиеся цитотоксические лимфоциты разрушают пораженные вирусом клетки. Ликвидация вирусной инфекции идет путем иммунологически опосредованной деструкции клеток. А это значит, что восприимчивость к данному вирусу и иммунный ответ на него зависят от сродства антигенов гистосовместимости к инфекционному агенту. Большой гетерогенностью наборов этих антигенов у разных индивидуумов может быть объяснена их разная чувствительность к вирусным агентам.
Следует отметить, что при увеитах возможен местный гуморальный и клеточно–опосредованный иммунный ответ, так как в интерстициальной ткани увеального тракта обнаруживаются макрофаги, лимфоциты и плазматические клетки [1, 8]. Локальная продукция антител исследовалась R. Witner с соавт. and A.C. Martenet при туберкулезном, стрептококковом, токсоплазмозном, вирусном и ленс–индуцированном увеитах [7,11]. Ими выявлялось соотношение уровней антител во влаге передней камеры и в сыворотке крови.
Концепция о наличии в глазу увеитогенного антигена или антигенов была предложена Elsching A. в 1910 году [4]. В течение долгого времени считалось, что антиген, вызывающий увеит, локализуется в хориоидее, возможно, в пигментом эпителии. Однако это положение стало меняться с появлением работ Waldon Wacker с соавт., показавших способность ретинального экстракта вызывать увеит [9]. Пик исследований пришелся на появление очищенного S–антигена, протеина с молекулярным весом 55000 дальтон, содержащим небольшое количество фосфолипида. Введение незначительного количества S–антигена с адъювантом животным в части тела, отдаленные от глаз, вызывает глазное воспаление, названное экспериментальным аутоиммунным увеитом.
Вторым увеитогенным антигеном является интерфоторецепторный ретиноид–связывающий протеин. Эта субстанция с молекулярным весом 140 kD была обнаружена, очищена и охарактеризована B. Wiggert c cоавт. [10].
I. Gery c соавт. показали увеитогенные свойства этого антигена [5]. Увеитогенное действие могут также оказывать родопсин, трансдуцин и др.
Наиболее изученными являются реакции, вызываемые S–антигеном и интерфоторецепторным ретиноид–связывающим протеином. Экспериментальный увеит, возникающий после введения интерфоторецепторного ретиноид–связывающего протеина, имеет сходную картину с процессом, вызванным S–антигеном сетчатки, но при первом наблюдается менее выраженная экссудативная реакция стекловидного тела и чаще встречается хроническое течение.
Важная роль в развитии иммунных реакций, вызываемых этими антигенами, отводится Т–клеткам. C. Chan с cоавт. показали, что в начальную фазу экспериментального аутоиммунного увеита, вызванного S–антигеном, в глазу появляются Т–хелперы, позднее преобладают Т–супрессоры/цитотоксические лимфоциты [3]. Такая же картина наблюдается и при увеите у людей. Выраженная экспрессия Ia антигена на резидуальных клетках в глазу при аутоиммунном экспериментальном увеите и у больных является еще одним фактом, подтверждающим гипотезу о локальном иммунном ответе.
Следует подчеркнуть, что не всегда первично воспаление инициируется одними только увеитогенными антигенами, но высвобождение этих антигенов увеличивается при инфекционном процессе в глазу, таким образом увеличивая аутоиммунный ответ. Следовательно, так называемый аутоиммунный увеит может развиваться вследствие многих причин.
Другую экспериментальная модель увеита можно вызвать при введении липополисахарида (LPS, эндотоксин), являющегося компонентом клеточной стенки грамотрицательных бактерий, в удаленную от глаза часть тела. В данном случае появляется воспаление переднего отрезка глаза, характеризующееся главным образом инфильтрацией полиморфонуклеарными клетками. Считается, что этот тип воспалительных реакций присутствует у больных с HLA–B27, анкилозирующим спондилоартритом, синдромом Рейтера.
Таким образом, в развитии увеита играют роль различные механизмы. Знание этих механизмов способствует правильной диагностике и лечению этой тяжелой патологии.
Список литературы
1. Зайцева Н.С., Кацнельсон Л.А.. Увеиты.// М., Медицина.–1984. – 318с.
2. Benacerraf B, Green I., Paul WE.. The immune response of guinea pigs to hapten–poly–L–lysine conjugates as an example of the genetic control of the recognition of antigenicity. Cold Spring Harbor Symp. Quant Biol 1967.– Vol. 32.–P. 569–575.
3. Chan CC., Mochizuki M., Palestine J., et al.. Kinetics of T–lymphocyte sub>sets in the eyes of Levis rats with experimental autoimmune uveitis. // Cell Immunol.–1985.–Vol. 96.–P.430–434.
4. Elsching A.. Studien zur sympathischen ophthalmic. Die antigene wirkung des augenpigmentes. Albrecht von Graefes Arch. Ophthalmol.–1910.– Vol. 76.– P. 509–546.
5. Gery I., Mochizuki M., Nussenblatt RB.. Retinal specific antigens and immunopathogenic processes they provoke. //in Osborne N, Chader J (eds): Progress in retinal Research. Oxford, Pergamon Press, 1986. Vol 5.– P. 75–109.
6. Kasp–Grochowska E., Graham E., Sanders MD., et al. Autoimmunity and circulating immune complexes in retinal vasculitis. // Trans. Ophalmol. Soc. UK.–1981.– Vol. 101.–P. 342–348.
7. Martenet AC.. Antibodies to uvea in the eye. // Ophthal. Res.–1977.–Vol. 9.– P. 106–111.
8. Nussenblatt RB., Palestine AG. Uveitis. Fundamental and Clinical Practice. // Year book medical publishers, inc.–Chicago, London. – 1989. – 443 p.
9. Wacker WB., Donoso LA., Kalsow CM., et al.. Experimental allergic uveitis. Isolation, characterization, and localization of a soluble uveitopathogenic antigen from bovine retina. // J. Immunol.– 1977.–Vol. 119.–P. 1949–1958.
10. Wiggert B., Chader GJ. Monkey interphotoreceptor retinoid–binding protein (IRBP): Isolation, characterization, and synthesis. // in Bridges CD., Adler AJ (eds): The Interphotoreceptor Matrix in Health and Disease. New York, Alan R., Liss– 1985.– P. 89–110.
11. Witner R. Clinical implications of aqueous humor studies in uveitis. // Amer. J. Ophthal.–1978.–Vol.86.– P.39–45.