Технология продукции общественного питания (работа 5)
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РОССИЙСКОЙ ФЕДЕРАЦИИ
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
"НОВОСИБИРСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ"
Кафедра технологии и организации пищевых производств
Контрольная работа
по дисциплине "Технология продукции общественного питания"
Новосибирск 2011
Содержание
Денатурация фибрилярных белков, постденатурационные изменения
Крахмальные полисахариды и их свойства
Способы стабилизации витаминов
Изменение цвета продуктов под воздействием ферментов
Денатурация фибриллярных белков, постденатурационные изменения
Белки, или протеины, - сложные высокомолекулярные органические соединения (сложные полипептиды), построенные из остатков аминокислот, соединенных между собой амидными связями. В состав одного и того же белка входят различные аминокислоты. При полном гидролизе белок превращается в смесь аминокислот. Молекулярная масса белков весьма велика: так, молекулярная масса альбумина сыворотки крови человека 61 500, у глобулина сыворотки крови 153 000, гемоцианина улитки 600 000. Белки пищевых продуктов по строению молекулы подразделяются на два класса – фибриллярные и глобулярные. Они различаются по строению молекулы, аминокислотному составу, биологической ценности, выполняемой функции и функционально-технологическим свойствам. Глобулярные белки содержатся в подавляющем большинстве пищевых продуктов, а фибриллярные – в мясе, субпродуктах, птице, рыбе, костях.
Многие белки растворимы в воде, в разбавленных растворах солей, в кислотах. Почти все белки растворяются в щелочах, и все они нерастворимы в органических растворителях. Из растворов белки легко осаждаются органическими водорастворимыми растворителями (спиртом, ацетоном), растворами солей, особенно солей тяжелых металлов, кислотами и т. д. Осаждением растворами солей различной концентрации белки могут быть очищены и разделены. При осаждении некоторые белки меняют конформацию цепей и переходят в нерастворимое состояние. Этот процесс называется денатурацией. Денатурация многих белков может быть вызвана и нагреванием.
При кулинарной обработке денатурацию белков вызывает чаще всего нагревание. Процесс этот в глобулярных и фибриллярных белках происходит по-разному. В глобулярных белках при нагревании усиливается тепловое движение полипептидных цепей внутри глобулы, водородные связи, которые удерживали их в определенном положении, разрываются и полипептидная цепь развертывается, а затем сворачивается по-новому. Такое изменение структуры в корне меняет и свойства белков: уменьшается число полярных групп на поверхности, уменьшается или пропадает заряд частицы, резко уменьшается способность к гидратации. В результате денатурации белки теряют устойчивость (молекулы их слипаются, уплотняются, белок свертывается), окраску, ферментативную устойчивость, способность растворяться.
Свертывание белков в результате денатурации бывает двух видов. Если концентрация белка была низкая (до 1%), то свернувшийся белок образует хлопья (пена на поверхности бульонов). Если концентрация белка была высокой, то образуется студень и влага не отделяется (белки яйца). Денатурацию может вызвать не только нагревание, но и ряд других причин: действие солей тяжелых металлов, дубильных веществ; взбивание и др. При взбивании образуется пена с очень тонкими прослойками жидкости между пузырьками воздуха. Поверхность жидкости при этом сильно увеличивается. На поверхности всякой жидкости действуют силы поверхностного натяжения. Они способны механически развернуть полипептидные цепи в молекуле, изменить их конфигурацию и вызвать этим денатурацию. Например, при взбивании яичных белков в поверхностом слое денатурирует белок овомукоид, тормозящий действие трепсина, и усвояемость белков повышается.
Из содержащихся в пищевых продуктах фибриллярных белков (коллаген, эластин, миозин, актин и др.) наибольшее влияние на качество кулинарных изделий и блюд оказывают изменения в процессе тепловой кулинарной обработки белка коллагена. При нагревании в воде отдельных коллагеновых волокон или их пучков вначале они несколько набухают, а затем деформируются. Упорядоченная структура коллагена (вытянутые параллельные цепи) плавится, и коллаген переходит в аморфное состояние. В расплавленном состоянии из-за ослабления внутри- и межмолекулярного взаимодействия цепи за счет разрыва части поперечных связей, стабилизирующих структуру коллагенового волокна, принимают произвольную конфигурацию, что приводит к усадке (сокращению) коллагенового волокна. Длина волокон может уменьшиться до 60% от первоначальной, а их диаметр увеличивается, что приводит к увеличению объема волокна по сравнению с первоначальным. Это происходит при температуре 40-50°С. При дальнейшем повышении температуры разрушение структуры волокон значительно усиливается, и при достижении температуры 55-65°С для коллагенов различного происхождения происходит резкое и мгновенное сокращение длины волокон и увеличение их объема. Этот процесс называется свариванием коллагена. Наряду с изменением линейных размеров коллагеновых волокон происходит нарушение их фибриллярной структуры, и волокна становятся стекловидными. При сваривании коллагена тройные, плотно свитые спирали нативного коллагена переориентируются в беспорядочно свернутые молекулы. Волокна становятся эластичными, более доступными действию ферментов желудочно-кишечного тракта (трипсина), их прочность значительно снижается.
Нагревание коллагеновых волокон выше температуры сваривания вызывает дальнейшее разрушение их структуры, обусловленное последовательным разрывом поперечных связей между молекулами тропоколлагена и внутримолекулярных поперечных связей между цепями тропоколлагена, что приводит в конечном счете к необратимой дезагрегации структуры молеуклы тропоколлагена. Этот процесс резко ускоряется при температурах выше 80°С. В результате этих изменений из коллагена образуется растворимый в горячей воде продукт – глютин.
Стадии перехода коллагена в глютин:
Плавление трехспиральной структуры до аморфного состояния;
Гидролиз поперечных (межмолекулярных) связей между тропоколлагеновыми единицами;
Гидролиз внутримолекулярных поперечных связей;
Гидролиз пептидных связей главной цепи.
Для образования глютина необязательно наличие всех четырех стадий, а также необязательно, чтобы каждая стадия прошла полностью.
Образовавшийся глютин, в отличие от нативного коллагена не только хорошо набухает, но при температуре 40°С и выше неограниченно растворяется в воде. Растворы глютина при охлаждении образуют студни, прочность которых зависит от концентрации и продолжительности нагрева. Студни при концентрации глютина более 2,5% хорошо сохраняют форму. При длительном нагреве глютина студнеобразующая способность его снижается вследствие дальнейшей деструкции глютина.
Крахмальные полисахариды и их свойства
Полисахариды – это высокомолекулярные соединения, содержащие сотни и тысячи остатков моносахаридов. Общим для строения полисахаридов является то, что остатки моносахаридов связываются за счет полуацетального гидроксила одной молекулы и спиртового гидроксила другой и т.д. Каждый остаток моносахарида связан с соседними остатками гликозидными связями. Полигликозиды могут содержать разветвленные и неразветвленные цепи. Остатки моносахаридов, входящие в состав молекулы, могут быть одинаковыми или разными. Наибольшее значение из высших полисахаридов имеют крахмал, гликоген (животный крахмал), клетчатка (или целлюлоза). Все эти три полисахарида состоят из молекул глюкозы, по-разному соединенных друг с другом. Состав всех трех соединений можно выразить общей формулой: (С6Н10О5)n
Крахмал относится к полисахаридам. Молекулярная масса этого вещества точно не установлена, но известно, что очень велика (порядка 100000) и для разных образцов может быть различна. Поэтому формулу крахмала, как и других полисахаридов, изображают в виде (С6Н10О5)n. Для каждого полисахарида n имеет различные значения.
Крахмал представляет собой полимеры α-D-глюкозы, находящейся в двух молекулярых формах: линейной (амилоза)

И разветвленной (амилопектин)
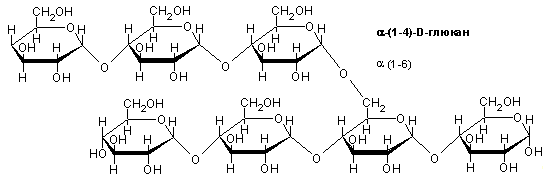
Соотношение этих полисахаридов различное в разных крахмалах (амилозы 18-30%, амилопектина 70-82%).
Амилоза имеет молекулярную массу от 105 до 106. Длина цепи находится в пределах от 500 до 6000 глюкозных остатков. Полимерная цепь амилозы закручивается в спираль. Амилоза способна образовывать комплексные соединения с йодом, которые окрашиваются в синий цвет. Благодаря длинным линейным цепям молекулы амилозы могут объединяться друг с другом и осаждаться из раствора. Этот процесс называется ретроградацией.
Цепочка амилопектина состоит лишь из 20-25 глюкозных остатков. Молекулярная масса превышает 108. Из-за множества ответвлений амилопектин имеет молекулярную массу в 1000 раз большую, чем амилоза. Амилопектиновые цепи собираются в кластерную структуру. Амилопектин не растворяется в воде и образует вязкие стабильные растворы. С йодом амилопектин дает фиолетовое с красноватым оттенком окрашивание.
Физические свойства
Крахмал представляет собой безвкусный порошок, нерастворимый в холодной воде. В горячей воде набухает, образуя клейстер. Крахмал широко распространен в природе. Он является для различных растений запасным питательным материалом и содержится в них в виде крахмальных зерен. Наиболее богато крахмалом зерно злаков: риса (до 86%), пшеницы (до 75%), кукурузы (до 72% ), а также клубни картофеля (до 24% ). В клубнях картофеля крахмальные зерна плавают в клеточном соке, а в злаках они плотно склеены белковым веществом клейковиной. Крахмал является одним из продуктов фотосинтеза.
Химические свойства
При действии ферментов или при нагревании с кислотами (ионы водорода служат катализатором) крахмал, как и все сложные углеводы, подвергается гидролизу. При этом сначала образуется растворимый крахмал, затем менее сложные вещества — декстрины. Конечным продуктом гидролиза является глюкоза. Можно выразить суммарное уравнение реакции следующим образом:
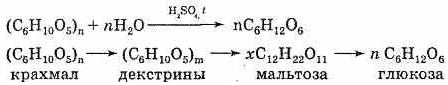
Происходит постепенное расщепление макромолекул. Гидролиз крахмала — его важное химическое свойство.
Крахмал не дает реакции "серебряного зеркала", но ее дают продукты его гидролиза. Макромолекулы крахмала состоят из многих молекул циклической α-глюкозы. Процесс образования крахмала можно выразить так (реакция поликонденсации):
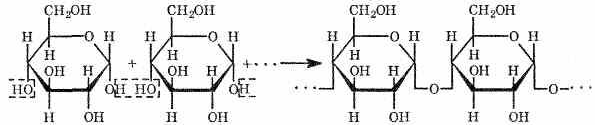
Характерной реакцией является взаимодействие крахмала с растворами йода. Если к охлажденному крахмальному клейстеру добавить раствор йода, то появляется синее окрашивание. При нагревании клейстера оно исчезает, а при охлаждении появляется вновь. Этим свойством пользуются при определении крахмала в пищевых продуктах. Так, например, если каплю йода нанести на срез картофеля или ломтик белого хлеба, то появляется синее окрашивание.
Применение
Крахмал является основным углеводом пищи человека, он в больших количествах содержится в хлебе, крупах, картофеле, овощах. В значительных количествах крахмал перерабатывается на декстрины, патоку, глюкозу, которые используются в кондитерской промышленности. Крахмал используется как клеящее средство, применяется для отделки тканей, накрахмаливания белья. В медицине на основе крахмала готовят мази, присыпки и т.д.
Способы стабилизации витаминов
Витамины участвуют во множестве биохимических реакций, выполняя каталитическую функцию в составе активных центров большого количества разнообразных ферментов либо выступая информационными регуляторными посредниками, выполняя сигнальные функции экзогенных прогормонов и гормонов. Они не являются для организма поставщиком энергии и не имеют существенного пластического значения. Однако витаминам отводится важнейшая роль в обмене веществ. Известно около полутора десятков витаминов. Исходя из растворимости, витамины делят на жирорастворимые — A, D, E, F, K и водорастворимые — все остальные. Жирорастворимые витамины накапливаются в организме, причём их депо являются жировая ткань и печень. Водорастворимые витамины в существенных количествах не депонируются, а при избытке выводятся. Витамины отличаются от других органических пищевых веществ тем, что не включаются в структуру тканей и не используются организмом в качестве источника энергии (не обладают калорийностью).
При надлежащем хранении витамины в их исходной форме сохраняют свою биологическую активность в течение ряда лет. Хорошая сохранность отмечается также в сухих продуктах. Однако в более сложных условиях витамины подвергаются воздействию ряда физических и химических факторов, которые необходимо принимать во внимание перед выбором обогащающих компонентов: температура, тепловая энергия, срок хранения, влажность, неблагоприятная величина рН, кислород и другие газы, свободные Радикалы, свет, облучение, катализаторы (например, ионы меди и железа), ферменты.
Физические и химические факторы, оказывающие влияние на стабильность витаминов:
В целом, холекальциферол, токоферола ацетат, биотин, ниацин, никотинамид, пиридоксин и рибофлавин могут рассматриваться как стабильные витамины, тогда как витамин А, витамин К, аскорбиновая кислота, цианокобаламин, фолиевая кислота, пантотеновая кислота, пантенол и тиамин могут создавать некоторые сложности, связанные с их стабильностью, возникающих при обработке и/или хранении продуктов. Переработка продуктов питания наиболее сильно воздействует на стабильность витаминов в готовых продуктах. Применение стабилизированных и микрокапсулированных форм витаминов значительно повышает их устойчивость в продуктах при различных условиях переработки и хранения. Исследования показывают, что витамин А стабилен в обогащенной муке (после шести месяцев хранения при температуре ниже 25°С сохранность витамина А составляет 95% от исходного уровня). При выпечке хлеба из обогащенной муки наблюдаются незначительные потери витамина А: 10-20%, при использовании для жарки обогащенного растительного масла потери витамина А могут составить порядка 40%. Витамин Е наиболее стабилен в форме d,l-alfa-токоферола ацетата. Природный витамин Е, присутствующий в пищевом сырье в форме аlfa-токоферола, медленно окисляется под воздействием кислорода воздуха. Однако стабильность витамина Е, внесенного в форме d,l-alfa-токоферола ацетата, очень высока и его потери появляются только при продолжительном нагревании, например, кипячении или жарке. Тиамин (витамин В1) - один из наименее стабильных витаминов. Выпечка, пастеризация или кипячение продуктов, обогащенных тиамином, может привести к его потерям до 50%. Стабильность тиамина при хранении зависит от влажности продукта. При хранении муки с влажностью 12% в течение пяти месяцев потери тиамина могут составить до 20%, при 6% влажности муки потерь не наблюдается. Тиамин, рибофлавин и ниацин стабильны при выпечке хлеба: потери составляют от 5 до 10%. Рибофлавин (витамин В2) очень стабилен во время термообработки, хранения и приготовления пищи. Однако рибофлавин подвержен разрушению под воздействием света. Этого можно избежать при использовании светозащитной упаковки. Ниацин - один из наиболее стабильных витаминов и основные потери возникают из-за выщелачивания в воде для приготовления пищи. Пиридоксин (Витамин В6): его потери зависят от типа термической обработки. Например, наибольшие потери в витамина В6 возникают в процессе стерилизации жидкого детского питания, и наоборот, В6 в обогащенной муке стоек к температуре выпекания. В6 чувствителен на свету, вызывающем расщепление и выдерживание в воде может вызвать выщелачивание и привести к значительным потерям. Однако витамин В6 стабилен при хранении, в пшеничной муке, хранящейся при комнатной температуре или при 45°С сохраняется около 90% от внесенного В6. Фолиевая кислота нестабильна и теряет свою активность в присутствии света, окислителей или восстановителей, в кислой или щелочной средах. Однако она относительно стабильна к нагреванию и влажности; так выпечка и зерновые хлопья сохраняют до 100% от добавленного количества фолиевой кислоты после шести месяцев хранения. Свыше 70% ее сохраняется в процессе выпечки хлеба. D-пантотенаткальция стабилен при нагревании в слабых кислотах и нейтральной среде, но его стабильность снижается в щелочной среде. Биотин чувствителен как к кислотам, так и к основаниям. Аскорбиновая кислота (витамин С) легко разрушается в ходе технологической обработки или хранении из-за действия металлов таких как медь или железо. Длительное воздействие воздуха и продолжительное нагревание в присутствии кислорода разрушает аскорбиновую кислоту, таким образом стабильность витамина С в обогащенном продукте будет зависеть от самого продукта, технологии его производства, типа используемой упаковки. В витаминизированном продукте или напитке сохраняется от 75 до 97% витамина С при хранении 12 месяцев при комнатной температуре. Для увеличения стабильности некоторые витамины могут быть также подвержены химической модификации, специальной технологической обработке с целью получения более стабильных форм, позволяющих их использовать в различных отраслях пищевой промышленности. Основные параметры, учитывающиеся при разработке форм продуктов:
- стабильность (в процессе обработки и при хранении)
- удобство при использовании (например, минимальное пылеобразование, минимальное расслоение в конечном продукте, устойчивость к слеживанию, хорошая сыпучесть и однородность)
- растворимость (получение вододиспергируемых форм жирорастворимых витаминов и каротиноидов)
- биодоступность
- органолептические характеристики (например, маскирование неприятных запахов за счет встраивания или инкапсулирования действующего вещества в защитную матрицу)
Выбор оптимальной упаковки в значительной степени определяется сроком хранения и стоимостью. Витамин А необходимо защищать от кислорода и света, витамин С - от кислорода, а рибофлавин и пиридоксин - от света. В напитках, молоке и масле кислород может вызывать быстрое разложение витаминов А и С. Упаковка из стекла - хороший выбор для защиты от кислорода, но с точки зрения удобства использования, утилизации и других причин пластмассовая является более подходящей. Правильно подобранные упаковочные материалы совместно с соответствующими передозировками витаминов - путь преодоления проблем, вызываемых взаимодействием с кислородом. Светозащитная упаковка (темное стекло, темный пластик, асептические коробки) - также способствуют сведению к минимуму воздействие света и, следовательно, сведению к минимуму разложения светочувствительных витаминов.
Изменение цвета продуктов под воздействием ферментов
Ферменты - (от латинского слова "ферментум" - закваска) - это вещества белковой природы, вырабатываемые живой клеткой. Известно около 1000 ферментов, и каждый из них обладает исключительной специфичностью действия, т.е. катализирует только одну определённую реакцию. Все ферменты делятся на 6 классов:
оксиредуктазы - катализируют окислительно-восстановительные процессы;
трансферазы - перенос химических групп;
гидролазы - гидролиз;
лиазы - расщепление негидролитическим путём с образованием воды или диоксида углерода;
изомеразы - внутримолекулярное перемещение различных групп;
лигазы - синтез.
Оптимальная температура для действия растительных ферментов 50-60 °С, животного происхождения – 40-50 °С.
В сырье, собранном для консервирования, дыхательные процессы не прекращаются, а находятся в равновесии, что не дает происходить явным изменениям вещества. Но любое механическое мероприятие, например, резание, чистка, измельчение, помол материала приводят к дезорганизации ферментативной системы, разрушению витамина С и других веществ и вследствие окисления некоторых органических материалов приводят к окрашиванию в коричневый цвет. При обработке фруктов с белой мякотью на компот можно замочить готовые плоды в слабом растворе лимонной кислоты, таким вмешательством можно ограничить доступ кислорода к продуктам и тем самым снизить скорость ферментативных реакций. Добавка лимонного сока к тому же приводит к предохранению от быстрого окисления витамина С, что могло бы привести к коричневой окраске продуктов. В измельченных фруктах, предназначенных для приготовления мармелада, инактивация (снижение активности) ферментов достигается своевременным и быстрым нагревом. Окрашивание некоторых видов нарезанных овощей (сельдерея, петрушки), предназначенных для дальнейшей стерилизации или сушки снижается быстрым обвариванием в кипящей воде.
Изменение цвета очищенных клубней картофеля. Потемнение на воздухе очищенного картофеля вызвано деятельностью фермента полифенолоксидазы (комплекс фенолазы, полифенолазы, катехолазы, тирозиназы и крезолазы), катализирующей первые две ступени сложной реакции превращения моно-, ди - или полифенолов в темноокрашенный меланин. При хранении очищенного картофеля на воздухе появляются розовые пятна, постепенно темнеющие и переходящие в черные. Пигмент, окрашивающий поверхность очищенного картофеля, называется меланином. Склонность к потемнению не является устойчивым сортовым признаком. У одного и того же сорта картофеля она может сильно варьировать в зависимости от почвенных и климатических условий. Наблюдается прямая зависимость между активностью ферментной системы картофеля и скоростью его потемнения. Так, в быстро темнеющем сорте Вольтман активность тирозиназы в 2,7 раза больше, чем в сорте 8670, не склонном к потемнению. Для предохранения очищенного картофеля от потемнения применяются способы, основанные на инактивации полифенолоксидазы.
В мясоперерабатывающей практике существует так называемый "загар мяса" - автолиз мяса — процесс самопроизвольного изменения химического состава, структуры и свойств мясного сырья после убоя животного под воздействием собственных ферментов мяса. В связи с отсутствием поступления кислорода в организм ресинтез гликогена в мясе после убоя идти не может, и начинается его анаэробный распад, который протекает по пути фосфоролиза и амилолиза с образованием молочной кислоты и глюкозы. Скорость гликолиза можно регулировать: введение хлорида натрия в парное мясо подавляет процесс; применение электростимуляции — ускоряет. Интенсивный прижизненный распад гликогена может вызываться стрессовыми ситуациями у животных. Процесс этот сопровождается изменением цвета (в зависимости от интенсивности процесса — коричнево-красный, медно-красный, желто- или серо-красный) и удушливо кислым запахом мяса.
При кулинарной обработке может происходить изменение естественной окраски продуктов животного (мясо и мясопродукты) и растительного происхождения (щавель, крыжовник и др.) и образование другой окраски (очищенные клубни картофеля). Основными причинами изменения цвета продуктов являются окислительные и другие превращения полифенольных соединений, которые в них содержатся, происходящие при участии ферментов и неферментативным путем; полимеризация продуктов окисления полифенолов; сахаро-аминные (меланоидиновые) реакции между сахаром со свободными карбонильными группами и аминокислотными соединениями; карамелизация сахаров, интенсивно проходящая при температурах их плавления и связанная с реакциями дегидратации; окисление соединений железа и т. д.
Литература
Баранов В.С., Мглинец А.И., Алешина Л.М. и др. Технология производства продукции общественного питания. – М: Экономика, 1986.
Мацейчик И.В., Габелко С.В. Методические указания по курсу Технология продукции общественного питания. – Н: НГТУ, 2000
Интернет – портал www.publiccatering.ru
Интернет – портал www.meatinfo.ru
Интернет – портал www.wikipedia.ru
Интернет – портал http://ido.tsu.ru/schools/chem/data/res/org/uchpos/text/Untitled3.html?sphrase_id=33558
Мглинец А.И. Технология продукции общественного питания. – СПб: Троицкий мост, 2010