Гетероциклические соединения (работа 1)
- 2 -
Гетероциклические соединения
К гетероциклическим относятся соединения, содержащие циклы, в которых один или два (несколько) атомов являются элементами, отличными от углерода. Гетероциклические системы многообразны. Элементы, которые участвуют в образовании цикла, называют гетероатомами. В соответствии с количеством гетероатомов циклы разделяют на моно-, ди-, тригетероатомные кольца.
Гетероциклы могут содержать три, четыре, пять и более атомов. Как и в случае карбоциклических соединений, наиболее устойчивы циклы с пятью и шестью атомами.
Число возможных гетероциклических систем увеличивается из-за существования конденсированных ядер.
Широко распространены гетероциклические системы в природе, являются побочными продуктами при коксовании угля, переработки нефти и сланцев.
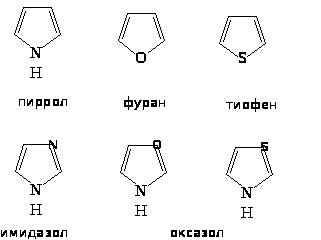
Наиболее важны гетероциклические системы, обладающие ароматическими свойствами. Простейшие из них содержат по одном гетероатому:
Если исходить из этих структур, то можно было бы ожидать, что каждое соединение будет обладать свойствами сопряженных диенов и свойствами амина, простого эфира, сульфида. Но для указанных соединений не характерны реакции, которые можно ожидать из-за наличия гетероатомов.
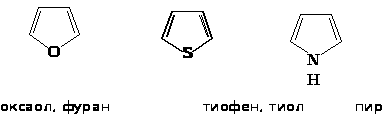
Для пятичленных циклов типичными являются реакции электрофильного замещения: нитрование, сульфирование, галогенирование, ацилирование, сочетание с солями диазония. Поэтому пиррол, фуран и тиофен можно считать ароматическими соединениями.
Рассмотрим строение тиофена исходя из молекулярных орбиталей. Каждый атом кольца связан -связями с тремя другими атомами. Для образования этих связей атом использует три sp2-орбитали, которые лежат в плоскости под углом 120о. Каждый атом затрачивает один электрон на образование -связи, после чего у атома углерода остается один электрон, а у атома серы - два электрона. Эти электроны занимают p-орбитали. Перекрывание p-орбиталей приводит к возникновению -облаков выше и ниже плоскости кольца. Эти -облака содержат в сумме шесть -электронов (ароматический секстет).
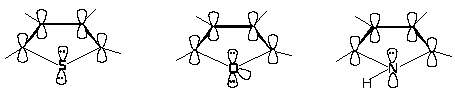
Делокализация -электронов стабилизирует кольцо. В результате этого тиофен вступает в реакции с сохранением кольца, т.е. в реакции замещения.
Номенклатура и изомерия
Нумерация всегда начинается с гетероатома. Если в цикле имеется несколько гетероатомов, то их нумеруют в следующем порядке: O, S, N. Если имеется третичный азот и NH, то нумерацию начинают с NH.
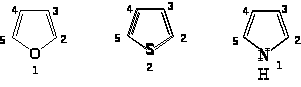
Положения 2 и 5 часто обозначают и ’, а положения 3 и 4 - и ’. По рациональной номенклатуре названия гетероциклов: фуран, тиофен, пиррол, имидазол, тиазол. В систематической номенклатуре природа гетероатома обозначается приставками:
-
O
окса-
S
тиа-
N
аза-
размер цикла
-
3
-ир
4
-ет
5
-ол
6
-ин
7
-ен
8
-ок
Соответственно суффиксами обозначается степень ненасыщенности:
-
-идин
насыщенный цикл с атомом N
-ан
насыщенный цикл без атома N
-ин
ненасыщенный цикл с атомом N
Допускаются упрощения названий.
Методы получения пятичленных гетероциклов
Пиррол и тиофен содержатся в каменноугольной смоле. Фракционной перегонкой смолы тиофен (Т>пл> 84 оС) перегоняется вместе с бензолом (Т>кип> 80 оС) и содержание его в бензоле 0,5% (1884 г., В.Мейер). Тиофен в промышленности может быть получен при взаимодействии бутана с серой при 560 оС:

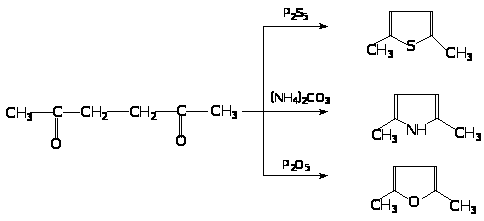
Гомологи получают при нагревании 1,4-дикарбонильных соединений:
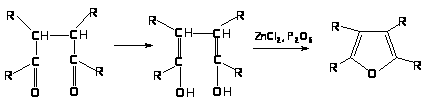
Фуран:
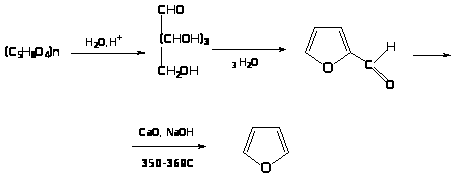
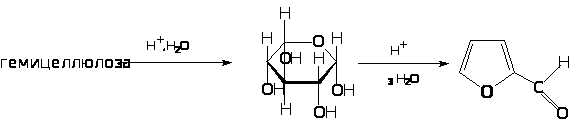
Пентозы, претерпевая дегидратацию и циклизацию, образуют фурфурол. При нагревании его с окисным катализатором образуется фуран. При сухой перегонке соли пирослизевой кислоты:
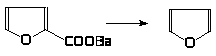
Большинство замещенных тиофена и фурана получают циклизацией:
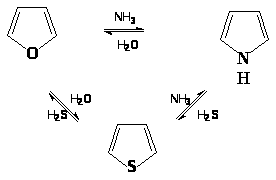
Пятичленные циклы могут взаимно переходить друг в друга (реакция Юрьева) при нагревании над Al>2>O>3> при 450 оС:
Электрофильное замещение, реакционная способность, ориентация
Фуран, пиррол и тиофен обладают значительной реакционной способностью по отношению к электрофильным реагентам. Это вызвано несимметричным распределением заряда в этих гетероциклах, из-за чего на углеродных атомах в цикле сосредоточен больший отрицательный заряд, чем в бензоле. Фуран обладает несколько большей реакционной способностью, чем пиррол.
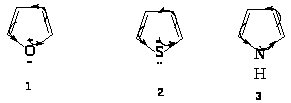
Фуран бурно реагирует с сильными кислотами с образованием смолистых веществ, пиррол в результате протонирования по атому азота также неустойчив в кислых средах и полимеризуется. Тиофен более устойчив по отношению к кислотам, что позволяет использовать кислые реагенты при выборе условий для реакций электрофильного замещения.
Механизм электрофильного замещения в пятичленных гетероциклах существенно не отличается от общепринятого механизма замещения в ароматических соединениях, который предполагает изменение гибридизации атакуемого атома углерода от sp2 в sp3 и образование комплексов, являющимися промежуточными соединениями. Образование -комплекса является стадией, определяющей скорость реакции.
В настоящее время основные пятичленные гетероциклы расположены в ряд по реакционной способности:
пиррол фуран > теллурофен > селенофен > тиофен
Электрофильное замещение по -положению происходит легче, чем в -положение, так как в возникающем при этом промежуточном переходном состоянии в результате присоединения по -положению резонансная стабилизация больше, чем в катионе, являющаяся результатом присоединения по -положению.
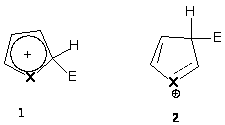
В катионе (2) двойная связь не может участвовать в мезомерной делокализации положительного заряда.
Скорость замещения зависит от различия энергий основного и переходного состояний, и более высокую скорость будет иметь тот процесс, который протекает через более стабильное переходное состояние.
Реакционная способность - и -положений сильно зависит от электрофильного агента и экспериментальных условий. Чем меньше сила электрофильного агента, тем выше величина :. Это соотношение зависит также от гетероатома. 2-Монозамещенные производные образуют с элктрофильными реагентами смеси изомеров. Положения 2 и 5 находятся в сопряжении подобно п-положениям в бензоле, поэтому возможно резонансное взаимодействие реакционного центра в положении 5 с заместителем в положении 2. Положения 2 и 4 являются положениями мета-типа, между которыми невозможно резонансное взаимодействие. Если в положении 2 находятся орто-пара-ориентирующие группы, то замещение протекает в положении 5, которое является -положением по отношению к гетероатому и пара-положением по отношению к заместителю. Если мета-ориентирующий заместитель находится в положении 2, возникает конкуренция между ориентирующим влиянием гетероатома и заместителя. В фуране и тиофене, для которых соотношение : велико, -ориентирующий эффект гетероатома преобладает и замещение протекает, главным образом, в положении 5. В пирроле образуется смесь изомеров с преобладанием 4-изомера.
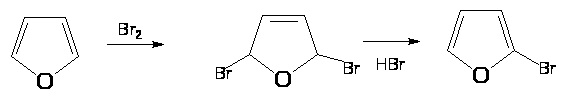
Реакции электрофильного замещения в фуране
Бромирование диоксандибромидом:
Сульфирование комплексом SO>3> с пиридином (А.П. Терентьев, Л.А. Яновская):
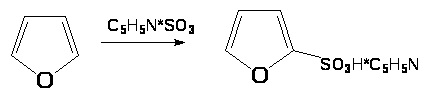
3. Ацилирование
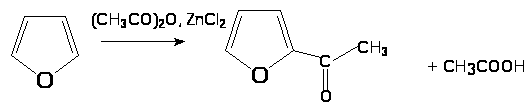
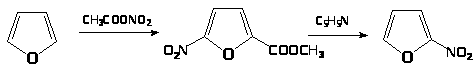
4. Нитрование фурана ацетилнитратом с обработкой продукта присоединения пиридином
Реакции электрофильного замещения тиофена
Хлорирование тиофена сульфурилхлоридом:
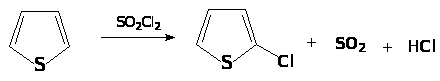
Тиофен легко сульфируется H>2>SO>4> (95%) с образованием 2-тиофенсульфокислоты:
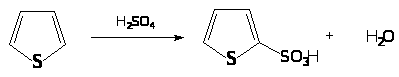
Нитрование ацетилнитратом приводит к смеси 2- и 3-нитротиофенов в соотношении 6:1.
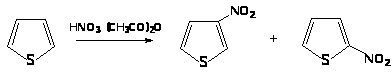
Введение альдегидной группировки в тиофен может быть достигнуто при взаимодействии тиофена с комплексом POCl>3> и N,N-диметилформамида.
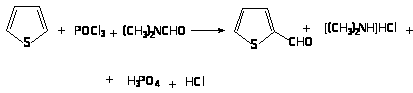
Бромирование тиофена может протекать при взаимодействии с бромом:
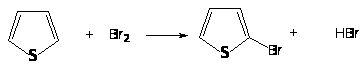
Лучшие выходы достигаются при бромировании N-сукцинимидом
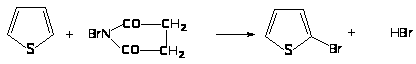
Ацилирование тиофена в положение 2:
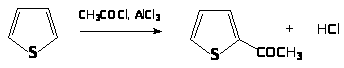
Реакции электрофильного замещения пиррола
Для пиррола также характерны реакции электрофильного замещения в мягких условиях. Кислотность пиррольного водорода намного выше, чем кислотность алифатических аминов. При нагревании с сухим KOH пиррол депротонируется.
1. Соли пиррола со щелочными металлами получают действием калия или натрия в жидком аммиаке:
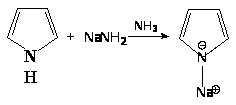
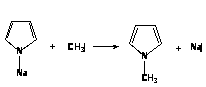
2. Пирролнатрий легко вступает в реакции замещения натрия на алкилы с образованием N-алкилпиррола
3. При нагревании N-алкилпиррол изомеризуется в С-алкилпирролы:
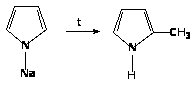
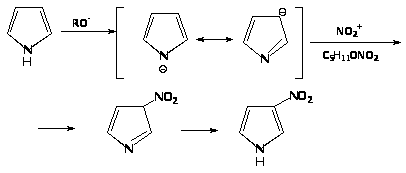
4. Амилнитрат реагирует с пирролом в присутствии этилата натрия с образованием натриевой соли 3-нитропиррола: