Несимметричные сульфиды
Отдел образования администрации
Центрального района
Муниципальная
гимназия № 1
реферат
По теме:
несимметричные сульфиды на
основе
4 - ( - хлорпропил ) - 2 - трет. - бутилфенола
Галанская галина, Евсюкова Ирина и
Кривошапкин Иван,
ученики 11 «А» класса
научный руководитель: ст. преподаватель
кафедры органической химии НГПУ
Марков Александр Федорович
Новосибирск – 2000
СОДЕРЖАНИЕ
1. Введение 3
2. Пространственно-затрудненные фенолы и стабилизация полимерных материалов 4
2.1. Старение полимеров 4
2.2. Пространственно-затрудненные фенолы, как ингибиторы радикальных процессов в полимерах. 6
3. Методы получения органических сульфидов 8
4. Пути синтеза несимметричных сульфидов на основе 4-(-хлорпропил)-2-трет.-бутилфенола. 10
4.1. Получение 4-(-хлорпропил)-2-трет.-бутилфенола (хлорид Ф-13) 10
4.2. Синтез 4-(-меркаптопропил)-2-трет.-бутилфенола 11
4.3. Синтез 2,2'– метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола]. 12
4.4. Синтез несимметричных сульфидов алкилированием 4-(-меркаптопропил)-2-трет.-бутилфенола и 2,2`метиленбис-[4-(-меркаптопропил)-6-трет.- бутилфенол] алкилгалогенидами в щелочном виде. 12
5. Практическая часть 13
5.1. Наработка 4-(-хлорпропил)-2-трет.-бутилфенола (хлорид Ф-13) 13
5.2. Получение 4-(-меркаптопропил)-2-трет.-бутилфенола 13
5.3. Получение 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола] 14
5.4. Взаимодействие 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола] с бромистым бутилом (н-C>4>H>9>Br) в щелочной среде 14
5.5. Взаимодействие 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола] с йодистым этилом (C>2>H>5>J) в щелочной среде 15
5.6. Взаимодействие 4-(-меркаптопропил)-2-трет.-бутилфенола с йодистым этилом (C>2>H>5>J) в щелочной среде. 15
5.7. Взаимодействие 4-(-меркаптопропил)-2-трет.-бутилфенола с бромистым бутилом (н-C>4>H>9>Br) в щелочной среде. 16
6. Выводы 16
1. Введение
Полимерные вещества внедрились во все сферы человеческой деятельности – технику, здравоохранение, быт. Ежедневно мы сталкиваемся с различными пластмассами, резинами, синтетическими волокнами. Полимерные материалы обладают многими полезными свойствами: они высокоустойчивы в агрессивных средах, хорошие диэлектрики и теплоизоляторы. Некоторые полимеры обладают высокой стойкостью к низким температурам, другие - водоотталкивающими cвойствами и так далее.
Недостатками многих высокомолекулярных соединений является склонность к старению и, в частности, к деструкции – процессу уменьшению длины цепи и размеров молекул. Деструкция может быть вызвана механическими нагрузками, действий света, теплоты, воды и особенно кислорода и озона. Процесс уменьшения цепи идёт за счёт разрушения связей С-С и образования радикалов, которые в свою очередь, способствуют дальнейшему разрушению полимерных молекул.
Перед учёными стоит проблема продления срока службы полимерных изделий. Для предотвращения старения в полимерные материалы вводят различные добавки (стабилизаторы).
В качестве ловушек свободных радикалов, образующихся при деструкции полимерных материалов, используют фенольные стабилизаторы.
Фенольные стабилизаторы более эффективны, так как, улавливая свободные радикалы, образуют более устойчивые связи с ними, предотвращая дальнейшую деструкцию углеродной цепи. Кроме того, они обладают комплексным защитным действием (например, предотвращают разрушающее действие кислорода и высоких температур, или кислорода и радиации). Фенольные стабилизаторы выгодно отличаются от других добавок тем, что не изменяют цвет полимерных материалов, в состав которых вводятся.
В настоящее время в промышленном производстве полимеров требуются новые фенольные добавки с широким спектром стабилизирующих свойств и низкой себестоимостью. Несмотря на актуальность проблемы, исследований по разработке и получению фенольных стабилизаторов ведется мало. В связи с этим целью нашей работы был синтез новых серосодержащих пара-функционально-замещенных пространственно-затрудненных фенолов на основе 4-(-хлорпропил)-2-трет.-бутилфенола и 2,2'-метиленбис-[4-(-хлорпропил)-6-трет.-бутилфенола].
Основными задачами, которые требовалось решить в ходе исследования, являлись:
Изучить проблему старения полимеров и способов его предотвращения путем введения в материал фенольных стабилизаторов.
Ознакомиться с распространенными методами получения сульфидов.
Проверить возможности синтеза несимметричных сульфидов взаимодействием меркаптанов (4-(-меркаптопропил)-2-трет.-бутилфенола и 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола]) с алкилгалогенидами в этиловом спирте.
2. Пространственно-затрудненные фенолы и стабилизация полимерных материалов
2.1. Старение полимеров
Полимерные материалы в значительной мере подвержены воздействию условий окружающей среды (свет, тепло, действие озона, радиация, механические нагрузки).Под влиянием этих факторов снижается эластичность, ухудшается электроизоляционные свойства и др. Эти явления, называемые в совокупности старением, приводят к необратимым изменениям свойств полимерных материалов и сокращают срок службы изделий из них. При эксплуатации большинство полимеров находится в контакте с кислородом воздуха, т.е. в окислительной среде. Реакции окислительной деструкции являются наиболее распространенными из реакций, протекающих при старении в естественных условиях, и представляют собой радикально-цепной окислительный процесс. Этот процесс активируется различными внешними воздействиями – тепловым, радиационным, механическим, химическим. Характерная особенность радикально-цепных окислительных процессов – возможность их резкого замедления путем введения небольшого количества ингибитора (стабилизатора).
Выделяют следующие типы стабилизаторов:
антиоксиданты или антиокислители (защищающие полимерные вещества от разрушающего действия кислорода);
антиозонаты (защищающие полимерные вещества от разрушающего действия озона);
светостабилизаторы (защищающие полимерные вещества от разрушающего действия ультрафиолетовых лучей);
термостабилизаторы (защищающие полимерные вещества от разрушающего действия высокой температуры);
антирады (защищающие полимерные вещества от разрушающего действия радиационного излучения).
Как известно, основу макромолекулы большинства полимеров общего назначения составляет углеродная цепь типа:
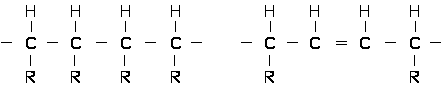
где: R = H, alk, ar.
В общем виде механизм ингибированного окисления углеводородов молекулярным кислородом может быть представлен следующей схемой:
Механизм ингибированного окисления
углеводородов
молекулярным
кислородом
(0) RH R•
(1) R• + O>2> ROO•
(2) ROO• + RH ROOH + R•
(3) ROOH RO• + HO•
(4) R• + R• R-R
(5) ROO• + R• ROOR
(6) ROO• + ROO• ROH + R"COR + O>2>
(7) ROO• + InH ROOH + In•
(8) In• + RH InH + R•
(9) In• + In• In-In
(10) In• + ROO• InOOR
В целом процесс окисления зависит от величины константы скорости реакции продолжения цепи (k2) и концентрации перекисных радикалов. Соответствующие гидроперекиси являются первичными продуктами окисления, дальнейший распад которых приводит к различным кислородсодержащим веществам и часто сопровождается разрывом углерод-углеродной цепи.
Присутствующий в окисляющейся системе ингибитор (InH), как правило, реагирует c радикалами ROO• (реакция 7), либо прерывая цепь окисления, либо уменьшая концентрацию этих радикалов, что приводит к снижению скорости окисления. Естественно, что чем менее активен получающийся из ингибитора радикал, тем меньше вероятность протекания реакции 8. Следовательно, тормозящее действие любого ингибитора окисления зависит, с одной стороны, от скорости реакции перекисных радикалов с ингибитором, а с другой – от активности получающегося из ингибиторов радикала. Малоактивные радикалы In• обычно не способны продолжать цепь (реакция 8) и рекомбинируют друг с другом (реакция 9). Таким образом, относительная активность радикала In• непосредственно в процессе окисления должна определяться отношением констант скоростей реакций k2/k7, которое характеризует максимальную возможность торможения процесса окисления при использовании данного ингибитора (сила ингибитора). Чем меньше это отношение, тем больше возможное тормозящее действие ингибитора.
2.2. Пространственно-затрудненные фенолы, как ингибиторы радикальных процессов в полимерах.
В качестве стабилизаторов могут быть использованы различные органические сульфиды, в том числе пространственно-затруднённые фенолы типа:
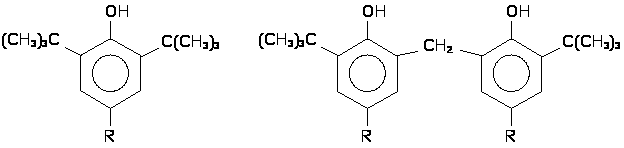
Пространственно-затрудненные фенолы (и получающиеся из них феноксильные радикалы) полностью удовлетворяют требованиям, предъявляемым к сильным антиоксидантам, и являются эффективными ингибиторами процессов окисления различных органических материалов. Подобные фенолы, как правило, реагируют с радикалами ROO•, прерывая цепь окисления.
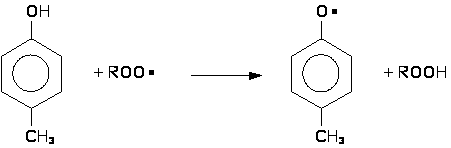
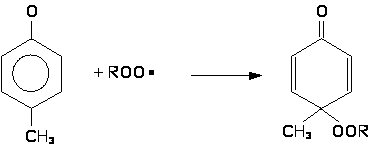
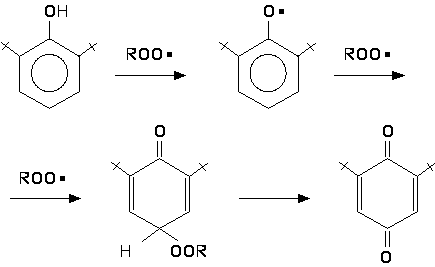
Эффективность пространственно-затрудненных фенолов как ингибиторов окисления существенно зависит от их структуры. Определяющим фактором в этом случае является строение о-алкильных групп и характер пара-заместителя. Ниже приведено соотношение k2/k7, характеризующее эффективность некоторых пространственно-затрудненных фенолов при ингибированном окислении тетралина при 50°С.
|
k2/k7 |
|
|
Фенол |
83 |
|
о-крезол |
522 |
|
2-трет.-бутилфенол |
787 |
|
2,6-ди-трет.-бутилфенол |
967 |
|
2,4,6-три-трет.-бутилфенол |
1413 |
|
4-метил-2,6-ди-трет.-бутилфенол |
1990 |
Введение в пара-положение молекулы пространственно-затрудненного фенола электрондонорных заместителей увеличивает его антиокислительную активность, а электронакцепторных - уменьшает:
|
Пара-заместитель: |
Относительная
|
|
- CH>3> |
100 |
|
- C2H>5> |
125 |
|
н-C>4>H>9> |
140 |
|
- CH(CH>3>)C>2>H>5> |
80 |
|
- C(CH>3>)>3> |
36 |
Эффективность большинства стабилизаторов класса пространственно-затрудненных фенолов значительно повышается в композиции с веществами, разрушающими гидроперекиси и предотвращающими возможность вырожденного разветвления цепи окисления сульфидами, фосфитами, аминами, тиолами.
При использовании антиоксидантов помимо рассмотренных выше закономерностей, определяющих эффективность ингибитора, необходимо дополнительно учитывать следующие факторы: совместимость стабилизатора с защищаемым материалом, степень окрашивания полимера и особенности продукта его окисления, летучесть.
3. Методы получения органических сульфидов
Как стабилизаторы могут использоваться симметричные и несимметричные сульфиды.
Наиболее распространённым способом получения симметричных органических сульфидов является взаимодействие алкилгалогенидов с сульфидом натрия Na>2>S в органических растворителях. Более высокие выходы достигаются при использовании протонных (спирты: этиловый, изопропиловый и другие) или апротонных (диметилформамид) растворителях.
2 R–Hal + Na>2>S R–S–R + 2 NaHal
Когда R = R’, то получаются симметричные сульфиды. Получение несимметричных сульфидов можно осуществить взаимодействием тиолов с алкилгалогенидами в присутствии щелочей. Сначала образуется тиолят-анион:
R – SH + OH R – S + H>2>O
Далее возможны два варианта:
R – S + R’ – Hal R – S – R’
или
R – Hal + R’ – S R – S – R’
Выбор зависит от многих факторов.
Меркаптаны (алкантиолы), имеющие небольшую молекулярную массу, достаточно летучи (имеют отвратительный запах!), ядовиты и отсутствуют в продаже.
Для получения тиолов (меркаптанов) более эффективны и чаще используются в лабораторных условиях непрямые методы синтеза, с последующим разложением или восстановлением промежуточных продуктов. Из прямых синтезов наиболее доступным является нуклеофильного замещения атомов галогена на гидросульфид анион HS . В лабораторных условиях из гидросульфидов с высоким выходом и хорошего качества получают гидросульфид аммония NH>4>HS.
Получение соответствующих алкилгалогенидов из спиртов в лабораторных условиях не представляет особой сложности.
4. Пути синтеза несимметричных
сульфидов на основе
4-(-хлорпропил)-2-трет.-бутилфенола.
Одним из перспективных направлений производства отечественных антиоксидантов до настоящего времени остаётся синтез полифункциональных пространственно-затруднённых фенолов на основе 4-(-хлорпропил)-2-трет.-бутилфенола (-пропанола, разработка НИОХ СО РАН). Среди промышленных фенольных антиоксидантов неплохо зарекомендовали себя метиленбисфенолы.
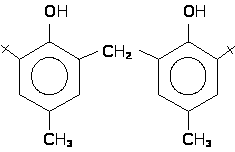
2,2’-метиленбис-[4-метил-6-трет.-бутилфенол]
«антиоксидант
2246»
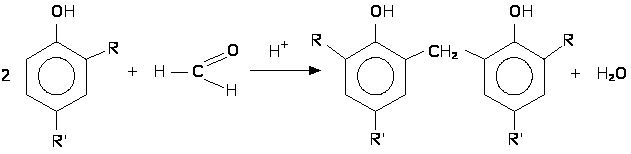
Для получения метиленбисфенолов применяют конденсацию 2,4-диалкилфенолов с формальдегидом в кислой среде:
4.1. Получение 4-(-хлорпропил)-2-трет.-бутилфенола (хлорид Ф-13)
4-(-хлорпропил)-2-трет.-бутилфенол удобнее получать деалкилированием 4 – (-хлорпропил)-2,6-ди-трет.-бутилфенола, синтез которого хорошо отработан на кафедре химии НГПУ взаимодействием 4-(-гидроксопропил)-2,6-ди-трет.-бутилфенола с хлорангидридами неорганических кислот: SOCl>2>, POCl, POCl>3>, PCl>5> и COCl>2>.
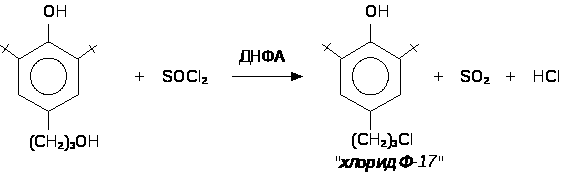
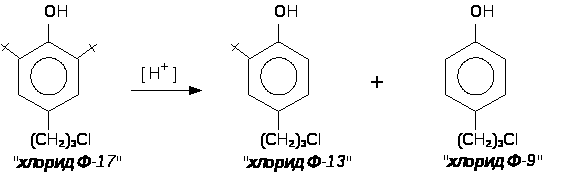
В качестве катализатора используют минеральные кислоты (H>2>SO>4>, HClO>4>) или КУ-2 (катионно-обменная смола, Н-форма). Процесс ведут до почти полной конверсии исходного хлорида Ф-17, так как эффективного метода очистки целевого хлорида Ф-13 от остатков хлорида Ф-17 не существует. Хлорид Ф-9 хорошо растворяется в щелочах и его отмывают 5%-ным раствором гидроксида натрия NaOH. Продукт перегоняют под вакуумом (ост. давление 1-2 мм рт. ст.). Потери, за счёт протекания побочного процесса деалкилирования хлорида Ф-13 и образования хлорида Ф-9, составляют не менее 30%.Полученный хлорид Ф-13 (4-(-хлорпропил)-2-трет.-бутилфенол) конденсируют с параформом в течении двух часов при 80С (растворитель: уксусная кислота). Выход 70% от теоретического. Хлорид Ф-13 (4-(-хлорпропил)-2-трет.-бутилфенол) используется как сырье при получении 4-(-меркаптопропил)-2-трет.-бутилфенола и 2,2’метилен-бис-[4-(-меркаптопропил)-6-трет.-бутилфенола].
4.2. Синтез 4-(-меркаптопропил)-2-трет.-бутилфенола
4-(-меркаптопропил)-2-трет.-бутилфенол получали взаимодействием 4-(-хлорпропил)-2-трет.-бутилфенола (хлорид Ф-13) с водноспиртовым раствором гидросульфида аммония при 120С (16 часов, автоклав).
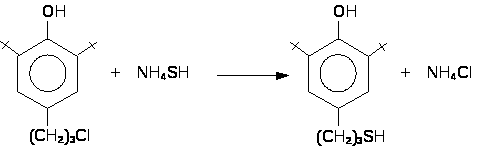
4.3. Синтез 2,2'– метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола].
2,2’метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенол] получали аналогично 4-(-меркаптопропил)-2-трет.-бутилфенолу.
Далее оба этих соединения используются в синтезе несимметричных сульфидов. Наиболее распространенным методом получения является алкилирование.
4.4. Синтез несимметричных сульфидов алкилированием 4-(-меркаптопропил)-2-трет.-бутилфенола и 2,2`метиленбис-[4-(-меркаптопропил)-6-трет.- бутилфенол] алкилгалогенидами в щелочном виде.
При синтезе в качестве алкилирующих и конденсирующих агентов используют изобутилен, стирол, формальдегид, тиохлориды. Изобутилен выделяют из бутан-бутиленовой фракции газов пиролиза нефтепродуктов или получают дегидрированием изобутана. Изобутилен для производства индивидуальных стабилизаторов содержит 98,5-99% основного вещества.
Стирол получают каталитическим дегидрированием этилбензола. Для производства стабилизаторов используют стирол, предназначенный для получения полистирола. Гидрохинон, который вводят в стирол для ингибирования его полимеризации при ректификации и хранении, практически не влияет на процесс алкилирования стиролом в производстве стабилизаторов.
Формальдегид, получаемый окислением метанола, используют в виде водного раствора. Примесь метанола в формалине обычно не влияет на синтез стабилизаторов. В лабораторных условиях предпочтительнее применять параформ.
Получение сульфидов осуществляли в открытой системе при кипении растворителя ( этиловый спирт, 96), в течение четырех часов, мольное соотношение тиол : галогенид : NaOH = 1 : 1,5 : 1,05 соответственно. Инертная среда - аргон. Экстрагент - бензол. Полученные продукты представляют собой вязкие, слабоокрашенные смолы.
5. Практическая часть
5.1. Наработка 4-(-хлорпропил)-2-трет.-бутилфенола (хлорид Ф-13)
В четырёхгорлую круглодонную колбу ёмкостью 1000 мл, снабжённую мешалкой, термометром, насадкой Дина-Старка и керном с трубкой (для подачи инертного газа аргона) загрузили расплав 564,3 г (1,9352 моля) 4-(-хлорпропил)-2,6-ди-трет.-бутилфенола (хлорид Ф-17), 115 г катионно-обменной смолы КУ-28 (Н-форма), 7 мл воды и нагрели, пропуская слабый ток аргона: 1 пузырек в секунду, на масляной бане (tбани=180-190) в течении 3,5 часов. Убрали нагрев, охладили реакционную смесь до 80-100С и прилили 250 мл бензола, перемешали и отфильтровали катионно-обменную смолу. Катионно-обменную смолу промыли на фильтре несколько раз бензолом (объем 250 мл). Фильтрат перенесли в делительную воронку (емкостью 2 л) и промыли пять раз 5%-ным раствором гидроксида натрия NaOH (общий объём 1500 мл). Прилили 200-300 мл разбавленной соляной кислоты, встряхнули, слили водно-кислотный слой до нейтрального значения pH (универсальная индикаторная бумага pH 0-12), осушили над безводным сульфатом натрия Na>2>SO>4>, отфильтровали осушителем и отогнали бензол на ротационном вакуум-испарителе. Полученную смолу перегнали при остаточном давлении 1-2 мм рт. ст. и собрали основную фракцию от 120 до 125С. Получили 219,4 г маслянистой бледно-желтой прозрачной жидкости (хлорид Ф-13). Выход 50% от теоретического.
5.2. Получение 4-(-меркаптопропил)-2-трет.-бутилфенола
В толстостенную стеклянную ампулу ёмкостью 100 мл загрузили 10 г хлорида Ф-13, 17 мл 20%-ого водного раствора гидросульфида аммония NH>4>HS и 20 мл этилового спирта. Ампулу запаяли и нагрели при 125С в течении 16 часов. После охлаждения ампулу отпаяли, содержимое перенесли в делительную воронку, прилили избыток разбавленной соляной кислоты, встряхнули и экстрагировали бензолом (объем 50-70 мл), промыли водой до нейтрального значения pH (универсальная индикаторная бумага pH 0-12), осушили над безводным сульфатом натрия Na>2>SO>4>, отфильтровали осушитель и отогнали бензол на ротационном вакуум-испарителе, получили 9,57г светло-жёлтой прозрачной вязкой смолы (4-(-меркаптопропил)-2-трет.-бутилфенол), СОВ по данным ГЖХ 95%, выход 94,7% от теоретического.
5.3. Получение 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола]
В толстостенную стеклянную ампулу ёмкостью 100 мл загрузили 10 г хлорида Ф-27 (2,2'-метиленбис-[4-(-хрорпропил)-6-трет.-бутилфенол]), 17 мл 20%-го водного раствора гидросульфида аммония NH>4>HS и 20 мл этилового спирта. Ампулу запаяли и нагрели при 125С в течении 16 часов. Выделение продукта провели аналогично выделению 4-(-меркаптопропил)-2-трет.-бутилфенола. Получили 9,97 г светло-жёлтой прозрачной очень вязкой смолы (2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенол]) Выход 98,5% по данным ГЖХ от теоретического.
5.4. Взаимодействие 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола] с бромистым бутилом (н-C>4>H>9>Br) в щелочной среде
В четырехгорлую остродонную колбу емкостью 25 мл, снабженную мешалкой, обратным холодильником и керном для подачи аргона, загрузили 3 г (0,0065 моль) меркаптана Ф-27, 1,8 мл бромистого бутила, 0,65 г гидроксида натрия и 10 мл этилового спирта (96). Нагрели до кипения и выдержали при постоянном перемешивании и слабом токе аргона в течении 4-х часов. После охлаждения нейтрализовали смесь раствором соляной кислоты. Содержимое колбы перенесли в делительную воронку, дважды провели экстракцию бензолом; объединённый бензольный экстракт отмыли дистиллированной водой и осушили над безводным сульфатом натрия Na>2>SO>4.>
Осушитель отфильтровали, и отогнали бензол на ротационном вакуумном испарителе.
Получили вязкую тёмно-жёлто-зеленоватую смолу, массой 3,9 г.
5.5. Взаимодействие 2,2'-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола] с йодистым этилом (C>2>H>5>J) в щелочной среде
В четырехгорлую остродонную колбу емкостью 25 мл, снабженную мешалкой, обратным холодильником и керном для подачи аргона, загрузили 3,72 г (0,0065 моль) меркаптана Ф-27, 2,2 мл йодистого этила, 0,65 г гидроксида натрия и 10 мл этилового спирта (96). Нагрели до кипения и выдержали при постоянном перемешивании и слабом токе аргона в течении 4-х часов. После охлаждения нейтрализовали смесь раствором соляной кислоты. Содержимое колбы перенесли в делительную воронку, дважды провели экстракцию бензолом; объединённый бензольный экстракт отмыли дистиллированной водой и осушили над безводным сульфатом натрия Na>2>SO>4.>
Осушитель отфильтровали, и отогнали бензол на ротационном вакуумном испарителе.
Получили вязкую жёлто-зеленоватую смолу, массой 3,86г.
5.6. Взаимодействие 4-(-меркаптопропил)-2-трет.-бутилфенола с йодистым этилом (C>2>H>5>J) в щелочной среде.
В четырехгорлую остродонную колбу емкостью 25 мл, снабженную мешалкой, обратным холодильником и керном для подачи аргона, загрузили 3 г (0,013 моль) меркаптана Ф-13, 1,6 мл йодистого этила, 0,55 г гидроксида натрия и 10 мл этилового спирта (96).Нагрели до кипения и выдержали при постоянном перемешивании и слабом токе аргона в течении 4-х часов. После охлаждения нейтрализовали смесь раствором соляной кислоты. Содержимое колбы перенесли в делительную воронку, дважды провели экстракцию бензолом; объединённый бензольный экстракт отмыли дистиллированной водой и осушили над безводным сульфатом натрия Na>2>SO>4.>
Осушитель отфильтровали, и отогнали бензол на ротационном вакуумном испарителе.
Получили вязкую светло-жёлтою смолу, массой 3,3г .
5.7. Взаимодействие 4-(-меркаптопропил)-2-трет.-бутилфенола с бромистым бутилом (н-C>4>H>9>Br) в щелочной среде.
В четырехгорлую остродонную колбу емкостью 25 мл, снабженную мешалкой, обратным холодильником и керном для подачи аргона, загрузили 3 ,2 (0,0138 моль) меркаптана Ф-13, 2,3 мл йодистого этила, 0,58 г гидроксида натрия и 10 мл этилового спирта (96). Нагрели до кипения и выдержали при постоянном перемешивании и слабом токе аргона в течении 4-х часов. После охлаждения нейтрализовали смесь раствором соляной кислоты. Содержимое колбы перенесли в делительную воронку, дважды провели экстракцию бензолом; объединённый бензольный экстракт отмыли дистиллированной водой и осушили над безводным сульфатом натрия Na>2>SO>4.>
Осушитель отфильтровали, и отогнали бензол на ротационном вакуумном испарителе.
Получили вязкую светло-жёлтою смолу, массой 4,7г.
6. Выводы
Освоена методика деалкилирования пространственно-затруднённых фенолов на катионно-обменной смоле КУ-28 и осуществлена наработка 200 г 4-(-хлорпропил)-2-трет.-бутилфенола.
Получен 4-(-меркаптопропил)-2-трет.-бутилфенол взаимодействием 4-(-хлорпропил)-2-трет.-бутилфенола с 20%-ным водным раствором гидросульфида аммония NH>4>HS в закрытой системе.
Получен 2,2’-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенол] взаимодействием 2,2’-метиленбис-[4-(-хлорпропил)-6-трет.-бутилфенола] с 20%-ным водным раствором гидросульфида аммония в закрытой системе.
Взаимодействием
4-(-меркаптопропил)-2-трет.-бутилфенола
в щелочной среде с йодистым этилом
C>2>H>5>J и бромистым бутилом
н-C>4>H>9>Br получено два
продукта, содержащих несимметричные
сульфиды.
Взаимодействием 2,2’-метиленбис-[4-(-меркаптопропил)-6-трет.-бутилфенола] в щелочной среде с йодистым этилом C>2>H>5>J и бромистым бутилом н-C>4>H>9>Br получено два смолоподобных продукта, содержащих несимметричные сульфиды.
Полученные несимметричные сульфиды на основе 4-(-меркаптопропил)-2-трет.-бутилфенола являются теоретически возможными перспективными антиоксидантами, но их химические свойства ещё не изучены.
Список литературы
1. Адельшина Е.Б. Синтез новых пространственно-затруднённых пара- функционально-замещённых метиленбисфенолов. Дипломная работа. – Новосибирск: НГПУ, 1996.
2. Берлин А.Я. Техника лабораторных
работ в органической химии. –
М.:
Химия, 1973.
3. Горбунов Б.Н., Гурвич Я.А., Маслова И.П. Химия и технологии стабилизаторов полимерных материалов. – М.: Химия,1981.
4. Ершов В.В., Никифоров Г.А., Володькин А.А. Пространственно-затруднённые фенолы. – М.: Химия,1972.
5. Карякин Ю.В, Ангелов И.И. Чистые химические вещества. – М.: Химия, 1974.
6. Общая органическая химия, том 5. – М.: Химия,1983.
7. Органикум. Практикум по органической химии, том 1. – М.:Мир,1973.
8. Птицына О.А. и др. Лабораторные
работы по органическому синтезу. –
М.:
Просвещение, 1979.
9. Справочник химика, том 2. – Л.: Химия, 1971.