Исследование совместного электровосстановление гадолиния и криолита в галогенидных расплавах
Министерство общего и профессионального образования
Российской Федерации
Кабардино-Балкарский Ордена Дружбы народов Государственный
Университет им. Х.М.Бербекова
Химический факультет
Кафедра неорганической и физической химии
КВАЛИФИКАЦИОННАЯ РАБОТА
на тему:
“Исследование совместного электровосстановления гадолиния и криолита в галогенидных расплавах”
Дипломник: студент 4 курса ХФ ______________Жекамухов А.Б.
Научный руководитель: доктор
химических наук, профессор
кафедры физической химии
__________________Кушхов Х.Б.
рецензент:
Нальчик 1999
Содержание
стр.
Введение……………………………………………………………………4
Глава I.
Строение и электрохимическое поведение расплавленных
галогенидных систем содержащих гадолиний и алюминий.……………6
1.1.1.Строение индивидуального расплава трихлорида гадолиния.………..6
1.1.2. Строение растворов расплава трихлорида гадолиния в хлоридах
щелочных металлов..………………………………………………..……..….8
1.1.3. Строение растворов расплава трихлорида гадолиния в хлоридно-фторидных расплавах..………………………………………………..………10
1.1.4. Строение гадолинийсодержащих фторидных расплавов.…...………11
1.2. Электрохимическое поведение гадолинийсодержащих галогенидных расплавов……………..………………………………………………..………16
Электрохимическое поведение гадолинийсодержащих хлоридных расплавов.…………..………………………………………………..……..16
Электрохимическое поведение гадолинийсодержащих фторидных расплавов.…………..………………………………………………..……..19
Строение и химические свойства алюминийсодержащих галогенидных расплавов.………..………………………………………………..…....21
Электрохимическое поведение алюминийсодержащих галогенидных расплавов.………..………………………………………………..…....24
Глава II.
Методы исследования и методика проведения экспериментов.
Выбор электрохимических методов исследования электродных процессов в расплавленных средах и применяемая аппаратура.……..…....28
Конструкция высокотемпературной кварцевой электрохимической ячейки и электродов.…………………………………………………..37
Методика получения безводного хлорида гадолиния.……………...39
Глава Ш.
Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах.
3.1. Исследование электровосстановления фторалюминат-иона на фоне
хлоридного расплава KCl-NaCl, влияние фторид-иона..…………...40
Исследование совместного электровосстановления фторалюминат-
иона и хлоридных комплексов гадолиния на фоне хлоридных и хлоридно-фторидных расплавов………………………………….……...46
Выводы……………………………….……………………….……………...52
Литература…………………….…….……………………….……………....53
ВВЕДЕНИЕ.
Судя по последним публикациям, нынче довольно трудно отметить те стороны жизни, где бы не находили применение редкоземельные элементы. Эти металлы и их сплавы обычно извлекаются из хлоридных и фторидных систем. Соответственно существует достаточно большое количество работ по хлоридным расплавам, однако по хлоридно-фторидным и фторидным системам, особенно по многокомпонентным фторидным расплавленным солям опубликовано довольно ограниченное число работ. [1]
На основе РЗМ получают многие уникальные материалы, которые находят широкое применение в различных областях науки и техники. Например, РЗМ используют как добавки к стали и в сплавах с другими металлами, в производстве материалов, адсорбирующих водород (например, LaNi>5>), как добавки к ядерным материалам, в качестве пирофорных материалов, в специальной керамике, оптических стеклах (стекла для TV-экранов), в производстве катализаторов для утилизации выхлопных газов, а также в получении магнитных материалов (например (Nd>1-x>Dy>x>)>15>Fe>77>B>8> или (Nd>1-x>Dy>x>)>15>Fe>76>B>8>) и так далее.
Перечисленное выше – лишь небольшая часть из списка областей применения РЗМ. Развитие высоких технологий все более и более вовлекает использование РЗМ, степень чистоты которых должна быть очень высока. В этом отношении не будет преувеличением отнести РЗЭ к материалам XXI века.
Перспективным способом получения чистых РЗМ и их сплавов с другими металлами является электролиз расплавленных солей РЗЭ, а также их смесей. Для эффективного использования электролитического метода получения РЗМ необходимо располагать надежной информацией об электрохимическом поведении комплексов, образуемых ионами РЗЭ в расплавах, а также химических реакциях, сопровождающих процессы электроосаждения. Поэтому является необходимым выяснение механизма электровосстановления комплексных ионов РЗЭ, в частности совместного электровосстановления гадолиния и криолита в галогенидных расплавах.
Глава I.
Строение и электрохимическое поведение расплавленных галогенидных систем, содержащих гадолиний и алюминий.
Строение индивидуального расплава трихлорида
гадолиния.
Кристаллические хлориды элементов от лантана до европия, включая гадолиний, имеют гексагональную решетку, а от диспрозия до лютеция (также и хлорид иттрия),- моноклинную. Температура плавления хлоридов РЗЭ постепенно снижается от лантана до диспрозия, а затем снова возрастает до лютеция; летучесть хлоридов увеличивается с возрастанием порядкового номера элемента, т.е. с увеличением ионного радиуса.
Безводные трихлориды очень гигроскопичны и расплываются на воздухе. Хорошо растворяются в воде и спирте. Поглощают NH>3>, выделяя теплоту и образуя аммиакаты LnCl>3>.n NH>3>. Заслуживает внимания тот факт, что монокристалл GdCl>3> при низких температурах становится ферромагнетиком при 2,2˚К [2]. В данной работе отмечается, что в ряду лантаноидов трихлориды от La до Gd включительно изоструктурны (гексагональная типа UCl>3>). Здесь же отмечается, что GdCl>3> – вещество с высокой температурой плавления (602˚С), в вакууме при высокой температуре летуче, что подтверждается данными по давлению паров [3].
Под строением ионного расплава понимают состав и взаимное расположение частиц, из которых он состоит. Первые выводы о строении ионных расплавов были сделаны на основании изучения их физико-химических свойств. Значительный прогресс в наших представлениях о строении ионных расплавов был достигнут в результате рентгеноструктурных и спектроскопических исследований. Вопреки прежним положениям, в соответствии с которыми жидкости вообще и ионные расплавы в частности считались отдаленными аналогами газов, а из рентгеновских исследований вытекает, что их нужно рассматривать как аналоги твердых кристаллических структур.
Однако если в структуре твердых кристаллов трихлорида гадолиния имеются как ближний, так и дальний порядок во взаимном расположении частиц, то в ионном расплаве сохраняется лишь ближний порядок. При плавлении кристаллов этого вещества дальний порядок разрушается. Рентгеновские исследования [4] несколько неожиданно показали уменьшение межионных расстояний в этом случае. Данный факт объясняется тем, что увеличение объема ионного вещества при его плавлении происходит не за счет возрастания параметров «кристаллической решетки», а «дефектов» в расплавленном ионном кристалле. Такое состояние ионного вещества называется квазикристаллическим. К тому же, по сравнению с твердым GdCl>3>, ионный расплав трихлорида гадолиния характеризуется большими свободными объемами. В работе [5] отмечается, что в расплавленном GdCl>3> в качестве структурных единиц существуют также кластерные димеры и более полимеризованные комплексные анионы.
Итак, на основании рентгенографических исследований [6] структуры расплавленного GdCl>3> можно сделать следующие выводы:
расстояния между разноименными ионами меньше, а между одноименными больше в солевом расплаве, чем в кристаллическом трихлориде гадолиния;
координационное число в расплаве ниже, чем в твердом GdCl>3>;
в высокой степени сохраняется ближний порядок во взаимном расположении частиц.
На основании всего сказанного можно говорить о следующих составных слагающих ионного расплава трихлорида гадолиния: разноименно заряженные ионы (Gd3+, Cl-), недиссоциированные молекулы, ассоциаты (например Gd>2>Cl>6>), свободные объемы (дислокации, дырки).
Строение растворов расплава трихлорида гадолиния в
хлоридах щелочных металлов
Изучение взаимодействия хлоридов РЗМ с хлоридами щелочных металлов представляет большой интерес для характеристики расплава, кроме того, чистые хлориды РЗМ и их смеси с хлоридами щелочных металлов являются одними из исходных соединений для получения редкоземельных металлов высокой чистоты.
В расплавленном трихлориде гадолиния и его смесях с хлоридами щелочных металлов образуются прочные комплексные группировки с большим числом аддентов, что подтверждается различными методами исследований.
Например, для изучения комплексообразования РЗЭ в солевых хлоридных расплавах применены методы изоморфной сокристаллизации и ионного обмена [7]. В данной работе исследованы хлоридные расплавы, содержащие микроконцентрации РЗЭ.
Из диаграмм состояния бинарных систем типа MIIICl>3 >- MICl, где MIII – РЗЭ; MI – щелочной металл, следует, что все хлориды РЗЭ образуют конгруэнтные либо инконгруэнтные соединения с хлоридами K, Rb, Cs. Для хлорида натрия такие соединения образуют РЗЭ, начиная с самария.
Образование анионных хлоридных комплексов лантаноидов в расплавах констатируется также путем изучения ИК – спектров при температуре 400 – 800 ˚С. при этом хлориды лантаноидов в расплавленной эвтектике LiCl – NaCl – KCl в области 0,8 – 2,6 µ имеют характеристические полосы поглощения, найденные в расплавах, соответствующих нитратным комплексам.
Соединения типа KLnCl>4> существуют в расплаве и в парообразном состоянии, что показано тензометрическими исследованиями и подтверждено масс-спектроскопией.
Интересна работа японских ученых A.Matsuoka и др. [8], в которой при помощи Раман-спектроскопии и молекулярно-динамического моделирования были изучены структуры систем GdCl>3> – ACl (A – Li, K, Na). В результате найдено, что октаэдрические комплексные анионы GdCl>6>3- не соединены друг с другом в расплавах с концентрацией GdCl>3> менее 25 мол.%, за исключением системы GdCl>3> – LiCl.
В работе [9] исследованы системы GdCl>3> – NaCl GdCl>3> – KCl. В первом случае в системе образуется инконгруэнтно плавящееся химическое соединение Na>3>GdCl>6>. Перитектическая точка отвечает 30 % GdCl>3> и температуре 486˚С. в случае системы GdCl>3> – KCl образуется два конгруэнтно и одно инконгруэнтно плавящихся соединения. Соединение KGd>3> Cl>10> плавится конгруэнтно при 580˚С. Соединение K>2>Gd Cl>5> плавится инконгруентно при 542˚С. Конгруэнтно плавящееся соединение K>3>GdCl>6> характеризуется температурой плавления 825˚С и имеет полиморфное превращение при 380˚С.
Интересно отметтить работу японских ученых Y.Katayama, R.Hagiwara и Y.Ito [31], которые исследовали образование оксихлоридов и оксидов РЗЭ в эвтектическом расплаве LiCl – KCl, содержащем исследуемый РЗЭ (III) и оксид лития. Отмечено, что когда к расплаву, содержащему 1 мол.% трихлорида гадолиния добавили 0,5 мол.% хлорида лития, наблюдалось осаждение лишь GdOCl. Дальнейшее добавление Li>2>О (~1 мол.%) дает осаждение Gd>2>O>3> и GdOCl.
Строение растворов расплава трихлорида гадолиния в
хлоридно-фторидных расплавах
Как указывалось в работе [10], при введении в хлоридный расплав, содержащий ионы Gd3+, фторид-иона происходит последовательное замещение хлорид-иона фторид-ионом во внешней координации. При большом избытке фтора (более чем десятикратном) формируется чисто фторидный комплекс, т. е. Происходит полное вытеснение хлора из внешнесферной координации.
Итак, при малых концентрациях фторид-иона имеет место реакция:
GdCl>6>3- + xF- → [GdCl>6-x>F>x>]3- + xCl- ,
то есть при х<6.
При больших избытках:
GdCl>6>3- +6F- → [GdF>6>]3- +6Cl- .
Таким образом, в концентрированных по фтору расплавах, где мольное отношение [F] : [Gd] > 3, преобладающая доля фторидных комплексов приходится на группировки GdF>3>, конечно, не нейтральные, а в виде смешанных фторидно-хлоридных анионов типа GdF>3>Cl-, GdF>3>Cl>2>2- и GdF>3>Cl>3>3-. В разбавленных по фтору расплавах преобладают группировки GdF2+, а в промежуточной области, где изотермы по наклону отвечают z = 2 (GdF>z>) – группировки GdF>2>+ также в виде смешанных фторидно-хлоридных ионов типа GdFCl>3> -, GdF>2>Cl>2>-, и т. п. [11].
Строение гадолинийсодержащих фторидных расплавов
Фториды РЗЭ относятся к наименее растворимым соединениям этой группы элементов. В расплавах фторидов редкоземельных и щелочных металлов образуются соли NaLaF>4>, KСeF>4>, NaYF>4>, а также соединения состава M>3>LnF>6> (Ln – Ce(III), Y, Sm, Gd, Er; M – Na, K, Rb, Cs).
Безводные фторидные
комплексы РЗМ с щелочами и щелочноземельными
металлами во внешней сфере изучали в
основном при исследованиях систем MF
– LnF>3>
или MF>2>
– LnF>3>.
На основании большого экспериментального
материала [12] был предложен эмпирический
критерий возможности образования
соединений в системах MF –
LnF>3>
(Тома). Предлагается рассматривать
значение отношений ионных радиусов
Ln3+
и М+
или отношение напряженностей полей
катионов Ln3+
и М+.
При отношении
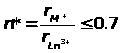 постулируется невозможность существования
соединений; при 0,7<n*<1.4 в системе MF>3>
– LnF>3>
существуют соединения MLnF>4>,
а при n*>>1.40 трифториды образуют с
MF соединения
M>3>LnF>6
>[13 - 15].
постулируется невозможность существования
соединений; при 0,7<n*<1.4 в системе MF>3>
– LnF>3>
существуют соединения MLnF>4>,
а при n*>>1.40 трифториды образуют с
MF соединения
M>3>LnF>6
>[13 - 15].
Соединения состава M>3>LnF>6 >плавятся конгруэнтно, тогда как соединения состава MLnF>4> плавятся с разложением. Термическая устойчивость M>3>LnF>6> увеличивается в ряду Na – Cs. В системах фторид цезия – фторид лантаноида реализуются соединения Cs>3>LnF>6>> >для всех РЗЭ от церия до лютеция. В системах RbF-LnF>3> соединения состава 3:1 образуются начиная с празеодима, а в системах КF-LnF>3 >подобные соединения образуются лишь начиная с самария.
Фториды M>3>LnF>6> можно синтезировать фторированием смеси хлоридов щелочного металла и РЗЭ1 (1-кроме церия, празеодима, неодима, тербия и диспрозия) в молярном соотношении 3:1 при температуре 300-400˚С при спекании смеси фторида щелочного металла и трифторида РЗЭ в атмосфере азота (аргона). Следует отметить, что спекание лучше проводить в течение двух часов при температуре на 50˚С ниже температуры плавления образующегося комплекса (особенно это относится к рубидий- и цезийсодержащим комплексам). Применение другого режима синтеза зачастую приводит к загрязнению продукта из – за взаимодействия с материалом реактора, либо к непомерному увеличению времени синтеза, что, впрочем, не исключает заметной коррозии реактора.
Структурные данные для фторокомплексов M>n>LnF>3+n> не полны. Двойные фториды MLnF>4> гексагональны и изоструктурны по всему ряду РЗЭ, либо обладают сходной структурой. Некоторые отличия в симметрии решетки, наблюдающиеся при замещении ионов Nd3+ на ионы других РЗЭ, объясняются частым смещением катионов, находящихся в различных позициях большинство комплексов РЗЭ обладают полиморфизмом.
Кристаллографические характеристики фторокомплексов
гадолиния
Таблица 1.1.
Параметры элементарных ячеек гексафторгадолинидов калия |
||||||
|
α-K>3>GdF>6> |
β-K>3>GdF>6> |
γ-K>3>GdF>6> |
||||
|
Куб.простр.группа Fm3m (z=4) |
Тетрагональная пространственная группа 14/mmm (z=2) |
Моноклинная пространственная группа Р2>1/n >(z=2) |
||||
|
a>0> |
a>0> |
c>0> |
a>0> |
b>0> |
c>0> |
β>0> |
|
9,305 |
6,580 |
9,305 |
6,368 |
6,520 |
9,069 |
90˚40΄ |
Лантаноиды во фторидных расплавах образуют устойчивые трехвалентные комплексы типа MeIMeIIIF>4> (MeI - Li, Na, K) и MeI>3>MeIIIF>6 >(MeI – K, Rb, Cs, NH>4>). Несколько лет назад Тома предсказал, что если отношение радиусов катионов Ме+/ Ме3+ находятся в интервале 0,77 – 1,4, комплексы типа МеIGdF>4>> >могут существовать, а если Ме+/ Ме3+>1,43, то будет образовываться конгруэнтно плавящиеся комплексы типа Ме>3>IGdF>6>.
Б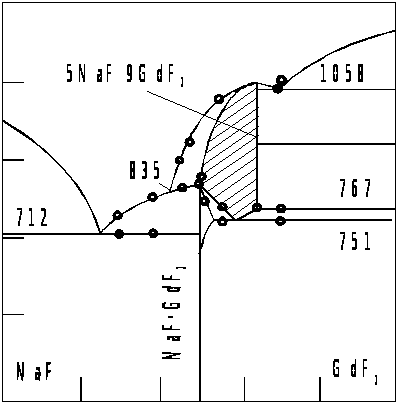
ольшинство
комплексов было идентифицировано в
фазовых исследованиях [13-21] или при
совместном сплавлении [22-25] стехиометрических
количеств фторидов, входящих в состав
соединений. Большое число равновесных
фазовых диаграмм собрано в опубликованном
обзоре Тома [26]. В отдельных случаях
исследуемые фторидные системы были
получены фторированием смесей 3:1 (хлорида
щелочного металла и галогенида лантаноида)
при 300 – 400˚С [27]; гидрофторированием
смеси фтористого натрия и полуторной
окиси лантоноидов [24] или нагреванием
смесей фтористого натрия и двуокиси
металла (металл – церий, празеодим,
тербий) при 450 - 650˚С в смеси водорода и
фтористого водорода.
Рис.1 Диаграмма состояния системы NaF-GdF>3>
Для получения полной картины строения фторидных расплавов, содержащих РЗЭ, в частности гадолиний, исследованы системы фторид натрия – фторид РЗМ и построены полные фазовые диаграммы в работе [14,15]. На рисунке 1 представлена диаграмма системы NaF – GdF>3>, где образуются равновесные комплексы NaGdF>4>> >и Na>5>Gd>9>F>32>. Первый комплекс 1:1 NaGdF>4> имеет гексагональную симметрию при низкой температуре, а при температуре выше 700˚С они превращаются в неупорядоченные кубические фазы переменного состава, подобные флюориту [14]. Верхний предел состава кубических фаз, установленный по показателю преломления, постоянной решетки и данными фазового перехода, соответствует составу Na>5>Gd>9>F>32>.
Твердые растворы кубической симметрии неустойчивы при температуре ниже 800 - 830˚С, и они при охлаждении переходят в различные продукты, состав которых зависит от состава разлагающихся фаз. Например, при эквимолярных составах фторидов наблюдается упорядочение и образуется фаза NaGdF>4> с гексагональной симметрией. Из фазы Na>5>Gd>9>F>32> в системе образуются гексагональные NaGdF>4> и GdF>3>.
Комплексы систем: фторид калия, рубидия, цезия – трифторид РЗМ изучены менее подробно. Опубликовано относительно небольшое число сведений о комплексах, образуемых фторидом калия и трифторидом лантаноидов [22, 25, 28, 29].
Другими авторами были исследованы фторидные системы РЗ – К [30]. Фторид калия совместно с фторидами редкоземельных металлов образуют два типа комплексных соединений – КЭF>4> и К>3>ЭF>6>, где Э – Y3+, La3+, Nd3+, Gd3+. Особенности образования соединений с различной координацией ионов фтора в расплавленном состоянии подтверждаются также результатами измерений плотности и электропроводности фторидных смесей. С уменьшением радиуса иона комплексообразователя – редкоземельного элемента – устойчивость фторидных комплексов возрастает. Минимум на изотерме мольного объема и молярной электропроводности для системы KF - GdF>3 >отвечает составу, содержащему 25 мол.% трихлорида гадолиния. Такой состав соответствует наиболее плотной упаковке ионов, которую можно объяснить высокой устойчивостью фторидных комплексов криолитового типа К>3>GdF>6>.
Для всех расплавленных смесей имеет место отклонение величин мольного объема от аддитивности. Величина молярной электропроводности в указанных выше системах понижается с повышением мольно-долевой концентрации фторида редкоземельного элемента. Это явление объясняется, по-видимому, присутствием в расплаве наряду с простыми ионами комплексных ионов типа: ЭF>4>- и ЭF>6>3-.
Электрохимическое поведение гадолинийсодержащих галогенидных расплавов
1.2.1. Электрохимическое поведение гадолинийсодержащих хлоридных расплавов.
Первая попытка получения редкоземельных металлов электролизом их расплавленных соединений была предпринята в конце XIX века. Полученные из хлоридных расплавов церий и лантан были в довольно чистом состоянии и больших количествах [32]. Тогда же и были отмечены основные трудности электролиза расплава соединений тяжелых редкоземельных металлов,- улетучивание трихлоридов РЗМ и относительно высокое содержание окисей в получаемом продукте.
Исследования по получению РЗМ и их сплавов электролизом расплавленных солей, проведенные в КНР показали, что при электролизе расплавов хлоридов состава NaCl-MeCl>3>, KCl-MeCl>3>, KCl-CaCl>2>-MeCl>3>, CaCl>2>-BaCl>2>-MeCl>3> и других (где М - РЗМ) выход по току колеблется в пределах 50-80% [33]. Он снижается при повышенной растворимости РЗМ в его хлориде, при образовании оксихлорида (взаимодействие расплавов с кислородом или окисью щелочного металла), из-за присутствия в электролите металлических и неметаллических примесей (главным образом ионов SO>4>2- и PO>4>3-). Посредством электролиза с жидким металлическим катодом получают сплавы Al-Ce, Al-La (~12% РЗМ), Al-Y (~ 94% РЗМ) и Al-Nd (16-24% Nd) при выходе по току в пределах 80-100%.
Авторами [39] исследован процесс электроосаждения смесей соединений РЗМ в эвтектике расплава LiCl-KCl. При соотношении 3:1 LiCl-GdCl>3> и температуре 723К из указанной эвтектики осаждалось соединение K>3>GdCl>6>. В присутствии ионов кислорода из расплава оксид гадолиния и/или оксихлорид гадолиния. Образование Gd>2>O>3> и GdOCl сторого зависит от концентрации ионов кислорода в расплаве.
Интересна работа японского ученого Masatoshi Iizuka [40], в которой были определены коэффициенты диффузии церия и гадолиния. Исследования проводились в эвтектическом расплаве хлоридов лития и калия при температурах от 673 до 823К хронопотенциометрическим методом. Для определения коэффициентов диффузии применялось усовершенствованное уравнение Сэнда. Коэффициент диффузии описан в следующем уравнении:
log D>Gd> = -2.78 (±0.128) – [1670 (±94.3)] / T . (D>Gd> : cm2/s )
Энергии активации для диффузии и коэффициентов диффузии Gd3+-ионов в эвтектике LiCl-KCl обсуждены в соотношении с их ионными радиусами и стабильностью их комплексных ионов.
В работе [41] приведены результаты изучения поляризации молибденового и жидкого цинкового катодов в расплаве NaCl-KCl, содержащем 2-13 мас.% трихлорида гадолиния, при температуре 700-800°С, а также данные по электролизу расплавов с получением металлического гадолиния.
Опыты проводили в трехэлектродной электролитической ячейке в атмосфере очищенного аргона. Трихлорид гадолиния получали хлорированием окиси гадолиния хлористым водородом или четыреххлористым углеродом в расплаве NaCl-KCl. Потенциалы катодов (молибден и цинк) измеряли относительно хлорного электрода сравнения.
При электролизе с использованием молибденового катода выход по току не превышал 60%. При этом отделение захваченного электролита от дендритообразных кристаллов металлического гадолиния затруднено, что обуславливает его загрязнение.
Авторами [41] приводится таблица, из которой видно, что с ростом температуры выход по току снижается, а с увеличением концентрации гадолиния при прочих равных условиях возрастает.
|
Содержание Gd в расплаве, мас.% |
Т, °С |
I,A/см2 |
Количество пропущенного электричества, Q*102А/ч |
Выход по току, % |
Содержание Gd в сплаве, мас.% |
|
12,0 |
700 |
0,045 |
4,5 |
98 |
7,0 |
|
12,0 |
750 |
0,030 |
5,0 |
70 |
14,4 |
|
12,0 |
800 |
0,450 |
4,5 |
41 |
7,6 |
|
7,4 |
800 |
0,050 |
19,5 |
27 |
13,2 |
|
7,4 |
750 |
0,030 |
3,5 |
66 |
6,8 |
|
3,4 |
750 |
0,030 |
6,0 |
52 |
2,3 |
|
13,2 |
750 |
0,030 |
4,5 |
96 |
12,0 |
|
13,2 |
750 |
0,085 |
4,0 |
114 |
13,2 |
|
13,2 |
750 |
0,120 |
4,0 |
120 |
15,2 |
С увеличением плотности тока увеличивается выход по току. Превышение выхода по току 100% свидетельствует, по-видимому, о том, что при выделении Gd на жидком Zn-катоде в расплаве в равновесии с Gd-Zn сплавом наряду с ионами Gd3+ присутствуют ионы Gd2+. Полученный осадок идентифицировался методом рентгеноструктурного анализа как металлический гадолиний с кристаллической структурой плотноупакованной гексагональной решетки с параметрами а=3,619±0,017; с=5,75±0,03.


1.2.2. Электрохимическое поведение гадолинийсодержащих
фторидных расплавов.
Фториды, растворяющие РЗМ-оксиды, менее гигроскопичные, но химически агрессивны по отношению к керамическим материалам. При электролизе расплавленной смеси состава (в %): МеF>3>-73, BaF>2>-10, LiF-17 при температуре 900°С достигали выхода по току 93%, а при увеличении концентрации РЗМ – 97%.
В течении 60 – 70х годов исследовательский центр Peno Горного Бюро США выполнил ряд работ по электролитическому получению РЗМ, иттрия и их сплавов электролизом оксидов, которые растворяли в расплавленных смесях систем фторид РЗМ – LiF (иногда с добавкой BaF>2>) [34]. Растворимость оксидов РЗМ в таких электролитах составляет 2 – 4%. Электролиз для получения неодима, празеодима, гадолиния и иттрия вели в графитовых тиглях со стержневыми графитовыми анодами и вольфрамовыми катодами. Наложением переменного тока обеспечивали дополнительный нагрев электролита. Поддон тигля охлаждали для образования корки электролита, защищающей металл от контакта с графитом. Электролиз при температурах ≥1120°С сопровождался заметным взаимодействием РЗМ с электролитом и графитом. С целью снижения рабочей температуры электролиз вели с получением относительно легкоплавких бинарных сплавов РЗМ, используя катоды из железа, кобальта и марганца. Этим способом получали сплавы Fe-Y, Fe-Dy, Co-Sm, Co-Y, Co-Nd, Co-Dy, Mn-Y, Mn-Gd. Электронное рафинирование гадолиния в электролите, состоящем из фторида гадолиния с добавлением фторида лития, фторида бария и хлорида лития, позволяет получить РЗМ с содержанием примесей (в млн-1) H>146>, N>17>, О>85> [35]. Этим методом получен гадолиний с концентрацией примесей (в млн-1) H>500>, N>10>, О>300>, С>350>.
Спеддинг Ф. И Даан А..[37] предложили для электрохимического получения РЗМ расплавленную систему фторид РЗМ – фторид лития – фторид щелочноземельного металла. Далее авторами исследуются при помощи дериваторгафии и рентгенографии электролиты промышленных ванн для получения мишметалла, что показало наличие большого количества фазы твердого раствора оксифторида церия CeOF с оксифторидами других РЗМ, значительное количество фторидов РЗМ, причем с увеличением степени окисления расплава в электролита отмечено образование твердого раствора оксидов РЗМ на основе оксида церия. Кроме того, как отмечают авторы [36], как в промышленных, так и в искусственных электролитах зафиксировано появление Х-фазы, интенсивность которой возрастает с увеличением в составе электролита концентрации фторида бария. По данным ASTM структура Х-фазы идентифицирована со структурой сложных фторидов типа MeIMeIIF>8>, образованных фторидами щелочноземельных и редкоземельных металлов и соответствует в нашем случае соединению типа BaCe>2>F>8> [38]. Рентгеновские исследования составов искусственных смесей электролитов, не содержащих фторид бария, показали отсутствие Х-фазы. Термографические исследования, проведенные на дериватографе ОД-103, позволили обнаружить на кривых нагревания промышленных электролитов наличие двух эффектов, отвечающих плавлению фаз на основе флюорита и фторидов РЗМ при температурах 610 – 640°С и 680 - 700°С соответственно.
Так как в электролитах для получения мишметалла присутствуют оксидные соединения РЗМ [36] и вследствие взаимодействия фторидов РЗМ с кислородом воздуха и влаги в расплаве возможно образование сложных оксифторидных комплексов типа BaCe>2>F>8-2x>O>x>, которые могут участвовать в электрохимическом процессе по схеме:
BaCe>2>F>8-2x>O>x>
 Ba++
+ [Ce>2>F>8-2x>O>x>]΄΄
Ba++
+ [Ce>2>F>8-2x>O>x>]΄΄
[Ce>2>F>8-2x>O>x>]΄΄
 2Ce+++
+ (8-2x)F΄ + xO΄΄
2Ce+++
+ (8-2x)F΄ + xO΄΄
на катоде: Ce+++ + 3e = Се металл;
на аноде: (8-2x)F΄ → (8-2х)F>2 >/ 2 + (8-2x)e
x O΄΄→ x/2 O>2>
Электрохимическое поведение алюминийсодержащих галогенидных расплавов
Строение и химические свойства алюминийсодержащих
галогенидных расплавов.
Исходя из традиционных соображений, алюминийсодержащие галогенидные системы являются сравнительно подробно изученными. Эти соображения подразумевают отсутствие до сегодняшнего дня конкурентоспособных альтернативных технологических решений получения как металлического алюминия, так и соединений и покрытий на его основе. Наибольший практический интерес при этом представляет алюминийсодержащие галогенидные расплавы, преимущественно в виде индивидуальных солей.
Трактовка колебательных спектров и структуры алюминийсодержащих галогенидных расплавов основывается на довольно обширном экспериментальном материале [42-47].
Спектры фторидных систем согласуются с наличием в расплаве равновесия между комплексными ионами AlF>4>- и AlF>6>3-. Первому соответствует поляризационная линия 620 – 630 см –1 и линии 210, 760, 322 см –1, характеризующие тетраэдрическую симметрию. Второй на основании линии 556 - 575 и 297см–1 может характеризоваться октаэдрической симметрией, вероятно, существенно искаженной, судя по большим ширинам линии СКР. Рассчитано, что в расплаве криолита AlF>6>3- диссоциирован на 60 – 80 % на AlF>4>- и F- ионы.
Расплавы хлоридов алюминия и щелочных металлов исследованы методом СКР в широком диапазоне состава. До содержания 50 мол.% AlCl>3> в расплаве наблюдаются линии, в основном, тетраэдрического иона AlCl>4>– : 350, 122, 487 и 182 см-1. По мере увеличения содержания AlCl>3> в смеси начинают появляться линии, отнесенные к колебаниям димерного комплексного иона AlCl>7>-.
Константа равновесия реакции диссоциации 2Al>2>Cl>7>- Al>2>Cl>6> + 2AlCl>4>- для расплава AlCl>3 >–KCl при 170-240 0С равна 4.10-3.
Помимо димерных форм Al>2>Cl>7>- не исключается вероятность существования более высоких полимерных форм формулы Al>n>Сl>3n+1>.
В работах [48] в СКР расплава SbCl>3> – AlCl>3> не выявлено характерных линий комплексов AlCl>4> – и их димера Al>2>Cl>6.> Обнаруженная линия валентного колебания Al – Cl – 376 см-1 типична для мономерного AlCl>3> , который может находиться в расплаве в свободном состоянии.
Как видим, строение и координация алюминийсодержащих расплавов исследовалась, в основном, или в индивидуальных расплавленных галогенидах или в системе с общим анионом. Что касается строения и структурных свойств хлоридно-фторидных расплавов или хлоридных систем, содержащих фториды алюминия, то в литературе информация по этому вопросу является весьма ограниченной.
Термодинамика фторидных комплексов алюминия исследовалась в расплаве KCl-NaCl [49-51] при 973, 1023,1073 К. Измерены равновесные электродные потенциалы алюминия в расплаве KCl-NaCl, содержащем 0,75 мол.% Al и от 10 до 40 мол. % NaF.KCl. При увеличении концентрации фторидов комплексов Al3+ + mF Al>m>(m-3)-. Получены зависимости E=- a–bln[F-], где [F-] – равновесная концентрация фторид-иона. В зависимости от концентрации фторидов в [50] рассчитаны доли фторидных комплексов AlF>6>3- и AlF>4>- и определены их условные константы устойчивости. Такие же данные были получены в работе [51] на основе измерения равновесных потенциалов в системах KCl-NaCl - AlCl>3> и KC l- NaCl - AlCl>3> –KF. Отмечается образование (при подщелачивании расплава ионами F-) комплексных частиц AlF>4>- и AlF>6>3-.
Авторы работы [52] потенциометрическими исследованиями доказали наличие а алюминийсодержащем хлоридном расплаве частиц AlCl>4> –, Al>2>Cl>7>-, Al>2>Cl>6>, AlCl>3 > и рассчитали их концентрации.
На основе данных спектральных исследований (КР) эвтектической смеси Li>3>AlF>6> – AlF>3> при температуре 730 ˚С авторы [53] делают заключение, что наблюдаемые в спектре в две полосы 620 см-1 и 545 см-1, имеющие разные пиковые интенсивности, относятся соответственно к колебанию тетраэдрического AlF>4>- и октаэдрического AlF>6>3- ионов.
Спектры комбинационного рассеяния алюминийсодержащих фторидных расплавов были получены также в работах [54, 55]. В интервале температур 700 – 900 ˚С в обеих работах спектр КР согласуется с наличием во фторидной системе AlF>4 >- тетраэдрической симметрии.
Как видно из рассмотренного литературного материала строение и координация алюминийсодержащих расплавов исследовалась, в основном, или в индивидуальных расплавленных галогенидах или в системе с общим анионом. Что касается строения и структурных свойств хлоридно-фторидных расплавов или хлоридных систем, содержащих фторидные соединения алюминия, то в литературе информация является весьма ограниченной. В основном следует отметить наличие в алюминийсодержащих галогенидных расплавах многообразных равновесных энергетически неравноценных комплексных форм. Последнее, вероятно, должно отражаться на вольтамперных характеристиках процесса электровосстановления в соответствующих системах.
Электрохимическое поведение алюминийсодержащих
хлоридных расплавов.
После анализа литературных данных по строению алюминийсодержащих галогенидных расплавов следует предположить сложный характер процесса электровосстановления в этих системах. Эта сложность обусловлена наличием в расплаве нескольких алюминийсодержащих равновесных форм, что затрудняет правильную и однозначную интерпретацию результатов поляризационных измерений, особенно в части идентификации электрохимически активных частиц.
Электрохимическому восстановлению алюминия в галогенидных расплавах посвящено значительное количество работ [55-60].
Полярограмма AlCl>3> , полученная на капельном свинцовом электроде на фоне LiCl-KCl содержит две волны, но для первой не обнаруживается количественная зависимость высоты волны от концентрации. Вторая волна, обработанная в полулогарифмических координатах, показала соответствие с двухэлектронным переходом. При этом восстановление алюминия на платиновом электроде происходит при потенциале 1,7В, а на вольфрамовом – при 1,8В относительно хлорного электрода сравнения[55].
Согласно данным [56] восстановление трехвалентного иона алюминия (AlCl>3>) на фоне расплава LiCl-KCl проходит ступенчато в две стадии при достаточно высоких отрицательных потенциалах. На полярограммах, снятых с помощью макающегося молибденового электрода, фиксируются две волны при потенциалах полуволн –1,25В и 1,70В относительно хлорного электрода сравнения.
Судя по данным, приведенным в [57, 58], кинетика электровыделения алюминия определяется сплавообразованием алюминия с электродной поверхностью (платина).
Авторы [59] получили вольтамперные характеристики катодного выделения алюминия в расплаве эквимолярного состава AlCl>3> – NaCl, для которого характерно наличие участка предельного тока, предшествующего разряду прочного комплекса AlCl>4>- . Добавлением хлорида натрия авторам работы удалось полностью подавить волну восстановления электрохимически активных частиц, принимающих участие в стадии перехода при потенциалах формирования первой волны. При этом отмечается, что авторами установлено монотонное уменьшение диффузионной константы по мере увеличения концентрации AlCl>3>. Последнее дало авторам основание предположить, что процесс восстановления алюминия хлоралюминатных расплавах сопряжен с замедленной химической реакцией, предшествующей стадии разряда. Для изучения вклада предшествующей химической реакции в общую электродную поляризацию авторы применили метод хронопотенциометрических измерений, позволяющий обнаружить сравнительно быстрые кинетические процессы.
На экспериментальных зависимостях τ1/2 – 1/i отмечается наличие двух прямолинейных участков с разными наклонами. Анализ этих зависимостей по общеизвестной методике подтверждает высказанное авторами предположение о роли химической стадии в процессе восстановления алюминия. По-видимому, в данной работе впервые обнаружено наличие кинетического тока в чисто галогенидном расплаве. Наиболее ярко влияние предшествующей химической реакции проявляется в области эквимолярного состава. С увеличением концентрации хлорида алюминия кинетические торможения ослабевают, а при его значительном избытке процесс переходит к чисто диффузионному режиму. Аналогичные данные были получены и в работе [60].
Делимарский Ю.К. с сотр. [56] изучили разряд алюминия на фоне расплава KCl-NaCl при 730ºС и концентрациях хлорида алюминия(0,5–1,2).10-2 моль/см3 в потенциодинамическом режиме поляризации. На вольтамперных характеристиках фиксируется волна со значением E = 0,67 – 0,70 В (относительно свинцового электрода сравнения) в зависимости от концентрации хлористого алюминия. При этом волна обладает всеми признаками обратимости и описывается уравнением обратимого разряда с деполяризацией. Анализ полярографической волны дает прямую линию с угловым коэффициентом, соответствующим трехэлектронному обратимому переходу.
Авторы отличают диффузионный контроль электродного процесса. При этом в качестве АЭЧ они принимают ионы алюминия. При разбавлении расплава перед основной волной появляется дополнительная волна, которая тоже описывается уравнением обратимой волны. Авторы объясняют наличие этой волны перезарядкой ионов алюминия до одновалентного состояния.
Следует отметить, что на неполный разряд при низких плотностях тока (0,08 А/см2) указывается и в [61].
Автор, исследуя зависимость поляризации графитовых электродов в хлоридно-фторидном электролите от плотности тока, показал, что при низких плотностях тока преимущественно происходит неполный разряд.
Автор работ [62, 63] исследуя механизм электровосстановления алюминия в хлоралюминатном расплаве на индифферентных (графитовом и стеклографитовом) электродах, сделали заключение об обратимом трехэлектронном переходе с участием AlCl>4>-. Исследования были проведены также в расплавленных хлоридных системах различного катионного состава.
В частности, полярографическому исследованию были подвергнуты расплавленные солевые системы: (KCl-NaCl) + AlCl>3>, (LiCl-NaCl) + AlCl>3>, (CaCl>2>- NaCl) + AlCl>3>, (KC l-NaCl-MgCl>2>) + AlCl>3>.
Отмечается, что различие в катионном составе существенно не влияет на потенциал восстановления алюминия. Все кривые, за исключением полученных в магнийсодержащем расплаве, описываются уравнением обратимой волны с деполяризацией, обусловленной взаимодействием выделяющегося металла с материалом электрода. В магнийсодержащем расплаве волна на вольтамперной кривой имела форму, характерную для разряда без деполяризации и описывалась уравнением Кольтгофа – Лингейма.
Авторы работы [60] при гальваностатическом режиме поляризации катода в расплаве МеCl-AlCl>3> (где Ме - К, Na) обнаружили наличие кинетического процесса.
По мнению авторов, при 500 ºС предшествующая реакция диссоциации комплекса: MeAlCl>4> AlCl>3> – МеCl протекает с конечной скоростью и лимитирует скорость электродного процесса в целом. В стадии перехода непосредственно участвуют мономеры хлорида алюминия. Как видно, эти данные находятся в соответствии с данными, приведенными в работе [59], и подтверждают возможность существования в расплавленных хлоридах медленных сопряженных химических реакций, способных лимитировать скорость электродного процесса в целом.
Таким образом, на основании анализа литературных данных по изучению кинетики электровосстановления алюминия в галогенидных расплавах нужно отметить, что исследования были проведены в основном в хлоралюминатных расплавах.
Что касается кинетики процесса электровосстановления фторидных соединений алюминия на фоне хлоридных расплавов, то информация по этому вопросу отсутствует. Исходя из этого, нами были проведены исследования по изучению кинетических закономерностей протекания процессов электровосстановления алюминия в хлоридно-фторидных расплавах.
Глава II.
Методы исследования и методика проведения эксперимента
Выбор электролитических методов исследования
электродных процессов в расплавленных средах и применяемая аппаратура.
В последние несколько лет наблюдается развитие теории и практики электрохимических методов исследования. Согласно общей классификации электрохимических методов анализа, предложенной ИЮПАК [58], методы, в которых изучаются электродные реакции, подразделяются на два подкласса:
1) методы, в которых возбуждаемый электрический сигнал постоянен или равен нулю, как например, потенциометрия;
2) методы, в которых возбуждаемый сигнал меняется во времени.
Методы второго подкласса в свою очередь можно разделить на две группы. В методах первой группы используются большие переменные сигналы, причем “большие” означает более удвоенного значения 2,3 RT/F. В эту группу входят все методы, в которых происходит изменение потенциала или тока, например, вольтамперометрия и ее варианты, полярография и большинство ее вариантов, а также некоторые хронопотенциометрические методы. Во вторую группу входят все методы, в которых используются переменные малые сигналы, где “малые” означает сигналы с амплитудами, меньшими, чем 2,3 RT/F: это переменно-токовая и квадратно-волновая полярография.
Методом исследования совместного электровосстановления ионов гадолиния и кобальта (никеля) нами выбрана вольтамперометрия (ВА). Она включает группу электрохимических методов, в которых контролируемый параметр - потенциал индикаторного электрода - меняется во времени, а измеряемой величиной является ток, протекающий через индикаторный электрод.
Методом исследования электровосстановления ионов РЗМ нами выбрана вольтамперометрия (ВА). Она включает группу электрохимических методов, в которых контролируемый параметр - потенциал индикаторного электрода - меняется во времени, а измеряемой величиной является ток, протекающий через индикаторный электрод.
Под вольтамперометрией понимается большая группа методов изучения кинетики электродных процессов, в которых во времени изменяется потенциал исследуемого электрода (обычно по линейному закону) и измеряется ток, протекающий через электрохимическую ячейку. Частью вольтамперометрического метода является полярография. В настоящее время под полярографией понимаются вольтамперометрические исследования с применением жидких капельных электродов (в основном - ртутных).
Применение полярографии к расплавленным средам затруднено по ряду причин, главным образом, высокой летучестью ртути. Полярографические кривые трудно воспроизводятся и на них недостаточно четко выражены области предельных токов. Величины потенциалов разложения не совпадают, как правило, с ЭДС соответствующих обратимых гальванических цепей. Это объясняется отсутствием надежных индикаторных электродов и электродов сравнения, высокой температурой процессов, обусловливающей ускорение деполяризации, неудовлетворительной конструкцией электрохимической ячейки с разделенными приэлектродными пространствами.
Методы, при которых потенциал меняется во времени достаточно медленно (1-4 мВ/с), так, что наблюдаемые явления могут быть описаны количественно на основании равновесных или квазиравновесных теорий, называется классической или стационарной вольтамперометрией (КВА). При малых скоростях поляризации электродной системы запись вольтамперных кривых осуществляется обычно с помощью электронных потенциометров. Другой разновидностью вольтамперометрического метода является вольтамперометрия с быстрой разверткой потенциала или осциллографическая вольтамперометрия (осциллографическая полярография). В этом случае скорость поляризации рабочего электрода составляет от 10 мВ/с до 100 В/c. При таких высоких скоростях поляризации запись вольтамперных кривых производится с помощью осциллографа или дисплея. Классическая кривая имеет предельный ток (I>пр.>), а осциллографическая кривая - четко выраженный максимум (пик). В качестве основных, экспериментально определяемых параметров в методе классической вольтамперометрии служат предельный ток I>пр.> и потенциал полуволны >1/2> (при I = I>пр/2>), а в методе осциллографической вольтамперометрии - ток пика I>p> и потенциал полупика >1/2> (при I>пp/2>).
Теория классической и осциллографической вольтамперометрии применительно к простым и сложным электрохимическим процессам рассмотрена в монографиях Д. Плэмбэка и З. Галюса [59, 60]. Методы с быстрой разверткой потенциала, в которых направление изменения потенциала меняется на обратное, называются циклическими. Циклическая вольтамперометрия (ЦВА) представляет собой вольтамперометрический метод, в котором фиксируется изменение во времени тока, протекающего через изучаемую систему при наложении на нее напряжения, изменяющегося во времени по закону треугольника. Теоретические основы ЦВА разработаны Николсоном и Шейном [61], а хороший обзор теоретических положений дал Адамсон [62]. Независимыми переменными в этом методе являются скорость и пределы изменения потенциала индикаторного электрода. Предельное значение потенциала, при котором направление его развертки меняется на обратное, называется потенциалом возврата, переключения или обрыва. Рассмотренные выше вольтамперометрические методы являются одними из наиболее нормативных. Но при изучении электрохимического поведения иона лантана нами чаще будут использоваться КВА и ОВА.
Рассмотрим основы теории этого метода [63].
Классическая вольтамперометрия.
Рассмотрим случай обратимой электродной реакции:
Охn+ + ne Red (2.1)
которая протекает на плоском электроде в условиях избытка индифферентного электролита в исследуемом расплаве. Лимитирующей стадией процесса является диффузия разряжающихся ионов Oxn+ к поверхности индикаторного (рабочего) электрода. В этих условиях массоперенос осуществляется путем полубесконечной линейной диффузии и у поверхности электрода возникает изменяющийся во времени градиент концентрации ионов Oxn+. Решая дифференциальное уравнение Фика относительно концентраций C>ox>(x, t) и С>Red>(x, t) при x = 0 и подставляя их значения в уравнение Нернста, получаем зависимость, которая описывает классическую полярограмму. При этом различают случай, когда продукт реакции (2.1) растворим в расплаве или материале электрода, то есть имеет место сплавообразование (случай а), или продукт Red нерастворим и накапливается на поверхности индикаторного электрода (случай б).
а) Восстановление и окисление нерастворимых веществ.
Для этого случая связь между потенциалом и током в любой точке вольтамперной кривой описывается уравнением Гейровского - Ильковича:
> > (2.2)
Плюс в уравнении (2.2) относится к процессу катодного восстановления, а минус к реакции анодного окисления вещества .
б) Восстановление и окисление нерастворимых веществ.
В этом случае вещество Red, образующееся в ходе реакции (2.1) нерастворимо ни в расплаве, ни в материале электрода, поэтому уравнение Гейровского - Ильковича можно упростить. Наличие вещества на поверхности электрода позволяет принять его активность а>Red> = 1 (>Red> = 1; C>Red> = 1); при этом уравнение вольтамперной кривой принимает следующий вид:
> > (2.3)
где как и ранее плюс относится к катодной реакции, а минус - к анодной. Уравнение (2.3) называют уравнением Кольтгофа - Лингейна.
Для того, чтобы установить, каким уравнением - (2.2) или (2.3) - описываются экспериментальные вольтамперные кривые, необходимо провести их графический анализ, который заключается в построении зависимостей:
> >
Полученная линейная зависимость позволяет таким образом установить вид уравнения, которым необходимо пользоваться в каждом конкретном случае при расчете опытных кривых. Тангенс угла наклона прямой позволяет определить число электронов n, участвующих в электродной реакции (2.1).
Осциллографическая вольтамперометрия.
Зависимости ток - потенциал в методе осциллографической вольтамперометрии существенно зависят от типа электродной реакции.
Рассмотрим случай обратимого процесса (2.1), скорость которого ограничена массопереносом ионов в условиях линейной полубесконечной диффузии к плоскому электроду. Аналогично методу КВА, в данном методе также необходимо различать тот случай, когда продукт электродной реакции (2.1) Red растворим в расплаве или материале электрода, и случай, когда вещество Red нерастворимо.
а) Восстановление или окисление растворимых веществ.
В данной задаче для нахождения зависимости I необходимо решить дифференциальное уравнение Фика при следующих граничных условиях: t > 0, x = 0
> > (2.4)
> > (2.5)
Условие (2.4) получено из уравнения Нернста, а уравнение (2.5) отражает тот факт, что массоперенос веществ Ox и Red у поверхности электродов одинаков. В осциллографической вольтамперометрии потенциал является функцией времени:
= >i> v t (2.6)
где v скорость поляризации электрода (В/с). Плюс относится к анодной поляризации, а минус к катодной.
Впервые эта задача была решена независимо Рэндлсом и Шевчиком. В общей форме зависимость I получена в следующем виде:
> > (2.7)
где функция, зависящая от потенциала. С учетом (2.7) ток в максимуме вольтамперной кривой (ток пика) равен:
> > (2.8)
Потенциал пика >p> определяется следующим соотношением:
> > (2.9)
где плюс относится к анодному процессу, а минус к катодному. Разность значений потенциалов пика >р> и полупика >р/2> составила:
> > (2.10)
Уравнение (2.10) обычно используется для оценки числа электронов n, участвующих в электродной реакции (2.1).
б) Восстановление или окисление нерастворимых веществ.
В этом случае активность продукта электродной реакции (2.1) равна 1, что учитывается при формировании граничного условия (2.4), полученного на основе уравнения Нернста при t > 0, x = 0 :
> > (2.11)
Решение этой задачи впервые выполнено Берзинсом и Делахеем, которые получили зависимость I в виде:
> > (2.12)
Уравнение для потенциала пика получено в виде:
> > (2.13)
где плюс относится к анодному процессу, а минус - к катодному.
Для установления механизма электродных процессов весьма ценным является также использование развертки потенциала в обратном направлении. По разности потенциалов катодного и анодного пиков, подчиняющейся для обратимых процессов соотношению:
> > (2.14),
а также по соотношению высот анодного и катодного пиков тока можно охарактеризовать скорость процесса переноса заряда.
В вольтамперометрии наблюдаемая плотность тока является суммой нефарадеевского i>нф> и фарадеевского i>ф> токов, что соответствует разделению этих компонентов тока в виде:
i = i>нф> + i>ф> = C>d> dE/dt + i>ф> (2.15)
При скоростях поляризации до 1 В/с плотность нефарадеевского тока обычно мала по сравнению с фарадеевским. При более высоких скоростях развертки потенциала нефарадеевский компонент может стать довольно большим и оказать значительное влияние на форму вольтамперных кривых. В качестве основного прибора в вольтамперометрии используется полярограф, который имеет две электрические цепи: поляризующую, которая подает на электрохимическую ячейку нарастающее или уменьшающееся напряжение, и измерительную, которая следует за протекающим током.
Приборы и оборудование, применяемые в работе.
В наших исследованиях вольтамперные зависимости получали с помощью импульсного потенциостата ПИ501. Стационарные I кривые регистрировались x y потенциометрическим двухкоординатным самописцем ЛКД 4003.
В нашей работе использовалась печь сопротивления, нагревательным элементом которой служили стержни из карбида кремния. Вблизи силитовых стержней в корундовом чехле помещался датчик температуры (платино-платинородиевая термопара).
Автоматическое регулирование температуры осуществлялось с помощью электронного потенциометра А 56500102. Для включения и выключения печи использовали бесконтактный электронный быстродействующий выключатель. Он был выполнен на основе кремниевого семистора типа ВКДУС150. Приняв указанные здесь меры, нам удалось достичь точности измерения температуры 1С.
Для сушки солей использовался вакуумный сушильный шкаф SPT200. Все операции взвешивания производились на аналитических весах марки ВЛР200.
2.2. Конструкция высокотемпературной кварцевой электрохимической ячейки и электродов.
Вольтамперное исследование совместного электровосстановления лантана и криолита в галогенидных расплавах проводилось в высокотемпературной кварцевой ячейке, схематично представленной на рис. 2.1.
Электрохимическая ячейка состояла из кварцевого стакана (1) со штуцером (2), в верхней части которого было приклеено стальное кольцо с резьбой (3) и съемной крышки. Крышка состояла из фторопластовой втулки (4) и стальной накидной гайки (5). Герметизация ячейки достигается использованием плотно прилегающих к втулке колец из вакуумной резины (6) и фторопласта (7). Во фторопластовой втулке имеется шесть отверстий, в которых при помощи плотно подогнанных пробок из вакуумной резины (8) крепятся индикаторный электрод (9), электрод сравнения (10), токоподводы к аноду (11), термопара (12), загрузочное устройство для вводимых добавок (13).
Уровень погружения электродов в исследуемый расплав регулировался с помощью стопорного кольца (14).
Строгая фиксация электродов осуществлялась с помощью трех серпентиновых шайб (15), жестко скрепленных с фторопластовой втулкой двумя фарфоровыми трубками (16).
В качестве индикаторного электрода применялись полностью погруженные игольчатые платиновые и серебряные электроды (S = 0,130,16 см2), заплавленные в тугоплавкое стекло. Анодом и одновременно контейнером для расплава служил стеклоуглеродный тигель. В качестве электрода сравнения использовали квазиобратимый стеклоуглеродный электрод.
Схема высокотемпературной кварцевой
э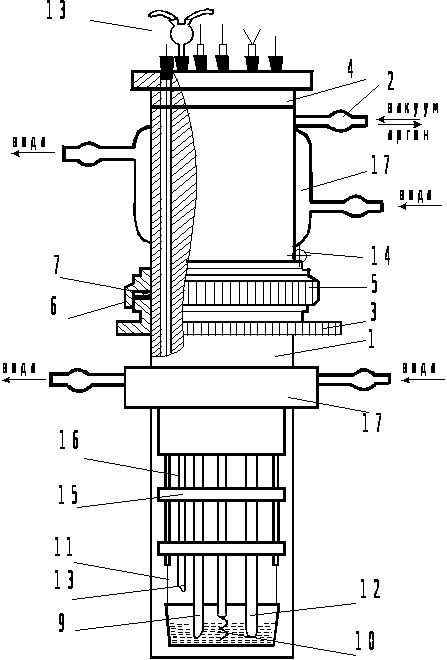
лектрохимической
ячейки
Рис. 2.1. 1 кварцевый стакан; 2 штуцер для вакуумирования ячейки; 3 кольцо с резьбой; 4 фторопластовая втулка; 5 стальная зажимная гайка; 6 кольцо из вакуумной резины; 7 кольцо из фторопласта; 8 пробки из вакуумной резины; 9 индикаторный электрод; 10 электрод сравнения; 11 токопроводы к аноду; 12 термопара; 13 загрузочное устройство; 14 стопорное кольцо; 15 серпентиновые шайбы; 16 фарфоровые трубки; 17 рубашка охлаждения.
2.3. Методика получения безводного хлорида гадолиния (GdCl>3>).
Все безводные трихлориды лантаноидов являются сильно гигроскопичными веществами. На воздухе они легко гидрализуются, образуя гидраты, поэтому работать с ними нужно в атмосфере инертного газа или в высоком вакууме. Описана удачная методика [33] получения трихлорида лантаноида за счет использования аммония в качестве дегидратирующего агента.
В нашей работе обезвоживание GdCl>3 > 6H>2>O до чистого безводного хлорида проводилось в присутствии избытка NH>4>Cl, который подавляет гидролиз:
GdCl>3 >. 6H>2>O + 6NH>4>Cl LaCl>3> + 6NH>3> + 6HСl + 6H>2>O
Для данного процесса необходимо следующее молярное соотношение солей: GdCl>3 >. 6H>2>O : NH>4>Cl = 1 : 6.
Тонкоигольчатый GdCl>3> . 6H>2>O ( = 0,017 моль, m=4.6 г) хорошо перемешали с NH>4>Cl ( = 0,102 моль, m= 5,45 г). Полученную смесь перенесли в платиновый тигель, который поместили в кварцевую ячейку. Платиновый тигель с содержимым медленно нагревали и одновременно поддерживали вакуум ( 103 мм. рт. ст.). За соблюдением высокого вакуума особенно следили в начале нагревания, когда температура поднимается от 353 до 423 К, так как в этом интервале отщепляется основная масса воды. Через некоторое время температуру медленно поднимали до 673 К. Быстрый нагрев не столько увеличивает опасность гидролиза, сколько снижает выход, поскольку трихлорид механически захватывается возгоняющимся NH>4>Cl.
Температуру поднимали до 890К, чтобы GdCl>3> расплавился (t>пл.> GdCl>3 >= 610˚C), остывший трихлорид хранили в герметически закрытых ампулах.
Все операции с солью проводились в сухом боксе.
Глава Ш.
Исследование совместного электровосстановления гадолиния и алюминия в галогенидных расплавах.
Из анализа литературных данных следует, что процесс электровосстановления алюминия из хлоридных и фторидных расплавов изучался в основном на платиновом электродах.
Электровосстановление алюминия на платиновом электроде сопровождается процессом сплавообразования с материалом катода, что значительно осложняет выяснение механизма электровосстановления.
В отличие от платинового электрода, серебряный электрод практически индифферентен к алюминию при температуре 700-750°С и может быть использован для получения более надежной информации о механизме электровосстановления фторалюминат-иона, что и показали предварительные исследования процессов электровосстановления фторалюминат-иона на серебряном электроде.
3.1. Исследование электровосстановления фторалюминат-иона на фоне хлоридного расплава KCl-NaCl, влияние добавок
фторид-иона.
Вольтамперные зависимости хлоридного расплава KClNaCl, содержащего фторалюминат-ион в концентрационном интервале 0,5.10-4 - 5.10-4 моль/см3 (рис.3.1.) характеризуются следующими особенностями:
волна электровосстановления фторалюминат-иона на серебряном электроде находится в области потенциалов 1,25 – 1,55 В относительно платинового электрода сравнения;
волны электровосстановления фторалюминат-иона удается обнаружить при довольно высоких концентрациях (1,0.10-4 моль/см3);
при стационарных условиях поляризации волны электровосстановления фторалюминат-иона s-образны и растянуты по оси потенциалов;
на стационарных вольтамперометрических зависимостях отсутствует диффузионный пик, волна растянута по потенциалу и по форме похожа на стационарные вольтамперометрические зависимости;
на циклических вольтамперных зависимостях имеется волна анодного растворения продукта катодного цикла, которая также растянута по оси потенциалов и не имеет диффузионного пика;
повышение концентрации фторалюминат-иона на фоне хлоридного расплава приводит к увеличению предельного тока как при стационарных и нестационарных режимах поляризации, но при этом не наблюдается прямолинейная зависимость тока от концентрации.
Анализ стационарных и нестационарных вольтамперометрических зависимостей электровосстановления фторалюминат-иона на фоне хлоридного расплава KClNaCl по общеизвестным критериям, приведенным во второй главе, раздел 1., а именно, наклон стационарных вольтамперометрических кривых в полулогарифмических координатах, полуширина пика при нестационарных вольтамперометрических зависимостях, разность потенциалов катодного и анодного пиков, свидетельствуют о замедленности стадии переноса заряда.
Отсутствие прямо пропорциональных зависимостей тока от концентрации при стационарных и нестационарных режимах поляризации, и при этом, не исходящих из начала координат, уменьшение соотношения i>p>/V1/2 при увеличении скорости поляризации свидетельствует о том, что электродному процессу предшествует химическая реакция образования электрохимически активных частиц (ЭАЧ).
Рис. 3.1. Циклические хроновольтамперограммы расплава NaCl – KCl – Na>3>AlF>6>, С(Na>3>AlF>6>) = 1,5.10-5 моль/см3 на серебряном электроде при добавлении NaF, моль/см3 .104: 1, 2 – 0; 3 – 1,5; 4 – 3,0; 5 – 7,5; 6 – 15,0; 7 – 30,0. Т=973К. Э.с.- Pt.
Отсутствие диффузионного пика на нестационарных вольтамперометрических зависимостях, растянутость по оси потенциалов как катодных, так и особенно анодных волн, может свидетельствовать как о замедленности стадии переноса заряда, так и о том, что в электродном процессе могут принимать участие различные комплексы алюминия, с близкими потенциалами восстановления. На фоне хлоридных расплавов, содержащих фторалюминат –ион, вследствие большой активности хлорид-ионов возможны частичные замещения фторид-иона хлорид-ионом во фторалюминатных комплексах.
На рис.3.1. приведены циклические хроновольтамперограммы расплава KClNaCl, содержащего 1,5·10-4 моль/см3 криолита на серебряном электроде при последовательном добавлении фторида натрия. Циклические вольтамперные зависимости иллюстрируют, что добавление фторид-иона существенно не сказывается на высоту волны. Однако наблюдается влияние фторид-иона как на форму катодной волны восстановления, так и анодной волны окисления.
Отсутствие стандартного электрода сравнения в изучаемой системе не позволило нам четко провести анализ смещения волн в зависимости от концентрации фторид-иона в расплаве.
Судя по потенциалу выделения щелочного металла, можно сделать вывод, что при увеличении концентрации фторид-иона в расплаве, потенциал катодной волны восстановления смещается в отрицательную область.
При увеличении концентрации фторид-иона наблюдается увеличение наклона вольтамперной кривой, хотя более прочный чисто фторидный комплекс AlF>6>3- будет разряжаться труднее (более необратимо). Причина заключается в том, что при больших избытках фторид-иона ион алюминия прочно закомплексован в AlF>6>3- и вольтамперная кривая является волной восстановления одного комплекса AlF>6>3-.
Такой вывод можно сделать также и при рассмотрении анодной ветви циклической хроновольтамперограммы при добавлении фторида натрия. Если в чисто хлоридных расплавах анодная волна растянута по потенциалу и нечетко выражена, то при добавлении фторид-иона на анодных участках пик появляется и смещается в отрицательную область потенциалов.
При более чем 10-кратном избытке фторид-иона по отношению к криолиту, на циклической вольтамперограмме наблюдается четкая волна анодного растворения продуктов катодного цикла.
С увеличением концентрации F--иона разность потенциалов существенно уменьшается. Основываясь на вышеприведенных данных о влиянии на электровосстановление фторалюминат-иона фторид-иона, определенный интерес представляет процесс электровосстановления в хлоридно-фторидных расплавах KCl-NaCl-NaF (10 мас.%). В этот расплав вводится такое количество фторид-иона, который обеспечивал бы полную закомплексованность иона Al3+ фторид-ионами.
Таблица 3.1
Электрохимические параметры электровосстановления Na>3>AlF>6> в расплаве
NaCl KCl – NaF (10 вес.%) на серебряном электроде. Т = 973 К.
|
C(LaCl>3>), моль/см3 |
v, В/с |
v1/2 |
i>p>,, мА/см2 |
> > |
>p>, B |
>p/2>, B |
, B |
|
8,0·105 |
0,1 |
0,3162 |
80 |
253,16 |
1,47 |
1,37 |
0,10 |
|
0,2 |
0,4472 |
110 |
246,08 |
1,43 |
1,37 |
0,06 |
|
|
0,5 |
0,7071 |
170 |
240,45 |
1,32 |
1,23 |
0,09 |
|
|
1,0·104 |
0,2 |
0,4472 |
135 |
302,01 |
1,42 |
1,35 |
0,07 |
|
0,5 |
0,7071 |
201 |
284,30 |
1,52 |
1,375 |
0,145 |
|
|
3,0·104 |
0,1 |
0,3162 |
310 |
918,00 |
1,55 |
1,35 |
0,20 |
|
0,2 |
0,4472 |
420 |
939,59 |
1,58 |
1,41 |
0,17 |
|
|
0,5 |
0,7071 |
850 |
1202,26 |
1,67 |
1,42 |
0,25 |
|
|
0,5 |
0,7071 |
820 |
1159,83 |
1,67 |
1,46 |
0,21 |
|
|
3,0·104 |
0,1 |
0,3162 |
492,30 |
1557,91 |
1,66 |
1,46 |
0,20 |
|
0,1 |
0,3162 |
507,69 |
1606,62 |
1,66 |
1,46 |
0,20 |
|
|
0,2 |
0,4472 |
646,15 |
1445,53 |
1,70 |
1,49 |
0,21 |
|
|
0,5 |
0,7071 |
484,00 |
684,58 |
1,77 |
1,50 |
0,27 |
На основании анализа результатов вольтамперных измерений (табл.3.1.), электродную реакцию восстановления фторалюминат-иона в хлоридных расплавах можно представить в виде:
AlF>6>3-
+ xCl-
 [AlF>6-x>Cl>x>]3-
[AlF>6-x>Cl>x>]3-
[AlF>6-x>Cl>x>]3- + 3e → Al + (6-x)F- + xCl-
При добавлении фторид-иона происходит химическая реакция:
AlF>6-x>Cl>x>
+ xF
 AlF>6>3-
+ xCl-
AlF>6>3-
+ xCl-
AlF>6>3- + 3e → Al + 6F-
Таким образом, анионный состав расплава влияет на электродный процесс восстановления алюминия в галогенидных расплавах.
3.2. Исследование совместного электровосстановления фторалюминат-иона и галогенидных комплексов гадолиния на фоне хлоридных и хлоридно-фторидных расплавов.
Д
Рис. 3.2. Диаграмма плавкости системы Al - Gd
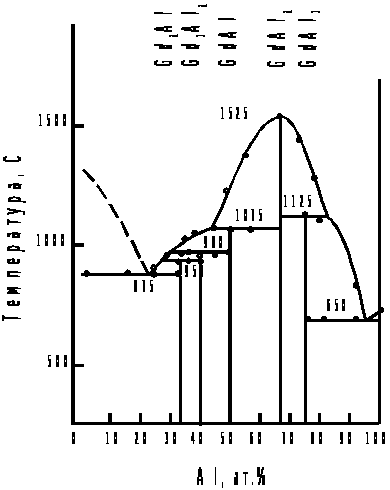
ля рационального и целенаправленного осуществления электрохимического получения Gd– Al сплавов необходимо иметь представление о механизме совместного выделения этих металлов из расплавов галогенидов. Анализ литературных данных, приведенных в первой главе и наших собственных результатов (раздел 3.1) свидетельствует, что механизм процесса выделения гадолиния и алюминия в чистом виде исследовался довольно подробно.
В работе [64] исследована система алюминий – гадолиний методами микроскопического, термического и рентгеновского анализов (рис3.2.). В сплавах системы образуются 5 интерметаллических соединений, из них только одно – GdAl>2> плавится с открытым максимумом при 1525˚С. Остальные 4 – Gd>2>Al, Gd>3>Al>2>, GdAl и GdAl>3> – образуются по перитектическим реакциям при температурах 950, 980, 1075 и 1125˚С соответственно. Кроме того, в сплавах системы кристаллизуются две эвтектики: одна со стороны гадолиния при 875˚С, вторая со стороны алюминия при 650˚С. Сплавы изготовляли методом дуговой плавки в атмосфере очищенного аргона.
Что касается совместного электровыделения и механизма этого процесса, то в литературе практически нет этой информации.
В нашей работе исследование совместного электровосстановления гадолиния и алюминия проводили вольтамперометрическим методом на фоне хлоридных и хлоридно-фторидных расплавов с использованием серебряного электрода. Как показано выше, при электровосстановлении фторалюминат-иона, а также проведенных ранее на кафедре неорганической и физической химии работ по электровосстановлению различных комплексов гадолиния на фоне хлоридных и хлоридно-фторидных расплавов серебряный электрод наиболее индифферентен к этим двум металлам.
На рис. 3.3. приведены результаты вольтамперометрических измерений совместного электровосстановления комплексов алюминия и гадолиния. Кривые (2) и (3) соответствуют электровосстановлению фторалюминат-иона при потенциалах 1,5 – 1,55 В относительно платинового квазиобратимого электрода сравнения.
Введение трихлорида гадолиния в хлоридный расплав NaCl – KCl, содержащий фторалюминат-ионы, приводит к изменению формы вольтамперных кривых,- на катодной части вольтамперограмм при потенциалах, отрицательнее электровосстановления фторалюминат-ионов появляются волны восстановления хлоридных комплексов гадолиния. Первые, в этом случае, ока
Рис. 3.3. Циклические хроновольтамперограммы процесса совместного электровосстановления Na>3>AlF>6> и GdCl>3> на фоне NaCl – KCl. С(GdCl>3>)=1,89.10-4моль/см3(3). С(Na>3>AlF>6>), моль/см3.104: 1, 2 – 0,945; 4 – 1,89. Т = 973К; V = 0,1В/с.
Рис. 3.4. Циклические хроновольтамперограммы процесса совместного электровосстановления Na>3>AlF>6> и GdCl>3> на фоне NaCl – KCl - NaF. С(GdCl>3>)=1,855.10-4моль/см3(3). С(Na>3>AlF>6>), моль/см3.104: 1 – 0; 2 – 0,928; 3 – 1,855; 4 – 3,71; 5 – 9,28. Т = 973К; V = 0,1В/с.
зываются более растянутыми по оси потенциалов, чем в системах в отсутствии хлоридных комплексов гадолиния (гадолиний и алюминий дают сплав).
На анодных участках циклической вольтамперограммы наблюдаются две волны окисления катодных продуктов (волны С и D).
Отличительной особенностью анодной волны окисления при совместном присутствии комплексов гадолиния и алюминия является то, что волны анодного растворения смещаются в более отрицательную область потенциалов и значительно растягиваются по оси потенциалов.
Появление двух волн (С и Д) на анодной части мы связываем с растворением гадолиния и сплавов гадолиний - алюминий разных соотношений.
На рис. 3.4. представлены циклические хроновольтамперограммы расплава NaCl-KCl-NaF(10 вес.%) - GdCl>3>> >при последовательном добавлении Na>3>AlF>6>> >. Сравнивая данные зависимости с аналогичными в хлоридном расплаве можно заметить, что волны совместного электровосстановления GdCl>6>3- и AlF>6>3- во фторидном расплаве имеют более четко выраженный пик и менее растянуты по оси потенциалов. К тому же, анодная часть вольтамперограмм в этих условиях сливается в одну волну и становится более воспроизводимой. Эти процессы обусловлены избытком фторид–иона, уменьшающего число частиц, участвующих в электродном процессе. Как видно из рис. 3.4 (кривые 4 и 5), при большом избытке криолита волны восстановления гадолиния и алюминия сливаются в одну растянутую по оси потенциалов волну,- происходит электровосстановление частиц различного состава (Al>X>Gd>Y>).
Таким образом, результаты вольтамперных измерений в расплаве NaCl-KCl-GdCl>3>-Na>3>AlF>6>> >говорят о возможности электрохимического получения сплавов Gd-Al в различных соотношениях. С нашей точки зрения, механизм электрохимического получения сплавов можно представить следующим образом: электровыделение алюминия из фторалюминат-иона происходит при более положительном потенциале, чем выделение гадолиния из хлоридных комплексов. Разность потенциалов выделения составляет 350 – 400 мВ. Уменьшение разности потенциалов возможно за счет энергии сплавообразования гадолиния и алюминия, а также при увеличении концентрации фторалюминат-иона в расплаве и при определенных соотношениях удается совмещение волн выделения гадолиния и алюминия в одну растянутую волну. Однако электрохимическое получение сплава необходимо проводить при плотностях тока выше предельного тока электровосстановления фторалюминат-иона.
Электрохимические процессы, происходящие при образовании сплава можно представить следующим уравнением:
GdCl>6>3- + AlF>6-x>Cl>x>3- + 6e → GdAl>(>>спл>>)> + (6-x)F- + xCl-
Выводы
Методом линейной циклической вольтамперометрии исследовано совместное восстановление ионов гадолиния и алюминия в хлоридных и хлоридно-фторидных расплавах на серебряном и платиновом электродах.
Изучен процесс электровосстановления фторалюминат-иона на фоне хлоридных и хлоридно-фторидных расплавов. Показано, что серебряный электрод является индифферентным по отношению к алюминию и может быть использован для получения более надежных данных.
Установлен необратимый характер электровосстановления фторалюминат-иона на фоне эквимолярного расплава NaCl-KCl.
Показано влияние анионного состава (фторид-иона) на процесс электровосстановления фторалюминат-иона на фоне хлоридно-фторидных расплавов.
Изучено совместное электровосстановление фторалюминат-иона и хлоридных комплексов гадолиния на фоне хлоридных и хлоридно-фторидных расплавов.
Показано, что при определенных соотношениях концентраций ионов алюминия и гадолиния и анионного состава расплава можно осуществить процесс совместного электровосстановления и получения гадолиний-алюминий сплавов.
Литература.
AN INVESTIGATION on MELTING POINT and ELECTRICAL CONDUCTIVITY OF FLUORIDE – LANTANA MELT. Wei Xujun, Mu Xiuzhi, Liu Xuliang, Zhao Yifa. “New Front. Rare Earth Sci. And Appl. Proc. Jnt. Conf., Beijing, Sept. 10-14, 1985. Vol. 2”. Beijing, 1985, 1176-1179.
Д.Браун. Галогениды лантаноидов и актиноидов. Под ред. академика И.В.Тананаева, перевод с англ. к.х.н. С.С.Родина. Москва, Атомиздат, 1972
Поляченок О.Г., Новиков Г.И. «ЖНХ», 8, 2818-2819. (1963)
Прикладная химия ионных расплавов / Делимарский Ю.К., Барчук Л.П.- Киев: Наук. думка, 1988. с. 8-10
J.MOCHINAGA. EDITORIAL. Structure of molten salts. Molten Salts Bulletin Sels Fondus./ France, 1997
Строение расплавленных солей /Под ред. Е.А.Укше.- М.: Мир, 1966.- 432 с.
Крюкова А.И., Коршунов И.А. Исследование комплексообразования празеодима, неодима и прометия в растворах хлоридах и нитратов щелочных металлов. Тезисы докладов V Всесоюзной конференции по физической химии и электрохимии ионных расплавов и твердых электролитов, 1974
A.Matsuoka, K.Fukushima, J.Mochinaga, Y.Iwadate, M.Tomita and R.Takagi. Proceedings of the 25th Symposium on Molten Salt Chemistry, p.19, (1993)
Д.В.Дробот, Б.Г.Коршунов, З.М.Шевцова. Некоторые закономерности комплексообразования в расплавах, содержащих хлориды редкоземельных и щелочных металлов./ В кн.: Физическая химия расплавленных солей. Труды 2-го Всесоюзного Совещания по физической химии расплавленных солей. 15 – 20 октября 1963 г. Изд-во «Металлургия», М.,1965, с. 48-54
H.B.Kushchov, A.S.Usdenova. The Investigation of the Electrochemical Behaviour of the Ions of gadolinium and Samarium in Chloride and Chloride-Fluoride Melts /EUCHEM CONFERENCE of MOLTEN SALTS,France, 1998
В. М.Смирнов. Электродные потенциалы в расплавленных хлоридах./ Из-во «Наука», М., 1973г
Координационная химия РЗЭ. Под ред. В.И.Спицына и Л.И.Мартыненко; М., Из-во МГУ, 1979г
Thoma R.E.et.al. Inorg. Chem., 1963
Thoma R.E., Insley H., Herbert G.M. Ibid, 1966
Thoma R.E., Karraker R.H. Ibid, 1966
Дергунов Е.П. Доклад АН СССР, 1952
Букалов Г.А., Бабаева Е.П. ЖНХ, 1954
Дергунов Е.П. Доклад АН СССР, 1958
Thoma R.E.et.al.J. Phis. Chem., 1961
Barton C.J., Redman J.P., Stehlow R.A./ J.Inorg. Nucl. Chem., 1961
Thoma R.E. US Report ORNL, 1959
Zachariasen W.H. Amer. Chem. Soc., 1958
Roy P.M., Roy R.G. Electrochem. Soc., 1964
Keller C.Z. Naturforsch, 1964
Zachariasen W.H. Acta. Cryst., 1958
Thoma R.E. In: Progress in the Science and Technology of the Rare Earths (L. Eyring, Ed.), Vol. 2. Pergamon Press, London, 1966
Bode H., Voss E.Z. Anorg. Chem., 1957
Zachariasen W.H. Ibid., 1959
Sears D.R. US Report ORNL, 1966
Е.М.Простаков и др. Комплексообразование в расплавленных смесях фторидов калия, иттрия, лантана, неодима и гадолиния. Тезисы докладов VI Всесоюзной конференции по физической химии ионных расплавов и твердых электролитов, 1976
J.Electrochem. Soc., Vol.142, № 7. July 1995
В.В. Серебренников. Химия РЗЭ. Т.1, Изд. Томского университета, 1959г
Du Senlin, Tang Dingxiang. New Front Rare Earth Sci. and Appl. Pros. Int. Conf. Biejng, Sept 10-14, 1985. Vol.2, Biejng, 1985, 1117-1126
Morzice Edwar New Front Rare Earth Sci. and Appl. Pros. Int. Conf. Biejng, Sept 10-14, 1985. Vol.2, Biejng, 1985, 1099-1106
Хасэгава Иосисукэ. Кондзуку, Metals and Technal, 1988, 58, №1, 52-57
В.С.Купцев, В.Х.Новичков, Н.Л.Ополченова, Р.Д.Рыбкина, Н.Н.Степарева, Е.Р.Томашленская. Физико-химические исследования фазовых превращений в электролите для электрохимического получения РЗМ./ Кольский семинар по электрохимии редких и цветных металлов. Тез.докл. Аппатиты, 1989, с 30-31.
Ф.Спеддинг, А.Даан. Редкоземельные металлы. М., Металлургия, 1965
Powder diffraction fine search manual alhabetical listing inorganic. 1978 (ASTM) USA.
Y.Katayama, R.Hagiwara and Y.Ito. Precipitationof rare earth comounds in LiCl-KCl eutectic./ J. Electrochem. Soc., 142, 7, 2174-2178, 1995
Masatoshi Iizuka. Diffusion Coefficient of Cerium and Gadolinium in Molten LiCL-KCl./ J.Electrochem. Soc., Vol. 145, No. 1, January 1998
В.П.Колесников, Г.Н.Казанцев, Е.В.Устюгов, А.А.Хаматшин. Катодные процессы при осаждении гадолиния на твердых и жидких электродах из хлоридных расплавов. VI Всесоюзная конференция по физической химии ионных расплавов и твердых электролитов. Ч. 2
Balasub>rahmanim K., Nahis L. Raman Spectra of Liquid AlCl>3>-KCl and AlCl>3>-NaCl // J.Chem. Phys.- 1965.- V. 42.- P. 676-680.
Begun G.Ms., Bosion G.R., Toris G., Mamontov G.A. The Raman Spectra of molten Aluminium & halide-alkali.
Torsi G., Mamontov G.A., Begun G.Ms. Raman Spectra of the AlCl>3>-NaCl Sustem // Inorg. Nucl. Chem. Lett.- 1970. V. 6.- P. 553-560.
Cyrin S.J., Klaboe P., Rutter E., Oye H.A. Spectral Eviadensi for Al>2>Cl>7> in chloride melts // J.Chem. Phys.- 1970.- N 52 - P. 2776-2779.
Rutter E., Oye H.A. Raman Spectra of the AlCl>3>-KCl and trends in species Formation. // Inorg. Nucl. Chem.- 1973. V. 35.- P. 1185-1198.
Solomons G., Clarce J.H.P., Bokris J.O.M. Intensification of the complections in liquidicryolite // J.Chem. Phys.- 1968.- V.49.- P. 445-450.
Funcy K-W., Begun G. Ms. Mamontov G.A. Raman Spectra of molten Bismute threchloride and antimony threchloride and of their Mixtures with Potassium Chloride on Aluminium chloride. // J. Inorg. Chem.- 1973. V. 12.- P. 53-57.
Кудяков В.Я., Смирнов М.В. Термодинамика фторидных комплексов алюминия в расплаве KCl – NaCl. V Всесоюзный симпозиум по химии неорганических фторидов. Днепропетровск. 1978.- М.1978. с.153.
Кудяков В.Я., Смирнов М.В., Росохин Ю.В. Фторидные комплексы алюминия в расплаве KCl – NaCl. // Координационная химия.- 1975.- 5.- с.821-823.
Мельников Б.В., Сальников В.И., ЛебедевВ.А., Ничков И.Ф., Роспопин С.П. Равновесные потенциалы алюминия и термодинамика образования его фторидных комплексов в расплавленной эквимольной смеси хлоридов натрия и калия. Деп. в ВИНИТИ 20.07.76г. № 2807-76.
Багрий В.А., Городыский А.В. Делимарский Ю.К. Потенциометрическое изучение комплексообразования в расплавленных хлоралюминатах. // Укр.хим.ж.- 1978.- т.44.- с. 563-570.
Rutter E., Ratkje S.K. Raman Spectra of molten mixtures containing Aluminium fluoride. Dissolving of AlF>6>3- // Acta Chem. Scand.- 1975. V. 29.- P. 565-560.
Rollein M. Connaissence aotnelle de la Structure des millenx fondus a bass de cryolite // Rev. Sht. Tempset nefract.- 1976.- V.13.- P. 83-88.
Нарышкин И.И., Могилев В.М. Полярография расплавов на фоне хлоридов калия и натрия с применением свинцового капельного электрода. // Журн. Прикл.химия. – 1961. Т.34.- с.2353-2356.
Делимарский Ю.К., Макагон В.Ф., Грищенко О.П. Исследование разряда ионов алюминия из высокотемпературного хлоралюминатного расплава. // Укр.хим.ж.- 1980.- т.46.- с.115-118.
Saito M., Suzuki S, Coto H. Polarography of some metals ions in molten evtectic using dipping molibdenum electrode.// J. Electroanalytical Chem.- 1963.- V.84.- P. 332-334.
Tremillon B., Letisse G. Proprietes en Solution dans le tetrachloalyminate Sodium fondu. Systems “acidе-bese” // J. Electroanalytical Chem.- 1968.- V.17.- P. 371-386.
Городыский А.В., Багрий В.А., Делимарский Ю.К. Хронопотенциометрическое исследование восстановления алюминия из хлоралюминатных расплавов. // Укр.хим.ж.- 1979.- т.45.- с.579-582.
Демидов А.И., Симонов И.А., Морачевский А.Г. Катодные поляризации алюминия в расплавах MeCl – AlCl>3> (Me – K, Na). Изв. вуз. цвет. металлургии.- 1985. № 2.- с.72-76.
Polland P., Mamontov G.A. Electrochemical reduction of Al>2>Cl>7>- ions in Chloraluminate melts // J. Electrjchemical Soc.- 1976.- V.123.- P. 1299-1303.
Делимарский Ю.К. Макагон В.Ф. Особенности электровосстановления алюминия из высокотемпературных хлоралюминатных расплавов.// Электрохимия.- 1982.- т.28.- с.1386-1390.
Делимарский Ю.К., Макагон В.Ф., Грищенко О.П. Природа остаточных токов при электровосстановлении хлорида алюминия из хлоридных расплавов. // Электрохимия.- 1985.- т.21.- с.1225-1227.
Диаграммы состояния металлических систем, опубликованные в 1965 году. Выпуск 11 под редакцией Н.В.Агеева, М., 1968г.