хіміко-технологічна система
Зміст
Вступ
1. Поняття хіміко-технологічної системи
2. Задачі аналізу ХТС
3. Принципи складання матеріальних і теплових балансів
4. Ентальпійний, енергетичний і ексергічний показники, їх використання в аналізі ХТС
Висновок
Література
Вступ
Тема реферату «Хімічне виробництво – хіміко-технологічна система» з дисципліни «Загальна хімічна технологія».
Дисципліна "Загальна хімічна технологія" відноситься до циклу загально професійних дисциплін. Вивчення даної дисципліни базується на курсах: загальної неорганічної, органічної і фізичної хімії, фізики, математики, обчислювальної математики, процесів й апаратів хімічної технології і повинно передувати вивченню фахових дисциплін.
Вивчення дисципліни передбачає розгляд загальних проблем аналізу і синтезу хімічних виробництв. У задачу курсу входить загальне знайомство з хімічним виробництвом, його структурою і компонентами; вивчення основ хімічних процесів і реакторів; освоєння загальних методів аналізу і синтезу хімічного виробництва як ХТС; ознайомлення з окремими хімічними виробництвами на прикладі яких предметно демонструються теоретичні положення курсу.
Мета роботи – ознайомитися з відповідними темами, а саме:
поняттям про ХТС, моделями ХТС;
графічними моделями ХТС – функціональною, структурною, операторною та технологічною схемами;
задачами аналізу ХТС. Принципами складання матеріального і теплового балансів;
ексергічним показником, його використанням в аналізі ХТС.
1 Поняття хіміко-технологічної системи
Хімічне виробництво – це система, а точніше, хіміко-технологічна система (ХТС) - сукупність апаратів, зв'язаних між собою потоками і функціонуючих як єдине ціле. У кожнім апараті чи елементі по термінології теорії систем, відбувається перетворення потоку (змішування, поділ, подрібнення, нагрівання, перетворення енергії, стиск, розширення, хімічне перетворення, випаровування і т.д.). Потоки як зв'язки за термінологією систем, забезпечують передачу речовини або енергії між апаратами (елементами системи) і можуть бути матеріальними, тепловими, енергетичними та інформаційними.
Тому ХТС – представлення хімічного виробництва у виді системи. Вивчення систем (у тому числі ХТС) проводиться методами теорії систем. Конкретна реалізація і додаток цієї теорії виражається у виді системного аналізу – сукупність методів і засобів вивчення складних систем.
Методи вивчення систем включають евристичні або неформалізовані методи і формалізовані або строгі математичні прийоми.
Функціонування ХТС характеризують станом ХТС, тобто показниками всіх потоків і апаратів. Показники потоків називають параметрами, які розділяються на параметри стану і параметри властивостей. До першого належать витрати і концентрації компонентів у потоці, температура, тиск та ін., до других – теплоємність, щільність, густина. Показниками апарата (елемента) є параметри вихідних і вхідних потоків, показники керуючих впливів, деякі параметри стану цього елемента, що визначають його функціонування в даний момент часу, наприклад - активність каталізатора, максимальна температура в апараті та ін.
Для побудови і аналізу XTС необхідно мати її опис чи модель, що дозволяє якісно і кількісно визначити стан ХТС.
Моделі хіміко-технологічних систем
Приймаються три види моделей XTС – хімічна, графічна і математична.
Хімічна модель, в основу якої покладені хімічні реакції, що протікають у системі, передається хімічною схемою.
Хімічна схема показує основні і побічні хімічні реакції, що протікають при переробці сировини про одержання необхідного продукту.
Прикладом може служити хімічна схема виробництва соди (рис.1).
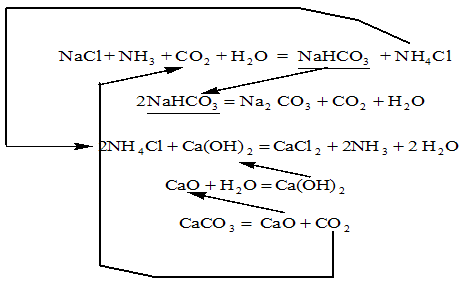
Рис.1. Хімічна схема виробництва соди
Порівняння різних варіантів хімічних схем, наприклад, схем одержання того самого продукту на базі різної сировини, дозволяє вибрати з них найбільш афективну. При порівнянні хімічних схем одержання продуктів враховуються не тільки вартість і доступність сировини, але і можливі побічні реакції, що знижують вихід цільового продукту і селективність, та обумовлюють утворення відходів, збільшення витрати енергія на переробку сировини і т.д. Розгляд хімічних схем дозволяє передбачити апаратурне оформлення процесів, вибір конструкційних матеріалів, можливість автоматизація й ін. Хімічні схеми широко використовуються при розробці, модернізації і проектування технологічних процесів.
Графічні моделі дозволяють одержати наглядне уявлення про спосіб взаємодії між окремими елементами системи, що представляється у виді схем - функціональні, технологічні, структурної, основою яких є хімічні схеми.
Функціональна схема ХТС будується на базі хімічної схеми. Вона показує технологічні зв'язки між процесами, що протікають на всіх стадіях виробництва продукту, а саме – підготовки сировини, хімічних перетворень, виділення й очищення продуктів. Так, наприклад, функціональна схема виробництва соди, у відповідності з приведеною вище хімічною схемою, буде наступна.
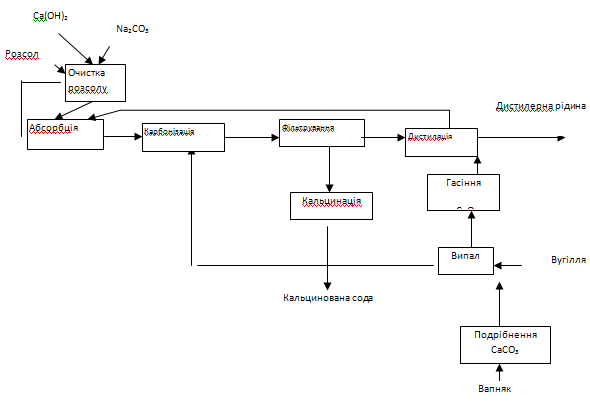
Рис.2. Функціональна схема виробництва соди
Таким чином, ця схема дає загальне уявлення про функціонування ХТС і служить передумовою для апаратурного оформлення в розробці технологічної і структурної схем процесу.
Технологічна схема ХТС показує елементи системи ,способи їхнього з‘єднання і послідовність технологічних операцій. Для цього в технологічній схемі кожний елемент (агрегат, апарат) має загальноприйняте зображення, що відповідає його конструктивному оформленню. Зв'язки між ними (технологічні зв'язки) зображуються у вигляді стрілок. На технологічній схемі коротко можуть бути приведені дані про речовини, що беруть участь у процесі. і про параметри процесу. Як приклад на рис. 4 приведена технологічна схема ХТС виробництва азотної кислоти.
Технологічні схеми одержують у результаті наукової розробки даного способу виробництва.
Слід зазначити наочність представлення процесів за допомогою технологічних схем, що привело до їхнього використання як при експлуатації, так і при проектуванні ХТС.
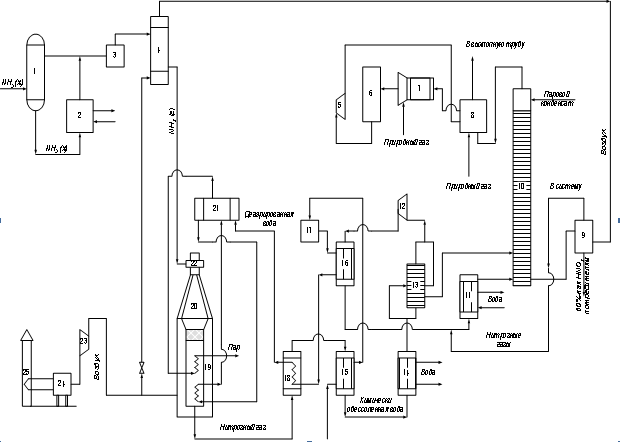
Рис. 3. Технологічна схема виробництва азотної кислоти АК-72
Структурна (блокова) схема ХТС на відміну від технологічної схеми включає елементи ХТС у вигляді блоків, що мають входи і виходи. Вона показує технологічні зв'язки між блоками, які показують напрямок руху матеріальних і енергетичних потоків системи, лініями зі стрілками. Як і функціональна вона не містить інформації про окремі типи елементів, але на структурній схемі дуже чітко простежуються напрямки потоків. Структурна схема ХТС синтезу аміаку представлена на рис. 4.
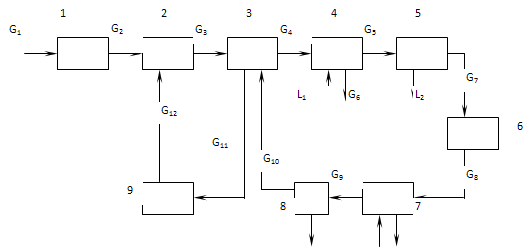
Рис.4. Структурна схема синтезу аміаку:
1 – компресор; 2 – інжектор; 3 – теплообмінник; 4 – випарювач рідкого аміаку; 5,8 – сепаратори; 6 – колона синтезу; 7 – водяний холодильник;
9 – циркуляційний компресор.
Простота оформлення, наочність зображення обумовили широке застосування схем цього типу при розробці і проектуванні ХТС. Якщо є набір "блоків", то стає можливим зміна їх розташування, можна "програвати" різні варіанта проектованої ХТС і вибирати найкращі.
Операторна схема ХТС заснована на тім, що кожен елемент XTC являє собою сукупність декількох типів технологічних операторів або окремих типових технологічних операторів.
Технологічний оператор - це елемент ХТС, у якому відбувається якісне чи кількісне перетворення фізичних параметрів вхідних матеріальних і енергетичних потоків у фізичні параметри вихідних матеріальних і енергетичних потоків у результаті хімічних або фізичних процесів, які протікають у них. Це може бути, наприклад, зміна температури, щільності, густини або інших параметрів при здійсненні в даному елементі ХТС хімічної реакції, процесів масообміну , розподілу, змішання, нагрівання і та ін.
Типові технологічні оператори представляють типові хіміко-технологічні процеси, що відбуваються в елементах ХТС, при яких якісно або кількісно перетворюються параметри. потоку: хімічні реакції, масообмін, змішування, розподіл, нагрівання, охолодження, стиснення розширення, зміна агрегатного стану (конденсація, випарювання, розчинення) (рис.5).
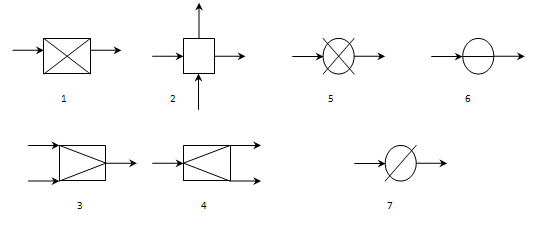
Рис. 5. Технологічні оператори :
ентальпійний ексергічний тепловий баланс
1-хімічного перетворення; 2 - масообміну; 3 - змішування; 4 - розподіл; 5 – нагрівання або охолодження ; 6 - стиснення або розширення; 7 – змінення агрегатного стану речовини.
Операторна схема ХТС за допомогою операторів показує взаємозв'язок між окремими елементами системи, а також відображає фізико-хімічну суттєвість процесів, що протікають у системі.
На рис. 6 приведена схема, на якій відображені три стадії хіміко-технологічного процесу. Кожна стадія може включати декілька типових технологічних операторів
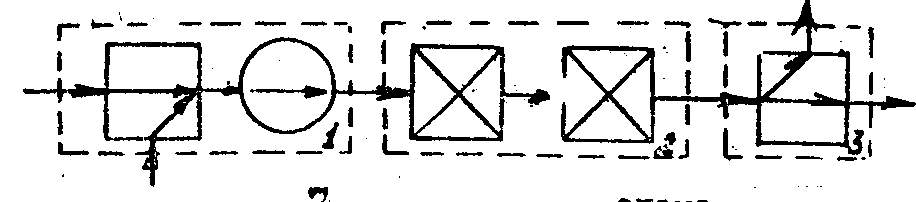
Рис. 7. Операторна схема ХТС:
1- стадія підготовки; 2 – стадія хімічного перетворення; 3 – розділення
Операторні схеми знайшли застосування головним чином як вихідний етап при складанні математичних моделей ХТС. Графічні схеми (моделі) дають структуру ХТС, тобто показують апарати (чи групи апаратів), які виконують деякі операції над потоками, порядок їх з‘єднання і напрямку потоків.
Математичні моделі дозволяють дати формалізований або строгий кількісний математичний опис ХТС у вигляді системи рівнянь, які передають дію кожного вузла і кожного зв'язку, та провести аналіз ХТС.
2. Задачі аналізу ХТС
Задачі аналізу ХТС полягають в одержанні відомостей про функціонування системи в залежності від прийнятої хімічної схеми, структури технологічних зв'язків між елементами і підсистемами, а так само від конструкційних і технологічних параметрів, виходячи з заданих властивостей і показників функціонування, що мають оптимальне значення
Для цього необхідні:
а) технологічний аналіз ХТС – одержання технологічних показників - температури, тиску, розмірів потоків, виходу селективності, кількості відходів і т.д.;
б) техніко-економічний аналіз ХТС – одержання економічних критеріїв оцінки ефективності системи – видаткових коефіцієнтів, витрат на виробництво продуктів і т.д. і, у кінцевому рахунку, одержання відомостей про собівартість продукції;
в) аналіз функціонування системи – сталість, надійність, безпека роботи та ін.
Аналіз ХТС здійснюється при розробці проектування системи для визначення її ефективності, а також для порівняння різних варіантів реалізації процесу з метою вибору з них оптимального. Аналіз використовується і при модернізації і реконструкції діючих ХТС. Показники роботи ХТС визначаються в результаті рішення систем рівнянь матеріальних і теплових балансів
3. Принципи складання матеріальних і теплових балансів
Розрахунки матеріальних балансів засновано на законах збереження маси речовин, що може бути інтерпретовано так:
сума мас речовин, що входять в апарат дорівнюється сумі мас речовин, які виходять з апарату та виробничих збитків і представлено у вигляді рівняння:
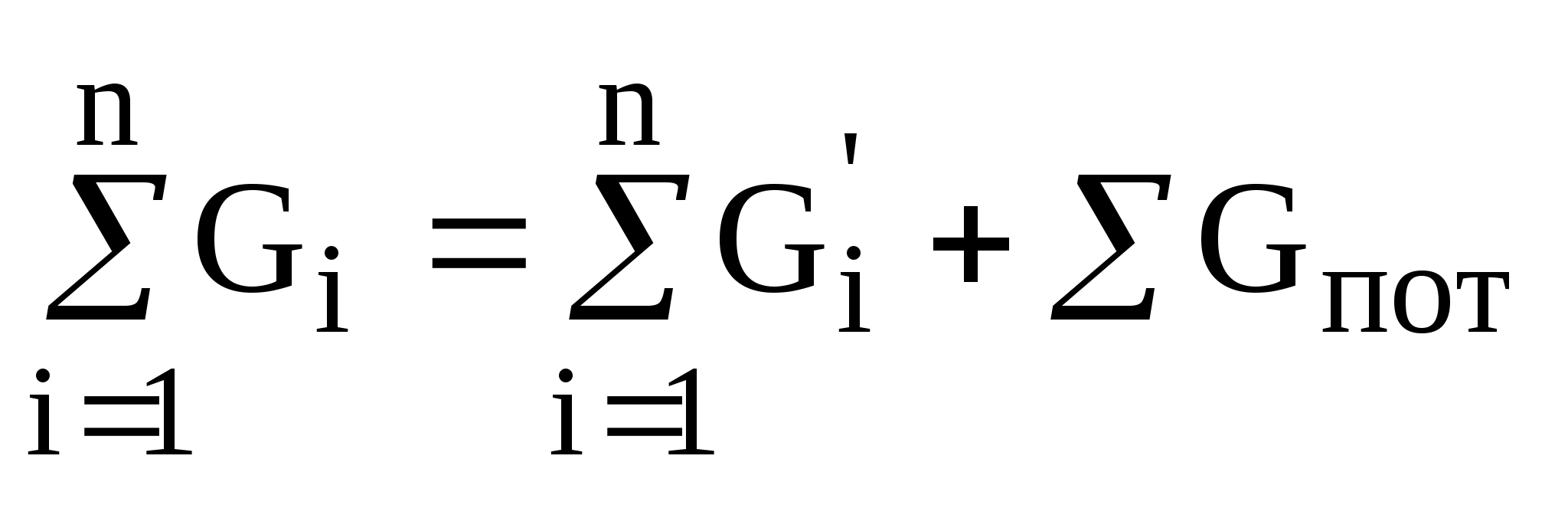
де Gi – сума мас речовин, що надходять до апарату;
Gi' – сума мас речовин, що виходять з апарату;
Gпот – сума мас виробничих збитків.
Розрізняють теоретичні та практичні матеріальні баланси. Теоретичний матеріальний баланс розраховується за хімічними реакціями, що протікають в апараті а основі закону еквівалентів та закону сталості складу речовин. Практичні матеріальні баланси виконуються з урахуванням показників ефективності хіміко-технологічних процесів – ступеня перетворення сировини, виходу продукту, селективності, складу та збитків сировини
Оформлюють результати матеріальних розрахунків у вигляді таблиці, що містить привхідну та витратну колонки. Стовпчик таблиці "Прихід" повинен містити перелік матеріальних потоків речовин, які надходять до апарату, стовпчик таблиці "витрата" – перелік матеріальних потоків речовин, що виходять з апарату. В стовпчиках "КГ" указуються значення мас матеріальних потоків, в стовпчиках "%" склад потоку в відсотках. В разі потреби вводять стовпчики, в яких зазначають кількість сировини в киломолях або м3.
Матеріальний баланс лежить в основі конструктивних розрахунків. На основі кількості потоків розраховуються вхідні і вихідні штуцера апарата, тому в матеріальному балансі необхідно відбивати окремі потоки, привласнюючи їм номера і вказуючи склад (табл.1). Складання теплового балансу засновано на законі збереження енергії – Сума енергії, що надходить в апарат повинна дорівнювати сумі енергії, що виходить з апарату.
Таблиця 1 Матеріальний баланс процесу синтезу аміаку
|
Прихід |
кг |
% |
Витрата |
кг |
% |
|
1. Свіжа азотоводнева суміш, в т.ч. N2 H3 2. Циркулююча азотоводнева суміш, в т.ч. N2 H3 |
715,0 153,0 1590,0 342,0 |
1. Синтез-газ, в т.ч. NH3 N2 H3 |
760,0 1678,7 361,1 |
||
|
Разом: |
2800 |
Разом: |
2800 |
Рівняння теплового балансу виглядає так :
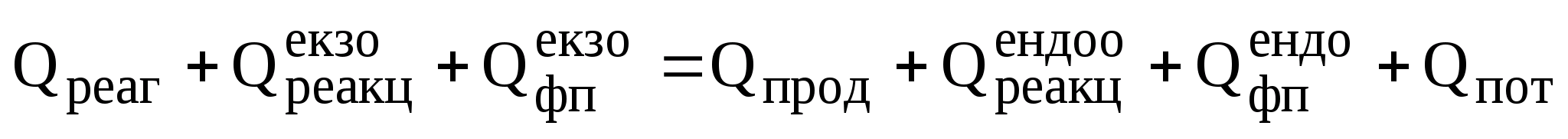
Тепло,
що надходить в апарат з реагентами ( ),
або виходить з продуктами реакції (
),
або виходить з продуктами реакції ( )
обчислюється за рівнянням:
)
обчислюється за рівнянням:
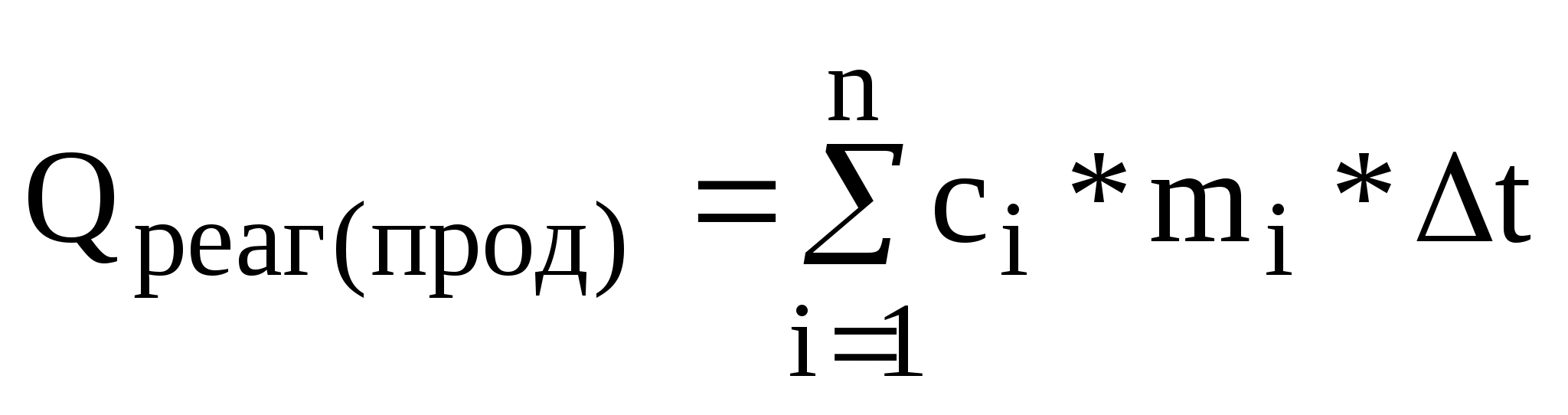 ,
,
де ci – теплоємність реагенту (продукту);
mi – кількість реагенту (продукту);
Δt – температура, °С
При розрахунку теплових балансів використовуються властивості сумішей (наприклад, теплоємність), для газів і розчинів розраховується за правилом адитивності (складання в частках):
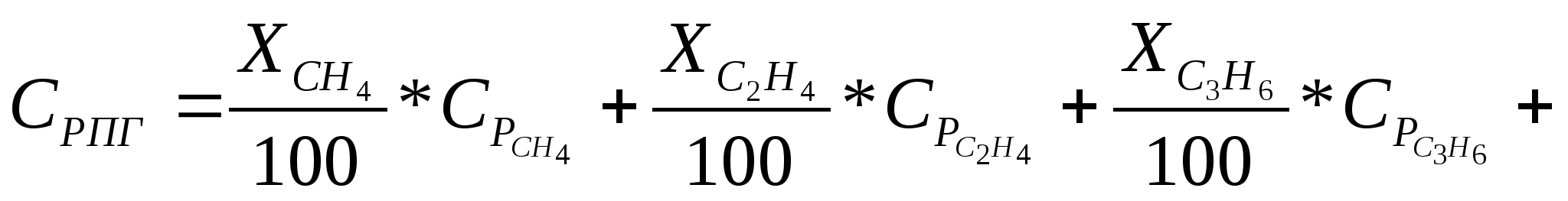
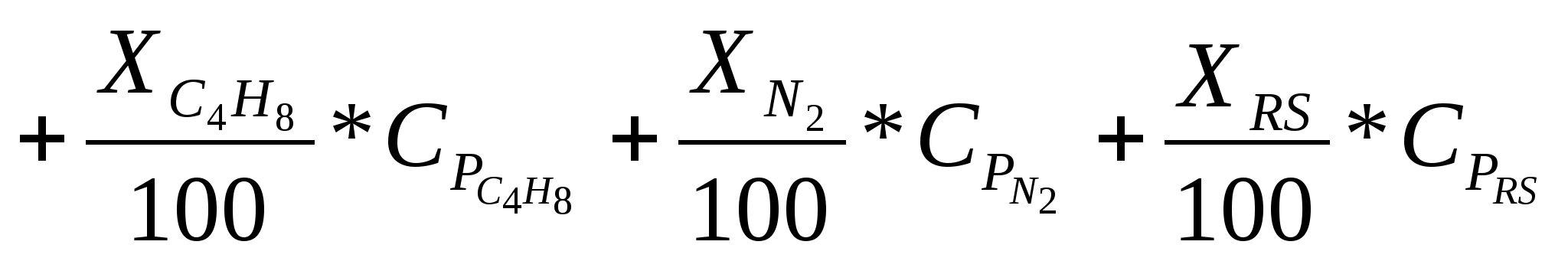 ;
;
де X – процентний уміст компонента в суміші;
 -
середня теплоємність (довідкове значення
для компонентів суміші).
-
середня теплоємність (довідкове значення
для компонентів суміші).
Реакційне тепло розраховується за рівнянням :
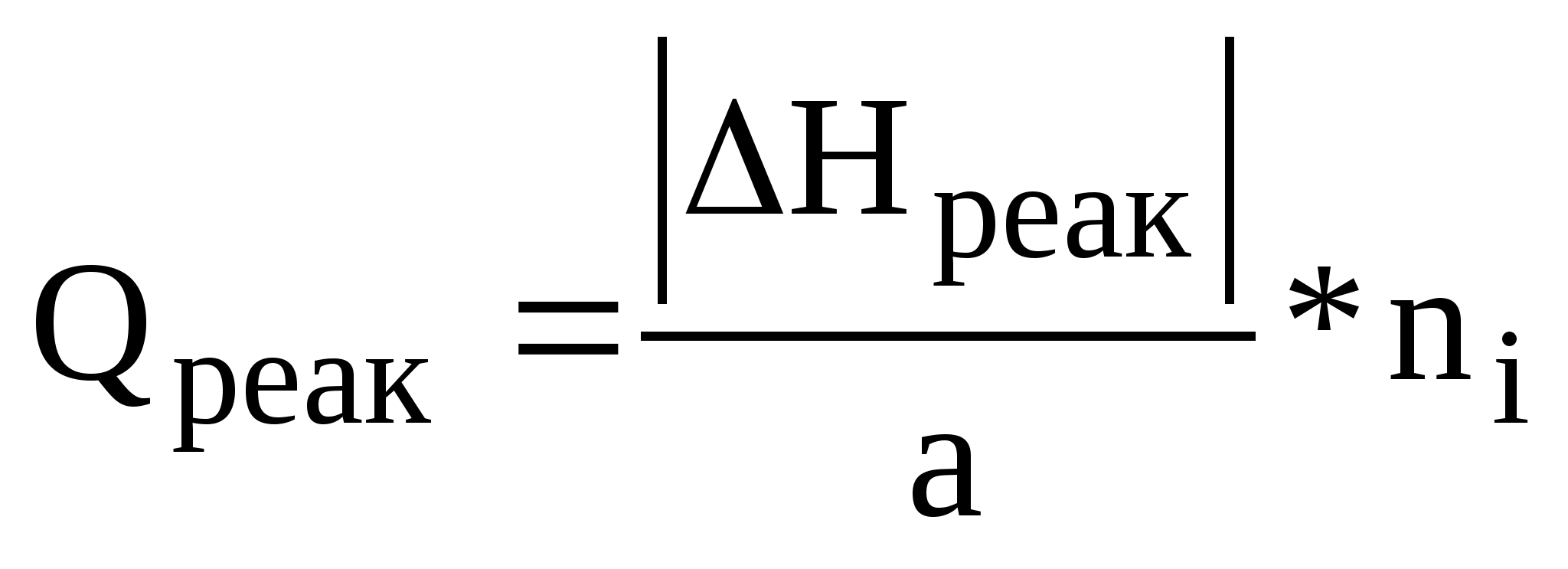 ,
,
де ΔНреак – тепловий ефект реакції, розрахований за законом Гесса, кДж/моль;
а – стехіометричний коефіцієнт хімічного рівняння для і – го продукту;
ni – кількість молів і –го продукту.
Якщо в результаті реакції виділяється тепло, то його записують у прихід. Якщо – поглинається, то – у витрату.
При складанні балансу необхідно вказати потоки тепла в апарат, якщо тепло приноситься (несеться) окремими матеріальними потоками, у таблиці теплового балансу необхідно вказати кількість тепла внесеного і виноси кожним потоком.
При
оформленні документів у таблицю (або
рівняння) теплового балансу записують
 і
і
 ,
якщо такі існують.
,
якщо такі існують.
Після розрахунку теплового балансу можна підібрати теплоносій або холодоагент або визначити кількість (витрату) теплоносію.
4. Ентальпійний, енергетичний і ексергічний показники, їх використання в аналізі ХТС
Для розрахунку складної системи варто використовувати мінімальну кількість рівнянь хімічних реакцій, що відображують кількісні зміни системи або складу реагуючої суміші. Виходячи з цього необхідно визначити які з реакцій стехіометрично залежні і які незалежні.
Стехіометрично залежними хімічними реакціями називаються такі, стехіометричні рівняння яких можуть бути отримані як лінійні комбінації інших стехіометричних рівнянь з числа розглянутих рівнянь реакцій.
Стехіометрично незалежними називають реакції, ніяке з яких стехіометричних рівнянь не може бути отримане шляхом лінійної комбінації інших, і набір цих R рівнянь достатній для повного й однозначного опису матеріального балансу ХТС.
Необхідно відзначити, для аналізу протікання стехіометрично незалежних реакцій використовуються термохімічні, термодинамічні і міжфазові балансові співвідношення. Термохімічні балансові співвідношення надають відомості про зміну ентальпії при протікання хімічних реакція в окремих або елементах всієї ХТС в цілому, про кількість теплоти, що виділяється при екзотермічних реакціях і поглинається при ендотермічних реакціях, що визначає вибір режимів апаратури і структури ХTC.
Термодинамічні балансові співвідношення, оскільки баланси складаються для стаціонарних станів, дають можливість кількісного визначення рівноважних складів реакційних сумішей.
Для цього необхідно визначення величину ізобарно-ізотермічного потенціалу відповідно до рівняння Гиббса:
 ,
,
де ΔН – ентальпія системи;
Т - температура;
ΔS - ентропія.
Кількісно визначити рівноважний склад реакційної суміші, слід визначати виходячи з константи рівноваги реакції, яка може бути знайдена з рівняння:
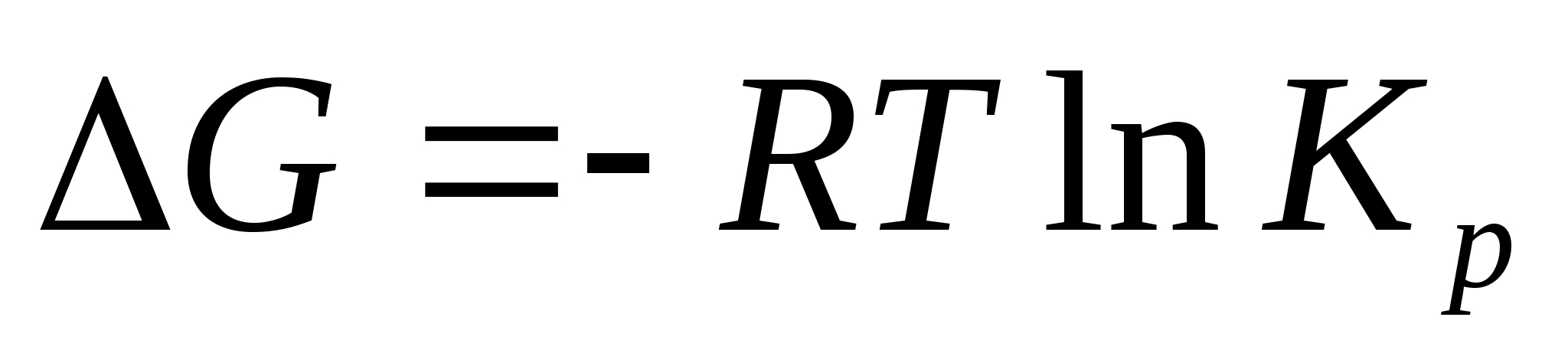 ,
,
де – ΔG - зміна стандартного ізобарно-ізотермічного потенціалу; R –газова константа.
Міжфазові балансові співвідношення дають відомості про рівновагу в гетерогенних системах. Для цього використовуються правило фаз, закон розподілу речовин між фазами, діаграми фазової рівноваги, що дозволяють знайти склад фаз і їхні властивості: агрегатний стан, температура плавлення, кипіння, пружність пари і ін.
У результаті рішення приведених вище балансових співвідношень одержують дані, необхідні для складання матеріальних і теплових балансів окремих елементів у ХТС. Такі баланси часто називають ентальпійними, оскільки в них для визначення складу реакційних сумішей, кількості поглиненого чи виділеного тепла, у відповідності до першого закону термодинаміки виходять зі зміни ентальпії системи.
Інформацію, що дозволяє більш повно обґрунтувати вибір процесу і провести його порівняння з іншими, можна одержати при застосуванні поряд з ентальпійним, термодинамічного аналізу, зокрема, ексергетичного.
Ексергія характеризує корисну роботу, яку може зробити система у відповідності з другим законом термодинаміки, відповідно до якого не всі процеси можуть протікати в напрямку, зворотному його природному ходу. Або, що є таким самим, ексергія – це енергія, що при участі заданого навколишнього середовища, може бути перетворена в іншу форму енергії.
Використання ексергії дає можливість при оцінці в порівнянні ефективності різних процесів, враховувати не тільки кількість потоків енергії, але і їхню якість, тобто здатність енергії до здійснення корисної роботи.
Питома ексергія потоку речовини, виходячи з другого закону термодинаміки, буде:
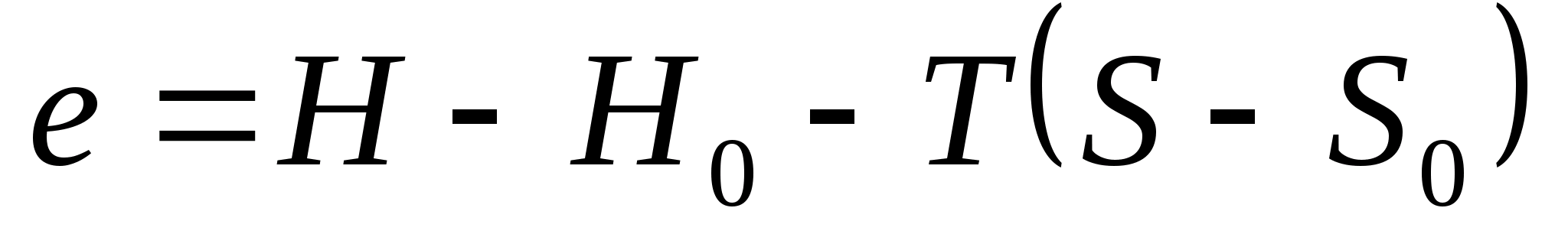
де Н, S – ентальпія та ентропія речовини в аналізованому стані. відповідно;
Н0, S0 – ентальпія та ентропія речовини в стані термодинамічної рівноваги з навколишнім середовищем. Т – температура навколишнього середовища.
Величина ексергіі знаходиться за допомогою відомих параметрів стану – ентальпії і ентропії.
При цьому втрати ексергії в адіабатній системі визначаються здобутком температури навколишнього середовища на збільшення. ентропії внаслідок необоротності процесу. Вони будуть дорівнювати
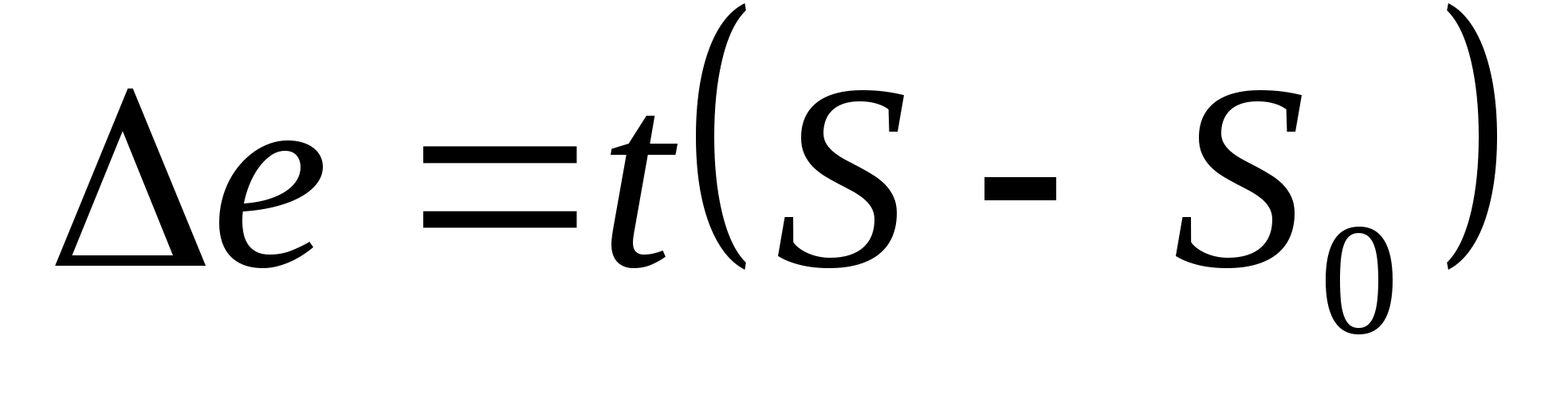
Критерієм термодинамічної ефективності процесу служить ексергетичний коефіцієнт корисної дії, що у загальному виді може бути представлений як:
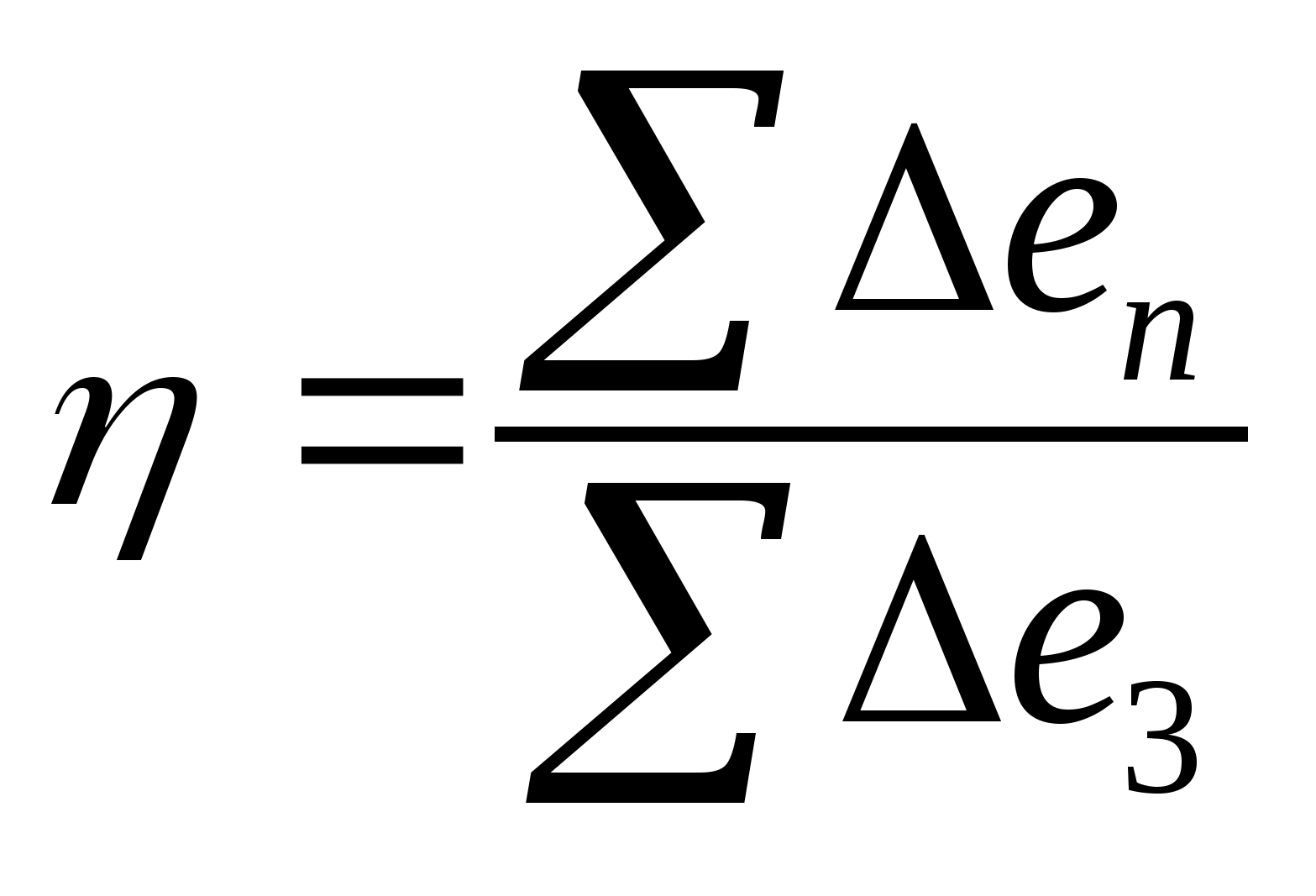
де
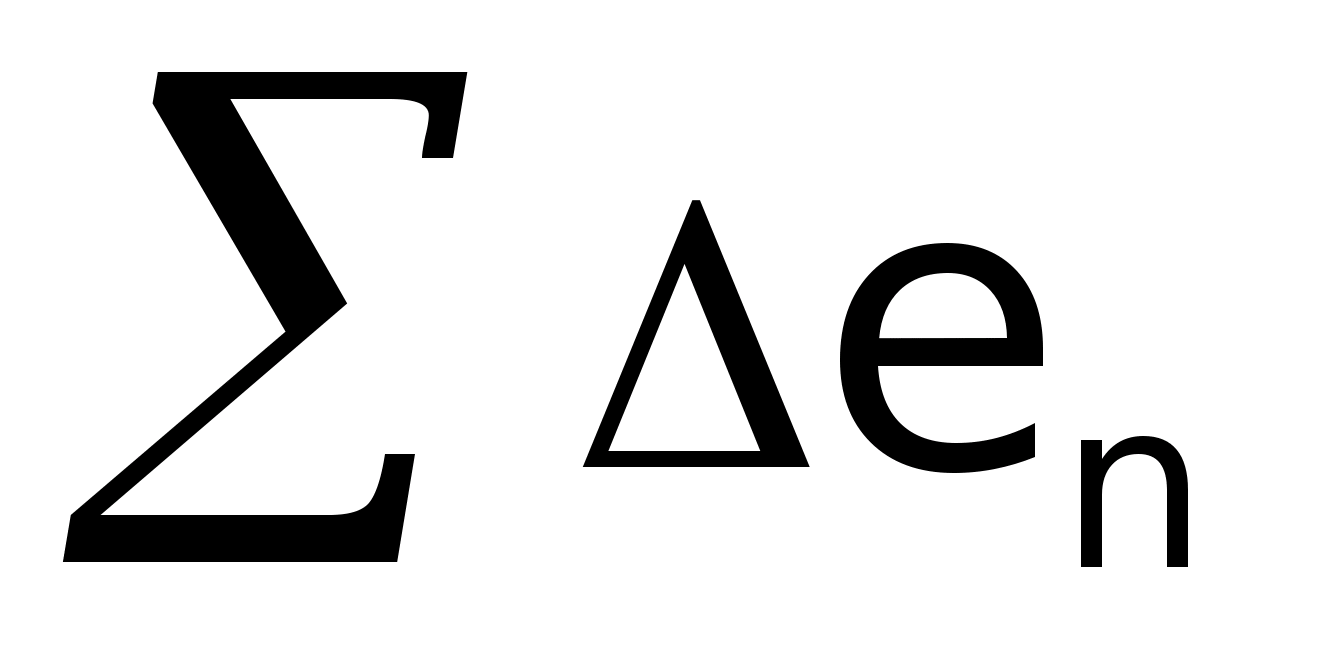 –
вироблена
ексергія;
–
вироблена
ексергія;
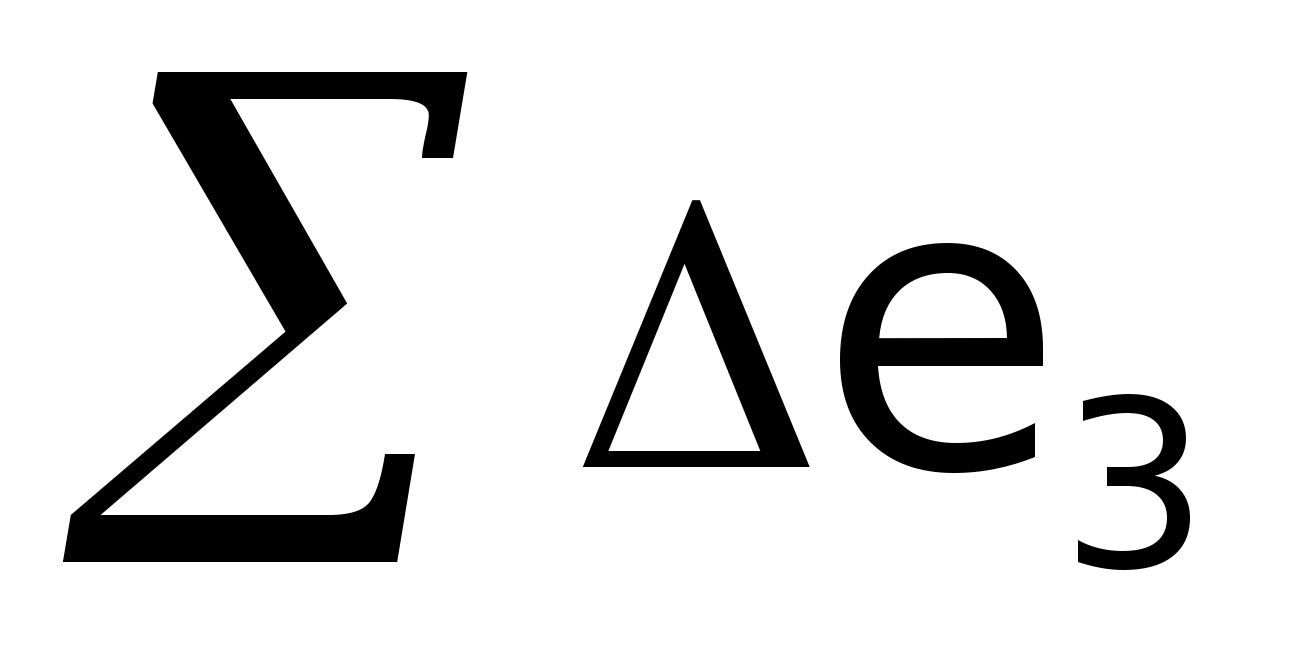 –витрачена
ексергія.
–витрачена
ексергія.
Висновок
Отже, ексергетичний аналіз дає можливість оцінки досконалості процесів і показує границі їхнього поліпшення. В даний час найбільш ефективно вирішується проблема використання енергії в енерготехнологічних системах, для яких характерна сувора збалансованість виробництва і споживання енергії, засновані на використанні теплоти екзотермічних реакцій і вторинних енергетичних ресурсів.
Література
Мухленов И.П. и др. Общая химическая технология. – М.: Высшая школа, 1991.-С. 113-127.
Кутепов А.М. и др. Общая химическая технология. – М.: Высшая школа, 1990.-С. 57-59