Термическое окисление кремния
1
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Новгородский государственный университет имени Ярослава Мудрого
Институт электронных информационных систем
Кафедра «Проектирования и технологии радиоаппаратуры»
ТЕРМИЧЕСКОЕ ОКИСЛЕНИЕ КРЕМЛЕНИЯ
Реферат по дисциплине:
«Физико-химические основы технологии электронных средств»
Специальность 210201
Руководитель
__________ Л.В. Быстрова
“___” __________ 2009 г.
Студент группы 6023зу
__________ Д.А.Смирнов
“___” __________ 2009 г.
Содержание
1. Оборудование для термического окисления
2. Модель Дила-Гроува
3. Зависимость толщины окисла от времени окисления
4. Особенности роста тонких и толстых плёнок двуокиси кремния
5. Свойства плёнок SiO2
Список литературы
1. Оборудование для термического окисления
Слой двуокиси кремния формируется обычно на кремниевой пластине за счет химического взаимодействия в приповерхностной области полупроводника атомов кремния и кислорода. Кислород содержится в окислительной среде, с которой контактирует поверхность кремниевой подложки, нагретой в печи до температуры T = 900 - 1200 ºС. Окислительной средой может быть сухой или влажный кислород. Схематично вид установки показан на рис. 1 (в современных установках пластины в подложкодержателе располагаются вертикально).
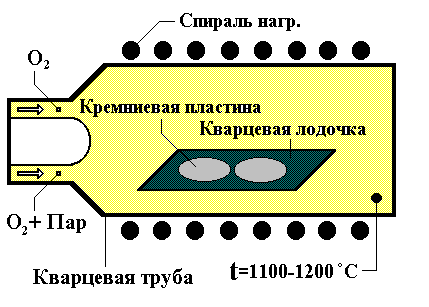
Рис. 1
Требования к оборудованию:
контролируемая с точностью до 1 градуса температура подложкодержателя,
обеспечение плавного повышения и понижения температуры в реакторе (двухстадийный нагрев),
отсутствие посторонних частиц в реакторе (подложкодержатель сначала вводится в трубу реактора, а затем опускается на дно),
отсутствие посторонних примесей, в частности, ионов натрия на внутренней поверхности реактора (с целью их удаления проводится предварительная продувка трубы реактора хлором),
обеспечение введения кремниевых пластин в реактор сразу после их химической очистки.
Химическая реакция, идущая на поверхности кремниевой пластины, соответствует одному из следующих уравнений:
окисление в атмосфере сухого кислорода (сухое окисление): Si>тверд.>+ O>2> = SiO>2>;
окисление в парах воды (влажное окисление): Si>тверд.>+2H>2>O = SiO>2> + 2H>2>;
термическое окисление в присутствии хлора (хлорное окисление);
термическое окисление при взаимодействии молекул воды, синтезированных из атомарно чистых кислорода и водорода непосредственно у поверхности кремния, с атомами кремния (пирогенное окисление).
Время окисления в стандартных технологических процессах составляет 4 - 5 часов.
Значительным достижением в совершенствовании технологии окисления кремния явилось добавление в окислительную среду в процессе окисления хлорсодержащих компонентов. Это привело к улучшению стабильности порогового напряжения полевых МДП транзисторов, увеличению напряжения пробоя диэлектриков и повышению скорости окисления кремния. Главная роль хлора в пленках двуокиси кремния (обычно с концентрацией хлора 1016- 1020 см-3) заключается в превращении случайно проникших в SiO2 примесных ионов натрия или калия в электрически неактивные.
2. Модель Дила-Гроува
Методом радиоактивного маркера показано, что рост SiO2 происходит за счет диффузии кислорода к поверхности кремния. Выход SiO2 за границы начального объема, занимаемого кремнием, обусловлен их разными плотностями.
Для теоретического обоснования было предложено множество моделей, основанных на объемной диффузии заряженных частиц или нейтральных пар, а также эффектах туннелирования электронов, кинетике адсорбции, образования пространственного заряда, изменении граничных концентраций диффундирующих частиц в зависимости от толщины пленки и многих других.
К сожалению, ни один из указанных механизмов не способен полностью объяснить обширный класс имеющихся к настоящему времени экспериментальных данных. Что касается получения пленок двуокиси кремния, то кинетику ее роста в широком диапазоне толщин SiO2 можно объяснить, исходя из достаточно простой модели Дила-Гроува.
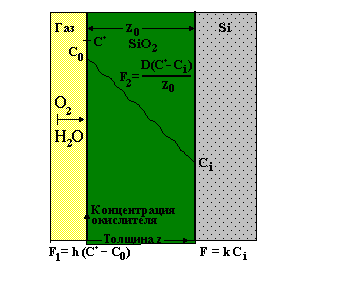
Процесс окисления происходит на границе Si - SiO2, поэтому молекулы окислителя диффундируют через все предварительно сформированные слои окисла и лишь затем вступают в реакцию с кремнием на его границе. Согласно закону Генри, равновесная концентрация твердой фазы прямо пропорциональна парциальному давлению газа P:
C* = HP, где
C*- максимальная концентрация окислителя в газе для данного значения давления P,
H - постоянный коэффициент Генри.
В неравновесном случае концентрация окислителя на поверхности твердого тела меньше, чем C*.
Поток F1 определяется разностью между максимальной и реальной поверхностной концентраций окислителя:
F1 = h(C* - C0), где
C>0> - поверхностная концентрация окислителя,
h - коэффициент переноса.
Значение концентрации окислителя C0 зависит от температуры, скорости газового потока и растворимости окислителя в SiO>2>.
Для того чтобы определить скорость роста окисла, рассмотрим потоки окислителя в объеме окисла F2 и на его границе с кремнием F3. Согласно закону Фика, поток через объем окисла определяется градиентом концентрации окислителя:
F2 = - D(dC/dz) = D(C0 - Ci)/z>0>, (1)
где C>i> - концентрация окислителя в молекулах на кубический сантиметр при z = z>0>,
D - коэффициент диффузии при данной температуре,
z>0> - толщина окисла.
Величина потока F3 на границе окисла с полупроводником зависит от постоянной K скорости поверхностной реакции и определяется как:
F>3>= kCi (2)
При стационарных условиях эти потоки равны, так что F3 = F2 = F1 = F. Следовательно, приравняв соотношения (1) и (2), можно выразить величины Ci и C0 через C*:
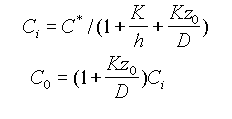 (3)
(3)
Для того чтобы определить скорость роста окисла, представим поток F3 как изменение числа молекул в слое dz>0 >за время dt. Тогда уравнение потока на границе SiO2 - Si будет иметь следующий вид:
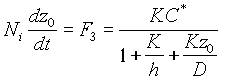 (4)
(4)
Скорость роста окисла определяется потоком F3 и количеством молекул окислителя Ni , входящих в единичный объем окисла. Поскольку концентрация молекул SiO2 в окисле равна 2.2*1022 см-3, то для получения двуокиси кремния требуется такая же концентрация молекул кислорода или в два раза большая концентрация молекул воды.
Соотношение между величинами z>0> и t определяется интегралом вида
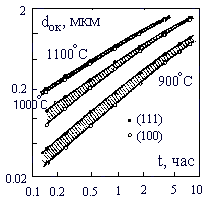
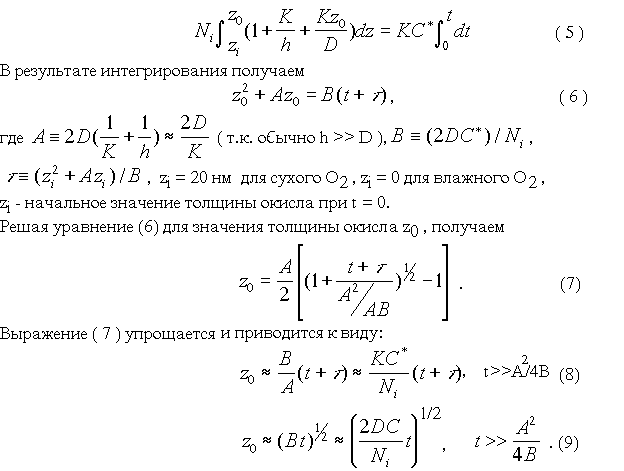
3. Зависимость толщины окисла от времени окисления
Следовательно, для малых времен окисления толщина окисла определяется постоянной скорости поверхностной реакции K и прямо пропорциональна времени окисления (8). Для больших времен окисления скорость роста зависит от постоянной диффузии D (9), а толщина окисла пропорциональна корню квадратному из времени процесса.
На скорость окисления влияют также ориентация подложки, присутствие паров воды, наличие натрия, хлора и концентрация легирующей примеси в кремнии. На рис. 3 приведена зависимость толщины пленки SiO2 от времени окисления во влажном кислороде при парциальном давлении паров воды 85*103 Па.
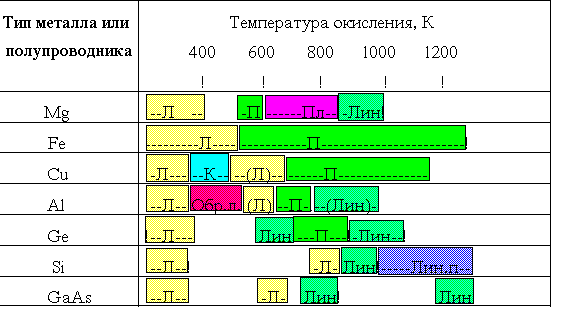
Для широкого класса полупроводников и металлов кинетика процесса активного окисления характеризуется в равновесии линейным законом, то в случае пассивного окисления физическая картина процесса усложняется процессом переноса реагента к реакционной поверхности раздела сквозь растущую пленку. При этом кинетика окисления может быть аппроксимирована следующими законами:
линейным Х(т) = К>1>*т; (1)
параболическим Х>2>(т) = К>2>*т; (2)
кубическим Х>3>(т) = К>3>*т; (3)
логарифмическим Х(т) = К>4>*lg(В*т+ 1); (5)
обратно логарифмическим K>5>/X(т) = А - lg(т) (6)
Существование каждого из этих законов определяется условиями проведения процесса окисления и свойствами исходного материала. Константы К>1>- К>5> зависят от температуры, давления реагента и природы окисляемого материала.
Зависимость экспериментально наблюдаемых кинетических закономерностей от температуры процесса приведена в Таблице 1.
4. Особенности роста тонких и толстых пленок двуокиси кремния
Отметим, что в микроэлектронике наиболее часто используются окислы кремния толщиной в несколько десятых долей микрона а верхний предел по толщине для обычного термического окисления составляет 1-2 мкм. В технологии СБИС используются также как более тонкие, так и более толстые пленки SiO2.
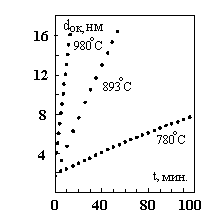
Одним из приборов, в которых используются сверхтонкие слои двуокиси кремния толщиной 2 - 5 нм являются энергонезависимые элементы памяти. Обычно для этих целей применяется многослойная структура - металл - нитрид кремния - двуокись кремния - кремний (МНОП транзистор). SiO2 в данной системе позволяет произвести контролируемую инжекцию заряда в нитрид кремния при подаче высокого потенциала на затвор транзистора (цикл записи или стирания информации) и препятствует растеканию этого заряда в отсутствии потенциала на затворе (хранение информации).
По мере повышения степени интеграции ИС становится необходимым получение пленок подзатворного диэлектрика с хорошо контролируемыми параметрами толщиной 20-50 нм. В ряде случаев необходимо иметь качественные пленки SiO2 толщиной 5 - 100 нм под маскирующими слоями нитрида кремния для предотвращения появления дефектов в кремниевой подложке, обусловленных наличием механических напряжений.
Обычно для получения воспроизводимых по свойствам пленок в реакторах атмосферного давления подбирают соответствующие температурно-временные условия (см. рис. 4). Однако необходимо учитывать, что для пассивирования ионов натрия хлором, вводимым в пленку в процессе окисления, требуются достаточно высокие температуры окисления. Плотность окисла и концентрация дефектов в кремнии также определяются температурой. Часто применяется двухстадийный процесс сухого окисления кремния, состоящий из окисления с добавлением HCl при средних температурах (около 1000 ºС), с последующей термообработкой в атмосфере O>2>, N>2> и HCl при температуре 1150 ºС.
Для получения высокооднородных пленок SiO2 с воспроизводимыми свойствами используют также реакторы пониженного давления (РПД реакторы). Окисление, проводимое в РПД, позволяет синтезировать тонкие слои SiO2 с точностью до нескольких ангстрем. Температура окисления T = 900 - 1000 ºС, давление P = 30 - 300 Па. Окислы гомогенны, аналогичны окислам, полученным в реакторах атмосферного давления, напряженность электрического пробоя пленок E = 10 - 13 МВ/см. Толщина синтезируемых в РПД пленок составляет 2 - 14 нм.
Еще одним способом, используемым для производства тонких пленок SiO2, является их получение во влажной атмосфере, но при пониженной температуре (T = 750 ºС) и атмосферном давлении (P = 1 МПа).
Толстые окисные пленки получают, как правило, во влажной атмосфере при повышенном давлении. По своим свойствам они более пористые, имеют меньшие значения напряженности пробоя. Такие пленки используются в биполярной технологии для создания окисной изоляции и в МОП технологии - для выращивания толстых изолирующих слоев. Верхний предел по толщине для термического окисления составляет 1-2 мкм. Пленку такой толщины получают при давлении 2*106 Па при окислении в парах воды и температуре 900 ºС в течение 1 - 2 часов.
5. Свойства пленок SiO2
Основными контролируемыми параметрами пленок являются: коэффициент преломления, химический состав пленки, пористость, плотность, скорость травления, напряженность поля пробоя. Значения некоторых типичных характеристик термических пленок SiO2 приведены в таблице 2.
Таблица 2
-
Параметр
Значение параметра
Плотность, г/см3
2.2
Показатель преломления
1.46
Диэлектрическая постоянная
3.82
Ширина запрещенной зоны, эВ
8.9
Удельное сопротивление постоянному току при T = 25 ºС, Ом*см
1014-1016
Скорость травления в буферном растворе HF, нм/мин
100
Линия ИК поглощения, мкм
9.3
Коэффициент теплового расширения, С-1
5*10-7
Механические напряжения в окисле, дин/см2
3*109
Список литературы
1. Маслов А.А., Технология и конструкции полупроводниковых приборов, М.: Энергия, 1970. – 296 с.: ил.
2. Курносов А.И., Юдин В.В., Технология производства полупроводниковых приборов и интегральных микросхем. – 5-е изд., перераб. и доп. М.: Наука, - 1986.
3. Технология СБИС: в 2-х книгах, пер с англ., под ред. Зи С. - М.: Мир, 1986. – 404 с.: ил.
4. Болтакс Б.И. Диффузия и точечные деффекты в полупроводниках. – Л.: Наука, 1972. – 384 с.: ил.
5. Готра З.Ю Технология микроэлектронных устройств: Справочник. – М.: Радио и связь, 1991. – 528 с.: ил.