Экологические аспекты преподавания темы "Ванадий и его применение" в школьном курсе химии
ВВЕДЕНИЕ
История ванадия началась в 1801 г. Его открыл мексиканский минералог А. М. дель Рио в свинцовой руде и назвал эритронием (от греч. "erythros" — красный) из-за цвета соли этого элемента. Однако четыре года спустя это открытие было опровергнуто ошибочным заключением о том, что новое вещество представляет собой содержащий примеси хромат свинца.
Повторно открыл элемент в 1830 г. шведский химик Н. Сефстрём, анализируя пробы железной руды. Сефстрём назвал новый элемент ванадием по имени легендарной древнескандинавской богини красоты Ванадис.
ГЛАВА 1. ВАНАДИЙ: ПРИРОДНЫЕ И ТЕХНОГЕННЫЕ РЕСУРСЫ, СВОЙСТВА, ПРОИЗВОДСТВО И ПОТРЕБЛЕНИЕ
Немецкий химик Ф. Вёлер, изучая образцы мексиканской свинцовой руды, доказал, что эритроний и ванадий — один и тот же химический элемент. В итоге элемент сохранил название "ванадий", а его первооткрывателями считают двух ученых: А. М. дель Рио и Н. Сефстрёма.
Металлический порошок ванадия впервые получил в 1865 г. английский химик Г. Роско восстановлением хлорида ванадия(И) VC1>2> водородом. Пластичный, ковкий ванадий был получен лишь в 1927 г. Морденом и Ричем при восстановлении оксида ванадия(У) V>2>0>5> кальцием.
ПРИРОДНЫЕ РЕСУРСЫ
Ванадий — весьма распространенный элемент: его содержание в земной коре составляет 1,9"2 % (здесь и далее используются проценты по массе), что больше содержания таких элементов, как Pb, Sn, Со, Ni, Zn, Сг и даже Си. В свободном виде в природе он не встречается. Минералы, богатые ванадием, встречаются редко. Это ванадинит (содержит 19 % V>2>0>5>), патронит (17-29 %), деклуазит (22 %), купродеклуазит (17-22 %), карнотит (20 %), роскоэлит (21-29 %).
Ванадий — типичный рассеянный элемент, и в литосфере большая его часть встречается в комплексных полиметаллических рудах: титаномагнетитовых, ильменит-магнетитовых, уран-ванадиевых, свинцово-цинковых, медных и др. В некоторых магнетитовых, титаномагнетитовых, осадочных железных рудах и ванадийсодержащих фосфоритах бывает до 2,5-3,0 % V>2>0>5>. Основные запасы комплексных полиметаллических руд сосредоточены в ЮАР, Китае, России, США.
В России ванадий впервые был найден в Ферганской долине, позднее его обнаружили в керченских железных рудах, после чего было налажено производство отечественного феррованадия. Богатейшими источниками ванадия оказались уральские титаномагнетиты.
Прогнозируется, что в ближайшем будущем источниками извлечения ванадия могут быть оолитовые бурые железняки (железо-фосфористые руды), характеризующиеся низким содержанием V>2>0>5> (0,07-0,2 %), но большими запасами; углисто-кремнистые сланцы (0,02-0,04 %); золы углей и горючих сланцев (0,2 %); железомарганцевые конкреции океанов (0,1 %).
Общие мировые промышленные запасы ванадия в рудах (в пересчете на V>2>0>5>) составляют около 28 млн. тонн, а прогнозные оцениваются в 100 млн. тонн, что при достигнутом уровне использования способно удовлетворять мировые потребности в течение 700 лет. Наибольшие запасы (около 65 %) сосредоточены в осадочных месторождениях — битуминозных сланцах, сырой нефти и нефтеносных песках, фосфатных породах. В настоящее время ванадий в основном извлекают из титаномагнетитовых, а также ильменит-магнетитовых руд, но и запасы титаномагнетитов могут обеспечить потребности промышленности в ванадии на сотни лет. Тем не менее роль техногенного сырья (продукты нефтепереработки, шлаки, золы) для его получения непрерывно возрастает.
Богатый источник металлов, в первую очередь ванадия и никеля, — нефть. Содержание ванадия в нефти колеблется в пределах 10"2-10"5 %, а никеля — на порядок меньше. В 1 т нефти тяжелых сортов может содержаться до 300 г ванадия и около 40 г никеля. В битумах эти показатели в 7-10 раз больше. Преобладающая часть (иногда до 98 %) ванадия, присутствующего в сырой нефти, аккумулируется в получаемых после перегонки нефтяных остатках.
В процессе нефтепереработки ванадий и никель, как и другие тяжелые металлы, переходят в тяжелые высокотемпературные фракции, прежде всего в мазут, в котором их концентрация возрастает в десятки раз. Тяжелые фракции сжигают на ТЭС, при этом их органическая часть сгорает, а неорганическая оседает на поверхностях котлоагрегатов и газовых трактов. В результате содержание ванадия в золошлаковых отходах (ЗШО) ТЭС возрастает до 20-40 %, а никеля — до 5-12 %.
Таким образом, в нефти заключены значительные запасы ванадия, что позволит в ближайшем будущем расширить сырьевую базу его производства. По-видимому, наиболее заметную роль будет играть ванадийсодержащая нефть Венесуэлы, а также нефть некоторых месторождений Ирана, Кувейта и Саудовской Аравии, в 1 т которой содержится 20-180 г ванадия. По предварительным оценкам, разведанные в России запасы нефти содержат 7-10 млн. тонн ванадия.
По микроэлементному составу нефтей и их фракций накоплен обширный материал. Гораздо меньше сведений имеется о том, в каких формах эти элементы существуют в нефти и какова структура содержащих их соединений. До сих пор достоверно не выяснена точная химическая структура ни одного нефтяного вещества, содержащего микроэлемент, за исключением порфириновых комплексов ванадила (V02+) и никеля.
Порфирины представляют собой широко распространенные в живой природе пигменты, в основе молекул которых лежит порфинструктура из четырех колец пиррола (например, биологически важные комплексы порфирина с железом — гемоглобин, с магнием — хлорофилл). Порфирины обнаружены в нефти, битумах и ископаемых органических остатках.
При переработке битуминозных сланцев, нефтеносных песков, фосфатных пород металл накапливается в различных отходах: шлаках, шламах, золах, складируемых в огромных количествах в непосредственной близости от перерабатывающих предприятий. В последнее время накопители промышленных отходов некоторых металлургических предприятий с полным основанием могут рассматриваться в качестве техногенных месторождений, которые уже сегодня становятся важными источниками сырья, в частности ванадиевого.
Особо следует отметить, что растворимые и пылевые формы ванадия, содержащиеся в отходах и промежуточных продуктах ванадиевого и ряда других производств, представляют серьезную экологическую опасность. Соединения ванадия токсичны, они могут поражать органы дыхания, пищеварения, кровеносную и нервную системы, а также вызывать воспалительные и аллергические заболевания кожи.
СВОЙСТВА МЕТАЛЛА
Ванадий — серебристо-серый твердый металл, плотность 6,11 г/см3, температура плавления 1920 °С, температура кипения 3392 "С.
Чистый металл, не содержащий нитридов и карбидов, пластичен. Из пластичного ванадия в холодном состоянии без промежуточных отжигов можно изготовлять листы, прутки, тонкостенные трубы, проволоку, тонкую фольгу и т. п. Примеси кислорода, водорода и азота резко снижают пластические свойства ванадия и повышают его твердость и хрупкость.
При обычной температуре ванадий не подвержен действию воздуха, отличается высокой химической стойкостью в морской воде, водных растворах минеральных солей, довольно стоек к действию разбавленной соляной кислоты, не взаимодействует на холоду с разбавленными азотной и серной кислотами. По коррозионной стойкости в соляной и серной кислотах ванадий значительно превосходит титан и нержавеющую сталь. Он реагирует с плавиковой кислотой, концентрированными азотной и серной кислотами, "царской водкой", не взаимодействует с растворами щелочей, но в расплавах щелочей в присутствии воздуха окисляется с образованием ванадатов.
При 600-700 °С ванадий интенсивно окисляется вплоть до высшего оксида — V>2>0>5>. Выше 700 °С в токе азота он образует нитрид VN (желтые кристаллы, 1>Ш> = 2360 °С), отличающийся высокой химической стойкостью; с углеродом и углеродсодержащими газами выше 800 "С — карбид VC (черные кристаллы, t>m> = 2830 °С), обладающий высокой твердостью; с галогенами — галогениды и оксогалогениды, из которых практический интерес представляют VF>5>, VF>3>, VC1>4>, VC1>3>, VC1>2>, VOCl>3>. В атмосфере с избытком хлора ванадий сгорает, образуя VC1>4>. С серой он образует сульфиды: V>2>S>2>, V>2>S>3> и V>2>S>5> — вещества темно-коричневого или черного цвета, которые на воздухе окисляются с образованием V>2>0>5> и S0>2>.
С металлами ванадий дает сплавы и интерметаллические соединения. Он — перспективный металл для создания сплавов, работающих при более высоких температурах, чем никелевые и кобальтовые жаропрочные сплавы. Наиболее распространенные легирующие добавки ванадиевых сплавов - Ti, Nb, W, Zr.
В качестве необходимого микроэлемента ванадий входит в состав микроорганизмов, растений и животных. Его доля в организме взрослого человека должна составлять 10~5 %. Некоторые организмы, например асцидии, лишайники, мухоморы, избирательно концентрируют ванадий.
ГЛАВНЫЕ СОЕДИНЕНИЯ ВАНАДИЯ
Ванадий образует соединения, проявляя степени окисления от +2 до +5, при этом наиболее стойки и типичны соединения, в которых он проявляет высшую степень окисления. С увеличением степени окисления ванадия усиливаются кислотные свойства его оксидов, а также их химическая стойкость.
Монооксид ванадия VO и сесквиоксид ванадия V>2>0>3> не растворяются в воде, имеют основный характер и являются сильными восстановителями. Оксид V>2>0>3> применяется при получении ванадиевых бронз, как материал для термисторов.
Диоксид ванадия V0>2> не растворяется в воде, гигроскопичен, амфотерен: в кислой среде образуется катион ванадия V02+ (раствор приобретает светло-синюю окраску), в щелочной — растворы ванадатов(ГУ), восстановитель. Он применяется в производстве ванадиевых бронз, как полупроводниковый материал для термисторов, переключателей элементов памяти, дисплеев и др.
Пентаоксид диванадия V>2>0>5> (красные или желто-красные кристаллы) в водных растворах дает кислую реакцию (растворимость в воде 0,35 г/л), реагируя со щелочами, образует соли — ванадаты(У). В кислых растворах вероятные формы существования ванадия(У) — ионы V0>2> и VO3*. При нагревании таких растворов (1 рН 2) выделяются гидраты переменного состава V>2>0>5> • хН>2>0. Чистый V>2>0>5> получают разложением NH>4>V0>3 >при 400-500 °С с последующей выдержкой в струе кислорода, гидролизом VOCl>3>.
Пентаоксид диванадия промежуточный продукт в производстве ванадия, феррованадия, ванадатов и других соединений ванадия, катализатор в производстве серной и органических кислот, электролит в топливных батареях, компонент специальных стекол, глазурей и люминофоров красного свечения.
Ванадаты металлов — это соли ванадиевых кислот. Различают ванадаты(У) — соли не существующих в свободном состоянии или малоустойчивых кислот (ортованадиевой H>3>V0>4>, пированадиевой H>4>V>2>0>7>, метаванадиевой HV0>3> и поливанадиевых кислот) и ванадаты(ГУ) — соли не существующих в свободном состоянии кислот (H>2>V>4>0>9>, Н>4>У>2>0б и др.).
Ванадаты применяют для получения V>2>0>5 >и других соединений ванадия, для выплавки феррованадия и других сплавов. Ванадаты используют также как протраву при крашении тканей, для фиксации анилина на шелке, как компоненты стекол и глазурей, как катализаторы.
ГЛАВА 2. ПРОИЗВОДСТВО И ПОТРЕБЛЕНИЕ ВАНАДИЯ
Применение ванадия началось в производстве цветного стекла, красок и керамики.
Изделия из фарфора и продукцию гончарных мастеров с помощью соединений ванадия покрывали золотистой глазурью, а стекло окрашивали солями ванадия в голубой или зеленый цвет. Реакция Зинина (1842) открыла новые возможности для развития производства синтетических красителей, и соединения ванадия нашли применение в этой отрасли химии, принеся ей значительную пользу. Ведь достаточно всего одной массовой части V>2>0>5>, чтобы перевести 200 тыс. массовых частей бесцветной соли анилина в красящее вещество — черный анилин. Столь же эффективным оказалось применение соединений ванадия в индиговом крашении, ситцепечатании, в производстве цветных хлопчатобумажных и шелковых тканей.
В 1896-1906 гг. были проведены первые специальные исследования по оценке возможности использования ванадия в металлургии. Результаты показали, что его применение способствует повышению качества целого ряда сталей. Поэтому уже в первые десятилетия XX в. в Англии, Германии, Франции и США вместо солей ванадия началось производство главным образом феррованадия, который широко применяется как легирующий элемент в сталеплавильном производстве.
К началу Первой мировой войны общий объем производства ванадия в мире превысил 1000 т в год В прошедшем столетии потребление ванадия многократно возросло, а сфера его использования существенно расширилась. Катализаторы на основе ванадия позволили заменить в сернокислотном производстве дорогостоящую платину. Впервые они были внедрены в производство в США в 1926 г.
Структура потребления ванадия в последние пятьдесят лет менялась незначительно. Основное направление его применения — производство стали, в котором используется более 85 % всего производимого ванадия. Вторым по объему использования стало получение легированных титановых сплавов (8-10 %). Около 5 % ванадия в составе различных соединений используется в химической промышленности.
В настоящее время значение ванадия в народном хозяйстве в целом и в черной металлургии в частности трудно переоценить. Он — один из важнейших легирующих элементов в производстве более чем 250 марок сталей и чугунов, незаменим при производстве таких видов стали, как быстрорежущие, жаропрочные, теплостойкие, штамповые с повышенной вязкостью и горячего деформирования, с особыми свойствами для агрессивных сред и суровых климатических условий Крайнего Севера.
Содержание ванадия в сталях и чугунах составляет от 0,04 до 6 %. Реагируя с углеродом и азотом, он образует твердые тугоплавкие карбиды, нитриды и карбонитриды, вследствие чего сталь приобретает мелкозернистую структуру. Это способствует повышению прочности, упругости и износостойкости при одновременном сохранении пластичности металла и его способности свариваться. Кроме того, ванадий повышает ударную вязкость металла при пониженных температурах, снижает его склонность к старению и чувствительность к перегреву. Поэтому его применяют для легирования сталей, часто в комбинации с Сг, N1, Mo, W.
Основная доля ванадия потребляется в производстве конструкционных низколегированных сталей, используемых при изготовлении труб большого диаметра для магистральных газо- и нефтепроводов, протяженных мостов, резервуаров большой емкости, в транспортном машиностроении и автомобилестроении.
Ванадийсодержащие стали используют в производстве листового и рельсового проката, сортовой стали для высотных строений. Добавка ванадия к рельсовым сталям увеличивает прочность на растяжение, тем самым повышает износостойкость рельсов. Полностью или поверхностно закаленные рельсы из ванадиевой стали используют там, где существуют особо тяжелые условия эксплуатации. В России, где тонны железной руды перевозят на дальние расстояния, рельсы делают из специальных ванадиевых сталей для продления срока их эксплуатации.
Ванадиевую сталь используют для обшивки корпусов судов. Возрастающая конкуренция в судостроении интенсифицирует внедрение сталей, позволяющих осуществлять скоростную сварку во влажной среде. Расширяется использование ванадия в производстве сплавов на основе титана и других тугоплавких металлов, предназначенных для новой техники (авиационной, ракетной, ядерной энергетики). Содержание ванадия в этих сплавах составляет 0,8-6,0 %. Ванадий в сочетании с алюминием используют с целью придания требуемой прочности в сплавах титана, идущего на создание специальных батисфер для исследования океана на глубине 10 000 м. Добавление ванадия в алюминиевые сплавы улучшает их жаропрочность и свариваемость.
Благодаря высокой коррозионной стойкости в агрессивных химических средах ванадий — перспективный материал для химического машиностроения. Он служит основой сплавов со специальными свойствами, в том числе и сверхпроводящих. В последние годы перспективным стало применение ванадия в производстве аккумуляторных батарей. По оценкам ряда экспертов, использование его в окислительно-восстановительных батареях имеет много преимуществ для хранения энергии. Чистый металл используют в производстве электронных приборов, отдельных деталей рентгеновской аппаратуры и т. д.
Соединения ванадия находят широкое применение во многих областях промышленности, в частности в химической, как катализаторы, в органическом синтезе, при производстве полимерных материалов, в стекольной, керамической, текстильной, лакокрасочной, резиновой отраслях, в фотографии и кинематографии, медицине, сельском хозяйстве и т. д.
Мировые производственные мощности по выпуску"'оксида V>2>0>5> на начало 2005 г. оценивались в 115 тыс. тонн в год. При этом его фактическое производство составило в период с 2000 по 2003 г. около 82 тыс. тонн в год (45-46 тыс. тонн ванадия). Соответствующие мощности по выплавке феррованадия достигают 80,5 тыс. тонн в год при фактическом объеме производства в 2000-2003 гг. около 56 тыс. тонн в год. Таким образом, загруженность мощностей в обоих случаях составляет около 70 %.
Мировой объем потребления ванадия в виде феррованадия в 2002-2003 гг. стабилизировался на уровне 35-37 тыс. тонн. Еще примерно 5-7 тыс. тонн ванадия в год потребляется на рынках ванадий-алюминиевых лигатур и химически чистого V>2>0>5>.
Подъему ванадиевой отрасли в 2004 г. способствовал рост производства и потребления стали в Китае. С учетом прогнозируемого увеличения производства стали до 1200 млн. тонн к 2010 г. можно предположить, что потребление феррованадия будет постепенно расти и достигнет уровня 43-47 тыс. тонн по ванадию.
В настоящее время главные производители ванадия — ЮАР, Китай, США и Россия (свыше 90 % выпуска). Получают ванадий и в Австралии, Новой Зеландии, Японии и Великобритании. Основными экспортерами ванадийсодержащих материалов (ванадиевый шлак, V>2>0>5> и феррованадий) выступают ЮАР, Китай и Россия.
Российская ванадиевая отрасль представлена четырьмя основными предприятиями:
Качканарский горно-обогатительный комбинат "Ванадий" добывает ванадийсодержащую титаномагнетитовую руду, производит концентрат, агломерат и окатыши;
Нижнетагильский металлургический комбинат (НТМК), используя поставляемое ему сырье, производит ванадиевый чугун и ванадийсодержащий шлак;
Чусовской металлургический завод на основе того же сырья производит ванадиевый чугун, ванадийсодержащий шлак, V>2>0>5>, феррованадий;
ОАО "Ванадий-Тула", перерабатывая ванадийсодержащие шлаки НТМК, производит V>2>0>5> и феррованадий.
Основные потребители ванадия — страны Западной Европы, США и Япония, которые выступают в роли нетто-импортеров.
Структура внутреннего потребления феррованадия в российской экономике принципиально не отличается от мировой. Предполагается, что в 2005 г. оно несколько вырастет и достигнет 2-2,2 тыс. тонн в год.
Существуют три основных способа извлечения ванадия: пирометаллургический, гидрометаллургический и гидрохимический.
При пирометаллургическом способе ванадий извлекают из ванадийсодержащего сталеплавильного (конвертерного) шлака. На долю пирометаллургии приходится около 70 % всего производимого ванадия, ее используют большинство производителей ванадия, в том числе китайские и российские предприятия, а также некоторые производители в ЮАР и США.
Технологическая схема переработки конвертерных ванадиевых шлаков (16-18 % V>2>0>5>) состоит из следующих этапов:
подготовки шлака к обжигу (дробление, размол, очистка от металловключений, смешение с реакционной добавкой);
окислительного обжига шихты в присутствии реакционно-способной добавки (Na>2>C0>3> или СаС0>3>);
выщелачивания обожженной шихты водой и раствором серной кислоты;
осаждения ванадия из растворов в виде химического концентрата V>2>0>5> или NH>4>V0>3>;
сушки, плавки и грануляции химического концентрата V>2>0>5>.
Ванадиевые шлаки поступают на производство в кусках и измельчаются до тонкого порошка с размером частиц менее 0,1 мм. Наличие металлической фазы в шлаках требует их многократной обработки на магнитных сепараторах. Металлоотсев возвращают в начало металлургического процесса или используют для прямого легирования сталей и чугунов.
Одна из важнейших задач обжига ванадиевых шлаков — окисление низших оксидов железа, ванадия и марганца в высшие и образование растворимых соединений ванадия. При обжиге шлаков оксид V>2>О>3> переходит в легкорастворимые соединения ванадия(У), окисляются дисперсное железо, монооксид железа и низшие оксиды марганца, перекристаллизовываются силикаты.
Процесс окисления шлаков может быть представлен следующими основными реакциями:
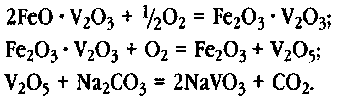
Оптимальный температурный интервал реакций — от 700 до 900 °С.
Окислительный обжиг шлаков ведут в трубчатых вращающихся печах. Обычно шлаки обжигают в присутствии солей натрия, что позволяет получать ванадаты, хорошо растворяющиеся в воде и разбавленных растворах кислот и карбонатов. Обжиг шлаков совместно с содой позволяет осуществлять процесс при более низких температурах, чем при добавлении других солей натрия.
Шихта из обжиговой печи с температурой от 550 до 620 °С поступает в барабанный холодильник, где орошается водой или оборотным раствором. Одновременно с охлаждением в барабане происходит измельчение спека до 0,15 мм помещенными в барабан металлическими катками.
Выщелачивание шихты начинается в барабанном холодильнике. Пульпа, проходя ряд насосов и реакторов с мешалками, выщелачивается и поступает на вакуум-фильтр. После фильтра раствор направляют на осаждение концентрата V>2>0>5>, а твердый остаток влажностью до 20 % — на сернокислотное выщелачивание. Применение серной кислоты как выщелачивающего реагента связано с тем, что разбавленные растворы этой кислоты в меньшей степени, чем другие минеральные кислоты, растворяют сопутствующие ванадию компоненты шлака.
Трехстадийное выщелачивание позволяет перевести в растворы 97,5-99,0 % V>2>0>5>, в том числе около 65 % на стадии водного выщелачивания.
Существующие способы выделения ванадия из растворов позволяют осадить его в виде химического концентрата, в состав которого входит один или несколько металлов или аммонийная группа NH. При осаждении V>2>0>5> происходит нейтрализация щелочных растворов минеральными кислотами, а кислых — содой до рН 1,5-2,0. Затем раствор нагревают до 85-95 °С и выдерживают. При этом из него выпадает красно-коричневый осадок. Процесс осаждения пятивалентного ванадия можно представить в общем виде следующими реакциями:
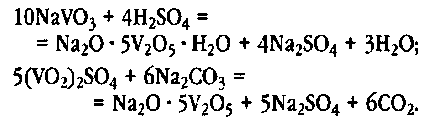
Фильтрацию гидратной пульпы проводят на барабанных вакуум-фильтрах. Сырой остаток, содержащий около 60 % влаги, загружают в плавильную печь. Плавление осадка происходит при температурах 950-1100 °С. Расплавленный продукт вытекает через отверстие на боковой стенке плавильной печи по железному желобу на охлаждаемую водой вращающуюся поверхность стола, на котором застывает тонким слоем. С помощью съемного ножа слой разделяют на небольшие пластинки и направляют их в контейнеры.
Химический концентрат, содержащий после сушки до 92 % V>2>0>5>, используют для выплавки феррованадия и других сплавов. Феррованадий (35-80 % V) получают восстановлением ферросилицием или алюминием.
Гидрометаллургический способ предусматривает извлечение ванадия химическим выщелачиванием из обожженных титано-магнетитовых и ильменит-магнетитовых концентратов. Этот метод предъявляет жесткие требования к качеству перерабатываемых руд: высокое содержание ванадия в исходной руде и низкое — примесей.
Гидрохимический способ — это переработка вторичных материалов техногенного происхождения, таких, как отработанные ванадийсодержащие катализаторы, нефтяные остатки, нефтяной кокс, асфальтиты, зола от сжигания мазута, шлаки феррофосфорного производства, отходы переработки уран-ванадиевых руд и др.
Извлечение ванадия при этом осуществляется по различным гидрохимическим технологиям. Этот способ используют главным образом американские производители, а также в Великобритании и Японии. На его долю приходится около 10 % производимого ванадия. В настоящее время он является наиболее дорогостоящим.
Развитие технологий извлечения ванадия из вторичных материалов в США и Великобритании обусловлено в основном отсутствием в этих странах рудной базы ванадийсодержащего титаномагнетитового сырья. Кроме того, учитывается и наличие большого количества отходов других производств с высоким содержанием ванадия (до 50 %), а также жесткие экологические требования и высокие платежи за загрязнение окружающей среды.
ИСПОЛЬЗОВАНИЕ ТЕХНОГЕННЫХ РЕСУРСОВ
Структура ресурсов ванадия в нашей стране определяется наличием больших запасов ванадийсодержащих титаномагнетитовых руд. В связи с высокой стоимостью переработки и сложностью технологической схемы передела этих руд в настоящее время стала актуальной задача разработки технологий и создания производств по выпуску ванадиевой продукции из техногенного ванадийсодержащего сырья.
К ванадиевым ресурсам техногенного происхождения относятся золы и шлаки тепловых электростанций, отработанные катализаторы сернокислотного производства, шламы титанового и глиноземного производств, попутные продукты и вторичные материалы ванадиевого и феррованадиевого производств.
Один из видов такого сырья — материалы, образующиеся в котлоагрегатах ТЭС, сжигающих ванадийсодержащие мазуты и нефтеводяные эмульсии. В результате оксидные соединения ванадия концентрируются в зольных остатках, оседающих на поверхностях нагрева, или в шламах, образующихся в обмывочных растворах.
В некоторых странах ванадийсодержащие ЗШО ТЭС активно вовлекают в производственную сферу. В Канаде, США и Венесуэле ванадий, а также никель получают не только из нефти и битума, но и из ВЗШО, полученных в результате сжигания на ТЭС нефтепродуктов. Наиболее развито применение техногенного ванадийсодержащего сырья в Японии. Доля ванадийсодержащих нефтяных остатков, летучей золы, образующейся в топках, работающих на мазуте, и отработанных катализаторов в производстве феррованадия в Японии достигает 30 %.
В России переработка ВЗШО ТЭС в промышленных масштабах до сих пор не освоена. Если учесть все золоотходы, полученные при сжигании органического топлива за последние два-три десятилетия, то количество техногенного сырья окажется достаточным для производства около 100 тыс. тонн металлического ванадия. Количество этого сырья с каждым годом возрастает, несмотря на то, что практически все ТЭС в России не оборудованы системами пылеулавливания и до 90 % ванадия теряется в виде выбросов в атмосферу.
Таким образом, использование золошлаковых отходов продиктовано не только возможностью извлечения ванадия. Попутно может быть решена важнейшая экологическая задача утилизации отходов, занимающих значительные площади и представляющих опасность для окружающей среды, так как при взаимодействии с атмосферными осадками эти отходы выделяют в гидросферу токсичные органические вещества и тяжелые металлы.
Принимая во внимание истощение сырьевой базы и учитывая тот факт, что с каждым годом технологии переработки техногенного сырья совершенствуются, а затраты на производство V>2>0>5> с использованием вторичного сырья постепенно приближаются к стоимости производства по традиционным технологиям, можно с уверенностью утверждать, что структура производства ванадия будет изменяться в сторону использования техногенных материалов.
ГЛАВА 3. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ "ВАНАДИЙ И ЕГО СОЕДИНЕНИЯ"
Тема. Ванадий.
Цель: повторить и обобщить сведения о свойствах, способах получения и применении ванадия и его соединений.
Оборудование: Периодическая система химических элементов Д.И. Менделеева (приведена в электронном учебном пособии).
Содержание урока соответствует части IV.9 электронного учебного пособия.
Знакомство с химией ванадия и его соединений следует начать с исторической справки. Ванадий был открыт в 1830 г. шведским химиком и минералогом Н. Сефстремом в железной руде из Таберга (Швеция). В чистом виде выделен в 1869 г. английским химиком Г. Роско при взаимодействии водорода и хлористого ванадия.
Охарактеризовать положение ванадия в Периодической системе химических элементов Д.И. Менделеева. Ванадий расположен в 5 группе Периодической системы химических элементов Д.И. Менделеева. Ванадий – d-элемент. Валентные электроны атома ванадия имеют электронную конфигурацию 3d34s2. В соединениях ванадий проявляет степени окисления +2, +3, +4, +5. Соединения ванадия (II) проявляют преимущественно основные свойства, ванадия (III) и (IV) – амфотерные, соединения ванадия (V) – кислотные.
Остановиться на распространенности ванадия в земной коре: ванадий – довольно распространенный элемент, но его минералы не встречаются в виде крупных месторождений, ванадий относится к рассеянным элементам. Ванадий встречается в нефти, битумах, углях, содержится в морской воде и осадочных породах.
При изучении физических свойств ванадия отметить, что ванадий – серебристо-белый металл, пластичен, при нагревании на воздухе выше 300 °С становится хрупким, примеси кислорода, водорода и азота резко снижают пластичность ванадия, придают ему твердость и хрупкость. На воздухе покрывается прочной оксидной пленкой.
При изучении химических свойств ванадия обратить внимание, что ванадий отличается высокой химической стойкостью, при нормальных условиях инертен. При нагревании взаимодействует со многими неметаллами: кислородом, азотом, галогенами, углеродом, бором, кремнием, серой и фосфором. Обратить внимание на образующиеся продукты и степень окисления ванадия в соединениях. Ванадий находится в ряду напряжений металлов до водорода, но, благодаря своей прочной защитной пленке, довольно инертен, не растворяется в воде и разбавленной соляной кислоте, на холоду не реагирует с разбавленной серной и азотной кислотой. Реагирует с плавиковой кислотой с образованием фторида ванадия, с концентрированной азотной кислотой с образованием соединения ванадия (V) – нитрата ванадина, с концентрированной серной кислотой с образованием соединения ванадия (IV) – сульфата ванадила, с царской водкой с образованием соединения ванадия (V) – хлорида ванадина, растворяется в смеси азотной и плавиковой кислот с образованием гептафторованадата (V) водорода. Ванадий не взаимодействует с растворами щелочей, в расплавах в присутствии воздуха окисляется с образованием ванадатов. Необходимо обратить особое внимание на характер образующихся продуктов.
Рассмотреть способы получения ванадия методами металлотермии и электролизом расплава солей ванадия.
Познакомить учащихся с соединениями ванадия в различных степенях окисления. Из соединений ванадия (II) рассмотреть свойства оксида, гидроксида и солей ванадия (II). Обратить внимание, что они проявляет основные свойства, с водой и щелочами не взаимодействует, реагирует с кислотами. Соединения ванадия (II) – сильные восстановители, уже на воздухе растворы солей окисляются с образованием соединений ванадия (III).
Из соединений ванадия (III) рассмотреть свойства оксида, гидроксида и солей ванадия (III). Основными формами существования ванадия (III) являются V3+, VO+, VO>3>3-, комплексные ионы, в которых ванадий имеет координационное число, равное 6. Соединения ванадия (III) проявляют амфотерные свойства с преобладанием основных, являются сильными восстановителями, в растворах окисляются кислородом воздуха до производных ванадия (IV).
Из соединений ванадия (IV) рассмотреть свойства оксида, гидроксида и солей ванадия (IV). При обычных условиях степень окисления +4 является для ванадия наиболее характерной. Ванадий (IV) существует в следующих формах: VO2+ (ванадин-ион), VO>3>2-, V>4>O>9>2- (ванадат (IV)-ионы). В комплексных ионах имеет координационное число, равное 6, а также 4 и 5. Соединения ванадия (IV) проявляют амфотерные свойства, с преобладанием кислотных, в зависимости от условий могут быть окислителями и восстановителями.
Из соединений ванадия (V) рассмотреть свойства оксида и солей ванадия (V) – изополиванадатов. Степень окисления +5 для ванадия реализуется в оксокатионах VO>2>+, VO3+ (ванадил-ионы) и оксоанионах VO>4>3-, V>2>O>7>4-, V>3>O>9>3- и др. (ванадат (V)-ионы). Соединения ванадия (V) проявляют кислотные свойства. Обратить внимание на формы существования ванадат-ионов в растворе в зависимости от рН и концентрации раствора.
Сделать вывод об изменении кислотно-основных и окислительно-восстановительных свойств соединений ванадия в ряду V (II) – V (III) – V (IV) – V (V). В указанном ряду кислотно-основные свойства изменяются от основных (V (II)) через амфотерные (V (III) и V (IV)) до кислотных (V (V)), а окислительно-восстановительные – от восстановительных (V (II)) до окислительных (V (V)).
Рассмотреть основные области применения ванадия и его соединений.
ЛИТЕРАТУРА
Бобылев В., Бродов А., Фофанов А., Рабинович Е. Ванадий — запасов хватит на века // Металлы Евразии.— 2001. —№3.
Исидоров В. А. Экологическая химия: Учеб. пособ. для вузов. — СПб.: Химиздат, 2001.
Использование ванадия в стали: Сб. тр. — Екатеринбург: Изд-во УрО РАН, 2002.
Сирина Т. П., Мизин В. Г., Рабинович Е. М. и др. Извлечение ванадия и никеля из отходов теплоэлектростанций. — Екатеринбург: Изд-во УрО РАН, 2001.
Смирнов Л. А., Дерябин Ю. А. и др. Конвертерный передел ванадиевого чугуну. — Екатеринбург: Ср.-Урал. кн. изд-во, 2000