Генетический код (работа 2)
Лекция 1. Структура геномов про- и эукариот. Генетический код
1. 1928г. Опыты Фредерика Гриффита
Гриффит работал с пневмококками - бактериями, вызывающими пневмонию. Он брал два штамма пневмококков: капсульный и бескапсульный. Капсульный - патогенный (вирулентный), при инфицировании таким штаммом мыши погибают, бескапсульный - непатогенный. При введении мышам смеси убитых нагреванием (и, следовательно, потерявших вирулентность) капсульных пневмококков и живых бескапсульных невирулентных бактерий, животные погибали в результате размножения капсульных вирулентных форм. Обнаруженное явление Гриффит интерпретировал как трансформацию.
В 1944г. этот эксперимент был повторен Освальдом Эйвери, Колином Мак-Леодом и Маклином Мак-Карти в варианте смешивания бескапсульных пневмококков с взятыми от капсульных белками, полисахаридами или ДНК. В результате этого эксперимента была выявлена природа трансформирующего фактора.
Трансформирующим фактором оказалась ДНК.
2. 1952г. Эксперимент Альфреда Херши и Марты Чейз
Фаги (бактериофаги) - это вирусы, размножающиеся в бактериях.
E. сoli - кишечная палочка (эубактерия).
Суть опыта: фаги, у которых белковая оболочка была мечена радиоактивной серой (S35), а ДНК - радиоактивным фосфором (Р32), инкубировали с бактериями. Затем бактерии отмывали. В смывных водах не обнаруживали Р32, а в бактериях - S35 Следовательно, внутрь попала только ДНК. Через несколько минут из бактерии выходили десятки полноценных фагов, содержащих и белковую оболочку, и ДНК.
Отсюда следовал однозначный вывод о том, что именно ДНК выполняет генетическую функцию - несет информацию как о создании новых копий ДНК, так и о синтезе фаговых белков 1957г. Опыты Френкеля – Конрата
Френкель-Конрат работал с вирусом табачной мозаики (ВТМ). В этом вирусе содержится РНК, а не ДНК. Было известно, что разные штаммы вируса вызывают разную картину поражения листьев табака. После смены белковой оболочки "переодетые" вирусы вызывали картину поражения, характерную для того штамма, чья РНК была покрыта чужим белком.
Следовательно, не только ДНК, но и РНК может служить носителем генетической информации
Молекулярная биология - это наука о механизмах хранения, воспроизведения, передачи и реализации генетической информации, о структуре и функциях нерегулярных биополимеров - нуклеиновых кислот и белков.
Нуклеотиды
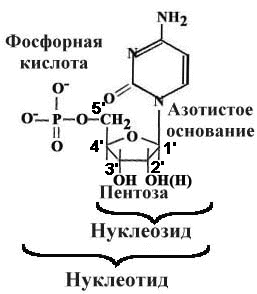
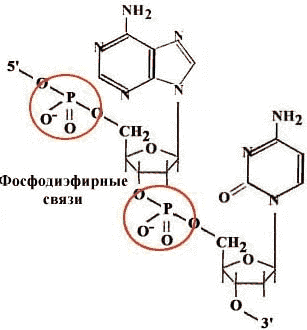
Принципы строения ДНК
1.Нерегулярность.
Существует регулярный сахарофосфатный остов, к которому присоединены азотистые основания. Их чередование нерегулярно.
2.Антипараллельность.
ДНК состоит из двух полинуклеотидных цепей, ориентированных антипараллельно. 3`-конец одной расположен напротив 5`- конца другой.
3.Комплементарность(дополнительность).
Каждому азотистому основанию одной цепи соответствует строго определенное азотистое основание другой цепи. Соответствие задается химией. Пурин и пиримидин в паре образуют водородные связи. В паре A-Т две водородные связи, в паре Г-Ц - три.
4.Наличие регулярной вторичной структуры.
Две комплементарные, антипараллельно расположенные полинуклеотидные цепи образуют правые спирали с общей осью.
Формы двойной спирали ДНК
В основной - В-форме на виток
приходится 10 комплементарных пар.
Плоскости азотистых оснований
перпендикулярны оси спирали. Соседние
комплементарные пары повернуты друг
относительно друга на 36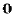 .
Диаметр спирали 20Å, причем пуриновый
нуклеотид занимает 12Å, а пиримидиновый
- 8Å. А-форма - 11 пар азотистых оснований
на виток. Плоскости азотистых оснований
отклонены от нормали к оси спирали на
20
.
Диаметр спирали 20Å, причем пуриновый
нуклеотид занимает 12Å, а пиримидиновый
- 8Å. А-форма - 11 пар азотистых оснований
на виток. Плоскости азотистых оснований
отклонены от нормали к оси спирали на
20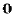 .
Отсюда следует наличие внутренней
пустоты диаметром 5Å. Высота витка 28Å.
Такие же параметры у гибрида из одной
цепи ДНК и одной цепи РНК.
.
Отсюда следует наличие внутренней
пустоты диаметром 5Å. Высота витка 28Å.
Такие же параметры у гибрида из одной
цепи ДНК и одной цепи РНК.
С-форма - шаг спирали 31Å, 9.3
пар оснований на виток, угол наклона к
перпендикуляру 6 .
.
Все три формы - правозакрученные спирали.
Есть еще несколько форм правых спиралей и всего одна левая спираль (Z -форма). Высота витка в Z-форме -44.5 Å, на виток приходится 12 пар нуклеотидов. Ни А-, ни Z- формы не могут существовать в водном растворе без дополнительных воздействий (белки или суперспирализация).
Отличия между ДНК и РНК
|
ДНК |
РНК |
|
|
Сахар |
Дезоксирибоза |
Рибоза |
|
Азотистые основания |
А, Т, Г, Ц |
А, У, Г, Ц |
|
Количество цепей в молекуле |
99.99% двойная спираль 0.01% одноцепочечная. |
99.99% одноцепочечная |
|
Форма молекулы |
Все одноцепочечные- кольцевые. Большинство двухцепочечных - линейные, часть- кольцевые. |
Линейные молекулы |
Сюрпризы митохондриального генома
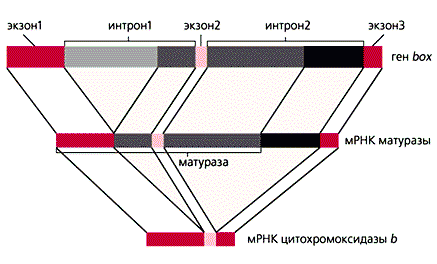
Несмотря на то, что в геномах митохондрий млекопитающих и дрожжей содержится приблизительно одинаковое количество генов, размеры дрожжевого генома в 4-5 раз больше — около 80 тыс. пар нуклеотидов. Хотя кодирующие последовательности мтДНК дрожжей высоко гомологичны соответствующим последовательностям у человека, дрожжевые мРНК дополнительно имеют 5'-лидерную и 3'-некодирующую области, как и большинство ядерных мРНК. Ряд генов содержит еще и интроны. Так, в гене box, кодирующем цитохромоксидазу b, имеется два интрона. Из первичного РНК-транскрипта автокаталитически (без участия каких-либо белков) вырезается копия большей части первого интрона. Оставшаяся РНК служит матрицей для образования фермента матуразы, участвующей в сплайсинге. Часть ее аминокислотной последовательности закодирована в оставшихся копиях интронов. Матураза вырезает их, разрушая свою собственную мРНК, копии экзонов сшиваются, и образуется мРНК для цитохромоксидазы b . Открытие такого феномена заставило пересмотреть представление об интронах, как о “ничего не кодирующих последовательностях”.
Сверхспирализация.
Образование сверхспиральной ДНК происходит во всех прокариотических и эукариотических клетках и во многих вирусах, поражающих эукариот. Сверх спиральная (сверхскрученная) ДНК образуется при введении в двойную спираль ДНК дополнительных витков (сверхвитков). В результате в молекуле возникает напряжение, которое проявляется, в частности в том, что ось двойной спирали сама закручивается в спираль (спирализуется) – см. на примере кольцевой замкнутой двуцепочечной ДНК (прозрачка). Полученная таким образом суперспиральная ДНК должна быть стабилизирована, поскольку в результате более плотной упаковки отрицательно заряженные фосфатные группы оказываются в непосредственной близости друг от друга. Взаимное отталкивание их компенсируется путем связывания их с положительно заряженными белками (есть не у всех вирусов, но у всех про-и-эукариотах) и с малыми молекулами, представляющими собой полиамины, например, спермидин (их нет только в вирусах).
Упаковка ДНК в клетках прокариот.
Сверхспиральный участок ДНК в комплексе с гистоноподобными белками, обладающими сродством к ДНК, и полиаминами образует «бусину» диаметром около 12 нм. Внутри бусины ось двойной спирали ДНК перекручена и образует примерно 6 витков. Бусины соединены между собой участками ДНК, в которых сверхспиральность отсутствует, и объединяются таким образом в структуру, напоминающую ожерелье. Такая ДНК образует далее большие петли, которые стабилизируются и окончательно конденсируются благодаря взаимодействию с соответствующими белками и РНК.
Упаковка ДНК в клетках эукариот
Включает в себяассоциацию сверхспирализованной ДНК с различными белками (гистонами –основные белки, 11,3-21 кДа, внутри бусины Н2А, Н2В, Н3 и Н4 ), в результате которой образуется комплекс, называемый хроматином. Хроматин в свою очередь образует соленоидоподобную структуру, с которой связываются хромосомные структурные белки (они образуют каркас на котором идет окончательная конденсация хроматина, этот белковый остов не разрушается даже после удаления всех гистонов); получившийся в результате комплекс – хромосома.
Хроматин состоит из двуцепочечной ДНК, которая обвивается вокруг гранул, состоящих из гистонов. Такая структура похожая на бусы – хроматиновое волокно. Каждая бусина – это нуклеосома (диаметр ее около 10 нм, впервые установил ее структуру Клуг с сотрудниками). Нуклеосомы соединяются с помощью гистона Н1, ДНК этих связующих участков – соединительная (или линкерная) ДНК. Н1 не участвует в стабилизации структуры хромосомы, а скорее играет роль в регуляции транскрипционной активности хроматина. В результате конденсации в хроматин продольные размеры ДНК уменьшаются в 5-6 раз.
Топоизомеразы. Переходы в молекулах ДНК, связанные с изменением степени сверхспирализации (топологические изомеры ДНК), катализируются ферментами топоизомеразами. Одни топоизомеразы вызывают релаксацию сверхспиральной ДНК, а другие напротив, приводят к появлению в ней сверх витков. Так например, ДНК-гираза E. Coli переводит двуцепочечную кольцевую ДНК в состояние с отрицательной сверхспирализацией. Это необходимо для снятия положительных сверхвитков, возникающих при репликации (и транскрипции) из-за раскручивания двойной спирали ДНК. (см. действие антибиотиков).
Гены. Структурный ген – это наименьший отрезок ДНК или РНК, кодирующий полную аминокислотную последовательность какого-либо белка. В клетке высших организмов может содержаться до 100 000 генов (по последним данным их существенно меньше). Однако ДНК в клетке столько, что ее хватило бы на образование в 10 раз большего числа генов. «лишняя ДНК» - в составе интронов, спейсерной ДНК, например. В вирусах может быть лишь 5-6 генов, а геном прокариот составляет примерно 0,1% от генома высших.
Хромосома прокариот. Структурные гены подразделяются на три основных типа: независимые гены (транскрибируются без каких-либо механизмов регуляции транскрипционной активности), транскрипционные единицы (транскриптоны – группа следующих друг за другом генов, транскрибируемых совместно, обычно это гены белков или н.к., связанных между собой в функциональном отношении), и опрероны (группа следующих подряд структурных генов, находящихся под контролем участка ДНК - оператора). Кроме того в прокариотической клетке могут находиться более мелкие реплицирующиеся единицы – плазмиды (кольцевые молекулы ДНК, в них есть участки способные к перемещению – транспозоны, они часто содержат гены резистентности к антибиотикам, перемещаясь из одной клетки в другую в процессе коньюгации, гены резистентности быстро распространяются в популяции бактерий).
Клетки эукариот используют в качестве генетического материала лишь двуцепочечную ДНК. Структурные гены в них подразделяются на независимые гены (их транскрипция не связана с транскрипцией других генов, их активность регулируется, например гормонами), повторяющиеся гены (например, ген рибосомной 5S-РНК повторятся много сотен раз, причем повторы следуют вплотную друг за другом) и кластерные гены (это локализованные в определенных участках – локусах – хромосомы группы различных генов с родственными функциями, иногда также в виде повторов, например, кластер гистоновых генов в геноме человека повторяются 10-20 раз). В кодирующие последовательности этих генов могут вклиниваться некодирующие – интроны (разбивают кодирующую – экспрессируемую часть гена – следовательно для полученной с этой матрицы мРНК нужен сплайсинг). Кроме того, между генами могут находиться участки ДНК с большим числом повторов (сателлитной ДНК – в теломерных и центромерных участках хромосомы – функция этой ДНК пока неясна, вероятно структурная) и спейсерной ДНК (располагается между генами), транскрибируемой и нетранскрибируемой.
Неядерные геномы. ДНК митохондрий и хлоропластов.
Отличительная особенность клеток эукариот состоит в том, что часть генетической информации у них заключена в молекулах, находящихся вне хромосом, локализованных в ядре. Существует два таких типа цитоплазматических ДНК: одни – в митохондриях эукариот, другие – в хлоропластах зеленых растений и водорослей. Как и все цитоплазматические элементы, они наследуются по материнской линии, а не по законам Менделя.
ДНК митохондрий. Это замкнутые кольцевые сверхспиральные дуплексные ДНК (прозрачка). Размер у животных около 20 т.п.н., у дрожжей – 80 т.п.н., у растений – от нескольких сотен до нескольких тысяч т.п.н. Митохондриальная ДНК эволюционирует быстрее, чем ядерная, и мутации в ней происходят почти в десять раз чаще. Рассмотрим на примере митохондриальной ДНК дрожжей. Есть гены, кодирующие белки, гены кодирующие РНК, вставочные последовательности, есть сайты начала репликации, кодирующие субединицы АТФ-азного комплекса.
ДНК хлоропластов сходна с ДНК митохондрий. Эта ДНК – кольцевой дуплекс (прозрачка), содержащий какое-то количество (но далеко не все) генов, существенных для функционирования (например, кодирование фрагмента ключевого фермента фотосинтеза – рибулозо-1,5-бифосфат карбоксилаза) и поддержания структуры хлоропластов, и имеет достаточно большую длину – 120-180 т.п.н. в отличие от ДНК митохондрий в пределах вида довольно консервативна.
Есть примеры межгеномного обмена: перенос сегментов хлоропластной ДНК в ядерную ДНК, митохондриальной ДНК в ядерную ДНК (дрожжи, саранча, крыса), хлоропластной ДНК в митохондриальную ДНК. Механизм таких переносов пока не установлен.
Лекция 2. Структура хроматина. Полиморфизм ДНК
В живых организмах молекулы ДНК представляют собой либо очень длинные, либо замкнутые в кольцо двуспиральные молекулы, поэтому любой процесс, связанный с передачей наследственной информации, должен наталкиваться на серьезные топологические проблемы: возникновение положительной (+) или отрицательной (-) сверхспирализации ДНК, образование катенанов или узлов.
Сверхспирализованная ДНК обладает значительным запасом энергии по сравнению с ее релаксированной формой. Следовательно, локальное расплетание двойной спирали ДНК с отрицательными сверхвитками будет приводить к сбросу напряжения сверхспирализации и поэтому энергетически выгодно. Это отчетливо проявляется в том, что отрицательная сверхспирализация заметно стимулирует переход ДНК из правой В-формы в левую Z-форму. Отрицательная сверхспирализация ДНК облегчает связывание с ней белков, раскручивающих ее двойную спираль.
Решение названных топологических проблем обеспечивают ДНК-топоизомеразы — ферменты, изменяющие топологию ДНК (рис. 49). Топоизомеразы релаксируют сверхспирализованные молекулы ДНК, снимая их внутреннее напряжение путем внесения одно и двуцепочечных разрывов с последующим их восстановлением лигированием). По механизму действия различают ДНК-топоизомеразы двух типов — I и II.
ДНК-топоизомеразы I — мономерные белки, релаксируют ДНК без затраты энергии путем внесения одноцепочечных разрывов. ДНК-топоизомеразы II функционируют в виде димеров (у эукариот) и тетрамеров (у прокариот), осуществляя АТР-зависимое расщепление обеих цепей ДНК с последующим переносом цепей через разрыв и его лигированием.
Для внесения одноцепочечного разрыва в ДНК все ДНК-топоизомеразы используют остаток тирозина, который осуществляет нуклеофильную атаку фосфатной группы ДНК с образованием фосфотирозина. В результате ферменты оказываются ковалентно связанными с 5'-или З'-концами ДНК в одноцепочечном разрыве.
Топоизомеразы подтипа 1-5' связываются преимущественно с одноцепочечными участками ДНК,
осуществляя ее разрыв с образованием 5'-фосфодиэфирной связи с тирозином активного центра фермента. Через образовавшийся разрыв проходит либо одноцепочечная ДНК (снятие витка), либо двуцепочечная (образование узла или катенана). Ферменты этого типа снимают только отрицательную суперспирализацию. Характерны для прокариот.
Топоизомеразы подтипа 1-3' связываются с двуцепочечной ДНК, разрывают одну цепь с образованием З'-фосфодиэфирной связи с тирозином активного центра фермента. Через разрыв проходит вторая цепь дуплекса, уменьшая плотность суперспирализации ДНК; знак суперспирализации существенной роли не играет. Характерны для эукариот.
Топоизомеразы типа II связываются с двуцепочечной ДНК и осуществляют разрыв обеих цепей с образованием двух 5'-фосфодиэфирных связей с тирозинами активного центра. В образовавшуюся щель проходит вторая двуцепочечная ДНК, и результатом является изменение числа положительных или отрицательных супервитков на 2 (в отличие от ферментов типа I, изменяющих число супервитков на единицу за шаг).
Этот фермент способен катенировать, декатенировать и развязывать узлы интактной ДНК. Для многократного повторения цикла требуется АТР (рис. 50).
Топоизомераза II Е. coli (ДНК-гираза) относится к ферментам типа II, но не требует АТР. Она индуцирует образование отрицательных супервитков в релаксированных кольцевых ДНК. Гираза взаимодействует с ДНК таким образом, что последняя наматывается вокруг белка. При этом возникает положительная сверхспирализация в тех местах молекулы ДНК, которые связаны с белком. Затем фермент разрывает обе нити ДНК и переносит двойную нить с внутренней стороны на внешнюю, после чего скрепляет оба разрыва, превращая положительную петлю в отрицательную (рис. 51). Это особенно важно для инициации репликации, а также необходимо для ее элонгации и терминации.
ДНК-топоизомераза II является жизненно важным ферментом любого эукариотического организма. Выяснена роль ДНК-топоизомеразы в формировании высших уровней структуры хроматина, а именно, участии фермента в образовании петель хроматина во время конденсации хромосом.
Гистоны составляют большинство основных белков хроматина и находятся примерно в том же количестве, что и ДНК. По относительной доле основных аминокислот каждого типа, которую выражают отношением лизин/аргинин, сначала охарактеризовали пять типов гистонов. След этой классификации до сих пор остается в названиях гистонов. Практически у всех эукариот обнаруживают одни и те же классы гистонов. Их свойства суммированы в табл. 29.1.
Гистоны четырех классов прямо взаимодействуют с ДНК и образуют в хроматине серию частиц первого уровня организации. Консервативность типов гистонов на протяжении эволюции можно объяснить необходимостью сохранения этой важнейшей реакции. Пятый класс гистонов принимает участие во взаимодействиях между частицами. Постоянство классов гистонов позволяет предполагать, что взаимодействия типа ДНК—гистоны, гистон—гистоны и гистон—негистоновые белки могут быть в основном похожими у разных видов. Отсюда мы можем сделать заключение об общих механизмах образования как первичных частиц, так и последующих структур более сложного порядка, состоящих из серий частиц.
Гистоны первых четырех классов имеют значительное количество как кислых, так и основных аминокислот. Поэтому эти белки несут высокий заряд. Отношение основных аминокислот к кислым находится в диапазоне 1,4-2,5. Эти гистоны подразделяются на две группы.
К аргинин-богатым относятся два вида гистонов: Н3 и Н4. Они принадлежат к наиболее консервативным из всех известных белков. Аминокислотные последовательности этих белков идентичны даже у таких удаленных видов, как корова и горох. В гистонах Н3 и Н4 других видов обнаружены только редкие аминокислотные замены. Консервативность целой последовательности говорит о том, что все ее аминокислоты имеют существенное значение для выполнения функции белка. По логике вещей эта функция должна быть одинаковой у огромного большинства различных видов, что свидетельствует в пользу концепции об общей основе для структуры хроматина.
К гистонам, умеренно обогащенным лизином, относятся два белка. Их называют Н2А и Н2В (в противоположность их номенклатурному обозначению это не родственные, а независимые белки). У различных эукариот находят те же самые два типа гистонов, но у них обнаружены заметные межвидовые вариации в аминокислотной последовательности.
Пятый класс представлен гистонами, очень богатыми лизином; он состоит из нескольких достаточно близкородственных белков с перекрывающимися последовательностями аминокислот. Это гистоны H2 (в эритроцитах птиц существует вариант, названный Н5). У этих гистонов обнаружены значительные межвидовые и межтканевые вариации (у дрожжей, по-видимому, гистонов данного класса нет). Хотя эти гистоны являются самыми основными гистонами, их легко можно выделить из хроматина, полностью растворив в солевом растворе (0,5М).
Как и следует из названия, негистоны - это все другие белки хроматина. Предполагается поэтому, что они обладают большими видовыми и тканевыми различиями, хотя строгих данных о степени их разнообразия пока нет. Эти белки составляют меньшую долю от всей массы белков хроматина, чем гистоны. Кроме того, сюда относится намного большее число белков, так что любой индивидуальный белок присутствует в значительно меньшем количестве, чем любой гистон.
В класс негистоновых белков могут попасть белки, связанные с экспрессией генов, и белки, участвующие в организации структур высшего порядка. Так, в числе наиболее выдающихся негистонов можно назвать РНК-полимеразу. HMG-белки (высокомобильная группа) составляют отдельный, хорошо различимый подкласс негистонов. Основная проблема, возникающая при работе с другими негистоновыми белками - их загрязнение другими ядерными белками
Гистоны удаляют путем конкурентного замещения полианионами декстрансульфатом и гепарином.
Нуклеосомы
Если интерфазные ядра суспендировать в растворе с низкой ионной силой, они разбухнут и в местах разрывов из них высвободятся нити хроматина. На рис. 29.1 показано лизировавшее ядро, из которого вытекают нити. В некоторых местах нити хроматина состоят из плотноупакованного материала, но в тех местах, где они вытянуты, можно видеть, что они состоят из отдельных частиц. Эти частицы называют нуклеосомами. В особенно вытянутых участках видно, что индивидуальные нуклеосомы соединены тонкой нитью - это свободная двухцепочечная ДНК. Таким образом, непрерывная двухцепочечная ДНК проходит через серию частиц.
Индивидуальные нуклеосомы можно получить, обработав хроматин ферментом нуклеазой микрококков. Это эндонуклеаза, которая разрезает нить ДНК в местах соединения между нуклеосомами. Сначала освобождаются группы частиц, а потом отдельные нуклеосомы. Мономерные нуклеосомы отчетливо видны на рис. 29.2 в виде компактных частиц (настоящая форма которых похожа на диск; см. ниже). Они седиментируют примерно со скоростью 11S, что соответствует общей массе в диапазоне 250000-300000 дальтон. Отношение белок/ДНК составляет около 1,25. Димеры, тримеры и т.д. имеют соответствующие свойства при биохимическом анализе или при наблюдении под электронным микроскопом.
Мономерные нуклеосомы содержат ДНК ( ~ 200 п. н.), связанную с гистоновым октамером. Этот октамер содержит гистоны Н2А, Н2В, НЗ и Н4 - по две копии каждого. Иногда их называют гистоновой сердцевиной (гистоновым кором). Такие комплексы схематически изображены на рис. 29.3.
Нуклеосома - белковый комплекс, состоящий из гистонов состава [2H3A, 2H3B, 2H3, 2H4].
Характеристика нуклеосомы
|
нуклеосома 5,5x11нм |
146пн |
|
нуклеосома+H2 |
166пн |
|
нуклеосома+H2+линкер (участок м-у н.) |
200пн |
ДНК в B-форме перекручена на 0,25-0,35 пн на виток спирали, при этом шаг спирали 10,2 пн/виток (у В-формы в растворе - 10,5 пн/виток). Такая ДНК делает 1,75 левых оборота вокруг нуклеосомы. Комплекс не разрушается при разрушении плеч гистонов. N-концевые домены Н3 контактируют с ДНК на входе в коровую частицу и выходе из нее, Н4 связывается с внутренней частью ДНК нуклеосомы H2 - линкерный гистон и выполняет функцию связывания нуклеосом между собой, однако у дрожжей H2 не обнаружен, а его аналог Hho1p не выполняет видимой роли в сворачивании ДНК и взаимодействии нуклеосом между собой.
Любое дополнительное увеличение содержания белка зависит от присутствия небольшого количества негистоновых белков, которые связываются с нуклеосомами.
Нуклеосомную ДНК можно разделить на две части.
ДНК минимальной нуклеосомы имеет постоянную длину 146 п.н. и относительно устойчива к расщеплению нуклеазами. (Другие нуклеазы, в том числе и нуклеаза микрококков, останавливаются перед этим отрезком ДНК.)
Линкерная ДНК заключает в себе остаток повторяющейся единицы. Ее длина может варьировать in vivo от такого малого размера, как 8 п. н., до такого большого, как 114 п.н., на 1 нуклеосому.

Рассматривая модель, изображенную на рис. 29.8 в виде поперечного сечения, можно видеть, что два витка ДНК лежат близко один к другому. Это, возможно, имеет функциональное объяснение. Один виток вокруг нуклеосомы захватывает 80 п.н., так что точки, отстоящие на это расстояние в свободной двойной спирали, могут оказаться расположенными достаточно близко друг к другу на нуклеосоме. Таким образом, если ДНК-связывающий белок одновременно контактирует с двумя витками ДНК, как показано на рис. 29.9, узнаваемые им последовательности могут отстоять на двойной спирали ДНК гораздо дальше, чем величина соединяющего их участка в белке. Часто обсуждается вопрос о том, может ли стартовая точка транскрипции находиться поблизости от положения — 80 так чтобы обе цепи одновременно контактировали с РНК-полимеразой. (Это внесло бы конкретную деталь в обобщенную модель, показанную на рис. 11.8).
Плотность упаковки отдельной нуклеосомы равна примерно 6 (так как 67 нм ДНК упакованы в частицу длиной около 11 нм). Можно упаковать серию нуклеосом достаточно плотно, чтобы сохранить это отношение. Множество работ по изучению наборов нуклеосом было выполнено на вирусе SV40.
Важным параметром в описании структуры хроматина является степень суперспирализации, которая может возникнуть на нескольких уровнях:
суперспирализация может быть результатом упаковки ДНК на нуклеосоме.
суперспирализация может быть следствием укладки нуклеосом в структуру более высокого уровня.
Состояние суперспирализации во многом может удерживаться белками (по принципу, описанному в гл. 28). Прямые измерения плотности суперспирализации позволят узнать среднее напряжение скручивания ДНК, возникающее в результате образования свободных супервитков, но таким образом нельзя обнаружить суперспирализации, которая удерживается в ходе упаковки ДНК.
Для мини-хромосомы вируса SV40 можно прямо измерить степень суперспирализации в самой нуклеосоме. Мини-хромосома может иметь свободные супервитки в гирлянде нуклеосом, а также супервитки, удерживаемые на нуклеосоме. Процедура измерения суперспирализации, обусловленная только структурой нуклеосом, показана на рис. 29.10. Сначала освобождаются свободные супервитки самой мини-хромосомы, так что гирлянда нуклеосом образует кольцо с нулевой суперспирализацией. Затем экстрагируют гистоновые октамеры. В результате этой процедуры освободившаяся ДНК свободно расправляется. Таким образом каждый супервиток, который сдерживается в мини-хромосоме, проявится в депротеинизированной ДНК как — 1 оборот. Так можно измерить общее число супервитков в ДНК вируса SV40.
Организация нуклеосом (гистонов) и ДНК
До сих пор мы рассматривали конструкцию нуклеосомы, исходя из того, как организованы повторяющиеся единицы длины ДНК на поверхности нуклеосом.
каким образом гистоны взаимодействуют друг с другом и с ДНК. Взаимодействуют ли гистоны только в присутствии ДНК или способны независимо собираться в октамеры?
Мы еще многого не знаем о структуре индивидуальных гистонов в нуклеосоме, но уже стала проясняться их относительная локализация. Большинство данных о взаимодействиях гистонов получено при изучении способности к агрегированию и к образованию перекрестных сшивок в нуклеосоме.
Способность гистонов агрегировать друг с другом изучена хорошо. Гистоны, богатые аргинином, можно получать в виде хорошо различимого тетрамера (Н3>2>Н4>2>). Гистоны, умеренно богатые лизином, образуют продукт, который менее четко охарактеризован, но который, очевидно, образует димер (Н2А • Н2В), имеющий тенденцию к дальнейшей агрегации. Одной из форм образующегося агрегата может быть тетрамер (Н2А>2> • Н2В>2>). Два указанных тетрамера называют гомотипическими (название отражает то, что каждый из них содержит только гистоны, относящиеся к одному из исходных классов).
Интактные октамеры гистонов можно получить либо экстракцией хроматина, либо (с большими трудностями) путем соединения гистонов in vitro в условиях высокой концентрации соли и белка. Октамер может диссоциировать с образованием гексамера гистонов и свободного димера Н2А • Н2В. В результате отделения второго димера Н2А • Н2В образуется тетрамер Н32Н42. Все эти формы можно экстрагировать из хроматина. Исходя из этих данных, можно сделать вывод, что в нуклеосоме имеется центральное «ядро» (kernel), состоящее из тетрамера Н3>2>Н4>2>, связанного с двумя независимыми димерами Н2А • Н2В.
Перекрестные сшивки позволяют установить, какие пары гистонов лежат ближе друг к другу в нуклеосоме. (Сложность в интерпретации этих данных заключается в том, что сшивается только небольшая часть гистонов. Поэтому следует оценивать результаты с осторожностью, учитывая типичность большинства взаимодействий.) На основе полученных данных была сконструирована модель организации нуклеосомы.
Сборка нуклеосом
1 способ. обусловлен способностью тетрамера Н32Н42 организовывать ДНК в частицы, которые несколько напоминают минимальную нуклеосому (по их чувствительности к нуклеазе микрококков). При добавлении димера Н2А • Н2В эти тельца могут превращаться в минимальную нуклеосому. Именно отсюда возникла идея о том, что в структуре нуклеосомы существует «ядро» из аргинин-богатых гистонов. Возможно, такой путь используется in vivo, поскольку это согласуется с наблюдением, что гистоны НЗ и Н4 включаются в реплицирующийся хроматин, до того как в его состав входят гистоны Н2А и Н2В.
2. способ. Данные получены при использовании поперечно-сшитых гистоновых октамеров, которые не могут диссоциировать на отдельные белки, но тем не менее сохраняют способность связывать ДНК с образованием минимальной нуклеосомы. Это говорит о том, что в принципе ДНК может обвиваться вокруг предварительно сформированного октамера.
Из ооцитов Xenopus выделен белок сборки.
Это пентамер, содержащий идентичные субъединицы по 29000 дальтон.
Это белок, преобладающий в ооцитах, и локализован он в нуклеоплазме.
Антитела, полученные против этого белка, реагируют с белками нуклеоплазмы многих эукариот. Следовательно, можно предположить, что этот белок соответствует эволюционно какой-то универсальной функции, закрепленной в процессе эволюции. Он был назван нуклеоплазмином.
В присутствии нуклеоплазмина гистоны могут связываться с ДНК, образуя в физиологических условиях (низкая концентрация соли) частицы.
Однако самого по себе нуклеоплазмина недостаточно для образования нуклеосом со специфическим интервалом.
Какова функция нуклеоплазмина?
Это кислый белок, который не связывается ни со свободной ДНК, ни с интактными нуклеосомами, но при этом он связывается со всеми индивидуальными гистонами
Реакция насыщается на уровне, равном одному пентамеру нуклеоплазмина на октамер гистона.
Нуклеоплазмин, возможно, играет роль «молекулярного сопровождающего», связываясь с гистонами и передавая их ДНК более регулируемым образом, чем было бы возможно без такого конкурента. Т.е. контролирует сродство гистонов к ДНК В пользу этого предположения говорит тот факт, что кислая полиглутаминовая кислота, а также РНК могут действовать сходным образом в качестве факторов сборки.
Фейзинг. Термином "фазирование" обозначают неслучайное расположение нуклеосом относительно конкретной последовательности нуклеотидов ДНК в определенных участках генома. Позиционирование идет в том числе при помощи специальных последовательностей ДНК, которые обладают тем свойством, что они более податливы к изгибу двойной спирали ДНК в этом месте. Перед активацией гена нуклеосомы присутствуют как в вышерасположенных регуляторных последовательностях ДНК, так и в самом промоторе. Во время индукции транскрипции такого гена регуляторные факторы (TF‚ связывающиеся с ТАТАбоксом), связываясь с ДНК, прямо или косвенно вызывают разрушение нуклеосомной структуры соответствующих участков ДНК.
Существуют области, в которых нет нуклеосом. Такие области могут быть связаны с контролем экспрессии генов или же с образованием структур более высокого уровня организации хроматина.(Льюин)
Нуклеосомы при репликации и транскрипции
При электронно-микроскопическом исследовании реплицирующегося хроматина было обнаружено, что обе новообразованные фибриллы содержат нуклеосомы. Если учесть скорость синтеза ДНК эукариот (20 нм/с), то новые нуклеосомы при удвоении хромосомных фибрилл должны возникать со скоростью 3—4 с. Такая высокая скорость образования нуклеосом связана с тем, что в момент синтеза ДНК уже существует пул синтезированных гистонов всех классов, готовых войти в состав нуклеосом. Гистоновые гены, относящиеся к фракции умеренно повторяющихся последовательностей ДНК, представлены в виде множественных копий для каждого гистона. Они активируются вместе с началом синтеза ДНК, поэтому по мере продвижения репликационной вилки новые участки ДНК могут сразу взаимодействовать с новосинтезированными гистонами. Новосинтезированные гистоны и старые гистоны в составе предшествующих нуклеосом не смешиваются при образовании нуклеосом во время репликации ДНК. Вместо этого октамеры гистонов, присутствующие до репликации, остаются интактными и переходят на дочерний дуплекс ДНК, в то время как новые гистоны собираются в совершенно новые кор-частицы на свободных от нуклеосом участках ДНК. Старые и новые октамеры гистонов распределяются между дочерними дуплексами ДНК случайным образом.
Что происходит со старыми нуклеосомами в вилке репликации ДНК, до конца не ясно. Согласно одной из гипотез, каждая из нуклеосом при подходе к ней репликативной вилки как бы расщепляется на две «полунуклеосомы», а нуклеосомная ДНК разворачивается, чтобы дать пройти этот участок ДНК-полимеразе. После этого новосинтезированная цепь ДНК связывается со свободными гистонами, которые есть в избытке в ядре, и образуются новые нуклеосомы на второй цепи ДНК.
Как уже упоминалось, для активно функционирующих зон хроматина характерно деконденсированное, диффузное, состояние. На этом свойстве хроматина основан один из методов получения фракций активного хроматина, когда с помощью центрифугирования удается осадить конденсированный хроматин из гомогенатов ядер, отделив его тем самым от диффузного хроматина, обладающего высокой транскрипционной активностью. Фракции активного хроматина обладают рядом характерных свойств: повышенной чувствительностью к нуклеазам, повышенным уровнем модификации гистонов (особенно ацетилированием гистона HI), повышенным содержанием некоторых негистоновых белков.
Биохимические данные показывают, что во время транскрипции часть нуклеосомных белков остается связанной с ДНК. Нуклеосомы как частицы видны на хроматиновых фибриллах как до места отхожде-ния транскрипта, так и после него при редкой посадке РНК-полиме-разы — фермента, вдвое большего, чем нуклеосома. При частой посадке этого фермента (например, при транскрипции рибосомных генов или генов в других активных локусах) частицы РНК-полимеразы располагаются тесно друг к другу и между ними нуклеосомы не видны (см, рис. 101). Вероятнее всего, нуклеосомные белки при прохождении РНК-полимеразы не теряют связи с ДНК, а сама ДНК в составе нуклеосомы разворачивается. Предлагаются два варианта изменения структуры нуклеосом при синтезе РНК. При одном их них нуклеосома «расщепляется» на две полунуклеосомы, а ДНК разворачивается; при другом — нуклеосома, частично декомпактизируясь, сохраняет тетра-мер (НЗ-Н4)>2>, а два димера Н2А-Н2В временно отходят, а затем, после прохождения РНК-полимеразы, возвращаются, при этом восстанавливается исходная нуклеосома.
Второй уровень компактизации ДНК - фибрилла диаметром 30 нм
Таким образом, первый, нуклеосомный, уровень компактизации хроматина играет как регуляторную, так и структурную роль, обеспечивая плотность упаковки ДНК приблизительно в 6—7 раз.
Однако во многих электронно-микроскопических исследованиях было показано, что как в митотических хромосомах, так и в интерфазных ядрах выявляются фибриллы хроматина диаметром 30 нм (рис. 57, в и 62). Хроматиновые фибриллы такого диаметра были видны как на ультратонких срезах после фиксации глутаровым альдегидом, так и на препаратах выделенного хроматина и выделенных хромосом в растворах, содержащих хотя бы низкие концентрации двухвалентных катионов. Показано, что фибрилла хроматина диаметром 30 нм может обратимо менять свой диаметр: становится фибриллой толщиной 10 нм, если препараты хроматина перевести в деионизованную воду или в растворы, содержащие хелатон ЭДТА. В то же время даже частичная экстракция гистона Н1 переводит исходные фибриллы хроматина (30 нм) в нити диаметром 10 нм, имеющие типичный нуклеосомный уровень организации. При добавлении к ним гистона Н1 восстанавливается первоначальный диаметр фибрилл.
Все это говорило о том, что нуклеосомные цепочки хроматина каким-то специфическим образом уложены так‚ что возникает не хаотическая агрегация нуклеосом‚ а правильная нитчатая структура диаметром 30 нм.
Относительно характера упаковки нуклеосом в составе фибриллы хроматина диаметром 30 нм существуют, по крайней мере, две точки зрения. Одна из них защищает так называемый соленоидный тип укладки нуклеосом. Согласно этой модели, нить плотно упакованных нуклеосом диаметром 10 нм образует в свою очередь спиральные витки с шагом спирали около 10 нм. На один виток такой суперспирали приходится шесть нуклеосом (см. рис. 62). В результате такой упаковки возникает фибрилла спирального типа с центральной полостью, которая иногда на негативно окрашенных препаратах бывает видна как узкий «канал» в центре фибриллы. При частичном разворачивании, декомпактизации такой фибриллы и нанесении ее на подложку хорошо видно «зигзагообразное» расположение нуклеосом вдоль фибриллы. Считается, что гистон HI обеспечивает взаимодействие между соседними нуклеосомами, не только сближая и связывая их друг с другом, но и способствуя образованию кооперативной связи между нуклеосомами, благодаря чему возникает довольно плотная спираль из фибриллы диаметром 10 нм. Удаление, даже частичное, гистона HI вызывает переход фибриллы диаметром 30 нм в фибриллу диаметром 10 нм, а при полном удалении его происходит разворачивание последней в структуру типа «бусин на нити». Такой соленоидный тип упаковки ДНК приводит к плотности упаковки, равной приблизительно 40 (т.е. на каждый микрометр нити приходится 40 мкм ДНК). Эти представления получили подтверждение при анализе структуры хроматина с помощью дифракции рентгеновских лучей и нейтронов. Здесь необходимо отметить, что представление о соленоидном типе укладки получено из анализа вторично конденсированного хроматина. Вначале были получены препараты хроматина в присутствии ЭДТА или выделялись в растворах низкой ионной силы в присутствии ионов магния. Во всех этих случаях первоначально хроматин деконденсировался до уровня «бусин на нити», где отсутствует или дестабилизируется контакт между нуклеосомами.
Если же исследовать хроматин в составе ядер или в виде выделенных препаратов, но при поддержании определенной концентрации двухвалентных катионов (не ниже 1мМ), то можно видеть дискретность в составе фибрилл хроматина диаметром 30 нм: она состоит как бы из сближенных глобул того же размера — из нуклеомеров. В зарубежной литературе такие 30-нанометровые глобулы, иди нуклеомеры, получили название сверхбусин («супербиды») (см. рис. 57, в и 62). Обнаружено, что если в условиях, когда нуклеомерная структура фибрилл хроматина сохраняется, препараты хроматина подвергнуть нук-леазной обработке, то часть хроматина растворяется. При этом в раствор выходят частицы, имеющие размер около 30 нм, с коэффициентом седиментации, равным 45S, в растворах, содержащих 1 мМ магния. Если такие выделенные нуклеомеры обработать ЭДТА, удалить ионы магния, то они разворачиваются в нуклеосомные цепочки, содержащие 6—8 нук-леосом. Таким образом, в состав одного нуклеомера входит отрезок ДНК, соответствующий 1600 парам оснований, или 8 нуклеосомам.
Компактность нуклеомера зависит от концентрации ионов магния и наличия гистона HI. Негистоновые белки в конформационных превращениях нуклеомеров не участвуют.
Итак, основная фибрилла хроматина диаметром 30 нм представляет собой линейное чередование нуклеомеров вдоль компактизованной молекулы ДНК (см. рис. 62). Вероятно, гистоны HI, находясь в центральной зоне этой крупной частицы и взаимодействуя друг с другом, поддерживают ее целостность. В пользу этого говорят данные о кооперативном связывании гистонов HI в группе по 6—8 молекул.
Противоречие между соленоидной и нуклеомерной моделями упаковки нуклеосом в составе фибрилл хроматина может быть снято, если принять модель нерегулярного соленоида: число нуклеосом на виток спирали не является строго постоянной величиной, что может привести к чередованию участков с большим или меньшим числом нуклеосом на виток.
Нуклеомерный уровень укладки хроматина обеспечивает 40-кратное уплотнение ДНК, что важно не только для достижения целей ком-пактизации гигантских молекул ДНК. Компактизация ДНК в составе фибрилл хроматина диаметром 30 нм может налагать дополнительные функциональные ограничения. Так, обнаружено, что в составе фибриллы хроматина диаметром 30 нм ДНК становится практически недоступной для взаимодействия с таким ферментом, как метилаза ДНК. Кроме того, резко падает способность хроматина связываться с РНК-полимеразой и рядом регуляторных белков. Таким образом, второй уровень компактизации ДНК может играть роль фактора, инакти-вирующего гены.
В заключение необходимо еще раз напомнить, что как нуклеосомный, так и нуклеомерный (супербидный) уровни компактизации ДНК хроматина осуществляются за счет гистоновых белков, которые участвуют не только в образовании нуклеосом, но и в их кооперативном объединении в виде фибрилл ДНП, где ДНК претерпевает дополнительную сверхспирализацию. Все остальные уровни компактизации связаны с дальнейшим характером укладки фибрилл диаметром 30 нм в новые ком-пактизационные уровни, где ведущую роль играют негистоновые белки.