Молекулярная физика (работа 2)
Молекулярная физика
Опытное обоснование основных положений МКТ:
Молекулярно-кинетическая теория – учение о строении и свойствах вещества, использующее представление о существовании атомов и молекул как наименьших частиц химического вещества. В основе МКТ лежат три строго доказанных с помощью опытов утверждения:
Вещество состоит из частиц – атомов и молекул, между которыми существуют промежутки;
Эти частицы находятся в хаотическом движении, на скорость которого влияет температура;
Частицы взаимодействуют друг с другом.
То, что вещество действительно состоит из молекул, можно доказать, определив их размеры: Капля масла расплывается по поверхности воды, образуя слой, толщина которого равна диаметру молекулы. Капля объемом 1 мм3 не может расплыться больше, чем на 0,6 м2:
> >
>
Существуют также другие способы доказательства существования молекул, но перечислять их нет необходимости: современные приборы (электронный микроскоп, ионный проектор) позволяют видеть отдельные атомы и молекулы.
Силы взаимодействия молекул. а) взаимодействие имеет электромагнитный характер; б) силы короткодействующие, обнаруживаются на расстояниях, сопоставимых с размерами молекул; в) существует такое расстояние, когда силы притяжения и отталкивания равны (R>0>), если R>R>0>, тогда преобладают силы притяжения, если R<R>0> – силы отталкивания.
Действие сил молекулярного притяжения обнаруживается в опыте со свинцовыми цилиндрами, слипающимися после очистки их поверхностей.
Молекулы и атомы в твердом теле совершают беспорядочные колебания относительно положений, в которых силы притяжения и отталкивания со стороны соседних атомов уравновешены. В жидкости молекулы не только колеблются около положения равновесия, но и совершают перескоки из одного положения равновесия в соседнее, эти перескоки молекул являются причиной текучести жидкости, ее способности принимать форму сосуда. В газах обычно расстояния между атомами и молекулами в среднем значительно больше размеров молекул; силы отталкивания на больших расстояниях не действуют, поэтому газы легко сжимаются; практически отсутствуют между молекулами газа и силы притяжения, поэтому газы обладают свойством неограниченно расширяться.
Масса и размер молекул. Постоянная Авогадро:
Любое вещество состоит из частиц, поэтому количество вещества принято считать пропорциональным числу частиц. Единицей количества вещества является моль. Моль равен количеству вещества системы, содержащей столько же частиц, сколько содержится атомов в 0,012 кг углерода.
Отношение числа молекул к количеству вещества называется постоянной Авогадро:
> >
>
Постоянная
Авогадро равна >
 >.
Она показывает, сколько атомов или
молекул содержится в одном моле вещества.
>.
Она показывает, сколько атомов или
молекул содержится в одном моле вещества.
Количество вещества можно найти как отношение числа атомов или молекул вещества к постоянной Авогадро:
> >
>
Молярной массой называется величина, равная отношению массы вещества к количеству вещества:
> >
>
Молярную массу можно выразить через массу молекулы:
> >
>
Для определения массы молекул нужно разделить массу вещества на число молекул в нем:
> >
>
Броуновское движение:
Броуновское движение – тепловое движение взвешенных в газе или жидкости частиц. Английский ботаник Роберт Броун (1773 – 1858) в 1827 году обнаружил беспорядочное движение видимых в микроскоп твердых частиц, находящихся в жидкости. Это явление было названо броуновским движением. Это движение не прекращается; с увеличением температуры его интенсивность растет. Броуновское движение – результат флуктуации давления (заметного отклонения от средней величины).
Причина броуновского движения частицы заключается в том, что удары молекул жидкости о частицу не компенсируют друг друга.
Идеальный газ:
У разреженного газа расстояние между молекулами во много раз превышает их размеры. В этом случае взаимодействие между молекулами пренебрежимо мало и кинетическая энергия молекул много больше потенциальной энергии их взаимодействия.
Для объяснения свойств вещества в газообразном состоянии вместо реального газа используется его физическая модель - идеальный газ. В модели предполагается:
расстояние между молекулами чуть больше их диаметра;
молекулы – упругие шарики;
между молекулами не действуют силы притяжения;
при соударении молекул друг с другом и со стенками сосуда действуют силы отталкивают;
движения молекул подчиняется законам механики.
Основное уравнение МКТ идеального газа:
Основное уравнение МКТ позволяет вычислить давление газа, если известны масса молекулы, среднее значение квадрата скорости и концентрация молекул.
Давление идеального газа заключается в том, что молекулы при столкновениях со стенками сосуда взаимодействуют с ними по законам механики как упругие тела. При столкновении молекулы со стенкой сосуда проекция скорости v>x> вектора скорости на ось OX, перпендикулярную стенке, изменяет свой знак на противоположный, но остается постоянной по модулю. Поэтому в результате столкновений молекулы со стенкой проекция ее импульса на ось OX изменяется от mv>1x>=-mv>x> до mv>2x>=mv>x>. Изменение импульса молекулы при столкновении со стенкой вызывает сила F>1>, действующая на нее со стороны стенки. Изменение импульса молекулы равно импульсу этой силы:
> >
>
Во время столкновения, согласно третьему закону Ньютона, молекула действует на стенку с силой F>2>, равной по модулю силе F>1> и направленной противоположно.
Молекул
много, и каждая передает стенке при
столкновении такой же импульс. За секунду
они передают импульс >
 >,
где z
– число столкновений всех молекул со
стенкой, которое пропорционально
концентрации молекул в газе, скорости
молекул и площади поверхности стенки:
>
>,
где z
– число столкновений всех молекул со
стенкой, которое пропорционально
концентрации молекул в газе, скорости
молекул и площади поверхности стенки:
>
 >.
К стенке движется только половина
молекул, остальные движутся в обратную
сторону: >
>.
К стенке движется только половина
молекул, остальные движутся в обратную
сторону: >
 >.
Тогда полный импульс, переданный стенке
за 1 секунду: >
>.
Тогда полный импульс, переданный стенке
за 1 секунду: >
 >.
Согласно второму закону Ньютона изменение
импульса тела за единицу времени равно
действующей на него силе:
>.
Согласно второму закону Ньютона изменение
импульса тела за единицу времени равно
действующей на него силе:
> >
>
Учитывая,
что не все молекулы имеют одинаковую
скорость, сила, действующая на стенку
будет пропорциональна среднему квадрату
скорости. Так как молекулы движутся во
всех направлениях, средние значения
квадратов проекций скорости равны.
Следовательно, средний квадрат проекции
скорости: >
 >;
>
>;
>
 >.
Тогда давление газа на стенку сосуда
равно:
>.
Тогда давление газа на стенку сосуда
равно:
> >
- основное
уравнение МКТ.
>
- основное
уравнение МКТ.
Обозначив среднее значение кинетической энергии поступательного движения молекул идеального газа:
> >,
получим
>,
получим
> >
>
Температура и ее измерение:
Основное уравнение МКТ для идеального газа устанавливает связь легко измеряемого макроскопического параметра – давления – с такими микроскопическими параметрами газа, как средняя кинетическая энергия и концентрация молекул. Но, измерив только давление, мы не можем узнать ни среднее значение кинетической энергии молекул в отдельности, ни их концентрацию. Следовательно, для нахождения микроскопических параметров газа нужны измерения еще какой-то физической величины, связанной со средней кинетической энергией молекул. Такой величиной является температура.
Любое макроскопическое тело или группа макроскопических тел при неизменных внешних условиях самопроизвольно переходит в состояние теплового равновесия. Тепловое равновесие – это такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными.
Температура характеризует состояние теплового равновесия системы тел: все тела системы, находящиеся друг с другом в тепловом равновесии, имеют одну и ту же температуру.
Для измерения температуры можно воспользоваться изменением любой макроскопической величины в зависимости от температуры: объема, давления, электрического сопротивления и т.д.
Чаще всего на практике используют зависимость объема жидкости (ртути или спирта) от температуры. При градуировке термометра обычно за начало отсчета (0) принимают температуру тающего льда; второй постоянной точкой (100) считают температуру кипения воды при нормальном атмосферном давлении (шкала Цельсия). Так как различные жидкости расширяются при нагревании неодинаково, то установленная таким образом шкала будет до некоторой степени зависеть от свойств данной жидкости. Конечно, 0 и 100°С будут совпадать у всех термометров, но 50°С совпадать не будут.
В отличие от жидкостей все разреженные газы расширяются при нагревании одинаково и одинаково меняют свое давление при изменении температуры. Поэтому в физике для установления рациональной температурной шкалы используют изменение давления определенного количества разреженного газа при постоянном объеме или изменение объема газа при постоянном давлении. Такую шкалу иногда называют идеальной газовой шкалой температур.
При тепловом
равновесии средняя кинетическая энергия
поступательного движения молекул всех
газов одинакова. Давление прямо
пропорционально средней кинетической
энергии поступательного движения
молекул: >
 >.
При тепловом равновесии, если давление
газа данной массы и его объем фиксированы,
средняя кинетическая энергия молекул
газа должна иметь строго определенное
значение, как и температура. Т.к. >
>.
При тепловом равновесии, если давление
газа данной массы и его объем фиксированы,
средняя кинетическая энергия молекул
газа должна иметь строго определенное
значение, как и температура. Т.к. >
 >,
то >
>,
то >
 >,
или >
>,
или >
 >.
>.
Обозначим
>
 >.
Величина >
>.
Величина >
 >
растет с повышением температуры и ни
от чего, кроме температуры не зависит.
Следовательно, ее можно считать
естественной мерой температуры.
>
растет с повышением температуры и ни
от чего, кроме температуры не зависит.
Следовательно, ее можно считать
естественной мерой температуры.
Абсолютная температурная шкала:
Будем считать
величину >
 >,
измеряемую в энергетических единицах,
прямо пропорциональной температуре >
>,
измеряемую в энергетических единицах,
прямо пропорциональной температуре >
 >,
выражаемой в градусах: >
>,
выражаемой в градусах: >
 >,
где >
>,
где >
 > -
коэффициент пропорциональности.
Коэффициент >
> -
коэффициент пропорциональности.
Коэффициент >
 >,
в честь австрийского физика Л. Больцмана
называется постоянной
Больцмана.
>,
в честь австрийского физика Л. Больцмана
называется постоянной
Больцмана.
Следовательно,
>
 >.
Температура, определяемая этой формулой,
не может быть отрицательной. Следовательно,
наименьшим возможным значением
температуры является 0, если давление
или объем равны нулю.
>.
Температура, определяемая этой формулой,
не может быть отрицательной. Следовательно,
наименьшим возможным значением
температуры является 0, если давление
или объем равны нулю.
Предельную температуру, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю при неизменном давлении, называют абсолютным нулем температуры.
Английский ученый У. Кельвин ввел абсолютную шкалу температур. Нулевая температура по шкале Кельвина соответствует абсолютному нулю, а каждая единица температуры по этой шкале равна градусу по шкале Цельсия. Единица абсолютной температуры в СИ называется Кельвином.
> >.
Следовательно, абсолютная
температура есть мера средней кинетической
энергии движения молекул.
>.
Следовательно, абсолютная
температура есть мера средней кинетической
энергии движения молекул.
> > >
> >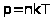 >
>
Скорость молекул газа:
Зная абсолютную температуру, можно найти среднюю кинетическую энергию молекул газа, а , следовательно, и средний квадрат их скорости.
> >
>
Квадратный
корень из этой величины называется
средней
квадратичной скоростью:
>
 >
>
Опыты по определению скоростей молекул доказали справедливость этой формулы. Одни из опытов был предложен О. Штерном в 1920 году.
Уравнение состояния идеального газа (уравнение Менделеева – Клапейрона). Универсальная газовая постоянная:
На основе зависимости давления газа от концентрации его молекул и температуры можно получить уравнение, связывающее все три макроскопических параметра: давление, объем и температуру - характеризующие состояние данной массы достаточно разреженного газа. Это уравнение называют уравнением состояния идеального газа.
> >
>
> >,
где >
>,
где >
 >-
универсальная газовая постоянная
>-
универсальная газовая постоянная
> >
>
> >
для данной
массы газа, следовательно
>
для данной
массы газа, следовательно
> >
- уравнение
Клапейрона.
>
- уравнение
Клапейрона.
Изотермический, изохорный и изобарный процессы:
Количественные зависимости между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами. А процессы, протекающие при неизменном значении одного из параметров, - изопроцессами.
Изотермический процесс – процесс изменения состояния термодинамической системы макроскопических тел при постоянной температуре.
> >
при >
>
при >
 >
>
Для газа данной массы произведение давления газа на его объем постоянно, если температура газа не меняется. – закон Бойля - Мариотта.
Изохорный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном объеме.
> >
при >
>
при >
 >
>
Для газа данной массы отношение давления к температуре постоянно, если объем газа не меняется. – закон Шарля.
Изобарный процесс - процесс изменения состояния термодинамической системы макроскопических тел при постоянном давлении.
> >
при >
>
при >
 >
>
Для газа данной массы отношение объема к температуре постоянно, если давление газа не меняется. – закон Гей-Люссака.
Внутренняя энергия:
Внутренняя энергия макроскопического тела равна сумме кинетических энергий беспорядочного движения всех молекул (или атомов) относительно центров масс тела и потенциальных энергий взаимодействия всех молекул друг с другом (но не с молекулами других тел).
При любых
процессах в изолированной термодинамической
системе внутренняя энергия остается
неизменной. >
 >
>
Внутренняя энергия идеального газа.
Для вычисления
внутренней энергии идеального одноатомного
газа массой >
 >
нужно умножить среднюю кинетическую
энергию одного атома >
>
нужно умножить среднюю кинетическую
энергию одного атома >
 >
на число атомов >
>
на число атомов >
 >.
Учитывая, что >
>.
Учитывая, что >
 >,
получим значение внутренней энергии
идеального газа:
>,
получим значение внутренней энергии
идеального газа:
> >
>
Если идеальный газ состоит из более сложных молекул, чем одноатомный, то его внутренняя энергия равна сумме поступательного и вращательного движения молекул.
Для двухатомного
газа: >
 >
>
Для многоатомного
газа:> >
>
У реальных газов, жидкостей и твердых тел средняя потенциальная энергия взаимодействия молекул не равна нулю. Для газов она много меньше средней кинетической энергии молекул, но для твердых тел и жидкостей она сравнима с ней. Средняя потенциальная энергия взаимодействия молекул зависит от объема вещества, так как при изменении объема меняется среднее расстояние между молекулами. Следовательно, внутренняя энергия в термодинамике в общем случае наряду с температурой зависит и от объема.
Количество теплоты:
Процесс передачи энергии от одного тела к другому без совершения работы называется теплообменом или теплопередачей. Теплообмен происходит между телами, имеющими разную температуру. При установлении контакта между телами с различными температурами происходит передача части внутренней энергии от тела с более высокой температурой к телу, у которого температура ниже. Энергия, переданная телу в результате теплообмена, называется количеством теплоты.
Удельная теплоемкость вещества:
Если процесс
теплопередачи не сопровождается работой,
то на основании первого закона
термодинамики количество теплоты равно
изменению внутренней энергии тела: >
 >.
>.
Средняя энергия беспорядочного поступательного движения молекул пропорциональна абсолютной температуре. Изменение внутренней энергии тела равно алгебраической сумме изменений энергии всех атомов или молекул, число которых пропорционально массе тела, поэтому изменение внутренней энергии и, следовательно, количество теплоты пропорционально массе и изменению температуры:
> >
>
>
>
 >
>
Коэффициент пропорциональности в этом уравнении называется удельной теплоемкостью вещества. Удельная теплоемкость показывает, какое количество теплоты необходимо для нагревания 1 кг вещества на 1 К.
Работа в термодинамике:
В механике работа определяется как произведение модулей силы и перемещения и косинуса угла между ними. Работа совершается при действии силы на движущееся тело и равна изменению его кинетической энергии.
В термодинамике движение тела как целого не рассматривается, речь идет о перемещении частей макроскопического тела относительно друг друга. В результате меняется объем тела, а его скорость остается равной нулю. Работа в термодинамике определяется так же, как и в механике, но равна изменению не кинетической энергии тела, а его внутренней энергии.
При совершении работы (сжатии или расширении) изменяется внутренняя энергия газа. Причина этого состоит в следующем: при упругих соударениях молекул газа с движущимся поршнем изменяется их кинетическая энергия.
Вычислим
работу газа при расширении. Газ действует
на поршень с силой >
 >,
где >
>,
где >
 >
- давление газа, а >
>
- давление газа, а >
 >
- площадь поверхности >
>
- площадь поверхности >
 >поршня.
При расширении газа поршень смещается
в направлении силы >
>поршня.
При расширении газа поршень смещается
в направлении силы >
 >
на малое расстояние >
>
на малое расстояние >
 >.
Если расстояние мало, то давление газа
можно считать постоянным. Работа газа
равна:
>.
Если расстояние мало, то давление газа
можно считать постоянным. Работа газа
равна:
> >,
где >
>,
где >
 >
- изменение объема газа.
>
- изменение объема газа.
В процессе расширения газа совершает положительную работу, так как направление силы и перемещения совпадают. В процессе расширения газ отдает энергию окружающим телам.
Работа,
совершаемая внешними телами над газом,
отличается от работы газа только знаком
>
 >,
так как сила >
>,
так как сила >
 >,
действующая на газ, противоположна силе
>
>,
действующая на газ, противоположна силе
>
 >,
с которой газ действует на поршень, и
равна ей по модулю (третий закон Ньютона);
а перемещение остается тем же самым.
Поэтому работа внешних сил равна:
>,
с которой газ действует на поршень, и
равна ей по модулю (третий закон Ньютона);
а перемещение остается тем же самым.
Поэтому работа внешних сил равна:
> >.
>.
Первый закон термодинамики:
Первый закон термодинамики является законом сохранения энергии, распространенным на тепловые явления. Закон сохранения энергии: энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно, она только переходит из одной формы в другую.
В термодинамике рассматриваются тела, положение центра тяжести которых практически не меняется. Механическая энергия таких тел остается постоянной, а изменяться может лишь внутренняя энергия.
Внутренняя энергия может изменяться двумя способами: теплопередачей и совершением работы. В общем случае внутренняя энергия изменяется как за счет теплопередачи, так и за счет совершения работы. Первый закон термодинамики формулируется именно для таких общих случаев:
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе:
> >
>
Если система изолирована, то над ней не совершается работа и она не обменивается теплотой с окружающими телами. Согласно первому закону термодинамики внутренняя энергия изолированной системы остается неизменной.
Учитывая,
что >
 >,
первый закон термодинамики можно
записать так:
>,
первый закон термодинамики можно
записать так:
> >
>
Количество теплоты, переданное системе, идет на изменение ее внутренней энергии и на совершение системой работы над внешними телами.
Второй закон термодинамики: невозможно перевести теплоту от более холодной системы к более горячей при отсутствии других одновременных изменений в обеих системах или в окружающих телах.
Применение первого закона термодинамики к изопроцессам:
При изохорном процессе объем газа не меняется и поэтому работа газа равна нулю. Изменение внутренней энергии равно количеству переданной теплоты:
> >
>
При изотермическом процессе внутренняя энергия идеального газа не меняется. Все переданное газу количество теплоты идет на совершение работы:
> >
>
При изобарном процессе передаваемое газу количество теплоты идет на изменение его внутренней энергии и на совершение работы при постоянном давлении.
Адиабатный процесс:
Адиабатный процесс – процесс в теплоизолированной системе. Следовательно, изменение внутренней энергии при адиабатном процессе происходит только за счет совершении работы:
> >
>
Так как работа внешних сил при сжатии положительна, внутренняя энергия газа при адиабатном сжатии увеличивается, а его температура повышается.
При адиабатном расширении газ совершает работу за счет уменьшения своей внутренней энергии, поэтому температура газа при адиабатном расширении понижается.
Принцип действия тепловых двигателей:
Тепловым двигателем называется двигатель, который производит механическую работу за счет энергии, выделившейся при сгорании топлива. Некоторые виды тепловых двигателей:
паровая машина;
паровая турбина;
двигатель внутреннего сгорания;
реактивный двигатель.
Физические основы работы всех тепловых двигателей одинаковы. Тепловой двигатель состоит из трех основных частей: нагревателя, рабочего тела, холодильника.
Процесс
работы теплового двигателя: Рабочее
тело приводят в контакт с нагревателем
(> >
- высокая), поэтому рабочее тело получает
от нагревателя >
>
- высокая), поэтому рабочее тело получает
от нагревателя >
 >.
За счет этого количества теплоты рабочее
тело совершает механическую работу.
Затем рабочее тело приводят в контакт
с холодильником (>
>.
За счет этого количества теплоты рабочее
тело совершает механическую работу.
Затем рабочее тело приводят в контакт
с холодильником (> >
- низкая), поэтому рабочее тело отдает
тепло холодильнику. Таким образом
возвращается в исходное состояние.
Теперь рабочее тело приводят в контакт
с нагревателем и все происходит сначала.
Следовательно, тепловая машина –
периодического действия, то есть в этой
машине тело совершает замкнутый процесс
– цикл. За каждый цикл рабочее тело
совершает работу >
>
- низкая), поэтому рабочее тело отдает
тепло холодильнику. Таким образом
возвращается в исходное состояние.
Теперь рабочее тело приводят в контакт
с нагревателем и все происходит сначала.
Следовательно, тепловая машина –
периодического действия, то есть в этой
машине тело совершает замкнутый процесс
– цикл. За каждый цикл рабочее тело
совершает работу >
 >.
>.
>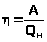 >
или >
>
или >
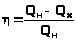 >
>
КПД принято
выражать в процентах: >
 >
>
КПД теплового двигателя и его максимальное значение:
В начале XIX века французский инженер Сади Карно исследовал пути повышения КПД тепловых двигателей. Он придумал цикл, который должен совершать идеальный газ в некоторой тепловой машине, такой, что при этом получается максимально возможный КПД. Цикл Карно состоит из двух изотерм и двух адиабат.
Идеальный
газ приводят в контакт с нагревателем
и предоставляют ему возможность
расширяться изотермически, то есть при
температуре нагревателя. Когда
расширившийся газ перейдет в состояние
2, его теплоизолируют от нагревателя и
дают ему возможность расширяться
адиабатически, то есть газ совершает
работу за счет убыли его внутренней
энергии. Расширяясь адиабатически газ
охлаждается до тех пор, пока его
температура не будет равна температуре
холодильника (состояние 3). Теперь газ
приводят в контакт с холодильником
сжимают изотермически. Газ отдает
холодильнику >
 >.
Газ переходит в состояние 4. Затем газ
теплоизолируют от холодильника и сжимают
адиабатически. При этом температура
газа увеличивается и достигает температуры
нагревателя. Процесс повторяется
сначала.
>.
Газ переходит в состояние 4. Затем газ
теплоизолируют от холодильника и сжимают
адиабатически. При этом температура
газа увеличивается и достигает температуры
нагревателя. Процесс повторяется
сначала.
> >(*)
- формула для расчета КПД идеальной
тепловой машины, работающей по циклу
Карно с идеальным газом.
>(*)
- формула для расчета КПД идеальной
тепловой машины, работающей по циклу
Карно с идеальным газом.
Карно показал, что КПД любой другой тепловой машины (то есть с другим рабочим телом или работающей по другому циклу) будет меньше, чем КПД цикла Карно. На практике не используют машины, работающие по циклу Карно, но формула (*) позволяет определить максимальный КПД при заданных температурах нагревателя и холодильника.
> >
>
Очевидно, что для увеличения КПД нужно понижать температуру холодильника и повышать температуру нагревателя. Понижать температуру холодильника искусственно невыгодно, так как это требует дополнительных затрат энергии. Повышать температуру нагревателя можно тоже до определенного предела, так как различные материалы обладают различной жаропрочностью при высоких температурах. Однако формула Карно показала, что существуют неиспользованные резервы повышения КПД, так как практический КПД очень сильно отличается от КПД цикла Карно.
Тепловые двигатели и охрана природы:
Испарение и конденсация, насыщенные и ненасыщенные пары:
Неравномерное распределение кинетической энергии теплового движения молекул приводит к тому, что при любой температуре кинетическая энергия некоторых молекул жидкости или твердого тела может превышать потенциальную энергию их связи с остальными молекулами. Испарение – процесс, при котором с поверхности жидкости или твердого тела вылетают молекулы, кинетическая энергия которых превышает потенциальную энергию взаимодействия молекул. Испарение сопровождается охлаждением жидкости, так как жидкость покидают молекулы, имеющие большую кинетическую энергию, и внутренняя энергия жидкости понижается. Вылетевшие молекулы начинают беспорядочно двигаться в тепловом движении газа; они могут или навсегда удалиться от поверхности жидкости, или снова вернуться в жидкость. Такой процесс называется конденсацией.
Испарение жидкости в закрытом сосуде при неизменной температуре приводит к постепенному увеличению концентрации молекул испаряющегося вещества в газообразном состоянии. Через некоторое время после начала процесса испарения концентрация вещества в газообразном состоянии достигает такого значения, при котором число молекул, возвращающихся в жидкость в единицу времени, становится равным числу молекул, покидающих поверхность жидкости за то же время. Устанавливается динамическое равновесие между процессами испарения и конденсации вещества.
Вещество в газообразном состоянии, находящееся в динамическом равновесии с жидкостью, называется насыщенным паром. Пар, находящийся при давлении ниже давления насыщенного пара называется ненасыщенным.
При сжатии
насыщенного пара концентрация молекул
пара увеличивается, равновесие между
процессами испарения и конденсации
нарушается и часть пара превращается
в жидкость. При расширении насыщенного
пара концентрация его молекул уменьшается
и часть жидкости превращается в пар.
Таким образом, концентрация насыщенного
пара остается постоянной независимо
от объема. Так как давление газа
пропорционально концентрации и
температуре (> >),
давление насыщенного пара при постоянной
температуре не зависит от объема.
>),
давление насыщенного пара при постоянной
температуре не зависит от объема.
Интенсивность процесса испарения увеличивается с возрастанием температуры жидкости. Поэтому динамическое равновесие между испарением и конденсацией при повышении температуры устанавливается при больших концентрациях молекул газа.
Давление идеального газа при постоянной концентрации молекул возрастает прямо пропорционально абсолютной температуре. Так как в насыщенном паре при возрастании температуры концентрация молекул увеличивается, давление насыщенного пара с повышением температуры возрастает быстрее, чем давление идеального газа с постоянной концентрацией молекул. То есть давление насыщенного пара растет не только вследствие повышения температуры жидкости, но и вследствие увеличения концентрации молекул пара.
Главное различие в поведении идеального газа и насыщенного пара состоит в том, что при изменении температуры пара в закрытом сосуде (или при изменении объема при постоянной температуре) меняется масса пара.
Зависимость температуры кипения жидкости от давления:
При увеличении температуры интенсивность испарения жидкости увеличивается, и при некоторой температуре жидкость начинает кипеть. При кипении по всему объему жидкости образуются быстро растущие пузырьки пара, которые всплывают на поверхность. Температура кипения жидкости остается постоянной.
В жидкости всегда присутствуют растворенные газы, которые выделяются на дне и стенках сосуда. Пары жидкости, находящиеся внутри пузырьков, являются насыщенными. С увеличением температуры давление насыщенных паров возрастает и пузырьки увеличиваются в размерах. Под действием выталкивающей силы они всплывают на поверхность.
Зависимость давления насыщенного пара от температуры объясняет, почему температура кипения жидкости зависит от давления на ее поверхность. Пузырек пара может расти, когда давление насыщенного пара внутри его немного превосходит давление в жидкости, которое складывается из давления воздуха на поверхность жидкости (внешнее давление) и гидростатического давления столба жидкости.
Кипение начинается при температуре, при которой давление насыщенного пара в пузырьках сравнивается с давлением в жидкости. Чем больше внешнее давление, тем выше температура кипения.
У каждой жидкости своя температура кипения, которая зависит от давления насыщенного пара. чем выше давление насыщенного пара, тем ниже температура кипения соответствующей жидкости, так как при меньших температурах давление насыщенного пара становится равным атмосферному.
При увеличении температуры жидкости увеличивается давление насыщенного пара и одновременно растет его плотность. Плотность жидкости, находящейся в равновесии со своим паром, наоборот, уменьшается вследствие расширения жидкости при нагревании.
Если на одном рисунке начертить кривые зависимости плотности жидкости и плотности ее насыщенного пара от температуры, то для жидкости кривая пойдет вниз, а для пара – вверх.
При некоторой температуре обе кривые сливаются, то есть плотность жидкости становится равной плотности пара.
Критическая температура – температура, при которой исчезают различия в физических свойствах между жидкостью и ее насыщенным паром.
При температурах, больших критической, вещество не превращается в жидкость ни при каких давлениях.
Влажность воздуха:
Атмосферный воздух представляет собой смесь различных газов и водяного пара. Каждый из газов вносит свой вклад в суммарное давление, производимое воздухом на находящиеся в нем тела.
Давление, которое производил бы водяной пар, если бы все остальные газы отсутствовали, называют парциальным давлением водяного пара.
_Относительной
влажностью воздуха >
 >
называют отношение парциального давления
>
>
называют отношение парциального давления
>
 >
водяного пара, содержащегося в воздухе
при данной температуре, к давлению >
>
водяного пара, содержащегося в воздухе
при данной температуре, к давлению >
 >
насыщенного пара при той же температуре,
выраженное в процентах:
>
насыщенного пара при той же температуре,
выраженное в процентах:
> >
>
Так как
давление насыщенного пара тем меньше,
чем меньше температура, то при охлаждении
воздуха находящийся в нем водяной пар
при некоторой температуре становится
насыщенным. Температура >
 >,
при которой находящийся в воздухе
водяной пар становится насыщенным,
называется точкой
росы.
>,
при которой находящийся в воздухе
водяной пар становится насыщенным,
называется точкой
росы.
По точке росы можно найти давление водяного пара в воздухе. Она равно давлению насыщенного пара при температуре, равной точке росы. По значениям давления пара в воздухе и давления насыщенного пара при данной температуре можно определить относительную влажность воздуха.
Кристаллические и аморфные тела:
Аморфными называются тела, физические свойства которых одинаковы по всем направлениям. Аморфные тела являются изотропными – у них нет строгого порядка в расположении атомов. Примерами аморфных тел могут служить куски затвердевшей смолы, янтарь, стекло.
Твердые тела, в которых атомы или молекулы расположены упорядоченно и образуют периодически повторяющуюся внутреннюю структуру, называют кристаллами. Физические свойства кристаллических тел неодинаковы в различных направлениях, но совпадают в параллельных направлениях. Это свойство кристаллов называется анизотропностью.
Анизотропия механических, тепловых, электрических и оптических свойств кристаллов объясняется тем, что при упорядоченном расположении атомов, молекул или ионов силы взаимодействия между ними и межатомные расстояния оказываются неодинаковыми по различным направлениям.
Кристаллические тела делятся на монокристаллы и поликристаллы. Монокристаллы иногда обладают геометрически правильной формой, но главный признак монокристалла – периодически повторяющаяся внутренняя структура во всем его объеме. Поликристаллическое тело представляет собой совокупность сросшихся друг с другом хаотически ориентированных маленьких кристаллов – кристаллитов. Каждый маленький монокристалл поликристаллического тела анизотропен, но поликристаллическое тело изотропно.
Механические свойства твердых тел:
Рассмотрим механические свойства твердого тела на примере деформации растяжения. В любом сечении деформированного тела действуют силы упругости, препятствующие разрыву этого тела на части. Механическим напряжением называют отношение модуля силы упругости к площади поперечного сечения тела:
> >
>
При малых
деформациях напряжение >
 >
прямо пропорционально относительному
удлинению >
>
прямо пропорционально относительному
удлинению >
 >
(участок ОА). Эта зависимость называется
законом Гука:
>
(участок ОА). Эта зависимость называется
законом Гука:
> >,
где >
>,
где >
 >
- модуль Юнга.
>
- модуль Юнга.
> >
>
Обозначим
>
 >,
тогда >
>,
тогда >
 >
>
Закон Гука
выполняется только при небольших
деформациях, а следовательно, при
напряжениях, не превосходящих некоторого
предела. Максимальное напряжение >
 >,
при котором еще выполняется закон Гука
называют пределом
пропорциональности.
>,
при котором еще выполняется закон Гука
называют пределом
пропорциональности.
Если увеличивать
нагрузку, то деформация становится
нелинейной, напряжение перестает быть
прямо пропорционально относительному
удлинению. Тем не менее при небольших
нелинейных деформациях после снятия
нагрузки форма и размеры тела практически
восстанавливаются (участок АВ).
Максимальное напряжение, при котором
еще не возникают заметные остаточные
деформации (относительная остаточная
деформация не превышает 0,1%), называют
пределом
упругости >
 >.
>.
Если внешняя нагрузка такова, что напряжение в материале превышает предел упругости, то после снятия нагрузки тело остается деформированным. При некотором значении напряжения, соответствующем на диаграмме точке С, удлинение нарастает практически без увеличения нагрузки. Это явление называется текучестью материала (участок CD).
Далее с
увеличением деформации кривая напряжений
начинает немного возрастать и достигает
максимума в точке Е. Затем напряжение
резко спадает и тело разрушается. Разрыв
происходит после того, как напряжение
достигает максимального значения >
 >,
называемого пределом
прочности.
>,
называемого пределом
прочности.
Упругие деформации:
При упругих деформациях размеры и форма тела восстанавливаются при снятии нагрузки.