Биосенсоры: основы и приложения
Министерство образования Российской Федерации
Пензенский Государственный Педагогический университет им.В.Г. Белинского
КУРСОВАЯ РАБОТА НА ТЕМУ
Биосенсоры: основы и приложения
Проверил
к. б. н. Соловьев В.Б.
Выполнила
Махнова Е.В.
Содержание
ВВЕДЕНИЕ 4
1. ОСНОВНАЯ ЧАСТЬ 6
1.1 Сенсоры на основе микроорганизмов 6
1.2 Сенсор для определения усваиваемых сахаров 6
1.3 Глюкозный сенсор 7
1.4 Сенсор уксусной кислоты 9
1.5 Сенсор спиртов 10
1.6 Цефалоспориновый сенсор 11
1.7 Сенсор БПК 13
2. Основные биосенсоры на основе растительных и животных тканей 15
2.1 Биосенсор АМР 16
2.2 Биосенсор мочевины 18
2.3 Цистейповый биосенсор 19
2.4 Митохондриальные биосенсоры 20
2.5 Амперометрические биосенсоры 22
3. Возможное использование биосенсоров, применение биосенсоров в клинической медицине 25
3.1 Газы крови 26
3.2 Мониторинг калия 27
3.3 Глюкоза 29
ЗАКЛЮЧЕНИЕ 34
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ 35
ВВЕДЕНИЕ
Биосенсор - это устройство, включающее биологический чувствительный элемент, тесно связанный с преобразователем либо интегрированный с ним. Обычно биосенсор предназначен для формирования цифрового электрического сигнала, пропорционального концентрации определенного химического соединения или ряда соединений. Современная концепция биосенсора в значительной степени связана с идеями Лиланда Кларка-младшего и соавторов, развитыми в 1962г. Авторы предположили, что если бы ферменты можно было иммобилизовать на электрохимических датчиках, то такие "ферментные электроды" расширили бы диапазон аналитических возможностей базового датчика. Последовавшая затем грандиозная работа с бесконечными вариациями этой темы постепенно раздвинула горизонты этой области. Ее нынешнее состояние в какой-то степени характеризуют перечисленные ниже потенциальные чувствительные элементы и преобразователи, которые можно использовать при конструировании биосенсоров: биологические компоненты (целые организмы, ткани, клетки, органеллы, ферменты и тд), преобразователи (потенциометрические, амперометрические, кондуктометрические, оптические, калориметрические, механические, акустические, химические).
Развитие биосенсоров обусловлено усилием исследователей в нескольких направлений. Весьма перспективно е направление исследований - создание новых материалов для конструирования преобразователей или более эффективной связи между компонентами сенсора. Движущей силой в исследовании сенсоров было ярко выраженное инстинктивное понимание возможности их широких практических приложений. Эти исследования стимулировались прежде всего потребностями медицины. Возможность немедленного анализа клинических препаратов, очевидно, одинаково привлекает и врачей, и пациентов, хотя некоторые национальные службы здравоохранения испытывают трудности с внедрением этой философии. Более привлекательной является возможность непрерывного in vivo мониторинга метаболитов, лекарственных препаратов и белков с помощью миниатюрных и портативных систем. Отличным примером клинического приложения является сенсор глюкозы для больных диабетом, ставший классическим объектом исследований в области биосенсоров.
В последние годы возрастает интерес к другим возможным использованиям биосенсоров. Клинические исследования повернулись в сторону ветеринарии и животноводства. Все больше внимания придается качеству продуктов в пищевой промышленности. В этой области давно признано значение быстрых методов оценки сроков хранения, порчи и загрязнения продуктов. Развитие биотехнологии стимулирует разработку методов мониторинга процессов ферментации, что также расширяет возможности непрерывного контроля этих процессов. Проблемы охраны окружающей и промышленной среды стимулировали разработку сенсоров для определения таких вредных веществ, как оксид углерода и гербициды. В то же время интересы военных неизменно сосредоточены на специальных требованиях биологической и химической защиты.
1. ОСНОВНАЯ ЧАСТЬ
1.1 Сенсоры на основе микроорганизмов
В последние годы разработано множество биосенсоров для определения органических соединений. Многие ферментные сенсоры обладают высокой специфичностью по отношению к представляющим интерес субстратам, однако используемые в них ферменты дороги и неустойчивы. Микробные сенсоры состоят из иммобилизированных микроорганизмов и какого-либо электрохимического датчика и пригодны для непрерывного контроля биохимических процессов. Принцип работы микробных сенсоров - это ассимиляция органических соединений микроорганизмами, что регистрируется электрохимическими датчиками.
1.2 Сенсор для определения усваиваемых сахаров
При культивации микроорганизмов на патоке сахарного тростника, содержащей различные сахара, для контроля процесса брожения важно определение суммарного содержания усваиваемых Сахаров в среде. Так, при высокой концентрации сахара наблюдается подавление катаболизма, что приводит к подавлению роста клеток. Восстановленные сахара и сахарозу в культуральных средах можно определять феррицианидным методом. Этот метод, однако, не вполне надежен, поскольку неусваиваемые сахара могут мешать определению.
Усвоение органических соединений микроорганизмами можно оценивать по дыхательной активности последних, которую в свою очередь можно непосредственно измерить при помощи кислородного электрода.
Для непрерывного определения общего содержания усваиваемых Сахаров (глюкозы, фруктозы и сахарозы) в бродильной среде сконструирован микробный сенсор, состоящий из иммобилизованных живых клеток. Общее содержание усваиваемых Сахаров оценивали по потреблению кислорода иммобилизованными микроорганизмами. Добавление аликвотной части глюкозы приводило к увеличению поглощения кислорода в растворе. В результате электродный ток постепенно понижался, пока не достигал некоторого стационарного значения. Время отклика сенсора составляло 10 мин при измерении стационарного тока и 1 мин в импульсном режиме. Существует линейная зависимость между уменьшением тока и концентрацией глюкозы (до 1 мМ), фруктозы (до 1 мМ) и сахарозы (до 0,8 мМ) соответственно. Чувствительность микробного сенсора к этим сахарам оценивается соотношением 1,00: 0,80: 0,92. При использовании растворов, содержащих 0,8 мМ глюкозы, относительное стандартное отклонение для величины уменьшения тока составляло 2%. Общее содержание усваиваемых Сахаров рассчитывали, суммируя значения аналитических сигналов для откликов на глюкозу, фруктозу и сахарозу, при этом разность истинных и расчетных концентраций не превышала 8%. Микробный сенсор помещали в бродильную среду для получения глутаминовой кислоты, где он надежно работал более 10 дней и выдержал 960 измерений.
1.3 Глюкозный сенсор
Для определения глюкозы предложен микробный сенсор, состоящий из иммобилизованных целых клеток Pseudomonas fluorescens и кислородного электрода. Сенсор помещали в исследуемый раствор, который во время измерений насыщали кислородом и перемешивали магнитной мешалкой.
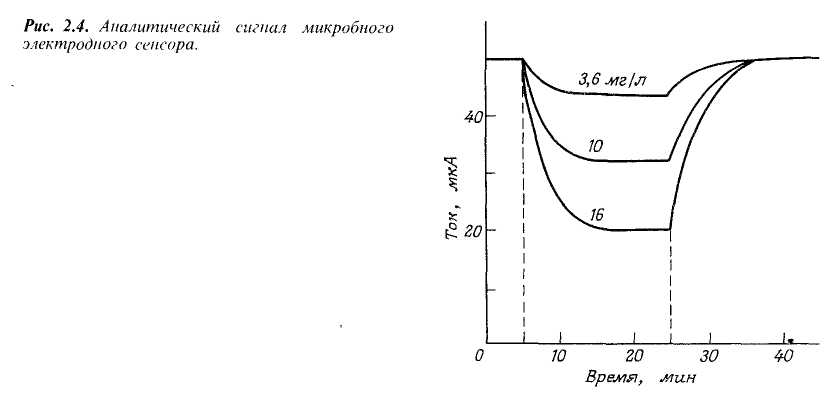
На рис.2.4 показана типичная зависимость сигнала сенсора от времени. При 30"С стационарный ток устанавливался в пределах 10 мин. Точное время отклика зависело от концентрации добавленной глюкозы. При удалении микробного сенсора из раствора и помещении в среду, не содержащую глюкозы, ток постепенно возрастал и возвращался к начальному уровню примерно за 15 мин при 30°С.
Сенсор проявляет слабую чувствительность к фруктозе, галактозе, манозе, сахарозе и не чувствителен к аминокислотам. Поэтому избирательность определения глюкозы при помощи этого микробного сенсора можно считать вполне удовлетворительной. При измерениях стационарного тока зависимость между током и концентрацией глюкозы линейна до концентрации 20 мг/л, причем нижняя граница определяемых концентраций глюкозы составляла 2 мг/л. При содержании глюкозы 10 мг/л значение тока воспроизводилось с точностью +6%. Стандартное отклонение составило 6,5 мг/л при числе опытов более 20.
Микробный глюкозный сенсор позволяет определять концентрацию глюкозы в патоке со средней относительной погрешностью ±10%. Для сравнения глюкозу определяли также ферментным методом; результаты коррелируют с полученными электрохимическим методом.
1.4 Сенсор уксусной кислоты
При выращивании микроорганизмов на уксусной кислоте как источнике углерода избыток кислоты подавляет их рост и, следовательно, ее оптимальную концентрацию следует поддерживать с помощью непрерывного контроля в режиме "на линии".
Пористую мембрану с иммобилизованными дрожжами закрепляли на поверхности тефлоновой мембраны кислородного электрода и покрывали другой газопроницаемой тефлоновой мембраной. Таким образом, микроорганизмы помещались между двумя пористыми мембранами. Микробная сенсорная система состояла из проточной ячейки с водяной рубашкой, магнитной мешалки, перистальтического насоса, автоматического дозатора и самописца, регистрирующего ток.
Принцип работы этого сенсора аналогичен описанному выше. Поскольку ацетат-ионы не могут проходить через мембрану, рН пробы поддерживали существенно ниже рК уксусной кислоты (4,75 при 30°С). Что касается избирательности микробного сенсора по отношению к уксусной кислоте, то следует отметить, что он не чувствителен к таким летучим соединениям, как муравьиная кислота и метанол, или нелетучим компонентам питательной среды, таким, как глюкоза или фосфат-ионы. Tiichosporon brassicae могут потреблять пропионовую, н-бутановую кислоты и этанол, однако при ферментации эти вещества обычно отсутствуют либо их концентрация слишком мала, чтобы мешать определению уксусной кислоты.
Для сравнения концентрацию уксусной кислоты в бродильной среде для производства глутаминовой кислоты определяли описанным микробным сенсором и методом газовой хроматографии. Наблюдается хорошее согласие результатов, полученных двумя методами: коэффициент корреляции равен 1,04 для 26 опытов. Выходной сигнал сенсора (0,29-0,25 мкА) был постоянен (с точностью до +10% от исходного значения) более трех недель, при этом было выполнено 1500 измерений. Теперь этот микробный сенсор выпускается в Японии серийно.
1.5 Сенсор спиртов
В бродильных производствах необходимо непрерывно определять концентрации метанола и этанола в культуральных средах. При использовании спиртов в качестве источника углерода для культивируемых микроорганизмов концентрация спиртов должна поддерживаться на оптимальном уровне, чтобы избежать ингибирования субстратом. Как известно, спирты утилизируются многими микроорганизмами, следовательно, такие микроорганизмы можно использовать для конструирования спиртового сенсора [5].
Этанольный сенсор включает иммобилизованные Trichosporon brassicae и кислородный электрод. Способ иммобилизации клеток и конструкция электрода такие же, как в глюкозном сенсоре.
Для измерений этим сенсором в стационарных условиях требуется много времени, поэтому был использован импульсный метод, обеспечивающий отклик в течение всего 6 мин. Линейная зависимость между уменьшением тока и концентрацией этанола наблюдается в диапазоне концентраций от 2 до 22,5 мг/л. Для пробы с концентрацией этанола 16,5 мг/л разностный токовый сигнал воспроизводим с относительной погрешностью 6%. Стандартное отклонение составило 0,5 мг/л при числе опытов, равном 40.
Сенсор не проявляет чувствительности ни к летучим соединениям, таким, как метанол, муравьиная, уксусная и пропионовая кислоты, ни к нелетучим веществам.
Микробный этанольный сенсор использовали в дрожжевых бродильных средах. Определение концентрации этанола в тех же пробах методом газовой хроматографии дало результаты, сравнимые с полученными при помощи микробного сенсора: коэффициент корреляции составил 0,98 при числе опытов более 20. В диапазоне концентраций этанола 5,5-22,3 мг/л выходной ток сенсора оставался постоянным более трех недель, в течение которых было проведено 2100 анализов. Сейчас этот сенсор выпускается в Японии серийно.
1.6 Цефалоспориновый сенсор
Антибиотики обычно определяют с помощью турбидиметрического или титриметрического микробиологического анализа, однако методики такого определения довольно сложны и непригодны для экспрессных анализов.
Известно, что Citrobac'ter freundii вырабатывает фермент цефалоспориназу, который катализирует реакцию цефалоспорина с выделением протона:
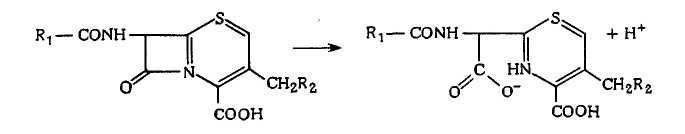
Цефалоспориназа, однако, очень неустойчива и не подходит для изготовления ферментного сенсора. В сенсоре, чувствительном к цефалоспорину, можно использовать целые клетки Citrobacter freundii, которые иммобилизуют в коллагеновой мембране, помещаемой затем в мембранный реактор.
На рис.2.8 показана система для непрерывного определения цефалоспоринов. Она включает реактор мембранного типа с прокладкой в середине. Измерения рН, обусловливаемые ферментативной реакцией, измеряли комбинированным стеклянным электродом и регистрировали с помощью самописца.
При введении в реактор растворов, содержащих различные количества цефалоспоринов, разность потенциалов на электродах постепенно увеличивалась, пока не достигала некоторого максимума. Минимальное время отклика системы зависело от скорости потока и активности иммобилизованных бактерий в коллагеновой мембране.
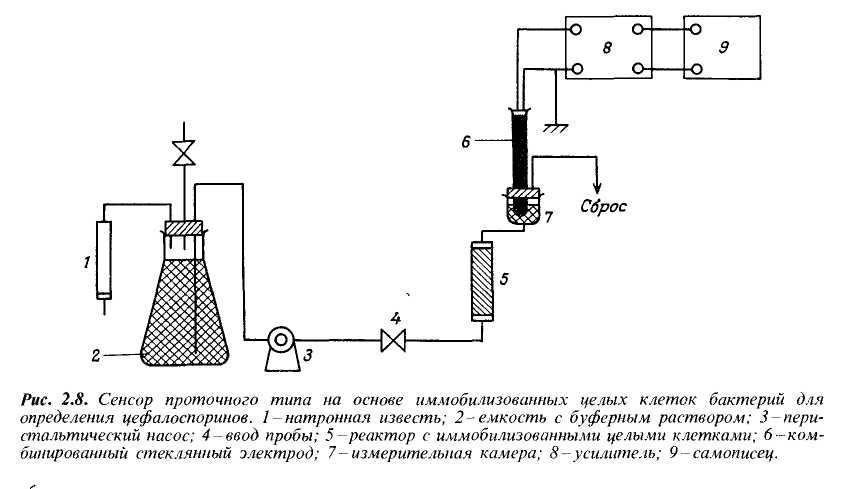
При скорости потока 2 мл/мин максимальная разность потенциалов достигалась через 10 мин.
Получена линейная зависимость между максимальной разностью потенциалов и логарифмом концентрации цефалоспорина. С помощью цефалоспоринового раствора определяли 7-фенилацетиламидодезацетоксиспорановую кислоту (7-фенилацетил-ADCA), цефалоридин, цефалотин и цефалоспорин С.
Стабильность микробного сенсора проверяли, анализируя раствор, содержащий 125 мкг/мл 7-фснилацетил-АОСА. Цефалоспорин определяли несколько раз в день, однако наблюдаемая разность потенциалов не менялась в течение недели.
Эту систему применяли также для определения цефалоспорина С в культуральной среде Cephalosporium acremonium. Результаты измерений сравнивали с данными, полученными методом высокоэффективной жидкостной хроматографии. В случае микробного сенсора относительная погрешность составила 8%, следовательно, сенсор вполне пригоден для непрерывного определения цефалоспоринов в ферментационных средах.
1.7 Сенсор БПК
Биохимическое потребление кислорода (БПК) - один из часто используемых показателей загрязнения органическими веществами. Обычно определение БПК требует пятидневной инкубации, поэтому необходим экспрессный метод оценки БПК, дающий более воспроизводимые результаты.
Насыщенный кислородом фосфатный буферный раствор (0,01 М, рН 7) пропускали через проточную ячейку со скоростью 1 мл/мин. Когда измеряемый ток достигал стационарного значения, в ячейку вводили пробу со скоростью 0,2 мл/мин. Значение стационарного тока зависело от БПК анализируемого раствора. Затем ток постепенно возвращался к начальному уровню. Время отклика сенсора (время, требуемое для достижения стационарного тока) зависело от природы анализируемого раствора.
Линейная зависимость между разностью токов (начального и стационарного значений) и БПК, определяемого после пятидневной выдержки в стандартном растворе глюкозы и глутамината, наблюдалась до значения БПК 60 мг/л. Нижняя граница определяемых концентраций составляла 3 мг/л. При анализе раствора с БПК, равным 40 мг/л, ток воспроизводился с относительной погрешностью +6% (число опытов более 10).
Рассматриваемый микробный сенсор применяли для оценки пятидневного БПК необработанных сточных вод бродильного производства. Пятидневное БПК сточных вод определяли также методом JIS (метод, рекомендованный Japanese Industrial Standard Committee). Значения БПК, оцененные микробным сенсором и определенные методом JIS, хорошо коррелировали между собой. С помощью данного сенсора оценивали также БПК необработанных промышленных сточных вод различных типов. Найдено, что сигнал сенсора определяется соединениями, присутствующими в сточных водах.
2. Основные биосенсоры на основе растительных и животных тканей
Тканевые материалы растительного и животного происхождения успешно используют в качестве биокаталитических компонентов биосенсоров. Биокаталитические материалы этого класса просто создают естественное окружение для представляющего интерес фермента, в результате чего требуемая ферментативная активность заметно стабилизируется. Во многих случаях тканевые биосенсоры служат намного дольше, чем аналогичные биосенсоры с выделенными ферментами. Кроме того, тканевые материалы сохраняют достаточно высокую специфическую активность, необходимую для конструирования некоторых биосенсоров, тогда как выделенные ферменты в тех же условиях разрушаются. В большинстве случаев эти преимущества достигаются не в ущерб избирательности. Если же в тканевом материале протекают мешающие процессы, разрабатывают специальные меры по увеличению избирательности. В этой главе достоинства тканевых биосенсоров показаны на конкретных примерах. Рассмотрено также несколько биосенсоров на основе таких биокаталитических материалов, как фрагменты животных клеток. Наконец, впервые предложены возможные механизмы транспорта (вход, внутренний перенос и выход) субстрата и продуктов в иммобилизованных клетках ткани.
Исторически тканевые биосенсоры появились позже рассмотренных в предыдущих главах ферментных и микробных биосенсоров. Возможность использования цельного фрагмента ткани млекопитающих в качестве биокаталитического слоя впервые была продемонстрирована на примере аргининового сенсора. Тонкий слой бычьей печени и соответствующее количество фермента - уреазы совместно иммобилизовали на поверхности аммиачного газочувствительного датчика. На кончике сенсора протекали каталитические реакции.
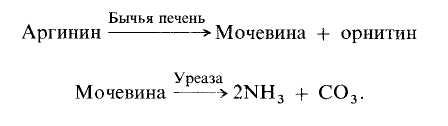
Разработка этого первого сенсора на основе ткани печени быка открыла путь к созданию тканевых биосенсоров.
2.1 Биосенсор АМР
Тканевые материалы не только удлиняют срок службы биосенсора, но и обеспечивают большую концентрацию заданного биокатализатора. Примером может служить рассматриваемый в этом разделе биосенсор AMP с газоаммиачным датчиком. Ограниченная площадь поверхности датчика не позволяет иммобилизовать большие количества ферментного препарата. Поэтому если специфическая активность последнего невысока, то и аналитические характеристики сенсора будут неудовлетворительными. Эффект низкой концентрации фермента проявился, в частности, в случае ферментного АМР-электрода, описанного в работе. Используемый в этом сенсоре выделенный фермент обычно имеет низкую активность, что приводит к малой величине наклона градуировочных кривых и короткому сроку службы. Чувствительность и срок службы сенсора AMP можно значительно улучшить при помощи тонкого слоя мышечной ткани кролика. Повышение чувствительности биосенсора непосредственно связано с пятикратным увеличением активности биокатализатора на поверхности датчика.
Выделенный фермент иммобилизуют на поверхности датчика с помощью диацетилцеллюлозной мембраны. В тканевом биосенсоре тонкий слой мышечной ткани кролика удерживают на датчике найлоновой сеткой с отверстиями размером 37 мкм. Сенсоры обоих типов хранят при комнатной температуре в рабочем буферном растворе, содержащем 0,1 М ТрисНС1, 0,1 М КС1 и 0,02% азида натрия (рН 7,5). После сборки тканевый биосенсор следует выдерживать от 2 до 4 ч для удаления фонового аммиака.
Чтобы улучшить аналитический сигнал тканевого АМР-сенсора, оптимизировали различные параметры эксперимента (рН, концентрацию ионов калия, температуру и толщину слоя ткани). Найденные оптимальные условия-рН 7,5, 0,1 М К+ и 25°С. Увеличение толщины ткани приводит к большим временам отклика, которые становятся неприемлемыми при толщине слоя больше 0,81 мм. С другой стороны, кусочки ткани толщиной меньше 0,5 мм неудобны в обращении и плохо воспроизводимы. По этим причинам для изготовления сенсора используют слои ткани толщиной от 0,5 до 0,8 мм, которые можно легко получить с помощью острого лезвия бритвы.
Слой мышечной ткани кролика толщиной 0,5 мм содержит приблизительно пять международных единиц АМР-деаминазной активности. В то же время сравнимый объем (25 мкм) коммерческого препарата фермента имеет активность всего 0,1 ед. Такая низкая активность и приводит к плохой чувствительности ферментных биосенсоров. Фактически перед иммобилизацией выделенный фермент приходится концентрировать фильтрацией в течение 16 ч и в результате активность ферментного слоя на поверхности электрода повышается до 0,9 ед. [35]. Но даже после такого концентрирования ферментативная активность в слое ткани остается выше примерно в пять раз. Часто бывает трудно найти надежный источник приобретения некоторых видов млекопитающих для получения специфического тканевого материала. В таких случаях в качестве биокатализатора удобнее использовать порошок из высушенной ацетоном ткани. Первая попытка такого рода описана в сообщении о биосенсоре AMP, в котором пасту из растертой в порошок обезвоженной ацетоном мышцы кролика физически закрепляли на поверхности аммиачного датчика [4].
Пасту из растертой в порошок мышцы кролика получают следующим образом. В пластиковую пробирку (1 мл) вводят 300 мкл буферного раствора, содержащего 0,1 М Трис-НС1, 0,1 М КО и 0,02% азида натрия (рН 7,9), и добавляют 100 мг замороженного порошка. Смесь перемешивают на вихревой мешалке в течение 30 с. При такой обработке получается однородная паста, необходимое количество которой (обычно 10 мг) наносят на тефлоновую мембрану аммиачного датчика. Поверх пасты помещают диацетилцеллюлозную мембрану и завинчивают колпачок электрода до положения, при котором паста прочно удерживается на месте. Собранный биосенсор оставляют вымачиваться на ночь в указанном выше буферном растворе для удаления фонового аммиака из биокаталитического слоя.
2.2 Биосенсор мочевины
Здесь описан биосенсор для определения мочевины, а котором в качестве биокаталитического компонента используют слой муки из бобов канавалии мечевидной. Эта мука исходно содержит большое количество фермента уреазы, который катализирует реакцию
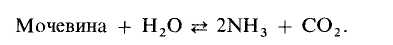
Этот биокаталитический материал оказался удачным заменителем чистого фермента.
Рассматриваемый биосенсор готовят следующим образом. С целого боба канавалии мечевидной удаляют наружный слой и измельчают семя с помощью ступки и пестика. Свежеприготовленную муку (обычно 7 мг) наносят на поверхность газоаммиачного датчика и смешивают с небольшим объемом буферного раствора (0,2 М Трис-HCl, рН 8,5, 0,1 мМ ЭДТА). Полученную таким способом пасту равномерно размазывают по мембране датчика и добавляют глутаровый альдегид, чтобы связать белки. В результате получается стабильный биокаталитический слой. Градуировочные кривые обычно получают в буферном растворе, содержащем Трис-HCl и ЭДТА при 25°С. Биосенсоры хранят в том же растворе при комнатной температуре.
Как видно из табл.3.7, основные характеристики мочевинного сенсора на основе бобовой муки лучше, чем у сенсора на основе выделенного фермента. Более того найдено, что как катализатор бобовая мука проявляет ярко выраженную селективность по отношению к мочевине в присутствии разнообразных веществ, которые потенциально могли бы мешать определению. Преимуществами бобовой муки по сравнению с ферментом являются также низкая стоимость и более удобные условия хранения. Очищенная уреаза относительно дорога и должна храниться при температуре замерзания или более низкой, тогда как бобовая мука существенно дешевле и неплохо сохраняется при комнатной температуре. Таким образом, при конструировании биосенсоров мочевины мука из бобов канавалии мечевидной является хорошей заменой очищенной уреазы.
2.3 Цистейповый биосенсор
Для конструирования биосенсоров можно эффективно использовать и другие виды растительных материалов. Например, для определения цистеина на поверхности аммонийного датчика иммобилизуют модифицированные листья огурца. Вообще листья растений, по-видимому, имеют много преимуществ как биокатализаторы благодаря своему строению. Многие листья имеют многослойную структуру, включающую восковое покрытие (кутикулу) с внешней стороны листа, слой эпидермальных клеток (эпидермис) и примыкающий к нему губчатый промежуточный слой; те же слои повторяются в обратном порядке на другой стороне листа. Кутикула обладает гидрофобными свойствами, однако проницаема для газов. Газообмен осуществляется через небольшие отверстия на поверхности листа, называемые устьицами. Губчатый промежуточный слой наиболее активен в метаболических процессах с участием газов. Для получения биокаталитических мембранных электродов срезают кутикулу с наружной или нижней стороны листа и помещают оставшуюся часть листа на газочувствительный потенциометрический электрод так, чтобы открытый эпидермальный слой находился в контакте с анализируемым раствором, а газопроницаемая восковая кутикула-с внутренними элементами сенсора.
Этот принцип был продемонстрирован, в частности, при разработке L-цистеиново-го биосенсора с использованием огуречных листьев и аммиачного датчика [45]. В листьях огурца содержится фермент L-цистеиндесульфгидролаза, катализирующий реакцию
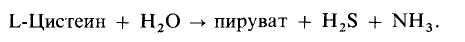
Таким образом, в цистеиновых сенсорах можно использовать электроды, чувствительные либо к NH3, либо к H3S, хотя из химических соображений первые предпочтительнее.
Методика изготовления цистеинового биосенсора довольно проста. Огурцы (Cucumis saturis) выращивают из семени в почве для рассады. По мере необходимости отрываю! зрелые листья и вымачивают их в воде в течение 45 мин. При вымачивании кутикула размягчается и легко удаляется, обнажая биохимически активный эпидермис. Эта процедура необходима, так как субстрат, L-цистеин, с трудом диффундирует через восковый слой кутикулы. Затем из листа вырезают диск нужного размера, помещают его на торец газового датчика и закрепляют диализной мембраной.
В фосфатном буферном растворе с рН 7,6 электродная функция такого биосенсора характеризуется наклоном около 35 мВ/рС в диапазоне от 10"3 до 10"5 М. Такой относительно низкий наклон градуировочной кривой, наряду с довольно большим временем отклика, свидетельствует о необходимости дальнейшего совершенствования этого биосенсора. Однако благодаря большому сроку службы сенсоров (до четырех недель) и исключительно низкой стоимости листья и их фрагменты как биокатализаторы вполне могли бы конкурировать с иммобилизованными ферментами и клетками.
2.4 Митохондриальные биосенсоры
Наряду с цельными фрагментами тканей млекопитающих в биосенсорах можно эффективно использовать фракции тканевых клеток, иммобилизуя именно те субклеточные компоненты, которые обладают наибольшей биокаталитической активностью. Такой подход может быть весьма плодотворным, если необходимо увеличить количество иммобилизованного фермента или улучшить избирательность сенсора, устраняя мешающие ферменты, которые содержатся в других частях клетки. Показано, что некоторые субклеточные фракции можно использовать как аналитические реагенты. Так. для определения тироксина можно использовать микросомы печени крысы [34]. Первой удачной попыткой создания биосенсора на основе субклеточной фракции был биосенсор для определения глутамина [8]. В этом сенсоре митохондриальную фракцию клеток кортекса почки свиньи иммобилизовали на газоаммиачном датчике. Митохондрии содержат два изофермента глутаминазы [15], активность которых и используют в глутаминовом биосенсоре.
Митохондриальную фракцию клеток почки свиньи выделяют по стандартной методике, включающей дифференциальное центрифугирование [26]. Полученную митохондриальную фракцию иммобилизуют с помощью обычной диацетилцеллюлозной диализной мембраны. Собранные биосенсоры помещают в буферный раствор (0,120 М хлорида калия, 0,02 М Трис-хлорида, 0,04 М Трис-фосфата, 0,005 М сукцината, 1 мкг/1,5 мл ротенона, 0,02% азида натрия) с рН 8,5. Сенсоры хранят и используют при комнатной температуре.
Аналитические характеристики митохондриального электрода сравнимы с характеристиками тканевых и бактериальных электродов и намного превосходят полученные в системе с выделенным ферментом (табл.3.2). Селективность митохондриального глутаминового биосенсора оказалась очень высокой [8].
Успех в создании митохондриального биосенсора показывает, что субклеточные материалы могут служить эффективными биокатализаторами. Хотя это и не относится к рассмотренному глутаминовому биосенсору, субклеточные фракции можно использовать для улучшения чувствительности и избирательности биосенсора в тех случаях, когда цельные фрагменты тканей не обладают необходимыми свойствами.
2.5 Амперометрические биосенсоры
Амперометрическое детектирование находит широкое применение при анализе биологических сред. В оптимальных условиях метод позволяет определять концентрации до 10~8-10~9 М, при этом величина сигнала варьируется в пределах трех-четырех порядков. В связи с биосенсорами имеет смысл рассмотреть основные особенности амперометрии и их влияние на сигнал детектора.
Наложение разности потенциалов между электродом сравнения и индикаторным электродом приводит к росту тока, который в свою очередь зависит от концентрации анализируемых электроактивных частиц в растворе. Измеряемый ток может быть непосредственно связан со скоростью электрохимической реакции, протекающей на индикаторном электроде. Важно, однако, найти и научиться контролировать условия, от которых зависит, какая стадия лимитирует скорость всего электрохимического процесса. Скорость гетерогенного переноса электрона (/ст), протекающего непосредственно на электроде, можно контролировать, изменяя приложенный потенциал в соответствии с уравнением Бутлера - Фольмера [10]. Таким образом, во многих системах можно выбрать такое значение потенциала, чтобы ток не лимитировался гетерогенным переносом электрона, даже если этот процесс необратим. При выполнении этого условия скорость определяющей стадией может быть диффузия (массопере-нос), адсорбция или химические реакции. Суммарный ток сенсора описывается следующим выражением:
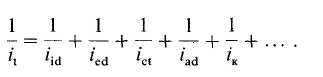
В него входят два диффузионных члена iid и /ed, которые определяются скоростями внутренней и внешней диффузии соответственно. Последний связан с диффузией в объеме раствора вплоть до электрода или границы раздела мембрана/раствор. Внутренняя диффузия включает движение соответствующих частиц в мембране или реакционном слое. Суммарный ток определяется также переносом заряда или адсорбцией реагирующих частиц на мембране или поверхности электрода (; '2d). Перемещение частиц определяемого вещества из раствора к сенсору может сочетаться с химической реакцией, протекающей с конечной скоростью (7к). Следует, однако, подчеркнуть, что члены уравнения (11.1) не являются совершенно независимыми друг от друга.
Многие биосенсоры работают при постоянном потенциале, что существенно упрощает приборное оформление. Однако при этом всегда наблюдается фоновый ток, величина которого может быть значимой при низких концентрациях определяемого вещества. Коррекция фонового тока и градуировка биосенсоров in vivo-две серьезные проблемы, которые требуют надежного решения. Колебания этих параметров могут быть обусловлены "отравлением" электрода компонентами среды. Ухудшается также чувствительность и время отклика биосенсора. Если флуктуации базовой линии обусловлены колебаниями концентраций эндогенных электроактивных мешающих частиц, то можно использовать двухэлектродную (дифференциальную) систему. Этот подход использовали при конструировании глюкозного датчика, где один электрод покрыт мембраной на основе глюкозооксидазы, а другой-мембраной, не содержащей фермента. Предполагается, что электроактивные примеси одинаковым образом диффундируют через обе мембраны [60]. В случаях, когда электрод загрязняется примесями из матрицы или продуктом электрохимической реакции, его подвергают многоимпульсной ступенчатой обработке при разных потенциалах [45, 52]. Этот способ позволяет одновременно провести как обработку электрода (в том числе удаление накопившихся на его поверхности пленок), так и установку базовой линии в области потенциалов, в которой отсутствует электролиз. Применяют также различные виды импульсной полярографии, вольтамперометрию (циклическую или с линейной разверткой потенциала). Последняя особенно полезна в двух случаях, описываемых ниже. Многие нейроактивные вещества окисляются при очень близких значениях потенциалов, и поэтому их трудно различить. Полная циклическая вольтамперограмма отражает различие в химических свойствах продуктов электролиза. Она может служить, с одной стороны, для качественного анализа, как "отпечаток пальца" исследуемой системы [56], а с другой-для количественного описания протекающих в ней электрохимических процессов. Недавно было показано [61], что представляющие интерес для биологии органические молекулы могут концентрироваться на обработанной поверхности электрода. При линейной развертке потенциала осадок определяемого вещества удаляется с поверхности, давая четко выраженный пик.
Амперометрия является перспективным направлением развития биосенсоров для применения как in vivo, так и in vitro. Широкий динамический диапазон концентраций (104-105) позволяет более широко применять ее на практике, чем потенциометрическое детектирование. Проблема заключается лишь в эффективном сопряжении специфических биохимических реакций с процессами, обуславливающими отклик электрода. Такие сенсоры могут функционировать в исключительно неоднородной среде и (в случае имплантируемых сенсоров) при температуре 37 °С.
3. Возможное использование биосенсоров, применение биосенсоров в клинической медицине
Биосенсор in vivo можно определить как небольшой датчик зондового типа, который вводится либо прикрепляется к телу для непрерывного определения (без добавления реагентов) концентрации веществ, представляющих интерес для выявления патологии или терапии.
В литературе многие сенсоры описывают как потенциально имплантируемые, однако, хотя они нередко представляют собой значительные научные достижения, их авторы уделяют мало внимания клиническому подтверждению возможности непрерывного мониторинга концентрации того или иного вещества. Любой in vivo биосенсор (до тех пор, пока они не станут в целом безвредны) представляет риск для пациента или добровольца. Поэтому, выбирая вещество для непрерывного мониторинга, важно установить критерии отбора. По нашему мнению, прежде всего это должно быть вещество, концентрация которого меняется так быстро (как, например, в случае глюкозы в крови или артериального давления кислорода, />аО2), что обычный анализ in vitro не позволяет адекватно следить за ходом этого изменения метода в минуту. Во-вторых, изменения концентрации должны иметь физиологическое или клиническое значение. Общая цель развития in vivo биосенсоров в медицине заключается в том, чтобы улучшить контроль состояния пациентов, и, если исходить из приведенных выше соображений, в настоящее время основными компонентами, для которых имеет смысл непрерывный мониторинг, являются содержащиеся в крови газы, рН, глюкоза и калий.
В будущем, возможно, будут разработаны системы с замкнутым контуром, в которых с помощью биосенсоров будут непрерывно контролироваться уровни содержания различных лекарственных веществ в крови, а скорости их поступления из подающего насоса будут регулироваться с помощью обратной связи, что позволит поддерживать их концентрации в узком терапевтическом диапазоне. Значительный интерес представляют и незамкнутые системы для контролируемого введения нескольких лекарственных препаратов [38, 45].
В определенных обстоятельствах имплантируемые биосенсоры могут быть также полезны для периодического аналитического контроля. Теоретически миниатюрные сенсоры должны обеспечивать: доступ в строго ограниченные области в организме; возможность проведения измерений в малых объемах физиологических жидкостей (например, интерстициальной жидкости) без их расходования или удаления; быстрое получение результатов. Можно предположить, что эти достоинства сенсоров можно было бы успешно использовать, например, в ходе хирургической операции, для обнаружения определенных веществ непосредственно в ткани или в сосуде с отсасываемой из нее кровью. Это позволило бы локализовать опухоль, гарантировать правильность удаления и даже установить ее биохимическую природу.
3.1 Газы крови
У здорового человека парциальные давления кислорода и диоксида углерода в артериальной крови поддерживаются в строго контролируемых пределах (p. dO2 = = 12,6-13,3 кПа; />аСО2 = 4,5-6,1 кПа). Однако при различных нарушениях и болезненных состояниях, прежде всего воздействующих на сердечно-сосудистую и дыхательную систему или регуляцию метаболизма (см. ниже), измерения раО2 и РаСО7, если не принять соответствующих мер по их корректированию, могут приводить к серьезным, а иногда и фатальным клиническим последствиям.
Нарушения, сопровождаемые отклонениями от нормы газового состава крови:
Дыхательная недостаточность у детей
Дыхательная недостаточность у взрослых
Хроническая закупорка легких
Сердечная недостаточность
Врожденные пороки сердца
Операции на сердце
Имеется три категории пациентов, для которых целесообразно ввести непрерывный мониторинг газового состава крови: недоношенные новорожденные, пациенты с острой сердечно-сосудистой или дыхательной недостаточностью (особенно требующие искусственной вентиляции легких) и, наконец, пациенты, подвергающиеся операции на открытом сердце.
3.2 Мониторинг калия
Калий имеет первостепенное физиологическое и патологическое значение. Это основной катион, присутствующий внутри клеток. Он играет важную роль в поддержании мембранного потенциала электрически возбудимых клеток, например клеток сердечной мышцы или нервных тканей. В норме концентрация К+ в плазме поддерживается в узком диапазоне (3,8-5,5 ммоль/л), но этот тонкий баланс может нарушаться при многих заболеваниях, в том числе болезнях почек, надпочечников и желудочно-кишечного тракта, сахарном диабете, а также лекарственной терапии (например, при использовании диуретиков). Изменение содержания К+ может существенно влиять на сердечный ритм: гиперкалиемия (наиболее серьезное нарушение, связанное с калием) вызывает брадикардию, фибрилляцию желудочков и, в тяжелых случаях, остановку сердца. Действительно, непрерывный мониторинг К +, очевидно, имеет наибольшую ценность для пациентов, страдающих сердечными заболеваниями (по-видимому, изменения концентрации К+ из-за болезни почек или диабета происходят не так быстро, чтобы обычного анализа in vitro было недостаточно).
Рядом исследователей разработаны катетерные калийселективные сенсоры либо на основе обычного потенциометрического ионоселективного электрода с использованием валиномицина в качестве ионофора [55, 58], либо твердотельных приборов типа ионоселективных полевых транзисторов (ИСПТ), покрытых ионоселективной мембраной [34].
Одно из наиболее интересных и полезных приложений К+-сенсоров описано в работе [58]. Два пациента подвергались чрескожной пластической операции транспазушных сосудов сердца с использованием катетерного баллона Грюнзига для расширения коронарной артерии (эта новая методика была разработана, чтобы избежать серьезного хирургического вмешательства при необходимости расширить суженные кровеносные сосуды). Калиевый электрод вводили этим пациентам в коронарный синус (в который поступает кровь, циркулирующая через сердечную мышцу). Было проведено три последовательных раздувания баллонного катетера в течение 20 с с интервалами в 80 с. В ходе ангиопластической окклюзии пациенты не испытывали боли в груди; на электрокардиограммах, регистрируемых на поверхности тела, заметных изменений также не было. При раздувании баллона не наблюдалось изменений концентрации К+ в коронарном синусе, но через 4,5 с после спускания баллона уровень К+ временно повышался на 0,3 ммоль/л выше базовой линии (4,0 ммоль/л). Этот эффект интерпретировали как отмывку от К+ из миокардиальных клеток, происходящую через несколько секунд после ишемии. Если уровень содержания К+ в коронарном синусе действительно может служить для раннего выявления миокардиальной ишемии, то постоянно находящиеся в синусе К+-электроды могут быть полезны при лечении пациентов после острого инфаркта миокарда или хирургической операции на коронарной артерии.
3.3 Глюкоза
Относительное или полное отсутствие инсулина у больных диабетом приводит к тому, что концентрация глюкозы в крови превышает допустимые в норме узкие пределы (около 3,5-5 моль/л натощак). Около 20% диабетиков, которые в основном заболевают в возрасте около 30 лет, страдают от полного или почти полного разрушения вырабатывающих инсулин клеток поджелудочной железы (островки Лангерганса). Диабет этого типа называют инсулин-зависимым, или диабетом I типа. Для жизни больных диабетом этого типа необходимо восполнение инсулина. Обычно инсулин вводят подкожной инъекцией. И хотя такие инъекции сохраняют жизнь и в значительной степени предотвращают симптомы острой гипергликемии, они все же не могут поддерживать уровень глюкозы в крови на недиабетическом (контрольном) уровне. Иногда содержание глюкозы падает до слишком низких величин (гипогликемия), что сопровождается неприятными проявлениями и опасной потерей сознания; часто, однако, оно столь высоко, что, как всерьез полагают, оказывает весьма существенные и длительные воздействия на ткани в глазах, нервах, почках и кровеносных сосудах.
Поэтому в течение последних нескольких лет принимались интенсивные меры к улучшению диабетического контроля. Один из важных подходов в этой области заключается в контролируемом вливании инсулина из портативного насоса "с незамкнутым контуром" [41, 42], что фактически является имитацией секреции инсулина у здоровых людей. Эти приборы могут поддерживать гликемию почти в норме по меньшей мере в течение нескольких лег, однако при самых различных обстоятельствах, например после интенсивной тренировки, в ходе случайной болезни или менструации, есть опасность потери контроля. Логическое развитие этих систем - "замыкание контура" и установление обратной связи, управляющей скоростью вливания инсулина, при помощи имплантируемого глюкозного сенсора. В конечном итоге такая искусственная поджелудочная железа может стать целиком имплантируемой, но это направление находится пока на самой ранней стадии развития, поэтому, прежде чем прогресс станет реальностью, необходимо решить бесчисленное множество технологических, биологических и этических проблем.
Между тем имплантируемые глюкозные сенсоры, не связанные с насосами, все еще имеют значительные преимущества, если необходимо дать тревожный сигнал о гипогликемии, предупредить надвигающуюся гипергликемию или кетоацидоз и вообще получать непрерывную информацию о содержании глюкозы в крови, что даст возможность пациенту самому скорректировать и отрегулировать инсулиновую терапию.
Возможные применения биосенсоров.
Если определить биосенсоры как идеальные приборы, пригодные для имплантации, позволяющие проводить непрерывное наблюдение, уникально чувствительные и свободные от помех, то люминесцентные методы еще должны развиваться и развиваться. Совершенно ясно, однако, что как методы трансляции малых концентраций биологических соединений в легко обрабатываемый сигнал, они заслуживают внимания.
Потенциальные возможности этих методов велики, особенно если учесть, что они обладают достаточной чувствительностью и не требуют предварительного разделения пробы. Существующее аппаратурное оформление этих методов в целом является традиционным в том смысле, что подготовленный образец помещают в ячейку или кювету, которую при детектировании излучаемого света ставят перед вакуумным фотоумножителем. Недавние разработки в этой области позволяют предполагать, что в недалеком будущем будет налажен серийный выпуск новых, более удобных приборов.
Моделью для многих приборов на основе описанных реакций может служить рассматриваемое ниже устройство, в котором используется оптическое волокно диаметром ~3,3 мм [12]. В этом приборе, измеряющем концентрацию пероксида водорода в буферном растворе, пероксидазу иммобилизуют в прозрачном полиакриламидном геле и вводят люминол как в гель, так и в раствор. С помощью фотоумножителя, помещенного на другом конце волокна длиной 61 см, можно детектировать концентрации до 10~6М. Указывается, что в отличие от других ферментных электродов нет необходимости в том, чтобы продукт ферментативной реакции диффундировал к поверхности электрода. Таким образом, время отклика прибора очень мало, около 4 с. При этом, однако, возникает проблема, связанная с тем, что сигнал лимитируется массопереносом. Использование световода простой формы позволяет сделать конструкцию приборов удобной и работоспособной [4]. Так что эта идея заслуживает внимания. При реализации такого подхода основные проблемы, вероятно, связаны с иммобилизацией фермента. В случае иммуносенсоров, конечно, возникают трудности, обуславливаемые крайне низкой скоростью установления равновесия при связывании лиганда с антителом. Тем не менее благодаря высокой чувствительности детектирования света и независимости от процессов на электроде дальнейшие исследования в этой области представляются перспективными. Развитию аналитических приборов на основе биолюминесценции препятствует трудность получения люциферазы. Однако последние обнадеживающие успехи в этой области, в частности клонирование бактериальной люциферазы [3] и фотопротеина экорина [7], позволяют надеяться, что такой проблемы больше не существует. Теперь можно полагать, что редкость данного организма не будет в дальнейшем сдерживать попытки разработки на его основе новых аналитических методов.
Как и в случае любых приборов, основанных на использовании ферментов, возникает вопрос об устойчивости. Уже накоплен довольно большой опыт по использованию люцифераз, иммобилизованных на различных подложках. Препараты люциферазы светляка пока еще недостаточно устойчивы для применения в биосенсорах, однако устойчивость бактериальной люциферазы постоянно улучшается по мере появления лучших методов иммобилизации. Теперь бактериальную люциферазу можно использовать в нескольких сотнях циклов, полагая при этом, что фермент не изменился по сравнению с исходным. Сможет ли на практике этот фермент служить так долго, как немногие известные "долгожители", остается предметом дальнейшего исследования.
Еще одна проблема, возникающая при использовании хемилюминесцента и биолюминесценции в сенсорах, связана с необходимостью пополнения реагента. Коль скоро мы хотим использовать такие преимущества эмиссии света, как простота детектирования и высокая чувствительность, то в конструкции прибора необходимо предусмотреть и возможность добавления реагента. Следует понимать, что рассматриваемое явление предполагает необратимое окисление субстрата-люциферина в случае биолюминесценции и легко доступной небольшой органической молекулы в хемилюминесценции. Для многих описанных в этой главе реакций удается сделать так, чтобы их скорость зависела только от концентрации определяемого вещества. В настоящее время единственный способ достижения этого состоит во введении избытка люминесцирующего соединения. В обычном анализе такое "буферирование" самим реагентом не представляет проблемы, но нужно проявить немало изобретательности, чтобы добиться того же эффекта в пределах ограниченного рабочего объема сенсора. Если, однако, допустить, что концентрация определяемого вещества не слишком отличается от нижней границы диапазона определяемых концентраций (это предположение вполне согласуется с исключительной чувствительностью метода), то нетрудно найти приемлемую конструкцию прибора. Интересным примером долговременного обеспечения природной люминесцентной системы люциферином является сам светляк. Этот организм появляется из куколки со всем запасом люциферина, который необходим на время (около одного месяца) почти непрекращающегося импульсного свечения по ночам! Учитывая, что потребность фотоумножителей в фотонах существенно ниже интенсивности вспышки светляка, можно было бы оценить продолжительность работы сенсора. До такой оценки нельзя дать точный ответ на этот вопрос, однако в лучших случаях продолжительность работы сенсора не слишком отличается от срока службы ферментов, используемых в существующих биосенсорах. Хемилюминесцирующие соединения могут функционировать в виде твердых тел или паст; можно предусмотреть и удерживающие их полупроницаемые мембраны в сочетании с соответствующим образом измененными соединениями.
ЗАКЛЮЧЕНИЕ
Коммерческому будущему биосенсоров, предсказываемому многими, может угрожать целый ряд непредвиденных осложнений, в том числе плохие отзывы о товаре, усиленная конкуренция, отсутствие потребности, технические трудности, законодательные или патентные проблемы, плохой маркетинг или сбыт, плохой дизайн товара. Путь к коммерческому успеху биосенсора лежит через анализ рынка, глубокое понимание потенциальных преимуществ, финансовую поддержку, всеобъемлющий маркетинг и сбыт, целеустремленность. При условии удачных коммерческих решений потенциал этих приборов действительно очень велик. Однако коммерческое продвижение биосенсоров - это область приложения сил не для тех, кто согласен со старым изречением Кромвеля о том, что идущий дальше всех не знает, куда ведет дорога
В последние годы биосенсоры привлекают значительное внимание как достойные преемники целого ряда аналитических методов контроля, использовавшихся в клинических лабораториях, ветеринарии и пищевой промышленности. Действительно, потенциальные приложения сенсорной техники столь широки, что можно лишь отметить некоторые наиболее важные тенденции, проявившиеся при распространении и сбыте этих приборов за последние несколько лет.
СПИСОК ИСПОЛЬЗУЕМОЙ ЛИТЕРАТУРЫ
Биосенсоры: основы и применения / Под ред. Д. Тернера. М.: Мир, 1992.
Грин Н., Стаут У., Тейлор Д. Биология: В 3 т. / Под ред. Р. Сопера. М.: Мир, 1996.
Евдокимов Ю.М. Биосенсоры на основе одноцепочечных и двухцепочечных нуклеиновых кислот // Сенсорные системы. 1998. Т.12. Вып.1. С.5–21.
Решетилов А.Н. Модели биосенсоров на основе потенциометрических и амперометрических преобразователей для использования в медицине, биотехнологии, мониторинге объектов окружающей среды (обзор) //
Прикладная биохимия и микробиология. 1996. Т.32. № 11. С.78–93.
Сафронова О.Г., Химченко В.И., Штарк М.Б. Тканевые и клеточные биосенсоры. Возможности клинического применения (обзор) // Медицинская техника. 1995. № 6. С.39–46