Передача информации в нервной системе
Передача информации в нервной системе
Передача информации в нервной системе
Электрические сигналы, обеспечивающие функционирование нервных клеток, опосредованы потоком ионов через водопроницаемые поры клеточной мембраны. Эти поры, образованные трансмембранными белками, называются ионными каналами. К настоящему времени разработаны высокочувствительные методы, позволяющие зарегистрировать и измерить ионные токи, протекающие через одиночные ионные каналы.
Некоторые ионные каналы избирательно проницаемы только для катионов, тогда как другие проводят только анионы. Катионные каналы могут быть высоко избирательными по отношению к одному иону, например натрию. Ионные каналы совершают переходы между открытым и закрытым состоянием и имеют, как правило, характерное время открытого состояния. Их вклад в ионный ток через клеточную мембрану определяется относительным количеством времени, которое они находятся в открытом состоянии.
Открытие канала регулируется различными механизмами. Некоторые из этих механизмов физические, такие как растяжение мембраны или изменения мембранного потенциала. Другие механизмы химические, включающие связывание активных молекул (лигандов) с активным центром, который располагается либо с внеклеточной, либо с внутриклеточной стороны канала.
Важным свойством каналов, в дополнение к кинетике открытия и закрытия, является способность открытого канала проводить ионный ток. Один из способов, которым ионы могут проникать через открытый канал, является простая диффузия. Другой способ – взаимодействие ионов с внутриканальными центрами связывания и перескакивание внутри водной поры от одного центра к другому. В любом случае движение иона через канал является пассивным и определяется градиентом концентрации и градиентом электрического потенциала на мембране.
Количество тока, проходящего через открытый канал по электрическому градиенту, зависит от проницаемости канала для данного типа ионов. Величина тока также зависит от концентрации ионов в устьях канала. Эти два фактора, проницаемость и концентрация, определяют проводимость канала.
Передача импульса в нервной системе опосредуется изменениями мембранного потенциала. В сенсорных нейронах адекватный стимул, такой как прикосновение, звук, свет, вызывает локальную деполяризацию (делая мембранный потенциал менее негативным) или гиперполяризацию (мембранный потенциал становится более негативным). Подобным же образом нейротрансмиттеры в синапсах вызывают деполяризацию или гиперполяризацию постсинаптической клетки. Потенциалы действия, представляющие собой короткие деполяризационные сигналы большой амплитуды, проводят по отросткам нейрона информацию из одного отдела нервной системы в другой.
Все эти изменения мембранного потенциала вызваны движением ионов через клеточную мембрану. Например, направленное внутрь клетки движение положительно заряженных ионов натрия снижает общий отрицательный заряд мембраны или, другими словами, вызывает деполяризацию. Наоборот, результатом движения положительно заряженных ионов калия из клетки является рост общего отрицательного заряда, то есть гиперполяризация. Гиперполяризация может быть обусловлена также движением внутрь клетки отрицательно заряженных ионов хлора.
Как движутся ионы через клеточную мембрану и чем их движение регулируется? Главным путем для быстрого перемещения ионов внутрь клетки и из нее являются ионные каналы. Ионные каналы представляют собой встроенные в мембрану молекулы белка, которые образуют поры, проницаемые для ионов. Ионные токи регулируются через открытие и закрытие этих ионных каналов. Знание механизмов работы ионных каналов позволяет понять, как генерируются электрические сигналы.
Свойства ионных каналов. Клеточная мембрана нервной клетки
Клеточные мембраны состоят из жидкой фазы липидов и встроенных в липиды белковыхмолекул. Молекулы липидов организованы в двухслойную мембрану (бислой) толщиной около 6 нм. Полярные гидрофильные головки липидов обращены к поверхностям мембраны, а гидрофобные хвосты вытянуты к середине бислоя. Липиды плохо пропускают воду и практически непроницаемы для ионов. Белковые молекулы частично погружены в слой липидов, либо с внеклеточной, либо с цитоплазматической стороны. Некоторые белки целиком пронизывают мембрану. Именно пронизывающие мембрану (трансмембранные) белки образуют ионные каналы. Основные ионы, участвующие в генерации электрических сигналов, такие как калий, натрий, кальций или хлор, движутся через ионные каналы пассивно благодаря градиенту концентраций и электрическому потенциалу мембраны.
Другие трансмембранные белки служат в качестве насосов и переносчиков, обеспечивающих транспорт веществ через клеточную мембрану против электрохимических градиентов. Транспортные механизмы поддерживают ионный состав цитоплазмы, удаляя или возвращая те ионы, которые прошли клеточную мембрану по их электрохимическим градиентам. Они также выполняют важную функцию переноса через клеточные мембраны субстратов метаболических реакций, таких как глюкоза и аминокислоты
Мембранные каналы отличаются по своей избирательности: некоторые проницаемы для катионов, другие для анионов. Некоторые катионные каналы являются селективными по отношению только к одному виду иона. Например, некоторые каналы проницаемы исключительно для ионов натрия, другие для ионов калия, прочие для ионов кальция. Однако существуют относительно неселективные катионные каналы, позволяющие проходить даже небольшим органическим катионам. Анионные каналы, связанные с передачей электрического импульса, обладают низкой специфичностью. Однако они, как правило, называются «хлорными каналами», потому что ион хлора является наиболее распространенным подвижным анионом в биологических жидкостях. Вдобавок, некоторые каналы (называемые коннексонами) соединяют соседние клетки и проницаемы как для многих неорганических ионов, так и для некоторых мелких органических молекул
Хотя для простоты мы часто представляем белковые молекулы как статические структуры, они таковыми вовсе не являются. Из-за своей тепловой энергии все большие молекулы внутренне нестабильны. При комнатной температуре химические связи растягиваются и ослабляются, то есть постоянно колеблются по отношению к устойчивому состоянию. Несмотря на то, что эти индивидуальные движения составляют величину только около 10–12 м (с частотой, достигающей 1013 Гц), такие атомные колебания могут приводить в итоге к гораздо более значительным и более медленным изменениям в структуре молекул. Это происходит потому, что многочисленные быстрые движения атомов периодически создают условия для взаимодействия функциональных групп белка, несмотря на наличие взаимных отталкивающих сил. Взаимодействия функциональных групп приводят к кинетическим переходам белка, которые, раз возникнув, могут длиться многие миллисекунды или даже секунды. Известным примером может служить молекула гемоглобина. Центры связывания кислорода заключены внутри макромолекулы этого белка и к ним нет постоянного свободного доступа. Связывание кислорода может быть достигнуто только за счет транзиторного доступа молекул газа к центрам связывания на молекуле тема. Таким образом, молекула гемоглобина «дышит», периодически становясь доступной для связывания кислорода, иначе данный белок был бы не способен выполнять предназначенную функцию по переносу газов.
Для ионных каналов функционально важными являются переходы между открытым и закрытым состояниями. Эти переходы совершаются практически моментально. С другой стороны, при системном изучении поведения любого ионного канала мы обнаружим, что время открытого состояния варьирует случайным образом. Иногда канал открыт только одну миллисекунду или даже меньше, хотя в следующий раз он может быть открыт на гораздо более продолжительное время. Тем не менее, каждый канал имеет характерное среднее время открытого состояния (т), и все вариации происходят вокруг этого среднего показателя.
Некоторые ионные каналы открываются достаточно часто даже в покое. Иными словами, вероятность нахождения таких каналов в открытом состоянии в неактивированной клетке относительно высока. Большинство таких ионных каналов проницаемо для калия или хлора. Они важны для генерации мембранного потенциала покоя. Остальные ионные каналы при этом закрыты, то есть вероятность нахождения их в открытом состоянии очень низка. Активация этих каналов адекватным стимулом резко увеличивает вероятность открытия. Этот же стимул может деактивировать ионные каналы, бывшие активными в покое. Важно помнить, что активация или деактивация канала означает возрастание или снижение вероятности открытия канала, но не увеличение или уменьшение времени открытого состояния (т) канала.
Помимо активации и деактивации, ионный ток через каналы регулируется двумя другими факторами. Первый фактор заключается в том, что ионный канал переходит в новое конформационное состояние, в котором обычный активирующий стимул не способен вызвать открытие канала. Для ионных каналов, активируемых деполяризацией, такое состояние называется инактивацией. Для каналов, отвечающих на химические стимулы, это состояние известно как десенситнзация. Второй механизм – блок открытого канала. Такое случается, когда, например, крупная молекула (такая как токсин) связывается с ионным каналом и физически закупоривает пору. Другим примером может служить блокирование некоторых катионных каналов ионами магния. В этом случае ионы магния сами не проникают через ионный канал, но связываются с каналом в области его устья и тем самым мешают проникновению других катионов.
Некоторые каналы специфически отвечают на физические изменения в клеточной мембране нейрона. Наиболее яркими представителями этой группы являются потенциал-активируемые каналы. Примером может служить чувствительный к потенциалу натриевый канал, который отвечает за регенеративную деполяризацию, лежащую в основе генерации потенциала действия. К этой группе относятся также механочувствительные ионные каналы, которые отвечают на механическое воздействие на клеточную мембрану. Рецепторы растяжения, содержащие ионные каналы такого рода, найдены в механорецепторах кожи.
Другие ионные каналы открываются тогда, когда химические агенты активируют связывающие центры на молекуле канала. Такие лиганд-активируемые ионные каналы подразделяются на две подгруппы, в зависимости от того, являются ли активные центры внутриклеточными или внеклеточными. Каналом, отвечающим на внеклеточную активацию, является катионный канал постсинаптической мембраны в скелетной мышце. Этот канал активируется нейротрансмиттером ацетилхолином, освобождающимся из двигательного нервного окончания. Открытие ацетилхолин-активируемого ионного канала позволяет ионам натрия войти в клетку, вызывая деполяризацию мышечного волокна.
Лиганд-активируемые каналы, отвечающие на внутриклеточные стимулы, включают каналы, чувствительные к местным изменениям концентрации специфических ионов. Например, кальций-активируемые калиевые каналы активируются локальным повышением концентрации внутриклеточного кальция. Такие каналы играют важную роль в реполяризации клеточной мембраны во время завершения потенциала действия. Помимо ионов кальция, типичными представителями лигандов, активирующих ионные каналы с цитоплазматической стороны мембраны, являются циклические нуклеотиды. Циклический ГМФ, например, отвечает за активацию натриевых каналов в палочках сетчатки. Такой тип канала играет принципиальную роль в работе зрительного анализатора.
Эта классификация не является достаточно строгой. Например, кальций-активируемые калиевые каналы чувствительны также к изменению потенциала, а некоторые потенциал-активируемые ионные каналы чувствительны к внутриклеточным лигандам.
Для измерения ионных токов через одиночные каналы первоначально был предложен непрямой метод анализа мембранного шума. Затем был разработан способ прямой регистрации одиночных ионных каналов с помощью метода, который называется пэтч-кламп (patch-clamp). В совокупности эти подходы дали прямые ответы на вопросы, касающиеся функции ионных каналов, как то: какой заряд проходит через одиночный канал? как долго канал остается открытым? как время нахождения ионного канала в открытом или закрытом состоянии зависит от мембранного потенциала?
Пэтч-кламп метод, предложенный Э. Неером, Б. Сакманном и их коллегами, значительно углубил наши знания о функционировании ионных каналов. Для пэтч-кламп регистрации необходимо, чтобы кончик стеклянной пипетки с внутренним диаметром около 1 мкм плотно контактировал с мембраной исследуемой клетки. При удачном подведении, благодаря легкому присасыванию, между клеточной мембраной и стеклом пипетки создается сопротивление больше 109 Ом (отсюда возник термин «гигаомный контакт», gigaohm seal). Когда пипетка соединена с соответствующим усилителем, можно зарегистрировать небольшие токи, проходящие через участок мембраны, находящейся внутри кончика пипетки. Такая конфигурация пэтч-кламп метода называется cell attached (контакт с клеткой). Высокоомный контакт гарантирует, что ионные токи, проводимые этим участком клеточной мембраны, проходят преимущественно через усилительную аппаратуру, а не теряются в месте контакта пэтч-пипетки с клеткой. При использовании пэтч-кламп метода регистрируемые события состоят из прямоугольных токовых сигналов, отражающих процессы открытия и закрытия одиночных ионных каналов. Таким образом, мы в реальном времени можем наблюдать активность одиночных белковых молекул мембраны.
В простом случае токи одиночных каналов появляются нерегулярно и с различной продолжительностью, но с постоянной амплитудой. В некоторых случаях, однако, картина токов может быть более сложной. Некоторые ионные каналы, например, в открытом состоянии могут иметь более чем один уровень проводимости. Кроме того, ионные каналы могут проявлять комплексную кинетику. Например, ток через одиночный ионный канал может выглядеть не как простой прямоугольник, а как «вспышка» открытий канала.
Таким образом, пэтч-кламп метод предоставляет новые уникальные возможности для изучения поведения ионных каналов. Во-первых, изоляция маленького участка мембраны позволяет наблюдать активность всего нескольких ионных каналов, а не тысяч, которые активируются в целой клетке. Во-вторых, высокое сопротивление контакта дает возможность регистрировать даже крайне одиночных ионных каналов и можем провести анализ кинетики каналов.
Пэтч-кламп метод позволяет осуществлять также регистрацию ионных каналов и в других конфигурациях. Достигнув контакта в конфигурации cell attached, можно, отводя электрод, оттянуть участок мембраны для формирования inside-out (внутренняя сторона наружу) конфигурации. В последнем случае цитоплазматическая сторона мембраны будет обрашена к перфузионному раствору. С другой стороны, с помощью небольшого дополнительного присасывания можно прорвать участок мембраны, расположенный внутри регистрирующего электрода, обеспечив контакт последнего с цитоплазмой клетки. В этих условиях будут регистрироваться токи в конфигурации whole-cell (целая клетка). Наконец, после получения конфигурации «целая клетка», можно оттянуть электрод от клетки, сформировав из мембраны сначала тонкую перемычку, а затем, после отделения этого участка, получить конфигурацию outside-out (наружная сторона наружу). Каждая из этих конфигураций имеет свои преимущества, их использование зависит от типа изучаемого ионного канала и той информации, которую мы хотим получить в данном эксперименте. Например, для аппликации веществ на внешнюю сторону мембраны предпочтительной является конфигурация outside-out.
Пэтч-кламп конфигурация «целая клетка» предполагает обмен между цитоплазмой клетки и раствором, заполняющим регистрирующую пипетку. Этот обмен, называемый иногда «диализ», может быть использован для намеренной замены внутриклеточного состава ионов на те, которые находятся в пипетке. С другой стороны (особенно в тех случаях, когда клетка мала), необходимо учитывать, что важные цитоплазматические компоненты могут быть потеряны из-за их быстрого перехода во внутрипипеточный раствор. Такой потери можно избежать, используя так называемый перфорированный пэтч-кламп метод. В этом случае для формирования начальной cell attached конфигурации используется пипетка, заполненная веществом, способным формировать мембранные поры (например антибиотик нистатин). По прошествии некоторого времени в изолированном с помощью электрода участке мембраны образуются проницаемые для электролитов поры, позволяющие регистрировать ионные токи в конфигурации «целая клетка».
До разработки пэтч-кламп метода свойства ионных каналов в клеточных мембранах исследовались в экспериментах, в которых для измерения мембранного потенциала или мембранного тока использовались стеклянные микроэлектроды. Использование Лингом и Джерардом в 1949 году стеклянных микроэлектродов для внутриклеточной регистрации ионных токов в живых клетках было не менее важным событием, чем введение пэтч-кламп метода три десятилетия спустя. Этот метод обеспечивал точное измерение мембранного потенциала покоя клетки, потенциала действия, а также ответов на синаптическую активацию мышечных волокон и нейронов.
Метод внутриклеточной регистрации. Острая стеклянная микропипетка, диаметр кончика которой не превышает 0,5 мкм, заполненная концентрированным солевым раствором (например, 3 M KC1), служит электродом и присоединяется к вольтметру для записи потенциала. Момент прокалывания пипеткой клеточной мембраны, приводящий к проникновению ее в клеточную цитоплазму, проявляется мгновенным появлением потенциала, соответствующего мембранному потенциалу покоя. При удачном проникновении в клетку мембрана обхватывает внешнюю поверхность пипетки, благодаря чему цитоплазма остается изолированной от внеклеточной жидкости.
В начале 1970-х годов, используя нервно-мышечный синапс лягушки, Катц и Миледи предприняли оригинальные эксперименты, в которых метод внутриклеточной микроэлектродной регистрации использовался для изучения характеристик «шумов», продуцируемых медиатором ацетилхолином (АХ). В таком синапсе АХ, освобождаюшийся из моторного нервного окончания, открывает хемовозбудимые ионные каналы постсинаптической мембраны. Вход катионов в волокно через открытые ионные каналы вызывает деполяризацию мембраны. Когда Катц и Миледи локально апплицировали экзогенный АХ на область синапса, они обнаружили, что вызванная деполяризация сопровождалась электрическим «шумом». Во время стабильной деполяризации быстрые колебания потенциала были гораздо больше колебаний изолинии в покое. Они предположили, что возрастание электрического шума в присутствии АХ было связано с хаотичным открытием и закрытием АХ-активируемых ионных каналов. Иными словами, аппликация АХ приводила к открытию большого числа ионных каналов, и число это случайно колебалось в зависимости от числа взаимодействий АХ с рецепторами.
Используя известную из физики технику анализа шума, Катц и Миледи смогли получить информацию о среднестатистическом поведении отдельного ионного канала, активируемого АХ. Позднее подобные эксперименты были проведены на том же объекте Anderson и Stevens. В отличие от предшественников, эти исследователи измеряли мембранный ток, вызванный АХ, что позволило установить величину и продолжительность ионных токов через одиночный канал.
Принципы анализа шума достаточно просты: во-первых, если токи одиночного канала являются большими, суммарный шум также будет большим. Во-вторых, ионные каналы, открывающиеся на относительно длительное время, будут продуцировать низкочастотный шум; наоборот, каналы, открывающиеся на короткое время, будут продуцировать высокочастотный шум. Исследование амплитудно-временных характеристик шумов, активированных АХ в нервно-мышечном синапсе, показало, что через одиночный открытый ионный канал проходит около 10 миллионов ионов в секунду. Кроме того, выяснилось, что значение среднего открытого времени ионного канала составляет от 1 до 2 мс.
Несмотря на широкое вытеснение пэтч-кламп методом, анализ шума до сих пор используется для изучения ионных каналов в клетках, которые не поддаются исследованию с помощью пэтч-клампа, например, в некоторых областях центральной нервной системы. Кроме того, анализ шума является сравнительно быстрым методом для получения информации о свойствах большой популяции каналов и используется в комбинации с пэтч-кламп регистрацией от целой клетки для идентификации типов каналов. Тем не менее, надо понимать, что с помощью анализа шума невозможно получить детальную информацию о поведении одиночного канала, особенно в каналах со сложной кинетикой или при наличии нескольких уровней проводимости канала.
Кинетическое поведение канала, то есть время его нахождения в закрытом и открытом состояниях, может предоставить информацию о механизмах открытия и закрытия канала, а также о константах скоростей этих процессов. С другой стороны, величина тока, проходящего через ионный канал, является прямым отражением того, как быстро проникающие ионы движутся через канал. Ток ионов зависит не только от свойств канала, но также от трансмембранного потенциала. На этом рисунке изображен фрагмент мембраны, который содержит один спонтанно активный ионный канал, проницаемый для калия. Растворы, как в пипетке, так и в ванночке для объекта, содержат одинаковую (150 ммоль) концентрацию ионов калия. Ионы калия через открытый канал могут двигаться в обоих направлениях. Однако поскольку концентрации ионов по обе стороны мембраны идентичны, а трансмембранный потенциал отсутствует, то нет никакого движения ионов ни в одном Пэтч-кламп метод имеет достоинство, которое еще не было упомянуто: мы можем менять потенциал на регистрирующей пипетке и варьировать, таким образом, трансмембранную разность потенциалов. Например, при мембранном потенциале +20 Мв каждое открытие калиевого ионного канала сопровождается током, направленным наружу. Это связано с тем, что положительно заряженные ионы калия двигаются через канал по электрическому градиенту между раствором в пипетке и в ванночке. С другой стороны, когда внутри пипетки создан отрицательный потенциал величиной в -20 мВток направлен в обратном направлении (через открытый канал в пипетку).
Зависимость
тока является линейной: ток (I),
проходящий через канал, пропорционален
потенциалу (V):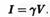
Это формула представляет собой преобразованный закон Ома. Константа 7 называется проводимостью канала. При одном и том же потенциале на мембране канал с высокой проводимостью переносит много тока, канал с низкой проводимостью проводит малый ток.
Проводимость измеряется в сименсах (См). В нейронах трансмембранный потенциал обычно выражается в милливольтах (1 мВ = 10–3 В), токи одиночных ионных каналов в пикоамперах (1 пА = 10–12 А), проводимость в пикосименсах (1 пСм = 10–12 См). потенциал +20 мВ продуцировал ток около 2,2 пА, соответственно проводимость канала (I/V) составила 2,2 пА/20 мВ = 110 пСм
Выводы
Электрические сигналы в нервной системе генерируются движением ионов через мембрану нервной клетки. Эти ионные токи протекают через водные поры трансмембранных белков, известных как ионные каналы.
Каналы различаются по своей избирательности: некоторые катионные каналы пропускают только натрий, калий или кальций, другие являются менее избирательными. Анионные каналы сравнительно не избирательны для малых анионов, но они пропускают в основном ионы хлора, так как хлор является самым распространенным анионом внеклеточной и внутриклеточной жидкостей.
Литература
Крутько В.Н., Славин М.Б., Смирнова Т.М. Математические основания геронтологии.
Реутов В.П. и др. Проблема оксида азота в биологии и медицине и принцип цикличности.
Методология биологии: новые идеи (синергетика, семиотика, коэволюция). Ред. Баксанский О.Е.
Новиков Г.Г. Рост и энергетика развития костистых рыб в раннем онтогенезе