Пептидные антибиотики животных как биохимические факторы противоинфекционной защиты
Реферат
по биологии
"Пептидные антибиотики животных как биохимические факторы противоинфекционной защиты"
2008
Пептиды, осуществляющие защиту животных от инфекции, широко представлены в природе от простейших до человека. Наиболее распространенным в эволюции типом антимикробных молекул являются катионные цистинсодержащие полипептиды. Наименьшим по размерам молекулы представителем этой группы антибиотических соединений является додекапептид с 1 дисульфидной связью, выделенный из нейтрофилов коров. Открытые нами протегрины содержат уже 2 дисульфидных мостика, так же как и подобные им соединения из гемоцитов подковообразного краба - тахиплезины и гемолимфы скорпиона - андроктонин. Дефенсины человека, кролика, крысы, мыши и морской свинки, как и р-дефенсины коров и галлинацины кур, содержат в своем составе 6 цистеиновых остатков, образующих 3 внутримолекулярные S-S-связи. Замыкают рассматриваемый ряд антимикробные полипептиды eNAP-1 и eNAP-2 из нейтрофилов лошади, для структуры которых характерно наличие уже 4 дисульфидных групп. Есть основания предполагать, что дисульфидные связи придают молекулам полипептидов повышенную устойчивость к переваривающему действию многочисленных протеиназ лейкоцитарного и микробного происхождения, обеспечивая их пролонгированное функционирование в качестве антибиотических агентов при фагоцитозе и воспалении.
Следует подчеркнуть, что фагоциты и гемоциты являются не единственными клетками организма, содержащими дефенсины и структурно-родственные им полипептиды. Выявлены дефенсины в клетках эпителия тонкой кишки мышей, кролика и человека, в эпителии трахеи и языка коров, в структурах мочеполового и репродуктивного трактов человека.
Присутствие дефенсинов в клетках слизистой тонкого кишечника интересно в связи с представлениями И.И. Мечникова о морфофизиологическкх предпосылках формирования фагоцитарной функции клеток в эволюции. Он рассматривал фагоцитоз как антимикробную функцию специализированных клеток организма, возникшую и развившуюся на основе пищеварительной активности цитоплазмы. Антимикробная функция фагоцитов эволюционно возникла на основе способности простейших поглощать и инактивировать бактерии, которые являются основным объектом их питания. Поэтому уже на заре развития животных перед ними стояла задача инактивации потенциально патогенных микроорганизмов, являющихся для них источником пластических веществ и энергии. Есть основания допускать, что продукция простейшим Entamoeba histolytica пептидов, структурно гомологичных NK-лизинам лимфоцитов, отражает генеральную линию развития механизмов противоинфекционной резистентности у животных. В последние годы дефенсины описаны и у высших растений, причем, несмотря на наличие у них 4 дисульфидных связей, они имеют вторично-третичную структуру, сходную с таковой дефенсинов насекомых. Данные о единстве ряда молекулярных механизмов защиты от инфекции у животных и растений могут служить свидетельством общности их происхождения в эволюции.
Локализация дефенсинов в фагоцитах и клеточно-тканевых структурах организма, "пограничных к инфекции", свидетельствует в пользу их участия в формировании неспецифической антимикробной резистентности в качестве универсальных антибиотиков эндогенного происхождения. Более того, рассматриваемый молекулярный механизм защиты от микробов является, по-видимому, одним из древнейших в эволюции животных, поскольку полипептиды дефенсиновой природы встречаются уже в гемолимфе имаго медоносной пчелы, личинок мясной мухи, жука Zophobas atratus и стрекозы.
Другой распространенной в эволюции матрицей антибиотических пептидов являются цекропины, выявленные первоначально в гемолимфе ряда насекомых, а позже в слизистой тонкого кишечника свиньи. Гены структурно-родственных им пептидов были клонированы и секвеированы из асцидии Styela clava в лаборатории проф. Лерера. Эта гомологическая группа пептидов представляет собой линейные, не содержащие цистеина молекулы оснбвной природы.
При всем структурном разнообразии большинства описанных в настоящее время антибиотических пептидов все они являются, как правило, одновременно основными и амфипатическими молекулами, проявляющими сродство как к липофобным, так и липофильным средам и соединениям. Положительный заряд и амфифильность молекул антибиотических пептидов лежат в основе их функциональных проявлений,' в частности антимикробного действия. Благодаря им антибиотические пептиды вступают в электростатическое и гидрофобное взаимодействия с анионными фосфолипидами и липополисахаридами мембран микробных клеток-мишеней, которые приводят сначала к их адсорбции на поверхности мембран, а потом к внедрению в двойной липидный слой, что нарушает организацию и целостность оболо-чечных структур микроорганизмов. Подобное воздействие АП на ци-топлазматическую мембрану имеет следствием необратимые повреждения ее структуры и нарушения ее разнообразных функций, результирующим эффектом которых является гибель клеток-мишеней. Частным случаем цитотоксичности АП является их действие на микроорганизмы. В силу мембранотропного механизма антибиотического действия этих пептидов они способны в определенных условиях проявлять повреждающие эффекты в отношении клеток животного организма, который их продуцирует. В связи с этим встает вопрос о том, какие клеточно-молекулярные механизмы обеспечивают прицельность именно антимикробного действия АП, сводя к минимуму их возможные аутоповреждающие эффекты в процессах фагоцитоза и воспаления, а также на поверхности барьерных эпителиев макроорганизма. Как теперь установлено, подобная избирательность действия АП определяется рядом структурных и морфологических факторов. К последним относится, в частности, компартментализация дефенсинов в лизосомоподобных гранулах лейкоцитов и клеток Панета, где они связаны с кислыми мукополисахаридами, которые обеспечивают нейтрализацию цитотоксических молекул. Другие пептиды упакованы в гранулах в форме функционально неактивных предшественников, которые подвергаются ограниченному протеолизу с освобождением антимикробного пептида только в случае активации нейтрофильных гранулоцитов в процессе фагоцитоза. В случае освобождения содержимого лизосомоподобных гранул нейтрофильных гранулоцитов во внеклеточное пространство цитотоксичность дефенсинов нейтрализуется вследствие их взаимодействия с плазменными белками, являющимися в своей основной массе анионными соединениями. В настоящее время установлено, что хорошо известные ингибиторы сериновых протеиназ - а2-макроглобулин, а 1-ингибитор протеиназ, а 1 - антихимотрипсин, антитромбин Ш - обладают повышенным сродством к дефенси-нам, благодаря чему образуются нецитотоксичные комплексы серпины-дефенсины.
Существенно важным фактором, определяющим избирательность действия АП на микроорганизмы, являются особенности поверхностных структур бактерий, низших грибов, оболочечных вирусов и, в меньшей степени, простейших. В клеточной стенке и цитоплазматической мембране бактерий и грибов локализованы молекулы, к которым АП проявляют повышенное сродство в ходе межмолекулярных электростатических и гидрофобных взаимодействий. Так, в частности, в состав липидов цитоплазматической мембраны большинства бактерий входят кислые фосфолипиды в существенно более высокой концентрации, чем в плазмалемму эукариотических клеток. Вследствие повышенного электростатического взаимодействия АП с мембранными структурами, обогащенными кислыми фосфолипидами, наблюдается их преимущественная сорбция на бактериальных клетках как в фаголизосомах фагоцитов, так и во внеклеточной среде в очагах воспаления и на поверхности слизистых и кожных покровов. Благодаря ионному взаимодействию АП концентрируются в областях цитоплазматических мембран бактерий, обогащенных кислыми фосфолипидами. Подобное свойство АП было неоднократно продемонстрировано в модельных условиях с использованием искусственных плоских мембран и липосом. Повреждающее действие АП на мембраны-мишени также зависит и от интенсивности гидрофобных взаимодействий пептида с углеводородными хвостами жирных кислот липидов. Амфипатический характер строения молекул большинства АП обеспечивает их внедрение в двойной липидный слой мембран и нарушение структурной целостности последних. Известно также, что присутствие холестерина в составе липидов мембран эукариотических клеток повышает резистентность последних к повреждающему действию таких пептидов, как магейнин и цекропин.
При анализе рассматриваемых взаимодействий важно также учитывать то обстоятельство, что цитоплазматическая мембрана бактерий непосредственно недоступна для контакта с АП, поскольку покрыта клеточной стенкой, в состав которой у грамположительных бактерий входит пептидогликан, а грамотрицательных - пептидогликан и наружная мембрана, являющаяся дополнительным защитным барьером микробной клетки. Поэтому дефенсины, за исключением некоторых криптдинов, и мягейнины более эффективно поражают in vitro грамположительную микрофлору, нежели грамотрицательную. Однако это правило распространяется не на все группы антибиотических пептидов. Например, цекропины и некоторые бактенецины более активны как цитотоксические молекулы в отношении грамотрицательных бактерий. Это свойство указанных соединений обусловлено их повышенной способностью к взаимодействию с одним из типичных представителей структуры наружной мембраны грамотрицательных бактерий, каковым является липополисахарид. Наличие липополисахарида во внешнем слое наружной мембраны грамотрицательных бактерий является одним из условий их опознания антибиотическими пептидами и белками.
Пенетрирующая липофильный бислой активность молекул антибиотических пептидов в ряде случаев заметно зависит от трансмембранного электрического потенциала клеток-мишеней, который, как известно, у плазмалеммы бактерий обычно в 1.5-2 раза более высокий, чем у мембран эукариотических клеток. Это свойство мембран является одним из условий, облегчающих проникновение АП через липидный бислой, особенно в тех случаях, когда эффекторные молекулы умеренно - или слабоосновные. Проникающая способность высокоосновных пептидов, таких как дефенсины кролика NP-1 и NP-2, практически не зависит от мембранного потенциала клеток-мишеней. Направление электрического поля поперек мембран от плюса на внешней поверхности мембраны к минусу - на внутренней обеспечивает электрофорез положительно заряженных молекул антибиотических пептидов через мембрану внутрь клетки. При этом часть молекул самостоятельно или в ассоциации друг с другом внедряется в мембраны, образуя в них пороподобные отверстия различной молекулярной организации. Перфорация мембран, которая в ряде случаев носит транзиторный характер, приводит к утечке из клеток ионов и нарушению ионной асимметрии между средой и клетками. Следствием этого является диссипация мембранного потенциала клеток-мишеней и стремление молекул воды войти в клетки. Результатами подобного движения воды могут быть разбухание клеток-мишеней и их осмотический лизис. Рассеивание мембранного потенциала лишает клетки возможности осуществлять активный транспорт ионов и веществ против градиента концентраций, что в итоге резко снижает их жизнеспособность.
При типичной ориентации электрического поля мембран катионные АП могут переноситься через этот барьер путем электрофореза, подобно тому как это описано для микробных пептидных антибиотиков полимиксина В и грамицидинов., что дополняет картину деструктурирующих воздействий наv клетки-мишени, результатом которых является гибель последних. Обобщенная схема предполагаемого механизма антимикробного действия одного из антибиотических пептидов - цекропина - представлена на рис. 20. Первая фаза действия пептида связана с адсорбцией димера цекропина на поверхности мембраны за счет электростатических взаимодействий с ее отрицательно заряженными соединениями. На следующей стадии происходит диссоциация димера и внедрение в липофильную фазу липидного бислоя отдельных молекул цекропина за счет гидрофобных взаимодействий. На заключительной стадии внедрившиеся и ориентированные поперек мембран молекулы цекропинов формируют каналоподобные поры с умеренной селективной проницаемостью для анионов.
Схема, отражающая основные этапы взаимодействия цекропинов с липидной мембраной.
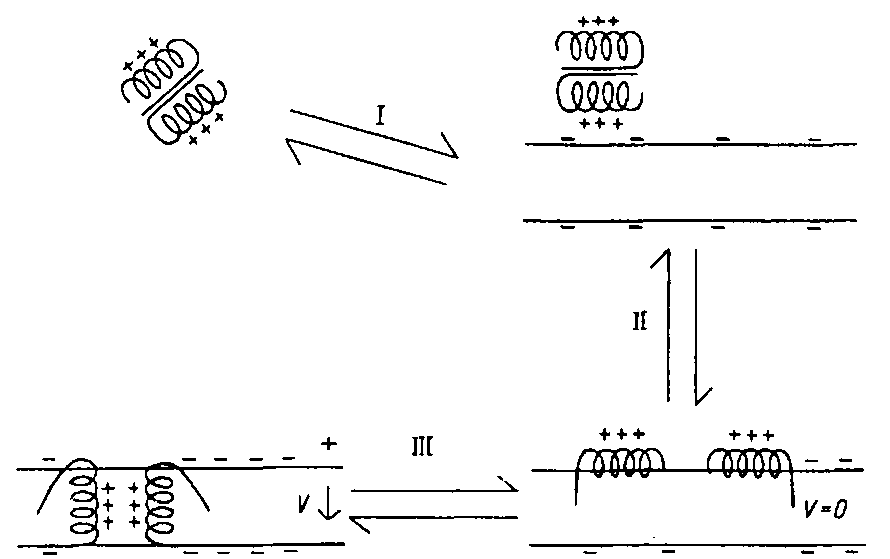
Таким образом, отрицательный заряд поверхности микробных клеток наряду с набором специфических структур их оболочек и высоким трансмембранным электрическим потенциалом их цитоплазматических мембран обеспечивает избирательность антимикробного действия антибиотических пептидов. Для рассматриваемого механизма врожденного иммунитета животных характерен относительно низкий по сравнению с молекулярными факторами приобретенного иммунитета уровень распознавания "своего" и "чужого", а также отсутствие памяти. Однако именно антибиотические пептиды клеток и жидких сред в значительной степени обеспечивают выживаемость большинства видов беспозвоночных животных в среде, изобилующей микробами, поскольку у них отсутствуют механизмы приобретенного иммунитета.
Необходимостью обеспечения надежной антимикробной защиты животных объясняется факт удивительного структурного разнообразия молекулярных матриц АП, сосуществующих в клетках и жидких средах одного и того же организма. Так, в нейтрофилах коров представлены Р-дефенсины, бактенецины и индолицидин. В гемолимфе мясных мух встречаются дефенсины, цекропины и другие АП. Один из ведущих идеологов рассматриваемой области исследований - проф. X. Боман из Стокгольмского университета - видит основную причину столь широкого разнообразия молекулярных матриц антимикробных пептидов в особенностях, очень часто ускользающих из поля зрения и анализа ученых, сопряженной эволюции экосистемы животный организм-микробная флора. Другими словами, именно микроорганизмы являются одним из ведущих природных биотических факторов среды, определяющих как поддержание стабильности молекулярно-генетических структур, ответственных за биосинтез антимикробных пептидов, так и направление возможных их изменений в эволюции животного мира. По мнению X. Бомана, именно в реальном многообразии видов микроорганизмов, с которыми в природе взаимодействует конкретный вид животных, кроется одна из основных причин видового спектра антимикробных пептидов, которые, с одной стороны, обеспечивают стерильность внутренней среды макроорганизма, а с другой - контролируют профиль его аутофлоры.
Понимание механизмов антимикробного действия АП является основанием для использования этих соединений в качестве антибиотиков нового поколения в медицине и ветеринарии. Поразительные генетическая изменчивость и скорость размножения микроорганизмов являются факторами, обеспечивающими быстрое формирование у них антибиотикорезистентности. Это обстоятельство создает для человека серьезные проблемы в борьбе с потенциально патогенными возбудителями инфекционных заболеваний. Последний новый класс антибиотиков - налидиксовая кислота - был внедрен в практику более 30 лет тому назад. В связи с этим поиск и создание новых антибиотических веществ пептидной природы являются насущными задачами современной медико-биологической науки.
Традиционно применяемые антибиотики микробного происхождения, решая основную задачу, связанную с инактивацией микроорганизмов, вызывают, однако, у человека и животных ряд нежелательных побочных эффектов: во-первых, многие из них индуцируют в организме состояние иммунодефицита вследствие иммуносупрессивной активности, во-вторых, вызывают в организме эндотоксемию, в-третьих, к ним вырабатывается резистентность со стороны микроорганизмов.
Антимикробные пептиды лишены этих недостатков. Более того, многие катионные АП обладают эндотоксиннейтрализующей и иммунорегулиру-ющей активностью. К ним практически не вырабатывается резистентность со стороны микробов. Будучи факторами проницаемости, катионные АП усиливают действие традиционно используемых антибиотиков, для них пока не описаны анафилактоидоподобные реакции, поскольку они неантигенны. Все это является предпосылкой для создания антимикробных препаратов на основе природных пептидных антибиотиков, совокупность которых представляет собой неотложную систему неспецифической антимикробной защиты, включающуюся в действие без существенно заметного латентного периода, с высокой эффективностью и относительной избирательностью распознавания "свое"-"чужое".
С целью оценки терапевтических свойств дефенсинов в условиях организма нами впервые было изучено влияние суммарных дефенсинов кролика и человека на течение экспериментальной герпетической инфекции на мышах линии СВА. С этой целью мышей заражали интрацеребрально вирусом герпеса в дозе 2 ЛД>50>/0.02 мл. Дефенсины испытывали по лечебно-профилактической схеме с одноразовой концентрацией белка, равной 100 мкг на животное, что оказалось оптимальным в результате предварительно проведенных экспериментов. У мышей вследствие инфицирования в мозг развивается энцефаломиелит разной степени тяжести. Причем по данным, полученным в нашей лаборатории, максимальная продукция вируса в клетках организма-хозяина имеет место на 3-4-е сут инфекционного процесса. Поэтому именно в эти сроки нами внутрибрюшинно вводились дефенсины инфицированным животным. В результате проведенных опытов получены доказательства защитного действия дефенсинов при экспериментальной герпетической инфекции у мышей, количественно более выраженного в случае использования препаратов кролика по сравнению с пептидами нейтрофилов человека. Испытание активности дефенсинов в этих условиях выявило в принципе те же тенденции, которые были установлены при оценке их прямого антивирусного действия. Эффективнее в обоих случаях были дефенсины кролика, нежели человека, что в некоторой степени можно связать с более основным характером молекул первых, определяющим в значительной степени интенсивность вирусоцидной активности препаратов. Необходимо подчеркнуть, что суммарная лечебная доза препаратов составляла в наших экспериментах 10 мг полипептидов на 1 кг веса животного, в то время как ЛД>50> дефенсинов кролика, но нашим данным, находится в пределах 500-700 мг/кг, а дефенсинов человека - 700-800 мг/кг. Соотношение токсической и терапевтической доз дефенсинов позволяет считать нетоксичными эти препараты в используемых концентрациях. Что касается механизмов защитного действия этих полипептидов в условиях организма, то наряду с их прямым антивирусным действием наиболее вероятно их стимулирующее воздействие на клетки мононуклеарной фагоцитирующей системы, которые являются одним из определяющих факторов резистентности к герпетической инфекции. Проверка этих предположений является предметом наших продолжающихся работ.
Результаты данных экспериментов позволяют рассматривать дефенсины в качестве эффективных препаратов, повышающих резистентность организма к вирусной инфекции. Принципиальная возможность их использования в качестве профилактическо-терапевтических средств при инфекционной патологии с неизбежностью ставит вопрос о необходимости изучения влияния дефенсинов на гомеостатические механизмы организма.