Метилотрофные бактерии - источники изотопно-меченных Н-2 и С-13 аминокислот
БИОТЕХНОЛОГИЯ
МЕТИЛОТРОФНЫЕ БАКТЕРИИ - ИСТОЧНИКИ ИЗОТОПНО - МЕЧЕННЫХ 2Н- и 13С- АМИНОКИСЛОТ.
@ О.В. МОСИН.
Московская государственная академия тонкой химической технологии им. М.В. Ломоносова, 117571.
Изучена возможность использования различных штаммов метилотрофных бактерий для получения аминокислот, меченных стабильными изотопами 2Н и 13С, как секретируемыми в культуральную жидкость в процессе ферментации штаммов-продуцентов, так и выделяемыми из гидролизатов суммарного белка биомассы. Представлены данные по адаптации L-фенилаланин-продуцирующего штамма факультативных метилотрофных бактерий Brevibacterium methylicum к ростовым средам, содержащим 2 об.% С2Н>3>О2Н и 98 об.% 2Н>2>О и биосинтезу L-фенилаланина. Для L-лейцин-продуцирующего штамма облигатных метилотрофных бактерий Methylobacillus flagellatum проведено культивирование на среде, содержащей 1 об.% 13СН>3>ОН и 99 об.% Н>2>О. Уровни изотопного включения 2Н- и 13С в аминокислоты были изучены методом масс-спектрометрии электронного удара в виде метиловых эфиров N-диметиламинонафталин-5-сульфонильных (дансильных) производных аминокислот и бензилоксикарбонильных производных (Z-производных) аминокислот. Максимальные уровни включения стабильных изотопов 2Н-и 13С в аминокислоты при росте метилотрофных бактерий на средах, содержащих 2 об. % СН>3>ОН и 98 об.% 2Н>2>O, и 1 об.% 13CH>3>OH и 99 об.% Н>2>О составляют 97,5% и 95% соответственно.
Ключевые слова: Стабильные изотопы. - Brevibacterium methylicum. - Methylobacillus flagellatum. - Культивирование на 2Н>2>О. - Изотопно-меченные аминокислоты.
ВВЕДЕНИЕ
Разработка путей биосинтетического получения аминокислот, меченных 2Н и 13С является актуальной задачей для современной биотехнологии. Стоимость полученных таким способом изотопно меченных соединений значительно ниже, чем химически синтезированных, что представляет интерес для поиска новых штаммов - продуцентов аминокислот, способных к росту и биосинтезу на изотопно-меченных средах.
Удобными и дешёвыми источниками изотопно-меченных аминокислот могут быть метилотрофные бактерии, биотехнологический потенциал которых в настоящее время общепризнан [1,2]. Субстратом для роста метилотрофов при получении меченных аминокислот является метанол (или его меченные аналоги С2Н>3>О2Н/13СН>3>ОН), и другие низкомолекулярные соединения, например, тяжёлая вода (2Н>2>О) [3]. Однако, высокие концентрации 2Н>2>О в ростовой среде могут вызвать ингибирование роста и развития метилотрофов [3]. Несмотря на негативный биостатический эффект, оказываемый тяжёлой водой на клетки, некоторые бактерии устойчивы к высоким концентрациям тяжёлой воды в среде [4], в то время как растительные клетки могут нормально развиваются при концентрациях не более 50-75 % 2Н>2>О, а клетки животных не более 35 % 2Н>2>О [5]. В отличие от тяжёлой воды, при использовании 13СН>3>ОН в качестве источника метки нет необходимости проводить предварительную адаптацию культуры к изотопному субстрату, так как показано, что изотопный эффект 13СН>3>ОН незначителен [6]. Поэтому использование для получения 13С -аминокислот облигатных метилотрофных бактерий, которые способны ассимилировать только метанол в качестве единственного источника углерода и энергии является очень перспективным.
В плане раннее начатых исследований с метилотрофами по получению аминокислот, меченных стабильными изотопами, практический интерес представляет использование метилотрофных бактерий, особенно продуцентов аминокислот для получения целевых соединений за счет биоконверсии низкомолекулярных меченных субстратов [7-10]. Традиционным подходом при получении аминокислот является культивирование штаммов - продуцентов на средах, содержащих изотопно-меченные субстраты и 2Н>2>О с последующим выделением меченных аминокислот как из культуральной жидкости после ферментации штаммов-продуцентов, так и из гидролизатов общего белка биомассы.
Целью данной работы было изучение принципиальной возможности получения 2Н-и 13С-аминокислот за счёт использования штаммов метилотрофных бактерий Brevibacterium methylicum и Methylobacillus flagellatum .
УСЛОВИЯ ЭКСПЕРИМЕНТА.
Бактериальные штаммы. Исследования проводили с генетически маркированными штаммами метилотрофных бактерий, полученными из коллекции культур Всероссийской коллекции промышленных микроорганизмов (ВКПМ) Государственного научно-исследовательского института генетики и селекции промышленных микроорганизмов:
1. - Brevibacterium methylicum ВКПМ В 5652, лейцинзависимый штамм факультативных метилотрофных бактерий, продуцент L-фенилаланина.
2. - Methylobacillus flagellatum KT, изолейцинзависимый штамм облигатных метилотрофных бактерий, продуцент L-лейцина.
В работе использовали 2Н>2>O (99,9% 2Н), С2Н>3>О2Н (97,5 % 2Н) и 13СН>3>ОН (97,5 % 13С), полученные из Российского научно-исследовательского центра “Изотоп” (Санкт-Петербург, РФ), а также N-диметиламинонафталин-5-сульфохлорид (дансилхлорид) (Sigma, CША), карбобензоксихлорид (Войковский химзавод, РФ).
Условия адаптации. Адаптацию штаммов к дейтерию проводили на агаризованных средах (2 %-ный агар), содержащих тяжёлую воду. При этом использовали рассев культур до отдельных колоний на средах, содержащих ступенчато увеличивающиеся концентрации тяжёлой воды [9].
Культивирование бактерий проводили на минеральной среде М9 [11], как описано в работе [9].
Гидролиз белка проводили с использованием 6 н. 2 НСl (в 2Н>2>О) и 4 н. Ва(ОН)>2> (1100, 24 ч)> > [12].
Экстракцию липидов проводили смесью хлороформ-метанол (2:1) по методу Блайя и Дайера [13].
Метиловые эфиры дансиламинокислот получали как описано в работе [8].
Бензилоксикарбонильные производные аминокислот получали как указано в работе [14].
Аналитическое и препаративное разделение бензилоксикарбонильных производных аминокислот культуральной жидкости и белковых гидролизатов проводили методом обращённо-фазовой высокоэффективной жидкостной хроматографии (ВЭЖХ) по раннее разработанной методике [15].
Разделение метиловых эфиров дансил-аминокислот проводили методом обращённо-фазовой ВЭЖХ на жидкостном хроматографе “Knauer” (ФРГ), снабженным насосом “Knauer”, УФ-детектором “2563” и интегратором “С-R 3A” (Shimadzy, Япония). Использовали неподвижную фазу: Separon SGX C 18, 7 мкм, 150 x 3,3 мм (Kova, Чехословакия). Элюирование проводили в системе растворителей: (А) - ацетонитрил-трифторуксусная кислота (20:80 об/об) и (В) - ацетонитрил. Использовали градиентное элюирование: от 20% В до 100%В в течение 30 мин, при 100% В в течение 5 мин, от 100% В до 20% В в течение 2 мин, при 20% В в течение 10 мин.
Ионнообменную хроматографию белковых гидролизатов проводили на приборе “Biotronic LC 5001” (ФРГ), 230> >> >x 3,2 мм, рабочее давление 50-60 атм, скорость подачи цитратного буфера 18,5 мл/ч, нингидрина 9,25 мл/ч, детекция при 570 и 440 нм.
Количественное определение L-фенилаланина в культуральной жидкости проводили на приборе “Beckman DU- 6” (США) при 540 нм, после обработки препаратов культуральной жидкости нингидрином.
Масс-спектры электронного удара производных аминокислот получены на приборе “MB-80A” (Hitachi, Япония) при энергии ионизирующих электронов 70 эВ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ.
Получение штаммов - продуцентов аминокислот, адаптированных к максимальным концентрациям 2Н>2>О в среде.
В рамках данной работы была исследована возможность адаптации различных штаммов метилотрофных бактерий, продуцентов аминокислот к росту на средах с максимальными концентрациями тяжёлой воды. Для этого были проверены два из имеющихся в коллекции “ГосНИИ Генетики” штаммов метилотрофных бактерий: штамм облигатных метилотрофных бактерий M. flagellatum, продуцент L-лейцина и штамм факультативных метилотрофных бактерий B. methylicum, продуцент L-фенилаланина.
Для проведения адаптации был выбран ступенчатый режим увеличения концентрации 2Н>2>О в ростовых средах, так как мы предположили, что постепенное привыкание организма к 2Н>2>О будет оказывать благоприятный эффект на адаптацию. Этапы адаптации метилотрофных бактерий к средам, содержащим максимальные концентрации 2Н>2>О показаны на рис. 1 и схеме. Однако вопреки нашим ожиданиям, штамм облигатных метилотрофных бактерий M. flagellatum обнаружил повышенную чувствительность к тяжёлой воде (ингибирование роста бактерий наблюдалось при концентрациях 2Н>2>О в среде 74,5 об.%) [3]. Дальнейшие эксперименты по адаптации с данным штаммом метилотрофных бактерий не проводились. В связи с этим в наших экспериментах по изучению уровней включения дейтерия в аминокислоты использовались препараты культуральной жидкости и биомасса M. flagellatum, полученная со среды, содержащей 74,5 об.% 2Н>2>О и 1 об.% С2Н>3>О2Н.
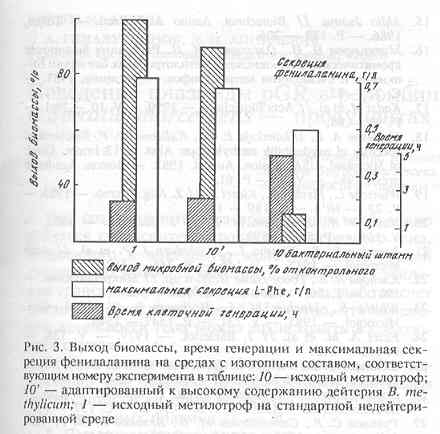
Раннее нами был описан метод адаптации штамма факультативных метилотрофных бактерий B. methylicum к росту при сохранении способности к биосинтезу фенилаланина на максимально дейтерированной среде [7]. В данной работе были исследованы образцы биомассы штамма B. Methylicum (рис.1), полученные в ходе многоступенчатой адаптации его к тяжёлой воде на средах с различным содержанием 2Н>2>О (от 0; 24,5; 49,0; 74,5; об% до 98 об% 2Н>2>О). Поскольку данный штамм метилотрофных бактерий удалось адаптировать к максимальным концентрациям 2Н>2>О в ростовой среде, исследование уровней включения дейтерия в аминокислоты суммарных белков биомассы представлялось наиболее интересным.
Факультативные метилотрофные Облигатные метилотрофные
б
 актерии
B. methylicum-источники
бактерии M. flagellatum,
актерии
B. methylicum-источники
бактерии M. flagellatum,
2Н-аминокислот источники 2Н-и 13С-
аминокислот
Многоступенчатая адаптация бактерий к
2Н>2>О на средах, содержащих 0; 24,5; 49; 74,5; 98
об.% 2H>2>O
B. methylicum, адаптированный M. flagellatum,
к 98 об.% 2Н>2>О и 2 об.% С2Н>3>О2Н
замедление
роста на
98 об.% 2Н>2>О и 2 об.% С2Н>3>О2Н
замедление
роста на
среде, содержащей 74,5 об.% 2Н>2>О
Культивирование на средах, Культивирование на среде,
содержащих различные концентрации содержащей обычную воду
2Н>2>О и 1 об.% 13СН>3>ОН
К

 ультуральная
жидкость после биомасса
биомасса Культуральная
жидкость после отделения от клеток
отделения от клеток
ультуральная
жидкость после биомасса
биомасса Культуральная
жидкость после отделения от клеток
отделения от клеток

2Н-секретируемые аминокислоты 13С-секретируемые аминокислоты



Гидролиз суммарных белков в
4н. Ва(ОН)>2> или 6 н. 2НСl ( в 2Н>2>О)
2Н-и 13С-аминокислоты в
составе белковых гидролизатов


Обработка DnsCl и CH>2>N>2> Обработка ZСl



Оценка уровней изотопного Обращённо-фазовая Обращённо-фазовая ВЭЖХ
включения методом масс- ВЭЖХ метиловых Z-производных аминокислот
спектрометрии метиловых эфиров дансил- аминокислот
 эфиров
дансил-аминокислот аминокислот
эфиров
дансил-аминокислот аминокислот

Оценка уровней изотопного
Схема
Адаптация метилотрофных бактерий к средам, содержащим максимальные концентрации 2Н>2>О и получения 2Н-и 13С-аминокислот.
Изучение ростовых характеристик M. flagellatum на средах, содержащих СН>3>ОН/С2Н>3>О2Н/13СН>3>ОН и 2Н>2>О.
Данные по росту штамма М. flagellatum на минимальных средах, с 1 об.% СН>3>ОН (С2Н>3>О>2>Н/13СН>3>ОН) и содержащих ступенчато увеличивающиеся концентрации тяжёлой воды приведены в таблице 1. Как видно из таблицы 1, на средах, содержащих обычную воду и аналоги метанола С2Н>3>О2Н и 13СН>3>ОН выходы микробной биомассы составили 81% и 72% соответственно, а на средах с 74,5 об.% 2Н>2>О выход биомассы составил 29%, что в 3,4 раза ниже, чем в контрольных экспериментах, когда использовали простую воду и метанол (табл. 1, опыты 1, 3, 8). Как видно из таблицы 1, устойчивый рост у M. flagellatum сохранялся лишь в средах, содержащих меньше чем 74,5 об.% 2Н>2>О. Выше этой концентрации наблюдалось ингибирование роста.
Таблица 1.
Влияние изотопного состава среды на рост штамма M. flagellaum.
|
Номер Компоненты среды, об% Величина Выход Время опыта лаг-фазы биомассы генер. Н>2>О 2Н>2>О СН>3>ОН С2Н>3>О2Н часы % ч |
|||||||
|
1 |
99,0 |
0 |
1,0 |
0 |
20,0 |
100 |
1,1 |
|
2 |
99,0 |
0 |
0,5 |
0,5 |
21,3 |
91,0 |
0,8 |
|
3 |
99,0 |
0 |
0 |
1,0 |
22,4 |
81,0 |
1,0 |
|
4 |
49,5 |
49,5 |
1,0 |
0 |
50,8 |
76,0 |
1,4 |
|
5 |
49,5 |
49,5 |
0,5 |
0,5 |
52,0 |
75,0 |
1,2 |
|
6 |
49,5 |
49,5 |
0 |
1,0 |
58,5 |
70,0 |
1,3 |
|
7 |
24,5 |
74,5 |
1,0 |
0 |
60,0 |
29,0 |
1,4 |
|
8 |
99,9 |
0 |
13СН>3>ОН 1,0 |
0 |
20,8 |
72,0 |
1,0 |
Как и следует из литературных данных, введение стабильного изотопа 13С не приводит к летальным последствиям для клетки, что мы и наблюдали в случае с M. flagellatum. В целом, полученные для M. flagellatum данные могут свидетельствовать о том, что адаптация к 2Н>2>О определяется как видовой специфичностью метилотрофных бактерий, так и особенностями их метаболизма.
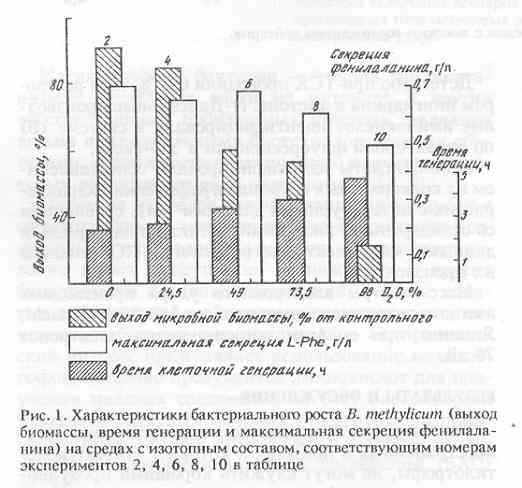
Изучение ростовых и биосинтетических характеристик B. methylicum на средах, содержащих СН>3>ОН/С2Н>3>О2Н и 2Н>2>О.
Данные по росту исходного и адаптированного к 2Н>2>О штамма B. methylicum и максимальному уровню накопления L-фенилаланина в культуральной жидкости на минимальных средах, содержащих 2 об.% СН>3>ОН (С2Н>3>О2Н) и ступенчато увеличивающиеся концентрации тяжёлой воды представлены в таблице 2. Как видно из этих данных, в отсутствие дейтерий-меченных субстратов продолжительность лаг-фазы не превышала 24 ч (см. таблицу 2, опыт 1). С увеличением концентрации 2Н>2>О в среде продолжительность лаг-фазы увеличивалась до 64,4 ч на средах с 98 об.% 2Н>2>О и 2 об.% С2Н>3>О2Н (таблица 2, опыт 10). Отмечено, что длительность времени клеточной генерации с увеличением степени изотопного насыщения среды дейтерием постепенно увеличивается, достигая 4,9 часов на максимально дейтерированной среде. Как видно из табл. 2, опыт 2, С2Н>3>О2Н не вызывал существенного ингибирования роста и не оказывал влияния на выходе микробной биомассы, в то время как на средах с 98 об.% 2Н>2>О микробный рост подавлялся. Так, на среде, содержащей 98 об.% 2Н>2>О и 2 об.% С2Н>3>О2Н, выход микробной биомассы был снижен в 3,3 раза по-сравнению с контролем. Важно, что выход микробной биомассы, время клеточной генерации и уровень накопления L-фенилаланина в культуральной жидкости при росте адаптированного к 2H>2>O штамма B. methylicum на среде, содержащей 98 об.% 2Н>2>О и 2 об.% С2Н>3>О2Н изменяются незначительно (табл. 2, опыт 10’).
Таблица 2.
Влияние изотопного состава среды на рост штамма B. methylicum и уровень накопления L-фенилаланина в культуральной жидкости.
|
Номер Компоненты среды, об% Величина Выход Время ген. Уровень опыта лаг-фазы биомассы часы секреции Н>2>О 2Н>2>О СН>3>ОН С2Н>3>О2Н часы % L-Phe, % |
||||||||
|
1 |
98 |
0 |
2 |
0 |
24,0 |
100 |
2,2 |
100 |
|
2 |
98 |
0 |
0 |
2 |
30,3 |
92,3 |
2,4 |
99,1 |
|
3 |
73,5 |
24,5 |
2 |
0 |
32,1 |
90,6 |
2,4 |
96,3 |
|
4 |
73,5 |
24,5 |
0 |
2 |
34,7 |
85,9 |
2,6 |
97,1 |
|
5 |
49,0 |
49,0 |
2 |
0 |
40,5 |
70,1 |
3,0 |
98,0 |
|
6 |
49,0 |
49,0 |
0 |
2 |
44,2 |
60,5 |
3,2 |
98,8 |
|
7 |
24,5 |
73,5 |
2 |
0 |
45,8 |
56,4 |
3,5 |
90,4 |
|
8 |
24,5 |
73,5 |
0 |
2 |
49,0 |
47,2 |
3,8 |
87,6 |
|
9 |
0 |
98,0 |
2 |
0 |
60,5 |
32,9 |
4,4 |
79,5 |
|
10 |
0 |
98,0 |
0 |
2 |
64,4 |
30,1 |
4,9 |
71,5 |
|
10’ |
0 |
98,0 |
0 |
2 |
39,9 |
87,0 |
2,9 |
95,0 |
*Данные (1-10) приведены для B. methylicum, не адаптированного к средам с высоким содержанием дейтерия.
Данные 10’ приведены для адаптированого B. methylicum.
За счёт использования данного штамма B. methylicum удалось получить десятки миллиграмм высокомеченного дейтерием фенилаланина из 20 г клеточной биомассы.
Изучение уровней включения изотопов 2Н- и 13С в секретируемые аминокислоты метилотрофных бактерий.
Эффективность использования дансильных и Z-производных аминокислот для масс-спектрометрических исследований была показана раннее [10, 16]. В данной работе уровни включения изотопов 2Н-и 13С в мультикомпонентные смеси аминокислот в составе культуральной жидкости и белковых гидролизатов определяли методом масс-спектрометрии электронного удара метиловых эфиров дансил-аминокислот или в виде Z-производных аминокислот после их препаративного разделения методом обращённо-фазовой ВЭЖХ.
Производные аминокислот получали прямой обработкой препаратов культуральной жидкости и гидролизатов суммарных белков биомассы карбобензоксихлоридом (ZCl) или дансилхлоридом (DnsCl) и диазометаном (CH>2>N>2>). Реакцию проводили в щелочной среде в водно-органическом растворителе в соотношении карбобензоксихлорид (дансилхлорид)-аминокислота, равным 2:1 (схема 1).
Для лизина, гистидина, тирозина, серина, треонина и цистеина наряду с монопроизводными было характерно образование ди-Z-(Dns)-производных: ди-Z,(Dns)-лизина, ди-Z,(Dns)-гистидина, О,N-ди-Z,(Dns)-тирозина, O,N-ди-Z,(Dns)-серина, O,N-ди-Z,(Dns)-треонина и N,S-ди-Z,(Dns)-цистеина (на схеме 1 эти произодные не показаны). Кроме этого, из аргинина синтезировался три-Z,(Dns)-аргинин.
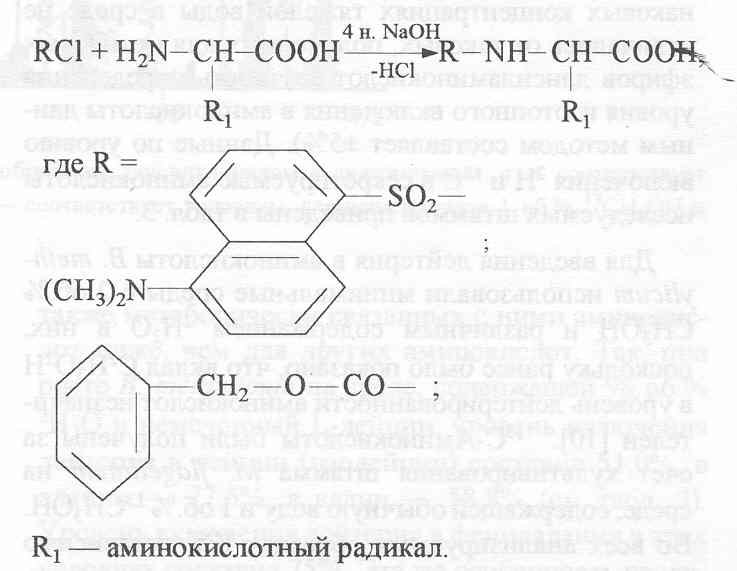
Летучесть дансилпроизводных аминокислот при масс-спектрометрическом анализе повышали за счет дополнительной дериватизации по карбоксильной группе (этерификации) диазометаном. Выбор диазометана как этерифицирующего реагента был обусловлен необходимостью проведения реакции в мягких условиях, исключающих изотопный (1Н-2Н) обмен в ароматических аминокислотах.
Данные масс-спектрометрии по уровням включения стабильных изотопов 2Н-и13С в бензилоксикарбонильные производные аминокислот в пределах одинаковых концентраций тяжёлой воды в среде не отличались от таковых, полученных для метиловых эфиров дансиламинокислот (точность определения уровней изотопного включения в аминокислоты данным методом составляет +5). Данные по уровням включения 2Н-и 13С секретируемые аминокислоты исследуемых штаммов приведены в таблице 3. Для введения дейтерия в аминокислоты B. methylicum использовали минимальные среды с 2 об.% СН>3>ОН и различным содержанием 2Н>2>О в них, поскольку раннее было показано, что вклад С2Н>3>О2Н в уровни дейтерированности аминокислот незначителен [10].
13С-аминокислоты были получены за счёт культивирования штамма M. flagellatum на среде, содержащей обычную воду и 1 об.% к 13CH>3>OH. Во всех анализируемых образцах культуральной жидкости не зависимо от рода штамма присутствовали аланин, валин, лейцин (изолейцин) и фенилаланин (см. табл. 3). В культуральной жидкости M. flagellatum в дополнение вышеназванным аминокислотам также накапливался глицин.
Таблица 3.
Уровни включения 2Н и 13С в секретируемые аминокислоты B. methylicum и M. flagellatum (данные получены для Z-,и Dns-производных аминокислот)*.
|
Аминокислоты |
Содержание 2Н>2>О в среде, об% 24,5 49,0 73,5 98,0 |
1 % 13СН>3>ОН |
|||
|
Глицин |
- |
- |
- |
- |
60,0 |
|
Аланин |
24,0 |
37,5 |
62,5 |
77,5 |
35,0 |
|
Валин |
20,0 |
46,3 |
43,8 |
58,8 |
50,0 |
|
Лейцин (изолейцин) |
15,0 |
47,0 |
46,0 |
51,0 |
38,0 |
|
фенилаланин |
15,0 |
27,5 |
51,3 |
75,0 |
95,0 |
* Данные по включению 2Н в аминокислоты приведены для B. methylicum при росте на средах, содержащих 2 об.% CH>3>OH и 24,5; 49,5; 73,5; 98,0 об.% 2Н>2>О.
Данные по включению 13С приведены для M. flagellatum при росте на среде, содержащей 1 об.% 13СН>3>ОН и 99 об.% Н>2>О.
Во всех опытах наблюдалось специфичное возрастание уровней изотопного включения дейтерия в индивидуальные аминокислоты культуральной жидкости при ступенчатом увеличении концентраций тяжёлой воды в ростовой среде (табл. 3). Как видно из таблицы 3, для аминокислот из культуральной жидкости, количество включенных атомов дейтерия по углеродному скелету молекулы варьирует в пределах 49 об.%-ной концентрации 2Н>2>O и составляет для фенилаланина 27,5%, аланина - 37,5%, валина - 46,3%, лейцина (изолейцина) - 47%.
Как и следовало ожидать, для получения 13С-аминокислот за счет микробной биоконверсии 13СН>3>ОН, предварительная адаптация не является необходимым этапом, поскольку этот изотопный субстрат не оказывает существенного влияния на ростовые и биосинтетические характеристики метилотрофов. Масс-спектр культуральной жидкости M. flagellatum, полученной после обработки дансилхлоридом и диазометаном со среды, содержащей 1 об.% 13СН>3>ОН и 99 об.% Н>2>О показан на рис. 2,б (Масс-спектр приведён относительно контрольных условий, где использовали обычную воду и метанол (а)). Как видно из рис. 2,б, в дериватизованной культуральной жидкости М. lagellatum детектируются обогащённые изотопом 13С пики молекулярных ионов производных аминокислот с М+. при m/z 337,4; 368,5; 382,3; 420,5, которые соответствуют по массе аланину, валину, лейцину (изолейцину) и фенилаланину. Так как отношения массы к заряду m/z для лейцина (изолейцина) в масс-спектрах электронного удара метиловых эфиров дансиламинокислот совпадают, то вследствие этого нельзя точно идентифицировать структуру соединения данным методом. Кроме вышеназванных пиков молекулярных ионов, в масс - спектре фиксируется пик с М+. при m/z 323,2 (вместо m/z 322,0 в контроле), соответствующий метиловому эфиру дансил-глицина.
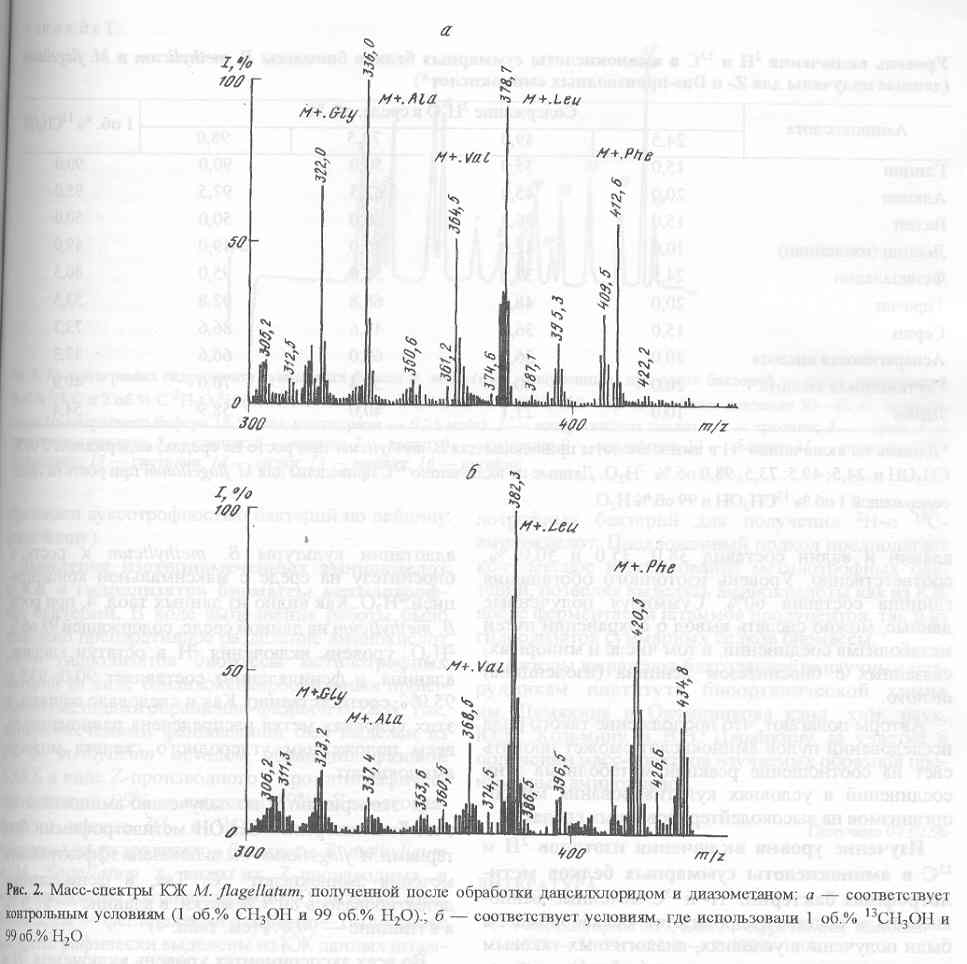
В связи с тем, что штамм B. methylicum был ауксотрофом по лейцину, а другой штамм M. flagellatum - ауксотрофом по изолейцину, было интересно изучить как изменяются уровни включения дейтерия в этих аминокислотах. Для этого лейцин добавляли в ростовую среду B. methylicum, приготовленную на основе 98 об.% 2Н>2>О в немеченном виде. В случае с M. flagellatum изолейцин добавляли в среду, приготовленную из обычной воды и 1 об.% 13СН>3>ОН. Как показали наши исследования, в условиях ауксотрофности по лейцину (изолейцину) уровень изотопного обогащения лейцина (изолейцина), а также метаболически связанных с ними аминокислот ниже, чем для других аминокислот. Так, при росте B. methylicum на среде, содержащей 98 об.% 2Н>2>О и немеченный L-лейцин, уровни включения дейтерия в лейцин (изолейцин) составили 51,0%, аланин - 77,5%, валин - 58,8% (табл. 3). Уровень включения дейтерия в фенилаланин в этих условиях составил 75%. Эта же особенность проявляется при росте M. flagellatum на среде с 1 об.% 13СН>3>ОН и добавкой немеченного L-изолейцина. Как видно из таблицы 3, в отличие от фенилаланина (уровень изотопного обогащения - 95%), уровни включения изотопа 13С в лейцин (изолейцин), аланин и валин составили 38,0; 35,0; 50,0 % соответственно. Уровень изотопного обогащения глицина составил 60%. Суммируя полученные данные, можно сделать вывод о сохранении минорных путей метаболизма, связанных с биосинтезом лейцина (изолейцина) de novo.
Изучение уровней включения изотопов 2Н- и 13С в аминокислоты суммарных белков метилотрофных бактерий.
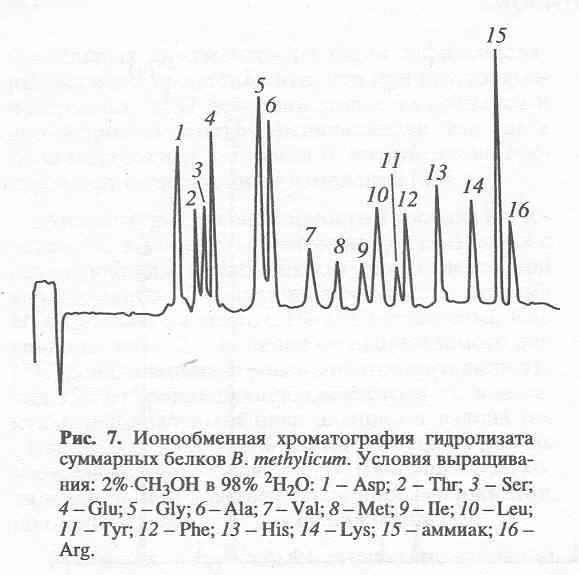
2Н- и 13С-меченные аминокислоты в составе гидролизатов белка биомассы были получены в условиях, аналогичных таковым для секретируемых аминокислот (табл. 4). Хотя в таблице 4 приведены данные только для 10 аминокислот, не вызывает сомнения, что в остальных аминокислотах уровни изотопного включения сопоставимы, хотя они не детектируются данным методом. Это предположение подтверждается данными по разделению белковых гидролизатов метилотрофных бактерий методом ионнообменной хроматографии, где детектируется уже 16 аминокислот (см. рис. 3).
Полученные данные свидетельствуют о возможности достижения максимальных уровней включения стабильных изотопов 2Н-и 13С в аминокислоты. Например, в случае с дейтерированными аминокислотами этого результата удалось достичь за счет адаптации культуры B. methylicum к росту и биосинтезу на среде с максимальной концентрацией 2Н>2>О. Как видно из табл. 4, при росте B. methylicum на данной среде, содержащей 98 об.% 2Н>2>О, уровни включения 2Н в остатки глицина, аланина, и фенилаланина составляют 90, 97,5, и 95% соответственно. Как и следовало ожидать, в этих условиях метка распределена равномерно по всем положениям углеродного скелета молекул аминокислот.
В экспериментах по получению аминокислот за счёт биоконверсии 13СН>3>ОН метилотрофными бактериями M. flagellatum была показана эффективность мечения аминокислот 13С. Так, в фенилаланине детектировалось 80,5 % метки, в аланине - 95 %, в глицине - 90% (см. табл. 4).
Таблица 4.
Уровни включения 2Н и 13С в аминокислоты общих белков биомассы B. methylicum и M. flagellatum (данные получены для Z-и Dns-производных аминокислот*).
|
Аминокислоты |
Содержание 2Н>2>О в среде, об% 24,5 49,5 73,5 98,0 |
1 % 13СН>3>ОН |
|||
|
Глицин |
15,0 |
35,0 |
50,0 |
90,0 |
90,0 |
|
Аланин |
20,0 |
45,0 |
62,5 |
97,5 |
95,0 |
|
Валин |
15,0 |
36,3 |
50,0 |
50,0 |
50,0 |
|
лейцин (изолейцин) |
10,0 |
42,0 |
45,0 |
49,0 |
49,0 |
|
фенилаланин |
24,5 |
37,5 |
50,0 |
95,0 |
80,5 |
|
тирозин |
20,0 |
48,8 |
68,8 |
92,8 |
53,5 |
|
Серин |
15,0 |
36,7 |
47,6 |
86,6 |
73,3 |
|
аспарагиновая кислота |
20,0 |
36,7 |
60,0 |
66,6 |
33,3 |
|
глутаминовая кислота |
20,0 |
40,0 |
53,4 |
70,0 |
40,0 |
|
Лизин |
10,0 |
21,1 |
40,0 |
58,9 |
54,4 |
*Данные по включению 2Н в аминокислоты приведены для B. methylicum при росте на средах, содержащих 2 об.% CH>3>OH и 24,5; 49,5; 73,5; 98,0 об.% 2Н>2>О.
Данные по включению 13С приведены для M. flagellatum при росте на среде, содержащей 1 об.% 13СН>3>ОН и 99 об.% Н>2>О.
Во всех экспериментах уровни включения 2Н и 13С в метаболически связанных аминокислотах обнаружили определённую коррелляцию. Так, уровни изотопного обогащения валина и лейцина, фенилаланина и тирозина совпадают (см. табл. 4). Уровни изотопного включения в глицине и серине, аспарагиновой и в глутаминовой кислотах также имеют близкие величины. Сравнивая данные таблицы 3 и 4 можно заключить, что уровни изотопного обогащения секретируемых аминокислот и соответствующих аминокислотных остатков суммарного белка в целом также коррелируют. Причина некоторых наблюдаемых расхождений в уровни включения изотопов в аминокислоты до конца не выяснена.
Как и в случае с секретируемыми аминокислотами, при росте бактерий на средах, содержащих 98 об.% 2Н>2>О или 1 об.% 13СН>3>ОН, низкие уровни включения 2Н- и 13С в остатки лейцина (изолейцина) и метаболически связанные с ним аминокислоты, обусловлены ауксотрофностью бактерий в лейцине (изолейцине).
Выделение изотопно-меченных аминокислот из культуральной жидкости и гидролизатов биомассы метилотрофных бактерий.
В ходе выполнения работы было проведено препаративное разделение аминокислот культуральной жидкости и гидролизатов биомассы метилотрофных бактерий методами обращенно-фазовой ВЭЖХ в виде бензилоксикарбонильных производных аминокислот. Так, дейтерий-меченный фенилаланин был выделен из культуральной жидкости В. methylicum методом обращённо-фазовой ВЭЖХ в виде Z-производного с хроматографической чистотой 99% и выходом 89%. Хроматографически чистые 2Н-и 13С-аминокислоты были выделены из гидролизатов биомассы B. methylicum и M. flagellatum в виде их Z-производных в миллиграммовых количествах [8]. Отдельные аминокислоты: фенилаланин и лейцин были также хроматографически выделены из культуральных жидкостей данных штаммов метилотрофных бактерий в виде метиловых эфиров дансил-аминокислот.
Ионнообменная хроматография аминокислот на колонке “Dowex” хорошо зарекомендовал себя как аналитический метод для изучения качественного и количественного состава белковых гидролизатов метилотрофных бактерий. Хроматограмма гидролизата суммарных белков B. methylicum, полученных при росте бактерий на среде, содержащей 98 об.% 2Н>2>О и 2 об.% С2Н>3>О2Н представлена на рис. 3. Как видно из рис.3, в этом гидролизате присутствуют 16 аминокислот. Поскольку пролин не детектируется в данных условиях его определяли при длине волны 440 нм.
Таким образом, проведённые исследования подтвердили эффективность использования метилотрофных бактерий для получения 2Н-и 13С- аминокислот. Предложенный подход предполагает комплексное использование метилотрофных бактерий, позволяя выделять аминокислоты как из культуральной жидкости после ферментации штаммов продуцентов, так и из гидролизатов суммарных белков биомассы.
ЛИТЕРАТУРА.
1. Patel G.B., Sprott G.D., Ekiel I. // Appl. Environ. Microbiol. - 1993. - V. 59. - N. 4. - P. 1099-1103.
2. John Colby, Howard Dalton. // Ann. Rev. Microbiol. - 1979. - V. 33. - P. 481-517.
3. Skladnev D.A., Baev M.V., Shilova S.Yu., et al. // Proceedings of 6th Europ. Conf. on Biomass for Energy. - Industry and Environment. - Athens. - 1991. - P. 47-51.
4. Katz J., and Crespi H. L. // Pure Appl. Chem. - 1972. - V. 32. - P. 221-250.
5. Crespi H. L. // Biosynthesis and uses of per-deuterated proteins. in: Synthesis and Applications of Isotopically labeled Compounds, Proceedings of the Second Inter. Symp. - Elsevier. - 1986. - P. 111-112.
6. Karnaukhova E.N., Reshetova O.S., Semenov S.Y., Skladnev D.A., Tsygankov Y.D. // Amino Acids. - 1994. - V. 6. - P. 165-176.
7. Мосин О.В., Карнаухова Е.Н., Пшеничникова А.Б.,Складнев Д.А., Акимова О.Л. // Биотехнология. - 1993. - N. 9. - С. 16-20.
8. Егорова Т.А., Мосин О.В., Еремин С.В., Карнаухова Е.Н.,Звонкова Е.Н., Швец В.И. // Биотехнология. - 1993. - N. 8. - С. 21-25.
9. Karnaukhova E.N., Mosin O.V., Reshetova O.S. // Amino Acids. - 1993. - V. 5. - P. 125.
10. Мосин О.В., Складнев Д.А., Егорова Т.А., Юркевич А.М., Швец В.И. // Биотехнология. - 1996. - N. 3. (в печати).
11. Миллер Дж. Эксперименты в молекулярной генетике. - М.: Мир, - 1976. - С. 393.
12. Звонкова Е.Н., Зотчик Н.В., Филлипович Е.И., Митрофанова Т.К., Мягкова Г.И., Серебренникова Г.А // Химия биологически активных природных соединений. - М.: Химия, 1970. - С. 65-68.
13. Bligh E.G., Dyer W.J. // Can. J. Biochem. Physiol. - 1959. - V. 37. - N. 8. - P. 911-918.
14. Егорова Т.А., Ерёмин С.В., Митснер Б.И., Звонкова Е.Н., Швец В.И. // Биотехнология. - N5. - 1993. - С. 30-35.
15. Egorova T.A., Eremin S.V., Mitsner B.I., Zvonkova E.N., Shvets V.I. // J. of Chromatography B. - 1995. - V. 665. - P. 53-62.
16. Daniely B. et al. // J. Org. mass spectrometry. - 1989. - 24. - P. 225-229.
О.V. MOSIN
Moscow State Academy of Fine Chemical Technology named after M.V. Lomonosov, 117571.
METHYLOTROPHIC BACTERIA - AS THE SOURCES OF ISOTOPICALLY LABELED 2H - AND 13C- AMINO ACIDS.
A possibility of using the various strains of methylotrophic bacteria for the preparation of amino acids labeled with stable isotopes 2Н и 13С, both secreted into culture medium and obtaining from protein hydrolysates is investigated. The data on adaptaition of L-phynylalanine producing strain of facultative methylotrophic bacteria Brevibacterium methylicum to growth media containing 2 v/v.% С2Н>3>О2Н and 98 v/v.% 2Н>2>О and biosynthesis of L-phenylalanine are presented. For L-leucine producing strain of obligate methylotrophic bacteria Methylobacillus flagellatum the cultivation was carried out on a medium containing the ordinary water and 1 v/v.% 13С>1>Н>3>ОН. The levels of 2Н- and 13С incorporation in amino acids were studied using the electron impact mass-spectrometry method of methyl esters of dansyl -and carbobenzoxychloride - derivatives of amino acids. The levels of 2Н- and 13C incorporation into amino acids while growing of methylotrophic bacteria on media containing 2 v/v CH>3>OH and 98 v/v.% 2Н>2>O, and 1 v/v.% 13CH>3>OH and 99 v/v. H>2>O were found to vary from 97,5% to 95%.