Мембранная энзимология
Мембранная энзимология
Введение
Биомембрана - это не просто некая пассивная структура, ограничивающая водные компартменты. Уже краткое знакомство с типами ферментов, связанных с мембранами, показывает, насколько разнообразны ассоциированные с мембранами каталитические активности.
Трансмембранные ферменты, катализирующие сопряженные реакции на противоположных сторонах мембраны. Типичные ферменты этого класса имеют несколько активных центров. Характерными примерами могут служить окислительно-восстановительные ферменты, например фотосинтетические реакционные центры растений и бактерий или цитохром с-оксидаза митохондрий. Расположенные на противоположных сторонах мембраны активные центры этих ферментов сопряжены друг с другом с помощью потока электронов, генерирующего трансмембранный электрический потенциал. К этому классу ферментов могут быть отнесены также многие рецепторы. Связывание лиганда с доменом, локализованным с наружной стороны клеточной мембраны, приводит к изменениям в цитоплазматическом домене фермента, которые в свою очередь инициируют клеточный ответ. В этом случае через мембрану переносится информация, а не заряды или какие-либо растворенные молекулы. Показано, что некоторые рецепторы являются тирозиновыми протеинкиназами и, следовательно, представляют собой мембранные ферменты, обладающие каталитической активностью. Большинство же мембранных рецепторов сами по себе не катализируют никаких химических реакций и не являются в этом смысле ферментами.
Трансмембранные ферменты, участвующие в транспорте веществ. Многие мембранные белки участвуют в транспорте молекул через бислой. Активный транспорт может быть сопряжен с гидролизом ATP, как в случае Са** - АТРазы саркоплазматического ретикулума. Движущей силой активного транспорта могут быть также ионные градиенты. Например, транспорт лактозы через плазматическую мембрану Е. coli с помощью лактозопермеазы сопряжен с поглощением протонов и зависит от трансмембранного градиента электрохимического потенциала.
Белки, являющиеся компонентами электронтранспортных цепей. Наиболее типичные ферменты этого класса - компоненты дыхательной цепи митохондрий, заканчивающейся, цитохром с-оксидазой; ферменты системы электронного транспорта микросом, включающие цитохром Р450 и цитохром bs; элементы фотосинтетической электронтранспортной цепи в тилакоидах. Локализация компонентов электронтранспортных цепей в мембране приводит к увеличению их локальной концентрации, что позволяет значительно ускорить перенос электронов между молекулами. Основной вопрос состоит в том, являются ли компоненты соответствующих электронтранспортных цепей свободно диффундирующими в плоскости мембраны белками или они находятся в мембране в виде более или менее долгоживущих суперкомплексов.
Ферменты, способные использовать мембраносвязанные субстраты. В этот класс могут входить ферменты, участвующие в метаболизме компонентов мембраны: фосфолипидов, гликолипидов, полиизопреноидных соединений и стероидов, а также ферменты, участвующие в процессинге мембранных и секреторных белков. В большинстве случаев эти ферменты являются интегральными мембранными белками, но иногда представляют собой растворимые белки, лишь временно связанные с мембраной. Примерами белков этого типа являются лидерная пептидаза из Е. coli и фосфолипаза С, связанные с мембраной посредством гликозилфосфа-тидилинозитольиого якоря.
Ферменты, использующие водорастворимые субстраты. Многие мембраносвязанные ферменты используют растворимые субстраты. В некоторых случаях фермент локализуется в такой области мембраны, где велика концентрация субстрата. Например, ацетилхолинэстераза, катализирующая гидролиз ацетилхолина, по-видимому, фиксируется в постсинаптической мембране с помощью ковалентной сшивки с фосфатидилинозитольным гликолипидом. Целый ряд ферментов, участвующих в гидролизе крахмала и белков, прикрепляется к мембранам микроворсинок кишечника с помощью гидрофобных доменов, расположенных в N-концевой части полипептидов. Вероятно, связь этих пищеварительных ферментов с мембраной позволяет создать локально высокую концентрацию растворимых молекул, что способствует их эффективному поглощению клеткой. В качестве примера можно привести два фермента из этой группы: сахараза-изомальтаза и мальтаза-глюкоамилаза.
Ферменты, образующие мембраносвязанный комплекс для облегчения канализации субстрата. Мембраны могут служить своеобразным организующим каркасом, с которым связываются периферические ферменты с образованием мультиферментного комплекса. Имеются косвенные данные о том, что участвующие в реакциях цикла Кребса ферменты матрикса митохондрий связываются с мембраной таким образом, что продукт одного фермента становится субстратом другого, не выходя за пределы мультиферментного комплекса. Такой механизм мог бы облегчить метаболические превращения. Поскольку ферменты в суперкомплексах связаны друг с другом слабыми связями, с определенностью продемонстрировать их существование довольно трудно.
Ферменты, которые совершают челночные перемещения между цитозолем и мембраной и активность которых модулируется связыванием с мембраной. Эта группа мембранных ферментов обнаружена недавно. Они способны связываться либо прямо с поверхностью фосфолипидного бислоя, либо со специфическими белковыми рецепторами. Чаще всего эти ферменты активируются при связывании с мембраной, но иногда наблюдается и их инактивация. Типичными примерами ферментов, активирующихся при связывании, являются пируватоксидаза из Е. cod, протеинкиназа С и некоторые ферменты, участвующие в каскаде свертывания крови.
В первую очередь следует отметить ключевую роль липидного окружения мембранных ферментов в проявлении их активности. Этот фактор может очень сильно усложнить интерпретацию кинетических данных и потребовать значительных экспериментальных усилий в реконструкции очищенных интегральных мембранных ферментов с фосфолипидами, с тем чтобы приблизить условия работы фермента к условиям in vivo или по крайней мере создать для фермента подходящее окружение.
1. Некоторые специфические положения, имеющие отношение к активности мембранных ферментов
Проблема изучения функционирования мембранных ферментов сводится по существу к проблеме гетерогенного катализа. Эти ферменты находятся не в непрерывной гомогенной среде, а локализованы в биомембране, мицелле, везикуле или иной мембранной системе. Мембранные ферменты весьма чувствительны к локальному окружению, которое, вообще говоря, может существенно отличаться от окружения в растворе. Более того, для осуществления каталитической реакции фермент и мембраносвязанный субстрат должны находиться в одной и той же мембране или. везикуле, поэтому при анализе кинетических свойств мембранных ферментов часто возникают проблемы, связанные с их пространственным разделением. Рассмотрим некоторые положения, касающиеся кинетических аспектов работы мембранных ферментов как in situ, так и в модельных системах.
1. Пространственное разделение фермента и субстрата. Фермент и субстрат должны иметь возможность взаимодействовать. Предположим, что мы изучаем очищенный интегральный мембранный фермент в растворе детергента с неполярным липофильным субстратом. И фермент, и субстрат солюбилизированы в детергентных мицеллах, но для того, чтобы мог осуществляться катализ, они должны находиться в одних и тех же мицеллах. При избытке детергента увеличивается вероятность того, что фермент и субстрат будут находиться в разных мицеллах, и лимитирующей стадией в этом случае станет диффузия субстрата в ферментно-детергентные мицеллы. При этом скорость работы фермента зависит от поверхностной концентрации субстрата в мицелле, а не от объемной концентрации. При работе с очень гидрофобными субстратами часто возникает другая проблема. Такие субстраты могут не до конца солюбилизироваться в мицеллах или мембранных везикулах, часть их коагулирует с образованием комков или микроскопических кристаллов, в которые фермент не проникает. Небольшое число ферментов может работать в вывернутых мицеллах, когда содержащие воду структуры диспергированы в органическом растворителе, но это скорее исключение, чем правило.
Иные проблемы при измерении активности мембранных ферментов возникают, когда либо фермент, либо субстрат находится как в мембраносвязанной, так и в растворенной формах. Примерами такого рода служат "поверхностные" ферменты - липазы или факторы свертывания крови. Для анализа кинетики таких систем необходимо знать соотношение между формами фермента в данных экспериментальных условиях и каталитические активности каждой из форм. Во всех этих случаях смысл величин максимальной скорости и константы Михаэлиса может быть совершенно иным, чем для ферментов, активность которых измеряется в гомогенной среде, что сильно осложняет интерпретацию этих параметров.
Гьстерезис и гетерогенность. Мембранные ферменты обладают и другими особенностями, затрудняющими интерпретацию кинетических данных. Эти особенности связаны с солюбилизацией. Каталитическая активность мембранных ферментов часто очень сильно зависит от используемого детергента или фосфолипида. Обычно активность мембранных ферментов измеряют в смеси, содержащей детергент и экзогенно добавленный фосфолипид. Кроме того, ферментный препарат нередко содержит соочищаемые с ним эндогенные липиды. В таких условиях физическое состояние фермента, в частности степень его агрегации, оказывается весьма неопределенным и скорее всего гетерогенным. Часто в одной и той же среде, компоненты которой смешивались в разной последовательности, получают совершенно разные ферментативные активности. Такая зависимость от предыстории препарата являет собой пример гистерезиса и весьма типична для мембранных ферментов. По существу фермент "застревает" в метастабильном состоянии и не может приобрести наиболее стабильную "рабочую конформацию". Например, простое смешивание солюбилизированного мембранного белка с фосфолипидными великулами скорее всего не приведет к встраиванию белка в липосомы. Для достижения успешной реконструкции разработаны специальные процедуры, позволяющие избежать перехода системы в нежелательное метастабильное состояние. В качестве примера фермента, образующего крупные агрегаты, можно привести бактопренолкиназу, очень гидрофобный белок из Staphylococcus aureus. Его активность не зависит от степени агрегации, что встречается далеко не всегда.
Явление гистерезиса сильно зависит от типа фосфолипида, поэтому данные по специфичности липидов в отношении активности отдельных мембранных ферментов часто оказываются весьма ненадежными.
Ферметы в везикулах. Часто в исследованиях используют мембранные ферменты, встроенные в бислой замкнутых везикул. Это могут быть либо ферменты in situ, содержащиеся в изолированных природных мембранах, либо очищенные ферменты, встроенные в липосомы. В таких экспериментах возникают свои проблемы. Наиболее очевидная из них связана с тем, что активный центр фермента может находиться внутри везикулы и, следовательно, быть изолированным от растворимого в воде субстрата. С этим связана проблема так называемой скрытой ферментативной активности, выявляемой только после того, как везикулы по тем или иным причинам станут проницаемыми или разрушатся. Это явление часто используют для определения ориентации мембранного фермента в везикуле. Доля скрытой активности прямо соответствует доле фермента, активный центр которого локализован внутри везикулы. При этом можно использовать только такие субстраты, которые не способны проникать через мембрану.
Проблемы другого рода возникают при измерении активности трансмембранных ферментов, которые катализируют реакции, сопровождающиеся транспортом веществ или зарядов через бислой. Примерами таких ферментов могут служить цитохром с-оксидаза, катализирующая перенос электронов через мембрану и транспорт протонов в противоположном направлении, а также разнообразные АТР-зависимые ионные насосы, например Са2 + - АТРа-зы. При встраивании в везикулы преимущественно в одной ориентации относительно внутренней и наружной сторон везикулы такие ферменты создают трансмембранный градиент концентрации веществ или электрический потенциал. Именно в этом и состоит их физиологическая функция. В везикулах с маленьким внутренним объемом, однако, этот градиент будет создаваться очень быстро, что приведет к фактическому уменьшению числа оборотов фермента, если не будут приняты соответствующие меры. Это уменьшение связано с тем, что химическая работа, совершаемая при переносе молекулы, иона или электрона против существующего градиента, увеличивается с увеличением этого градиента. При градиенте выше определенного уровня фермент вообще перестает работать. Система, в которой происходит такое уменьшение активности, называется "сопряженной", а сама эта активность является мерой того, насколько целостны везикулы и в какой мере предотвращена утечка ионов или молекул в направлении градиента, созданного с помощью фермента. Степень сопряжения можно оценить, измеряя активность фермента в условиях, когда градиенту не дают образовываться. Например, градиент электрического потенциала, создаваемый на мембране везикулы цитохром с-оксидазой, можно разрушить, добавив в среду ионофор, увеличивающий ионную проницаемость бислоя. При этом необходимо, чтобы внутри везикулы была высокая концентрация буфера, поскольку в противном случае утилизация протонов внутри везикулы с образованием воды приведет к быстрому и сильному защелачиванию внутренней среды, что может повлиять на ферментативную активность.
Работа некоторых ионных каналов и ферментов прямо регулируется трансмембранным потенциалом. С помощью флуоресцентных и спиновых меток показано также, что при наличии разности потенциалов может существенно увеличиваться микровязкость бислоя. Это тоже сказывается на активности ферментов. И наконец, утверждается, что трансмембранный потенциал влияет на степень агрегации некоторых мембранных белков, но физиологическая роль этого явления неизвестна. Все эти эффекты наблюдаются только на замкнутых везикулах.
Влияние поверхностного потенциала. Большинство биомембран содержат значительное количество отрицательно заряженных фосфолипидов, а следовательно, несут суммарный отрицательный заряд. С этим отрицательным зарядом, распределенным по поверхности мембраны, связан поверхностный электрический потенциал. Он вызывает уменьшение концентрации отрицательно заряженных ионов в прилегающем к мембране слое по сравнению со средней объемной концентрацией и увеличение локальной концентрации положительно заряженных ионов вблизи поверхности мембраны. Поверхностный потенциал, изменяя локальную концентрацию заряженных субстратов и протонов, может довольно существенным образом сказаться на поведении ферментов, активный центр которых локализован у поверхности мембраны. При физиологической ионной силе этот эффект будет проявляться главным образом в области, непосредственно примыкающей к заряженной поверхности мембраны, но тем не менее может оказаться весьма существенным. Влияние поверхностного потенциала проявляется в изменении измеряемой величины Км для заряженных субстратов или в сдвиге рН-зависимости активности фермента, поскольку локальная концентрация любого заряженного вещества будет либо выше, либо ниже, чем концентрация в объеме. Поэтому кинетические характеристики мембранного фермента, встроенного в везикулы, которые получены из разных фосфолипидов и имеют разную поверхностную плотность заряда, могут различаться, и в свою очередь отличаться от свойств фермента, находящегося в нейтральных детергентных мицеллах.
Подобные эффекты наблюдались для некоторых митохондриальных и микросомных ферментов - как in situ, так и встроенных в фосфолипидные везикулы, например для арилсульфатазы С, использующей отрицательно заряженный субстрат, или для моноаминооксидазы, катализирующей превращения катионного субстрата. Изменение липидного окружения /3-гидроксибути-ратдегидрогеназы также влияет на величины Км для NADH. Полагают, что это влияние обусловлено изменением плотности поверхностного заряда.
В заключение отметим, что в литературе активно обсуждалась роль поверхностного заряда тилакоидных мембран как фактора, регулирующего латеральное распределение мембранных белков и взаимодействие между мембранами. В этом случае, однако, поверхностный заряд мембраны определяется главным образом белковыми компонентами, а не липидами. Каж бы то ни было, ясно, что учет поверхностного потенциала совершенно необходим при анализе работы многих мембранных ферментов in vivo, а также при реконструировании систем из очищенных компонентов, моделирующих природные структуры.
2. Реконструкция мембранных ферментов
После того как мембранный фермент очищен, для изучения его каталитической активности желательно, а часто и необходимо реконструировать его с фосфолипидами. Кинетические характеристики многих ферментов in situ и после очистки и реконструкции одинаковы. Несмотря на то что свойства фермента в искусственных системах могут изменяться, изучение очищенных и реконструированных ферментов дает большие преимущества. В частности, а такой системе ие протекают различные конкурирующие реакции, присущие биомембранам. Удается устранить и другие осложняющие исследование проблемы. Использование реконструированной системы позволяет не только охарактеризовать изолированную систему, но и определить минимальное число компонентов, необходимых для проявления тех или иных биохимических активностей. С помощью реконструкции в фосфолипидные везикулы, например, было показано, что за поглощение лактозы клетками Е. coli ответствен только один белок, лактозопермеаза. Аналогичным способом было однозначно определено минимальное число белковых компонентов, необходимых для реконструкции дыхательной цепи Е. coli и системы аденилатциклазного гормонального ответа.
Для встраивания солюбилизированных в детергенте очищенных мембранных компонентов в модельные мембранные системы разработано несколько методов. Чаще всего ферменты встраиваются в однослойные фосфолипидные везикулы. Характеристики же белков, активно или пассивно увеличивающих ионную проводимость мембраны, часто определяют после их встраивания в плоский бислой. Плоские мембраны удобны для электрических измерений, позволяющих определить величину ионной проводимости и прочие производные характеристики, например зависимость доли открытых каналов от приложенного электрического напряжения. В таких системах, однако, трудно или даже невозможно определить биохимические характеристики белка, в частности его каталитические активности, отличные от ионной проницаемости.
2.1 Встраивание мембранных ферментов в липидные везикулы
Для встраивания мембранного белка в липидную везикулу прежде всего необходимо избавиться от находящегося в препарате белка детергента, который, если он присутствует в значительных количествах, дестабилизирует фосфолипидный бислой. Обычно детергент удаляют уже из смеси белка с фосфолипидом, но в некоторых случаях белок очищают от детергента до начала реконструкции. Для удаления детергента используют гель-фильтрацию, диализ или адсорбцию на поверхности шариков из полистирола. Последний способ применяют в первую очередь для удаления тритона Х-100. Все перечисленные методы довольно эффективны, однако следует иметь в виду, что даже после самых интенсивных обработок в системе обычно всегда остается то или иное количество связанного детергента.
Методы реконструкции можно разделить на две группы.
I. Процедуры, при которых белок предварительно очищают от детергента, а затем проводят реконструкцию.
II. Процедуры, в которых белки и фосфолипиды смешивают в присутствии детергента, а затем удаляют детергент до образования протеолипосом. Единственное ограничение здесь состоит в следующем: выбранный фосфолипид должен быть способен к формированию стабильных бислоев. Нельзя, например, использовать ненасыщенные фосфатидилэтаноламины. Весьма удобен суммарный фосфолипид из соевых бобов, поскольку он относительно недорог, легкодоступен и применим во многих случаях.
I. Реконструкция без избытка детергента
Условия включения мембранных белков в предварительно сформированные фосфолипидные везикулы часто совпадают с условиями, способствующими слиянию фосфолипидных везикул. В основе обоих процессов лежат определенные нарушения бислойной структуры, или образование "дефектов", которые могли бы облегчить как встраивание белка, так и слияние везикул. Механизмы этих процессов изучены мало. Возможной трудностью в применении этих методов является агрегация белка.
1. Инкубация белка с заранее полученными везикулами. Этот способ применим далеко не всегда и используется для реконструкции не пронизывающих бислой белков с ограниченной гидрофобной поверхностью, например цитохрома bs и /З-гидроксибутиратдегидрогеназы. Конформация встроенного таким образом белка, однако, отличается от нативной.
Реконструкция с участием амфифильных катализаторов. В ряде работ было показано, что добавление в белково-фосфолипидную смесь амфифильных веществ в низких концентрациях облегчает встраивание в везикулы таких мембранных ферментов, как бактериородопсин или цитохром с-оксидаза. В качестве амфифильных веществ использовали холестерол, короткоцепочечные фосфатидилхолины и жирные кислоты. Данный способ хорош тем, что в нем не используются какие-либо грубые процедуры, в том числе обработка избытком детергентов, однако пока он мало распространен.
Замораживание-оттаивание/обработка ультразвуком. В некоторых случаях с успехом используется метод замораживания-оттаивания смеси с последующей обработкой ультразвуком. Эта методика, однако, применяется нечасто из-за опасности денатурации белка. Иногда для облегчения реконструкции используют простую обработку ультразвуком. Вероятнее всего, белок вначале включается в маленькие везикулы, обладающие высокой кривизной. Замораживание-оттаивание, возможно, нужно для слияния мелких протеолипосом в более крупные и более однородные по размерам.
2. Реконструкция с использованием детергентов
В настоящее время для реконструкции гораздо чаще используют методики, состоящие в солюбилизации смеси белка и фосфолипида детергентом и последующем удалении детергента. После его удаления белок и фосфолипид спонтанно формируют однослойные везикулы, вполне пригодные для энзимологических исследований. Обычно выбирают детергенты с высокой критической концентрацией мицеллообразования и малыми размерами мицелл, с тем чтобы их можно было легко удалить диализом или гельфильтрацией. Чаще всего используют холат натрия и октилглюкозид. Распределение полученных везикул по размерам определяется соотношением детергент: фосфолипид, а также способом и скоростью удаления детергента. Обычно используют диализ как более медленный способ. В качестве примеров можно привести встраивание цитохром с-оксидазы и Na + /K+-ATPa3bi.
С помощью такой методики можно ввести в везикулы отличные от фосфолипидов вещества, например холестерол или убихинон. В ряде случаев возникает необходимость в достаточно быстром удалении детергента, особенно если белок нестабилен при его избытке. Тогда применяют гельфильтрационную хроматографию, тоже позволяющую эффективно отделить белково-липидные везикулы от детергента. На рис.1 показан профиль элюции с такой колонки.
Еще более быстрым является метод разведения, когда белково-липидно-детергентную смесь разводят до концентрации детергента много меньшей, чем критическая концентрация мицеллообразования. При этом спонтанно образуются белково-фосфолипидные везикулы, которые можно отделить от детергента центрифугированием.
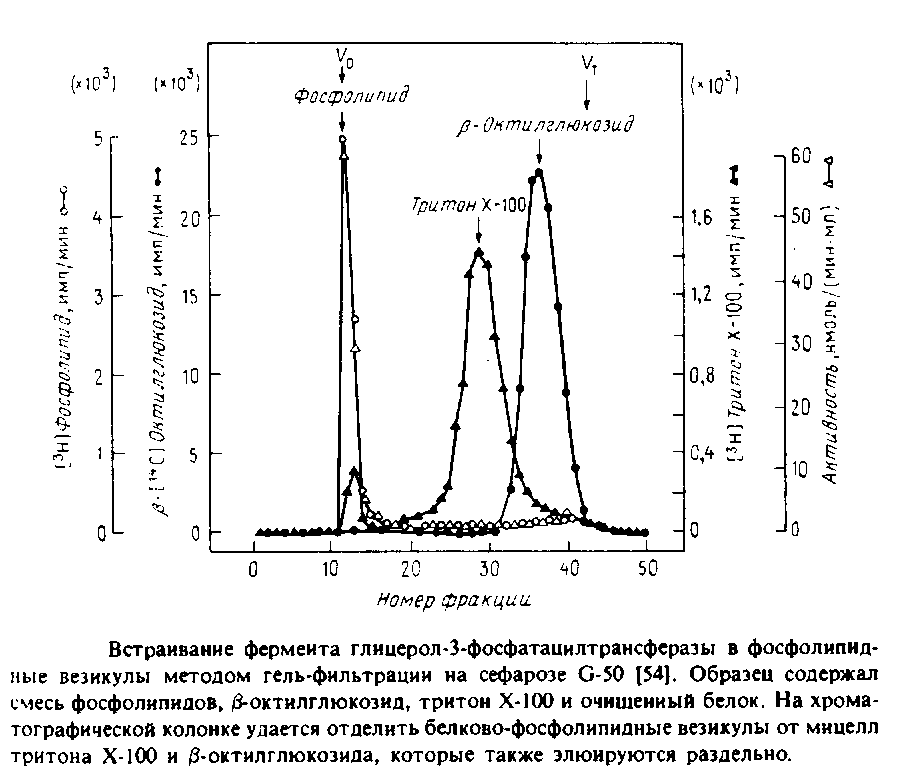
Обычно используемый для очистки мембранных ферментов тритон Х-100 весьма неудобен при реконструкции, поскольку его трудно Удалить из системы. Для удаления тритона применяют шарики из полистирола, и одна из проблем - потеря белка из-за его сорбции на поверхности шариков. В качестве примера белка, реконструируемого этим методом, можно привести натриевый канал.
И наконец, для реконструкции применяли метод, основанный на диспергировании смеси холестерол-фосфолипид-белок в диэтиловом эфире и последующем испарении обращенной фазы.
Однако маловероятно, что многие белки выдержат такую процедуру.
3. Некоторые характеристики реконструированных белково-фосфолипидных везикул
В результате применения всех методов, разработанных для реконструкции мембранных белков, образуются однослойные везикулы. Характеристики некоторых из них детально изучены. Это, в частности, протеолипосомы, содержащие цитохром с-оксидазу, Ыа + /К+-АТРазу, цитохром Ь>5> и гликофорин. Особый интерес представляют:
1) средний размер везикул и распределение их по размерам;
2) распределение белка в популяции везикул;
3) ориентация белка по отношению к плоскости бислоя;
4) проницаемость везикул. Эти характеристики особенно важны, если фермент катализирует трансмембранный перенос веществ или ионов. Для количественного анализа кинетики таких ферментов необходимо знать внутренний объем везикул, их проницаемость и распределение белка. Для ферментов, катализирующих векторные реакции, молекулы, которые имеют противоположную ориентацию и находятся в одной везикуле, будут работать "вхолостую", компенсируя друг друга при создании результирующего ионного градиента.
Размер везикул. Размер везикул сильно зависит от процедуры реконструкции. Для его определения лучше всего использовать методы электронной микроскопии или гельфильтрации. При удалении детергента диализом образуются протеолипосомы диаметром от 500 до 2500 А в зависимости от белка и используемого метода. При любом способе реконструкции размеры получаемых везикул варьируют в довольно широких пределах; протеолипосомы нужного диаметра можно затем отделить с помощью гельфильтрационной хроматографии.
Распределение белка. Когда при реконструкции используется диализ для удаления детергента из смеси, содержащей избыток ли-пида, распределение белка между полученными везикулами должно подчиняться распределению Пуассона. Однако на самом деле оно может зависеть от встраиваемого белка и методических деталей. Следует отметить, что при спонтанном встраивании в предварительно полученные липосомы некоторые белки включаются преимущественно в везикулы малых размеров. Цитохром bs, например, в 200 раз эффективнее встраивается в везикулы диаметром 200 А, чем 1000 А.
Ориентация белка. Этот вопрос важен с точки зрения энзимологии, поскольку белок, активный центр которого локализован внутри везикулы, может быть недоступен для субстрата. Как ни удивительно, многие ферменты, например цитохром с-оксидаза, Ыа + /К+-АТРаза, глицерол-3-фосфатацил-трансфераза, бактериородопсин, способны встраиваться в мембрану таким образом, что их активный центр с вероятностью 75-95Чо оказывается снаружи везикулы. Везикулы, содержащие цитохром с-оксидазу, с помощью ДЭАЭ-хроматографии удается разделить на две популяции: с активным центром, ориентированным внутрь, и с активным центром, ориентированным наружу. В принципе такой способ разделения пригоден и для других белков.
Причина такой асимметрии встраивания неизвестна. В некоторых случаях ориентированная наружу часть фермента имеет больший размер, а встраивание белка более массивной частью внутрь везикулы невыгодно. Поскольку преимущественная ориентация наблюдается и при встраивании белков в крупные липосомы, по-видимому, асимметрия встраивания не связана с кривизной везикулы, как в случае распределения липидов в везикулах малых размеров. Вероятно, важную роль играют какие-то кинетические факторы, однако их трудно оценить, поскольку неясна природа переходных состояний.
Нельзя не отметить также, что некоторые белки встраиваются в везикулы неправильным образом, т.е. в конформации, отличной от нативной. Наиболее типичный пример - цитохром bs, который в зависимости от метода реконструкции может находиться в одной из двух конформации. Такое поведение характерно также для компонента Н-2К главного комплекса гистосовместимости у мышей и, возможно, для белка оболочки бактериофага Ml 3. Все эти белки имеют один трансмембранный гидрофобный домен, и при некоторых условиях он включается в бислой в U-образной конфигурации, когда N - и С-концевые аминогруппы экспонированы наружу.
Проницаемость. Важность этой характеристики для ферментов, катализирующих перенос веществ или ионов через бислой, несомненна. Многие системы транспорта и ионные насосы изучали после встраивания их в протеолипосомы, и очевидно, что протеолипосомы, пригодные для таких исследований, должны обладать достаточно низкой проницаемостью. Присутствие белка обычно приводит к увеличению проницаемости везикул, но степень этого увеличения очень сильно зависит от выбора липида и от числа молекул белка на везикулу. Высказывалось предположение, что молекулы некоторых липидов благодаря их форме лучше упаковываются вокруг встроенных в бислой белков; тем самым сглаживаются дефекты структуры на границе белок-липид и уменьшается их проницаемость для растворенных веществ. Однако прямые доказательства по этому поводу отсутствуют.
3.1 Влияние липидов на активности мембраносвязанных ферментов
Каталитическая активность многих мембранных ферментов зависит от липидов. Липиды при этом могут выполнять две функции:
1) создавать необходимую среду;
2) действовать как аллостерический регулятор, модулирующий активность фермента. В первом случае липиды не только предотвращают денатурацию ферментов, но и облегчают взаимодействие ферментов друг с другом и с прочими мембраносвязанными компонентами, в частности с ли-пофильными субстратами. В качестве аллостерических эффекторов липиды обычно активируют фермент преимущественно путем стабилизации его в определенной конформации. В принципе две эти функции липидов совершенно различны, однако разграничить их экспериментально бывает крайне трудно. В идеальной экспериментальной системе аллостерическим эффектором должен быть специфический липид, а необходимое для работы окружение фермента должно создаваться всей основной массой липидов в бислое. К сожалению, пока обнаружен только один пример абсолютной специфичности фермента к определенному липиду. /З-Гидроксибутиратде-гидрогеназе для проявления каталитической активности необходим именно фосфатидилхолин, в большинстве же случаев ферменты достаточно эффективно активируются различными липидами. А поскольку любой липид может в той или иной степени выполнять как функцию окружения, так и функцию специфического аллостерического эффектора, различить эти два эффекта становится практически невозможно. На ферментативную активность может влиять также физическое состояние бислоя, в частности поверхностная плотность заряда и вязкость. Систематически подбирая липиды разной структуры и изменяя физическое состояние мембраны, можно установить корреляции между активностью фермента и этим" параметрами, но само по себе такое исследование еще не позволяет разграничить две функции липидов. Изменение физического состояния бислоя может влиять на взаимодействие с ферментом любых липидов, в том числе и тех, которые функционируют как аллостерические эффекторы. При изучении ферментов, субстратом которых служат липофильные соединения, возникают особые проблемы, поскольку такие субстраты должны быть включены в бислои до или после получения везикул, а большие концентрации растворенного в бислое субстрата не могут не сказаться на физическом состоянии модельной мембраны.
Для исследования влияния липидов на мембранные ферменты применяется еще одна стратегия - так называемый метод смешанных мицелл. Фермент растворяют в детергенте, не активирующем его, и к смеси добавляют липиды. Многие мембранные ферменты сохраняют определенную активность и в детергенте, причем такая активность сильно зависит не только от природы фермента, но и от выбранного детергента, а также, возможно, от наличия эндогенных липидов в препарате очищенного фермента. Вообще говоря, для метода смешанных мицелл желательно полностью освободить фермент от липида, однако для этого иногда приходится использовать весьма грубые процедуры, которые могут привести к денатурации белка. Методы полного обезжиривания обычно основаны на пропускании препарата фермента через среду с большим избытком детергента. Для этого используют гель-фильтрацию, центрифугирование в градиенте плотности сахарозы или связывание фермента с каким-либо твердым носителем с последующим промыванием избытком детергента.
Метод смешанных мицелл имеет еще и то преимущество, что липофильный субстрат можно добавить в мицеллах того же детергента, хотя в этом случае могут возникнуть трудности, связанные с пространственным разделением фермента и субстрата. Наблюдаемые в такого рода системах эффекты липидов являются преимущественно аллостерическими, поскольку здесь нет бислоя, а связывание липидов с белком происходит в глобулярной мицелле в присутствии большого количества детергента. К сожалению, физическое состояние комплекса фермент-детергент-фосфолипид определить практически невозможно, и это серьезный недостаток описываемого подхода.
Любые эффекты, наблюдаемые в такой системе для какого-либо липида, должны быть получены с использованием нескольких не активирующих фермент детергентов. Только в этом случае можно быть уверенным, что детергент нейтрален. К сожалению, такие работы встречаются не часто.
Результаты исследования многих систем позволяют сделать несколько общих выводов.
Для активации фермента очень редко бывает необходим липид с какой-то строго определенной структурой. Безусловно, одни липиды активируют данный фермент с большей эффективностью, чем другие, однако такое предпочтение может зависеть от условий измерения, а уж говорить о его физиологическом значении как минимум преждевременно. Вполне может оказаться, что липид, с высокой эффективностью активирующий фермент, вообще не присутствует в мембране, из которой этот фермент выделен. Поэтому к утверждениям о специфичности липида следует относиться с. осторожностью.
Измеряемая в системе со смешанными мицеллами зависимость скорости ферментативной реакции от концентрации липида обычно свидетельствует о высокой кооперативности процесса. Такое поведение можно объяснить, в частности, тем, что липиды связываются некооперативио с несколькими эквивалентными центрами на ферменте, но активными являются только те молекулы фермента, у которых занята большая часть липидсвязывающих центров. Нередко при активации фермента липидом наблюдается оптимум в концентрационной зависимости, вероятно связанный с достижением определенного соотношения между липидом и детергентом и образованием в такой смеси конкретных структур.
Сама по себе бислойная структура не является необходимой для активации ферментов, поскольку многие ферменты проявляют активность в присутствии детергента или в составе липидио-детергентных мицелл. Известны случаи, когда мембранные ферменты эффективно активируются липидами, вообще не формирующими стабильные бислои.
Важным параметром, определяющим активность большинства мембранных ферментов, безусловно является физическое состояние бислоя. Однако четких данных о физиологической регуляции ферментативной активности с помощью этого параметра in vivo нет. При переходе липидов в фазу геля многие ферменты становятся неактивными либо их активность резко уменьшается. В литературе есть масса примеров, когда изменения скорости работы фермента с температурой коррелировали с изменением физического состояния липидов. В этих работах основное внимание обращалось на корреляцию между точками перегиба в температурных зависимостях ферментативной активности и какой-либо характеристикой, отражающей физическое состояние липида. Выявить связь ферментативной активности с вязкостью мембраны, исходя из температурной зависимости, весьма непросто, поскольку температура влияет одновременно на очень многие параметры. Следует иметь в виду, что вязкость мембраны в значительной степени коррелирует с плотностью упаковки молекул липида в бислое, и индуцируемые температурой изменения вязкости можно объяснить в основном изменениями в плотности упаковки. Существует очень немного примеров четкой линейной корреляции между активностью фермента и вязкостью мембраны. Неясно, правда, как интерпретировать эту корреляцию с точки зрения механизма ферментативной реакции. И лишь в нескольких работах содержатся указания на то, какая или какие из стадий ферментативной реакции являются лимитирующими и модулируются связыванием липида. В связи с этим необходимо упомянуть, что липиды могут сильно влиять не только на максимальную скорость, но и на связывание фермента с субстратами и кофакторами.
Вообще говоря, при исследовании взаимодействия с определенным ферментом большого числа разных липидов корреляции между активностью фермента и каким-либо одним параметром не наблюдается. Пока липид находится в жидкокристаллическом состоянии, для ферментативной активности часто более важна структура полярной головки липида, чем вязкость бислоя. Другими словами, важна химическая структура индивидуальных липидов, а почему - это уже отдельный вопрос.
4. Некоторые примеры липидзависимых ферментов
Рассматриваемые ниже пять ферментов выбраны в качестве примеров потому, что, во-первых, они лучше всего изучены и охарактеризованы; во-вторых, они охватывают несколько типов мембранных ферментов; в-третьих, они могут служить иллюстрацией нескольких основных проблем, возникающих при исследовании липидзависимой активации.
4.1 0-гидроксибутиратдегидрогеназа
Это один из наиболее хорошо изученных активируемых липидом ферментов и единственный фермент, обладающий абсолютной специфичностью к определенному липиду: активировать БДГ способен только фосфатидилхолин. БДГ локализуется на внутренней поверхности внутренней митохондриальной мембраны и катализирует окисление /3-гидроксибутирата с помощью NAD+. Оба субстрата водорастворимы. Молекулярная масса субъединицы фермента равна 31 кДа, но ее аминокислотная последовательность до конца не установлена. БДГ скорее всего не является трансмембранным белком. Получаемый после очистки фермент свободен от фосфолипида и детергента и способен спонтанно встраиваться в фосфолипидные везикулы. Хотя БДГ связывается и с везикулами, не содержащими Фосфатидилхолина, каталитическую активность фермент начинает проявлять только в присутствии фосфатидилхолина. При встраивании фермента в везикулу, по-видимому, происходит не только взаимодействие с поверхностью мембраны, но и значительное погружение белка в бислой, а также изменения конформации белка. Кинетические свойства фермента и его тетрамерной формы одинаковы в митохондральной мембране и после реконструкции с митохондриальными липидами.
На Рис.6.2 приведена кривая активации БДГ фосфолипидными везикулами, содержащими разное количество фосфатидилхолина. Во всех случаях фермент встроен в липосомы. Зависимость скорости ферментативной реакции от содержания фосфатидилхолина в бислое указывает на высокую кооперативность процесса, в котором участвуют два необходимых для активации липидсвязывающих центра.
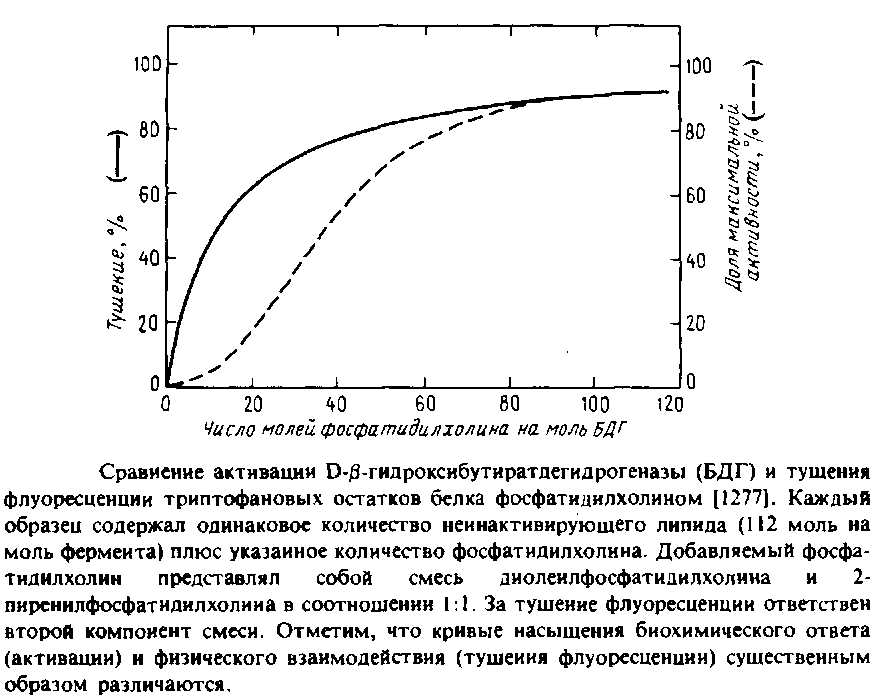
Кроме того, по данным о тушении флуоресценции триптофана производными фосфатидилхолина отдельно была определена доступность молекул фосфатидилхолина для БДГ. Степень тушения флуоресценции фактически является мерой связывания липида. Оказалось, что фосфатидилхолин связывается некооперативно с примерно 12 центрами в молекуле фермента. Такое некооперативное связывание с довольно большим числом центров весьма типично для мембранных белков в бислое. Кроме того, основная часть флуоресценции тушится при более низких концентрациях фосфатидилхолина, чем необходимо для активации. Такое расхождение между связыванием липида и активацией фермента можно объяснить, если предположить, что в активации участвует только очень небольшая часть центров, которые не удается выявить в экспериментах по тушению флуоресценции. Приведенные результаты интересны еще и тем, что позволяют сопоставить физическое взаимодействие определенного липида и фермента с биохимическим ответом.
Интерпретация результатов таких экспериментов осложняется тем, что активность фермента может сильно зависеть от степени его агрегации, т.е. активность фермента в различных липидах, по-видимому, будет соответствовать степени его дезинтеграции. БДГ замечателен еще и тем, что это один из немногих ферментов, активируемых короткоцепочечными гомологами фосфатидилхолина, которые связываются с ферментом и активируют его в концентрациях ниже критической концентрации мицеллообразования. Эти данные тоже подтверждают, что в активацию липидом вовлечено только небольшое число центров связывания на белке.
4.2 Пируватоксидаза
Эта флавиносодержащая дегидрогеназа из Е. coli, катализирующая окисление пирувата до уксусной кислоты и СОг и восстановление убихинона в цитоплазматической мембране, обеспечивает поступление электронов в аэробную дыхательную цепь. Фермент обладает рядом замечательных особенностей. Он растворим в воде и не проявляет никаких характерных для мембранного белка свойств. Однако в присутствии субстрата и кофактора происходит изменение конформации белка, в результате чего формируется центр связывания с мембраной. В этих условиях резко возрастает сродство фермента к детергентам и фосфолипидным везикулам, и белок по своим свойствам становится похож на истинный мембранный фермент. Пируватоксидаза может служить примером фермента, который является цитоплазматическим, пока субстрата мало, но превращается в мембранный, как только концентрация субстрата становится достаточно высокой.
Наибольший интерес при исследовании этого фермента представляла его эффективная активация липидами. Активность фермента можно измерить, используя вместо природного мембраносвязанного акцептора - убихинона какой-либо растворимый в воде искусственный акцептор электронов, например феррицианид. В присутствии липидов каталитическая активность пируватоксидазы возрастает до 50 раз. В отличие от /3-гидроксибутиратдегидрогеназы этот фермент активируется самыми разнообразными фосфолипидами и детергентами. В концентрациях ниже критических концентраций мицеллообразования фермент полностью активируется как анионными, так и катионными детергентами, а исследование связывания детергентов показывает, что в активации участвует очень небольшое число центров связывания. Связывание фермента с фосфатидилхолиновыми везикулами или детергентами не происходит до тех пор, пока не добавлены субстрат и кофактор. В присутствии субстрата и кофактора пируватоксидаза способна связываться и активироваться разнообразными везикулами, полученными из целого ряда фосфолипидов. Связывание происходит в первую очередь за счет гидрофобных, а не электростатических взаимодействий. Связывание липида и активация в случае пируватоксидазы, по-видимому, неразделимы, хотя и не все везикулы связываемого фосфолипида или амфифильного соединения ответственны за активацию фермента. Активация липидами вызывает изменения в спектре поглощения связанного флавина, вероятно, вследствие облегчения реакции переноса электронов.
Конформационные изменения в молекуле пируватоксидазы приводят не только к образованию липидсвязывающего домена, но и к появлению чувствительного к протеазам участка цепи вблизи С-конца. Протеолиз подавляет связывание липидов, но, как это ни удивительно, вызывает активацию фермента в отношении реакции восстановления водорастворимых искусственных акцепторов электронов. Активированный протеазами фермент, однако, уже не может восстанавливать мембраносвязанный убихинон, поскольку утрачивает способность связываться с мембраной.
Как показывают результаты клонирования и секвенирования гена, кодирующего пируватоксидазу, аминокислотная последовательность белка не имеет протяженных гидрофобных участков. Генетические исследования, а также данные по протеолизу показали, что за связывание липида ответствен участок полипептида, локализованный вблизи С-конца. В этом участке имеется короткая потенциально амфифильная а-спираль, которая и может участвовать в связывании с поверхностью бислоя. Получен мутантный штамм Е. coli, у которого пируватоксидаза лишена последних 24 аминокислотных остатков. Такой фермент полностью неактивен in vivo, но in vitro успешно катализирует реакцию с водорастворимым акцептором электронов. Предположительно такой мутантный вариант пируватоксидазы не способен связываться с мембраной даже при высоких концентрациях субстратов, а значит, не может осуществлять катализ, поскольку для этого фермент должен окисляться убихиноном. Приведенное исследование является хорошим примером того, как данные по связыванию липида и активации, полученные in vitro, могут с успехом применяться для объяснения механизма функционирования фермента в клетке.
И пируватоксидаза, и /3-гидроксибутиратдегидрогеназа могут активироваться либо 1) при связывании с небольшим числом молекул амфифильного соединения, либо 2) при связывании с поверхностью бислоя. В последнем случае некоторая часть белка проникает в глубь мембраны. Оба рассмотренных примера четко иллюстрируют роль фосфолипидов как аллостерических регуляторов.
4.3 Са2 + - АТРАза
Если предыдущие два примера иллюстрируют роль липидов как аллостерических эффекторов мембранных белков, то Са2 + - АТРаза и еще два фермента, рассмотренные ниже, являются примерами ферментов, на активность которых влияют структура липида и физическое состояние бислоя. Выделенная из саркоплазматического ретикула скелетных мышц Са2+ - АТРаза состоит из единственной полипептидной цепи с мол. массой 115 кДа. Фермент осуществляет активный транспорт Са2+ внутрь саркоплазматического ретикулума, уменьшая тем самым концентрацию Са2 + в цитоплазме во время релаксации мышцы. На каждую гидролизованную молекулу АТР через мембрану переносятся два иона Са2 +, и реакция является электрогенной, т.е. перенос зарядов через бислой создает трансмембранный электрический потенциал. По результатам секвенирования соответствующего гена установлена аминокислотная последовательность белка. Предполагается, что полипептид имеет 10 трансмембранных спиральных участков.
В мембране саркоплазматического ретикулума фермент, по-видимому, образует димеры, но мономерная форма в мицеллах детергента сохраняет основные кинетические свойства. С помощью процедуры дезоксихолатного диализа очищенная Са2 + - АТРаза может быть успешно встроена в везикулы. В некоторых препаратах реконструированный фермент образует более крупные агрегаты, чем димеры, хотя физиологическое значение этого процесса неясно.
В ряде лабораторий изолированный фермент был полностью обезжирен и реконструирован с целым рядом липидов и липидных смесей. На Рис.6.3 представлена зависимость активности АТРазы от количества связанного с ферментом липида в отсутствие детергентов. Из приведенных данных видно, что для полной активации на одну молекулу АТРазы должно приходиться 30 молекул фосфолипида; этого количества, по оценкам, достаточно, чтобы образовать вокруг каждой молекулы белка фосфолипидный монослой. Столь прямолинейная интерпретация этих данных, по-видимому, неправомочна, поскольку нам неизвестно физическое состояние такой смеси.
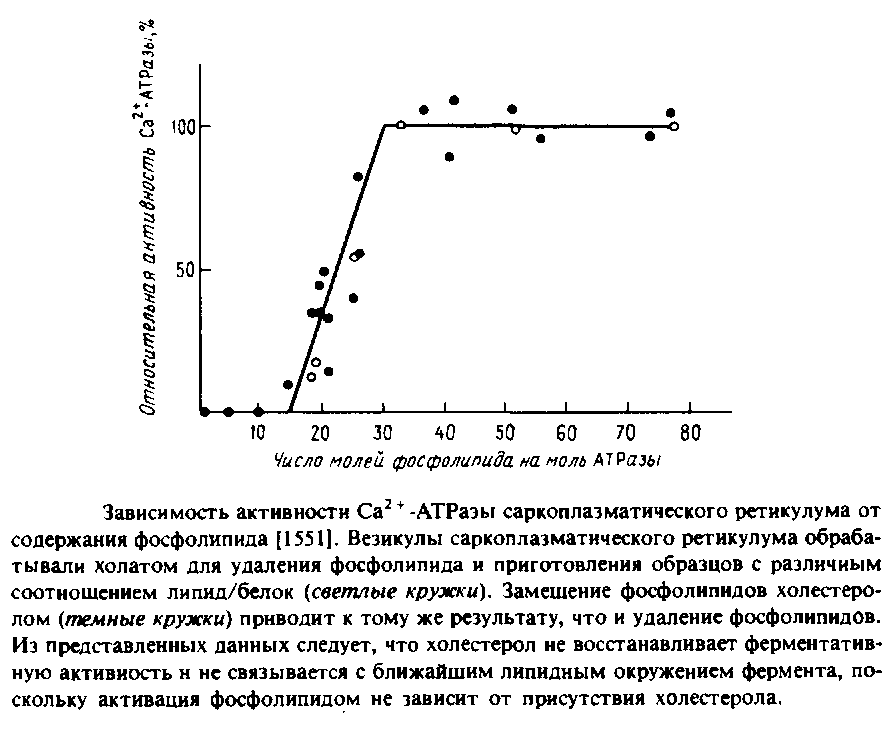
На основании результатов этой работы была предложена концепция пограничных, или аннулярных, липидов, т.е. липидов, непосредственно граничащих с белком. Критическим фактором, определяющим ферментативную активность, согласно этой концепции, должен быть липидный состав этого аннулярного слоя. Отсутствие влияния холестерола, включенного в фосфолипидно-белковые комплексы, предполагает, что холестерол не включается в аннулярный слой, однако соответствующие данные по связыванию холестерола показали, что это не так. Вообще говоря, на основании одних лишь кинетических данных понять механизм связывания липида довольно трудно.
В нескольких работах было достоверно доказано, что выше температуры фазового перехода липида отсутствует корреляция между вязкостью или параметром упорядоченности бислоя и ферментативной активностью. В регуляции ферментативной активности более важную роль, безусловно, играет структура самого липида, чем любой отдельно взятый параметр, отражающий физическое состояние бислоя. Но почему одни липиды активируют встроенные в везикулы ферменты лучше, чем другие, пока неизвестно.
4.4 Na+/K+ATPA3a
Этот фермент катализирует АТР-зависимый транспорт ионов Na+ и К+ через плазматическую мембрану животных клеток. На каждую молекулу гидролизованного АТР из клетки выводятся три иона Na + и поступают два иона К +. Фермент является электрогенным ионным насосом, генерирующим трансмембранный потенциал. Na +/К +-АТРаза выделена в чистом виде из нескольких источников. Она всегда состоит из двух суъединиц: большой каталитической субъединицы и малой, представляющей собой гликопротеин. Функция /3-субъ-единицы неясна. Полные аминокислотные последовательности обеих субъединиц известны для Na+/К+-АТРазы из почек овцы и из электрического органа ската Torpedo californica. Каталитическая субъединица гомологична Са + - АТРазе и также образует значительное число трансмембранных спиральных участков. /З-Субъединица, по-видимому, также пересекает мембрану; вероятно, трансмембранным является и единственный спиральный сегмент.
Функционирующей формой фермента, по-видимому, является либо гетеродимер а/3, либо тетрамер г; исследователи пока не пришли к единому мнению относительно минимальной единицы, необходимой для ионного транспорта. Очищенный фермент удается реконструировать с целым рядом фосфолипидов, но для восстановления активности наиболее эффективны фосфатидилсерин и фосфатидилглицерол. Причина этого неясна, но показано также, что фермент в бислое несколько лучше связывается с кислыми фосфолипидами. Липидное окружение влияет не только на каталитическую активность, но и на чувствительность фермента к специфическому ингибитору уабаину.
Для реконструкции Na+ /К + - АТРазы в первую очередь важна структура полярных головок фосфолипидов, но определенную роль, по-видимому, играет и вязкость бислоя. Об этом свидетельствуют результаты экспериментов по изменению с увеличением гидростатического давления вязкости липидов в содержащих фермент препаратах плазматической мембраны. Высокое давление стабилизирует систему в конфигурации с минимальным объемом. Поэтому с увеличением гидростатического давления свободный объем и вязкость бислоя уменьшаются. Как видно из рис, 6.4, между ферментативной активностью и вязкостью мембраны, измеряемой по степени анизотропии флуоресценции мембранных зондов, наблюдается четкая корреляция. Авторы полагают, что изменение свойств бислоя при повышении давления приводит к стабилизации определенных конформационных состояний фермента в ходе каталитического цикла, что влияет на лимитирующую стадию суммарной реакции.

Нельзя, однако, исключить и иное объяснение: давление влияет на фермент прямо, а не опосредованно через липид. Впрочем, эти эксперименты важны уже тем, что показывают возможность изменения физического состояния мембраны под действием гидростатического давления.
4.5 Переносчик глюкозы
Поразителен, однако, тот факт, что на максимальную скорость работы этого переносчика вообще не влияет температурный фазовый переход липида из жидкокристаллического состояния в гель.
5. Мембраносвязанные электротранспортные цепи
В большинстве работ, посвященных мембранным ферментам, исследовались компоненты различных мембранных систем электронного транспорта. Эти системы выполняют весьма важные биохимические функции, а их компоненты содержат окрашенные простетические группы, что позволяет следить с помощью спектрофотометрического метода за кинетикой их редокс- или конформационных превращений как в нативной мембране, так и после выделения и очистки отдельных ферментов. Здесь мы рассмотрим четыре основные злектронтранспортные системы, схематически изображенные на рис. 5. Это:
1) участвующая в биосинтезе стероидов, содержащая цитохром Р450 система митохондрий коры надпочечников;
2) система микросомного окисления, включающая множество цитохромов Р450, а также цитохром bs \ 3) дыхательная цепь митохондрий;
4) фотосинтетическая система тилакоидов зеленых растений. Все четыре системы являются основными белковыми компонентами мембран, в которых они локализованы, и могут служить иллюстрацией различных уровней организации мультиферментных комплексов в мембранной энзимологии. Первые две системы катализируют анаболические и катаболические реакции, протекающие в присутствии молекулярного кислорода и обычно липофильных мембраносвязанных субстратов. Терминальные ферменты этих электронтранспортных цепей, цитохром Р450 и десатураза жирных кислот, характеризуются очень низким числом оборотов. Системы и являются основными электронтранспортными ансамблями энергетического обмена, первичная функция которых состоит в переносе протонов через мембрану. Генерируемый при этом градиент электрохимического потенциала протонов используется для синтеза АТР. В отличие от микросомной и митохондриальной систем цитохрома Р450, дыхательная и фотосинтетическая цепи катализируют трансмембранные реакции и характеризуются довольно высоким числом оборотов, 200-300 с " 1. В приведенном ниже кратком обзоре основное внимание обращается на частные вопросы, интересные с точки зрения энзимологии, отмечаются некоторые общие черты, а также представляющие особый интерес дискуссионные моменты.
При рассмотрении любой из этих систем, естественно, возникает вопрос: до какой степени могут взаимодействовать друг с другом различные мембраносвязанные компоненты этих электронтранспортных цепей, с тем чтобы образовались долгоживущие комплексы? Теоретическое рассмотрение вероятности ассоциации мембранных белков показывает, что наиболее важны следующие факторы:
1) высокая концентрация реакционноспособных белков из-за ограниченности мембранного пространства;
2) заранее заданная ориентация белков, поскольку они могут вращаться лишь в плоскости, параллельной плоскости мембраны; вращение перпендикулярно поверхности бислоя запрещено;
3) исключенный объем, связанный с наличием в мембране других белков, что приводит к еще большему концентрированию компонентов этих систем.
5.1. Система синтеза стероидов в митохондриях
Выделяемые надпочечниками стероидные гормоны, такие, как кортизон, синтезируются из холестерола в ходе реакций, катализируемых ферментами, которые локализованы в митохондриях и эндоплазматическом ретикулуме. При этом промежуточные продукты метаболического пути должны "курсировать" между данными органеллами. Реакции катализируются мембраносвязанными гемсодержащими белками - цитохромами Р450. Название этой большой группы ферментов связано с тем, что максимум их поглощения приходится на длину волны 450 нм. Эти ферменты являются оксидазами со смешанной функцией; в катализируемой ими реакции происходит расщепление молекулы кислорода, при этом один атом кислорода включается в состав молекулы воды, второй - в субстрат. В биосинтезе стероидов участвуют четыре цитохрома Р450. Два находятся в митохондриях, два - в эндоплазматическом ретикулуме ткани. Необходимые для реакции электроны поступают в систему через относительно простую электронтранспортную цепь.
В митохондриях коры надпочечников источником электронов для синтеза гормонов является NADPH, который восстанавливает флавопротеин и ферредоксин. Эти белки локализованы на матриксной стороне внутренней митохондриальной мембраны. Два цитохрома Р450, P450>scc> и Р450п#, являются интегральными мембранными ферментами, способными взаимодействовать с мембраносвязанными субстратами. Адренодоксин-редуктаза, возможно, частично погружена в бислой, но легко отделяется от мембраны. Адренодоксин - это низкомолекулярный рао" творимый белок, он переносит электроны от флавопротеи" на к цитохромам Р450. Взаимодействие адренодоксина с редуктазой и цитохромами Р450 осуществляется главным образом с помощью ионных взаимодействий. Вероятно, с обоими реакционными партнерами адренодоксин связывается с помощью одного и того же домена. Такой же способ передачи электронов между двумя мембранными ферментами при участии небольшого растворимого белка можно обнаружить и в дыхательной, и в фотосинтетической электронтранспортных системах. Связывание стероидных субстратов с цитохромами Р450 можно зарегистрировать по изменениям в спектре поглощения гема. Холе-стеролсвязывающий центр, по-видимому, экспонирован в гидрофобную область липидного бислоя. Показано также, что связывание холестерола более чем в 10 раз увеличивает сродство адренодоксина к цитохрому Р450.
Число оборотов адренодоксина гораздо выше, чем двух указанных ферментов, поэтому одна молекула восстановленного адренодоксина может обеспечить электронами несколько молекул цитохрома Р450. Указанная на Рис.6.5 стехиометрия компонентов при условии, что лимитирующим является функционирование цитохромов Р450, создает своеобразный эффект электронного каскада. Очевидно, что при таких обстоятельствах три компонента этой простой системы не смогут образовать единый суперкомплекс, да и вряд ли формирование такого комплекса способствовало бы эффективному переносу электронов по цепи.
5.2 Микросомные электронтранспортные цепи
Электронтранспортные цепи, локализованные на цитоплазматической поверхности эндоплазматического ретикулума, участвуют также в метаболических превращениях липофильных субстратов. Как видно из Рис.6.5, существуют две такие системы, но, как недавно выяснилось, они не являются независимыми. В одной системе NADH окисляется флавопротеином цитохром fts-редуктазой, которая в свою очередь через цитохромы восстанавливает стеарил-СоА-десатуразу. В микросомах печени десатураза является индуцибельным ферментом. Вторая система включает в себя окисление NADPH другим флавопротеином, цитохром Р450-редуктаз<цй, которая затем передает электроны на целое семейство цитохромов Р450. Одни из этих цитохромов также являются индуцибельными, другие - конститутивными. Отметим, что в обеих системах число терминальных ферментов значительно превышает число редуктаз в начале каждой цепи. Как и в Р450-содержащей системе митохондрий, число оборотов терминальных ферментов настолько мало, что небольшое число редуктаз вполне успевает обеспечить восстановительными эквивалентами все молекулы терминальных ферментов. Микросомная система не содержит каких-либо растворимых белковых компонентов, аналогичных адренодоксину; все ферменты представляют собой интегральные мембранные белки, их можно выделить из мембраны, очистить и исследовать в реконструированном виде.
В серии обстоятельных работ Штритматтер с коллегами четко показал, что цитохром />5-редуктаза и цитохром bs распределены в мембране случайным образом и взаимодействуют благодаря диффузии: эти два фермента диффундируют латерально по поверхности мембраны, а перенос электронов происходит только во время их случайных столкновений. Такой механизм реализуется как в реконструированных протеолипосомах, так и в микросомной мембране. Диффузия, однако, не является лимитирующим процессом. В норме в системе имеется десятикратный избыток цитохрома bs над редуктазой. Такой избыток связанного с мик-Росомной мембраной экзогенного цитохрома bs кинетически эквивалентен эндогенному пулу цитохромов bs. И цитохром bs, и цитохром 65-редуктаза являются двухдоменными белками, в которых глобулярный растворимый домен связывает простетическую группу, а единственный гидрофобный хвост заякоривает белок в мембране. Гемсвязывающий и флавинсвязывающий домены сконструированы таким образом, чтобы облегчить перенос электрона от флавина к гему при взаимодействии этих белков.
В более поздних исследованиях, однако, были получены серьезные указания на то, что часть цитохрома bs в микросомах не диффундирует свободно, а по крайней мере временно образует стехиометрические комплексы с цитохромами Р450 и, возможно, с NADPH-цитохром Р450-редуктазой. Таким образом, цитохром bs играет важную роль в работе электронтранспортной цепи, включающей по крайней мере некоторые изоформы цитохрома Р450 из микросом печени.
Различные цитохромы Р450 в микросомах печени окисляются целым рядом эндогенных липофильных субстратов, а также чужеродных молекул. Если исходить из первичной структуры изоформ цитохромов Р450, то эти белки должны иметь множество трансмембранных сегментов, однако экспериментальные исследования показывают, что, по-видимому, ферменты заякорены в микросомной мембране с помощью единственного трансмембранного спирального домена, расположенного ближе к N-концу полипептида. NADPH-цитохром Р450-редуктаза имеет близкую структуру с большим гидрофильным доменом, прикрепленным к мембране коротким гидрофобным хвостом. Чтобы объяснить, каким образом одна молекула редуктазы может "обслужить" столь большой избыток молекул Р450, предложено два механизма. В одном постулируется существование стабильного кластера, представляющего собой молекулу редуктазы в окружении молекул цитохромов Р450. Согласно второй модели, для переноса электронов необходимы свободная диффузия и столкновение ферментов. Получены некоторые данные о формировании в реконструированных фосфолипидных протеолипосомах эквимолярных комплексов цитохрома Р450 и его редуктазы. Если такие комплексы действительно существуют в микросомной мембране, то они, по-видимому, представляют собой временные образования, быстро распадающиеся и вновь образующиеся с участием других молекул Р450. Лишь в таком варианте единственная молекула редуктазы может восстановить много молекул цитохромов. Окончательную картину еще предстоит выяснить, но уже ясно, что компоненты микросомной цепи нельзя считать изолированными. Для успешного функционирования системы, вероятно, существенными могут оказаться какие-то сложные варианты белок-белковых взаимодействий.
5.3 Дыхательная система митохондрий
Внутренняя мембрана митохондрий является местом, где осуществляется окислительное фосфорилирование. Суть процесса состоит в сопряжении потока электронов, направленного от органических субстратов к кислороду, с перемещением протонов из матрикса митохондрий через мембрану в межмембранное пространство. Как и предыдущие две электронтранспортные цепи, компоненты этой системы тоже представлены не в эквимолярных количествах, т.е. дыхательная цепь не может функционировать как долгоживущий мультиферментный комплекс. Однако в данном случае число оборотов терминального фермента, цитохром с-оксидазы, весьма велико, а оценить, какая стадия является лимитирующей, в такой ситуации очень непросто. Цепь состоит из четырех трансмембранных мультисубъединичных комплексов, растворимого цитохрома с и убихинона-10. Перенос электронов через комплекс II не сопровождается переносом протонов. Однако реакции, катализируемые комплексом I, комплексом III и комплексом IV, сопровождаются векторным переносом протонов через мембрану. Эти реакции являются электрогенными и приводят к генерации трансмембранного электрического потенциала. Такие ферменты в составе цепи называются "местами сопряжения". Относительно механизмов перемещения протонов пока нет единого мнения, хотя в литературе обсуждаются конкретные модели, в частности для комплексов III и IV. Образующаяся трансмембранная разность электрохимических потенциалов протонов уменьшается за счет работы протонного канала АТР-синтазы. Энергия потока используется этим ферментом для синтеза АТР.
Концентрация компонентов дыхательных цепей в митохондриальной мембране довольно высока, однако существование эквимолярных комплексов между образующими эти цепи мультисубъединичными ферментами нельзя считать доказанным.
В литературе обсуждаются модели электронного транспорта с участием таких переходных долгоживущих белковых агрегатов, однако имеющиеся кинетические данные можно объяснить, не предполагая образование таких суперкомплексов. Цитохром с выполняет функцию челнока, быстро переносящего электроны между комплексами III и IV, аналогично адренодоксину в содержащей цитохром Р450 системе митохондрий. При физиологической ионной силе цитохром с может диффундировать не только вдоль поверхности бислоя, но и в объеме раствора, что увеличивает его способность к быстрому переносу электронов. Данная система обладает рядом особенностей, не характерных для описанных выше примеров электронтранспортных цепей.
Основные компоненты дыхательной цепи организованы в не-диссоциирующие комплексы. Например, комплекс III состоит из нескольких субъединиц и содержит три гема и один железосерный центр. Перенос электронов между простетическими группами внутри каждого из компонентов происходит быстро и не требует их случайных столкновений.
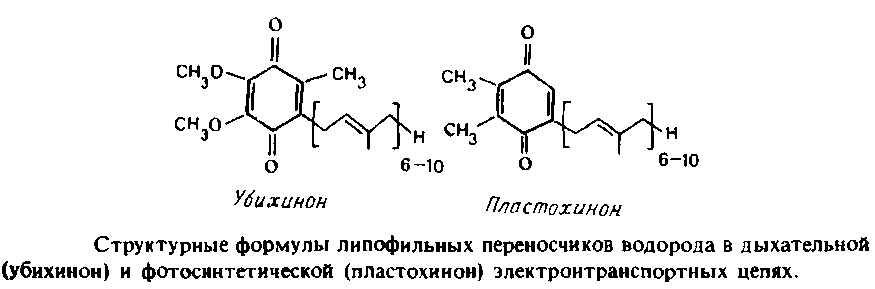
Жирорастворимые переносчики водорода служат для переноса восстановительных эквивалентов не только между ферментами, но и с одной стороны бислоя на другую. Показано, что убихинон обладает способностью к быстрой латеральной диффузии в плоскости мембраны, хотя вопрос о величине коэффициента диффузии не решен. В модельных системах убихинон также может переносить восстановительные эквиваленты через бислой. Убихинон при перемещениях не выходит из мембраны, однако в ходе редокспревращений он может захватывать или высвобождать протоны на границе раздела фаз липид-вода с любой стороны мембраны. Кинетические свойства изолированных ферментов, использующих убихинон в качестве субстрата, можно с успехом анализировать, используя уравнения Михаэлиса-Ментен с соответствующими значениями Км и И>тах>, если известна реальная концентрация хинона в бислое. Иное дело, если мы рассматриваем стационарную кинетику систем, в которых одна популяция ферментов сопряжена с другой посредством свободно диффундирующего пула хинонов как интермедиатов. Для описания подобных систем приходится применять специальные уравнения. Тот факт, что компоненты дыхательной цепи связаны через свободно диффундирующий пул хинонов, не вызывает сомнений, но в вопросе, является ли диффузия хинона лимитирующей стадией в работе электронтранспортной цепи, единого мнения среди исследователей нет.
Протоны, перенесенные через мембрану при работе дыхатель- ной цепи, возвращаются обратно с помощью АТР-синтазы, замыкая тем самым протонный цикл. Механизм, по которому протоны переносятся от компонентов электронтранспонтной цепи к АТР-синтазе, тоже до конца не установлен, и этот вопрос вряд ли будет разрешен в ближайшем будущем. Большинство исследователей считают, что протоны, переносимые через бислой, быстро приходят в равновесие со всей водной фазой. Согласно другой точке зрения, существует локализованный протонный поток и протоны переносятся либо вдоль поверхности бислоя, либо внутри бислоя, либо прямо на АТР-синтазу. Большинство данных в пользу этого механизма носят косвенный характер, но в литературе имеются свидетельства быстрого перемещения протонов вдоль поверхности фосфолипидного монослоя в нефизиологических условиях. Возможно, при некоторых обстоятельствах такой локализованный протонный поток имеет какое-то значение.
Таким образом, данная электронтранспортная система представляет собой совокупность небольшого числа высокоорганизованных комплексов, связанных между собой низкомолекулярными подвижными переносчиками, как липофильными, так и водорастворимыми. Кинетику переноса электронов можно объяснить в рамках модели свободно диффундирующих форм, которые могут перемещаться вдоль мембраны на расстояние более 100 А.
5.4. Фотосинтетическая электронтранспортная система тилакоидов
К фотосинтетической электронтранспортной системе можно также отнести светособирающие комплексы, поглощающие свет и передающие энергию электронного возбуждения на два реакционных центра. Захват энергии возбуждения реакционными центрами приводит к разделению зарядов и образованию на противоположных сторонах мембраны сильного окислителя и сильного восстановителя. Это в свою очередь Ведет к окислению воды до молекулярного кислорода фотосистемой II и создает движущую силу для транспорта электронов по цепи, сопряженного с трансмембранным переносом протонов. Образующийся на бислое градиент электрохимических потенциалов протонов используется для синтеза АТР с помощью АТР-синтазы, называемой сопрягающим фактором. Структура фотосистемы II, по-видимому, очень похожа на структуру бактериального фотореакционного центра, которая была детально изучена методом рентгеноструктурного анализа. &б/-Комплекс аналогичен комплексу III дыхательной цепи митохондрий, а сопрягающий фактор - митохондриальной АТР-синтазе. Роль пластоцианина очень напоминает роль цитохрома с в дыхательной цепи, являющегося растворимым переносчиком электронов, а пластохинон представляет собой полный аналог убихинона в электронтранспортной системе митохондрий.
В отличие от дыхательной цепи основные мембранные комплексы представлены в фотосинтетической системе примерно в эквимо-лярном соотношении. Однако какие-либо серьезные указания в литературе на формирование суперкомплексов отсутствуют. Напротив, для данной системы характерна поразительная латеральная гетерогенность, в результате которой фотосистема II оказывается локализованной в гранальных, плотно упакованных участках, а фотосистема I и сопрягающий фактор - в стромальных участках тилакоида. Пластохинон и комплекс, по-видимому, распределены между этими участками равномерно. Вследствие такого латерального разделения для сопряжения двух фотосистем необходима диффузия на расстояние по крайней мере 1000 А. Скорее всего основным переносчиком восстановительных эквивалентов на такие расстояния является пластохинон, хотя скорость его латериальной диффузии точно не известна. В оптимальных условиях лимитирующей стадией, вероятно, является окисление пластохинона £б/-комплексом, однако связано ли это со скоростью его латеральной диффузии или с работой самого фермента - неясно.
Латеральное разделение компонентов цепи в тилакоидах явно не способствует ускорению переноса электронов между ферментами. Возможно, оно необходимо для эффективного перераспределения световой энергии между двумя фотосистемами. Фосфорилирование белка светособирающего комплекса II приводит к его перераспределению между гранальными и стромальными участками мембраны, облегчая его взаимодействие с фотосистемой I в стромальных участках, что в свою очередь увеличивает долю энергии возбуждения, поступающей на реакционные центры фотосистемы I.
5.5 Взаимодействия между мембранными и растворимыми ферментами
Биомембраны играют важную роль в функционировании целого ряда растворимых ферментов. После разрушения клетки многие ферменты можно обнаружить и в растворимой, и в мембранной фракциях. Отнесение некоего фермента к классу периферических мембранных белков зависит от силы его взаимодействия с мембраной и способа выделения. Кроме того, некоторые растворимые ферменты в специфических условиях связываются с мембраной, и, следовательно, в зависимости от физиологического состояния клетки локализуются либо на мембране, либо в цитозоле. Кроме того, существует группа растворимых ферментов, катализирующих реакции с участием мембраносвязанных субстратов. Для функционирования такие белки должны быть способны хотя бы временно связываться с мембраной.
Во всех этих случаях мембрана выполняет следующие функции:
1) определяет локализацию или компартментацию фермента или группы ферментов;
2) осуществляет аллостерическую активацию или инактивацию ферментов в определенных условиях или в определенной области в клетке;
3) создает среду, в которой липофильные субстраты могут быть превращены в соответствующие продукты.
6. Растворимые ферменты, которые при необходимости могут связываться с мембраной
Пока эта важная группа насчитывает небольшое число ферментов, но, по-видимому, в недалеком будущем их список увеличится. Наиболее характерный пример - протеинкиназа С, хотя и другие представители этой группы неплохо охарактеризованы.
6.1 Протеинкиназа С
Это ключевой фермент системы передачи сигнала, запускаемого быстрым расщеплением фосфатидилинозитолов в плазматической мембране. Такие внеклеточные вещества, как нейромедиаторы, гормоны или факторы роста, связываются со специфическими рецепторами на поверхности клетки. Это приводит к активации фосфолипазы С, которая начинает гидролизовать фосфатидилинозитолы с образованием вторых посредников. Один из продуктов гидролиза, инозитол-1,4,5-трифосфат, вызывает увеличение концентрации свободного кальция внутри клетки. Второй продукт, 5я-1,2-диацилглицерол, активирует протеинкиназу С, что в свою очередь приводит к фосфорилированию целого ряда белков-мишеней, многие из которых, например рецептор фактора роста эпидермиса, являются мембраносвязанными. Согласно современным представлениям, данная система участвует в осуществлении целого ряда клеточных функций, в частности в делении, дифференцировке и экзоцитозе.
До активации клетки какими-либо экзогенными агентами протеинкиназа С остается неактивной и обнаруживается только в цитозоле. Однако после стимуляции клетки фермент быстро активируется и оказывается в мембранных фракциях. Исследования in vitro показали, что для связывания с мембраной и активации необходимы кислые фосфолипиды, а также Са2 + и диацилглицерол. Специфичность к фосфолипиду, необходимому для активации, до некоторой степени зависит от природы субстрата. Для активации фосфотрансферазной активности фермента можно добавить прямо к клеткам проникающие через мембрану коротко цепочечные диацилглицеролы, например диоктаноилглицерол. Природные вторые посредники, длинноцепочечные диацилглицеролы, нерастворимы в воде и остаются в мембране. Аналогичное действие оказывают, по-видимому, промоторы опухолевого роста форболовые эфиры: как показано, они способны связываться с ферментом и вызывать те же изменения, что и эндогенный сигнал. После связывания форболовых эфиров или диацилглицеролов возрастает сродство фермента к Са2+ и фосфатидилсерину. Показано, что эффективным конкурентным ингибитором фермента является сфингозин.
На самом деле протеинкиназа С представлена несколькими разными, но близкими по структуре полипептидами с мол. массой - 80000. Например, из мозга кролика выделено три формы. Протеинкиназа С имеет двухдоменную структуру. Один домен содержит каталитические центры, связывающие АТР и белок-субстрат, и функционирует как сериновая и треониновая фосфотрансфераза. Второй домен, по-видимому, участвует в связывании фосфатидилсерина, диацилглицерола и Са2 +. С помощью мягкого протеолиза можно разделить два этих домена, получив полностью активный каталитический фрагмент с мол. массой - 50000. Таким образом, активировать фермент можно двумя взаимоисключающими способами: протеолизом и связыванием с мембраной. Таким же образом ведут себя и некоторые другие липидзависимые ферменты, например пируватоксидаза. Физиологическое значение протеолитической активации неясно.
Очищенный фермент был встроен в фосфолипидные везикулы и в смешанные везикулы, содержащие тритон Х-100 и фосфолипиды. В обоих случаях было показано, что само по себе связывание липида ферментом необходимо, но не достаточно для проявления ферментативной активности. Например, для связывания фермента с фосфолипидными везикулами достаточно 2 "Уо фосфатидилсерина, в то время как для оптимального фосфорилирования его необходимо уже 50. В норме содержание фосфати-дилсерина в плазматической мембране составляет 8-10%. Поскольку фермент активируется в смешанных мицеллах, содержащих примерно 20 мол. % фосфатидилсерина в тритоне Х-100, наличие бислойной структуры не является необходимым, что, вообще говоря, весьма типично для липидзависимых ферментов. Зависимость наблюдаемой активации от концентрации фосфатидилсерина свидетельствует о кооперативном характере взаимодействий фермента и липида, что также довольно обычно. По оценкам функционально активный фермент представляет собой комплекс, содержащий мономер фермента, одну молекулу диацилглицерола, один или более ионов Са2+ и по крайней мере четыре молекулы фосфатидилсерина. Связывание всегда происходит с поверхностью мембраны, но роль Са2+ неизвестна. Он может, например, хелатировать карбоксильные группы фосфатидилсерина и какие-то группы в белке и/или играть роль аллостерического регулятора при связывании белка. Тот факт, что фермент может быть помечен иодонафталин-1-азидом, служит указанием на некоторое проникновение белка в гидрофобную зону бислоя, но не более того.
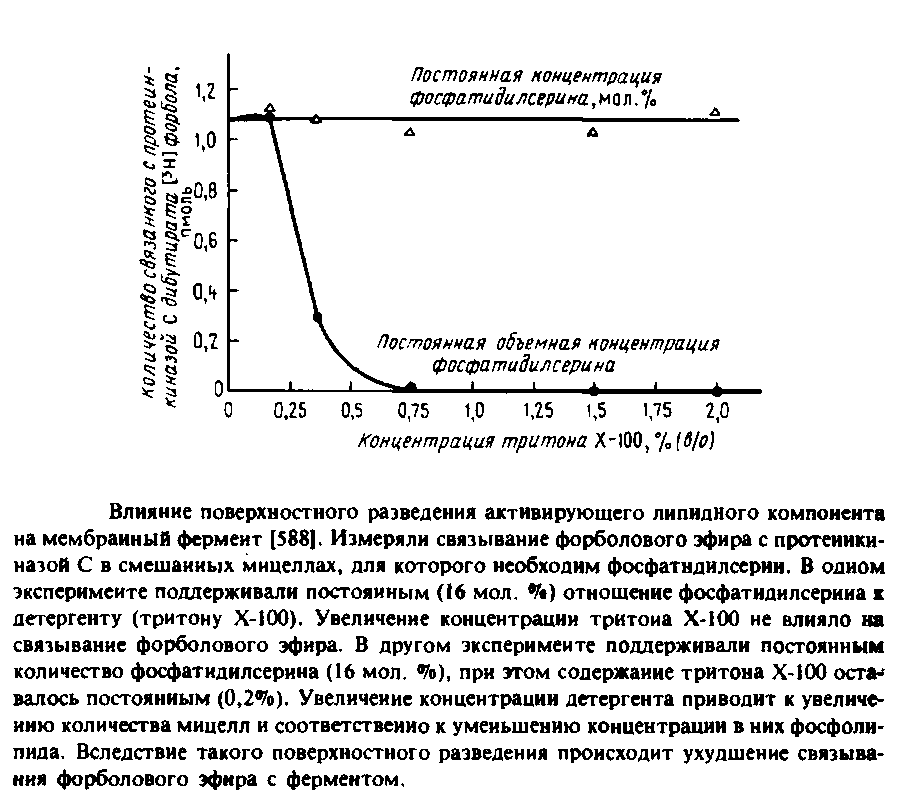
6.2 Эффект поверхностного разведения в смешанных мицеллах
Рис. иллюстрирует интересную особенность протеинкиназы С и других мембранных ферментов, выявляемую при измерении их активности в системах со смешанными мицеллами. В этом эксперименте измеряли зависимость способности фермента связывать форболовый эфир от концентрации тритона Х-100. Если поддерживать постоянным содержание фосфатидилсерина в мольных процентах, а концентрацию тритона Х-100 увеличивать, то фермент будет связывать форболовый эфир даже при высокой концентрации детергента. Однако если поддерживать постоянной объемную концентрацию фосфолипида и увеличивать количество детергента, то фермент перестанет связывать форболовый эфир при высоких концентрациях тритона Х-100. Для активации фермента важна не объемная, а поверхностная концентрация липида, иными словами, число молекул липида на мицеллу. Если эта величина падает, то уменьшаются также способность фермента связываться с такими смешанными мицеллами и способность активироваться. Это явление называется явлением поверхностного разведения.
6.3 Другие примеры
Лимитирующей стадией биосинтеза фосфатидилхолина является синтез интермедиата CDP-холина. Фермент, катализирующий эту реакцию, называется СОР: фосфохолин цитидилтрансферазой. Он содержится в цитозоле, но, как было недавно показано, может связываться с эндоплазматическим ретикулумом, где происходит его активация. Именно в месте связывания осуществляется биосинтез фосфатидилхолина. Отметим, что оба субстрата растворимы в воде и не связаны с мембраной. Что заставляет фермент связываться с мембраной, пока неясно. Возможно, сигналом служит появление в мембране диацилглицеролов. Рассматриваются также следующие механизмы:
1) увеличение содержания длинноцепочечных жирных кислот или ацильных производных СоА;
2) истощение микросомной мембраны по фосфатидилхолину;
3) дефосфорилирование самого фермента, в результате чего он переходит в мембраносвязанную активную конформацию. Для установления истинного механизма необходимы дальнейшие исследования.
Показано, что в зависимости от содержания мембраносвязанных диацилглицеролов фермент диацилглицеролкиназа может перемещаться из цитозоля в мембрану. Он катализирует превращение диацилглицерола в фосфатидную кислоту и по крайней мере частично ответствен за утилизацию диацилглицерола в мембране. Диацилглицерол и жирные кислоты участвуют также в связывании а-актинина с мембранами. Полагают, что определенную роль в прикреплении пучков микрофиламентов к плазматической мембране играет и диацилглицеролкиназа. Возможно, индуцируемое диацилглицеролом и жирными кислотами образование комплексов а-актинина и актина является важным элементом физиологической активности тромбоцитов.
Остановимся вкратце еще на двух ферментах, которые в определенных условиях связываются с биомембранами: пируватоксидазе и фосфатидилсеринсинтетазе из Е. coli. В присутствии субстрата оба фермента перемещаются из цитозоля в цитоплазматическую мембрану. Пируватоксидаза уже упоминалась как пример липидзависимого фермента. В присутствии пирувата, восстанавливающего связанный с белком флавиновый кофактор, фермент по своим свойствам становится классическим мембранным белком. Он восстанавливает растворенный в мембране убихинон и поэтому для своего функционирования должен быть связан с мембраной. В норме при очистке фосфатидилсеринсинтазы она выделяется в связанном с рибосомами виде, но в присутствии либо субстрата, либо продукта оказывается связанной с мембраной.
6.4 Растворимые ферменты или ферментные ансамбли, которые in vivo могут быть ассоциированы с мембраной
В литературе все чаще появляются данные о возможной ассоциации целого ряда растворимых ферментов с мембраной. Большинство работ посвящено связыванию ферментов цикла трикарбоновых кислот и /3-окисления жирных кислот с внутренней митохондриальной мембраной и ферментов гликолиза с плазматической мембраной эритроцитов. Приводятся доказательства, хотя и не вполне убедительные, что ферменты митохондриального матрикса организованы в связанные с поверхностью мембраны мультиферментные комплексы. В некоторых случаях удалось выявить специфические центры связывания. Например, NAD + - зависимые дегидрогеназы образуют комплексы с NADH: убихинон оксидоредуктазой. Креатинфосфокиназа специфически связывается с кардиолипином во внутренней митохондриальной мембране; гексокиназа также связывается с митохондриями - возможно, с их наружной мембраной. Распределение гексокиназы между растворенной и связанной с митохондриями формами, по-видимому, модулируется гормонами или метаболитами. Во всех этих случаях смысл ассоциации перечисленных ферментов, а возможно, и других растворимых ферментов с мембраной, состоит в "канализации" субстрата. Например, переносимый через внутреннюю митохондриальную мембрану АТР должен более эффективно утилизироваться гексокиназой, локализованной около мембраны. Однако это предположение пока нельзя считать окончательно доказанным.
В ряде работ показано, что гликолитические ферменты связываются с экспонированным в цитоплазму кислым доменом белка полосы 3 мембраны эритроцитов. В число этих ферментов входят альдолаза, фосфофруктокиназа, глицеральдегид-3-фосфатдегидрогеназа. Предполагается, что в некоторых случаях связанный с мембраной фермент может оставаться в неактивной форме и быстро переходить в активную цитоплазматическую форму в присутствии соответствующих метаболитов. Пока неясно, правда, происходит ли такая ассоциация in vivo или это артефакт, связанный с работой in vitro. Взаимодействия между белками в таких ассоциатах относительно слабые и зависят от ионной силы. Такая же картина характерна для некоторых предполагаемых ассоциатов ферментов с митохондриальной мембраной. Однако сопряжение гликолитических функций с мембранными активностями и компартментализация этих ферментов, вообще говоря, слишком привлекательная концепция, чтобы ее отбрасывать, тем более что для других систем существование таких ассоциатов доказано.
Получить убедительные доказательства физиологической значимости взаимодействия этих ферментов и ферментных ансамблей с мембраной довольно трудно, но есть основания полагать, что в недалеком будущем в этой области исследований будет достигнут определенный прогресс.
Еще один класс взаимодействующих с мембраной растворимых белков представляют цитотоксины.
6.5 Факторы свертывания крови - внеклеточные ферменты, активируемые связыванием с мембраной
Свертывание крови происходит в результате сложного каскада реакций с участием целого ряда факторов сыворотки. В ходе этих реакций осуществляется последовательная протеолитическая активация серии зимогенов, каждый из которых, активировавшись, в свою очередь вызывает активацию одного или нескольких других зимогенов. Конечным результатом всех этих реакций является превращение фибриногена в фибрин. Для осуществления многих этапов этого каскада необходимо, чтобы активированная протеаза и/или субстрат-зимоген связалась с мембраной тромбоцитов, эндотелиальных или иных клеток. Особый интерес представляют следующие вопросы:
1) как белки связываются с мембранами? 2) какую роль играет мембрана в активации участвующих в свертывании крови ферментов? Окончательных ответов на эти вопросы пока нет.
Всем связывающимся с мембранами факторам свертывания крови необходимы кислые фосфолипиды. Некоторые из них, в частности факторы VII, IX, X и протромбин, требуют также Са2+. С участием витамина К происходит модификация этих четырех белков - карбоксилирование в ^-положении остатков глутамата, локализованных в гомологичных N-концевых участках каждого из полипептидов. В результате такой модификации в молекуле белка формируется значительное число высокоаффинных центров связывания Са2 +, который в свою очередь необходим для соответствующего взаимодействия белков с кислыми фосфолипидами на мембране. Каким образом Са2+ облегчает белково-мембранные взаимодействия, не совсем ясно. Это может быть, в частности, "сшивание" с помощью Са2+ белка с гидрофильными отрицательно заряженными головками фосфолипида. Кальций необходим не для всех факторов свертывания крови. Так, фактор V может непосредственно взаимодействовать с отрицательно заряженными фосфолипидами, а другой компонент, так называемый "тканевый фактор", вообще является интегральным мембранным белком. Большей частью, однако, факторы взаимодействуют с поверхностью бислоя за счет электростатических сил, хотя иногда наблюдается и некоторое проникновение белка в гидрофобную область мембраны.
Присутствие фосфолипидов сильно меняет стационарную кинетику реакций протеолитической активации. Резко уменьшается значение Км для белкового субстрата; например, для реакции активации фактора X фактором 1Ха Км изменяется от 181 до 0,058 мкМ. Добавление другого белка, фактора Villa, увеличивает K>ma>* более чем в 200 000 раз. Поскольку реакция катализируется обоими ферментами, а субстрат в данных условиях измерения представлен как мембраносвязанной, так и свободной формами, истинный механизм влияния липида в таких реакциях определить чрезвычайно сложно. Например, показано, что протеолитическая активность фактора X увеличивается при связывании его с мембраной, в то время как фактор IX одинаково активен в свободном и в мембраносвязанном состояниях. Фактор X можно также активировать комплексом фактора Vila и тканевого фактора. В этом случае протеолитическая активация фактора X происходит, только когда он находится в свободной форме в растворе и не связан с мембраной. Другой пример - активация протромбина фактором Ха. Наблюдаемое в этом случае низкое значение Км коррелирует с концентрацией субстрата и протромбина на поверхности фосфолипидной везикулы. Если же добавить кофактор - фактор Va, образующий с фактором Ха комплекс, - то всякая зависимость Км от поверхностной концентрации протромбина на везикуле исчезнет. В заключение отметим, что данная система очень сложна, и роль липидов здесь отнюдь не сводится лишь к созданию соответствующей поверхности, на которой происходит простое концентрирование компонентов системы.
Факторы свертывания крови входят в группу Са2 +-зависимых липидсвязывающих белков. Функции этих белков не всегда бывают известны; некоторые из них связаны с цитоскелетом. Фосфолипазы, к рассмотрению которых мы сейчас перейдем, также являются Са2 +-зависимыми ферментами.
6.6 Фосфолипазы - растворимые ферменты, катализирующие расщепление мембраносвязанных субстратов
Фосфолипиды служат субстратами многих растворимых ферментов, в том числе фосфолипаз. Среди них лучше всего изучена фосфолипаза Аг, которая катализирует гидролиз фосфолипидов по положению sn-2 с образованием жирной кислоты и лизофосфолипида. Фосфолипаза Аг была выделена сначала из ядов кобры и гремучей змеи, а затем из поджелудочной железы быка и свиньи. Это очень близкие по первичной структуре небольшие белки с мол. массой около 14 000. Для некоторых ферментов удалось получить с высоким разрешением трехмерные структуры, также обладающие высокой степенью гомологии. Ферменты из поджелудочной железы синтезируются как неактивные зимогены, которые затем активируются протеолизом: от зимогена отщепляется семь остатков с С-конца.
Фосфолипаза Аг представляет особый интерес с точки зрения мембранной энзимологии, поскольку она обладает способностью активироваться при взаимодействии с интегрированными формами субстрата, например с мицеллами или бислоем. На Рис.6.8 представлена зависимость от концентрации субстрата скорости гидролиза короткоцепочечного фосфатидилхолина фосфолипазой Аг и его предшественником из поджелудочной железы свиньи.
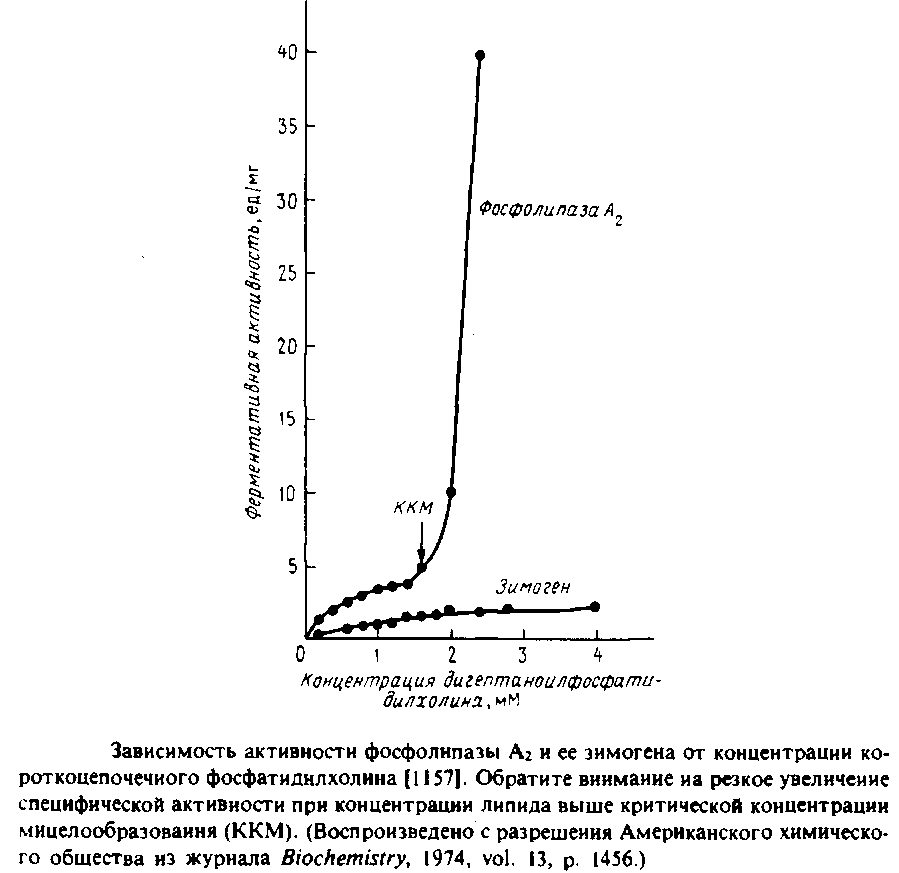
Данный субстрат в концентрациях до 1,5 мМ является мономером, но при дальнейшем увеличении концентрации формирует мицеллы. И зимоген, и активированный фермент очень медленно гидролизуют субстрат в мономерной форме, но как только фосфолипид начинает образовывать мицеллы, активность фосфолипазы А>2> резко возрастает.
Активации фосфолипазы агрегированными субстратами было посвящено множество работ, а которых исследовалась кинетика катализируемого ферментом гидролиза субстратов в мономерной форме, в чистых липидных мицеллах, в смешанных мицеллах с тритоном Х-100, в монослоях на поверхности раздела воздух-вода и в фосфолипидных везикулах. Для проявления каталитической активности ферменту во всех случаях нужен Са2 +, причем центр связывания единственного иона Са2+ можно выявить с помощью рентгеноструктурного анализа. В отличие от факторов свертывания крови фосфолипаза Аг не содержит остатка - у-карбоксиглутаминовой кислоты и для ее активации не требуются кислые фосфолипиды.
Для объяснения механизма активации фосфолипаз предложено несколько гипотез
В ряде работ было показано, что связывание фермента с мицеллами или бислоями предшествует стадии активации, при которой резко возрастает число оборотов фермента, и экспериментально эти две стадии можно разделить. Такое поведение ничем не отличается от поведения других рассмотренных липидзависимых ферментов. Несмотря на обилие данных по кинетике, связыванию и структуре фосфолипазы, исследователи не пришли к единому мнению о том, что происходит с ферментом при его активации в присутствии липидного бислоя или мицелл. В литературе рассматривается несколько возможных механизмов.
Фермент связывается с бислоем с помощью специального "участка узнавания поверхности раздела", отличного от активного центра, и для его формирования необходим Са2 +. Предполагается, что этот участок проникает в глубь мембраны. Эта модель основана, в частности, на данных по специфическому влиянию химической модификации N-концевого участка полипептида на взаимодействие с агрегированными субстратами. Происходящая при взаимодействии участка узнавания с мембраной активация фермента, по-видимому, обусловлена конформационными изменениями белка. Следует отметить, что в кристаллическом виде ферменты из поджелудочной железы быка и свиньи представляют собой мономеры, в то время как фосфолипаза Аг из яда гремучей змеи является димером. Обнаруживаемый в мономерных фосфолипазах участок, который, как предполагают, является "участком узнавания поверхности", в димерном ферменте недоступен из водной фазы и находится на поверхности межсубъединичного контакта.
Двухфосфолипидная модель предполагает существование в ферменте двух или более центров связывания фосфолипидов и основана прежде всего на кинетических данных по активации фермента фосфолипидами в смешанных мицеллах. Эта модель позволяет учесть роль агрегации двух или более молекул фермента как важнейшей части схемы активации, а также роль возможных конформационных изменений в увеличении каталитической активности.
Постулируется, что конформация фосфолипидного субстрата в агрегированном состоянии отличается от конформации мономерной формы, и именно с этим связана более высокая скорость гидролиза агрегированных форм липидов ферментом.
4. Увеличение активности связано с тем, что из мицелл или бислоя продукты гидролиза удаляются легче. Кроме того, само по себе накопление продуктов уже приводит к увеличению активности фосфолипазы Аг, хотя механизм этого явления неясен.
Одна из проблем, возникающих при анализе процесса активации, состоит в том, как разделить процессы связывания с липидом и активацию липидом. В экспериментах с однослойными фосфолипидными везикулами удалось выяснить, что критическим параметром для обоих стадий является физическое состояние бислоя. Показано, например, что фосфолипаза А2 лучше всего связывается с дипальмитоилфосфатидилхолином в фазе геля, причем Са2 + для этого не нужен. Для активации же фермента в такой системе, по-видимому, требуется Са2 +, причем в случае везикул фосфатидилхолиновый бислой должен обладать дефектами упаковки и в нем должны происходить структурные флуктуации, подобные тем, которые имеют место в ходе термоиндуцируемого фазового перехода. Взаимодействия молекул белков могут быть важны как для связывания, так и для активации. В некоторых условиях активированный фермент сохраняет активность по крайней мере в течение 30 мин.
Лучшими субстратами для фермента являются фосфолипиды с короткой ацильной цепью и небольшими по объему полярными заместителями при фосфате. Хотя для активации фермента кислые фосфолипиды не являются необходимыми, отрицательный заряд на поверхности раздела все же повышает сродство к субстрату. Связавшись с границей раздела, фермент может латерально перемещаться по поверхности бислоя и гидролизовать до нескольких тысяч фосфолипидных молекул в минуту до тех пор, пока не отделится от бислоя. Время пребывания белка на поверхности бислоя в значительной степени зависит от природы липида и свойств окружающего раствора.
Какие именно конформационные изменения приводят к активации и каким способом происходит связывание фермента с бислоем, неизвестно. Обнаруживаемая при изучении модельных бислойных систем зависимость кинетики от наличия дефектов бислоя представляется очень интересной, хотя неясно, насколько такие дефекты важны для работы фермента in vivo.
И в заключение необходимо отметить, что фосфолипаза Аг ответственна за высвобождение из мембраны арахидоновой кислоты, последующее превращение которой в лейкотриены и простагландины является частью воспалительного процесса. Стероиды, обладающие противоспалительным эффектом, активируют группу белков, называемых липокортинами, которые в свою очередь специфически ингибируют фосфолипазу Аг. Липокортины являются также субстратами протеинкиназы С и тирозиновых протеинкиназ, которые, вероятно, могут таким образом участвовать в регуляции активности липокортинов. Ингибирующий эффект липокортинов, по-видимому, связан не с образованием прочного комплекса с фосфолипазой Аг, а с их взаимодействием непосредственно с мембраной.
Резюме
Многие клеточные процессы катализируются мембраносвязанными ферментами. При этом мембрана может выполнять целый ряд функций. Связав фермент с определенной мембраной или участком на мембране, можно локализовать каталитический центр в определенной части клетки. Существует множество примеров, когда несколько действующих последовательно ферментов организованы подобным образом в некий суперкомплекс, что позволяет увеличить суммарную скорость реакции. Многие мембранные ферменты представляют собой белки, пронизывающие мембрану насквозь, и участвуют в трансмембранном транспорте растворенных веществ или в передаче информации с одной стороны бислоя на другую в форме трансмембранного аллостерического сигнала. Другие ферменты являются периферическими мембранными белками и в некоторых случаях способны связываться с мембраной только в ответ на определенный физиологический сигнал.
Во многих случаях липидный бислой играет пассивную роль в функционировании мембраносвязанных ферментов, являясь лишь средой, в которой происходит взаимодействие фермента с субстратом. Нередко, однако, оптимальное функционирование мембранных ферментов оказывается возможным только в присутствии определенных липидов, хотя абсолютная специфичность конкретного липида в активации фермента встречается крайне редко. Интерпретировать данные по влиянию липидов на активность изолированных мембранных ферментов часто очень непросто. Изучение очищенных мембранных белков in vitro ставит перед исследователем огромное множество совершенно особых проблем, не встречающихся при работе с растворимыми ферментами.