Роль карбоксипептидазы N и ангиотензинпревращающего фермента в гемостазе у онкологических больных в раннем послеоперационном периоде
Федеральное агентство по образованию
Пензенский государственный педагогический университет им. В. Г. Белинского
Дипломная работа
Роль карбоксипептидазы N и ангиотензинпревращающего фермента
в гемостазе у онкологических больных в раннем послеоперационном периоде
Студент Минькова Е. В подпись
Руководитель Сметанин В. А.
Пенза, 2008 г.
Содержание
Список сокращений
Введение
Глава 1. Обзор литературы
1.1 Система гемостаза
1.1.1 Механизмы свертывания крови
1.1.2 Противосвертывающие механизмы и система фибринолиза
1.1.3 Нарушения системы гемостаза у онкологических больных в раннем послеоперационном периоде
1.2 Пептидергическая система
1.2.1 Механизм образования активных форм пептидов
1.2.2 Вазоактивные пептиды и их роль в регуляции гемостаза
1.2.3 Ферменты обмена вазоактивных пептидов
1.2.4 Изменения в пептидергической системе онкологических больных
Глава 2. Материалы и методы исследования
2.1 Материал исследования
2.2 Методы исследования
2.2.1 Метод определения активности карбоксипептидазы N
2.2.2 Метод определения активности ангиотензинпревращающего фермента
2.2.3 Метод определения содержания белка
2.3 Статистическая обработка результатов исследования
Глава 3. Результаты и обсуждение
3.1 Исследование активности карбоксипептидазы N в сыворотке крови онкологических больных в раннем послеоперационном периоде
3.2 Исследование активности ангиотензинпревращающего фермента в сыворотке крови онкологических больных в раннем послеоперационном периоде
Выводы
Список литературы
Список сокращений
АД – артериальное давление
АПФ – ангиотензинпревращающий фермент
АДФ – аденозин фосфат
АПТВ – активированное парциальное тромбопластиновое время
ВФ – фактор Виллебранда
КПN – карбоксипептидаза N
МФ – мономер фибрина
ПТИ – протромбин
РААС – ренин-ангиотензин-альдостероновая система
РФМК – растворимый фибрин-мономерный комплекс
ТПА – тканевой плазминогеновый фактор
ТФ – тканевой фактор
ХЗФ – Хагеман-зависимый фибринолиз
ЭПР – эндоплазматический ретикулум
Введение
Онкологические заболевания – тяжелейший недуг, борьба с которым – задача современного общества и вторая по значимости причина смертности во многих странах мира после сердечно-сосудистой патологии [2, 3].
Опухоль оказывает воздействие на все обменные процессы в организме, при этом происходит нарушение гемостаза, несовместимое с жизнью. Современные многоцентровые исследования показали, что риск ранних тромбоэмболических осложнений у онкологических больных в несколько раз выше по сравнению со здоровыми людьми того же возраста. Учащение эпизодов тромбирования возрастает с 6-10 до 35 % [8]. Основную роль в патогенезе различного рода тромботических осложнений, диссеминированного внутрисосудистого свертывания у онкологических больных играют изменения системы гемостаза [5], вызываемые как самой опухолью, так и различными методами лечения [19, 26, 27, 35, 37].
В последние годы существенно повысилась эффективность во всех трех направлениях лечения раковых заболеваний: хирургического, химиотерапевтического и радиологического. При этом хирургические вмешательства у больных со злокачественными новообразованиями часто осложняются массивными кровопотерями, что в первую очередь обусловлено травматичностью оперативных вмешательств из-за распространенности опухолевого процесса, при этом усугубляются нарушения гемостаза, патогенетические механизмы которых изучены недостаточно [9, 17, 24, 32, 47, 52, 65] .
В функционировании системы гемостаза немаловажная роль принадлежит вазоактивным пептидам, в обмене которых принимают участие ангиотензинпревращающий фермент и карбоксипептидаза N [48].
Целью настоящей работы было изучение роли карбоксипептидазы N и ангиотензинпревращающего фермента в гемостазе у онкологических больных в раннем послеоперационном периоде.
При выполнении работы были поставлены следующие задачи:
1.Изучить активность карбоксипептидазы N и ангиотензинпревращающего фермента у больных раком легких.
2. Изучить активность карбоксипептидазы N и ангиотензинпревращающего фермента у больных раком брюшной полости.
3. Изучить активность карбоксипептидазы N и ангиотензинпревращающего фермента у больных раком мочеполовой системы.
4. Исследовать корреляционные взаимосвязи между активностью изучаемых ферментов и показателями гемостаза.
Научная новизна и практическая ценность работы. Изучена активность карбоксипептидазы N и ангиотензинпревращающего фермента в сыворотке крови у онкологических больных в раннем послеоперационном периоде. Установлены корреляционные взаимосвязи между активностью исследуемых ферментов и показателями гемостаза.
Полученные результаты представляют интерес для понимания роли карбоксипептидазы N и ангиотензинпревращающего фермента в регуляции гемостаза при онкологических заболеваниях с различной локализацией опухоли и могут быть использованы для разработки методов профилактики и коррекции нарушений гемостаза в послеоперационном периоде.
Апробация работы. Материалы данной работы представлены на 57 научной конференции студентов ПГПУ, направлена статья в журнал «Известия Пензенского государственного университета им. В. Г. Белинского» (2008 г.).
Глава 1. Обзор литературы
1.1 Система гемостаза
Система гемостаза является одной из защитных систем организма. Она обеспечивает с одной стороны сохранение крови в кровеносном русле в жидком агрегатном состоянии, а с другой стороны остановку кровотечения и предотвращает кровопотери при повреждении кровеносных сосудов. Основными компонентами системы гемостаза являются сосудистая стенка (особенно её эндотелий и субэндотелий), клетки крови, а также плазменные и клеточные ферментные системы: фибринолитическая, антикоагулянтная, калликреин-кининовая [36].
1.1.1 Механизмы свертывания крови
Сосудисто – тромбоцитарный (первичный) гемостаз
Стенка капилляра образована эндотелием, базальной мембраной и адвентицией.
Базальная мембрана капилляра состоит из аморфного вещества, представленного в основном гиалуроновой кислотой и коллагеновыми волокнами.
В синтезе гиалуроновой кислоты принимают активное участие катехоламины (адреналин, норадреналин), витамины С, Р, ионы Са2+, глюкокортикоиды. При достаточном количестве этих веществ создается структурно и функционально полноценная сосудистая стенка. Функциональная полноценность сосудистой стенки и эндотелия проявляется прежде всего в скорости их сокращения в ответ на травму и способности противостоять механическому воздействию. Это – первая и самая быстрая первичная реакция гемостатической системы [25].
В капиллярах и других сосудах микроциркуляторного русла сосудистый спазм, значительно снижающий объем кровопотери, длится 2-3 минуты, затем наступает дилатация поврежденного сосуда. Вследствие этого должно было бы возобновиться кровотечение. В норме этого не случается, так как сосудистый компонент гемостаза подкрепляется тромбоцитарным.
Уже в первые секунды после травмы происходит адгезия (прилипание) тромбоцитов к краям поврежденного эндотелия и коллагеновым волоконцам. Под влиянием АДФ, которая выделяется из поврежденного сосуда и при гемолизе эритроцитов, тромбоциты склеиваются друг с другом (наступает их агрегация) как у места поврежденного сосуда, так и в кровотоке. В результате адгезии и начальной агрегации тромбоцитов из них выделяются серотонин, адреналин и АДФ (собственная АДФ тромбоцитов). Это – реакция освобождения первого порядка. АДФ способствует агрегации пластинок, а серотонин и адреналин усиливают сокращение поврежденной сосудистой стенки [28].
Адреналин и АДФ, а также находящиеся в плазме Са2+, Mg2+, фибриноген и другие плазменные факторы усиливают агрегацию тромбоцитов. Однако эта реакция обратима у большинства пластинчатых агрегатов. Прилипая друг к другу и к адгезированным тромбоцитам, они все же могут отрываться и уноситься в кровоток. Таким путем идет дезагрегация, скорость которой также во многом определяет наклонность к кровоточивости или тромбообразованию.
Наряду с процессами адгезии и агрегации тромбоцитов из поврежденных тканей и эндотелия выделяется тканевый тромбопластин (IП фактор свертывания). При его взаимодействии с VП, IV, Х и V факторами, а затем и с протромбином (фактором П) образуется тромбин. Следов тромбина недостаточно для свертывания крови, но благодаря ему начинаются важные реакции первичного гемостаза: тромбин действует на агрегаты тромбоцитов, переводит обратимую агрегацию тромбоцитов в необратимую; необратимая агрегация сопровождается реакцией освобождения второго порядка, вследствие которой возникают гидролазы, АДФ в высокой концентрации и вазоактивные вещества (серотонин, адреналин, норадреналин) [20]. Благодаря воздействию этих веществ формируется белый тромбоцитарный, или первичный, тромб. Из-за недостатка VП, V, Х факторов и протромбина будет нарушаться первичный гемостаз. После образования первичного тромба полностью блокируется кровотечение из сосудов микроциркуляции.
Таким образом, гемостаз в сосудах микроциркуляции осуществляется в основном клеточными (эндотелием, тромбоцитами) и сосудистым факторами [25]. Свертывающая система крови не успевает включиться в полном объеме, а следы тромбина, обеспечивающего необратимую агрегацию, появляются вследствие быстрой активации тканевого тромбопластина (тканевый, или внешний, путь образования протромбиназы).
Поэтому первичный гемостаз будет нарушен при: изменениях сосудистой стенки (дистрофические, иммуноаллергические, неопластические и травматические капилляропатии); тромбоцитопении; тромбоцитопатии; сочетании этих факторов.
Сформировавшийся белый тромбоцитарный тромб, который подвергся вязкому метаморфозу и ретракции, надежно стягивает края поврежденного микрососуда, противостоит его дилатации и не пропускает жидкую часть крови.
В сосудах более крупного калибра, чем капилляры (венулах и артериолах), несмотря на их более длительный спазм (до двух часов), образовавшийся тромбоцитарный тромб не в силах противостоять расхождению краев поврежденного сосуда при его дилатации – белый тромб разрывается. Если этого не происходит, то даже неразрушенный пластиночный тромб в сосудах с повышенным кровяным давлением ненадежен, так как пропускает, словно сито, плазму и форменные элементы. И кровотечение хотя и медленно, но будет продолжаться. Поэтому для окончательного надежного гемостаза в поврежденных крупных венах и артериях первичного тромба недостаточно. У здоровых людей в таких случаях на первичном (белом) тромбоцитарном тромбе образуется красный [33].
Оперативное вмешательство выступает как мощный прокоагулянтный фактор и вызывает дальнейшее нарушение системы гемостаза. В патогенезе послеоперационных осложнений происходит ухудшение кровообращения в системе микроциркуляции и в магистральных сосудах [35].
Коагуляционный гемостаз
Процесс свертывания крови – многоступенчатая ферментная реакция, в которой принимает участие ряд белков, обозначаемых как факторы свертывания крови (табл. 1).
Одни из этих белков являются протеазами (факторы II, VII, IX, Х, ХI, XII, XIII), другие - акцелераторами (ускорителями) ферментных реакций (факторы V и VIII), третьи - конечным субстратом процесса (фактор I, или фибриноген). Взаимодействие факторов свертывания крови, их активация, а затем и инактивация почти на всем протяжении процесса происходят на плазменных фосфолипидных мембранах, от количества которых в плазме зависит либо ускорение, либо существенное замедление процесса свертывания.
Синтез ряда наиболее важных факторов свертывания (факторов V, VII, X, IX и II), а также двух основных физиологических антикоагулянов - протеинов С и S - осуществляется паренхиматозными клетками печени - гепатоцитами, причем для того, чтобы они могли участвовать в процессе свертывания крови, все эти факторы, кроме фактора V, должны подвергнуться γ-карбоксилированию витамин-К-зависимой карбоксилазой.
Таблица 1 Международная номенклатура факторов свертывания крови
|
Факторы |
Синонимы |
Содержание в плазме, г/л |
Полупериод распада (в часах) |
|
I |
Фибриноген |
1,8-4,0 |
72-120 |
|
II |
Протромбин |
около 0,1 |
48-96 |
|
III |
Тканевый тромбопластин |
0 |
- |
|
IV |
Ионы кальция |
0,09-0,10 |
- |
|
V |
Проакселерин |
Около 0,01 |
15-18 |
|
VII |
Проконвертин |
Около 0,005 |
4-6 |
|
VIII |
Антигемофильный фактор А |
0,01-0,02 |
7-8 |
|
IX |
Кристмас-фактор |
Около 0,003 |
15-30 |
|
X |
Фактор Стюарт-Проуэра |
Около 0,01 |
30-70 |
|
XI |
Антигемофильный фактор С |
Около 0,005 |
30-70 |
|
XII |
Фактор Хагемана |
Около 0,03 |
50-70 |
|
XIII |
Фибриназа |
0,01-0,02 |
72 |
|
Дополнительные |
|||
|
Фактор Виллебранда |
фВ |
18-30 |
|
|
Фактор Флетчера |
Прекалликреин |
- |
|
|
Фактор Фитцжеральда |
Кининоген |
- |
Поэтому при дефиците витамина К и нарушении его всасывания из кишечника (при кишечном дисбактериозе, обтурации общего желчного протока), а также под влиянием непрямых антикоагулянтов (кумаринов, фенилина), являющихся функциональными антагонистами витамина К, нарушается синтез всех витамин К-зависимых факторов свертывания, а также протеинов С и S, вследствие чего может возникнуть тяжелая кровоточивость, сочетающаяся в некоторых случаях с микротромбированием сосудов и некрозами тканей из-за недостатка антикоагулянта – протеина С.
Такое же нарушение свертываемости крови наблюдается и при тяжелых заболеваниях печени, но при этом снижается уровень в крови не только всех витамин К-зависимых факторов свертывания, но и фактора V, а также альбумина [28].
Различают три этапа процесса свертывания крови.
Первый этап завершается активацией фактора X в так называемом протромбиназном комплексе, в состав которого входят, наряду с фактором X, фактор V, ионы кальция и фосфолипидные матрицы. Активация факторов в этом комплексе может осуществляться двумя путями: внешним и внутренним. Запуск внешнего реализуется поступлением из тканей в кровь тканевого тромбопластина (или тканевого фактора - ТФ). Свертывание по этому механизму, который в пробирке имитируется добавлением к плазме тканевого тромбопластина, обозначается как протромбиновый (тромбопластиновый) тест. Коагуляция в нем происходит очень быстро, в течение 12-15 с.
Другим механизмом запуска процесса свертывания крови является внутренний путь. Он связан с контактом крови с субэндотелием (коллагеном), а также с разрушенными эритроцитами (при внутрисосудистом гемолизе), а в пробирке – контактом со стеклом. При этом механизме последовательно активируются в комплексах «фактор XII (фактор Хагемана) + прекалликреин + фактор XI», а затем «фактор XI + фактор IX + фактор VIII», после чего процесс, как и в предыдущем механизме, замыкается на активации фактора X с образованием протромбиназного комплекса. Внутренний механизм первого этапа свертывания протекает намного медленнее, чем внешний [42]. Он определяется общим временем свертывания крови, временем рекальцификации цитратной плазмы и активированным парциальным тромбопластиновым временем (АПТВ).
В отличие от пробирочных опытов в организме оба указанных выше механизма свертывания крови не строго изолированы друг от друга, а взаимодействуют между собой.
Второй этап свертывания крови заключается в активации протромбиназным комплексом (т. е. фактором Ха в комплексе с фактором Va + Ca2+ + фосфолипидная матрица) протромбина, который, расщепляясь, превращается в активный тромбин (фактор IIa). Таким образом, второй этап процесса свертывания завершается образованием активного тромбина.
На третьем этапе процесса этот активный тромбин отщепляет от α- и β -цепей фибриногена два пептида А и два пептида В, в результате чего в плазме крови повышается содержание этих пептидов и одновременно – мономеров фибрина (МФ) с четырьмя свободными связями. Вслед за этим начинается процесс полимеризации МФ – образование их димеров, затем тетрамеров и, в конечном счете – волокон и сгустков фибрина [50].
1.1.2 Противосвертывающие механизмы и система фибринолиза
В свертывающей системе крови действуют силы как аутокатализа, или самоускорения, так и самоторможения, в силу чего многие факторы свертывания крови и их фрагменты приобретают свойства антикоагулянтов. В частности, сам фибрин и продукты расщепления фибриногена плазмином обладают противосвертывающим действием. Однако наиболее важны для поддержания крови в жидком состоянии так называемые первичные, т. е. самостоятельно синтезируемые и постоянно находящиеся в крови, антикоагулянты (табл. 2). Помимо перечисленных в табл. 2 важнейших физиологических антикоагулянтов, в патологических условиях в крови могут появляться в высоком титре иммунные ингибиторы факторов свертывания крови - антитела к факторам VIII, IX и другим, а также к фосфолипидным матрицам, на которых взаимодействуют и активируются факторы свертывания крови (антифоcфолипидный синдром) [42].
Таблица 2 Основные первичные антикоагулянты
|
Наименование |
Механизмы действия |
|
Ингибитор внешнего пути свертывания крови (TFPI) |
Синтезируемый в эндотелии белок, инактивирующий комплекс «ТФ+фактор Vila+фактор Ха» |
|
Тромбомодулин |
Гликопротеин мембраны эндотелиальной клетки, связывающий и инактивирующий тромбин, в комплексе с которым тромбин сохраняет способность активировать протеин С |
|
«Контактные ингибиторы» (фосфолипидный, плацентарный) |
Подавляют пусковой механизм внутреннего пути свертывания крови (комплекс факторов XIIa-XIa и калликреина) |
|
Антитромбин III (AT III) |
Прогрессивно действующий ингибитор тромбина, фактора Ха и в меньшей степени других протеаз, участвующих в свертывании крови |
|
Гепарин и другие кислые мукополисахариды |
В комплексе с AT III действуют как мощные антикоагулянты |
|
Протеин С |
Синтезируемый гепатоцитами витамин К-зависимый ингибитор факторов Villa и Va, эндогенный активатор плазминогена. Активируется тромбином и комплексом «тромбин+тромбомодулин» |
Фибринолитическая (плазминовая) система, как и система свертывания крови, активируется как по внешнему, так и по внутреннему механизму.
Наиболее мощным внешним активатором этой системы является продуцируемый в эндотелии, а также в ряде тканей тканевый плазминогеновый активатор (ТПА), на долю которого приходится около 70% всего активаторного эффекта. Еще около 15% внешнего механизма активации приходится на фермент урокиназу, который вырабатывается в почках и в наибольшей своей части выделяется с мочой, а в кровь попадает в значительно меньшем количестве. На остальные активаторы, поступающие в кровь извне, приходится лишь небольшая часть указанной активности, но в патологических условиях она может быть резко усилена тканевыми и лейкоцитарными протеазами и другими факторами.
Внутренний механизм активации фибринолиза осуществляется в основном комплексом «фактор XIIа+калликреин+высокомолекулярный кининоген» (так называемый XIIа - калликреин зависимый фибринолиз), активированными протеинами C+S.
Механизмы активации фибринолиза замыкаются на плазминогене, который трансформируется в активный фермент – плазмин (в прошлом он обозначался как фибринолизин) [25].
Плазминоген и его активаторы фиксируются в основном на сгустках фибрина в тромбах, в связи с чем лизис фибрина преобладает над лизисом растворенного в плазме фибриногена. Кроме того, действию плазмина на фибриноген препятствует содержащийся в плазме мощный ингибитор этого фермента – а>2>-антиплазмин. Однако при чрезвычайно сильной активации плазминогена происходит истощение а>2>-антиплазмина, и в плазме крови обнаруживается большое количество продуктов как фибринолиза, так и фибриногенолиза. Эти продукты не идентичны друг другу. В результате расщепления фибриногена в плазме нарастает количество конечного продукта этого процесса - фрагмента D, тогда как при расщеплении фибрина увеличивается концентрация фрагментов D-D (димера) и D-E-D. Нарастание содержания в крови D-димера является важным маркером массивного тромбоза кровеносных сосудов, тромбоэмболии, диссеминированного внутрисосудистого свертывания крови [20, 25, 45].
1.1.3 Нарушения системы гемостаза у онкологических больных в раннем послеоперационном периоде
У онкологических больных система гемостаза реализуется преимущественно по внешнему механизму процесса свертывания крови, т.е. путем воздействия тканевого тромбопластина и так называемых раковых прокоагулянтов на факторы VII и Х. Многие виды опухолевых клеток продуцируют и выделяют в кровь большое количество ТФ, а также особых “раковых прокоагулянтов”, обладающих способностью активировать как фактор VII, так и фактор Х [8].
После операции значительно повышена интенсивность агрегации тромбоцитов. Эти изменения можно объяснить появлением тромбина и АДФ в результате прокоагулянтной активности опухолевых клеток и взаимодействием сиалопротеина мембран опухолевых клеток с тромбоцитами [8, 19, 26, 35].
В первую фазу свертывания крови и активации коагуляционного каскада возрастает скорость образования тромбопластина и тромбина, быстрее достигается максимальная активность этих факторов свертывания; во вторую фазу повышается активность факторов протромбиназного комплекса (II, VII, IX, X). Эти изменения индуцированы поступлением в кровоток высокоактивных прокоагулянтных субстанций из опухолевой ткани, наиболее важной из которых является серинопротеаза, которая независимо от тканевого фактора и фактора VIIа ведет к образованию фактора Ха. Отмечается увеличение концентрации фибриногена, что может быть связано с повышенным расходом фибрина на построение стромы опухоли и потреблением его в процессе внутрисосудистого свертывания крови [35].
Увеличивается количество РФМК, свидетельствуя о наличие в плазме комплексов фибрин-мономеров с продуктами деградации фибриногена. Таким образом оперативное вмешательство у онкологических больных вызывает развитие подострого ДВС-синдрома. При этом повышается агрегация тромбоцитов, потребление фибриногена и антитромбина III, увеличивается концентрация РФМК [43].
Гемокоагулирующие свойства легких
Легочная паренхима человека и животных богата тромбопластином. Т. Аструп и Пермин первыми обнаружили в легких большое количество активаторов фибринолиза. Легочная ткань содержит плазмин, плазминоген, активаторы и проактиваторы плазминогена, а также антиплазмин [44].
Гемокоагулирующие и фибринолитические агенты легких не только участвуют в локальном гемостазе, но и выделяются в кровь. В кровь поступают тромбопластин, естественные антикоагулянты, активаторы и ингибиторы фибринолиза.
Освобождение гемокоагулирующих и фибринолитических веществ из легких позволяет считать их одним из органов – эффекторов (наряду с сосудами, почками, желудочно-кишечных трактов), регулирующих свертывание крови и ее фибринолитическую активность. В стрессовых ситуациях и операциях на легких эти соединения выделяются в кровоток в более значительном количестве, нежели в норме, приводя к нарушениям гемокоагуляции. Гиперкоагулемия и внутрисосудистое свертывание крови при операциях на легких связаны с их тромбопластической активностью [44].
Гемокоагулирующие свойства предстательной железы, почек и мочевыводящих путей
Тромбогеморрагические осложнения при урологических операциях возникают возникают особенно часто. Причину этих осложнений связывают с поступлением в кровоток из оперируемого органа гемокоагулирующих и фибринолитических агентов [44].
Предстательная железа и ее аденома содержит активные тромбопластин, естественные антикоагулянты, антигепариновый фактор, фибриназу, ферменты, подобные плазменным факторам V и VII, активаторы и ингибиторы фибринолиза, вещества активно участвующие в сосудисто-тромбоцитарном гемостазе. При попадании в кровоток тканевой жидкости предстательной железы или ее аденомы доминирует действие тромбопластических и антифибринолитических соединений, а это способно привести к интравазальной гемокоагуляции и торможению фибринолиза.
При урологических операциях на свертывание крови могут влиять и гемокоагулирующие вещества мочевыводящих путей, которые травмируются при операционном вмешательстве. Экстракты мочевыводящих путей содержат антикоагулянты, тканевую фибриназу, усиливающую стабилизацию фибрина. Таким образом, мочевыводящие пути содержат весьма активный тромбопластин, фибриназу, естественные антикоагулянты, активаторы и ингибиторы фибринолиза.
Почки относятся к органам с высокой тромбопластической и фибринолитической активностью. В почках синтезируются и освобождаются в кровь и мочу тромбопластин, антигепариновые субстанции, антикоагулянты, вещества подобные плазменным факторам V и ХIII. При попадании мочи на раневую поверхность при аденомэктомии или при операциях на мочевом пузыре она будет стимулировать локальное свертывание и тормозить локальный фибринолиз, создавая надежный гемостаз в операционном поле [44].
Гемокоагулирующие свойства желудочно-кишечного тракта и поджелудочной железы
Местные и генерализованные тромбогеморрагические нарушения при заболеваниях пищеварительной системы встречаются весьма часто [44].
При онкологических заболеваниях гемокоагулирующие свойства стенок ЖКТ меняются. Опухоли обладают большей тромбопластической и антигепариновой активностью, чем не пораженные стенки. Экстракты опухоли желудка укорачивают тромбиновое время плазмы. Вытяжки же здорового желудка обладают высокой антикоагулянтной активностью. Опухоли желудка содержат меньше фибриназы, чем интактные участки. Фибринолитическая активность опухоли снижена вследствие увеличения в них ингибиторов фибринолиза. Фибринолитические компоненты опухолей содержат проактиватор и активатор плазминогена, плазминоген, большое количество ингибиторов. Обнаружено уменьшение содержания антигепариновых и фибрин-стабилизирующих соединений, почти полное отсутствие гепарина, комплексные соединения гепарина (с фибриногеном, адреналином, плазмином, серотонином). Усиление антигепариновой активности в опухоли ведет к связыванию гепарина, что благоприятствует действию активного тромбопластина опухолевой ткани и приводит к образованию в ней фибрина, защищающего клетки опухоли от канцеролитических агентов крови. В крови, оттекающей от пораженного раком желудка, усилена тромбопластическая и угнетена фибринолитическая активность, что объясняется выделением из опухоли ингибиторов фибринолиза и угнетением активаторов плазминогена [44].
Ткани поджелудочной железы обладают тромбопластической активностью, проявляют антифибринолитическое действие. При операциях на поджелудочной железе трипсин и гемокоагулирующие субстанции проникают в кровоток. Трипсин обладает многосторонним действием на свертывание крови: он усиливает агрегацию тромбоцитов, активирует плазменные факторы ХII, ХI, Х, VII, II, ХIII, запуская свертывание крови как по внешнему, так и по внутреннему пути. Он лизирует фибриноген и фибрин с образованием продуктов их деградации. Таким образом, трипсин усиливает течение тромбогеморрагического синдрома [44].
1.2 Пептидергическая система
1.2.1 Механизм образования активных форм пептидов
В регуляции гемостаза принимают участие пептиды. Это природные или синтетические соединения, молекулы которых построены из остатков аминокислот, соединенных между собой пептидными (амидными) связями C(O)–NH. Могут содержать в молекуле также неаминокислотную компоненту (напр., остаток углевода). Большинство биологически активных пептидов синтезируется в составе высокомолекулярных неактивных предшественников – препробелков, которые подвергаются посттрансляционной модификации различного типа [18]. Секретируемые белково-пептидные продукты синтезируются на мембраносвязанных рибосомах ЭПР. Благодаря наличию на N-конце препроформы нейропептида набора гидрофобных аминокислот, так называемой сигнальной последовательности, предшественник транслоцируется через мембрану ЭПР [1]. Внутри ЭПР сигнальная последовательность отщепляется от полипептидной цепи сигнальной пептидазой. Далее процессинг осуществляется в ходе передвижения молекул пропептидов по гранулярному ЭПР, комплексу Гольджи и в секреторных везикулах [38, 51, 62, 72].
Сначала под действием эндопептидаз, расщепляющих нейропептиды по синглетным и дуплетным остаткам основных аминокислот, образуются неактивные пептид, содержащие, как правило, “лишние” N- или, в основном, С-концевые остатки аминокислот. Удаление этих аминокислот в секреторных везикулах осуществляется соответственно аминопептидазо-В-подобным(и) и карбоксипептидазо-В-подобным(и) ферментами [14, 72].
Пептиды играют важную роль во многих процессах, происходящих в организме, например при свертывании крови и фибринолизе, оплодотворении, иммунном ответе (активации системы комплемента), гормональной регуляции. Уровень биологически активных пептидов в организме в значительной степени определяется активностью ферментов их обмена, к которым в частности принадлежат АПФ и КПN [21, 23, 30].
В связи с этим, большой интерес представляет изучение активности данных ферментов у онкологических больных в послеоперационном периоде, когда происходят существенные нарушения в системе гемостаза.
1.2.2 Вазоактивные пептиды и их роль в регуляции гемостаза
Наиболее важную роль в регуляции гемостаза играют вазоактивные пептиды ангиотензин и брадикинин [48].
Ангиотензины – пептиды, образующиеся в организме из ангиотензиногена, представляющего собой гликопротеид (альфа-2-глобулин) плазмы крови, синтезирующийся в печени. Под воздействием ренина (фермент, образующийся в юкстагломерулярном аппарате почек) полипептид ангиотензиноген, не обладающий прессорной активностью, гидролизуется, образуя ангиотензин I - биологически неактивный декапептид, легко подвергающийся дальнейшим преобразованиям. Под действием ангиотензинпревращающего фермента (АПФ), образующегося в легких, ангиотензин I превращается в октапептид – ангиотензин II, являющийся высокоактивным эндогенным прессорным соединением. Ангиотензин II - основной эффекторный пептид ренин-ангиотензин-альдостероновой системы. Он оказывает сильное сосудосуживающее действие, вызывает быстрое повышение АД. Пептид является стимулятором образования свободных радикалов, в частности супероксидных анионов, которые инактивируют NO, промотируют синтез пироксинитрита и снижает эффективность NO – опосредуемой сосудистой дилатации. Кроме того, вызывает агрегацию тромбоцитов, активирует ингибитор активатора плазминогена, способствуя формированию эндотелиальной дисфункции. Ангиотензин II стимулирует секрецию альдостерона, а в больших концентрациях - увеличивает секрецию антидиуретического гормона (повышение реабсорбции натрия и воды, гиперволемия) и вызывает симпатическую активацию. Все эти эффекты способствуют развитию гипертензии. Ангиотензин II быстро метаболизируется (период полураспада - 12 мин) при участии аминопептидазы А с образованием ангиотензина III и далее под влиянием аминопептидазы N - ангиотензина IV, обладающих биологической активностью. Ангиотензин III стимулирует выработку альдостерона надпочечниками, обладает положительной инотропной активностью. Ангиотензин IV, предположительно, участвует в регуляции гемостаза. Многолетние исследования РААС не только выявили важное значение этой системы в регуляции гемостаза, в развитии сердечно-сосудистой патологии, влиянии на функции органов-мишеней, среди которых наиболее важными являются сердце, кровеносные сосуды, почки и мозг, но и привели к созданию лекарственных средств, целенаправленно действующих на отдельные звенья РААС. Кроме того, на фоне повышенного уровня ангиотензинов I и II происходит образование ангиотензина-(1-7). Ангиотензин-(1-7) образуется из ангиотензина I под действием нейтральной эндопептидазы и из ангиотензина II под действием пролиловой эндопептидазы и является еще одним эффекторным пептидом РААС, оказывающим вазодилатирующее и натрийуретическое действие. Эффекты ангиотензина-(1-7) опосредованы через так называемые, не идентифицированные пока, АТ>х>-рецепторы. Недавние исследования дисфункции эндотелия при артериальной гипертензии позволяют предположить, что кардиоваскулярные эффекты блокаторов ангиотензиновых рецепторов могут быть также связаны с модуляцией эндотелия и влиянием на продукцию оксида азота (NO). Полученные экспериментальные данные и результаты отдельных клинических исследований достаточно противоречивы. Возможно, на фоне блокады АТ>x>-рецепторов, увеличивается эндотелийзависимый синтез и высвобождение оксида азота, что способствует вазодилатации, уменьшению агрегации тромбоцитов и снижению пролиферации клеток.
Брадикинин – естественно образующийся полипептид, состоящий из 9 аминокислот. Брадикинин расширяет просвет периферических и коронарных сосудов, снижает артериальное давление, способствует синтезу NО в эндотелии и усилению антиагрегативной активности крови.
Пептид повышает проницаемость капилляров, сокращает гладкую мускулатуру бронхов и других органов, стимулирует диапедез лейкоцитов и вызывает болевой эффект. Брадикинин освобождает гистамин из тучных клеток, стимулирует синтез и освобождение простагландинов и фактора некроза опухолей в различных тканей, освобождение ряда интерлейкинов, способствует процессам репарации и обладает инсулиноподобным действием, стимулируя захват глюкозы периферическими тканями, модулирует передачу нервных импульсов в центральной и периферической нервной системе.
Брадикинин участвует в периферической регуляции кровяного давления и широком спектре физиологических и патофизиологических эффектов, и особенно в развитии воспаления. В нормальном состоянии брадикинин обычно не присутствует в крови, а образуется в ней лишь при определенных условиях: например, в случае повреждения ткани или изменения кислотности и температуры крови. Многообразное биологическое действие брадикинин осуществляет при взаимодействии с двумя рецепторами В>1> и В>2>.
Период полураспада брадикинина в большом круге кровообращения равен 17-24 сек., еще быстрее он разрушается в малом круге кровообращения. Это обусловлено наличием в крови и тканях высокоактивных ферментов – кининаз, осуществляющих физиологический контроль уровня кининов [67]. Наиболее важную роль в метаболизме брадикинина играют два фермента – кининаза I (Карбоксипептидаза N), локализованная в плазме крови, и кининаза II (ангиотензинпревращающий фермент) – мембранно-связанный фермент, локализованный в эндотелии сосудов, главным образом легких, а также в тканях почек и в меньшем количестве в тканях других органов.
Хорошо известно, что такие процессы, как гемостаз, водно-солевой обмен, многие функции желудочно-кишечного тракта и репродуцирующей системы могут повреждаться, являясь мишенями воспаления и боли, при этом центральным событием является активация калликреин-кининовая система и образование брадикинина [48].
1.2.3 Ферменты обмена вазоактивных пептидов
Ангиотензинпревращающий фермент
Ангиотензинпревращающий фермент (АПФ, дипептидилкарбоксипептидаза A, кининаза II, карбоксикатепсин, пептидилдипептидаза, КФ 3.4.15.1) – гликопротеин, состоящий из одной большой полипептидной цепи. Кроме того, является Zn2+-содержащей дипептидилкарбоксипептидазой [14]. Впервые был выделен Скеггом и соавт. из сыворотки крови лошади. Основная масса фермента находится в мембранно-связанном состоянии – он является интегральным белком плазматической мембраны. Почти вся молекула АПФ локализована вне клетки, гидрофобный трансмембранный участок находится на карбоксильном конце полипептидной цепи, а внутриклеточный гидрофильный участок насчитывает всего 30 остатков аминокислот [53].
Фермент располагается на внешней поверхности плазматической мембраны разных клеток – эндотелиальных (артерии, вены, капилляры), специализированных эпителиальных, находящихся в местах интенсивного всасывания или выделения жидкости и солей (канальцы почек, слизистая оболочка кишечника, сосудистые сплетения мозга, цилиарное тело глаза, плацента), нейроэпителиальных (дендриты, аксоны, нервные окончания), на клетках мононуклеарного ряда (моноциты, макрофаги, фибробласты, лимфоциты), а также в репродуктивных органах. Растворимая форма фермента присутствует практически во всех биологических жидкостях: плазме, лимфе, слезной, спинномозговой, внутриглазной, амниотической жидкостях [22, 54]. До недавнего времени считалось, что растворимая форма освобождается из мембранно-связанной формы в результате отщепления С-концевого якорного фрагмента протеолитическим ферментом – секретазой, находящейся также на поверхности мембраны. Однако в 1998 г. было показано, что существует второй путь образования растворимой формы АПФ, что она может синтезироваться внутри клетки. В эндотелиальных клетках пупочной вены человека была обнаружена мРНК, кодирующая растворимую форму АПФ, не имеющую трансмембранного гидрофобного участка [67, 72].
РI фермента из различных органов
и тканей колеблется в пределах от 4,6 до
5,1. Фермент имеет рН-оптимум 7,0-8,0;
активируется ионами Cl ,
NO
,
NO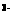 ,
SO
,
SO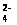 ингибируется соединениями, содержащими
SH-группу, хелаторами (ЭДТА, о-фенантролин),
брадикининпотенциирующим фактором (K>i>
= 40 нм), ДТТ, 2-меркаптоэтанолом,
додедилсульфатом натрия. Кроме того,
существуют специфические ингибиторы
АПФ – каптоприл (К
ингибируется соединениями, содержащими
SH-группу, хелаторами (ЭДТА, о-фенантролин),
брадикининпотенциирующим фактором (K>i>
= 40 нм), ДТТ, 2-меркаптоэтанолом,
додедилсульфатом натрия. Кроме того,
существуют специфические ингибиторы
АПФ – каптоприл (К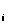 = 20 нм), лизиноприл (К
= 20 нм), лизиноприл (К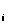 =
3-10 нм), и эналаприл (К
=
3-10 нм), и эналаприл (К =25-35 нм).
=25-35 нм).
Фермент катализирует превращение ангиотензина I в ангиотензин II (Km = 4-70 мкМ), последовательно отщепляет два дипептида с С-конца брадикинина (кининазная реакция с участием АПФ осуществляется преимущественно в плацентарном цитозоле), расщепляет неокиоторфин с образованием киоторфина, Met-энкефалин-Arg6-Phe7 с образованием Met–энкефалина, вещество Р и вещество К, холецистокинин и гастрин, энкефалин, нейротензин, нейрокинины А и В, рилизинг-фактор лютеинизирующего гормона. АПФ осуществляет образование Met-энкефалин-Arg6 из Met-энкефалин-Arg6-Gly7-Leu8, отщепляет последовательно два дипептида с С-конца динорфина А 1-8, расщепляет натрийуретический фактор из мозга и предсердий, вазопрессин, окситоцин. Отщепление АПФ C-концевого Phe-Arg от атриопептина II превращает его в атриопептин I, что сопровождается потерей его свойства расслаблять гладкую мускулатуру сосудов при сохранении натрийуретического действия.
Активность АПФ ингибируется многими биологически активными пептидами и их предшественниками: неокиоторфином, Met-энкефалин-Arg6-Phe7, -липотропином, веществом Р, брадикинином и лей-энкефалин-арг6 и некоторыми дипептидами.
Относительно недавно было обнаружено, что АПФ является также компонентом тканей, богатых фибриллярным коллагеном (матрикс сердечных клапанов, рубцы, образующиеся в результате инфаркта миокарда, и др.), и что его содержание повышается с усилением фиброза. Предполагается, что он может оказывать влияние на состав внеклеточного матрикса, в частности на синтез коллагена [22]. Кроме того, АПФ был обнаружен в атеросклеротических бляшках в стенках сосудов, что указывает на участие фермента в атеросклеротических процессах [67].
Фермент АПФ вовлекается в физиологический контроль за циркуляцией крови в послеоперационный период, регулируя калликреин-кининовую и ренин-ангиотензивую системы [48, 74]. В связи с этим представляет интерес изучения активности АПФ в сыворотке крови у онкологических больных в ранней послеоперационный период.
Карбоксипептидаза N
КПN (кининаза I, аргинин-карбоксипептидаза) впервые выделена и очищена Erdos и Sloane из плазмы крови человека. Фермент локализован в плазме крови, обнаружен в стенках кровеносных сосудов, слизистой оболочке носа, моче, имеется единичная работа по выделению фермента из микроворсинок плаценты человека.
Фермент имеет Mr 280 кДа и состоит из четырёх субъединиц трёх типов: двух с Mr 88 кДа и по одной с Mr 55 кДа и 48 кДа. Субъединицы с Mr 88 кДа гликозилированы (на долю углеводов приходится 29% массы), не обладают ферментативной активностью и, по-видимому, стабилизируют фермент в плазме крови [62]. Они содержат 12 богатых лейцином областей, участвующих в связывании с активными субъединицами [70]. Субъединицы с Mr 48 кДа и 55 кДа обладают ферментативной активностью и не содержат в своём составе углеводных остатков. Ограниченное протеолитическое расщепление субъединицы с Mr 55 кДа сериновыми протеиназами приводит к превращению её в субъединицу с Mr 48 кДа, более глубокое расщепление даёт два фрагмента с Mr 27 и 21 кДа. Образовавшиеся фрагменты в ассоциированном состоянии обладают большей активностью, чем нативные субъединицы, но стабильность фермента при этом снижается.
КПN содержит в активном центре ион Zn2+, проявляет максимальную активность при pH 7,0-7,8, сохраняет около 50% от максимальной активности при pH 6,0 [55, 58]. Фермент ингибируется ЭДТА и о-фенантролином, МГТК (K>i> = 0,5 мкМ), ГПЯК (K>i> = 0,9 мкМ), ГЭМЯК (K>i> =1,5 мкМ), АПМЯК (K>i> = 52 мкМ), гистаргином и протамином (Ki = 0,32 мкМ) [56, 66]. Несмотря на то, что дитиотреитол значительно активирует фермент, 2-меркаптоэтанол и реагенты на сульфгидрильные группы ПХМФС и ПХМБ не влияют на его активность. ФМСФ, ДФФ и апротинин также не влияют на активность фермента.
КПN отщепляет остатки аргинина и лизина с C-конца различных синтетических пептидов, при этом скорость расщепления субстратов, содержащих C-концевые остатки лизина в 5-6 раз выше, чем соответствующих пептидов с C-концевым аргинином [57]. КПN отщепляет C-концевые остатки аргинина и лизина от многих природных пептидов и белков: брадикинина (значение K>m> по данным разных авторов составляет от 0,4 до 19 мкМ), Met5-энкефалин-Arg6 (K>m> = 49 мкМ) [69], Leu5-энкефалин-Arg6 (K>m> = 57 мкМ), Met5-энкефалина-Lys6 (K>m> = 216 мкМ), анафилотоксинов [49], креатинкиназы [75], -енолазы [76], фибринопептидов .
Несмотря на многолетнюю историю изучения КПN, её биологическая роль во многом остаётся неясной. Фермент вначале был описан как карбоксипептидаза, инактивирующая брадикинин и, следовательно, способная вовлекаться в регуляцию артериального давления и тонуса кровеносных сосудов. Однако показано, что реальный вклад фермента в инактивацию брадикинина in vivo не превышает 10-12%. Вместе с тем, некоторые авторы предполагают, что КПN может играть роль модулятора действия брадикинина [55, 69].
Активность КПN изменяется при воспалении, при некоторых видах астмы, послеоперационных осложнениях. Поскольку фермент расщепляет пептиды, участвующие в развитии воспалительных реакций (брадикинин и анафилотоксины), и его активность в крови снижается при введении рекомбинантного интерлейкина-1, вероятно, что КПN вовлекается в развитие воспалительных реакций [48].
Так как активность фермента повышается в моче больных с первичным альдостеронизмом, то, возможно, что активность КПN в почках может регулироваться альдостероном. Не исключено, что фермент может играть некоторую роль в регуляции водно-солевого обмена в почках.
Поскольку очищенная КПN способна уменьшать связывание плазминогена с клетками, хотя и не уменьшает скорости полного лизиса сгустка крови, можно предположить, что она вовлекается в процессы коагуляции крови. Однако, её реальный вклад в этот процесс in vivo пока не ясен.
Таким образом, несмотря на предположения, что КПN возможно вовлекается в регуляцию артериального давления, тонуса кровеносных сосудов, развитие воспалительных реакций, процессы свёртывания крови, её биологические функции не совсем ясны. Представляется возможным, что она вносит вклад в расщепление многих эндогенных субстратов и регуляцию многих физиологических процессов, однако в подавляющем большинстве случаев она не является единственным ферментом, участвующем в том или ином процессе. Вместе с тем, разнообразные функции вызывают интерес к изучению фермента при самых различных состояниях организма, в том числе связанных с нарушениями гемостаза [10].
В связи с этим представляет интерес изучения активности КПN в сыворотке крови онкологических больных в раннем послеоперационном периоде.
гемостаз онкологический больной карбоксипептидаза
1.2.4 Изменения в пептидергической системе онкологических больных
Интерес к изучению протеолитических ферментов при злокачественных новообразованиях обусловлен их разнообразным влиянием на процесс канцерогенеза [13, 15]. В работе И. Л. Вовчука, А. Е. Дизика, М. Г. Ануфриева и др. было проведено сравнительное изучение протеиназной активности сыворотки крови у женщин с онкологическими заболевания эндометрия, при этом установлена обратнопропорциональная зависимость между активностью трипсиноподобных протеиназ в сыворотке крови и степенью дифференциации злокачественной опухоли. При гиперплазии наибольшая активность трипсиноподобных протеиназ в сыворотке крови наблюдается при аденоматозе, а наименьшая – при эндометриозе [15].
Наличие злокачественной опухоли в матке характеризовалось увеличением активности трипсиноподобных протеиназ в сыворотке крови по сравнению с показателями доноров: у женщин в возрасте от 51 до 60 лет – в 1,24 раза, у женщин в возрасте от 61 до 70 – в 2,0 раза. По сравнению с доброкачественными опухолями активность исследуемых протеиназ при наличии злокачественного процесса была выше в 1,4 раза. Следует отметить, что у больных старше 70 лет установили значительно более высокую (в 3,78 раза) протеиназную активность при наличии злокачественной опухоли. В то же время в этой возрастной группе показатели протеиназной активности как при наличии доброкачественного, так и злокачественного процесса, были в 3,3 и в 2,0 раза ниже, чем в других возрастных группах. Это можно объяснить, вероятнее всего, снижением скорости метаболических процессов, свойственных данному возрасту [31].
Снижение протеиназной активности в сыворотке крови при наличии доброкачественной опухоли и увеличение этого показателя в случае злокачественной опухоли может свидетельствовать, с одной стороны, о неспецифичности ответной реакции организма, а с другой - об отличии протеиназ тканей доброкачественной и злокачественной опухолей.
На основании полученных исследоватили предполагают, что наличие достаточно высокой активности трипсиноподобных протеиназ (выше 36,00 нмоль/мин на 1 мг белка) может свидетельствовать о плохом прогнозе заболевания и, вероятно, показания протеиназной активности свыше 100,00 нмоль/мин на 1 мг белка могут свидетельствовать об активно идущих процессах трансформации клеток, которые наблюдаются при аденоматозе (cancer in situ) [6, 15, 41].
Глава 2. Материалы и методы исследования
2.1 Материал исследования
Активность ферментов определяли в сыворотке крови онкологических больных. Кровь брали в первый день после операции из локтевой вены, далее ее инкубировали 30 минут при комнатной температуре, центрифугировали 20 минут при 4000g и получали сыворотку, в которой определяли активность карбоксипептидазы N и ангиотензинпревращающего фермента.
Изучение активности ферментов было проведено у 45 мужчин в возрасте от 49 до 70 лет. Больные были оперированы по поводу опухолей легких, брюшной полости и мочеполовой системы. Они составили три экспериментальные группы. Первая группа – больные торакального отделения (18 человек); вторая – абдоминального отделения (15 мужчин); третья – урологического отделения (12 человек).
Параллельно с нашим исследованием Корниенко Е. М. проводилась работа по определению параметров гемостаза у онкологических больных данных групп, которые мы использовали в своей работе.
2.2 Методы исследования
2.2.1 Метод определения активности карбоксипептидазы N
Активность КПN определяли в сыворотке крови нингидриновым методом [62].
Опытные пробы содержали 20 мкл 3,5 мМ раствора CoSO>4>, приготовленного на 100 мМ Трис-HCl буфере, pH 7,6 и 40 мкл препарата фермента. Контрольные пробы содержали 20 мкл 100 мМ Трис-HCl, pH 7,6 и 40 мкл препарата фермента. Пробы преинкубировали 8 мин при 37oC, реакцию начинали прибавлением в опытные пробы 10 мкл гиппурил-арг, приготовленного на 100 мМ Трис-HCl буфере, pH 7,6 (конечная концентрация в пробе 5 мкМ). Реакцию проводили 120 мин при 37oC и останавливали прибавлением 30 мкл 10 % трихлоруксусной кислоты.
Пробы центрифугировали 20 мин при 4000 об/мин, отбирали 50 мкл надосадочной жидкости, приливали 1 мл нингидринового реактива. Далее пробы встряхивали, выдерживали 12 мин на кипящей водяной бане и измеряли оптическую плотность на КФК-2 при 595 нм против H>2>O [58].
Активность КПN определяли как разность оптической плотности опытных и контрольных проб и выражали в нмоль аргинина, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
Концентрацию белка в пробах определяли биуретовым методом.
2.2.2 Метод определения активности ангиотензинпревращающего фермента
Активность АПФ определяли в сыворотке крови нингидриновым методом по образованию гли-арг из кбз-гли-гли-арг при рН 8,2 как активность, ингибируемую каптоприлом. Препарат фермента (40 мкл) смешивали с 20 мкл 35 мкМ каптоприла в 100 мМ Трис-НСl буфере, рН 8,2, или 20 мкл буфера и преинкубировали 8 мин при 37˚С. Реакцию начинали прибавлением 10 мкл раствора кбз-гли-гли-арг в вышеуказанном буфере (конечная концентрация в пробе 5 мкМ). Через 120 мин реакцию останавливали прибавлением 30 мкл 10% раствора трихлоруксусной кислоты [59]. Пробы центрифугировали 30 мин при 4000 об/ мин. Отбирали 50 мкл надосадочной жидкости и определяли количество образовавшегося гли-арг нингидриновым методом [62]. Пробы колориметрировали на КФК-2 при =590 нм. Активность АПФ определяли как разность в оптической плотности проб не содержащих и содержащих каптоприл. Активность фермента выражали в нмоль гли-арг, образовавшегося за 1 мин инкубации в пересчете на 1 мг белка.
Концентрацию белка определяли биуретовым методом.
2.2.3 Метод определения содержания белка
Содержание общего белка определяли биуретовым методом. Принцип метода основан на том, что ионы меди в щелочной среде взаимодействуют с пептидными связями белков сыворотки крови с образованием комплекса красного цвета, интенсивность окраски которого пропорциональна концентрации общего белка.
Опытные пробы содержали 50 мкл сыворотки крови и 2,5 мл рабочего раствора биуретового реагента (концентрат биуретового реагента развести дистиллированной водой в соотношении 1:19). Контрольные пробы содержали 50 мкл дистиллированной воды и 2,5 мл рабочего раствора биуретового реагента. В калибровочную пробу добавляли 50 мкл калибровочного раствора общего белка (раствор бычьего сывороточного альбумина с концентрацией 60 г/л с добавлением хлористого натрия 9 г/л и азида натрия 1 г/л).
Содержимое пробирок тщательно
перемешивали, избегая образования пены,
инкубировали при комнатной температуре
(+ 18 - 25 С)
в течение 30 минут, после чего измеряли
величину оптической плотности
калибровочной и опытных проб против
контрольной пробы при длине волны 540
нм.
С)
в течение 30 минут, после чего измеряли
величину оптической плотности
калибровочной и опытных проб против
контрольной пробы при длине волны 540
нм.
Концентрацию общего белка рассчитывали, как отношение оптической плотности опытной пробы к оптической плотности калибровочной пробы умноженная на концентрацию общего белка в калибровочном растворе (60 г/л).
2.3 Статистическая обработка результатов исследования
Достоверность отличий между средними определяли с использованием t-критерия Стьюдента [16, 29, 40]. Корреляционный анализ проводили с помощью программы «Статистика» (версия 6.0).
Глава 3. Результаты и обсуждение
3.1 Исследование активности карбоксипептидазы N в сыворотке крови онкологических больных в раннем послеоперационном периоде
Результаты исследования показали увеличение активности КПN в сыворотке крови онкологических больных торакального и абдоминального отделения в ранний послеоперационный период по сравнению с пациентами урологического отделения (рис. 1).
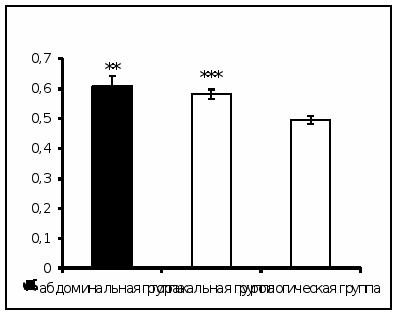
Рис. 1. Активность КПN у онкологических больных в ранний послеоперационный период (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, Mm, n=1218; достоверность отличий: ** – р < 0,01, *** – р < 0,001 относительно урологической группы).
КПN локализован в плазме крови, обнаружен в стенках кровеносных сосудов. Легкие, желудочно-кишечный тракт имеют обширную капиллярную систему, после операции происходит повреждение этой системы, и вероятно, выход фермента в кровяное русло, что в итоге приводит к увеличению его активности [60].
При проведении корреляционного анализа (табл. 3), была выявлена отрицательная взаимосвязь между активностью КПN и ХЗФ у больных абдоминального отделения. В процессе свертывания крови калликреин расщепляет высокомолекулярный кининоген до активного кинина, который повышает чувствительность фактора XI к действию фактора XIIа [48]. Известно, что КПN участвует в деградации брадикинина [74], вероятно, увеличение активности этого фермента у данной группы больных может способствовать уменьшению свертывания крови по внутреннему пути. Кроме того, фактор Хагемана может включаться в фибринолиз, снижая время лизиса фибринового сгустка.
Обнаружена положительная корреляционная взаимосвязь между активностью КПN и уровнем фибриногена у пациентов урологического отделения. Фибриноген относится к острофазным белкам, концентрация которого резко возрастает в послеоперационный период, что усиливает тромбообразование на данном этапе [8]. Этот белок определяет вязкость плазмы крови, повышает агрегацию тромбоцитов и эритроцитов. Под действием тромбина из фибриногена образуются фибрин-мономеры, из которых впоследствии образуются фибриновый сгусток. Чрезмерное увеличение фибриногена может приводить к повышенному тромбообразованию. КПN, участвуя в инактивации брадикинина, вероятно, сдерживает активацию свертывания крови по внутреннему пути, тем самым способствуя поддержанию фибриногена на нормальном уровне у данной группы больных.
Таблица 3 Корреляционные взаимосвязи параметров гемостаза и карбоксипептидазы N
|
Параметры гемостаза |
Активность КПN |
||
|
Абдоминальная группа |
Торакальная группа |
Урологическая группа |
|
|
КПN |
1,00 |
1,00 |
1,0 |
|
АПФ |
-0,7 |
0,23 |
0,19 |
|
Тромбоциты |
1,00 |
-0,43 |
-0,27 |
|
Время свертывания по Ли-Уайту |
0,60 |
0,37 |
-0,20 |
|
АПТВ |
0,23 |
-0,15 |
0,62 |
|
Протромбин |
0,19 |
0,03 |
0,35 |
|
Тромбиновое время |
-0,78 |
0,17 |
0,38 |
|
Растворимый фибрин-мономерный комплекс |
0,78 |
-0,13 |
-0,64 |
|
Фибриноген |
0,82 |
0,11 |
0,96* |
|
Хагеман-зависимый фибринолиз |
-0,98* |
0,08 |
0,97* |
Достоверность корреляционных взаимосвязей: *– р < 0,05.
Обнаружена также положительная корреляция между активностью КПN и ХЗФ у больных урологического отделения. Известно, что в почечной ткани вырабатывается большое количество активаторов плазминогена. После оперативных вмешательств, особенно по поводу удаления опухолей, в кровь выделяется большое количество компонентов фибринолиза [44]. Вероятно, в данных условиях активность КПN может быть снижена, чтобы сдерживать антикоагуляционные процессы.
3.2 Исследование активности ангиотензинпревращающего фермента в сыворотке крови онкологических больных в раннем послеоперационном периоде
Результаты исследования показали достоверное увеличение активности АПФ в сыворотке крови онкологических больных урологического отделения по сравнению с пациентами абдоминального и торакального отделения (рис.2).
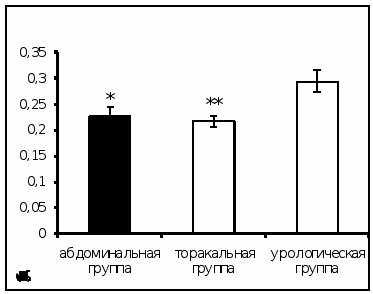
Рис. 2. Активность АПФ у онкологических больных в ранний послеоперационный период (нмоль продукта, образовавшегося за 1 мин инкубации на 1 мг белка, Mm, n=1218; достоверность отличий * – р < 0,05, ** – р < 0,01 относительно урологической группы).
АПФ – мембранно-связанный фермент, локализованный преимущественно в тканях почек. Этот фермент является компонентом ренин – ангиотензиновой системы [4, 48]. При повреждении почек, в том числе и хирургического вмешательства, происходит высвобождение АПФ в кровоток, что приводит к увеличению активности фермента.
При проведении корреляционного анализа (табл. 4) была обнаружена отрицательная корреляционная взаимосвязь между активностью АПФ и уровнем РФМК у пациентов абдоминального отделения. У больных, страдающих онкологическим заболеванием, антитромбогенная активность стенок сосудов в процессе роста опухоли снижается, а в раннем послеоперационном периоде обнаруживается повышенная склонность к внутрисосудистому свертыванию крови и тромбообразованию [8, 11, 19, 34, 35]. Известно так же, что в эндотелии содержится большое количество активатора плазминогена. Эндотелиальная дисфункция способствует уменьшению этого процесса, что вызывает сдвиг в системе антикоагуляция-коагуляция с преобладанием последней [73]. Участие АПФ в регуляции сосудистого тонуса реализуется через синтез ангиотензина-II, оказывающего мощное вазоконстрикторное действие. Другой механизм, более сопряженный с собственно эндотелиальной дисфункцией, связан со способностью АПФ ускорять деградацию брадикинина. Ангиотензин II является вазопрессором, стимулятором образования свободных радикалов, в частности, супероксидных анионов, которые инактивируют NO, промотируют образование пероксинитрита и снижают эффективность NO-опосредуемой сосудистой дилатации. Т.о., ангиотензин II, способствует развитию эндотелиальной дисфункции, в результате чего усиливается выработка вазоконстрикторов и прокоагулянтов [48]. В результате активируется система свертывания, компонентом которой является РФМК. В то время как брадикинин стимулирует синтез NO в эндотелии, участвуя в дилатации сосудов и усиливая скорость местного кровотока. Вероятно,
Таблица 4 Корреляционные взаимосвязи параметров гемостаза и ангиотензинпревращающего фермента
|
Параметры гемостаза |
Активность АПФ |
||
|
Абдоминальная группа |
Торакальная группа |
Урологическая группа |
|
|
КПN |
-0,7 |
0,23 |
0,19 |
|
АПФ |
1,00 |
1,00 |
1,00 |
|
Тромбоциты |
-0,72 |
0,55 |
-0,45 |
|
Время свертывания по Ли-Уайту |
-0,92 |
-0,20 |
-0,31 |
|
АПТВ |
-0,54 |
0,24 |
0,78 |
|
Протромбин |
0,41 |
0,71* |
0,48 |
|
Тромбиновое время |
0,89 |
0,00 |
0,77 |
|
Растворимый фибрин-мономерный комплекс |
-0,99** |
-0,39 |
-0,73 |
|
Фибриноген |
0,87 |
0,22 |
0,01 |
|
Хагеман-зависимый фибринолиз |
0,81 |
-0,10 |
0,18 |
Достоверность корреляционных взаимосвязей: *– р < 0,05, ** – р < 0,01. Снижение активности АПФ является компенсаторным механизмом в условиях имеющейся гиперкоагуляции.
Выявлена положительная корреляционная взаимосвязь между активностью АПФ и уровнем ПТИ у больных торакального отделения.
Исследования показали, что у больных злокачественными новообразования легких имеет место активация система гемостаза, осуществляемая преимущественно по внешнему механизму процесса свертывания крови, которая оценивается протромбиновым тестом [44]. Внешний путь начинается с повреждения сосудов и тканей, в результате чего в кровь высвобождается тканевый тромбопластин, которым богата легочная ткань. Этот фактор активирует фактор VII в присутствии ионов Са2+. Комплекс, состоящий из фактора III, фактора VIIа, ионов Са2+ на поверхности тромбоцитов приводит к активации фактора Х [44]. Известно, что в кровь АПФ попадает из легких. При оперативных вмешательствах, вероятно, инкреция АПФ усиливается, что в свою очередь приводит к генерализованному образованию ангиотензина II, участвующего в агрегации тромбоцитов, на поверхности которых идет процесс внешнего пути свертывания крови. Кроме того, в результате хирургического вмешательства происходит не только высвобождение факторов свертывания крови, но и повреждение эндотелия сосудов, что в свою очередь приводит к изменению активности АПФ, так как он участвует в синтезе коллагена и может таким образом усиливать фиброз [22, 68], активируя тем самым свертывающую систему, компонентом которой является протромбин.
Выводы
Обнаружено увеличение активности карбоксипептидазы N у торакальной и абдоминальной групп по сравнению с урологической группой онкологических больных в раннем послеоперационном периоде.
Обнаружено увеличение активности ангиотензинпревращающего фермента у урологической группы пациентов по сравнению с абдоминальной и торакальной группами онкологических больных в раннем послеоперационном периоде.
Выявлены корреляционные взаимосвязи между активностью карбоксипептидазы N и ангиотензинпревращающего фермента и показателями гемостаза в раннем послеоперационном периоде.
Изучаемые ферменты принимают участие в процессах гемостаза у онкологических больных в раннем послеоперационном периоде.
Список литературы
Азарян А.В. Пептидгидролазы нервной системы и их биологические функции // Ереван: Анастан, 1989.
Акоев И. Г., Биофизика познает рак. — М.: Наука, 1988. —160 с, 17 ил. — (Серия «От молекулы до организма»).
Албертс Б., Брей Д., Льюис Дж., Рэфф М., Роберте К., Уотсон Дж. Молекулярная биология клетки: В 3-х т. 2-е изд., перераб. и доп. Т. 3. Пер. с англ. – М.: Мир, 1994. – 504 с.
Альтшулер Б.Ю., Ройтман А.П., Долгов В.В. Методические аспекты определения ангиотензинпревращающего фермента // Клиническая лабораторная диагностика. – 2000. – №12. – С. 10– 14.
Антонова Л.В., Годенова Н.В., Земнюкова Н.А., Дудкина Н.Е. Опыт использования ортофенантролинового теста в диагностике синдрома ДВС в крови у пациенток с онкологическими заболеваниями репродуктивной сферы. // Медицина в Кузбассе. – 2004. – №11. – С. 26– 27.
Бакшеев Н.С., Ильяшенко Н.А.,Миляновский А.И. в кн. Злокачественные новообразования женских половых органов. – М., 1987. –С. 85– 187.
Баркаган З.С. Введение в клиническую гемостазиологию. – М.: Ньюдиамед, 1998. – 290 с.
Баркаган З. С. Патогенез и терапия нарушений гемостаза у онкологических больных // Терапевтический архив. – 1997. – №7. – С. 65– 67.
Баркаган З. С. Антитромботическая профилактика и терапия в онкологии. // Materia Medica. – 1997. – № 1 (13). – С. 5-14.
Баркаган З. С., Момот А.П. Диагностика и контролируемая терапия нарушений гемостаза. – М.: Ньюдиамед, 2001. – 298 с.
Баркаган Л.З. Нарушение гемостаза у детей. – М., 1993.
Биохимия: Учеб. Для вузов / В.П. Комов., В.Н. Шведова. – М.: Дрофа, 2004. – 640с.
Веремеенко К.Н., Голобородько О.П. Претромботическое состояние. Тромбоз и его профилактика. // Вопр. мед. химии . – 1986. – № 32. – С. 17– 25.
Вернигора А.Н., Генгин М.Т. Протеолитические ферменты: субклеточная локализация, свойства и участие в обмене нейропептидов // Биохимия. – 1996,т.6, №5. – С. 771– 785.
Гешелин С.А., Вовчук С.В., Близнюк Б.Ф.Нарушения гемостаза и их профилактика в онкологии. // Вопр. Онкологии. – 1986. – № 30. – С. 9– 18.
Гланц С. Медико-биологическая статистика: Пер. с англ. – М, Практика, 1998. – 459с.
Городецкий В.М. Неоплазмы и свертывание крови // Гематол. и трансфузиол. – 1994. – № 3. – С.25– 28.
Гринштейн Дж., Виниц M., Химия аминокислот и пептидов, пер. с англ., т. 12, M., 1967. – 350 с.
Давыдов М. И. Активация гемокоагуляции у больных в критических состояниях // Современная онкология. – 2000. – Т. 2, № 4. – С. 54– 58.
Долгов В.В., Сварин П.В. Лабоараторная диагностика нарушений гемостаза. – М. Изд. Триада, 2005. – 270 с.
Дэвени Т., Гергей Я. Аминокислоты, пептиды и белки, пер. с англ.- M.: 1976. – 380 с.
Елисеева Ю.Е. Ангиотензинпревращающий фермент, его физиологическая роль. // Вопросы медицинской химии. – 2001. – № 1. – С. 53– 60.
Ешкайт X. Аминокислоты, пептиды, белки, пер. с нем. – M.: 1985. – 460 с.
Золотокрылина Е.С. // Теоретические и клинические проблемы современной реаниматологии: Материалы международного симпозиума, посвящ. 90-летию со дня рожд. акад. В. А.Неговского. – М., 1999. – С. 32– 33.
Иванов Е.П. Диагностика нарушений гемостаза. Минск, 1983. – 278 с.
Калишевская Т. М., Коломина С. М., Кудряшов Б.А. Свертывающая и противосвертывающая системы крови и их значение при развитии злокачественных новообразований. – М., 1992. – 315 с.
Киричук В.Ф., Алипов В. В. Возможности диагностики активации системы гемостаза у больных в критических состояниях по уровню фибринопептида А и D-димера. // Кремлевская медицина. Клинический вестник. – 2005. – № 2. – С. 73– 76.
Кудряшов Б.А. Биологические проблемы регуляции жидкого состояния крови и ее свертывания. – М., 1975.
Лакин Г.Ф. Биометрия. – М.: Высш. шк., 1990. – 352с
Ленинджер А., Основы биохимии, пер. с англ., т. 1 3, M., 1985.
Локшина Л.А. Значение внутрисосудистого свертывания крови в формировании полиорганной недостаточности у хирургических больных в критических состояниях. // Новости анестезиологии и реаниматологии. – 2006. – № 1. – С. 15– 21.
Маджуга А. В., Сомонова О.В., Елизарова А. Л., Свиридова С.П., Мазурина, О.Г., Кашия Ш.Р. Нарушения системы гемостаза у онкологических больных с массивной интраоперационной кровопотерей // Анестезиология и реаниматология. – 2001. – № 5. – С. 50– 52.
Макацария А. Д., Бицадзе В. О., Баймурадова С. М., Акиньшина С. М.. Тромбофилия и здоровье женщины. // Сибирский медицинский журнал. – 2006. – №5(21). – С. 6– 8.
Мальков О.А. Гемостатические нарушения при колоректальном раке (вопросы патогенеза, диагностики, профилактики и лечения): Автореф. дис. …. канд. мед. наук. – Омск, 2000.
Мальков О.А., Долгих В.Т., Лукач В.Н. Комплексная профилактика тромботических осложнений у больных колоректальным раком на этапах хирургического лечения // Анастезиология и реаниматология . – 2001. – № 5. – С. 52 – 54.
Марри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека: В 2-х томах. Т.2. Пер. с англ.: – М.: Мир, 1993. – 384с.
Ноздрачев Ю. И. Турбидиметрический анализ полимеризации фибрина в плазме крови. // Вестн. интенсив. тер. – 1995. – № 1. – С. 17– 22.
Оболенская Н.Е. Некоторые особенности образования нейропептидов // Успехи совр. биол. – 1989. – Т. 108, № 3(5). – С. 337– 341.
Патологическая физиология и биохимия: Учебное пособие для вузов / - М.: Издательство «экзамен», 205. – 480с.
Рокитский П.Ф. Биологическая статистика. – Минск, Высшая. Школа, 1963.
Серебров А.И. в кн. Рак матки, Медгиз, 1957. – 210– 233 с.
Система гемостаза [Электронный ресурс]. – Режим доступа: http//www.cmd-online.ru/help/articles/detail.php?ID=111739
Синдром Диссименированного внутрисосудистого свертывания [Электронный ресурс]. – Режим доступа: http://studentport.su/referast/ptint.php.
Скипетров В.П. и др. коагуляционно - литическая система тканей и тромбогеморрагический синдром в хирургии. – Саранск: тип. «Крас. Окт.», 1999. – 232 с.
Фермилен Ж. и Ферстраге М. Гемостаз, пер. с франц., М., 1984.
Филлипович Ю.Б. Основы биохимии: Учеб. для хим. и биол. спец. пед. ун-тов и ин-тов. – 4-е изд., перераб. и доп. – М.: изд-во «Агар», 1999. – 512с.
Шиффман Ф.Д. Патофизиология крови: Пер. с англ. – М., СПб., 2000. – С. 191-253.
Яровая Г. А. Калликреин-кининовая система: новые факты и концепции (обзор) // Вопросы медицинской химии. – 2001, том 47. – № 1. – с. 20-42.
Bokish V.A., Muller-Eberhard H.J. Anaphylotoxin inactivator in human plasma: Its isolation and characterisation as a carboxypeptidase // J. Clin. Invest. – 1970. – № 49. – P. 2427– 2436.
Bui Т.Н., Wramsby H. Micromanipulative assisted fertilization till clinical research. Hum Reprod. – 1996. – №11(5). – Р. 921– 924.
Chretien M., Seidah N.G. Precursor polyproteins in endocrine and neuroendocrine systems // Int. J. Peptide Protein Res. – 1984. – № 23. – P. 335– 341.
Ciavarella D., Reed R. L. et. al. // Br. J. Haematol. – 1987. – Vol. 67. – № 3. – Р. 365– 368.
Erdos E., Schulz W., Gafford J., Defendini R. Neutral metal endopeptidase in human male genital tract:comparison to angiotensin-1 converting enzyme. // Lab. Invest. – 1985. – V.52. – Р .4374– 47.
Erdos E.G. Handbook of Experimental Pharmacology. // Biochem. Pharmacol. – 1979. – № 25. – Р. 438-487.
Erdos E.G., Sloane E.M., Wohler I.M. Carboxypeptidase in blood and other fluids // Biochem. Pharmacol. – 1964. – №13. – P. 893– 905.
Fricker L.D., Plummer T.H.Jr., Snyder S.H. Enkephalin convertase: potent, selective and irreversible inhibitors // Biochem. Biophys. Res. Commun. – 1983. – 11, N 3. – P. 994– 1000.
Hendriks D., Sande M., Scharpe S. Colorimetric assay for carboxypeptidase N in serum // Clin. Chim. Acta. – 1986 . – 157, N 1. – P. 103– 108.
Hendriks D., Soons J., Scharpe S., Wevers R., van Sande M., Holmquist B. Identification of the carboxypeptidase responsible for the post-synthetic modification of creatine kinase in human serum // Clin. Chim. Acta. – 1988. – 172, N 2– 3. – P. 253– 260.
Hurst P.L., Lovell-Smith C.J. Optimized assay for serum angiotensin-converting enzyme activity // Clin. Chem.- 1981. – 27. – P. 2048– 2052.
Ito Y., Misutani S., Kurauchi O., Kasugai M., Narita O., Tomoda Y. Purification and properties of microsomal carboxypeptidase N (kininase I) in human placenta // Enzyme. – 1989. – №42. – P. 8– 14.
Khanna A.S., Waisman D.M. Metabolism and intracellular processing of protein hormones // Hormon. Act. – 1988. – № 1. – P. 117– 132.
Lee P.V., Takahashi T.N. An improved colorimetric determination of amino acid with the use of ninhydrin // Analyt. Biochem. – 1966. – 14, № 1. – P. 71– 77.
Levin Y., Skidgel R., Erdos E. Isolation and characterization of the sub>units of human plasma carboxypeptidase N (kininase I) // Proc. Natl. Acad. Sci. USA.- 1982. – 79. – P. 4618– 4622.
Marino P.L. Интенсивная терапия: Пер. с англ. – М., 1998.
Masuda
S., Hattori A., Matsbmoto H., Miyazawa S., Natori Y., Mizutani S.,
Tsujimoto M. In volvemtnt of the V receptor in vasopressinstimulated translocation of placental leucine
aminopeptidase /oxytocinase in renal cells // Eur J.Biochem. –
2003. – Vol. 270, № 9. – Р.
1988– 1994.
receptor in vasopressinstimulated translocation of placental leucine
aminopeptidase /oxytocinase in renal cells // Eur J.Biochem. –
2003. – Vol. 270, № 9. – Р.
1988– 1994.
Plummer T.H., Ryan T.J. A potent mercapto bi-product analogue for human carboxypeptidase N // Biochem. Biophys. Res. Commun. – 1981. – № 98. – P. 448– 454.
Ramchandran R., Kasturi S., Douglas J.G., Sen I. Am. J. Physiol. - Heart and Circulatory Physiology. – 1996. – №40. – Р. 744– 751.
Skidgel R.A., Erdos E.G. Cellular carboxypeptidases // Immunol. Rev. – 1998. – V. 161, № 2. – P. 129-141
Skidgel R.A., Johnson A.R., Erdos E.G. Hydrolisys of opioid hexapeptides by carboxypeptidase N. Presence of carboxypeptidase in cell membranes // Biochem. Pharmacol. – 1984. – 33, № 21. – P. 3471– 3478.
Skidgel R.A., Tan F. Structural features of two kininase I-type enzymes revealed by molecular cloning // Agents Actions Suppl. – 1992. – 38, N 1. – P. 359-367.
Steiner D.F. The biosynthesis of biologically active peptides: a perspective // Peptide Biosynthesis and Processing (Fricker L.D., ed.).- CRC Press, Boca Raton, Florida, 1991. – P. 1-16.
Sugimura K., Tian X-L. Hoffmann S., Ganten D., Bader M. Biochem. Biophys. Res. Commun. – 1998. – 247. – Р. 466-472.
The Kallikrein - Kinin System in Health and Disease. Munich: Limbach - Verlag Braunschweig. – 1989. – p. 374.
Uehara M., Kishikawa H., Isomi S., Kisanuki K., Ohkubo Y., Miyamura N., Miyata T., Yano T. and Shiciri M. Diabetologia. – 1994. – 37. – Р. 300-307.
Van Sande M., Hendriks D., Soons J., Scharpe S., Wevers R., Holmquist B. Post synthetic modificati-on of CK-MM by kininase I // Adv. Exp. Med. Biol. – 1989. – 247A. – P. 319– 324.
Wevers R.A., Boegheim J.P., Hommes O.R., Van Landeghem A.A., Mul-Steinbusch M.W., Van der Stappen J.W., Soon J.B. A study on post-synthetic modification in alpha-alpha enolase brought about by a human serum prtotein // Clin. Chem. Acta. – 1984. – 139. – P. 127-135.