Диагностика туберкулезных лимфаденитов методом пункции. Дифференциальная диагностика. Бактериологическая диагностика туберкулеза
РЕФЕРАТ
НА ТЕМУ
ДИАГНОСТИКА ТУБЕРКУЛЕЗНЫХ ЛИМФАДЕНИТОВ МЕТОДОМ ПУНКЦИИ. ДИФЕРЕНЦИАЛЬНАЯ ДИАГНОСТИКА. БАКТЕРИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА
2009г.
ДИАГНОСТИКА ТУБЕРКУЛЕЗНЫХ ЛИМФАДЕНИТОВ МЕТОДОМ ПУНКЦИИ
Методика цитологического исследования лимфатических узлов и других кроветворных органов получила широкое применение, в клинической практике лишь за последнее десятилетие. Она основана на исследовании микроскопических кусочков тканей, добытых тонкой иглой и обработанных по гематологической методике.
Техника пункции очень проста. Материал, подлежащий исследованию, добывается тонкой иглой, насаженной на 10-граммовый шприц «Рекорд» с плотно притертым поршнем. Перед пункцией шприц кипятится, просушивается спиртом и эфиром. Намеченное место укола смазывается йодом, затем лимфатический узел фиксируется левой рукой и прокалывается иглой. Для получения возможно большего количества материала аспирацию рекомендуется производить многократно, каждый раз снимая шприц с иглы и переводя поршень в исходное положение. Перед извлечением иглы из ткани шприц необходимо разъединить с иглой. Если извлечь иглу на вакууме, то материал засосется в шприц и разбрызгается по его стенкам. Полученный при пункции материал с помощью шприца выдувают из иглы на предметное стекло и размазывают подобно мазкам крови. Окраска производится обычными гематологическими методами по принципу Райт-Романовского.
После окраски препарат исследуется под микроскопом, вначале обязательно малым увеличением с тем, чтобы иметь возможность отыскать те характерные элементы, которые находятся часто в единичных экземплярах в целом мазке, а затем уже для более детального изучения пользоваться обычной методикой микроскопирования сухих мазков, т. е. иммерсионной системой.
Клинические данные, касающиеся классификации туберкулезных лимфаденитов (Н. А. Шмелев, Ю. П. Коровина), и цитологическое исследование материала лимфатических узлов, пораженных туберкулезе, позволили выделить пять видов пунктатов.
Первый вид пунктата соответствует начальной форме туберкулезной лимфаденита (гиперпластическая стадия). Макроскопически он имеет кровянистый характер. При исследовании препаратов в нем обнаруживается воспалительная гиперпластическая реакция лимфаденоидной ткани без специфических элементов туберкулезной грануломы. Преобладающими клетками являются пролимфоциты: среди них отмечаются узкоплазменные лимфоциты, лимфобласты, плазматические клетки и ретикуло-эндотелиальные клетки двух типов. Одни из них (лимфоидно-ретикулярные клетки) с продолговатой несколько неправильной формой протоплазмы по структуре ядра близки к пролимфоцитам. Другие ретикуло-эндотелиальные клетки имели значительно большие размеры и представляли собой то круглой, то многоугольной формы клетки с большим светлым ядром. Они отличались от лимфоидно-ретикулярных клеток более топкой структурой хроматина ядра и более обильной базофильной протоплазмой. Часто эти клетки располагались в мазках в виде больших скоплений.
Цитологическая картина пунктатоз при начальной стадии туберкулезного процесса в лимфатическом узле не представляет ничего характерного для этого заболевания. Подобные картины отмечаются и при остром неспецифическом лимфадените. Начальная гиперпластическая стадия является быстро преходящей, и в лимфатическом узле вскоре наступают специфические для туберкулеза изменения. Поэтому в целях точной диагностики рекомендуется в этих случаях производить повторные пункции через 1—11/>2> месяца, в результате которых можно установить картину казеозного некроза, а также производить одновременно пункцию нескольких узлов с различной давностью воспалительного процесса, имея в виду то обстоятельство, что в одном случае может быть обнаружена чистая гиперплазия лимфоидной ткани, а в другом — казеозный субстрат.
Второй вид пунктатов имеет также кровянистый характер, но часто содержит некротические участки ткани в виде желтоватых крупинок. Этот вид пунктатов соответствует уже выраженной форме туберкулезного процесса.
В отличие от чисто лимфоидно-гиперпластической формы при микроскопическом исследовании в этих случаях отмечается картина воспалительного гиперпластического разрастания лимфаденоидной ткани с наличием специфических элементов туберкулезной грануломы (эпителиоидные клетки, многоядерные гигантские клетки, а также участки казеозного детрита).
Эпителиоидные клетки имеют в пунктатах очень характерный вид. Как правило, они располагаются в мазках значительными скоплениями, иногда в виде частокола. Эпителиоидные клетки обычно не имеют индивидуальной протоплазмы и заключены в общий синцитий. Ядра их вытянутые, несколько асимметричной формы, по величине раза в полтора превышающие моноцит, кажутся плоскими, имеют нежноажурный, бледно-красящий хроматин и содержат единичные нуклеолы (рис. 47).
Гигантские многоядерные клетки (рис. 48) характеризуются огромными размерами. Они достигают 30—70 μ, имеют овальную, реже круглую форму и содержат большое число ядер. Ядра имеют одинаковый размер и группируются главным образом по периферии клетки. Хроматин ядер располагается равномерно, в виде нежной ажурной сетки и содержит единичные ядрышки. Протоплазма обильна, нежноголубая. Наличие в мазках одного из этих компонентов туберкулезной грануломы является достаточным для диагносцирования туберкулезного процесса.
Третий вид пунктатов, получаемый при творожисто-казеозной форме поражения лимфатических узлов, представляет собой макроскопически крошковатую творожистую массу, с трудом набирающуюся в шприц. При пункции лимфатических узлов творожистый распад встречается чаще всего, являясь преобладающей формой в развитии туберкулезного процесса. При исследовании мазков отмечается своеобразная картина аморфного детрита, красящегося в темнофиолетовый цвет (рис. 49).


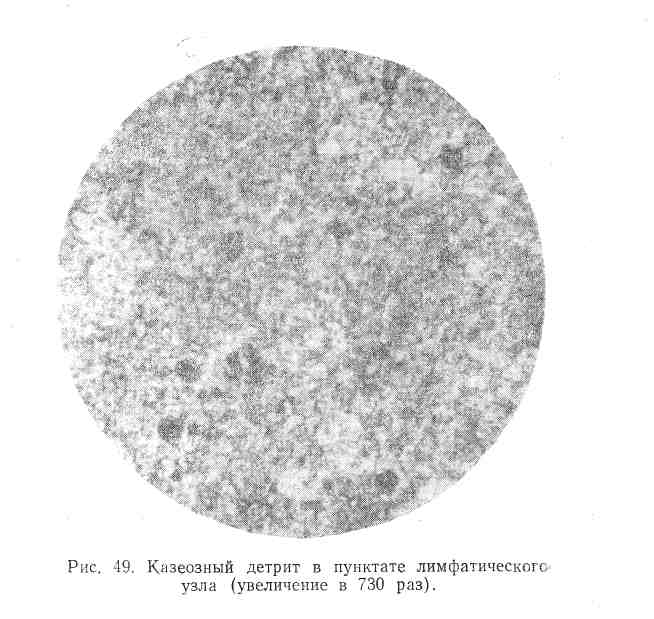

Казеозный детрит располагается в мазках в виде мельчайших крупинок или в форме неправильных глыб. Нередко в этом аморфном детрите содержится большое количество аморфных солей и кристаллов холестерина (рис. 50), указывающих на процесс обызвествления туберкулезного очага. Среди казеозных масс могут находиться также эпителиоидные й гигантские клетки. Наряду с богатыми казеозным детритом пунктатами, наблюдаются пунктаты, лишь с небольшими участками казеоза среди выраженной гиперплазии лимф аденоидной ткани. Этих небольших участков бывает вполне достаточно для постановки диагноза туберкулезного лимфаденита, так как морфология их очень характерна.
К четвертому виду пунктатов относятся гнойные и гнойно творожистые пунктаты. В противоположность гною банального происхождения отличительной чертой которого является Картина гнойного расплавления железистой ткани с выраженной нейтрофильной и макрофаговой реакцией, туберкулезный гной содержит мало форменных элементов. Характерным цитодиагностическим признаком его является наличие в нем казеозных участков или эпителиоидных и гигантских многоядерных клеток. При отсутствии этих специфических для туберкулеза элементов установить характер поражения лимфатического узла не всегда бывает возможно. Гнойные и гнойно-творожистые пунктаты параллельно с цитологическим исследованием необходимо· подвергать исследованию на туберкулез. Туберкулезные микобактерии при бактериоскопии в пунктатая лимфатических узлов обнаруживаются в небольшом проценте случаем (около 10%), в то время как при посеве пунктатов процент положительных находок увеличивается на 75.
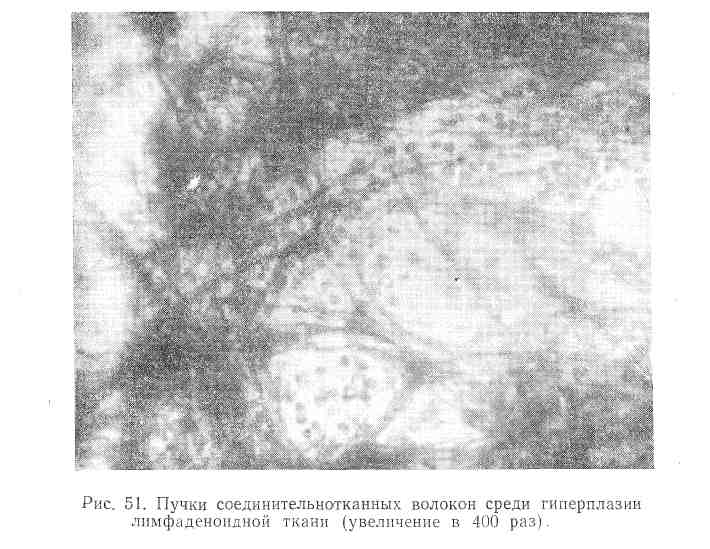
Пятый вид пунктата наблюдается при фиброзной форме туберкулезного лимфаденита. Характерным для него является, наряду с гиперпланзией лимфаденоидной ткани, наличие грубых пучков соединительнотканных волокон. По периферии последних иногда располагаются эпителиоидные клетки и гигантские клетки (рис. 51).
Таким образом, присутствие специфических элементов туберкулезной грануломы дает возможность простым методом пункции без применения биопсии диагноецировать туберкулезный лимфаденит в различных стадиях его развития.
Диференциальная диагностика туберкулезных лимфаденитов
В данном разделе мы считаем необходимым описать морфологию нетуберкулезных заболеваний лимфатических узлов и доброкачественных опухолей, которые приходится диференцировать с туберкулезным лимфаденитом. Одним из наиболее частых заболеваний лимфатических узлов с которым приходится диференцировать туберкулезный лимфаденит, является л им фогрануломатоз.
В типичных случаях пораженные лимфогранулематозом лимфатические узлы, независимо от своей локализации, бывают плотной консистенции, подвижны, безболезненны и располагаются большими пакетами, в которых отчетливо прощупываются отдельные узлы. В начальной стадии процесса, когда лимфогрануломатозные узлы не образовали еще характерных конгломератов, их легко спутать с гиперпластической стадией туберкулезного лимфаденита.
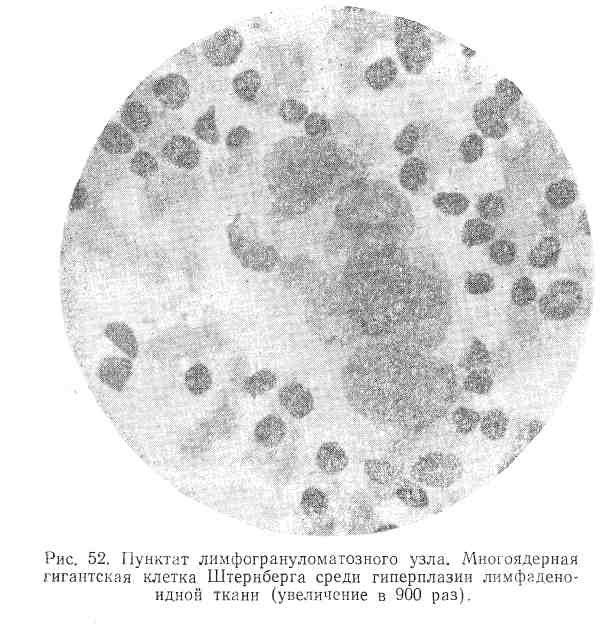
Характерным морфологическим признаком пунктатов лимфогрануломатозных узлов является картина резко выраженного клеточного полиморфизма. В этих случаях в препаратах отмечается преобладание уродливых лимфоидно-ретикулярных клеток, отличающихся многообразием своих форм. Среди них наблюдаются нейтрофилы, эозинофилы, плазмоциты, небольшое количество лимфоцитов, гипертрофированные ретикуло-эндотелиальные клетки и гигантские клетки Штернберга. Морфологически клетки Штернберга (рис. 52) представляют собой крупные образования. Они имеют большей частью неправильную округлую, реже удлиненную форму с неровными зубчатыми контурами и содержат .множество крупных и мелких ядер, чаще всего беспорядочно, расположенных. От ядер гигантских клеток они отличаются грубой зернистой структурой хроматина ядра, размерами и наличием огромных нуклеол, которые обычно свойственны клеткам злокачественной бластомы.
Из опухолевых поражений лимфатических узлов чаще всего приходится наблюдать метастазы рака, реже ретикулосаркому и лимфосаркому. Характерной особенностью лимфатических узлов, пораженных злокачественными новообразованиями, является их твердая консистенция, малая подвижность и спаянность с окружающими тканями.
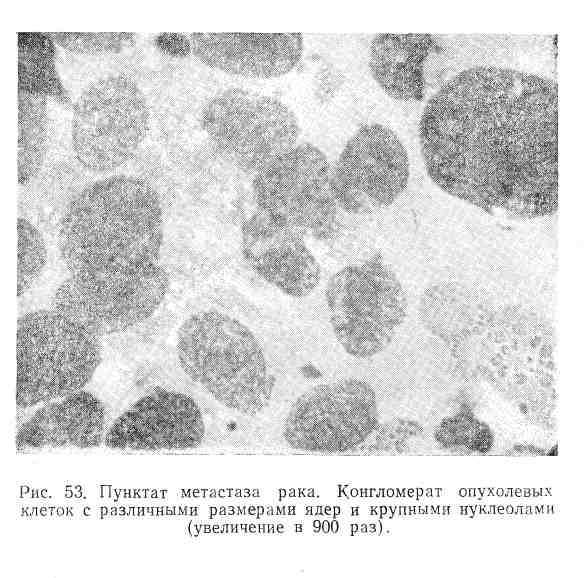
В пунктатах метастазов злокачественных опухолей в лимфатические узлы при микроскопическом исследовании отмечается отсутствие элементов нормальной лимфаденоидной ткани. Препарат содержит крупные конгломераты атипичных клеток, имеющих очень своеобразную морфологию (рис. 53). Характерными для них являются: а) разнообразие форм и размеров клеток; б) большое ядерно-протоплазменное соотношение; в) наличие крупных нуклеол, часто множественных; г) неравномерность окраски клеток; д) резко выраженная базофилия протоплазмы; последняя большей частью имеет вид общего синцития; е) наличие гигантских клеток уродливой формы и асимметрических митозов.
В области шеи нередко располагаются также различные опухолевидные образования, симулирующие лимфадениты. К ним относятся: 1) аденомы; 2) тератоидные опухоли, к которым относятся дермоидные кисты; 3) нейтрофибромы; 4) липомы и 5) струмы.

Дермоидные кисты, нейрофибромы и липомы располагаются в виде одиночных образований; струмы же щитовидной железы могут располагаться в виде цепи плотных узлов преимущественно по внутреннему краю грудино-ключично-сосковой мышцы.
Доброкачественные опухоли большей частью мягкой Консистенции, эластичны, очень подвижны и безболезненны, в то время как нейрофибромы и так называемые смешанные опухоли отличаются твердой консистенцией.
Макроскопически материал, получаемый при пункции, имеет далеко не одинаковый характер. Так, пунктаты дермоидных опухолей чаще всего представляют собой грязноватого цвета жидкость, легко поступающую в шприц, реже — кашицеобразную массу, напоминающую субстрат туберкулезных лимфатических узлов в случае их казеозного перерождения. Смешанные и простые железистые опухоли характеризуются наличием обильного кровянистого субстрата.
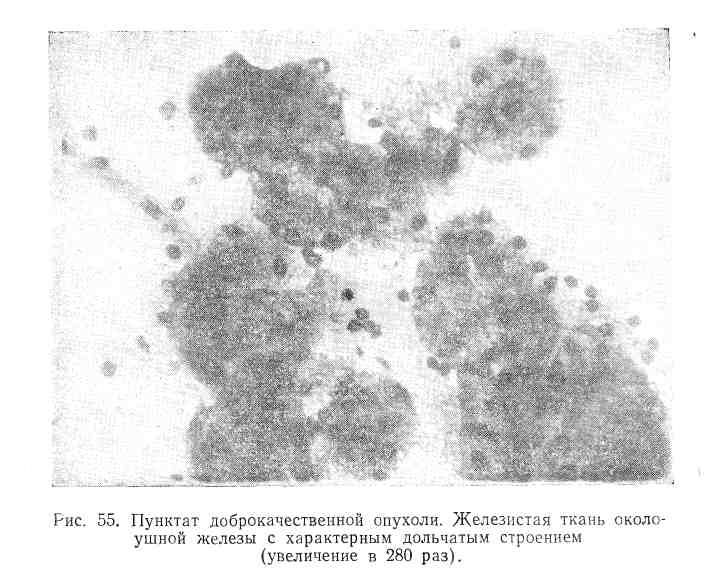
Первое, что привлекает внимание при исследовании аденом (рис. 54), это — наличие небольших групп одинаковой величины клеток с овальными ядрами, расположенными в общем синцитии, иногда сохраняющих структуру железистой ткани с характерным дольчатым строением (рис. 55). Хроматиновая сеть характеризуется плотной равномерной структурой и отсутствием нуклеол. Протоплазма бледноголубая. В мазках так называемых смешанных доброкачественных опухолей клетки аденоидной ткани располагаются среди тонких волокон соединительной ткани, окрашивающихся эозином е розовый цвет (рис. 56). Пунктаты дермоидных кист состоят из клеток плоского эпителия в различных стадиях ороговевания (рис. 57), кристаллов холестерина, а иногда (вероятно, в случаях начинающегося нагноения кисты) и нейтрофилов.
Помимо указанных выше заболеваний, цитологический метод исследования пунктатов дает возможность также диференцировать процессы, связанные с заболеванием кроветворных органов, воспалительные гиперплазии лимфатических узлов неспецифического характера — сифилис и актиномикоз. В постановке диагноза актиномикоза решающую роль играет исследование нативного препарата из лимфатических узлов, в котором можно обнаружить друзы актиномикоза.
Таким образом, цитологический метод исследования пунктатов позволяет четко диференцировать основные заболевания лимфатических узлов и в ряде случаев является решающим в диагностике патологического прοцесса.
БАКТЕРИОЛОГИЧЕСКАЯ ДИАГНОСТИКА ТУБЕРКУЛЕЗА
Для обнаружения возбудителя туберкулеза в патологическом материале в основном пользуются бактериоскопическим и бактериологическим методами. Так как первый наиболее прост и доступен, его преимущественно и используют, несмотря на недостаточную чувствительность.
Бактериологический способ менее доступен и требует гораздо больше времени (от 7 дней до нескольких месяцев), тем не менее он применяется при диагностических исследованиях, поскольку имеет подчас решающее значение в постановке правильного диагноза, например, при диференциации непатогенных кислотоупорных сапрофитов от туберкулезных микобактерий.
К бактериологическому исследованию обычно прибегают в случаях, когда бактериоскопический метод, включая и накопление микробов с помощью флотации, дает отрицательные результаты. Бактериологический способ исследования патологического материала распадается на следующие этапы: а) выделение чистой культуры микобактерий туберкулеза; б) дифференциация ее от кислотоупорных сапрофитов; в) биологический метод исследования (определение вирулентности).
Выделение чистой культуры микобактерий туберкулеза осуществляют посевом исследуемого материала на питательные среды. Следует при этом иметь в виду, что мокрота, кал и т. п., наряду с туберкулезными микобактериями, содержат множество других микробов, способных быстро размножаться и подавлять рост возбудителя туберкулеза. Поэтому туберкулезный материал до бактериологического исследования следует освободить от сопутствующей микрофлоры. Для этого пользуются двумя приемами. С одной стороны, нестерильный патологический материал предварительно (до посева) обрабатывают 3—15% раствором серной кислоты с целью уничтожения посторонних микробов, а с другой — делают посевы на яичные среды (Петраньяни, Любенау-Гона, Левенштейна), содержащие краски, задерживающие рост посторонних микроорганизмов, но не препятствующие размножению туберкулезных микобактерий. Выделенная на яичной среде культура в дальнейшем может сохраняться на других средах. Посевы держат в термостате при 37—38° и наблюдают за появлением роста в течение 2—3 месяцев, отмечая время появления первых признаков роста. Из выросших колоний делают окрашенные мазки и проверяют кислото- и спиртоустойчивость микробов. Атипичные колонии (пигментные, гладкие, быстро растущие, легко образующие суспензию) отвивают на среды для дальнейшего изучения.
При отсутствии роста в течение 8—10 недель берут соскоб с поверхности среды и микроскопией устанавливают наличие или отсутствие микророста. В положительных случаях приготовляют взвесь из соскоба и инъицируют ее морским свинкам для определения вирулентности.
Выделение чистой культуры из того или иного патологического материала имеет свои особенности главным образом в части предварительной обработки с целью подавления жизнедеятельности сопутствующей микрофлоры. В соответствии с этим приводим описание, обработки каждого патологического материала в отдельности.
Мокрота. Наиболее распространенным методом обработки материала на туберкулез является метод Гона. При этом методе мокроту собирают в стерильные баночки в утренние часы или в течение суток. Выбирают из нее гнойные частицы. Последние исследуют в окрашенных по Цилю и Граму мазках. Затем берут около 3 мл мокроты (с гнойными комочками), добавляют 6 мл 6—10% раствора серной кислоты, энергично в течение 10 минут встряхивают до полной гемогенизации, потом центрифугируют в стерильной центрифужной пробирке, жидкость сливают, а осадок сеют на яичные среды. Действие серной кислоты (с момента добавления до момента посева, включая и время центрифугирования) должно длиться 20 минут.
Метод Мазура. В ряд широких пробирок наливают по 3 мл 2—3% раствора серной кислоты. Затем, поместив в пробирки гнойные комочки мокроты, гомогенизируют их, умеренно сильно ударяя нижними частями пробирок об упругие поверхности (ладонь, предплечье, сложенное на столе полотенце) в течение 3 минут. При этом над эмульсией мокроты образуется толстый слой пены, содержащий смесь жизнеспособных туберкулезных микобактерий и убитых посторонних микробов. Часть такой пены сеют на яичную среду.
Обработка гортанного мазка. У детей и лиц, не выделяющих мокроты, микобактерий туберкулеза часто можно обнаружить в слизи из гортани. Последнюю снимают ватным тампоном, накрученным на нарезки слегка изогнутого металлического зонда длиной 20 см и толщиной 1 мм. До употребления зонд с тампоном заворачивают в бумагу и стерилизуют обычным способом. Прежде чем взять мазок, больному предлагают покашлять и под контролем гортанного зеркала тампоном снимают слизь с гортани. Затем тампон, снятый с зонда, помещают в пробирку г 5 мл 6% раствора серной кислоты, сильно в течение 5 минут встряхивают, после чего тампон удаляют стерильным пинцетом, предварительно отжав из него жидкость в пробирку. Содержимое пробирки центрифугируют и осадок сеют на яичные среды.
Промывные воды желудка. Промывные воды желудка рекомендуют исследовать у детей, которые, как правило, не умеют отплевывать мокроту и обычно проглатывают ее, а также у взрослых, не выделяющих мокроту или выделяющих ее в незначительном количестве. В подобных случаях промывание желудка и бактериологическое исследование осадка из этих вод оказывается наиболее чувствительным методом обнаружения возбудителя туберкулеза.
Промывные воды получают с помощью желудочного зонда у больных, которым утром натощак дают выпить стакан кипяченой воды. Вытекающую через зонд жидкость собирают в стерильную посуду. Эти воды нейтрализуют 20% раствором двууглекислой соды до нейтральной по лакмусу реакции, отстаивают 1—2 часа (или центрифугируют) и исследуют гнойные частицы осадка так же, как мокроту.
Обработку и посев промывных вод не следует откладывать, так как через 6 часов после взятия материала жизнеспособность туберкулезных бактерий под влиянием желудочного сока заметно ослабевает.
Кал. Кал растирают в стерильной ступке с дестиллированной водой (5 г кала -f- 10 мл воды) и оставляют в покое на 30 минут. За это время крупные частицы оседают на дно. Образовавшуюся на поверхности пленку снимают стерильной ложкой, которую смывают в пробирку 10 мл 4% раствора едкого натра и выдерживают 3 часа в термостате при периодическом встряхивании. После этого взвесь центрифугируют, осадок нейтрализуют по лакмусу несколькими каплями 8—10% раствора соляной кислоты и сеют на яичные среды.
Моча. При исследовании мочи следует помнить, что микобактерий туберкулеза в ней бывает мало. Обычно берут утреннюю мочу, а иногда и суточную. Для концентрации микробов в небольшом объеме пользуются центрифугированием со скоростью 3 000—6 000 об/мин всей порции мочи. Осадок сливают в одну пробирку и исследуют бактериоскопически. При отсутствии посторонних микробов сеют без предварительной обработки серной кислотой.
В противном случае добавляют к осадку двойной объем 6% раствора серной кислоты, перемешивают, центрифугируют и сеют полученный осадок на яичные среды (обработка кислотой, включая процедуру центрифугирования, продолжается 20 минут).
Гной, экссудат, спинномозговую жидкость центрифугируют и осадок, не содержащий посторонних микробов, сеют на среды. Если материал не стерилен, осадок обрабатывают так же, как мокроту.
Обработка кусочков органов. Кусочки органов или желез измельчают в стерильной ступке сначала ножницами, а потом пестиком до кашицеобразной консистенции, добавляют 5 мл 6—10% раствора серной кислоты. Продолжая действовать пестиком, превращают всю массу в суспензию. Последнюю центрифугируют и сеют на яичные среды. Процесс обработки кислотой, включая процедуру центрифугирования, должен длиться 20 минут.
Обработка крови. К 5 мл стерильно взятой крови добавляют 3 мл 10% раствора лимоннокислого натрия, тщательно перемешивают встряхиванием и оставляют на 2—3 часа для получения осадка (или центрифугируют). Плазму отсасывают стерильной пипеткой, осадок переносят в колбу с 40—50 мл дестиллированной воды, осторожно перемешивают круговыми движениями колбы, затем переливают в центрифужные пробирки, центрифугируют 5—10 минут при 3 000 об/мин. Осадок при центрифугировании промывают дестиллированной водой, смешивают его с 1 мл 5% раствора серной кислоты, встряхивают в течение 3 минут, добавляют 5 мл стерильной дестиллированной воды и снова центрифугируют. После этого осадок взмучивают в 1 мл физиологического раствора и стерильной пипеткой сеют на питательную среду.
Молоко. Для бактериологического исследования берут свежее молоко в количестве 30 мл. Его центрифугируют в течение 15—20 минут при 3 000 об/мин. Осадок сеют на питательную среду после предварительной обработки серной кислотой.
Использованная литература:
1. Внутренние болезни / Под. ред. проф. Г. И. Бурчинского. ― 4-е изд., перераб. и доп. ― К.: Вищашк. Головное изд-во, 2000. ― 656 с.