Теория молекулярных орбиталей в комплексных соединениях
1
Введение
Наиболее общий подход к рассмотрению электронной структуры комплексов связан с расчетами полных волновых функций комплекса как единого целого, а не только центрального иона по методу МО. В области координационных соединений обобщения, полученные на основе метода МО, названы теорией поля лигандов. Главная особенность ее состоит в том, что ввиду обычно высокой симметрии координационного узла МО молекулы или иона координационного соединения классифицируются по представлениям симметрии и принципиальную схему их образования из орбиталей лигандов можно зачастую построить, не проводя конкретных расчетов.
В то время как теория кристаллического поля (ТКП) чрезвычайно ценна как модель описания свойств координационных соединений, она в принципе не может учесть ряда важных эффектов определяющих природу химической связи в координационных соединениях.
Данная работа посвящена обзору основных положений теории МО применительно к координационным соединениям и дополнена рядом примеров и необходимым иллюстративным материалом.
1. Применение теории МО к координационным соединениям с лигандами, имеющими сигма-орбитали
Рассмотрим вначале наиболее простой, но весьма распространенный случай комплексов, образуемых лигандами L типа (СН>3>)>3>Р, NH>3>, H>2>O, ОН-, Н-, которые используют для связывания с центральным атомом металла неподеленную гибридную пару электронов или пару электронов на s-орбитали (гибрид-ион). Начнем рассмотрение с наиболее характерного типа координации — октаэдрического. Координационные связи в комплексе МL>6>k+, где М — переходный металл, образуются при донировании электронов с сигма-орбиталей лигандов на вакантные 3d-, 4s-, 4p- орбитали металла (возьмем атом металла третьего периода). Чтобы рассчитать валентные МО комплекса, выберем координатные оси, как показано на рис. 1, расположив вдоль них лиганды.
Полный базис валентных АО состоит из 15 орбиталей: девяти — металла, шести — лигандов. Только такие комбинации лигандных АО будут обобщаться в форме МО с различными орбиталями металла, которые преобразуются по одинаковым представлениям симметрии в точечной группе О>А>. Нетрудно подобрать соответствующие комбинации сигма-АО лигандов (называемые групповыми орбиталями). Рис. 2,а иллюстрирует выбор групповой орбитали е>g>-симметрии, комбинирующейся с d>x>2>- >>y>2 - орбиталью металла. Из рис. 2,б ясно, почему любая комбинация сигма-АО лигандов дает нулевое перекрывание с rf-орбиталями металла типа t>2>>g>.
На рис. 3 дана корреляционная диаграмма МО октаэдрического комплекса. Она строится исходя из правил качественной теории МО. Имеются также многочисленные прямые расчеты электронного строения разнообразных комплексов МL>6>k+, выполненные в различных вариантах приближений, которые дают согласующуюся с диаграммой картину энергетических уровней.
Из рис. 3 следует, что в комплексе, образованном сигма-лигандами и центральным атомом переходного металла, имеется шесть связывающих (a>1>>g>, t>1>>u>, 1e>g>) и три несвязывающих (t>2>>g>) валентных электронных уровня, на которых можно разместить 18 электронов. Если каждый из шести лигандов октаэдрического комплекса вносит по 2 сигма-электрона, это означает, что устойчивой конфигурацией центрального иона или атома будет 6-электронная.
2. Привенение теории МО к координационным соединениям с лигандами, имеющими р- и пи-орбитали
В общем случае, лиганды L, например галогены, могут образовывать связи с центральным ионом также за счет своих р-АО, оси которых ориентированы перпендикулярно связям М—L. При этом создается возможность пи-связывания двух типов. На рис. 4, а — в показаны два вида групповых пи-орбиталей лигандов. Групповые орбитали первого типа способны образовать пи-МО комплекса при перекрывании с р-АО металла. Групповые орбитали лигандов (рис. 4, в) способны к перекрыванию с t>2>>g>-АО металла. Учет пи-связывания приводит к включению этих орбиталей в комплексах типа [CoF>6>]3- и других в связывающие и антисвязывающие комбинации с орбиталями лигандов, тогда как в комплексах типа [Co(NH>3>)>6>]3+ t>2>>g>>-> орбитали имели несвязывающий характер. Именно этот эффект объясняет возможность образования дативных связей металла с лигандами, обусловливающих передачу электронной плотности с заполненных t>2>>g>-АО металла на вакантные р-, а также пи*-орбитали лиганда.
Другая особенность образования связей центрального атома металла с лигандами, обладающими р-рбиталями, состоит в том, что последние образуют отдельную систему р>пи>-орбиталей t>2>>u> -симметрии. Они вместе с сигма-орбиталями той же симметрии могут взаимодействовать с р-АО (t>1>>u>) центрального атома металла. Поскольку сигма-перекрывание намного больше, чем пи-перекрывание, можно в первом приближении пренебречь пи-взаимодействием и относить р>пи>-ряд лигандных орбиталей t>1>>u> -симметрии к несвязывающему типу.
Это дает возможность рассматривать комплексы с заполненными электронами р-рбиталями (галогены) в рамках схемы на рис. 3.
Наиболее важен эффект обобществления d-AO центрального атома металла с вакантными пи*-орбиталями таких лигандов (С = О, С = N) в карбонильных и цианидных комплексах. На рис. 5 показана структура одной из t>2>>g> -МО гексакарбонила хрома, образующейся при перекрывании d>xy>-AO металла с антисвязывающими пи*-МО оксида углерода. На рис. 6 дана корреляционная диаграмма МО гексакарбонила хрома, построенная с учетом пи- и пи*- орбиталей лиганда.
Для большей ясности сигма-орбитали различных типов (рис. 3) представляются в виде одного общего уровня. Расщепления, вызываемые взаимодействиями АО металла с пи-орбиталями лигандов, которые можно скомбинировать в групповые орбитали, пользуясь правилами теории групп, сравнительно малы. Как и в случае лигандов с р-орбиталями, можно рассматривать эти взаимодействия (за исключением t>2>>g>-пи-взаимодействия) как второстепенные по сравнению с взаимодействиями d-сигма типа. В то же время эффект примешивания пи*-орбиталей лиганда к орбиталям металла t>2>>g> -ряда играет важную роль, он приводит к увеличению расщепления t>2>>g>—е>g>> >- уровней. Шесть СО-групп гексакарбонила хрома вносят 12 электронов неподеленных электронных пар, 24 пи-электрона, а атом хрома дает шесть электронов, т. е. всего имеется 42 электрона, заполняющих 21 связывающие МО (рис. 6).
3. Применение теории МО для описания строения пи-комплексов и металлоценов
Особенная и чрезвычайно широкая область координационных соединений металлов представлена пи-комплексами — соединениями, в которых центральный атом образует многоцентровые связи с лигандами в результате обобществления своих d-орбиталей с делокализованными пи-орбиталями лигандов. Прототипом пи-комплексов являются более простые алкеновые комплексы металлов, первый представитель которых — хлороплатинат К [С>2>Н>4> •PtCl>3>] — в виде кристаллогидрата был получен В. Цейзе еще в 1827 г. при кипячении в этиловом спирте платинохлористоводородной кислоты с последующим добавлением к раствору КСl.
Природа связи в соли Цейзе XXV объясняется так называемой синергической моделью Дьюара—Чатта—Дункансона (1953), близкой по своей основной идее к описанию связывания в гексакар-бониле хрома (рис.7). Электронная плотность с высшей заполненной пи-МО этилена переносится на вакантную (sp>n>) орбиталь металла (прямое донирование XXVIa). Упрочнение связи достигается также за счет эффекта обратного донирования (дативной связи) — частичного переноса электронов с заполненной d-орбитали металла на вакантную пи*-МО этилена. Строгие расчеты хорошо согласуются с общей схемой XXVI формирования связи в пи-комплексе XXV и других подобных ему структурах. Отвлечение электронной плотности со связывающей и частичное заселение антисвязывающей орбиталей этиленового фрагмента в XXV должно приводить к разрыхлению связи С = С в комплексе. Действительно, если частота валентного колебания этой связи в молекуле этилена равна 1623 см-1, а длина связи 0,1337 нм, то в соли Цейзе частота колебания связи понижается до 1511 см-1 , а длина связи возрастает до 0,1354 нм.
Еще более значительные изменения происходят в этиленовых тг-комплексах (рис.8.). Учитывая типы взаимодействий XXVIa,б, определяющих связывание в пи-комплексах, можно подойти к решению вопроса о конформационной предпочтительности пи-комплексов. Например, для железокарбонильного комплекса XXVIII можно представить две альтернативные конформации, учитывая бисфеноидную геометрию фрагмента Fe (CO)>4> и предпочтительность экваториального положения алкена (рис. 9.):
На рис. 11 показана диаграмма орбитальных взаимодействий фрагментов для двух рассмотренных ориентации. Поскольку октаэдрическая симметрия уже не сохраняется, t>2>>g> -ряд соответствующим образом расщеплен.
Можно видеть, что взаимодействия, реализующие связь металл—лиганд, отвечают схеме Дьюара—Чатта—Дункансона. Однако оба типа связывающих эффектов — прямое и обратное донирование — возможны только в конформации XXVIIIa, тогда как в конформации XXVIII6, отличающейся поворотом одного из фрагментов в экваториальной плоскости на 90°, исчезает d-пи* -перекрывание. Это приводит к отсутствию обратного донирования, ослабляет связывание и дестабилизирует конформацию XXVIII6. По данным спектроскопии ЯМР, энергетический барьер для вращения фрагмента Fe (CO)>4> в XXVIIIa, связанный с прохождением через XXVIIIб, составляет 42—65 кДж/моль.
Аналогичная схема связывания осуществляется и в пи-комплексах, образуемых более сложными сопряженными алкенами, таких, как, например, металлкарбонильные комплексы XXIX—XXXII (рис. 10.).
Рис. 12 показывает схему орбитальных взаимодействий фрагментов в комплексе.
Особое внимание в ряду пи-комллексов привлекли так называемые металлоцены, или соединения с сэндвичевой структурой. Первым известным металлоценом, полученным в 1951 г. Т. Кили и П. Посоном, стал ферроцен XXXIII (M-Fe), послуживший прототипом для многих синтезированных впоследствии его аналогов. Аналогичное сэндвичевое строение было доказано и для хромоцена — дибензолхрома XXXIV и его аналогов. Объяснение природы связывания в молекуле ферроцена было дано впервые М. Дяткиной и Е. Шусторовичем (1959). Было показано, что только пи-орбитали лигандов играют существенную роль в стабилизации сэндвичевой структуры комплекса.
На рис. 13 показаны происхождение и последовательность валентных энергетических уровней в ферроцене XXXIII (M = Fe), а также в дибензолхроме XXXIV (М = Сг), получаемые на основании теории орбитальных взаимодействий и подтвержденные данными многочисленных полу эмпирических и неэмпирических расчетов.
Восемнадцать валентных электронов ферроцена (восемь от центрального атома d6s2) заполняют все нижние уровни вплоть до е>2>>g>. Связи между металлом и кольцами обусловливаются МО а>1>>g> и е>1>>g>. Вид некоторых МО ферроцена показан на рис. 14.
Электронное строение других металлоценов XXXIII и XXXIV описывается той же схемой МО, что и представленная на рис. 13. Тип связывания, реализованный в металлоценах XXXIII, XXXIV и обусловленный d—пи-взаимодействиями, осуществляется и для более сложных ценовых, так называемых трехпалубных структур.
Аналогичный характер имеют орбитальные взаимодействия, определяющие устойчивость сэндвичевых комплексов лантаноидов и актиноидов. Поскольку для этих элементов активными валентными орбиталями являются орбитали f-типа с квантовым числом 1=3, подходящие по симметрии пи-орбитали циклического лиганда должны обладать уже не одной узловой плоскостью (как е>1> и е>2>-МО циклопентадиена, комбинирующие с d-AO металла), а двумя. Это возможно лишь для циклических полиенов больших размеров, например для циклооктатетраена.
4. Правило 18 электронов
Анализ корреляционной диаграммы МО типового октаэдричес-кого комплекса ML>6>, в котором М — атом переходного металла (см. рис. 3), показывает, что в комплексе имеется девять низколежащих валентных МО (шесть связывающих и три несвязывающих), которые могут быть заселены 18 электронами. Диаграмма на рис. 11.13 относится к простейшему случаю лигандов L, образующих двухцентровые двухэлектронные связи. Как и в случае сигма-лигандов с р- и пи-орбиталями (например, С1-, СО, ...), именно двухцентровые двухэлектронные связи М—L определяют общую стабильность комплекса и можно ограничиться подсчетом электронов только на орбиталях этих связей. Из рис. 6 вытекает, что число электронов на таких орбиталях вместе с электронами на несвязывающих d-орбиталях металла также равно 18. Можно, таким образом, подойти к формулировке общего, весьма важного в химии координационных соединений «правила 18 электронов»: в устойчивых комплексах переходных металлов ML, общее число электронов на связях М—L и несвязывающих электронов металла равно 18.
Это правило можно трактовать как стремление центрального атома металла иметь замкнутую электронную оболочку соответствующего атома инертного газа. Можно представить и другое общее объяснение, позволяющее одновременно предсказать важные исключения из данного правила. На рис. 18,а приведена обобщенная диаграмма орбитальных взаимодействий валентных р-, s-, d-орбиталей (общее число которых равно 9) с n симметризованными сигма-орбиталями лигандов L в комплексе ML>n>. Подходящие по симметрии n-орбитали центрального атома (можно рассматривать их как соответствующие dx sy pz -гибридные орбитали) образуют с орбиталями лиганда n связывающих и n антисвязывающих МО, а (9 — n) d-орбиталей металла, имеющих отличную симметрию, образуют несвязывающий уровень. Очевидно, что на связывающих и несвязывающих уровнях можно разместить 18 электронов.
При практическом использовании правила 18 электронов пренебрегают всеми другими орбитальными взаимодействиями, кроме сигма-связывания, и каждый лиганд рассматривается как вносящий два электрона в валентную оболочку комплекса. Таким образом, объединяются и обычные сигма-лиганды (NR>3>, РRз, Н>2>О, CH>3>-), и сигма-лиганды
с р—d-донорным эффектом (Сl-, ОН-), и сигма-лиганды с d-пи* -акцепторными свойствами (СО, CNR, CR>2>, NO+). Кроме того, пи-лиганды рассматриваются аналогичным образом как льюисовские основания, причем число вносимых ими электронов приравнивается к числу электронов на связывающих и несвязывающих пи-МО. Это число можно оценить согласно рис.15.
Для металла подсчитываются все электроны на s-, р-, d-оболочках и учитывается общий заряд комплекса.
Нетрудно проверить выполнение правила 18 электронов для большинства рассмотренных выше пи-комплексов, например ферроцена (M = Fe), хромоцена (М = Сг). В отличие от последнего в валентной оболочке рутеноцена в структуре D>6h>-симметрик (M = Ru) содержалось бы не 18, а 20 электронов (Ru — d6s2, 8 электронов и по 6 электронов от каждого бензольного кольца). Чтобы иметь в валентной оболочке 18 электронов, структура рутеноцена должна быть искажена таким образом, чтобы одно из бензольных колец участвовало в связывании лишь двумя пи-связями. Именно такая структура XXXVIII найдена для перметильного производного рутеноцена (рис. 16). В отличие от неполярного симметричного хромоцена IX молекула XXXVIII характеризуется достаточно высоким дипольным моментом 2,03 D в растворе. Другой аналогичный пример — искажение пятичленного циклопентадиенового кольца в сэндвичевом вольфрамдикар-бонильном комплексе XXXIX (рис. 16), позволяющее вывести одну пи-связь (два электрона) из общего связывания. Атом вольфрама вносит шесть, два карбонильных лиганда — четыре, плоский циклопен-тадиенильный фрагмент — пять, а деформированный — три электрона.
Необычная структура карбонила кобальта Со>2>(СО)>8> также объясняется тем, что в ней достигается 18-электронная конфигурация валентной оболочки. Мостиковые карбонильные группы образуют многоцентровые связи, при формальном рассмотрении они отдают по одному электрону на оболочку каждого атома кобальта. Диамагнетизм Со>2>(СО)>8> свидетельствует о спаривании электронов кобальта и образовании связи Со—Со. Действительно, расстояние Со—Со составляет, по данным рентгеноструктурных исследований, всего 0,25 нм. Аналогичным образом, в комплексе XJLII следует ожидать наличия двойной связи Rh=Rh (рис. 17).
Правило 18 электронов имеет немало исключений, и его следует рассматривать только как один из факторов, способствующих образованию стабильной структуры координационного соединения. Отклонения от правила связаны часто с пространственными ограничениями, не допускающими координации центральным атомом необходимого для заполнения 18-электронной оболочкой числа лигандов. Например, ясно, что ион V3+ (d2) должен координировать восемь двухэлектронных лигандов, чтобы заполнить валентную оболочку полностью. Однако пространственные возможности допускают только октаэдрическую координацию. Особенно важным отклонением от требований правила 18 электронов являются плоскоквадратные тетракоординированные и плоские трикоординированные комплексы. Как следует из схемы орбитальных взаимодействий, приведенной на рис. 18, а—в, в обоих этих случаях р>z> -АО центрального атома остается отключенной от связывания с лигандами, так как ее узловая плоскость совпадает с плоскостью, в которой располагаются оси сигма-орбиталей лигандов L. Из рисунка следует, что при этом образуется в сумме только восемь связывающих и несвязывающих орбиталей комплекса, на которых могут разместиться лишь 16 электронов. Следовательно, в случае плоских тетра- и трико-ординированных структур переходных металлов устойчивой является 16-электронная конфигурация.
Действительно, рассмотрим электронную конфигурацию центрального атома Pt в соли Цейзе XXV. Этиленовый пи-лиганд и три сигма-лиганда С1- дают каждый по два электрона, т. е. всего восемь электронов, в валентную оболочку. Учитывая заряд комплексного аниона —1, заряд центрального иона (или число окисления центрального атома) определяют как — 1 —(—3)= +2. Ион Pt2+(d8) дает в валентную оболочку восемь электронов. Общая сумма валентных электронов, определяемая таким образом, равна 16 (8 + 8). Шестнадцать электронов содержатся также в валентных оболочках плоских трикоординированных комплексов [Fe (SiNMe>2>)>3>], XXVII, и др.

Рис. 1.

Рис. 2.

Рис.4.

Рис. 5.

Рис. 3.

Рис. 6.
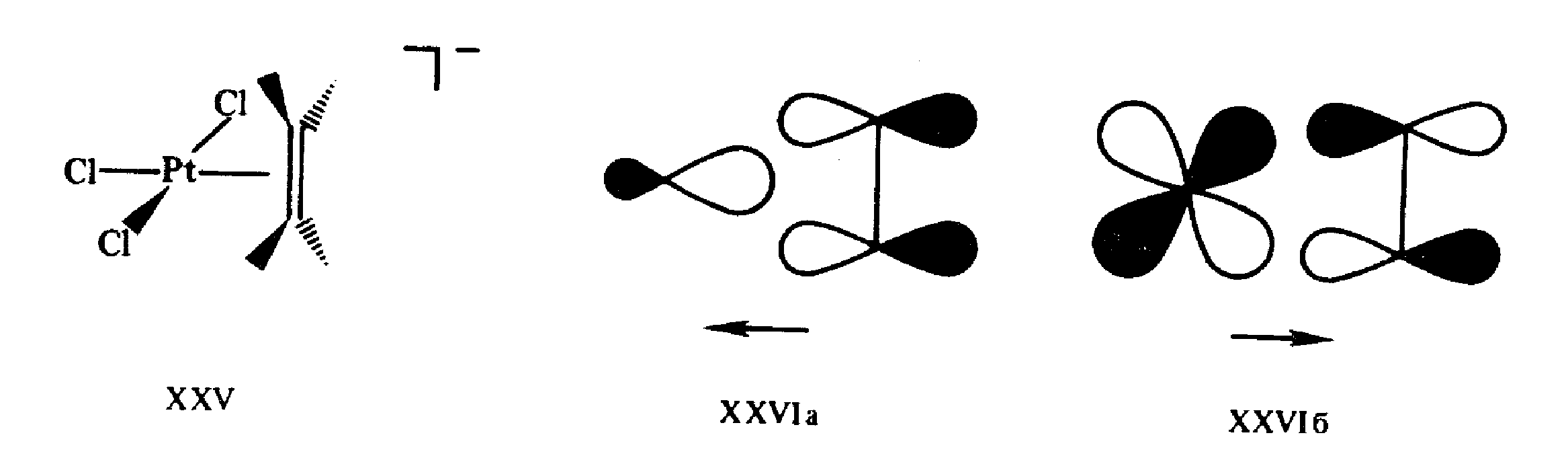
Рис. 7.

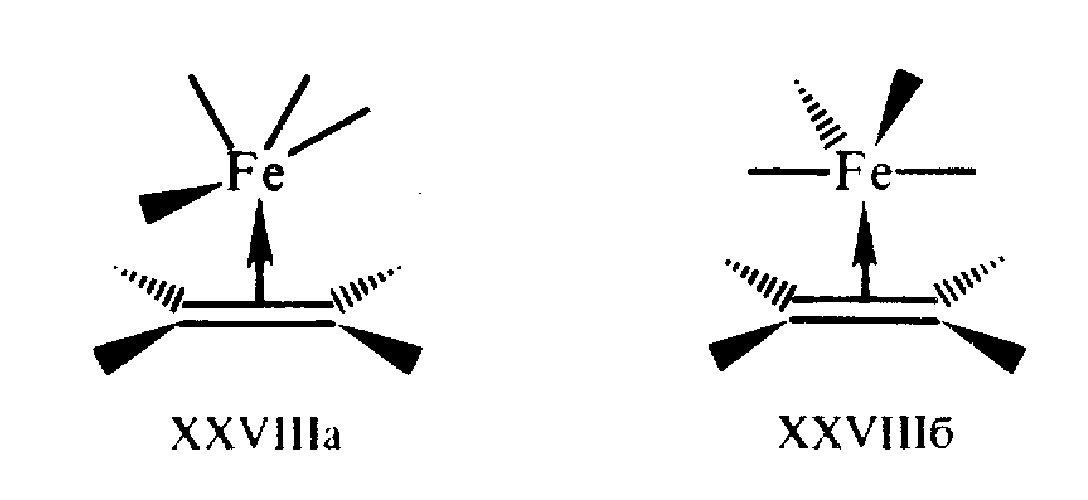
Рис. 8. Рис. 9.

Рис. 10.
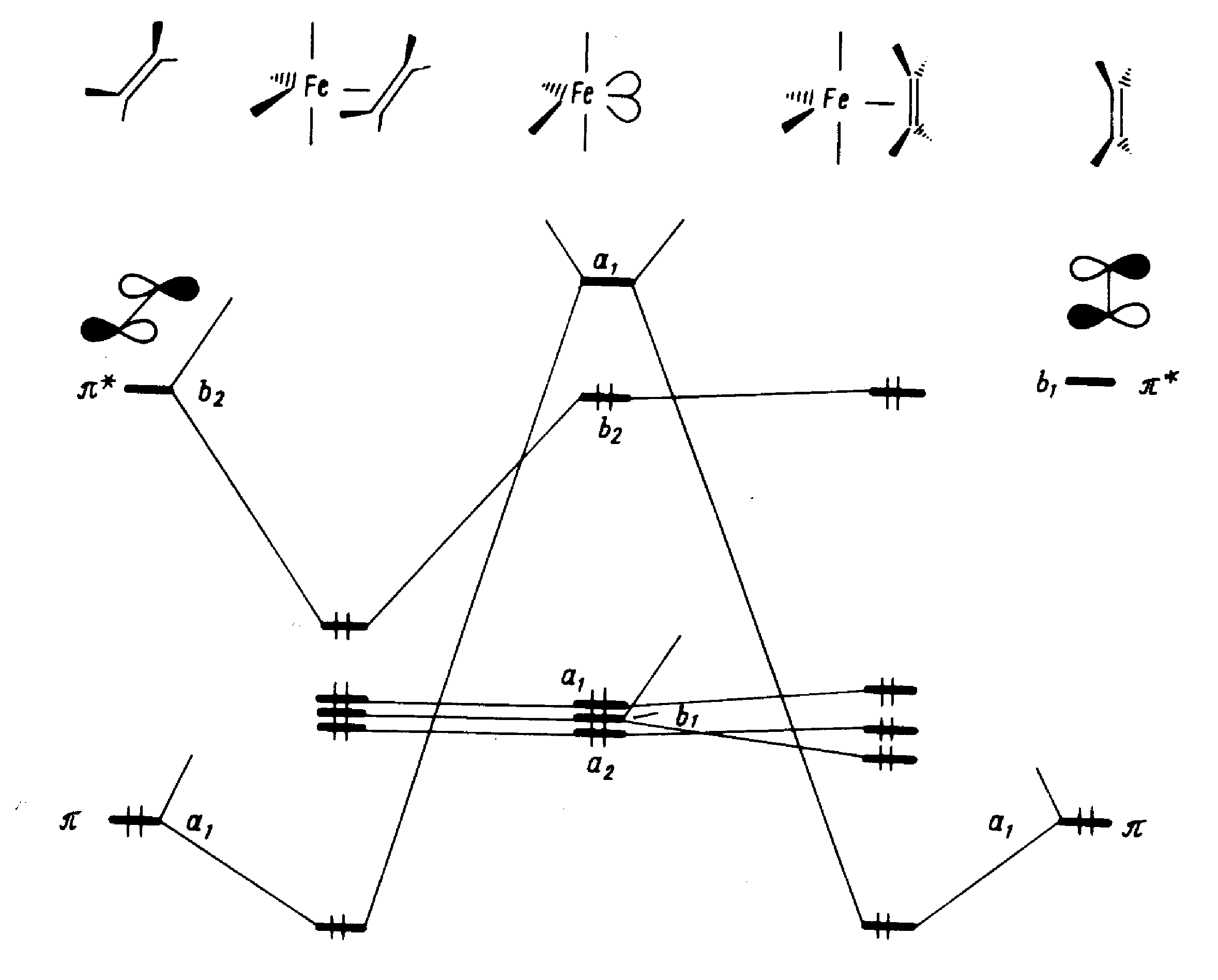
Рис. 11.

Рис. 12.

Рис. 13.

Рис. 14.

Рис. 15.

Рис. 16.

Рис. 17.

Рис. 18.
1