Гальмування залізоініційованого окиснення фосфоліпідів
1
МІНІСТЕРСТВО ОСВІТИ І НАУКИ УКРАЇНИ
ДОНЕЦЬКИЙ НАЦІОНАЛЬНИЙ УНІВЕРСИТЕТ
ХІМІЧНИЙ ФАКУЛЬТЕТ
МАГІСТЕРСЬКА РОБОТА
на тему: Гальмування залізоініційованого окиснення фосфоліпідів
Магістр: Льовкіна Вікторія Вікторівна
Спеціальність: 8.07301 “Хімія”
Затверджено наказом №126/08 від 10 лютого 2004 р.
Керівник: к.х.н., професор кафедри
Ніколаєвський Алим Микитович
Донецьк-2004
До захисту магістрської роботи допустити протокол № 17
від “3 ”червня 2004 р.
Зав. кафедрою фізичної хімії, к.х.н., професор Ніколаєвський Алім Микитович
________________________
Магістрська робота захищена з оцінкою _________
“____” _____________ 2004 р.
Секретар ДЕК ___________________
________________________________
________________________________
Зміст
Вступ
Теоретична частина
1.1.Емульсія фосфоліпідів яєчного жовтка як модель пероксидного окиснення ліпідів
1.2.Механізм залізоініційованого окиснення вуглеводнів
1.3.Антиоксидантний захист біологічних об’єктів
1.3.1. Регуляторні системи пероксидного окиснення ліпідів
1.3.2. Особливості дії природних антиоксидантів
1.3.3.Гальмування процесів окиснення синтетичними інгібіторами фенольного типу
1.4.Методи дослідження біологічного окиснення
2. Експериментальна частина
2.1. Газоволюмометричний метод
2.2. Тонкошарова хроматографія
2.3 Техніка безпеки
3. Гальмування залізоініційованого окиснення фосфоліпідів
Висновки
Література
Вступ
У зв’язку із забруднюванням навколишнього середовища та ростом поширення різноманітних хвороб, розвиток яких прямо чи посередньо пов’язан з ушкоджуваною дією вільних радикалів, питання забеспеченості організма людини антиоксидантами стоїть достатньо гостро. Тому пошук нових ефективних біоантиоксидантів представляється дуже актуальною і важливою науковою і практичною проблемою особливо для України, що пов'язано з наслідками Чорнобильської аварії.
Найбільш вивченими інгібіторами радикально-ланцюгових процесів є фенольні сполуки. Однак, спроби перенести результати, отримані in vitro, на біологічні системи не завжди успішні, тому що складні міжфазні явища in vivo визначають поведінку антиоксидантів в окисному процесі. Тому сучасні дослідники для оцінки антиоксидантів використовують тестові системи, наближені до біологічних. Однієї з них є емульсія яєчного жовтка – біохімічна система, що містить мембранні структури клітин. Дані, отримані на цій моделі, мають велику достовірність з погляду застосування до біологічних процесів, тим більше, що окиснення проводять в умовах, близьких до фізіологічних.
У зв'язку з цим метою даної роботи стало вивчення закономірностей інгібуючої дії фенольних антиоксидантів в процесі залізоініційованого окиснення жовточних ліпопротеїнів для пошуку нових ефективних антиоксидантів.
Теоретична частина
1.1. Емульсія фосфоліпідів яєчного жовтка як модель пероксидного окиснення ліпідів
В даний час загальновизнаною є роль пероксидного окиснення ліпідів в біологічних організмах [1]. В нормальному функціонуванні живих клітин першорядне значення мають біологічні мембрани, динамічними компонентами яких, що забезпечують стабільність біомембраної організації, є фосфоліпіди. В тканинах організмів утворення пероксидів і їхня витрата знаходяться на постійному стаціонарному рівні. Порушення цієї рівноваги в будь-який бік призводить до виникнення різних патологій.
Щоб дослідити можливість регулювання пероксидного окиснення ліпідів, що протікає за вільнорадикальним механізмом [2], для пошуку ефективних антиоксидантів цього процесу велике значення мають експерименти по моделюванню природних структур клітини.
Існують різні моделі пероксидного окиснення ліпідів.
I. Природні системи:
плазма людської крові [3,4],
гомогенати органів [2].
Дані моделі дуже нестабільні і легко окиснюються.
II. Синтетичні моделі пероксидного окиснення ліпідів у різних хемілюмінесцентних системах:
– модель, яка складається з пероксида водню і пероксидази з кореня хрону [5],
люмінол з додаванням ініціаторів [6],
лінолева кислота [7],
які далекі від живої системи.
Класичною моделлю клітинних мембран живих організмів є емульсія ліпопротеїдів яєчного жовтка [8,9], що дозволяє адекватно оцінювати антирадикальну активність досліджуваних сполук за ефектом гальмування пероксидного окиснення. Ця система відрізняється своєю доступністю, великою стабільністю при збереженні, дозволяє використовувати звичайні лабораторні методики й апаратуру для визначення рівня пероксидації ліпідів [10].
В медицині і біології широко використовується емульсія яєчного жовтка в фосфатному буфері. Сам жовток [11] на ~50% складається з води, 16% – білка, 34% – жирів, тому він являє собою емульсію, де жир у водній фазі є головною складовою частиною.
У жовтку яєць зосереджені практично всі ліпіди: прості ліпіди і жири, вміст яких складає біля 2/3 всіх ліпідів, і складні ліпіди (жироподібні сполуки), в основному фосфоліпіди – 37%, з них 82% – фосфатидилхолін, 15% – фосфатидилетаноламін. Більш 60% жирних кислот, що входять до складу ліпідів яйця, є ненасиченими, які в свою чергу беруть участь у пероксидному окисненні.
Як природна система емульсія містить вітаміни, ферменти, багато хто з них є ендогенними антиоксидантами.
Біологічні мембрани являють собою напівпроникний бар'єр, що відокремлює клітину від навколишнього середовища і дозволяє їй існувати як єдине ціле. Незважаючи на різноманітність біологічних функцій, форм і розмірів всі мембрани побудовані в основному з 2-х типів речовин: ліпідів і білків. Мембранні ліпіди – низькомолекулярні речовини, які відносяться до жирів. Характерна риса будь-якої ліпідної молекули полягає в тому, що вона побудована з двох частин: (полярної) голівки, яка несе електричні заряди і на яку приходиться не більш чверті довжини всієї молекули, і довгих хвостів, що не несуть електричного заряду [12]. Хвости ліпідної молекули – довгі ланцюги, побудовані з атомів С и Н. Голівки можуть мати різноманітну будову, але для ліпідів мембран найбільш характерні два типи: похідні цукрів – гліколіпіди чи похідні фосфорної кислоти – фосфоліпіди.
|
|
|
Рис.1.1. Схема будови молекул фосфоліпідів. |
Варто помітити, що полярні голівки всіх ліпідних молекул або заряджені негативно, або нейтральні (несуть одночасно і негативні, і позитивні заряди). В ліпідних молекулах ланкою, яка зв’язує хвіст і голівку, найчастіше служить залишок гліцерину; такі сполуки носять загальну назву – гліцероліпіди.
На схемі будови у ліпідів зображено два неполярних хвости. Ця характерна риса більшості ліпідних молекул, що входять до складу мембран.Одноланцюгові ліпіди звичайно не синтезуються клітинами в значній кількості, тому що вони руйнують мембрани [13].
Ліпіди, що входять до складу біомембран, можна підрозділяти на полярні ліпіди (фосфо–, гліко– і сфінголіпіди) і нейтральні (стерини).
В молекулах фосфоліпідів залишок фосфорної кислоти з'єднаний із гліцерином, ацільованим двома залишками жирних кислот. В природних фосфоліпідах в положенні 1 знаходиться, як правило, залишок насиченої жирної кислоти (найчастіше пальмітинової чи стеаринової), а в положенні 2 – залишок ненасиченої кислоти (олеїнової, лінолевої, арахідонової і декозагексаєнової) [13].
Основними компонентами мембран є фосфатидилхолін (ФХ), фосфатидилетаноламін (ФЕА), холестерин і різні гліколіпіди:

Фосфатидилхолін (лецитин)

Фосфатидилетаноламін (кефалін)
Наявність в молекулах ліпідів двох частин має пряме відношення до їх здатності утворювати мембрани. Ліпіди дуже погано розчиняються як в полярному розчиннику – воді (заважають неполярні хвости), так і в неполярному середовищі – олії (заважають полярні голівки). Щоб підкреслити різне відношення до води й олії, голівки називають гідрофільними, а хвости – ліпофільними. Відповідно ліпіди, молекули яких містять як гідрофільне, так і ліпофільне угрупування, називають амфіфільними речовинами.
Внаслідок поганої розчинності у воді і схильності до агрегації фосфоліпіди в водній фазі вже при низьких концентраціях (10-7–10-9М) здатні самоорганізовуватися або в структури типу протяжних подвійних шарів, що відділені один від одного водною фазою, або в замкнуті бульбашки – ліпосоми.
Ліпосоми (везикули) є найближчим аналогом біомембран. Вони являють собою замкнуті сферичні структури , що містять всередині воду в вигляді бульбашки і мають один чи кілька подвійних шарів ліпідів [14].
|
|
Рис.1.2. Ліпід-білковий подвійний шар – рідинно-мозаїчна модель.
Везикули можуть бути отримані із синтетичних амфіфілів і екстрактів мембран. Реконструйовані мембрани, тобто ліпосоми з мембранних складових клітин, містять майже всі компоненти клітинної мембрани: ліпіди, білки, гліколіпіди тощо.
Фосфоліпіди орієнтовані в подвійному шарі таким чином, щоб звести до мінімуму взаємодію між аполярними частинами їхніх молекул з водною фазою. Тому в подвійному шарі залишки жирних кислот контактують один з одним і формують гідрофобну зону, що відділена від водної фази зарядженим шаром, що складається з полярних “голівок”. Асоціація ліпідів в структури, обумовлена гідрофобними взаємодіями, супроводжується зменшенням вільної енергії, в результаті чого ці структури є стабільними. Ліпідний подвійний шар володіє одночасно і текучістю, і упорядкованістю структури, в зв'язку з чим у мембрані здійснюються взаємодії не тільки ближнього, але і далекого порядку. Така сукупність властивостей характерна для рідиннокристалічного стану, існування якого є необхідною умовою життєдіяльності біологічних систем.
Рухливість компонентів ліпідного подвійного шару забезпечується як визначеними властивостями молекул фосфоліпідів взагалі, так і властивостями окремих груп в кожній молекулі. Молекула фосфоліпідів в подвійному шарі може робити рухи трьох типів: обертання навколо власної осі, переміщення в площині подвійного шару (латеральна дифузія) і переміщення з одного шару в іншій (фліп-флоп) [13].
Простий фосфоліпідний подвійний шар має товщину ~37Å, що може збільшуватися до 45-50Å, якщо подвійний шар зв'язує холестерин і білок [12].
Основними компонентами біомембран, крім ліпідів, є білки. Білки біомембран в залежності від їхнього розташування можна розділити на дві великі групи: периферичні білки, що розташовуються на поверхні мембран, і інтегральні білки, що або глибоко занурені в гідрофобну область мембрани, або пронизують її наскрізь. Крім білків і ліпідів, в мембранах містяться протеоліпіди, тобто білки, ковалентно зв'язані з залишками ліпіду, чим вони і відрізняються від ліпопротеїнів, в яких комплекси між білком і ліпідом утворюються за рахунок нековалентних зв'язків [10].
Периферичні білки легко екстрагуються з мембрани слабкими розчинами солей і добре розчинюються у воді, вони зв'язані з поверхнею мембрани в основному електростатичними силами. Нерозчинні у воді інтегральні білки виділяють за допомогою детергентів чи органічних розчинників. Основний тип зв'язку між інтегральними білками і ліпідами мембран – це гідрофобні взаємодії. Існують також білки, що обмінюють ліпіди, які здатні здійснювати перенос фосфоліпідів між мембранами [15].
При зв'язуванні з фосфоліпідною мембраною периферичних білків відбувається зміна в їхній структурі. Можливо, часткове проникнення білків в товщу одинарного шару викликає його разупорядкування, що сприяє більш високої проникності іонів [16].
Таким чином, ліпопротеїни – це високомолекулярні водорозчинні частинки, що представляють собою комплекс білків (аполіпопротеїнів) і ліпідів, утворений нековалентними зв'язками, в яких полярні групи ліпідів разом з білком формують поверхневий гідрофільний шар, що оточує і захищає внутрішню гідрофобну ліпідну сферу від водного середовища.
1.2. Механізм залізоініційованого окиснення ліпідів
Окиснення біологічних мембран, основними компонентами яких є фосфоліпіди, що містять у своєму складі залишки ненасичених жирних кислот (НЖК), являє собою складний багатостадійний процес.
Як було раніше [2] доведено, це дійсно ланцюговий процес, який характеризується всіма рисами вільнорадикальної ланцюгової реакції: для його початку необхідна поява в системі вільних радикалів (ініціювання ланцюга), його протікання підкоряється кінетиці ланцюгових реакцій, між реакцією ініціювання споживання кисню і нагромадження гідропероксиду немає простих стехіометричних співвідношень, продукти реакції мають велику складність і інгібітори вільнорадикальних реакцій гальмують процес утворення пероксидів in vitro.
Друга найважливіша особливість процесу пероксидного окиснення ліпідів – це практично абсолютна необхідність іонів негемінового двовалентного заліза для його протікання при фізіологічних температурах. У цьому відношенні ліпідні системи відрізняються від моделей пероксидного окиснення ненасичених жирних кислот, наприклад лінолевої [2], у якій ефективні іони багатьох металів перемінної валентності. Є два шляхи пероксидного окиснення ліпідів біомембран, що принципово розрізняються на стадії ініціювання [17]. У першому випадку іони заліза – центри радикалоутворення – відновлюються ланцюгом переносу електронів ферментативно – НАДФН – специфічна система (НЗП). У неферментній системі (АЗП) відновлення заліза відбувається під дією аскорбінової кислоти й інших відновників з підходящим редокс-потенціалом. Реакції протікають за наступною схемою [1,18,19]:


Прооксидантна дія заліза опосередкована, тобто в цих реакціях залізо бере участь не у вільному, а в зв'язаному виді. З'єднуючись з визначеними функціональними групами білків, іони заліза стають пунктами радикалоутворення – центрами реакції ініціювання. У випадку НЗП ведучу роль у цьому процесі можуть грати сульфгідрильні групи цитохрома Р–450, що входять до складу його активного центра, також ініціює пероксидне окиснення комплекс АДФ-Fе2+. В АЗП на роль таких можуть претендувати функціональні групи мембранних білків, локалізовані в гідрофобній частині мембран.
Кінетика і стехіометрія обох процесів підтверджують представлення, відповідно до якого в основі розвитку цих реакцій лежить єдиний механізм – ланцюговий радикальний процес. Основні реакції, зв'язані з пероксидним окисненням ліпідів (ПОЛ) у біологічних мембранах, наступні [2,17]:
Ініціювання ланцюга:


Продовження ланцюга:
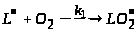

Розгалуження ланцюга:


Обрив ланцюга:






Таким чином, пероксидне окиснення ліпідів являє собою типовий ланцюговий процес з виродженим розгалуженням. У живій клітці матеріальним механізмом процесу біологічного окиснення є дихальний ланцюг – система транспорту електронів від відновленого органічного субстрату до кисню. Компоненти дихального ланцюга (близько 40) локалізовані у внутрішній мембрані мітохондрій. Спеціалізовані білки (залізо-сірчані, гемовмісні), у яких іони металів з перемінною валентністю, убіхінони, флавіни виконують роль переносників електронів:


Активні
форми кисню ( ), що виникли в ході цього процесу в силу
можливого “витоку” із системи транспорту
електронів можуть ініціювати
неферментативне пероксидне окиснення
ліпідів [1]. Вирішальну роль в його
регуляції в мембранах грають іони заліза
[20]. Реагуючи з гідропероксидами,
двовалентне залізо різко прискорює
процес ланцюгового окиснення ліпідів,
розгалужуючи ланцюг. Але, взаємодіючи
з вільними радикалами, що ведуть ланцюг,
те ж саме двовалентне залізо інгібує
реакції ланцюгового окиснення, діючи
як антиоксидант.
), що виникли в ході цього процесу в силу
можливого “витоку” із системи транспорту
електронів можуть ініціювати
неферментативне пероксидне окиснення
ліпідів [1]. Вирішальну роль в його
регуляції в мембранах грають іони заліза
[20]. Реагуючи з гідропероксидами,
двовалентне залізо різко прискорює
процес ланцюгового окиснення ліпідів,
розгалужуючи ланцюг. Але, взаємодіючи
з вільними радикалами, що ведуть ланцюг,
те ж саме двовалентне залізо інгібує
реакції ланцюгового окиснення, діючи
як антиоксидант.
Що ж визначає співвідношення між цими двома реакціями заліза? Наявні дані говорять про те, що воно визначається співвідношенням концентрації гідропероксиду і заліза в системі. Очевидно, двовалентне залізо набагато швидше реагує з гідропероксидами, чим з вільними радикалами. Спочатку залізо розкладає всі гідропероксиди, а вже потім, якщо воно в надлишку, вступає в реакцію з радикалами.
При окисненні ліпідної фази біомембран велике значення має місце взаємодії гідропероксидів ліпідів з іонами двовалентного заліза і доля вільних радикалів, що утворюються в цій реакції [21]. Деталі даного процесу не вивчені. Припускають, що проникнення іонів Fe2+ (де, зважаючи на все, йде ланцюгова реакція окиснення НЖК фосфоліпідів) малоймовірно. Скоріше відбувається “виринання” гідропероксидної групи на поверхню ліпідного шару і зворотне занурення вільного радикала, що утворився в реакції з залізом, в товщу ліпідної фази.
Було встановлено [17], що склад ліпідів і швидкість їхніх окисних перетворень взаємозалежні. Зміна складу ліпідів мембран спричиняє зміну мікров'язкості ліпідного компонента, ліпід-білкових взаємодій і умов для структурних переходів у мембранах. Збільшення антиоксидантної можливості призводить до переходу ліпідів мембран у більш “рідкий” стан, у той час як зниження антиоксидантної активності робить ліпідну фазу більш в'язкою. Жирнокислотні ланцюги з гідрофільними кисневмісними угрупуваннями, що проникли в них, будуть виштовхуватися з гідрофобного оточення і наближатися або входити в контакт із зовнішньою водною фазою. Це призводить до розпушення мембрани, до появи в них гідрофільних “пір” [22]. Ці процеси прискорюють подальше пероксидне окиснення фосфоліпідів у біомембранах.
1.3. Антиоксидантний захист біологічних об'єктів
1.3.1 Регуляторні системи пероксидного окиснення ліпідів
Біологічна значимість того або іншого процесу в живих клітках стає загальновизнаною звичайно після того, як виявляються спеціальні ферментативні системи, що регулюють даний процес.
У клітці існує кілька систем [17], що змінюють швидкість окиснення ліпідів і які можна розглянути як регуляторні. Ці системи можна розбити на чотири групи. Система I, відповідальна за строго визначену структурну організацію ліпідів і яка впливає таким чином на швидкість реакції ініціювання, продовження й обриву ланцюга. Ця система відповідає за доступність залишків НЖК фосфоліпідів мембран до дії кисню, чим щільніше упаковка НЖК в фосфоліпідах мембран, тим менше до них доступ кисню, тим нижче швидкість зародження вільних радикалів. Будь-які агенти, що порушують упаковку НЖК, прискорюють окиснення ліпідів. Фактори, що підтримують структуру ліпідів мембран, гальмують окиснення. При моделюванні ПОЛ у мембранах in vitro порушується структурованість ліпідного подвійного шару. Тому кількісні характеристики, отримані на таких модельних системах, можуть бути з визначеною обережністю перенесені на окиснення ліпідів in vivo, структурованість яких впливає на швидкість їхнього окиснення (структурне інгібування).
Система II. Ферменти, що відповідають за утворення і загибель активних форм кисню (супероксиддисмутаза) і вільних радикалів, що ініціюють окиснення, і ферменти, що беруть участь у розпаду пероксидів без утворення вільних радикалів з них (каталаза, глутатионпероксидаза) [23,24].
Система III, що регулює обмін фосфоліпідів мембран і впливає на швидкість окиснення шляхом зміни складу НЖК фосфоліпідів, співвідношень ліпід/білок, фосфоліпід/холестерин і т.д.
Система IV: низькомолекулярні речовини, що виконують роль ініціаторів, каталізаторів, інгібіторів і т.п. і які впливають на стадію розгалуження й обриву ланцюга.
Ендогенна система антиоксидантного захисту містить у собі [2]:
Антиоксиданти фенольного типу: вітамін Е, пироксин, стероїдні гормони; мікроелемент селен;
SH-вмісні низько– і високомолекулярні сполуки, що розкладають пероксиди за молекулярним механізмом;
Антиоксиданти – комплексони; моно-, ді-, трикарбонові кислоти й інші аніони, що зв'язують залізоцерулоплазмін, феррітин.
На думку ряду авторів [24], здатністю безпосередньо реагувати з RO>2>● ліпідів володіють тільки природні антиоксиданти, їхній вплив на швидкість окиснення значно перевищує ефективність впливу синтетичних інгібіторів. Це визначає особливу роль природних АО в регуляції процесів ПОЛ.
1.3.2 Особливості дії природних антиоксидантів
Ряд експериментальних даних [24,25] свідчить про те, що недостача в організмі тих або інших природних АО призводить до інтенсифікації окисних процесів в ліпідах і до появи в них продуктів окиснення в кількостях, великих чим у нормі.
До природних антиоксидантів або біоантиоксидантів відносяться речовини рослинного або тваринного походження, що гальмують у модельних реакціях розвиток процесів окиснення. Біоантиоксиданти клітки складаються з екзогенних, що доставляються з їжею, і ендогенних АО, що надходять у клітку гуморальним шляхом або синтезуються в ній.
В літературі широко обговорюється питання про внесок різних компонентів ліпідів в їхню антиоксидантну активність (АОА). Однак у цьому питанні не існує єдиної точки зору. Одні дослідники зв'язують АОА ліпідів із присутністю в них однієї індивідуальної речовини (наприклад, токоферола або убіхінона) [26]. Інші вважають, що активність ліпідів визначається сукупністю властивостей різних компонентів, зміна в складі яких виражається в зміні властивостей ліпідів взагалі [10]. Треті думають, що АОА ліпідів залежить від антиоксидантних властивостей природних антиоксидантів, їхньої кількості, від можливого взаємного впливу один на одного, від взаємодії з речовинами, що самі не є АО, але збільшують або зменшують активність останніх [17].
Загальновідомо,
що сутність процесу інгібованого
окиснення полягає в заміні активних у
реакції передачі ланцюга радикалів
 субстрату, що окисляється, на значно
менш активні
субстрату, що окисляється, на значно
менш активні
 радикали
, що надалі в залежності від співвідношення
концентрацій реагентів і відповідних
параметрів швидкостей реакцій гинуть
у реакціях обриву при взаємодії з
радикалами
радикали
, що надалі в залежності від співвідношення
концентрацій реагентів і відповідних
параметрів швидкостей реакцій гинуть
у реакціях обриву при взаємодії з
радикалами
 або
або
 або вступають у (побічні) реакції
продовження ланцюга. Загальноприйнята
модель інгібованого окиснення включає
наступні реакції [2,27]:
або вступають у (побічні) реакції
продовження ланцюга. Загальноприйнята
модель інгібованого окиснення включає
наступні реакції [2,27]:
 (7),(-7)
(7),(-7)

 (8)
(8)
 (9)
(9)
 (10)
(10)
 (11)
(11)
 (12)
(12)
Ослаблення антиоксидантної дії інгібіторів може бути пояснено протіканням в окисній системі побічних реакцій за участю інгібітора та його радикалів. Такими реакціями можуть бути: реакція взаємодії радикала інгібітора з молекулою вуглеводню (10), з молекулою гідропероксиду (реакція (7)), реакція інгібітора з гідропероксидом (реакція (11)), або киснем (реакція (12)). Швидкість цих реакцій суттєво залежить від будови антиоксиданта й умов окиснення. В першу чергу цікаві властивості інгібіторів в умовах, близьких до фізіологічних: невисока температура окиснення (37˚С), мала глибина перетворення, високий ступінь ненасиченості субстрату. В цих умовах реакцією (12) можна знехтувати за рахунок низької температури окиснення.
В умовах малої глибини окиснення, коли концентрація гідропероксидів у субстраті мала, можна знехтувати реакціями (-7) і (11).
Співвідношення швидкостей реакцій, що зменшують ефективну дію антиоксидантів, може змінюватися в залежності від концентрації вільних радикалів, тому що при збільшенні швидкості ініціювання (W>i>) швидкість реакцій (8) і (9) зростає квадратично, а реакція (10) – лінійно. Таким чином, при збільшенні W>i> в системі внесок реакції продовження ланцюга радикалами антиоксидантів у загальну швидкість окиснення зменшується, тобто зростає ефективність АО. У роботі [27] розглянута розширена кінетична схема окиснення вуглеводнів і отримані залежності, що підтверджують збільшення ефективності АО при підвищенні концентрації вільних радикалів у системі. Цим пояснюється той факт, що найбільшу ефективність природні АО виявляють у моделях окиснення високоненасичених жирних кислот.
Максимальний ефект гальмування окиснення природними АО в модельних системах може бути отриманий при окисненні високоненасичених субстратів з малим вмістом пероксиду і при низьких температурах. Саме такі умови властиві окисненню ліпідів у біомембранах, тобто фізіологічні умови є оптимальними для прояву антиоксидантної дії природних АО. Високі значення антирадикальної активності природних АО лежать в основі різкої зміни швидкості ПОЛ, що забезпечує високу ефективність регуляції навіть при незначній зміні їхньої концентрації.
У деяких випадках мала кількість природних АО може бути доповнена синтетичними інгібіторами, які можна використати для направленої зміни АОА ліпідів і, очевидно, для впливу на перебіг тих захворювань, для яких зміна антиоксидантної активності ліпідів є суттєвим чинником.
1.3.3 Гальмування процесів окиснення інгібіторами фенольного типу
Синтетичні інгібітори, що мають у своєму складі кілька функціональних груп, можуть брати участь у реакціях різного типу, що призводить до гальмування окиснення. Таким чином, з погляду механізму дії [28], інгібітори окиснення можна розділити на шість груп:
I. Інгібітори, що обривають ланцюг за реакцією з пероксидними радикалами. Такими інгібіторами є ароматичні сполуки з порівняно слабкими О-Н і N–H зв'язками (феноли, нафтоли, ароматичні аміни, діаміни).
II. Інгібітори, що обривають ланцюг за реакцією з алкільними радикалами. До них відносяться сполуки: хінони, імінохінони, метиленхінони, стабільні нітроксильні радикали, молекулярний иод.
III. Інгібітори, що швидко реагують з гідропероксидами без утворення вільних радикалів: сульфіди, фосфіти, арсеніти і т.д., а також тіосульфати і карбамати металів, різноманітні комплекси металів.
IV. Інгібітори-дезактиватори металів. Каталізоване окиснення сполуками металів перемінної валентності вдається сповільнити, вводячи комплексоутворювач, що утворює з металом неактивний комплекс стосовно гідропероксиду. До таких інгібіторів відносяться діаміни, гідроксікислоти й інші біфункціональні сполуки.
V. Інгібітори комбінованої дії. Часто в молекулі інгібітору присутні дві або кілька різних функціональних груп (-ОН, –NH>2>, =S, –SH та ін.), кожна з яких вступає паралельно у відповідну реакцію.
VI. Синергісти – це речовини, що підсилюють дію інгібіторів. Синергісти вводять з будь-яким типовим інгібітором у суміші. Для фенолів синергістами є органічні кислоти (лимонна, аскорбінова, щавелева).
Серед інгібіторів рідиннофазного окиснення органічних сполук центральне місце займають феноли. Саме гідроксильна група, яка приєднана до ароматичного кільця молекули, забезпечує здатність фенолів гальмувати окиснення за рахунок взаємодії їх з пероксидними радикалами субстрату, що окислюється:

Аргументами на користь цієї елементарної реакції є реєстрація методом ЕПР радикалів, що утворюються з інгібітору, наявність ізотопного ефекту з дейтерованими фенолами, відсутність інгібуючої активності простих і складних ефірів фенолів [29].
Активність фенолу в реакції з пероксидним радикалом залежить від двох факторів: міцності О-Н зв'язку (D>O–H>) і наявності об'ємних замісників в орто-положенні, що створюють в елементарному акті стеричні перешкоди. З одного боку, збільшення об'єму о–алкільних замісників знижує міцність ОН-зв'язку, оскільки ці замісники викликають порушення компланарності гідроксильної групи з площиною ароматичного кільця. Це повинно призводити до росту активності фенолів у реакціях радикального заміщення за участю атома водню гідроксильної групи. З іншої сторони виникають стеричні перешкоди для таких реакцій. Така подвійність приводить до того, що найбільше в реакціях радикального заміщення є феноли з проміжним о–алкільним заміщенням.
Необхідно відзначити, що електроннодонорні замісники збільшують антиоксидантну активність фенолів, а електронноакцепторні – її знижують.
В молекулі PhOH вразливий О-Н зв'язок, що легко атакується пероксидним радикалом. Висока реакційна здатність фенолів пояснюється в основному невисокими значеннями міцності О-Н зв'язків.
Феноли
інтенсивно обривають ланцюг за реакцією
з
 у концентраціях, що на 4–5 порядків
менше, ніж концентрація вуглеводню, що
окисляється. Цьому відповідає різниця
в k>2>
і
k>7
>на
кілька порядків. Таке велике розходження
не зв'язане лише з міцністю зв'язків С-Н
у вуглеводнях і О-Н
у фенолах, а викликано різними активаційними
бар'єрами цих реакцій. Як показано в
роботі [28], велике розходження в енергіях
активацій реакцій 2 і 7 викликано
триплетним відштовхуванням і внеском
незв’язуючої орбіталі Y…...OOR
у створенні активаційного бар'єра в
реакції типу
у концентраціях, що на 4–5 порядків
менше, ніж концентрація вуглеводню, що
окисляється. Цьому відповідає різниця
в k>2>
і
k>7
>на
кілька порядків. Таке велике розходження
не зв'язане лише з міцністю зв'язків С-Н
у вуглеводнях і О-Н
у фенолах, а викликано різними активаційними
бар'єрами цих реакцій. Як показано в
роботі [28], велике розходження в енергіях
активацій реакцій 2 і 7 викликано
триплетним відштовхуванням і внеском
незв’язуючої орбіталі Y…...OOR
у створенні активаційного бар'єра в
реакції типу
 Чим
міцніше зв'язок Y–OOR,
тим більше енергія незв’язуючої орбіталі
і вище її внесок триплетного відштовхування,
що складає 27,6 кдж/моль, а у випадку
фенолів він близький до нуля, тому що
зв'язок RO–OAr
дуже слабкий. Саме тому феноли володіють
високою реакційною здатністю стосовно
пероксидних і алкоксильних радикалів.
Чим
міцніше зв'язок Y–OOR,
тим більше енергія незв’язуючої орбіталі
і вище її внесок триплетного відштовхування,
що складає 27,6 кдж/моль, а у випадку
фенолів він близький до нуля, тому що
зв'язок RO–OAr
дуже слабкий. Саме тому феноли володіють
високою реакційною здатністю стосовно
пероксидних і алкоксильних радикалів.
Крім
того, реакції
 з фенолом, мабуть, передує утворення
водневого зв'язку:
з фенолом, мабуть, передує утворення
водневого зв'язку:

Вимірювана на досвіді константа швидкості цієї реакції k>7 >дорівнює добуткові К·k.
Час
життя комплексу
 трохи більший, ніж час існування клітинної
пари
трохи більший, ніж час існування клітинної
пари
 ,
що, видимо, позначається на константі
швидкості реакції 2. Коли в розчині
присутні полярні молекули, що утворюють
водневий зв'язок з фенолом, це, природно,
сповільнює реакцію і знижує ефективну
константу швидкості реакції k>7>.
,
що, видимо, позначається на константі
швидкості реакції 2. Коли в розчині
присутні полярні молекули, що утворюють
водневий зв'язок з фенолом, це, природно,
сповільнює реакцію і знижує ефективну
константу швидкості реакції k>7>.
Аналіз
значень k>7>
показує,
що величина цієї константи слабко
залежить від природи пероксирадикалів
і визначається, в основному, структурою
інгібітору [13,15,30]. Характер замісників,
їхнє положення в ароматичному кільці
інгібітору з однієї сторони впливають
на міцність О-Н
зв'язку
в молекулах інгібітору, а з іншої на
активність радикалів ,
що утворюються з нього .
,
що утворюються з нього .
Феноксильні
радикали багатьох фенолів порівняно
стійкі через делокалізацію вільного
 гетероатома з π-електронами
ароматичного кільця, що дає можливість
вивчати їхні властивості і визначати
будову продуктів. При великих концентраціях
радикалів
гетероатома з π-електронами
ароматичного кільця, що дає можливість
вивчати їхні властивості і визначати
будову продуктів. При великих концентраціях
радикалів
 в системі з продуктами перетворення
в системі з продуктами перетворення
 є,
головним чином, сполука ROOIn
(реакція
8).
є,
головним чином, сполука ROOIn
(реакція
8).
В
умовах інгібованого окиснення з реакцією
8 конкурує реакція бімолекулярної
загибелі
 (реакція 9). В залежності від співвідношення
[
(реакція 9). В залежності від співвідношення
[ ]/[
]/[ ]
і структури феноксила може переважати
той або інший шлях. Можлива димеризація
феноксильних радикалів за положеннями
2, 4, 6 ароматичного кільця, яка є зворотньою
і не призводить до утворення стабільних
продуктів. Основний шлях їх зворотньої
бімолекулярної загибелі при наявності
в феноксилі слабко зв'язаних атомів
водню
– диспропорціонування
з утворенням метиленхінона і регенерацією
вихідного фенолу [30].
]
і структури феноксила може переважати
той або інший шлях. Можлива димеризація
феноксильних радикалів за положеннями
2, 4, 6 ароматичного кільця, яка є зворотньою
і не призводить до утворення стабільних
продуктів. Основний шлях їх зворотньої
бімолекулярної загибелі при наявності
в феноксилі слабко зв'язаних атомів
водню
– диспропорціонування
з утворенням метиленхінона і регенерацією
вихідного фенолу [30].
Механізм дії інгібіторів досить складний і включає крім реакції обриву ланцюга ряд інших елементарних реакцій за участю молекул і радикалів інгібітору.
Оскільки феноли – відновники, а обрив ланцюга на інгібіторі – реакція окиснення, той будь-який інший окисник, що знаходиться в системі, буде реагувати з молекулою інгібітору. Такими окисниками в системі завжди є гідропероксид і молекулярний кисень. Якщо в результаті реакції інгібітору з цими речовинами утворюються тільки молекулярні продукти, то відбувається додаткова витрата інгібітору, що знижує його активність. Якщо ж у результаті реакції утворюються вільні радикали, то реакція служить додатковим джерелом ініціювання.
Активність різних фенольних сполук як вільнорадикальних АО досліджувалася на великій кількості систем, включаючи ліпіди в білку, емульговані ліпіди й інші складні харчові матеріали. В жировмісних системах, таких як емульсії, АО можуть розподілятися між гідрофобною ліпідною фазою, гідрофільною водною фазою і міжфазним середовищем. Ці системи відносять до гетерофазних, тому що ліпіди утворюють різні дискретні середовища, в залежності від їхніх фізичних властивостей, через несумісність з водними системами.
Ліпофільний характер АО, обумовлений його розподілом між фазами, розрізняється в полярності. Одною важливою рушійною силою для розподілу є енергія віддалення утримуваної водної оболонки, що утворюється навколо АО у водній фазі.
Сили взаємодії між молекулами, що є результатом притягання між різними функціональними групами, можуть призвести до різного характеру розподілу. З одного боку, загальний склад дискретних фаз може викликати розходження в полярностях, що так само впливає на характер розподілу АО [31].
Розходження в ефективності антиоксидантів у дискретних ліпідних системах можна віднести до різної розчинності АО в різних фазах колоїдних харчових систем [32,33].
Активність зростає при наявності притягання заряджених частинок і знижується при відштовхуванні ліпідної поверхні і гідрофільних АО [7,34].
На підставі розходжень антиоксидантної активності було припущено, що міжфазний розподіл антиоксидантів – важлива фізико-хімічна властивість, що може значно впливати на їхню активність, і значний вплив робить константа розподілу сполук на доступ до радикалів у ліпофільній фазі, а не прямий розгляд швидкостей захвату радикалів [34].
В деяких дослідженнях показано [32], що відносна активність АО може змінюватися, якщо порівнювати системи з розходженнями в розподілі ліпідної фази. Повідомили, що гідрофільні антиоксиданти менш ефективні в м/в (полярних) емульсіях і мембранних системах, чим гідрофобні. Антиоксидантний потенціал сполук різний при різних способах окиснення або, для того самого досліду, при різній полярності середовища, оскільки взаємодія АО з іншими сполуками відіграє важливу роль в активності. Спостерігали протилежні результати, коли та сама модельна сполука є сильним АО в одному методі і прооксидантом в іншому. Це явище, назване “полярним парадоксом”, описано в роботі [32], гідрофільні АО більш ефективні в масі олії, тоді як ліпофільні мають велику активність в емульсіях.
Загальна тенденція така, що поліпшена стабілізація феноксильного радикала – бажана, але ліпофільна природа молекул і спорідненість АО до ліпідів може бути визначальним [35].
Оскільки вважається, що окиснення ліпідів відбувається в середовищі міцели або на поверхні ліпіду, необхідні систематичні дослідження розподілу АО в ліпідвмісних гетерофазних системах.
1.4. Методи дослідження біологічного окиснення
Для дослідження процесів пероксидного окиснення ліпідів в біологічних системах використовують вільнорадикальні інтермедіати ПОЛ (головним чином алкильні та алкилперекисні вільні радикали), продукти першого єтапу ланцюга окиснення ліпідів – їх гідропероксиди; проміжні, чи вторинні сполуки, які утворюються в результаті розпаду гідропероксидів, та кінцеві продукти ПОЛ [27]:

Труднощі аналізу продуктів ПОЛ визначаються наступними причинами:
1 – в кожний момент часу вміст дієнових коньюгатів та ліпідних пероксидів є стаціонарна концентрація сполук, результат двох одночасно протікаючих процесів: утворення та розпаду, тобто підвищення вмісту ліпідних пероксидів може бути як результат збільшення швидкості їх утворення, так і навпаки – зменьшення швидкості розпаду;
2 – в добуванні біологічного матеріалу та готуванні його для аналізу стаціонарна концентрація пероксидів повинна залишатися постійною. Для запобігання накопичення пероксидів використовують антиоксиданти: токоферол, ЕДТА, а також проводять усі процедури виділення в безкисневих умовах.
Оскільки первинними молекулярними продуктами ПОЛ є гідропероксиди та діалкилпероксиди, то в основі більшості існуючих методів дослідження процесів окиснення полягає визначення вмісту гідропероксидів ліпідів реакцією відновлення їми різних барвників або іонів І- (йодометрія) [2]. В основі різноманітних модифікацій іодометричного метода лежить визначення вільного іоду, який утворюється в результаті стехіометричного відновлення пероксидних груп йодид-іоном. Недоліком цього методу є те, що крім ліпідних пероксидів в окиснювальній системі можуть утворюватись пероксиди інших класів.
Пероксиди ліпідів є достатньо нестійкими речовинами, які легко підлягають гомолітичному розпаду. Тому результати кількісного аналізу гідропероксидів відображають лише стаціонарні концентрації цих продуктів в ліпідних системах [27]. Більш стійкими є вторинні продукти ПОЛ. Особливий інтерес при цьому представляють спектральні методи (УФ-спектрофотометрія), які широко використовують при вивченні нестійких проміжних продуктів. Застосування спектрофотометричного методу обмежено тим, що в короткохвильовій області спектру суттєво поглинання ізольованих подвійних зв’язків, тобто його можна розглядати як приблизний напівкількісний.
Подальше перетворення утворених продуктів призводить до утворення малонового діальдегіду [2,27], які визначають за кольоровою реакцією з тіобарбітуровою кислотою. ТБК-тест дуже зручний для дослідженя швидкості ПОЛ в ізольованих системах. В роботі [36] проводили оцінку АОА плазми крові та фармакологічних препаратів за накопиченням ТБК-активних продуктів з використанням як модельної системи дисперсії жовточних ліпопротеїнів. В цей час найбільш чутливим методом виявлення вільнорадикальних інтермедіатів є метод, що оснований на вимірюванні інтенсивності хемілюмінесценції електронно-збуджених продуктів, які утворюються за реакцією рекомбінації ліпідних радикалів. Проте хемілюмінесцентний (ХЛ) метод дозволяє виявляти не самі радикали, а ті молекулярні продукти їх рекомбінації, що виявляються у збудженому стані, тобто ХЛ є непрямим методом регістрації ліпідних радикалів.
ХЛ свідчить про швидкість рекомбінації алкілпероксидних радикалів у зразку. Ця особливість метода може бути використана для дослідження процесів ПОЛ, які швидко розвиваються. Другою важливою перевагою цього метода є його висока чутливість (10-10М) [27].
Недолік ХЛ метода полягає у неможливості контролювати фізико-хімічні властивості ліпідів, що призводить до зниження відтворюваності результатів ХЛ досліджень.
В якості модельної системи часто використовують дисперсію жовточних ліпопротеїнів (ЖЛП). Її готують різними способами: екстракцією хлороформно-метанольною сумішшю [2]; шляхом суспензування ЯЖ в фосфатному буфері [37] або в дистильованій воді [37]. В роботах при окисненні ЖЛП використовують буфери – трис-HCl [2], фосфатний в присутності солей NaCl [38] чи KCl [39], які забеспечують фізіологічне рН = 7,4. Концентрація заліза змінюється в інтервалі 10-4 - 2•10-2 М.
Для дослідження кінетики окиснення вуглеводнів крім ХЛ широко використовують газоволюмометричний метод. Відомості про використання газометричного метода в літературі є лише для таких модельних систем як метилолеат [40], олеїнова кислота, етилбензол, але не дисперсія ЖЛП. Оскільки ліпосоми ЯЖ є найближчим аналогом біомембран, дослідження можливості їх використання в якості субстрата окиснення на газоволюмометричній установці є актуальним.
2. Експериментальна частина
2.1.1 Газоволюмометричний метод
Одним із простих і розповсюджених методів вивчення кінетики рідиннофазних реакцій окиснення органічних речовин є метод вимірювання кількості поглиненого кисню. Газоволюмометричний метод дозволяє вимірювати швидкість окиснення з великим ступенем точності при малих глибинах перетворення, коли впливом продуктів окиснення на кінетику реакції можна знехтувати.
Існують різні варіанти газоволюмометричних установок, загальний принцип їхньої дії полягає у вимірюванні швидкості поглинання кисню при постійному тиску. Визначення кінетичних параметрів процесу інгібованого окиснення: період індукції, константу швидкості реакції з пероксильними радикалами, коефіцієнт інгібування і ряд інших кінетичних характеристик проводили на установці для автоматичної реєстрації і запису поглинання кисню "Кулон-1" з фотоелектронним датчиком заводу інституту хімічної фізики РАН (рис.2.1).
Установка складається з реакційної судини (1), зануреної в термостатовану ячейку (2), термостатованої газової бюретки (3), електролітичної ячейки з платиновими електродами (електроліт - насичений розчин щавлевої кислоти) (4), регулятора тиску (5), заповненого ундеканом, і манометра (6), фотоелектроннного датчика (8), підсилювача датчика (9), стабілізатора струму (10). Перед початком досліду бюретка, регулятор тиску і реакційна судина з речовиною, що окиснюється, заповнюються до атмосферного тиску киснем. Для проведення окиснення реакційна судина нагрівається до певної температури за допомогою термостата, при безперервному перемішуванні, після двоххвилинного прогріву з'єднується з бюреткою і регулятором тиску. Фотоелектронний датчик через стабілізатор струму з'єднаний з електролітичною ячейкою. Під час реакції кисень з бюретки надходить у реакційну судину, при цьому тиск у системі падає, і в зв'язку з цим включається електролітична ячейка. Газ, що виділився з ячейки, підвищує тиск у термостатованому об'ємі і піднімає рівень ундекану в бюретці, у результаті чого тиск у системі вирівнюється. Швидкість просування меніска ундекана в бюретці пропорційна швидкості реакції.
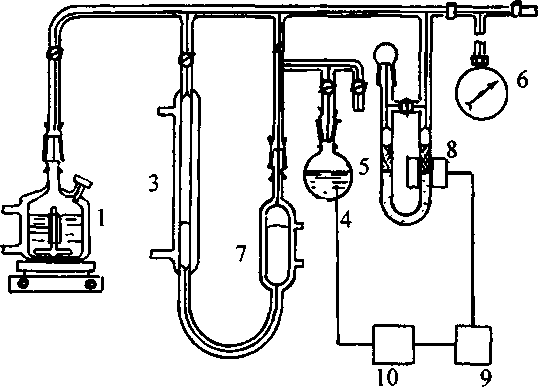
Рисунок 2.1 -Схема газоволюмометричної установки: 1 - реакційна судина, 2- термостат, 3 - газова бюретка, 4 - електролітична ячейка, 5 - регулятор тиску, 6 - манометр, 7 - термостатований об'єм, 8 - фотоелектронний датчик, 9 - підсилювач датчика, 10 - стабілізатор струму.
Сила струму на електролізері складала 0.2 А. Установка дозволяє вимірювати швидкість поглинання кисню - від 10-7-10-8 моль-л-1∙с-1 і більше. Об'єм реакційної суміші дорівнює 5 мл, частота перемішування - 8-100 с-1. Вимірювання проводили в кінетичній області при тиску кисню 1 атм. і температурі 310К.
Тонкошарова хроматографія (ТШХ)
Метод ТШХ полягає в наступному [41]: на один бік невеликої скляної пластинки наносять тонкий шар сорбента. На такий шар на стартову лінію наносять проби речовин та їх сумішей, і кінець пластинки, нище стартової лінії, занурюють в систему розчинників. За мірою просування рідини по пластинці відбувається розподіл суміші речовин. Границю підйому рідини чи лінію фронту позначають, пластинку висушують і проявляють для визначення речовин у вигляді забарвлених плям. Відмічають положення плям, які відповідають досліджуваним речовинам, що знаходяться між лінією старта і лінією фронту рідини. Для цього вимірюють відстань від центра плями до стартової лінії (АБ). Потім визначають відстань від лінії фронту рідини до стартової точки (АВ). Співвідношення відстані від стартової лінії до центра плями (АБ) та відстані від стартової лінії до лінії фронту (АВ) позначається через константу R>f>, яка характеризує положення речовини на хроматограмі. Таким чином, величина R>f> = АБ/АВ характерна для даної сполуки на даному сорбенті і в даній системі.
В якості носія для нерухомої фази використовують силікагель, а в якості системи розчинників – хлороформ-бензол-гексан в співвідношенні 30:6:1. По закінченню пластинку з отриманими результатами проявляють парами аміаку.
2.3. Техніка безпеки
2.3.1. Правила безпечної роботи в хімічних лабораторіях
Загальна організація роботи по техніці безпеки покладена на керівників відділів. Працювати в хімічних лабораторіях дозволяється особам віком не менше 18 років, які пройшли інструктаж з ТБ.
У всіх приміщеннях лабораторії повинна бути встановлена витяжна вентиляція. Всі роботи, пов'язані з виділенням шкідливих парів або газів, повинні проводитись у витяжних шафах. Зберігання різних хімічних речовин у лабораторіях повинно відбуватись із врахуванням їх властивостей. Залишати робоче місце і нагрівальні прибори без нагляду заборонено.
В кожній лабораторній кімнаті на певному місці повинні знаходитись вогнегасник, пісок, ковдра. Всі реактиви в лабораторіях повинні зберігатись в тарі з підписом. В лабораторії повинно знаходитись не менше двох чоловік. Всі роботи в лабораторії повинні проводитись при задовільному стані електрообладнання.
2.3.2 Основні правила безпеки при роботі з їдкими речовинами
Роботу з концентрованими кислотами та лугами без захисного обладнання заборонено. Концентрована кислота повинна зберігатись у товстостінному скляному посуді ємністю не більше 1 л у витяжній шафі. Розлиті кислоти або луги необхідно миттєво засипати піском. Після уборки піска це місце нейтралізують: кислоту - лугом або содою, луг - слабким розчином оцтової кислоти. Не можна набирати концентровані кислоти та луги в пипетки ртом. При використанні хромової суміші необхідно запобігати попаданню суміші на шкіру, одяг та взуття. Заборонено зливати концентровані кислоти та луги в каналізацію, їх слід окремо збирати в посуд і після нейтралізації зливати в зливи для неорганічних речовин.
2.3.3. Основні правила безпечної роботи з електрообладнанням та електроприладами
Заборонено переносити включені прилади та ремонтувати обладнання, що знаходиться під струмом. Заборонено працювати поруч з оголеними частинами обладнання. Заборонено загромаджувати підступи до електричних приладів. У випадку припинення подачі струму всі приклади повинні бути миттєво відключені. Заборонено залишати без нагляду включені прилади. У випадку загорання проводки слід негайно вимкнути електрику та погасити вогонь за допомогою вуглекислотного вогнегасника та ковдри з асбесту.
3. Гальмування залізоініційованого окиснення фосфоліпідів
Для оцінки антиоксидантної активності сполук застосовується велика кількість методів і тестових систем [27,33]. При підборі інгібіторів для збереження продуктів харчування, що містять фосфоліпіди (рослинні олії, жири, риба, м'ясо і т.д.), а також при рішенні медичних проблем, зв'язаних з окисненням ліпідів мембран, кращою моделлю є лецитинова ліпосомна емульсія [33]і в біології в якості тестової широко використовується емульсія яєчного жовтка (ЯЖ) [36,39] – гетерогенна система, що містить мембранні структури кліток (при розведенні у фосфатному буфері фосфоліпіди ЯЖ утворюють міцели подвійного шару - ліпосоми), і яка відповідає за ліпідно-білковим складом ліпопротеїнам низкої густини плазми крові [36]. У порівнянні з гомогенатами тканин вона доступна, стабільна при збереженні і, разом з тим, відрізняється високою окиснюваністю, що дозволяє використовувати звичайні лабораторні методики й апаратуру для визначення рівня ПОЛ. Застосування складного природнього субстрату (ЯЖ) утруднює одержання надійних кінетичних даних, але дає можливість якісно оцінити АОА різних сполук.
Загальноприйнятими методами дослідження ПОЛ у даний час є [42] хемілюмінесцентний (ХЛ) і за виміром продуктів пероксидації, таких як дієнові коньюгати, малоновий діальдегид (МДА), гексаналь, пероксиди. На жаль, усі методи не досконалі, тому що мають ряд недоліків. У той же час газоволюмометричний метод вивчення радикально-ланцюгових процесів окиснення (ГВ), який широко використовується на практиці для інших систем, практично не застосовується при дослідженні ПОЛ, очевидно, через низьку чутливість стандартних газоволюмометричних установок. Заміна ртутного нуль-датчика тиску фотоелектронним або чуттєвим елементом тиску дозволили вивчати окисні процеси, що протікають зі швидкістю 10-6 – 10-8 моль • м-1 • с-1.
Окиснення проводилося в умовах близьких до фізіологічних: ~3,3% дисперсія вимороженого яєчного жовтка у фосфатному буфері (рН=7,4, 0,04М КН>2>РО>4>/К>2>НРО>4>, 0,14М NaCl) t=37ºC, [Fe2+]=5·10–3моль/л.


Вплив
інкубації на окиснення ЖЛП можна
простежити за кінетичними кривими
поглинання кисню (рис.3.1).

O
Рис.3.1 – Вплив умов інкубації яєчного жовтка (1 – без виморожування, 2 – 4 – вимороженого) на процес окиснення його 9 % дисперсії в фосфатному буфері (рН = 7,4; 0,04 М KH>2>PO>4>/K>2>HPO>4>, 0,14 M NaCl) в присутності [Fe2+] = 2,5•10-3 M.
Тривалість інкубації, година: 2 – 4,5; 1,3 – 24; 4 – 48.
Видно, що для забезпечення помітної швидкості процесу необхідно попереднє (не менш доби) виморожування яєчного жовтка для руйнування природної емульсії й інкубація приготовленої з вимороженого жовтка дисперсії у фосфатному буфері протягом 24 годин.
Інкубація сприяє, ймовірно, нагромадженню деякої кількості пероксидів, що забезпечує початкове ініціювання ланцюгового процесу. Ряд дослідників для цих цілей використовують попереднє УФ – опромінення розчинів [43]. З рис.3.1 також видно, що окиснення ЖЛП йде з невеликим періодом індукції, обумовленим, очевидно, дією ендогенних АО жовтка.
Для вибору оптимальних умов окиснення ЖЛП був вивчений вплив на швидкість процесу температури (рис.3.2), концентрацій субстрату [ЯЖ] (рис.3.3) і ініціатора [Fe2+] (рис.3.4).


Рис.3.2 – Температурна залежність швидкості окиснення 9 % дисперсіі ЖЛП при [Fe2+] = 2,5•10-3 M.
При варіюванні температури було встановлено, що вище 400С швидкість окиснення помітно знижується, а при 500С поглинання кисню відсутнє. Це узгоджується з уявленнями [2] про ферментативний шлях залізоініційованого окиснення біологічних систем. Ферменти, що містяться в них, (НАДФН), що відновлюють ініціатор, інактивуються при підвищених температурах, що і призводить до зниження швидкості окиснення. Оптимальна температура, при якій спостерігається максимальна швидкість окиснення - 370С.
К онцентрація
субстрату окиснення (рис.3.3) складно
впливає на швидкість процесу.
онцентрація
субстрату окиснення (рис.3.3) складно
впливає на швидкість процесу.

Рис.3.3 – Кінетичні криві поглинання кисню в процесі залізоініційованого окиснення ЯЖ в залежності від масової частки субстрата окиснення; [Fe2+] = 2,5•10-3 M, [ЯЖ], % мас.: 1 – 3,2; 2 – 4,8; 3 – 16,7; 4 – 25,0.
При вмісті в розчині ЯЖ до 1% по масі поглинання кисню не спостерігається, далі швидкість зростає і досягає максимуму при 3,2%. Подальше підвищення концентрації ЖЛП призводить до зниження окиснюваності дисперсії. Це може бути наслідком як збільшення вмісту в системі ендогенних АО, так і підвищення ролі структурного інгібувания і дифузійних процесів при окисненні. Оптимально робоче співвідношення в системі ЯЖ і буфера 1:30. Дослідження впливу парціального тиску кисню в системі на швидкість окиснення при оптимальному вмісті субстрату показала, що зміна тиску в інтервалі 700 мм рт. ст. – 1 атм., як і зміна інтенсивності перемішування, не впливають на швидкість процесу, що свідчить про протікання його в кінетичній області.
Вплив концентрації ініціатора на окиснення дисперсії представлено на рис.3.4. Двовалентне залізо, як відомо [2], виступає ініціатором процесу, але у великих концентраціях може й інгібувати ПОЛ. Отримані результати (рис.3.4) підтверджують це, а максимальна швидкість окиснення досягається при [Fe2+]=5• 10-3моль/л.

Рис.3.4 – Залежність обєму поглиненого кисню при окисненні ЯЖ (3,2 % за масою) при 370С від концентрації ініціатора, t = 15 хв.
Окиснення емульсії яєчного жовтка в оптимальних умовах дозволило одержати в паралельних дослідах відтворені результати за значеннями швидкостей процесу і періодів індукції. Готування розчину й окиснення проводили наступним чином: попередньо виморожений протягом доби яєчний жовток (зберігається при –80С) розводили буфером у співвідношенні 1:30. Після добової інкубації дисперсії проводили окиснення. У нульовому досвіді в реактор поміщали 4,9 мл дисперсії ЯЖ, додавали 0,1 мл 0,025 М водного розчину FeSO>4>• 7H>2>O; при дослідженні АОА препаратів уводили 0,1 мл розчину інгібітору необхідної концентрації. Концентрація ініціатора в реакційній суміші була постійною 5• 10-3М.
Окиснення фосфоліпідів у даній системі протікає, як доведено в роботі [2], за вільнорадикальним механізмом. Процес має свої особливості, зв'язані насамперед з тим, що окиснення проходить на границі розділу фаз, процес гетерогенний, ініціатор – метал перемінної валентності, дисперсійне середовище – вода. Ефективність інгібітору повинна залежати від його колоїдної локалізації, розподілу між водною і масляною фазами, взаємодії з поверхнево-активними речовинами емульсії й ініціатором [32]. Незважаючи на велику кількість досліджень, присвячених вивченню антиоксидантних властивостей різних речовин у ліпідних субстратах, дотепер не отримано однозначних даних навіть про поведінку в таких системах іонола. В зв'язку з цим було проведене дослідження антиоксидантної активності типових фенольних антиоксидантів у процесі залізоініційованого окиснення емульсії яєчного жовтка. Необхідно відзначити, що ортополіфеноли, що є найбільш ефективними антиоксидантами неможливо досліджувати на даній модельній системі, тому що вони утворюють комплекси з ініціатором окиснення – двовалентним залізом, тим самим, виводячись із системи. Контроль за процесом окиснення емульсії здійснювали за поглинанням кисню. Вплив на окиснення різних фенольних антиоксидантів оцінювався при однакових концентраціях (10–3моль/л). Отримані кінетичні результати приведені на рис.3.5. Видно, що вивчені сполуки в межах помилки вимірів (±5 хв) практично не впливають на величину періоду індукції окиснення модельної емульсії, обумовленого наявністю ендогенних антиоксидантів.
Вплив уведених добавок позначається на швидкості процесу окиснення після виходу з періоду індукції, що пропорційна об’єму поглиненого кисню. Як критерій антиоксидантної дії фенолів обрана величина (V>0>–V)/V>0>, де V>0> – об’єм поглиненого кисню емульсією без добавок фенолу через 20 хв після початку окиснення, V - об’єм кисню, поглиненого емульсією, що окиснюється, з добавками фенолу в той же момент часу.
Очевидно, що чим більше відношення (V>0>–V)/V>0>, тим ефективніше антиоксидант в обраних умовах гальмує процес окиснення.
З
рис.3.5 видно, що феноли в різному ступені
гальмують окиснення фосфоліпідів
яєчного жовтка, що обумовлено будовою
антиоксиданту.
Рис.3.5 – Кінетичні криві поглинання кисню при залізоініційованому окисненні ЯЖ в присутності [InH] = 1•10-3 M:
[InH] = 0
ферулової кислоти
емоксипіна
7-гідрокси – 4-метилкумарина
фенікаберана
арбідола
іонола
Зі збільшенням концентрації уведеного фенолу ступінь гальмування окисного процесу в емульсії яєчного жовтка зростає. Причому вплив концентрації фенолів різний для слабких і сильних антиоксидантів. Так для емоксипіна, що є слабким антиоксидантом (рис.3.6), зниження швидкості окиснення фосфоліпідів спостерігається тільки при досить високих концентраціях (10-3– 10-4 моль/л) і плавно змінюється з ростом концентрації. У той же час іонол (рис.3.7) гальмує процес вже при концентрації в системі 10-5–10-6 моль/л, а подальше збільшення концентрації суттєво не змінює швидкості процесу. Таке розходження в поведінці різних фенольних антиоксидантів виявляється в концентраційній залежності параметра, що характеризує ефективність фенолу у вивченій системі. Для слабких антиоксидантів (рис. 3.8) залежність (V>0>–V)/V>0> від концентрації фенолів лінійна, а для сильних (рис.3.9) має верхню границю.
Побудова концентраційних залежностей для усіх вивчених фенолів дало можливість визначити концентрацію антиоксиданту, що викликає в однакових умовах 50%–ве зниження об’єму поглиненого кисню (С>50%>). В медичних дослідженнях аналогічний показник використовується для порівняння антиоксидантної активності різних лікарських препаратів за їхньою здатністю знижувати на 50% хемілюмінесценцію або вихід продуктів окиснення ліпідів.
Для трьох вивчених антиоксидантів (арбідол, іонол та емоксипін) значення С>50%>, визначені в даному дослідженні газоволюмометричним методом і літературні дані [6,8,9,37,43], отримані хемілюмінесцентним методом, приведені в табл.3.1. Як видно з таблиці отримані результати збігаються в межах погрішності застосовуваних методів. Цей факт свідчить на користь можливості використання запропонованої газоволюмометричної методики окиснення фосфоліпідів яєчного жовтка для тестування сполук на антиоксидантну активність.

Рис.3.6 – Окиснення дисперсії ЯЖ в присутності емоксипіна, [InH]: 1 – 0; 2 – 6,5•10-4M; 3 – 1,3•10-3M; 4 – 2 ,6•10-3M.

Рис.3.7 – Окиснення дисперсії ЯЖ в присутності іонола, [InH]: 1 – 0; 2 – 3,0·10-6М; 3 – 4,0·10-6М; 4 – 1,0·10-4М; 5 – 1,0·10-3М.

Рис.3.8 – Вплив концентрації антиоксидантів на відносне зниження обєму поглиненого кисню при окиснені ЖЛП в присутності: 1 - іонола, 2 - арбідола.

Рис.3.9 - Вплив концентрації антиоксидантів на відносне зниження обєму поглиненого кисню при окиснені ЖЛП в присутності: 3 – фенікаберана, 4 - 7-гідрокси – 4-метилкумарина, 5 – емоксипіна, 6 - ферулової кислоти
Таблиця 3.1
Значення С>50%>, визначені газоволюмометричним методом (ГВ) і методом хемілюмінесценції (ХЛ) при пероксидному окисненні ліпідів
-
№
Фенол
С>50%>, моль/л
Метод
1
Іонол
3,510-6
3,010-6
8,510-6
ГВ
ХЛ, ЯЖ
ХЛ,Л+I
2
Емоксипін
1,5·10-3
0,9·10-3
1,0·10-3
ГВ
ХЛ
ХЛ
3
Арбідол
1,110-5
0,910-5
0,510-5
ГВ
ХЛ
ХЛ
Концентрація фенолу, що викликає 50%–ве зниження об’єму поглиненого кисню при окисненні лецитинової емульсії, є характеристикою фенолу як антиоксиданту. Чим менше величина С>50%>, тим ефективніше фенол гальмує процес окиснення. В табл.3.2 приведені значення цих концентрацій для всіх вивчених фенолів. В таблиці 3.2 феноли розташовані в порядку зменшення величини С>50%>. Це дозволяє зробити ряд висновків щодо взаємозв'язку антиоксидантної активності фенолу в досліджуваній системі з будовою антиоксиданту:
Збільшення загального числа алкільних замісників в орто– і пара-положеннях до гідроксильної групи зменшує міцність О-Н зв'язку і підвищує ефективність сполуки як антиоксиданту. Цей висновок погодиться з класичним механізмом антиоксидантної дії фенолів, зв'язаним з обривом ланцюгів окиснення при гомолітичному розриві О-Н зв'язку.
Таблиця 3.2
Антиоксидантні властивості фенолів при залізоініційованому окисненні дисперсії ЖЛП. ЯЖ=3,2 % мас.; t=37С; Fe2+=510-3М
|
№ |
Інгібітор |
Назва |
С>50%>, моль/л |
|
1 |
|
ферулова кислота |
2,7·10-3 |
|
2 |
|
3,4–диметилфенол |
2,010-3* |
|
3 |
|
2,3–диметилфенол |
2,010-3* |
|
4 |
|
емоксипін |
1,610-4 |
|
5 |
|
1,3–діоксибензол |
9,010-4 |
|
6 |
|
1,4–діоксибензол |
5,010-4 |
|
7 |
|
4-метил–7–гідроксикумарин |
8,510-4 |
|
8 |
|
4-(2-оксистиріл)-N-бензил-піридин |
6,010-4 |
|
9 |
|
2–метил–6–гідрокси бензоксазол |
4,510-4 |
|
10 |
|
4–гідроксиізохінолін |
4,010-4 |
|
11 |
|
2-гідрокси-3-пропеніл-бензиліденроданін |
7,5·10-5 |
|
12 |
|
4-(3,5-ди-т.-бутил-4-оксистиріл)-піридин |
5,0·10-5 |
|
13 |
|
арбідол (основа) |
4,5·10-5 |
|
14 |
|
арбідол |
1,1·10-5 |
|
15 |
|
іонол |
3,5·10-6 |
|
16 |
|
фенозан-28 |
3,3·10-6 |
|
17 |
|
2,6-диметилфенол |
2,5·10-6 |
|
18 |
|
ірганокс-1076 |
2,5·10-6 |
|
19 |
|
фенол-85 |
0,7·10-6 |
|
* - С>30%> |
2. Найбільш ефективні феноли з орто-алкільними замісниками, причому збільшення об’єму таких замісників неоднозначно позначається на активності антиоксиданту. Обумовлено це з однієї сторони стеричними перешкодами в реакції з пероксирадикалами субстрату, що окислюється, а з іншого боку – активністю феноксильного радикала, що утворюється. Проте, в цілому, просторово-екрановані феноли більш ефективні антиоксиданти пероксидного окиснення ліпідів.
3. Введення в молекулу фенолу будь-яких електронноакцепторних замісників знижує антиокисну активність сполуки.
Аналіз отриманих даних показав, що антиоксидантна активність фенолів при окисненні ліпідів, як і в процесі гомогенного радикально-ланцюгового окиснення вуглеводнів, залежить від різних факторів, у першу чергу, від міцності ОН-зв'язку реакційного центра й активності феноксильного радикала, що залежить від можливості делокалізації електрона в подвійних зв'язках [9] і наявності об'ємних замісників в орто-положенні до гідроксогрупи.
В процесі пероксидації ліпідів ці фактори дуже важливі, але в гетерогенній системі суттєвий вплив на ефективність антиоксидантів робить, крім того, гідрофобність фенолів, що визначає їхній розподіл у системі і вміст у масляній фазі, а також адсорбція АО на її поверхні [2, 35]. Ці фактори сприяють збільшенню локальної концентрації АО в поверхневому шарі, а, отже, підсилюється інгібування ПОЛ.
Відомо, що основними складовими частинами ліпосомного подвійного шару є фосфатидилхолін (ФХ) і фосфатидилетаноламін (ФЕА). Структура подвійного шару така, що гідрофільні головні групи фосфоліпідів орієнтуються на поверхні ліпосом, а гідрофобні частини – асоційовані усередині [15]. В приведеній формулі ФХ
R
– залишок ненасиченої вищої жирної
кислоти (НЖК), що і піддається в першу
чергу окисненню. Тобто, чим вище
ліпофільність антиоксиданту, тим легше
він вбудовується в подвійний шар і,
знаходячись ближче до місця окиснення
НЖК, буде ефективніше перехоплювати
радикали, запобігаючи розвиток ланцюгового
процесу.
Високу антиоксидантну активність іонола при пероксидному окисненні ліпідів пояснюють його здатністю утворювати комплекси з НЖК [45], тобто він володіє підвищеною ліпофільністю. Незважаючи на те, що в етилбензолі значення k>7> і, наприклад, 2-метил-6-гідроксибензгексазола (спол. 9, табл. 3.2) дуже близькі, величина С>50%> у бензола на ~ 2 порядки більше, ймовірно, через низьку спорідненість до ліпідів.
Вплив ліпофільності антиоксиданту на його ефективність можна побачити у випадку фенола–85 і ірганокса 1076 (спол. 18,19, табл. 3.2). у складі молекули фенола–85 утримується два іонольних фрагменти, з'єднаних містком з гідрованих кілець піридину і -СН>2>-груп, однак, судячи з С>50%>, він у ~ 5 разів ефективніше іонола, а в молекулі іргонокса 1076 наявність довгого вуглеводневого радикала, що містить складноефірну групу, полегшує вбудовування в подвійний шар і призводить до збільшення його ефективності. Як відомо, в класичній кінетиці [28], замісники третинні аміногрупи, володіючи донорними властивостями, підсилюють антиоксидантну активність фенолів. На нашій моделі суттєва присутність аміногрупи в формі четвертинної солі, тоді як в етилбензолі солі не інгібують окисний процес. Позначається, видимо, краща сумісність солей із зарядженою полярною поверхнею фосфоліпідного подвійного шара.
Ліпофільність фенольних антиоксидантів досліджувалася методом тонкошарової хроматографії. Коефіцієнт утримування R>f> є характеристикою гідрофобності речовини. Це повязано з тим, що в системі рухливою фазою є суміш органічних розчинників: хлороформ – бензол – гексан, а нерухливою фазою є гідрофільний силікагель. Інгібітор в гетерогенній системі розподіляється між водною та масляною фазами. Чим більша величина R>f>> >, тим більша ліпофільність фенолу. Отримані дані приведені в таблиці 3.3.
Як видно, збільшення АОА фенолів корелює з коефіцієнтом утримування. Таким чином, стає зрозумілим, що активність антиоксидантів у фосфоліпідних емульсіях деякою мірою залежить від ліпофільності сполуки. Будучи жиророзчинним, антиоксидант одночасно повинний володіти і частковою спорідненістю до водної фази, що забезпечує перебування його на границі розділу фаз, і тим самим, дає максимально ефективну дію.
Таблиця 3.3 – Співвідношення між коефіцієнтом утримування та антиоксидантною активністю інгібіторів.
|
№ |
Інгібітор |
С>50% >, моль/л |
R>f> |
|
1 |
ферулова кислота |
2,7·10-3 |
0,004 |
|
2 |
3,4-диметилфенол |
2,0·10-3 |
0,41 |
|
3 |
2,3-диметилфенол |
2,0·10-3 |
0,48 |
|
4 |
фенозан-28 |
3,3·10-6 |
0,51 |
|
5 |
іонол |
3,5·10-6 |
0,87 |
|
6 |
2,6-диметилфенол |
2,5·10-6 |
0,62 |
Висновки
Підтверджена можливість використання запропонованої газоволюмометричної методики окиснення фосфоліпідів яєчного жовтка для тестування сполук на антиоксидантну активність. Отримані значення С>50%> збігаються з літературними даними для ряду препаратів, визначеними хемілюмінесцентним методом.
Вивчені фенольні сполуки дають інгібуючу дію на процес окиснення модельної емульсії. Ефективність антиоксидантів залежить від будови молекул.
Збільшення загального числа електроннодонорних замісників в орто– і пара-положеннях до гідроксильної групи підвищує, а електроакцепторних - знижує АОА сполук. Найбільш ефективні феноли з двома орто–алкільними замісниками, у тому числі просторово екрановані.
Проведені дослідження, спрямовані на вивчення ліпофільності сполук, зв'язаної з їхньою хімічною спорідненістю до фосфоліпідів, і міжфазний розподіл антиоксидантів.
Література
Барабой В.А., Сутковой Д.А. Окислительно-антиоксидантный гомеостаз в норме и патологии. – К.: Чернобыльинтеринформ, 1997. – Т.1. – 204с.
Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в биологических мембранах. – М.: Наука, 1972. – 252с.
Герчиков А.Я. Влияние некоторых средств, используемых в анестезиологии, на перекисное окисление липидов плазмы крови / А.Я.Герчиков, Г.Г.Гарифуллина, Л.Н.Ахметшина // Хим. – фарм. журнал. – 2000. – Т.34, №12. – С.34
Опейда И.А. Кинетика поглощения кислорода и хемилюминесценции при окислении липидов в присутствии ионов железа (2+) / И.А.Опейда, А.Н.Шендрик, И.О.Качурин, А.Н.Николаевский // Кинетика и катализ. – 1994. – Т.35, №1. – С.38-44.
Золотов Н.Н. Определение антирадикальной активности химических соединений методом хемилюминесценции / Н.Н.Золотов, К.Ю.Залилов, В.Э.Мухтаров, С.Б.Гашев // Хим. – фарм. журнал. – 1990. – Т.24, №1. – С.15.
Krasowska A. The antioxidant activity of BHT and new phenolic compounds PYA and PPA measured by chemiluminescence / A.Krasowska, D.Rosiak, K.Szkapiak, M.Oswiecimska // Cell. & Mol. Biol. letter. - –001. – V.6. – PP.71-81.
Yu W. Antioxidant effect of coumarin derivatives on free radical initiated and photosensitizes peroxidation of linolenic acid in micelles / W.Yu, Z.-Q.Liu, Z.-L.Liu // J. Chem. Soc., Perkin Trans 2. – 1999. – PP.969-974.
Губский Ю.И. Антирадикальные и антиокислительные свойства нестероидных противовоспалительных средств – производных пиридинкарбоновых кислот / Ю.И.Губский, А.Г.Горюшко, И.Е.Вистунова, Т.Н.Курапова // Укр. биохим. журнал. – 1999. – Т.71, №5. – С.85-89.
Васильева О.В. Антиоксидантные свойства арбидола и его структурных аналогов / О.В.Васильева, О.Б.Любицкий, Т.А.Гуськова, Р.Г.Глушков // Вопр. мед. химии. – 1999. – Т.45, №4. – С.326-331.
Селищева А.А., Козлов Ю.П. Метаболизм фосфолипидов и биологические мембраны. – Иркутск: Изд-во Иркут. ун-та, 1988. – 88с.
Рогов И.А., Антипова Л.В., Сунченко Н.И., Жеребцов Н.А. Химия пищи. – М.: Колос, 2000. – 426с.
Овчинников Ю.А. Биоорганическая химия. – М.: Просвещение, 1987. – 815с.
Ивков В.Г., Берестовский Г.Н. Динамическая структура липидного бислоя. – М.: Наука, 1981. – 296с.
Бадер Х. Полимерные монослои и липосомы – модели биологических мембран / Х. Бадер, К.Дорн, Б.Хупфер, Х.Рингсдорф // Успехи химии. – 1987. – Т.56, №12. – С.2028-2074.
Бергельсон Л.Д. Биологические мембраны. – М.: Наука, 1975. – 183.
Ивков В.Г., Берестовский Г.Н. Липидный бислой биологических мембран. – М.: Наука, 1982. – 224с.
Бурлакова Е.Б. Перекисное окисление липидов мембран и природные антиоксиданты / Е.Б. Бурлакова, Н.Г.Храпова // Успехи химии. – 1985. – Т.54, №9. – С.1540-1558.
Березов Т.Т., Коровкин Б.Ф. Биологическая химия. – М.: Медицина, 1983. – 752с.
Громовая В.Ф. Некоторые особенности действия аскорбиновой кислоты на окислительно-восстановительные реакции с участием кислорода / В.Ф.Громовая, Г.С.Шаповал, И.Е.Миронюк, В.И.Пивень // Хим. – фарм. журнал. – 1996. – Т.30, №7. – С.3-5.
Владимиров Ю.А. Реакции цепного окисления липидов в мембранных структурах клетки / Ю.А. Владимиров, Т.Б.Суслова // В кн. Сверхслабые свечения в биологии. – М.: Наука, 1972. – 272с.
Владимиров Ю.А. Свободнорадикальное окисление липидов и физические свойства липидного слоя биологических мембран // Биофизика. – 1987. – Т.32, №5. – С.830-844.
Козлов Ю.П. Свободнорадикальное окисление липидов в биомембранах в норме и при патологии //В кн. Биоантиокислители. – М.: Наука, 1975. – 268с.
Владимиров Ю.А. Свободные радикалы и антиоксиданты // Вестник РАМН. – 1998. - №7. – С.43-51.
Бурлакова Е.Б. Биоантиоксиданты и синтетические ингибиторы радикальных процессов // Успехи химии. – 1975. – Т.44, №10. – С.1871-1886.
Барабой В.А. Корекція променевих уражень, спричинених низькоінтенсивним опроміненням, за допомогою антиоксидантів / В.А.Барабой, Н.О.Горчакова, С.А.Олійник, Ю.В.Хмєлєвський // Укр. біохім. журнал. – 1994. – Т.66, №6. – С.3-22.
Бурлакова Е.Б. Кинетические особенности токоферолов как антиоксидантов / Е.Б.Бурлакова, С.А.Крашаков, Н.Г.Храпова // Хим. физика. – 1995. – Т.14, №10. – С.151-182.
Каган В.Е. Проблема анализа эндогенных продуктов перекисного окисления липидов / В.Е.Каган, О.Н.Орлов, Л.Л.Прилипко //В кн.: Итоги науки и техники. Биофизика. – М.: ВИНИТИ. – 1986. – Т.18. – 136с.
Азатян В.В., Денисов Е.Т. Ингибирование цепных реакций. – М.: Черноголовка, 1997. – 267с.
Осипов А.Н. Изучение кинетики гибели перекисных радикалов в липидах / А.Н.Осипов, А.П.Моравский, В.Ф.Шувалов, О.А.Азизова // Биофизика. – 1980. – Т.25, №2. – С.234.
Денисов Е.Т. Элементарные реакции ингибиторов окисления // Успехи химии. – 1973. – Т.42, №3. – С.361-390.
Schwarz K. Partition behavior of antioxidative compounds in heterophasic systems / K.Schwarz, E.N.Frankel, J.B.German // Fett/Lipid. – 1996. – V.98, №3. – РР.115-121.
Frankel E.N. Interfacial phenomena in the evaluation of antioxidants: bulk oils as emulsions / E.N.Frankel, Shu-Wen Huang. J.Kanner, J.Bruce German // J. Agric. Food Chem. – 1994. - V.42. – PP.1054-1059.
E.N.Frankel. Food antioxidants and phytochemicals: present and future perspectives // Fett/Lipid. – 1999. – V.101, №12. – Р.450-455.
Rice-Evance C.A. / Structure – Antioxidant activity relationships of flawonoids and phenolic acids / C.A. Rice-Evance, N.G.Miller, G.Palanga // Free Radical Biology & Medicine. – 1996. – V.20, №7. – РР.933-956.
von Gadow A. Effect of extraction and additional heating on the antioxidant activity of rooibos tea extracts / A. von Gadow, E.Joubert, C.F.Hansmann // J. Agric. Food Chem. – 1997. – V.45. – PP.1370-1374.
Клебанов Г.И. Оценки Антиокислительной активности плазмы крови с применением желточных липопротеидов / Г.И.Клебанов, И.В. Бабенкова, Ю.О.Теселкин и др. // Лабораторное дело, 1988. - №5. – С.59-69.
Владимиров Ю.А., Шерстнев Н.П., Азимбаев Т.К. Оценки антиокислительной и антирадикальной активности веществ и биологических объектов с помощью железоинициированной хемилюминесценции // Биофизика, 1992. – Т.37, вып.6. – С.1041-1047.
Клебанов Г.И., Теселкин Ю.О., Владимиров Ю.А. Ингибирование антиокислительной активности Плазмы крови азидом натрия // Биофизика, 1988. – Т.33, вып.3. – С.512-516.
Шаров В.С., Суслова Т.Б., Деев А.И., Владимиров Ю.А. // Активация хемилюминесценции при перекисном окислении липидов комплексом европий-тетрациклин // Биофизика, 1980. – Т.25, №5. – С.923-928.
Кандалинцева Н.В., Дюбченко О.И., Терах Е.И., Просенко А.Е., Шварц Я.Ш., Душкин М.И. Антиокислительная и гепатопротекторная активность водорастворимых 4-пропилфенолов, содержащих гидрофильные группы в алкильной цепи // Химико-фармацевтический журнал, 2002. – Т.36, №4. – С.13-15.
Ахрем А.А., Кузнецова А.И. Тонкослойная хроматография. – М.: Наука, 1965. – 123с.
Antolovich M. Methods for testing antioxidant activity / M.Antolovich, P.D.Prenzler, E.Pat-Salides, S.McDonald, K.Robards // Analyst. – 2002. - №127. – РР.183-198.
Ли Хо Ик. Сравнительное изучение действия карнозина и других антиоксидантов на хемилюминесценцию суспензии однослойных липосом в присутствии ионов железа / Ли Хо Ик, Ю.А.Владимиров, А.И.Деев // Биофизика. – 1990. – Т.35, №1. – С.82-85.
Mili B.L.J. Antioxidative activity of phenolic compounds on the metal-ion breakdown of lipid peroxidation system / B.L.J.Mili, S.M.Djilas, I.M.Brunet //Food Chem. – 1998. – V.62. – PP.443-447.
Зарудий Ф.С. 2,6-ди-трет. - бутил-4-метилфенол (дибунол, ионол, тонарол) классический антиоксидант (обзор) / Ф.С.Зарудий, Г.З.Гильмутдинов, Р.Ф.Зарудий, М.А.Мышкин // Хим. – фарм. журнал. – 2001. – Т.35, №3. – С.42-48.
Summary
This work deals with the investigation of application possibility of gasometric method which is widely used on other systems for lipoproteins of egg yolk (EY, biomembranes model of peroxide oxidation of lipids) oxidation kinetics studying and for sub>stances antioxidant activity (AOA) testing. The oxidation process was initiated by two-valent iron salt.
To obtain reproductive results the optimal conditions of oxidation (t =370C, [Fe2+] = 5•10-3 M, W(EY) = 3,2 % mass, the phosphate buffer solution ) has been chosen. It enable us to obtain results, adequately characterized AOA of sub>stances. As a parameter of sub>stances AOA was used C>50%> (sub>stance concentration twice decreasing the volume of absorbed oxygen in comparison with experiment without inhibitor). The received data analysis shows that studied phenols AOA depends on reaction center OH-bond strength, phenolic radical activity, phenols hydrophobia, that determine there partition in heterogeneous system and also on interface AO adsorption. The last promotes the increasing of AO local concentration in oxidizing dispersion surface layer and results in AO inhibition effect intensification.
Резюме
Данная работа посвящена исследованию возможности применения газоволюмометрического метода, широко применяемого на других системах, для изучения кинетики окисления липопротеинов яичного желтка (ЯЖ, модель ПОЛ биомембран), инициированного солями двухвалентного железа, и для оценки антиоксидантной активности (АОА) веществ.
Для получения воспроизводимых данных выбирались оптимальные условия окисления (t =370C, концентрация инициатора [Fe2+] = 5•10-3 M и субстрата окисления W(ЯЖ) = 3,2 % по массе, раствор в фосфатном буфере). Это позволило получать результаты, адекватно характеризующие АОА препаратов. В качестве параметра АОА соединений использован параметр С>50%> (концентрация соединения, в два раза снижающая объем поглощенного кислорода по сравнению с опытом без ингибитора). Анализ полученных данных показал, что АОА изученных фенолов зависит от прочности ОН-связи реакционного центра, активности феноксильного радикала, гидрофобности фенолов, определяющей их распределение в гетерогенной системе, а также от адсорбции АО на границе раздела фаз. Последнее способствует увеличению локальной концентрации антиоксиданта в поверхностном слое окисляющейся дисперсии и приводит к усилению ингибирующего действия АО.




















