Алкилирование фенола олефинами
Федеральное агентство по образованию.
Государственное образовательное учреждение высшего профессионального образования.
Самарский государственный технический университет.
Кафедра: «Технология органического и нефтехимического синтеза»
Курсовой проект по дисциплине:
«Теория химических процессов органического синтеза»
Алкилирование фенола олефинами
Руководитель: доцент, к. х. н. Нестерова Т.Н.
Самара
2006 г.
1. Термодинамический анализ
При анализе процесса алкилирования фенола олефинами необходимо, прежде всего, определить какие вещества будут образовываться. В молекуле фенола существует два реакционных центра: ароматическое кольцо и гидроксильная группа. При взаимодействии алкена с ОН- группой образуются простые эфиры, которые легко могут перегруппировываться в алкилфенолы. Установлено, что алкилфенолы преимущественно образуются путем прямого алкилирования в ядро. Рассмотрим влияние гидроксильной группы в молекуле фенола на ароматическое кольцо. Заместитель характеризуется большим положительным эффектом сопряжения по сравнению с отрицательным индуктивным эффектом. Он сильно активирует орто- и пара- положения, поэтому 3-алкилфенолы будут находиться в продуктах в очень малых количествах. Процесс может пойти и дальше с образованием моно-, ди- и триалкилфенолов. Т.к. нас интересуют моно- замещенные фенолы то необходимо проводить процесс при небольшом избытке фенола.
Процесс идет через образование
из алкена промежуточного карбкатиона,
который является легко изомеризующейся
и активной частицей. Возможно следующее:
позиционная и структурная изомеризация,
реакция крекинга, взаимодействие с
ненасыщенными углеводородами,
олигомеризация. Реакция изомеризации
как правило опережает все прочие
превращения, поэтому при алкилировании
 -
олефинами получаем всевозможные изомеры.
В условиях относительно нежестких
протекают реакции только позиционной
изомеризации.
-
олефинами получаем всевозможные изомеры.
В условиях относительно нежестких
протекают реакции только позиционной
изомеризации.
Учитывая выше сказанное, отберем вещества, которые вероятнее всего будут находиться в равновесной смеси:
(a)- 2-(2-гидроксифенил)тетрадекан; (b)- 3-(2-гидроксифенил)тетрадекан;
(c)- 4-(2-гидроксифенил)тетрадекан; (d)- 5-(2-гидроксифенил)тетрадекан;
(i)- 6-(2-гидроксифенил)тетрадекан; (f)- 7-(2-гидроксифенил)тетрадекан;
(g)- 2-(4-гидроксифенил)тетрадекан; (h)- 3-(4-гидроксифенил)тетрадекан;
(m)- 4-(4-гидроксифенил)тетрадекан; (n)- 5-(4-гидроксифенил)тетрадекан;
(o)- 6-(4-гидроксифенил)тетрадекан; (p)- 7-(4-гидроксифенил)тетрадекан.
Выберем (n-1) независимых реакций, где n-количество образовавшихся компонентов:
a b;
b
b;
b c;
c
c;
c d;
d
d;
d i;
i
i;
i f;
a
f;
a g;
g
g;
g h;
h
h;
h m;
m;
m n;
n
n;
n o;
o
o;
o p;
p;
Запишем константы скоростей реакции:
Kx>a>= ;
Kx>b>=
;
Kx>b>= ;
Kx>c>=
;
Kx>c>= ;
Kx>d>=
;
Kx>d>= ;
Kx>i>=
;
Kx>i>= ;
Kx>g>=
;
Kx>g>= ;
Kx>h>=
;
Kx>h>= ;
;
Kx>m>= ;
Kx>n>=
;
Kx>n>=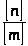 ;
Kx>o>=
;
Kx>o>= ;
Kx>p>=
;
Kx>p>= .
.
Выразим концентрацию каждого компонента через константы реакций и концентрацию компонента g:
 =
= ;
;
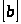 =
= ;
;
 =
=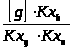 ;
;
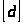 =
= ;
;
 =
=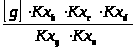 ;
;
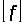 =
= ;
;
 =
= ;
;
 =
= ;
;
 =
= ;
;
 =
=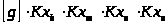 ;
;
 =
=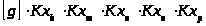
Для систем подчиняющихся закону
Рауля можно записать для
 :
:
 =
= =
=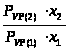 =
=

 =
=
В свою очередь:
 =
= -
-


 =
=
В термодинамическом анализе для расчета констант реакций необходимы точные данные энтальпии, энтропии, а если процесс идет в жидкой фазе, то критические параметры для расчета давления насыщенного пара, желательно, если это будут экспериментальные данные.
Энтальпии и энтропии. Метод
Бенсона не даст в нашем случае точные
значения. Для примера рассмотрим
2-(4-гидроксифенил)тетрадекан и
3-(4-гидроксифенил)тетрадекан. У этих
веществ будут одинаковые вклады:
Cb-(O)-1;
Cb-(H)-4;
Cb-(C)-1;
O-(H,Cb)-1;
CH-(2C,Cb)-1;
CH>2>-(2C)-11;
CH>3>-(C)-2.
Поэтому
 =0
и
=0
и
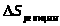 =0.
Исключение составит реакция (a)
=0.
Исключение составит реакция (a) (g).
(g).
 =-9,9
кДж/моль за счет орто- взаимодействия
в молекуле (a);
=-9,9
кДж/моль за счет орто- взаимодействия
в молекуле (a);
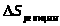 =-Rln2
кДж/(моль·K)
за счет вращения ароматического ядра
в молекуле (g).
=-Rln2
кДж/(моль·K)
за счет вращения ароматического ядра
в молекуле (g).
Давления насыщенного пара.
Используя метод Лидерсена или Джобака
можно рассчитать критические параметры,
а потом и
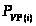 .
Но вклады для всех веществ одинаковы,
поэтому критические параметры равны,
следовательно,
.
Но вклады для всех веществ одинаковы,
поэтому критические параметры равны,
следовательно,
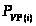 равны, их можно не учитывать,
равны, их можно не учитывать,

 =
= .
Давление не оказывает влияние на реакцию.
Применение разбавителя скажется
отрицательно на скорости реакции.
.
Давление не оказывает влияние на реакцию.
Применение разбавителя скажется
отрицательно на скорости реакции.
Зависимость константы скорости реакции от температуры.
|
Kx>a> |
Kx>b> |
Kx>c> |
Kx>d> |
Kx>i> |
Kx>g> |
Kx>h> |
Kx>m> |
Kx>n> |
Kx>o> |
|
|
298 |
1 |
1 |
1 |
1 |
1 |
27,23829 |
1 |
1 |
1 |
1 |
|
350 |
1 |
1 |
1 |
1 |
1 |
15,03934 |
1 |
1 |
1 |
1 |
|
400 |
1 |
1 |
1 |
1 |
1 |
9,827575 |
1 |
1 |
1 |
1 |
|
450 |
1 |
1 |
1 |
1 |
1 |
7,058733 |
1 |
1 |
1 |
1 |
|
500 |
1 |
1 |
1 |
1 |
1 |
5,416903 |
1 |
1 |
1 |
1 |
|
600 |
1 |
1 |
1 |
1 |
1 |
3,641561 |
1 |
1 |
1 |
1 |
|
700 |
1 |
1 |
1 |
1 |
1 |
2,742201 |
1 |
1 |
1 |
1 |
|
800 |
1 |
1 |
1 |
1 |
1 |
2,216706 |
1 |
1 |
1 |
1 |
|
900 |
1 |
1 |
1 |
1 |
1 |
1,878661 |
1 |
1 |
1 |
1 |
|
1000 |
1 |
1 |
1 |
1 |
1 |
1,645737 |
1 |
1 |
1 |
1 |
Сумма мольных долей всех компонентов равна 0,95, т.к. реакцию проводим в избытке фенола.
Зависимость мольной доли компонентов от температуры.
|
Т, К |
N |
a |
b |
c |
d |
i |
f |
g |
h |
m |
n |
o |
p |
|
298 |
0,95 |
0,0056 |
0,0056 |
0,0056 |
0,0056 |
0,0056 |
0,0056 |
0,1527 |
0,1527 |
0,1527 |
0,1527 |
0,1527 |
0,1527 |
|
350 |
0,95 |
0,0099 |
0,0099 |
0,0099 |
0,0099 |
0,0099 |
0,0099 |
0,1485 |
0,1485 |
0,1485 |
0,1485 |
0,1485 |
0,1485 |
|
400 |
0,95 |
0,0146 |
0,0146 |
0,0146 |
0,0146 |
0,0146 |
0,0146 |
0,1437 |
0,1437 |
0,1437 |
0,1437 |
0,1437 |
0,1437 |
|
450 |
0,95 |
0,0196 |
0,0196 |
0,0196 |
0,0196 |
0,0196 |
0,0196 |
0,1387 |
0,1387 |
0,1387 |
0,1387 |
0,1387 |
0,1387 |
|
500 |
0,95 |
0,0247 |
0,0247 |
0,0247 |
0,0247 |
0,0247 |
0,0247 |
0,1337 |
0,1337 |
0,1337 |
0,1337 |
0,1337 |
0,1337 |
|
600 |
0,95 |
0,0341 |
0,0341 |
0,0341 |
0,0341 |
0,0341 |
0,0341 |
0,1242 |
0,1242 |
0,1242 |
0,1242 |
0,1242 |
0,1242 |
|
700 |
0,95 |
0,0423 |
0,0423 |
0,0423 |
0,0423 |
0,0423 |
0,0423 |
0,1160 |
0,1160 |
0,1160 |
0,1160 |
0,1160 |
0,1160 |
|
800 |
0,96 |
0,0497 |
0,0497 |
0,0497 |
0,0497 |
0,0497 |
0,0497 |
0,1103 |
0,1103 |
0,1103 |
0,1103 |
0,1103 |
0,1103 |
|
900 |
0,95 |
0,0550 |
0,0550 |
0,0550 |
0,0550 |
0,0550 |
0,0550 |
0,1033 |
0,1033 |
0,1033 |
0,1033 |
0,1033 |
0,1033 |
|
1000 |
0,95 |
0,0598 |
0,0598 |
0,0598 |
0,0598 |
0,0598 |
0,0598 |
0,0985 |
0,0985 |
0,0985 |
0,0985 |
0,0985 |
0,0985 |
Строим график зависимости «мольная доля – температура» для двух веществ (g) и (a), т.к. параалкилфенолы сольются в одну линию, тоже самое произойдет и с ортоалкилфенолами.
Из графика видно, что при увеличении температуры мольная доля параалкилфенолов уменьшается. Поэтому процесс следует вести при невысоких температурах.
Как правило, параалкилфенолы используется как промежуточный продукт для синтеза неионогенных поверхностно-активных веществ путем их оксиэтилирования:
Чтобы получить продукты с лучшей биохимической разлагаемостью необходим алкил с менее разветвленной цепью.
2. Адиабатический перепад температур в реакторе
(есть ошибка в расчетах энтальпии алкилфенола, реакция экзотермическая)
Рассчитаем тепловой эффект реакции и температуру смеси в конце реакции в адиабатическом реакторе. Предположим, что при алкилировании фенола тетрадеценом-1 образуется 7-(4’-гидроксифенил)тетрадекан.
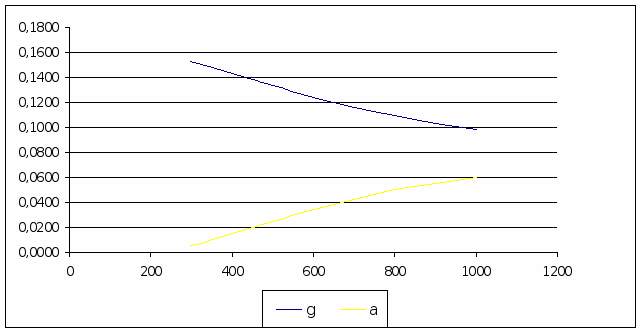
Количества тепла входящее в реактор складывается из тепла вносимого с фенолом и олефином. Расход фенола 1,1 моль/час, расход олефина 1 моль/час.
Q>вх>
=

 =
=
=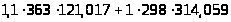 =
141911,6 (Дж/час)
=
141911,6 (Дж/час)
Необходимо найти температуру выходящей смеси из реактора, для этого нужно знать температуру входящей смеси. После смешения фенола и олефина их средняя температура будет равна T>вх,ср> . Таким образом Q>вх> равно:
Q>вх>
=
Используя программу Microsoft Excel и функцию «подбор параметров», а так же определенные ранее зависимости теплоемкости от температуры и количество тепла входящего в реактор найдем T>вх,ср. >
T>вх,ср>
= 315,13 К, при этом
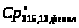 =
110,45 (Дж/моль),
=
110,45 (Дж/моль),
 =
328,84(Дж/моль).
=
328,84(Дж/моль).
Энтальпия реакции из следствия закона Гесса равна:
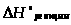 =
=
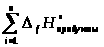 -
-
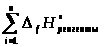 =
=
=
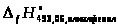 - (
- ( +
+
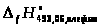 )
)
 =
-229297 + (98386,5 + 227532) = 96621,5 (Дж/моль)
=
-229297 + (98386,5 + 227532) = 96621,5 (Дж/моль)
Реакция эндотермическая, протекает с уменьшением количества тепла во всей системе.
Предположим что степень конверсии олефина 100%.
Количество тепла, выходящее со смесью из предконтактной зоны равно:
Q>вых> = Q>вх> - Q>реакции>
Q>вых> = 141911,6 - 96621,5 = 45290,1 (Дж/час)
Так же количества тепла выходящее со смесью можно рассчитать через T>вых,ср.>
Q>вых>
=

Таким образом T>вых,ср>=171,26 К.
3. Кинетика процесса
Механизм реакции:
1. Происходит протонирование олефина с образованием карбкатиона:
2. Образуется
 -комплекс:
-комплекс:
3. Образуется
 -комплекс.
Данная стадия является лимитирующей.
-комплекс.
Данная стадия является лимитирующей.
4. Отрыв протона от ароматического ядра:
Отделившийся протон может взаимодействовать с олефином, и процесс пойдет заново или с катализатором, тогда реакция прекратиться.
В качестве катализаторов – протонных кислот – в промышленности чаще всего применяют серную кислоту. Она является наиболее активной среди других доступных и дешевых кислот, но в то же время катализирует и побочные реакции, приводя дополнительно к сульфированию фенола и сульфированию олефина и образуя фенолсульфокислоты HOC>6>H>4>SO>2>OH и моноалкилсульфаты ROSO>2>OH, которые также участвуют в катализе процесса. С серной кислотой алкилирование н-олифинами происходит при 100-120ºС. Другим катализатором, не вызывающим побочных реакций сульфирования и более мягким по своему действию, является п-толуолсульфокислота CH>3>C>6>H>4>SO>2>OH. Однако она имеет меньшую активность и большую стоимость, чем H>2>SO>4>.
С этими катализаторами алкилирование фенола протекает как гомогенная реакция по следующему уравнению:
 =
=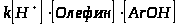
Из уравнения видно, что при увеличении концентрации одного из веществ скорость реакции линейно возрастет. В производстве работают при сравнительно небольшом избытке фенола по отношению к олефину и даже при их эквимольном количестве. Если в качестве катализатора берут H>2>SO>4>, то она применяется в количестве 3-10%(масс.). Увеличение температуры положительно скажется на скорости реакции, т.к. процесс эндотермический.
4. Технология процесса
Для алкилирования фенолов применяют периодический процесс. Реакцию проводят в аппарате с мешалкой и рубашкой для обогрева паром или охлаждения водой. В него загружают фенол и катализатор, нагревают их до 90 ºС, после чего при перемешивании и охлаждении подают жидкий тетрадецен-1 при температуре 25 ºС(температура плавления -12,7 ºС). Делают именно так потому что, если загрузить сначала катализатор с олефином, то там могут пойти реакции олиго- и полимеризации. Во второй половине реакции, наоборот, необходимо подогревать реакционную массу. Общая продолжительность операции составляет 2-4 часа. После этого реакционную массу нейтрализуют в смесителе 5%-ной щелочью, взятой в эквивалентном количестве к кислоте-катализатору, нагревая смесь острым паром. Нейтрализованный органический слой сырых алкилфенолов отделяют от водяного раствора солей и направляют на вакуум перегонку, когда отгоняется вода, остатки олефина и не превращенный фенол.
Задание №1
При окислительном аммонолизе пропилена получена реакционная масса следующего состава (% масс.): - пропилен – 18,94, нитрил акриловой кислоты – 54,85, ацетонитрил – 13,00, ацетальдегид – 1,15, пропионовый альдегид – 5,07, синильная кислота – 4,99, формальдегид – 0,80, СО>2 >– 1,20. Вычислить степень конверсии реагентов, селективность процесса по каждому из продуктов реакции в расчете на каждый реагент и выход на пропущенное сырье каждого из продуктов реакции в расчете на один реагент.
Решение: наиболее вероятная схема превращений при окислительном аммонолизе:

Составим таблицу распределения мол. долей исх. вещества:
|
Компонент |
% масс. |
М |
G |
Кол-во мол. исх. в-ва |
||
|
пропилен |
аммиак |
кислород |
||||
|
пропилен |
18.94 |
42.08 |
0.4501 |
b>1> = 0.4501 |
0 |
0 |
|
акрилонитрил |
54.85 |
53.06 |
1.0337 |
b>2> =1.0337 |
d>1> =1.0337 |
0 |
|
ацетонитрил |
13.00 |
41.05 |
0.3167 |
b>3> =0.3167 |
d>2> =0.3167 |
0 |
|
ацетальдегид |
1.15 |
44.05 |
0.0261 |
b>4> =0.0261 |
0 |
e>1> =0.0261 |
|
пропионовый альдегид |
5.07 |
58.08 |
0.0873 |
b>5> =0.0873 |
0 |
e>2 >=> >0.0873 |
|
синильная кислота |
4.99 |
27.03 |
0.1846 |
b>6> =0.1846 |
d>3> =0.1846 |
|
|
формальдегид |
0.80 |
30.03 |
0.0266 |
b>7> =0.0266 |
0 |
e>3 >=> >0.0266 |
|
углекислый газ |
1.20 |
44.01 |
0.0273 |
b>8> =0.0273 |
0 |
e>4 >=> >0.0273 |
Степень конверсии пропилена определяется по формуле:

Степень конверсии аммиака:
 и кислорода
и кислорода
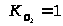 .
.
Селективность по пропилену
рассчитывается по формуле:
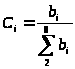 ,
по аммиаку:
,
по аммиаку:
 ,
по кислороду:
,
по кислороду:
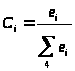 .
Результаты расчетов приведены в табл.
1.
.
Результаты расчетов приведены в табл.
1.
Таблица 1
|
Компонент |
Селективность |
||
|
по пропилену |
по аммиаку |
по О>2> |
|
|
акрилонитрил |
0.6072 |
0.6734 |
0 |
|
ацетонитрил |
0.1860 |
0.2063 |
0 |
|
ацетальдегид |
0.0153 |
0 |
0.1560 |
|
пропионовый альдегид |
0.0513 |
0 |
0.5218 |
|
синильная кислота |
0.1085 |
0.1203 |
0 |
|
формальдегид |
0.0157 |
0 |
0.1592 |
|
углекислый газ |
0.0160 |
0 |
0.1630 |
Проверка:
 ,
,
 .
.
Выход на пропущенное сырье в
расчете на пропилен рассчитывается по
формуле:
 .
Результаты представлены в табл. 2:
.
Результаты представлены в табл. 2:
Таблица 2
|
Компонент |
η>i> |
|
акрилонитрил |
0.4802 |
|
ацетонитрил |
0.1471 |
|
ацетальдегид |
0.0121 |
|
пропионовый альдегид |
0.0406 |
|
синильная кислота |
0.0858 |
|
формальдегид |
0.0124 |
|
углекислый газ |
0.0127 |
Задание 2.
Для изомеризации н-пентана в изопентан вычислить перепад температур в зоне реакции при адиабатическом ведении процесса. Процесс протекает при давлении 1 атм. В реактор подается 10 т/час н-пентана при 650К и 25 молей водорода на 1 моль пентана при 900К. Степень конверсии н-пентана 10, 20, 50, 70%. Селективность процесса 100%. Потери тепла в окружающую среду составляют 3% от прихода тепла в реактор. Провести графическую и аналитическую зависимости адиабатического перепада температур от степени конверсии н-пентана. Аргументировать технологические приемы, используемые при осуществлении промышленной изомеризации углеводородов.
Решение: Схема реакции представлена на рис. 1:

Рис. 1. Изомеризация н-пентана.
Схема реактора представлена на рис. 2.

Рис. 2. Схема теплового баланса реактора.
Тепло, входящее в реактор, определяется по формуле:
 ,
(1) здесь:
,
(1) здесь:
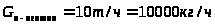 ,
,
 ,
,
 - определено для Т = 650К из
полиномного уравнения, полученного по
табличным данным;
- определено для Т = 650К из
полиномного уравнения, полученного по
табличным данным;
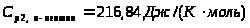 определено для Т>вх>
из полиномного уравнения для С>р>
н-пентана с помощью функции «Поиск
решения» программы «Microsoft
Excel»;
определено для Т>вх>
из полиномного уравнения для С>р>
н-пентана с помощью функции «Поиск
решения» программы «Microsoft
Excel»;
 - для 900К определено по табличным
данным;
- для 900К определено по табличным
данным;
 - определено для Т>вх>
из полиномного уравнения для С>р>
воды с помощью функции «Поиск решения»
программы «Microsoft
Excel»;
- определено для Т>вх>
из полиномного уравнения для С>р>
воды с помощью функции «Поиск решения»
программы «Microsoft
Excel»;
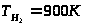 ,
,
 ,
,

С помощью функции «Поиск решения» программы «Microsoft Excel» методом наименьших квадратов определено значение Т>вх> = 685К.

Энтальпия реакции при данной Т>вх>:

Теплота реакции определяется величиной энтальпии реакции, массового расхода реагента, степенью конверсии реагента.
Рассмотрим пример, когда степень
конверсии
 .
.
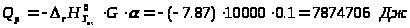 ,
,
Согласно уравнению теплового баланса:
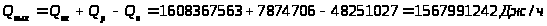
 .
.
Здесь:
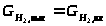 ,
,
 - определено для Т>вых>
из полиномного уравнения с помощью
функции «Поиск решения» программы
«Microsoft
Excel»;
- определено для Т>вых>
из полиномного уравнения с помощью
функции «Поиск решения» программы
«Microsoft
Excel»;
 ,
,
 - определено для Т>вых>
из полиномного уравнения для С>р>
н-пентана с помощью функции «Поиск
решения» программы «Microsoft
Excel»;
- определено для Т>вых>
из полиномного уравнения для С>р>
н-пентана с помощью функции «Поиск
решения» программы «Microsoft
Excel»;
 ,
,
 - определено для Т>вых>
из полиномного уравнения для С>р>
и-пентана с помощью функции «Поиск
решения» программы «Microsoft
Excel»;
- определено для Т>вых>
из полиномного уравнения для С>р>
и-пентана с помощью функции «Поиск
решения» программы «Microsoft
Excel»;
С помощью функции «Поиск решения» программы «Microsoft Excel» методом наименьших квадратов определено значение Т>вых> = 687К.
Аналогично определяем значения Т>вых> для различных значений степени конверсии. Полученные значения представлены в таблице 3.
Таблица 3
|
α |
Т>вых> |
|
0,1 |
662 |
|
0,2 |
663 |
|
0,5 |
667 |
|
0,7 |
669 |
Графическая зависимость перепада температур на входе и выходе от степени конверсии представлена на рисунке 3.

Рис. 3. Зависимость адиабатического перепада температур от степени конверсии.
При увеличении степени конверсии перепад температур в зоне реакции линейно уменьшается.