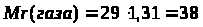Решение задач по химии (работа 1)
Решебник
разноуровневых заданий
по химии
для дифференцированного контроля
знаний учеников
8 класс
г. Кривой Рог
2001 год
Вариант 1
Задачи
Первый уровень
1.
|
Дано: О>2> |
|
|
Д(Н>2>) — ? |
|
|
Ответ: |
относительная плотность кислорода по водороду 16. |
2.
|
Дано: Н>2>О |
1. Определяем массовую долю оксигена в воде
|
|
W(O) — ? |
|
|
Ответ: |
массовая доля оксигена в воде 87%. |
3. О>2> – молекула простого вещества – кислорода, состоящая из двух атомов оксигена.
2О>2> – две молекулы простого вещества, каждая из которых состоит из двух атомов оксигена.
О – один атом оксигена.
10Н>2>О – десять молекул сложного вещества, каждая из которых состоит из двух атомов гидрогена и одного атома оксигена.
4СО>2> – четыре молекулы сложного вещества, каждая из которых состоит из одного атома карбона и двух атомов оксигена.
4. HNO>3>
Второй уровень
5.
|
Дано: ν(N>2>)=5 моль |
|
|
N(N>2>) — ? N(N) — ? |
|
|
Ответ: |
в 5 моль азота содержится 30∙1023 молекул азота и 60∙1023 атомов нитрогена. |
6.
|
Дано: m(Cu)=16 кг |
х 16кг CuO + H>2 >= Cu + H>2>O 1 кмоль 1 кмоль 80кг/моль 64кг/моль 80кг 64кг
х:80кг=16кг:64кг
|
|
m(CuO) — ? |
|
|
Ответ: |
для получения 16кг меди надо взять 20кг купрум (II) оксида. |
7.
|
Дано: V(H>2>)=16л |
2H>2>+O>2>=2H>2>O 1. Определяем объем кислорода V(H>2>):V(O>2>)=2:1=16л:х
|
|
V(O>2>) — ? |
|
|
Ответ: |
на полное сгорание 16 литров водорода пойдет 8л кислорода. |
Третий уровень
8. 2Ca+O>2>=2CaO
CaO+H>2>O=Ca(OH)>2>
Ca(OH)>2>+2HCl=CaCl>2>+2H>2>O
9.
|
Дано: Д(О>2>)=1,5 |
1. Определяем относительную молекулярную массу озона
Mr(озона)=Д(О>2>)∙Mr(O>2>) Mr(озона)=1,5∙32=48
16 – 1 атом 48 – х атомов
|
|
Формула озона — ? |
|
|
Ответ: |
формула озона – О>3>. |
10. При увеличении давления химическое равновесие сместится в сторону образования водорода и кислорода.
Вариант 2
Задачи
Первый уровень
1.
|
Дано: CaCO>3> |
|
|
W(Ca) — ? |
|
|
Ответ: |
массовая доля кальция в кальций карбонате 40%. |
2.
|
Дано: N(H>2>)=24∙1023 молекул |
|
|
ν(H>2>) — ? |
|
|
Ответ: |
количество вещества водорода – 4моль. |
3.
|
Дано: Д(Н>2>)=8 |
Mr(в-ва)=Д(Н>2>)∙Mr(H>2>) Mr(в-ва)=8∙2=16 |
|
Mr(в-ва) — ? |
|
|
Ответ: |
относительная молекулярная масса вещества – 16. |
2Br – два атома брома
Br – один атом брома
3HBr – три молекулы сложного вещества, каждая из которых
Второй уровень
5.
|
Дано: ν(AgNO>3>)=3моль |
3моль хг AgNO>3 >+ NaCl = AgCl + NaNO>3> 1моль 1моль 143,5г/моль 143,5г
3моль:1моль=х:143,5г
|
|
m(AgCl) — ? |
|
|
Ответ: |
масса аргентум хлорида 430,5г. |
6.
|
Дано: S V(O>2>)=44,8л |
44,8л х S + O>2 >= SO>2> 1моль 1моль 22,4л/моль 22,4л/моль 22,4л 22,4л
44,8л:22,4л=х:22,4л
|
|
V(SO>2>) — ? |
|
|
Ответ: |
объем сульфур (IV) оксида – 44,8л. |
С повышением температуры химическое равновесие сместится в сторону исходных веществ.
Третий уровень
2Pb+O>2>=2PbO
PbO+2HCl=PbCl>2>+H>2>O
PbCl>2>+2AgNO>3>=Pb(NO>3>)>2>+2AgCl↓
а) CuO+2HNO>3>=Cu(NO>3>)>2>+H>2>O
10.
|
Дано: m(H>2>SO>4>)=4,9г NaOH |
4,9г хг 2NaOH + H>2>SO>4 >= Na>2>SO>4 >+ 2H>2>O 1моль 1моль 98г/моль 142г/моль 98г 142г
4,9г:98г=х:142г
|
|
m(Na>2>SO>4>) — ? |
|
|
Ответ: |
в результате взаимодействия 4,9г сульфатной кислоты с натрий гидроксидом образуется 7,1г натрий сульфата. |
Вариант 3
Задачи
Первый уровень
1.
|
Дано: CuSO>4> |
|
|
W(Cu) — ? |
|
|
Ответ: |
массовая доля купрума в купрум (II) сульфате – 40% |
2.
|
Дано: ν(О>2>)=3моль |
N=3моль∙6∙1023молекул/моль=18∙1023молекул |
|
N(O>2>) — ? |
|
|
Ответ: |
в 3 моль кислорода содержится 18∙1023молекул. |
3. N>2> – одна молекула простого вещества азота каждая из которых состоит из двух атомов нитрогена.
5N – пять атомов нитрогена.
N>2>O – одна молекула сложного вещества, состоящая из двух атомов нитрогена и одного атома оксигена.
4HNO>3> – четыре молекулы сложного вещества, каждая из которых состоит из одного атома гидрогена, одного атома нитрогена и трех атомов оксигена.
7H>2> – семь молекул простого вещества водорода, каждая из которых состоит из двух атомов гидрогена.
4.
|
Дано: ν(Н>2>)=2моль |
V(H>2>)=2моль∙22,4л/моль=44,8л |
|
V(H>2>) — ? |
|
|
Ответ: |
объем 2 моль водорода составляет 44,8л. |
Второй уровень
5.
|
Дано: υ(NaOH)=4моль |
4моль хг 2NaOH + H>2>SO>4 >= Na>2>SO>4 >+ 2H>2>O 2моль 1моль 98г/моль 98г
4моль:2моль=х:98г
|
|
m(H>2>SO>4>) — ? |
|
|
Ответ: |
на нейтрализацию 4 моль натрий гидроксида пойдет 196г сульфатной кислоты. |
6.
|
Дано: m(CuO)=16г |
хг 16г 2Cu + O>2 >= 2CuO 2моль 2моль 64г/моль 80г/моль 64г 160г |
|
m(Cu) — ? |
|
х:64г=16г:160г
|
|
|
Ответ: |
для получения 16г купрум (II) оксида надо взять 6,4г меди. |
С повышением температуры равновесие сместится в сторону исходных веществ.
Третий уровень
2Cu+O>2>=2CuO
CuO+2HCl=CuCl>2>+H>2>O
CuCl>2>+2NaOH=Cu(OH)>2>↓+2NaCl
а) Fe(OH)>2>+H>2>SO>4>=FeSO>4>+2H>2>O
10.
|
Дано: Д(Н>2>)=16 |
Mr=16∙2=32
|
|
Формула — ? |
|
|
Ответ: |
О>2>. |
Вариант 4
Задачи
Первый уровень
1.
|
Дано: Fe>2>O>3> |
|
|
W(Fe) — ? |
|
|
Ответ: |
массовая доля феррума в феррум (III) оксиде – 70%. |
2.
|
Дано: О>2> |
1. Определяем относительную плотность кислорода по водороду
|
|
Д(Н>2>) — ? |
|
|
Ответ: |
относительная плотность кислорода по водороду – 16. |
3. 7Н>2>О – семь молекул сложного вещества, каждая из которых состоит из двух атомов гидрогена и одного атома оксигена.
Н>2> – молекула простого вещества, состоящая из двух атомов гидрогена.
5MgO – пять молекул сложного вещества, каждая из которых состоит из одного атома магния и одного атома оксигена.
4Cu – четыре атома купрума.
3О – три атома оксигена.
4. При уменьшении температуры химическое равновесие сместится в сторону продуктов реакции.
Второй уровень
5.
|
Дано: m(Al)=10,8г |
|
|
N(Al) — ? |
|
|
Ответ: |
в 10,8г алюминия содержится 1,2∙1023 молекул. |
6.
|
Дано: V(H>2>)=6,72л |
х 6,72л FeO + H>2 >= Fe + H>2>O 1моль 1моль 72г/моль 22,4л/моль 72г 22,4л
х:72г=6,72л:22,4л
|
|
m(FeO) — ? |
|
|
Ответ: |
масса феррум (II) оксида – 21,6г. |
7. б) AlCl>3>+3NaOH=Al(OH)>3>↓+3NaCl
Третий уровень
8. а) Pb(NO>3>)>2>+K>2>S=PbS↓+2KNO>3>
9. Zn+2HCl=ZnCl>2>+H>2>
ZnCl>2>+2NaOH=Zn(OH)>2>↓+2NaCl
Zn(OH)>2>+H>2>SO>4>=ZnSO>4>+2H>2>O
10.
|
Дано: ν(SO>2>)=1,5моль |
SO>2>+O>2>=SO>3> SO>3>+H>2>O=H>2>SO>4> 1,5 моль хг SO>2 >→ H>2>SO>4> 1моль 1моль 98г/моль 98г
1,5моль:1моль=х:98г
|
|
m(H>2>SO>4>) — ? |
|
|
Ответ: |
1,5 моль сульфур (IV) оксида пойдет на образование 147г сульфатной кислоты. |
Вариант 5
Задачи
Первый уровень
1.
|
Дано: CaCO>3> |
|
|
W(Ca) — ? |
|
|
Ответ: |
массовая доля кальция в кальций карбонате – 40%. |
2.
|
Дано: N(CO>2>)=36∙1028 |
|
|
ν(CO>2>) — ? |
|
|
Ответ: |
количество вещества карбон (IV) оксида – 6 моль. |
3.
|
Дано: Д(Н>2>)=8 |
|
|
Mr(метана) — ? |
|
|
Ответ: |
относительная молекулярная масса метана – 16. |
4. Уменьшение концентрации исходных веществ вызывает смещение химического равновесия в сторону исходных веществ, т.е. СО и О>2>.
Второй уровень
5.
|
Дано: m(Cu)=128г |
хг 128г CuO + H>2 >= Cu + H>2>O 1моль 1моль 80г/моль 64г/моль 80г 64г
х:80г=128г:64г
|
|
m(CuO) — ? |
|
|
Ответ: |
в реакцию может вступить 160г купрум (II) оксида для получения 128г меди. |
6. б) Na>2>CO>3>+2HNO>3>=2NaNO>3>+H>2>O+CO>2>
7.
|
Дано: m(Fe)=28г m(O)=12г m(Fe>2>O>3>)=40г |
|
|
W(Fe) — ? W(O) — ? |
|
|
Ответ: |
в феррум (III) оксиде массовая доля феррума – 70%, массовая доля оксигена – 30%. |
Третий уровень
8. Si+O>2>=SiO>2>
2W+3O>2>=2WO>3>
4As+3O>2>=2As>2>O>3>
Os+2O>2>=OsO>4>
9. N>2>+O>2>=2NO
2NO+O>2>=2NO>2>
4NO>2>+2H>2>O+O>2>=4HNO>3>
NaOH+HNO>3>=NaNO>3>+H>2>O
10.
|
Дано: N:O=7:16 |
N:O=7:16 N:O=14:32 число атомов нитрогена – 1, оксигена – 2, отсюда – NO>2> |
|
Формула — ? |
|
|
Ответ: |
формула соединения – NO>2>. |
Вариант 6
Задачи
Первый уровень
1.
|
Дано: CuSO>4> |
|
|
W(Cu) — ? |
|
|
Ответ: |
массовая доля купрума – 40%. |
2. Н>2> – два атома гидрогена
3Fe – три атома феррума
2NaOH – две молекулы сложного вещества, каждая из которых состоит из одного атома натрия, одного атома оксигена и одного атома нитрогена.
3.
|
Дано: H>2>S |
|
|
Д(Н>2>) — ? |
|
|
Ответ: |
относительная плотность сероводорода по водороду – 17. |
4. Повышение давления смещает химическое равновесие в сторону образования карбон (IV) оксида, а понижение давления – в сторону исходных веществ, т.е. СО и О>2>.
Второй уровень
5.
|
Дано: m(O>2>)=8г |
|
|
V(O>2>) — ? |
|
|
Ответ: |
объем 8г кислорода – 5,6л. |
6.
|
Дано: m(CuO)=320г |
320г хг CuO + 2HNO>3 >= Cu(NO>3>)>2 >+ H>2>O 1моль 2моль 80г/моль 63г/моль 80г 63г
320г:80г=х:63г
|
|
m(HNO>3>) — ? |
|
|
Ответ: |
на растворение 320г купрум (II) оксида пойдет 252г нитратной кислоты. |
7. BaCl>2>+2AgNO>3>=Ba(NO>3>)>2>+2AgCl↓
Третий уровень
8. 2Mg+O>2>=2MgO
MgO+2HCl=MgCl>2>+H>2>O
MgCl>2>+2AgNO>3>=Mg(NO>3>)>2>+2AgCl↓
Mg(NO>3>)>2>+Na>2>CO>3>=MgCO>3>+2NaNO>3>
9.
|
Дано: υ(CaCO>3>)=20моль HNO>3> |
20моль хл CaCO>3 >+ HNO>3>=Ca(NO>3>)>2>+H>2>O+ CO>2> 1моль 1моль 22,4л/моль 22,4л
20моль:1моль=х:22,4л
|
|
V(CO>2>) — ? |
|
|
Ответ: |
объем газа 448л. |
10.
|
Дано: С:Н=3:1 |
С:Н=3:1С:Н=12:4 число атомов карбона – 1, гидрогена – 4 формула СН>4> |
|
Формула — ? |
|
|
Ответ: |
формула соединения СН>4>. |
Вариант 7
Задачи
Первый уровень
1. 2Fe – два атома феррума.
2Р>2>О>5> – две молекулы сложного вещества, каждая из которых состоит из двух атомов фосфора и пяти атомов оксигена.
4О>2> – четыре молекулы простого вещества – кислорода, каждая из которых состоит из двух атомов оксигена.
S – один атом сульфура.
CuSO>4> – одна молекула сложного вещества, которая состоит из одного атома купрума, одного атома сульфура и четырех атомов оксигена.
2.
|
Дано: m(CO>2>)=8,8г |
|
|
N(CO>2>) — ? |
|
|
Ответ: |
в 8,8 г карбон (IV) оксида содержится 1,2∙1023 молекул. |
3.
|
Дано: СО>2> |
|
|
Д(Н>2>) — ? |
|
|
Ответ: |
относительная плотность карбон (IV) оксида по водороду – 22. |
4. Увеличение концентрации кислорода сместит химическое равновесие в сторону образования продукта реакции.
5.
|
Дано: ν(Mg)=5моль HCl |
5моль хл Mg + 2HCl = MgCl>2 >+ H>2> 1моль 1моль 22,4л/моль 22,4л
5 моль: 1 моль = х : 22,4 л
|
|
V(H>2>) — ? |
|
|
Ответ: |
объём водорода, который выделяется при действии хлоридной кислоты на 5 моль магния, равен 112 л. |
6. SO>2> + H>2>O = H>2>SO>3>
NaOH + SO>2> = Na>2>SO>3> + H>2>O
7.
|
Дано: m (NaOH) = 40 г H>2>SO>4> |
40 г х г 2 NaOH + H>2>SO>4 >= Na>2>SO>4 >+ 2H>2>O 2 моль 1 моль 40 г/моль 142 г/моль 80 г 142 г
40 г : 80 г = х : 142 г
|
|
m (Na>2>SO>4>) — ? |
|
|
Ответ: |
при действии сульфатной кислоты на 40 г натрий гидроксида образуется 71 г натрий сульфата. |
Третий уровень
8. 2 Na + 2H>2>O = 2NaOH + H>2>
2NaOH + H>2>SO>4> = Na>2>SO>4> + 2H>2>O
Na>2>SO>4 + >BaCl = BaSO>4> + 2NaCl
NaCl + AgNO>3> = NaNO>3> + AgCl
9.
|
Дано: (NaOH) = 3 моль Сl(NO>3>)>3> |
3 моль х г Сl(NO>3>)>3> + 3 NaOH = Cl(OH)>3> + 3NaNO>3> 3 моль 1 моль 103 г/моль 103 г 1. Определяем массу хром (3) гидроксида 3 моль: 3 моль = х : 109 г
|
|
m (Cl(OH)>3>) — ? |
|
|
Ответ: |
в результате действия 3 моль натрий гидроксида на хром (III) нитрат образуется 103 г хром (III) гидроксида. |
10. 1) 3Mg + 2H>3>PO>4> = Mg>3>(PO>4>)>2> + 3H>2>
2) 3MgO + 2H>3>PO>4> = Mg>3>(PO>4>)>2> + 3H>2>O
3) 3Mg(OH)>2>+ 2H>3>PO>4> = Mg>3>(PO>4>)>2> + 6H>2>O
Вариант 8
Задачи
Первый уровень
1.
|
Дано: SO>3> |
1. Определяем массовую долю сульфура
|
|
W(S) — ? |
|
|
Ответ: |
массовая доля сульфура в сульфур (VI) оксиде 40% |
2.
|
Дано: m (H>2>SO>4>) = 392 г |
Определяем количество вещества сульфатной кислоты
|
|
(H>2>SO>4>) — ? |
|
|
Ответ: |
4 моль сульфатной кислоты |
3.
|
Дано: C>3>H>8> |
Определяем относительную плотность пропана по водороду
|
|
D(H>2>) — ? |
|
|
Ответ: |
относительная плотность пропана по водороду 22 |
4. Повышение температуры будет способствовать смещению равновесия в сторону исходных веществ
Второй уровень
5.
|
Дано: m (CuO) = 16 г |
16 г х л CuO + H>2>= Cu + H>2> 1 моль 1моль 80 г/моль 22,4 л/моль 80 г 22,4 л
16 г : 80 г = х : 22,4 л
|
|
V (H>2>) — ? |
|
|
Ответ: |
объём водорода, необходимый для восстановления 16 г купрум (2) оксида 4,48 л |
6. а) Ca(NO>3>)>2>+Na>2>CO>3> = CaCO>3> + 2NaNO>3>
7.
|
Дано: (Na) = 1,5 моль H>2>O, н.у. |
1,5 моль х л 2Na + 2H>2>O = 2NaOH + H>2> 2моль 1 моль 22,4 л/моль 22,4 л
1,5 моль : 2 моль = х : 22,4 л
|
|
V(H>2>) — ? |
|
|
Ответ: |
в результате действия воды на 1,5 моль натрия выделилось 33,6 л водорода |
Третий уровень
8. 2Na +2HOH = 2NaOH + H>2>
Na>2>O + H>2>O = 2NaOH
9. Ba + 2H>2>O = Ba(OH)>2> +H>2>
Ba(OH)>2> + 2HNO>3> = Ba(NO>3>)>2> + 2H>2>O
Ba(NO>3>)>2> +Na>2>CO>3> = BaCO>3> + 2NaNO>3>
BaCO>3> + 2HNO>3> = Ba(NO>3>)>2> + H>2>O + CO>2>
10.
|
Дано: C:O = 3:8 |
C:O = 3:8 C:O = 12:32 число атомов С – 1 число атомов О –2, отсюда СО>2> |
|
формула — ? |
|
|
Ответ: |
СО>2> |
Вариант 9
Задачи
Первый уровень
1.
|
Дано: C>2>H>6> |
1. Определяем относительную плотность этана по водороду
|
|
D(H>2>) - ? |
|
|
Ответ: |
относительная плотность этана по водороду 15 |
2.
|
Дано: (N>2>) = 2 моль |
1. Определяем число молекул азота в 2 моль азота
N(N>2>) = 2 моль∙6∙1023молекул/моль = 12∙1023 молекул
1 молекула азота N>2> сод. 2 атома нитрогена 12∙1023 молекул — х
|
|
N(N>2>) - ? N(N) — ? |
|
|
Ответ: |
азот количеством вещества 2 моль содержит 12∙1023 молекул азота и 24∙1023 атомов нитрогена. |
3.
|
Дано: (О>2>) = 2 моль |
1. Определяем объём 2 моль кислорода
V(O>2>) = 2 моль∙22,4 л/моль = 44,8 л |
|
V(O>2>) — ? |
|
|
Ответ: |
занимают объём 44,8 л |
4. При понижении температуры химическое равновесие сместится в сторону исходного вещества, т.е. HBr
Второй уровень
5.
|
Дано: (HNO>3>) = 2 моль KOH |
2 моль х г KOH + HNO>3> = KNO>3> + H>2>O 1 моль 1 моль 101 г/моль 101 г
2 моль : 1 моль = х : 101 г
|
|
m (KNO>3>) — ? |
|
|
Ответ: |
в результате нейтрализации едкого калия 2 моль нитратной кислоты образовалось 202 г калий нитрата. |
6. а) AlCl>3> + 3AgNO>3> = Al(NO>3>)>3> + 3AgCl
7.
|
Дано: (Ca(OH)>2>) = 2 моль |
x 2 моль Ca + 2HOH = Ca(OH)>2 >+ H>2> 1 моль 1 моль 1. Определяем количество вещества кальция х : 1 моль = 2 моль : 1 моль
|
|
(Ca) — ? |
|
|
Ответ: |
для получения 2 моль кальций гидроксида в реакцию с водой должно вступить 2 моль кальция |
Третий уровень
8. 1) Сu + Cl>2> = CuCl>2>
2) CuO + 2HCl> > = CuCl>2> + H>2>O
3) Cu(OH)>2> + 2HCl = CuCl>2> + 2H>2>O
9. 1) 2Ca + O>2> = 2CaO
2) CaO + H>2>O = Ca(OH)>2>
3) Ca(OH)>2> + 2HCl = CaCl>2>+ 2H>2>O
4) CaCl>2>+Na>2>SO>4> = CaSO>4> + 2NaCl
10.
|
Дано: m (Zn и Ag) = 10 г V (H>2>) = 1,12 л |
x г 1,12 л Zn + 2HCl = ZnCl>2 >+ H>2> 1 моль 1 моль 65 г/моль 22,4 л/моль 65 г 22,4 л
х : 65 г = 1,12 л : 22,4 л
100% - 32,5% = 67,5% |
|
W (Zn) — ? W (Ag) — ? |
|
|
Ответ: |
смесь состоит из 32,5% цинка и 67,5% серебра |
Вариант 10
Задачи
Первый уровень
1.
|
Дано: MgO |
1. Определяем массовую долю магния в оксиде магния
|
|
W(Mg) — ? |
|
|
Ответ: |
массовая доля магния в оксида магния 60%. |
2.
|
Дано: (H>2>O) = 3 моль |
N(H>2>O) = 3 моль∙6∙1023 молекул/моль=18∙1023молекул |
|
N(H>2>O) — ? |
|
|
Ответ: |
в 3 моль воды содержится 18∙1023 молекул. |
3.
|
Дано: HCl |
Определяем относительную плотность хлороводорода по водороду
|
|
D(H>2>) - ? |
|
|
Ответ: |
относительная плотность хлороводорода по водороду 18,25. |
4. При повышении давления химическое равновесие сместится в сторону образования аммиака NH>3>.
Второй уровень
5.
|
Дано: V(O>2>)=16,8 л Al, н.у. |
16,8 л х моль 4Al + 3O>2> = 2Al>2>O>3> 3 моль 2 моль 22,4 л/моль 67,2 л
16,8 л : 67,2 л = х : 2 моль
|
|
(Al>2>O>3>) - ? |
|
|
Ответ: |
в результате окисления алюминия 16,8 л кислорода образуется 0,5 моль оксида алюминия |
6. а) MgSO>4> + 2KOH = Mg(OH)>2> +K>2>SO>4>
7.
|
Дано: m(CaO)=280 г H>2>O |
280 г х г CaO + H>2>O = Ca(OH)>2> 1 моль 1 моль 56 г/моль 74 г/моль 56 г 74 г
280 г : 56 г = х : 74 г
|
|
m(Ca(OH)>2>) - ? |
|
|
Ответ: |
в результате действия воды на 280 г кальций оксида образуется 370 г кальций гидроксида |
Третий уровень
8. CuO + H>2>SO>4> = CuSO>4> + H>2>O
9. 1) 4P + 5O>2> = 2P>2>O>5>
2) P>2>O>5> + 3H>2>O = 2H>3>PO>4>
> >3) H>3>PO>4> + 3NaOH = Na>3>PO>4> + 3H>2>O
4) 2Na>3>PO>4> + 3Ca(NO>3>)>2> = 6NaNO>3> + Ca>3>(PO>4>)>2>
10.
|
Дано: m(Fe) = 50 т W(Fe) = 0,7 |
|
|
m(Fe>2>O>3>) - ? |
|
|
Ответ: |
Вариант 11
Задачи
Первый уровень
1.
|
Дано: Ca>3>(PO>4>)>2> |
|
|
W(Ca)- ? |
|
|
Ответ: |
массовая доля кальция в кальций фосфате 38,7% |
2.
|
Дано: (С>2>H>12>O>6>) = 6 моль |
1.Определяем число молекул глюкозы
N(C>6>H>12>O>6>)=6моль∙6∙1023молекул/моль=36∙1023 молекул
в 1 молекуле C>6>H>12>O>6 >содержится > >6 атомов в 36∙1023 молекул — х
|
|
N (C) - ? |
|
|
Ответ: |
в 6 моль глюкозы содержится 216∙10 23 атомов |
3.
|
Дано: D(O>2>) = 1,5 |
1.Определяем относительную молекулярную массу озона
Mr(O>3>) = 1,5∙32 = 48 |
|
Mr(O>3>) — ? |
|
|
Ответ: |
относительная молекулярная масса озона 48 |
4. С увеличением давления химическое равновесие сместится в сторону образования продуктов реакции, т.е. в сторону образования сульфур (VI) оксида.
Второй уровень
5.
|
Дано: m (O>2>) = 64 г |
1.Определяем объём кислорода
|
|
V (O>2>) — ? |
|
|
Ответ: |
64г кислорода занимает объём 44,8 л. |
6. а) AgNO>3> + KBr = AgBr + KNO>3>
7.
|
Дано: m (Cu) = 8 кг |
х кг 8 кг CuO + H>2> = Cu + H>2>O 1 кмоль 1 кмоль 80 кг/кмоль 64 кг/кмоль 80 кг 64 кг
х кг : 80 кг = 8 кг : 64 кг
|
|
m (СuO) — ? |
|
|
Ответ: |
для получения 8 кг меди надо взять10 кг купрум (2) оксида |
Третий уровень
8. а) H>2>SO>4> + 2NaOH = Na>2>SO>4> + 2H>2>O
9. 1) 4P + 5O>2> = 2P>2>O>5>
2) P>2>O>5> + 3H>2>O =2H>3>PO>4>
3) H>3>PO>4> + 3NaOH = Na>3>PO>4> + 3H>2>O
4) 2Na>3>PO>4> + 3CaCl>2> = 6NaCl + Ca>3>(PO>4>)>2>
10.
|
Дано: m (Na>2>CO>3> и Na>2>SiO>3>) = 15 г V (CO>2>) = 2,24 л н.у. |
х г 2,24 л Na>2>CO>3> + 2HCl = 2NaCl + CO>2> + H>2>O 1 моль 1 моль 106 г/моль 22,4 л/моль 106 г 22,4 л
х : 106 г = 2,24 л : 22,4 л
|
|
W(Na>2>CO>3>) — ? W(Na>2>SiO>3>) — ? |
|
|
2. Определяем массовую долю натрий карбоната в смеси
3. Определяем массовую долю натрий силиката 100%-70,67% = 29,33% |
|
|
Ответ: |
смесь состоит из 70,67% натрий карбоната и 29,33 натрий силиката |
Вариант 12
Задачи
Первый уровень
1.
|
Дано: CaCO>3> |
|
|
W (Ca) — ? |
|
|
Ответ: |
массовая доля кальция 40% |
2.
|
Дано: D(H>2>) = 8,5 |
|
|
Mr(NH>3>) — ? |
|
|
Ответ: |
относительная молекулярная масса аммиака 17. |
3.
|
Дано: (S) = 3 моль |
1. Определяем число атомов сульфура
N (S) = 3 моль∙6∙1023 атомов/моль = 18∙1023 атомов |
|
N (S) - ? |
|
|
Ответ: |
в 3 моль серы содержится 18∙1023 атомов сульфура |
4. Если уменьшить концентрацию сульфур (VI) оксида, то химическое равновесие сместится в сторону исходных веществ
Второй уровень
5.
|
Дано: m (СО>2>) = 4,4 г н.у. |
|
|
V(CO>2>) — ? |
|
|
Ответ: |
4,4 г карбон (IV) оксида занимают объём 2,24 л. |
6. б) NaCl + AgNO>3> = NaNO>3> + AgCl
7.
|
Дано: (NaOH) = 2 моль H>2>SO>4> |
2 моль х г 2NaOH + H>2>SO>4> = Na>2>SO>4> + 2H>2>O 2 моль 2 моль 18 г/моль 36 г
2 моль : 2 моль = х : 36 г
|
|
m (H>2>O) —? |
|
|
Ответ: |
масса воды 36 г |
Третий уровень
8. 1) Mg(OH)>2> + 2HCl = MgCl>2> + 2H>2>O
2) Al>2>O>3> + 6HCl = 2AlCl>3> + 3H>2>O
3) Zn + 2HCl = ZnCl>2> + H>2>
9. 1)2Mg + O>2> = 2MgO
2) MgO + 2HNO>3> = Mg(NO>3>)>2> + H>2>O
t
3) Mg(NO>3>)>2> + 2NaOH = Mg(OH)>2> + 2NaNO>3>> >4)Mg(OH)>2> MgO + H>2>O
5)MgO + H>2> = Mg + H>2>O
10.
|
Дано: D (возд) = 1,31 V (газа) = 156,8 л н.у. |
22,4 л имеют массу 38 г 156,8 л — х
|
|
m (H>2>O) — ? |
|
|
Ответ: |
масса 156,8 л газа 256 г. |
Ответы на тестовые задания
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
|
1 |
а |
б |
б |
б |
а |
в |
б |
а |
а |
б |
|
3 |
а |
а |
б |
б |
б |
химия |
б |
в |
в |
б |
|
4 |
а |
в |
б |
а |
б |
б |
в |
а |
б |
кол-во в-ва |
|
2 |
б |
в |
б |
а |
б |
в |
в |
а,г,д |
б |
б |
|
5 |
б |
в |
а |
в |
сохран. массы |
а |
Zu O |
в |
а |
в |
|
6 |
а |
в |
б |
б |
а |
б |
б |
а |
в |
а |
|
7 |
а |
в |
б |
в |
в |
а |
б |
б |
а |
моле-кула |
|
8 |
б |
в |
а |
б |
в |
б |
в |
а |
б |
а,г |
|
9 |
а,б |
б |
б |
б |
моль |
б |
Na, Zu, O |
в |
б |
б |
|
10 |
а |
а |
а |
а |
просты-ми |
б |
а |
в |
а |
а |
|
11 |
а |
в |
а |
а,в |
катали-заторы |
б |
б |
а |
а |
б |
|
12 |
а |
а |
б |
б |
относи-тельной атомной массой |
в |
б |
а |
а |
б |

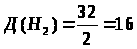


 или 87%
или 87%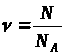



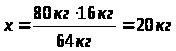




 или 40%
или 40%

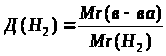

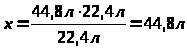
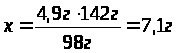

 или
40%
или
40% ;
;

 ;
;


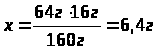

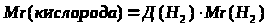
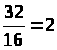 ,
отсюда О>2>
,
отсюда О>2>
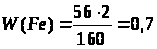 или 70%
или 70%

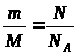 ;
;

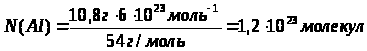
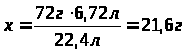



 ;
;
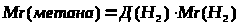



 или 30%
или 30%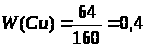 или
40%
или
40%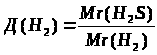
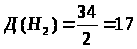
 ;
;



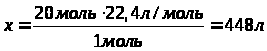

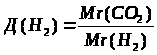




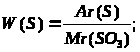
 или
40%
или
40%
 )
=
)
=



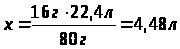
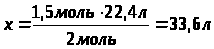










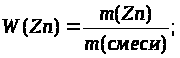
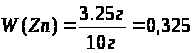 или 32,5 %
или 32,5 %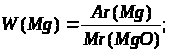
 или 60%
или 60%
 N
= ∙N>A>;
N
= ∙N>A>;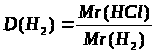




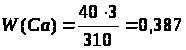 или 38,7%
или 38,7%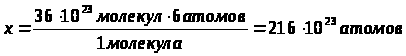
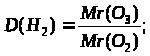
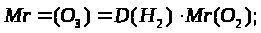




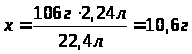
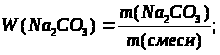
 или 70,67%
или 70,67%
 или 40%
или 40%

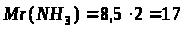
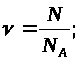 N
= ∙N>A>
N
= ∙N>A>