Оксисоединения
Под оксисоединениями понимают органические соединения содержащие в составе своей структурной формулы одну или несколько гидроксильных групп (OH). Таковыми являются все спирты и фенолы.
АЦИКЛИЧЕСКИЕ ОКСИСОЕДИНЕНИЯ
Спирты.
Спиртами называются соединения общей формулой ROH, где R любая алкильная или замещённая алкильная группа. Эта группа может быть первичной, вторичной или третичной; она может быть как ациклической, так и циклической; она может содержать двойную связь, атом галогена или ароматическое кольцо, например:
CH>3 >

 OH
OH
CH>3>CCH>3 > H>2>C=CHCH>2>OH
 Аллиловый
спирт
Аллиловый
спирт
OH циклогексанол
Третбутиловый
спирт

 CH>2>OH
CH>2>
CH>2>
CH>2>CHCH>2>
CH>2>OH
CH>2>
CH>2>
CH>2>CHCH>2>





Cl OH OH OH OH
Бензиловый спирт этиленхлоргидрин глцерин
(хлорэтиловый спирт)
все спирты содержат гидроксильную группу (OH), которая является функциональной и определяет свойства, характерные для данного класса соединений. Строение R влияет на скорость, с которой спирт вступает в некоторые реакции, и иногда на характер реакции.
Одноатомные насыщенные спирты.
Классификация.
Спирты классифицируют на первичные, вторичные и третичные в зависимости оттого, с каким атомом углерода (связана гидроксильная группа). Атом углерода считается первичным, вторичным третичным в зависимости от числа связанных с ним других атомов углерода.
H R R
RCOH RCOH RCOH
H H H
Первичный вторичный третичный
Номенклатура.
Для названия спиртов по номенклатуре IUPAC выбирают наиболее длинную цепь, содержащую гидроксильную группу. Нумерацию начинают с того конца цепи к которому ближе находится эта группа. Принадлежность соединения к классу спиртов обозначается окончанием «ол». Между основой названия и окончанием ставят цифру, обозначающую атом углерода у которой стоит OHгруппа. Если имеются алкильные заместители, то название спирта начинают с цыфр(ы), указывающих (указывающей) положение заместителя (заместителей) в цепи, далее идёт название заместителей как радикалов.
Простейшие спирты можно называть по карбинольной номенклатуре, беря за основу название первого представителя спиртов, CH>3>OH “карбинол”. Название начинают с перечисления радикалов, замещающих атомы водорда, стоящие у углеродного атома, в метиловом спирте CH>3>OH, например:
OH OH


CH>3 >CH>2>OH CH>3 >CH CH>3 > CH>3 >C CH>2>CH>3 >
 Метилкарбинол
диметилкарбинол
Метилкарбинол
диметилкарбинол
CH>3 >
Диметилэтилкарбинол
Часто простейшие представители класса спиртов называют по рациоальной (радикальной) номенклатуре, по названию углеводородного радикала (см. таблицу).
Изомерия.
Изомерия спиртов аналогична изомерии галогенопроизводных. В случае спиртов кроме изменения строения углеродного скелета может изменяться положение OH группы.
Для соединения общей формулы C>5>H>11>OH=C>5>H>12>O существует семь изомеров:
OH OH
CH>3>CH>2>CH>2>CH>2>CH>2>OH > > CH>3>CHCH>2>CH>2>CH>3 > CH>3>CH>2>CHCH>2>CH>3 > > >
Пентанол1 пентанол2 пентанол3

 CH>3 >
CH>3 >
OH CH>3 >
CH>3 >
CH>3 >
CH>3 >
OH CH>3 >
CH>3 >
CH>3>CCH>2>CH>3 > > > CH>3>CHCHCH>3 > > > CH>3>CHCH>2>CH>2>OH CH>3>CH>2>CHCH>2>OH
OH
2метилбутанол2 3метилбутанол2 3метилбутанол1 2метилбутанол1
Физические свойства.
Спирты сильно отличаются по свойствам от углеводородов вследствие присутствия в их молекуле очень полярной гидроксильной группы. Спирты бесцветные вещества с плотностью меньше единицы.
Формула |
Номенклатура |
Т.пл.,C |
Т.кип.,C |
Растворимость Г/100г H>2>O |
|
|
IUPAC |
радикальная |
||||
|
CH>3>OH CH>3>CH>2>OH CH>3>CH>2>CH>2>OH CH>3>CH(OH)CH>3 > CH>3>(CH>2>)>2>CH>2>OH (CH>3>)>2>CHCH>2>OH> > CH>3>CH(OH)CH>2>CH>3 > (CH>3>)>3>COH > > > > CH>3 >(CH>2>)>3>CH>2>OH CH>3 >(CH>2>)>4>CH>2>OH CH>3>(CH>2>)>5>CH>2>OH> > CH>3>(CH>2>)>6>CH>2>OH CH>3 >(CH>2>)>12>CH>2>OH> > > > |
Метанол Этанол Пропанол1 Пропанол2 Бутанол1 2метилпропанол1 Бутанол2 2метилпропанол2 Пентанол1 Гексанол1 Гептанол1 Октанол1 Тетрадеканол1 |
Метиловый Этиловый нПропиловый Изопропиловый нБутиловый Изобутиловый вторБутиловый третБутиловый нАмиловый нГексиловый нГептиловый нОктиловый нТетрадециловый |
97 115 126 86 90 108 114 26 79 52 34 15 38 |
65 78 97 83 118 108 100 83 138 157 176 195 |
7,9 10,2 12,5 2,3 0,6 0,2 0,05 |
Такое отличие в физических свойствах между спиртами и многими другими классами органических соединений объясняется наличием в молекулах спиртов гидроксильной группы. В гидроксильной группе атом кислорода, проявляя электроакцепторные свойства, «стягивает на себя» электронную плотность от связанного с ним атома водорода, и у последнего образуется дефицит электронной плотности. В результате между атомом водорода гидроксильной группы и свободной электронной парой кислорода OHгруппы другой молекулы спирта возникает водородная связь, за счёт которой происходит ассоциация молекул спиртов:
 R R R
R
R R R
R




 HO
HO
HO
HO
HO
HO
HO
HO
Повышение температур кипения спиртов по сравнению с температурой кипения некоторых других классов органических соединений объясняется необходимостью введения дополнительной энергии на разрыв водородных связей перед переводом из жидкого в парообразное состояние. Энергия электростатической водородной связи около 5 ккал/моль (20,93*103 Дж/моль).[Для большинства ковалентных связей эта величина составляет 50100 ккал/моль (209,34*103 418,68*103 Дж/моль)].
Образование водородных связей между молекулами спиртов и воды причина хорошей растворимости первых представителей ряда спиртов в воде:
 R
R


 R
H O H
R
H O H



 HO
HO
H O
HO
HO
H O
R
С увеличением массы углеводородного радикала в молекуле спирта уменьшается растворимость спиртов в воде и увеличиваются их температуры кипения (температуры кипения уменьшаются пи наличии разветвлений). Температуры кипения спиртов значительно выше, чем температуры кипения соответствующих углеводородов (это объясняется ассоциацией молекул спиртов водородными связями).
Методы получения.
Гидролиз моногалогенопроизводных.
В лабораторных условиях, для получения спиртов часто используют реакцию гидролиза галогенопроизводных водными растворами щелочей. Щёлочь используют для ускорения реакции и для связывания выделяющегося при гидролизе галогеноводорода, подавляя обратимость процесса:

 RX + HOH
ROH + HX
RX + HOH
ROH + HX
Где X:Cl, Br, I; например:
 CH>3>Br
+ HOH >NaOH >
CH>3>OH + NaBr + H>2>O
CH>3>Br
+ HOH >NaOH >
CH>3>OH + NaBr + H>2>O
Бромметан метанол
Реакция может протекать по механизмам S>N>2 или S>N>1 в зависимости от строения исходного галогенпроизводного. Реакционная способность различных соответствующих галогенпроизводных в реакциях гидролиза уменьшается в ряду :
RI > RBr > RCl >> RF
Наиболее легко гидролизуется галоген у третичного атома углерода, труднее у вторичного и наиболее трудно у первичного.
Если у атома углерода, соседнего с атомом несущим галоген, имеется хотя бы один атом водорода, то при взаимодействии с водными растворами щелочей на ряду с гидролизом может протекать реакция дегидрогалогенирования (отщепления галогеноводорода):
OH

 CH>3>CHCH>3
>
CH>3>CHCH>3
>
Пропанол2
NaOH
 CH>3>CHCH>3
> > >
CH>3>CHCH>3
> > >
 H>2>O
H>2>O
 Cl
CH>3 >CH=CH>2>
Cl
CH>3 >CH=CH>2>
2хлорпропан пропен
Гидратация этиленовых углеводородов.
Присоединение воды к двойной связи этиленовых углеводородов с образованием спиртов можно осуществить в присутствии серной кислоты. К несимметричным олефинам вода присоединяется в соответствии с правилом Марковникова:
+
HOH
 + H>2>O
H>2>O
+
+ H>2>O
H>2>O
+


 RCH=CH>2> + H+ RCHCH>3>
RCHCH>3
> RCHCH>3 > + H>3>O
RCH=CH>2> + H+ RCHCH>3>
RCHCH>3
> RCHCH>3 > + H>3>O

OH
Спирты можно получить прямой перегонкой олефинов при 300350 C в присутствии оксида алюминия:
OH
 300350
C
300350
C
 CH>3>CH=CH>2>
+ H>2>O >
> CH>3>CHCH>3
>
CH>3>CH=CH>2>
+ H>2>O >
> CH>3>CHCH>3
>
Пропен Al>2>O>3> пропанол2
Гидроборирование окисление этиленовых углеводородов.
Это современный способ получения спиртов из олефинов. В результате присоединения диборана (BH>3>)>2> к этиленовым углеводородам и последующего окисления образующихся триалкилборанов щелочным раствором пероксида водорода образуются спирты, в которых формально фрагменты воды присоединены к исходному олефину против правила Марковникова. H>2>O>2>

 6RCH=CH>2>
+ (BH>3>)>2>
2(RCH>2>CH>2>)>3>B
6 RCH>2>CH>2>OH
+ 2B(OH)>3>
6RCH=CH>2>
+ (BH>3>)>2>
2(RCH>2>CH>2>)>3>B
6 RCH>2>CH>2>OH
+ 2B(OH)>3>
алкены диборан алкилбораны OH спирты борная кта
Эта реакция гидроборирования очень проста и удобна, выходы очень высоки, и её можно использовать для синтеза для синтеза соединений, которые трудно получить из алкенов какимлибо другим способом.
Диборан димер гипотетического BH>3> (борана), который в рассматриваемых реакциях реагирует как BH>3>.



 H
H H H
H
H H H



 H:B
B B
H:B
B B
H H H H
Боран диборан
Гидроборирование включает присоединение BH>3> по двойной связи, водород направляется к одному из атомов углерода двойной связи, а бор к другому. Алкилбораны могут затем подвергаться окислению, при котором бор заменяется на OHгруппу.




 H>2>O>2
>OH
H>2>O>2
>OH






 C=C + HB
CC
CC
C=C + HB
CC
CC

 Алкен
H B H OH
Алкен
H B H OH
 HB
= HBH>2>,
HBR>2>
HB
= HBH>2>,
HBR>2>
Таким образом, двухстадийная реакция гидроборирования окисления в действительности представляет присоединение элементов воды HOH по двойной углерод углеродной связи.
CH>3 > CH>3 >

 (BH>3>)>3>
H>2>O>2>,
OH
(BH>3>)>3>
H>2>O>2>,
OH

 CH>3
>C
CH>3 >=CH>2
> CH>3
>CCH>2>CH>2>OH
CH>3
>C
CH>3 >=CH>2
> CH>3
>CCH>2>CH>2>OH


CH>3 > CH>3 >
3,3диметилбутен1 3,3диметилбутанол1
(первичный)
Реакция гидроборирования протекает против правила Марковникова. Что интересно, в реакциях гидроборирования не происходит перегруппировок (очевидно, потому, что в это случае не образуются карбониевые ионы), и, следовательно, метод может быть использован без осложнений, которые часто сопровождают другие реакции присоединения.
Благодаря этому реакция гидроборирования окисления приобретает большое синтетическое значение: она позволяет получать из алкенов спирты, которые недоступны другими методами; эти спирты служат исходными для синтеза многих соединений других классов.
Синтезы спиртов с помощью металорганических соединений (синтезы Гриньяра).
Спирты получают взаимодействием реактивов Гриньяра RMgX (где R: алкил; X: Cl, Br, I) или литий органических соединений Rli с альдегидами или кетонами. Образующиеся при этом алкоголяты при при обработке водой или разбавленными кислотами превращаются в соответствующие спирты. В зависимости от строения исходного карбонильного соединения можно получить первичный, вторичный или третичный спирт:
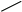
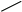 O
+
O
+

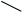

 RMgX + HC
RCH>2>OMgX
RMgX + HC
RCH>2>OMgX
H H>2>O
 RCH>2>OH
RCH>2>OH
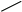 O
+
H+
первичный спирт
O
+
H+
первичный спирт

 RLi + HC
RCH>2>OLi
RLi + HC
RCH>2>OLi
H
Фрмальдегид
 O R
O R


 RMgX + R’C
CHOMg+X
RMgX + R’C
CHOMg+X
 H R’
H>2>O
R
H R’
H>2>O
R

 CHOH
CHOH
 O
H+
R’
O
H+
R’

 RLi + R’C
CHOLi+
вторичный
спирт
RLi + R’C
CHOLi+
вторичный
спирт
H
Альдегиды
(R’ H)
H)
 R’ R
R’ R


 RMgX + C=O R’
COMg+X
RMgX + C=O R’
COMg+X
 R”
R” H>2>O
R
R”
R” H>2>O
R
 R’
COH
R’
COH

 R’
R H+
R”
R’
R H+
R”


 RLi + C=O R’
COLi+
третичный
спирт
RLi + C=O R’
COLi+
третичный
спирт
R” R”
Кетоны
Примеры синтезов:
 O
O


 CH>3>CH>2>MgBr>
> + HC
CH>3>CH>2>CH>2>OH
CH>3>CH>2>MgBr>
> + HC
CH>3>CH>2>CH>2>OH
этилмагнийбромид H пропанол1
метаналь (первичный спирт)
 OH
OH
 O
O
 CH>3>CH>2>MgI
+ CH>3>C>
> CH>3>CH>2>CHCH>3
>
CH>3>CH>2>MgI
+ CH>3>C>
> CH>3>CH>2>CHCH>3
>
этилмагнийиодид H бутанол2
этаналь (вторичный спирт)
O OH




 CH>3>MgCl
+ CH>3>CCH>3
> CH>3>CCH>3
>
CH>3>MgCl
+ CH>3>CCH>3
> CH>3>CCH>3
>
CH>3 >
Метилмагний пропанон 2метилпропанол2
хлорид (третичный спирт)
Связь углерод магний в реактиве Гриньяра сильно полярна, причём углерод яляется отрицательным относительно электроположительного магния. Поэтому не удивительно, что в результате присоединения к карбонильному соединению органическая группа образует связь с углеродом, а магний с кислородом. Продукт представляет собой магниевую соль слабо кислого спирта и легко превращается в спирт при прибавлении более сильной кислоты воды.
 C+=O
C+=O



 H>2>O
H>2>O
 COMgX
C
OH + Mg(OH)X
COMgX
C
OH + Mg(OH)X
 R:
MgX
R:
MgX
+ R R H+
спирт
Mg2+ + X + H>2>O
Поскольку образовавшийся в процессе реакции Mg(OH)X представляет собой желатинообразное вещество, с которым трудно работать, поэтому вместо воды обычно используют разбавленную минеральную кислоту (HCl, H>2>SO>4>), так что образуются растворимые в воде соли магния.
В аналогичном синтезе для получения первичных спиртов, содержащих на два атома углерода больше, чем исходный реактив Гриньяра, используют окись этилена.

 H>2>C
CH>2>
+ RMgX RCH>2>CH>2>HMgX
RCH>2>CH>2>OH
H>2>C
CH>2>
+ RMgX RCH>2>CH>2>HMgX
RCH>2>CH>2>OH
 H>2>O
первичный спирт
H>2>O
первичный спирт
O + 2 атома углерода
Окись этилена
Органическая группа опять связывается с углеродом, а магний с кислородом, но при этом разрушается углерод кислородная связь в сильно напряжённом трёхчленном кольце.
Промышленные способы получения спиртов.
Метиловый спирт в промышленности получают из оксида углерода и водорода в присутствии катализаторов. В разных условиях можно получить как чистый метиловый спирт
>350>>>>400 >>>>C>> , 21,27 Мпа >
 СО + 2Н>2>
СН>3>ОН
СО + 2Н>2>
СН>3>ОН
катализатор
так и смесь его первичных гомологов, начиная с этилового спирта (синтол).
Метанол в больших масштабах получают гидрированием СО водородом примерно при 400°С и давлении 200 кгс/см2 над катализатором, представляющим собой смесь окиси хрома и окиси цинка.
В производстве синтола в качестве катализатора применяют железо и кобальт и процесс ведут при давлении в несколько десятков атмосфер и повышенной температуре.
Общим методом синтеза спиртов с небольшим молекулярным весом (этиловый, изопропиловый, вторбутиловый, третбутиловый) является гидратация олефинов в присутствии серной кислоты. В зависимости от строения олефина образуются вторичные и третичные спирты (из первичных спиртов таким путём можно получить только этиловый, R = H):
H>2>O
R
 ─CH=CH>2>
+ H>2>SO>4> R─CH─CH>3 >
RCHCH>3> + H>2>SO>4>
─CH=CH>2>
+ H>2>SO>4> R─CH─CH>3 >
RCHCH>3> + H>2>SO>4>
| |
OSO>3>H OH
R R
| H+ |
 C=CH>2> + H>2>O C─CH>3>
C=CH>2> + H>2>O C─CH>3>
| / |
R’ R ’OH
Реакция начинается с атаки ионом водорода того углеродного атома, который связан с бóльшим числом водородных атомов и является поэтому более электроотрицательным, чем соседний углерод (правило Марковникова). После этого к соседнему углероду присоединяется вода с выбросом Н+.
Важный способ получения этилового спирта, известный с древнейших времён, заключается в ферментативном гидролизе некоторых углеводов, содержащихся в различных природных источниках (фрукты, картофель, кукуруза, пшеница и др.), например:
 С>6>Н>12>О>6>
2С>2>Н>5>ОН + 2СО>2>
С>6>Н>12>О>6>
2С>2>Н>5>ОН + 2СО>2>
глюкоза
Химические свойства спиртов
Ряд химических свойств спиртов является общим для всех спиртов; имеются также и реакции, по-разному протекающие для первичных, вторичных и третичных спиртов.
1. Реакци с разрывом OH связи
Образование алкоголятов металлов. Алифатические спирты слабые кислоты. Кислотность спиртов в зависимости от строения убывает в ряду: первичные > вторичные > третичные. При действии на спирты щелочных металлов, в частности натрия, происходит, хотя и менее бурно, взаимодействие, подобное реакции натрия с водой:
 2ROH + 2Na 2RONa + H>2>
2ROH + 2Na 2RONa + H>2>
Такого типа металлические производные спиртов носят общее название алкоголяты (отдельные представители: метилат натрия СН>3>ОNa, этилат натрия С>2>Н>5>ОNa). Их называют также алкоксидами (метоксид натрия, этоксид и т.д.). С увеличением молекулярной массы спирта реакционная способность их при взаимодействии с натрием уменьшается.
Известны алкоголяты и других металлов, кроме щелочных, но они образуются косвенными путями. Так, щелочноземельные металлы непосредственно со спиртами не реагируют. Но алкоголяты щелочноземельных металлов, а также Mg, Zn, Cd, Al и других металлов, образующих реакционноспособные металлорганические соединения, можно получить действием спирта на такие металлорганические соединения. Например:
 2CH>3>OH + Zn (CH>3>)>2>
(CH>3>O)>2>Zn + 2CH>4>
2CH>3>OH + Zn (CH>3>)>2>
(CH>3>O)>2>Zn + 2CH>4>
Алкоголяты спиртов широко применяют в органическом синтезе. Так как вода более сильная кислота, чем спирты, то в присутствии воды алкоголяты разлагаются с выделением исходных спиртов:
 CH>3>ONa +H>2>O
CH>3>OH + NaOH
CH>3>ONa +H>2>O
CH>3>OH + NaOH
Метилат натрия метанол
Поэтому алкоголяты невозможно получить при действии гидроксидов металлов на спирты:

 ROH + NaOH
RONa + H>2>O
ROH + NaOH
RONa + H>2>O
С другой стороны, спирты проявляют слабоосновные свойства, образуя с сильными кислотами более или менее устойчивые соли:
H Br

 ROH + HBr RO+H
ROH + HBr RO+H
Оксониевые соли
Образование сложных эфиров спиртов (реакция этерификации). При действии кислородных минеральных и органических кислот на спирты происходит реакция, которую можно представить следующими примерами:
HO RO
R
 OH
+ SO>2 > SO>2> + H>2>O
OH
+ SO>2 > SO>2> + H>2>O
HO HO
HO RO
2
 ROH
+ SO>2 > SO>2 >+ 2H>2>O
ROH
+ SO>2 > SO>2 >+ 2H>2>O
HO RO
 O O >**
> OH HO+H
O O >**
> OH HO+H
║ H+ ║ R’OH H>2>O






 RCOH
RC+OH
** RCOH
RCOH
RC+OH
RCOH
RC+OH
** RCOH
RCOH
RC+OH
Карбоновая
Кта R’O+H R’O R’O
O
║

 RCOR’
RCOR’
Сложные эфиры
Такого рода взаимодействие спирта с кислотами называется реакцией этерификации, а полученные вещества – сложными эфирами данного спирта и данной кислоты. Реакция этерификации спиртов сильными минеральными кислотами (такими как H>2>SO>4>) протекает быстро и не требует использования катализаторов. С карбоновыми кислотами скорость реакции этерификации значительно увеличивается в присутствии катализаторов. В качестве последних обычно используют минеральные кислоты в небольших количествах.
Внешне уравнение этой реакции подобно уравнению нейтрализации щёлочи кислотой:
NaOH + HNO>3> = NaNO>3> + H>2>O
Однако глубоким различием этих реакций является то, что нейтрализация – ионная, неизмеримо быстро протекающая реакция, которая сводится, в сущности, к взаимодействию ионов:
Н+ + ОН- → Н>2>О
Реакция этерификации идёт иным путём. Спирт в большинстве случаев реагирует, отдавая не гидроксил (как щёлочь при нейтрализации), а водород гидроксильной группы; кислоты (органические и некоторые, но не все, минеральные) отдают свой гидроксил. Этот механизм был установлен при помощи спирта, меченного изотопом кислорода 18О. Как оказалось, при взаимодействии такого спирта с кислотами RCOOH выделяется обычная вода, а не Н>2>18О.
Образование сложных эфиров при действии на спирты хлорангидридов неорганических и органических кислот. Взаимодействие хлорангидридов с первичными спиртами:
ROH + ClN=O → RO─N=O + HCl
3ROH + PCl>3 >→ (RO)>3>P + 3HCl
O O
║ ║
ROH + Cl─C─CH>3 >→ RO─C─CH>3> + HCl
O O
║ ║
ROH + Cl─C─Cl> >→ RO─C─CCl + HCl
2. Реакции с разрывом СO связи.
Образование галогенидов.
При действии неорганических галогенангидридов на третичные и вторичные спирты происходит в основном обмен гидроксила на галоген:
3(CH>3>)>3>COH + PBr>3> → 3(CH>3>)>3>CBr + P(OH)>3>
Обмен гидроксила на галоген происходит и при действии PBr>3> и PI>3 >на первичные спирты:
3C>2>H>5>OH + PBr>3> → 3C>2>H>5>Br + P(OH)>3>
При действии галогенводородных кислот на спирты также образуются алкилгалогениды.
Реакция может протекать либо по механизму S>N>2, либо по S>N>1. Например:
Br
RCH>2>OH + H+ → RCH>2> O+O → RCH>2>Br + H>2>O S>N>2
H для первичных спиртов
R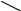
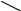
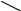
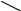 R H>2>O
R Br
R
R H>2>O
R Br
R
R
 ’COH
+ H+
→ R’CO+H
R’C+
→ R’CBr
S>N>1
’COH
+ H+
→ R’CO+H
R’C+
→ R’CBr
S>N>1
R
 ”
R”
R” R”
”
R”
R” R”
H для вторичных и третичных спитртов
Для успешной замены гидроксильной группы на хлор используют реактив Лукаса (соляная кислота + ZnCl>2> ). Реакционная способность спиртов в этих реакциях изменяется в ряду: третичные>вторичные>первичные.
3. Реакции с участием группы OH и атома водорода, стоящего у соседнего атома углерода.
Дегидратация спиртов в олефины. Все спирты (кроме метилового) при пропускании их паров над нагретой до ~375°С окисью алюминия отщепляют воду и образуют олефин:
Al>2>O>3>
С Н>3>─СН>2>ОН
СН>2>=СН>2> + Н>2>О
Н>3>─СН>2>ОН
СН>2>=СН>2> + Н>2>О
Особенно легко элиминируется вода из третичных спиртов.
Дегидрогенизация. Образование разных продуктов в реакциях дегидрогенизации и окисления является важнейшим свойством, позволяющим отличить первичные, вторичные и третичные спирты.
При пропускании паров первичного или вторичного, но не третичного спирта над металлической медью при повышенной температуре происходит выделение двух атомов водорода, и спирт превращается в альдегид:
Cu
RCH>2>OH → R−C−H + H>2>
200300 C ║
O
Вторичные спирты дают в этих условиях кетоны:
R
\ Cu
CHOH → R’−C−R + H>2>
/ 200300 C ║
R’ O
Окисление. Для окисления спиртов обычно используют сильные окислители: KMnO>4, >K>2>Cr>2>O>7> и H>2>SO>4>. При окислении первичных спиртов образуются альдегиды, которые далее могут окисляться до карбоновых кислот:> >
RCH>2>OH + [O] → R─C─H + H>2>O
║
O
R
\
CHOH + [O] → R’−C−R + H>2>O
/ ║
R’ O
Вторичные спирты при окислении превращаются в кетоны:
OH O
[O] ║
CH>3>CHCH>3 > → CH>3>CCH>3 >
Пропанол2 пропанон2
Третичные спирты значительно труднее окисляются, чем первичные и вторичные, причём с разрывом связей CC(OH):
(а) O O CH>3>
║ ║

 HCOH
+ CH>3>CH>2>CCHCH>3>
HCOH
+ CH>3>CH>2>CCHCH>3>
Муравьиная кта 2метилпентанон3
CH>3> O O CH>3>
[O] (б) ║ ║
C H>3>CH>2
>
COH
CH>3 >COH
+ CH>3>CCHCH>3>
H>3>CH>2
>
COH
CH>3 >COH
+ CH>3>CCHCH>3>
Уксусная кта 2метилбутанон3
CH>3>CHCH>3>
2,3диметилпентанон3 O O
(в) ║ ║
CH>3>CCH>3 >+ CH>3>CH>2>CCH>3>
Ацетон бутанон2
Двухатомные спирты, или гликоли (алкандиолы)
Двугидроксильные производные алканов (открыты Вюрцем) носят название гликолей или алкандиолов. Гидроксилы в алкандиолах находятся либо при соседних, либо более удалённых друг от друга углеродных атомах. 1,2-Гликоли имеют сладкий вкус, откуда и происходит название класса. Низшие гликоли – смешивающиеся с водой вязкие жидкости большей плотности, чем одноатомные спирты. Кипят при высокой температуре. Гликоли с короткой углеродной цепью, и прежде всего этиленгликоль, не растворяются в углеводородах и эфире, но смешиваются с водой и спиртами; как растворители они ближе стоят к воде и метанолу, чем к обычным органическим растворителям.
Способы получения
В принципе гликоли могут быть получены всеми синтетическими способами получения спиртов.
Гидролиз дигалогенпроизводных:
ClCH>2>─CH>2>Cl + 2H>2>O → HOCH>2>─CH>2>OH + 2HCl
или
ClCH>2>─CH>2>OH + H>2>O → HOCH>2>─CH>2>OH + HCl
Восстановление сложных эфиров двухосновных кислот:
O O
║ ║
C>2>H>5>O─C─(CH>2>)>n>─C─OC>2>H>5> + 8Na+6C>2>H>5>OH → HOCH>2>─(CH>2>)>n>─CH>2>OH +8C>2>H>5>ONa
3CH>2>=CH>2> + 4H>2>O + 2KMnO>4> → 3HOCH>2>─CH>2>OH + 2KOH + 2MnO>2>
Получение гликолей через хлоргидрины. Действием хлора и воды на олефин можно получить хлоргидрин, например ClCH>2>─CH>2>OH. Хлоргидрин может быть превращён гидролизом непосредственно в гликоль.
Пинаконы получают восстановлением (неполным) кетонов электрохимически или действием магния в присутствии иода:
СH>3 > H>3>C CH>3> H>3>C CH>3>
| | 2H>2>O | |
2 C=O + 2Mg + I>2> → CH>3>─C─C─CH>3> → CH>3>─C─C─CH>3>
| | | |
CH>3> imgO OMgI HO OH
Бутандиол-1,4 (важный продукт, являющийся промежуточным продуктом при получении бутадиена и далее синтетического каучука) получают в промышленности гидрированием бутин-2-диола-1,4 (НОН>2>С─С≡С─СН>2>ОН).
В промышленности этиленгликоль синтезируют из окида этилена, который получают окислением этилена:
250 C H>2>O
2
 CH>2>=CH>2>
+O>2>
> Ag >
CH>2>CH>2>
> >>H+>>
> HOCH>2>CH>2>OH
CH>2>=CH>2>
+O>2>
> Ag >
CH>2>CH>2>
> >>H+>>
> HOCH>2>CH>2>OH
\ /
O
окись
Химические свойства гликолей
Так же как и одноатомные спирты, гликоли могут иметь первичные, вторичные и третичные гидроксилы. Этиленгликоль – двупервичный спирт, пропиленгликоль – первично-вторичный, пинакон – двутретичный. Всё сказанное о свойствах первичных, вторичных и третичных спиртов приложимо и к соответствующим гликолям.
Гликоли легко образуют хлорангидриды и бромгидрины при действии HCl или HBr, но второй гидроксил замещается на галоген труднее (лучше действием PCl>5> или SOCl>2>).
При действии кислот гликоли дают два ряда сложных эфиров:
O O O
║ ║ ║
HOCH>2>─CH>2>─O─C─R R─C─O─CH>2>─CH>2>─O─C─R
При окислении первичных гликолей образуются альдегиды. Так, окислением этиленгликоля получают глиоксаль:
[O] [O]
HOCH>2>─CH>2>OH → HOCH>2>─C=O → O=C─C=O
│ │
H H H
Дегидратация гликолей (кислотами или хлористым цинком) приводит к образованию альдегидов (или кетонов). Считают, что механизм этой дегидратации состоит в том, что сначала путём отрыва одной гидроксильной группы протоном образуется карбониевый катион, а затем атом водорода вместе со своей парой электронов (в виде гидрид-иона) перемещается к карбониевому углероду (гидридное перемещение):
H
+ │
CH>2>─CH>2> → CH>2>─CH → CH>3>─CH + H+
│ │ │ ║
H+ OH OH O O
│
H
При дегидратации пинаконов мигрирует не водород, а метильная группа и происходит пинаколиновая перегруппировка, сопровождающаяся изменением углеродного скелета:
СН>3> СН>3> СН>3>> > СН>3>> > СН>3>
│ │ │ │
СН>3>─C С─СН>3> → С+─С─СН>3> → СН>3>─С ─ С─СН>3> + Н+
│ │ │ ║
ОН ОН СН>3> О СН>3>> >> >О
Н+ │ пинаколин
пинакон Н
Альдегиды в кислой среде ацетилируют 1,2-гликоли, образуя циклические ацетали (в кислой, но не щелочной среде в результате гидролиза ацеталя регенерируются исходные вещества):
 СН>2>─О
СН>2>─О
С Н>2>─ОН
Н+
Н>2>─ОН
Н+
│
 + О=С─СН>3>
С─СН>3>
+ О=С─СН>3>
С─СН>3>
С Н>2>─ОН
│ Н+,
Н>2>О
Н>2>─ОН
│ Н+,
Н>2>О
Н СН>2>─О
ацеталь
1,3-Гликоли способны реагировать подобным образом, давая шестичленные циклические ацетали.
Для осуществления реакций ацетилирования необходима возможность приведения обоих гидроксилов в одну плоскость, т.е. возможность свободного вращения вокруг углерод-углеродной связи:
НО─С
│
С─ОН
Это условие соблюдается у гликолей с открытой цепью, но не всегда у циклических.
Многоатомные спирты
Трёхатомные спирты – алкантриолы
Единственным важным представителем алкантриолов является глицерин (пропантриол-1,2,3). Это очень вязкая бесцветная сладкая жидкость; т. пл. 17°С, т. кип. 290°С.
Глицерин был получен гидролизом жиров, которые являются сложными эфирами глицерина и высших гомологов уксусной кислоты (и их олефиновых изологов). При гидролизе жиров перегретым паром глицерин остаётся в водном растворе, который отделяют от слоя расплавленных жирных кислот; после отгонки воды из этого раствора может быть выделен глицерин.
Некоторое количество глицерина образуется при брожении сахаров.
В настоящее время осуществлён промышленный синтез глицерина из пропилена, выделяемого из газов крекинга нефти. Этот синтез является доказательством строения глицерина как пропантриола.
Сначала путём хлорирования пропилена при высокой температуре (500°С) получают хлористый аллил, сохраняющий двойную связь (реакция Львова):
СН>2>=СН─СН>3> + Сl>2> → CH>2>=CH─CH>2>Cl + HCl
Затем присоединением хлора и воды хлористый аллил превращают в 1,3-дихлорпропанол-2
Cl OH Cl
│ │ │
CH>2>=CH─CH>2>Cl + Cl>2> + H>2>O → CH>2>─CH─CH>2> + HCl
гидролиз которого даёт глицерин:
Cl OH Cl ОН ОН ОН
│ │ │ │ │ │
CH>2>─CH─CH>2 >+ 2Н>2>О → CH>2>─CH─CH>2 >+ 2HСl
1,3-дихлорпропанол-2 пропантриол-1,2,3
(глицерин)
Глицерин даёт с кислотами три ряда сложных эфиров: моно-, ди- и триэфиры. Для первых и вторых возможны изомеры: продукты этерификации по первичным и вторичным группам. При действии HCl на глицерин получается смесь двух монохлоргидринов глицерина, содержащая больше α-монохлоргидрина СН>2>ОН─СНОН─СН>2>Cl и меньше β-изомера СH>2>OH─CHCl─CH>2>OH. При обработке щёлочью оба изомера дают один и тот же глицидный спирт
Н>2>С─СН─СН>2>ОН
\ /
О
При обработке глицерина хлористым водородом в более жёстких условиях образуются два дихлоргидрина
СН>2>Cl─СНОН─СН>2>Cl СH>2>OH─CHCl─CH>2>Cl
при обработке щёлочью дающие эпихлоргидрин глицерина
Н>2>С─СН─СН>2>Сl
\ /
О
Являясь одновременно первичным и вторичным спиртом, глицерин, нашедший многообразное применение в органическом синтезе, при окислении образует смесь соответствующего альдегида и кетона:

 СН>2>ОН─СНОН─С=О
СН>2>ОН─СНОН─С=О
|
Н
С H>2>OH─CНОН─CH>2>OH
Глицериновый альдегид
H>2>OH─CНОН─CH>2>OH
Глицериновый альдегид
СH>2>OH─CО─CH>2>OH
диоксиацетон
Диоксиацетон может быть получен хлорированием ацетона в 1,3-дихлорацетон СH>2>Cl─CО─CH>2>Cl и гидролизом последнего. Эта реакция также подтверждает строение глицерина.
Четырёхатомные, пятиатомные и шестиатомные спирты (эритриты, пентиты и гекситы)
Эритрит (бутантетраол-1,2,3,4) встречается в свободном виде и в виде сложных эфиров в водорослях и некоторых плесенях. Синтетический четырёхатомный спирт эритрит был получен из бутадиена СH>2>=СH─CН=CH>2> следующим путём:
O O
║ ║
CН=CH>2> +Br>2> CH─CH>2>Br 2AgO CCH>3> CH─CH>2>─OCCH>3 >+Br>2>
│




 ║
║
║
║
CН=CH>2> CH─CH>2>Br CH─CH>2>─OCCH>3>
║
O
O O O O
║ ║ ║ ║
CHBr─CH>2>─OCCH>3 >2AgOCCH>3> CH>3>CO─CH─CH>2>─OCCH>3 >+4H>2>O
│ │
CHBr─CH>2>─OCCH>3 >CH>3>CO─CH─CH>2>─OCCH>3>
║ ║ ║
O O O
2CH>2>─CH─CH─CH>2>
 │ │ │ │
│ │ │ │
OH OH OH OH
Стереоизомерные эритриты – твёрдые, отлично растворимые в воде, сладкие на вкус вещества.
Пентаэритрит (тетраоксинеопентан) С(СН>2>ОН)>4> в природе не встречается. Это твёрдое высокоплавкое (т. пл. 262°С) вещество. Получается синтетически взаимодействием формальдегида с водным раствором ацетальдегида в щелочной среде:
Ca(OH)>2>
С Н>3>─С=О
+ 4НСН=О + Н>2>О C(CH>2>OH)>4>
+ H─C─OH
Н>3>─С=О
+ 4НСН=О + Н>2>О C(CH>2>OH)>4>
+ H─C─OH
│ ║
H пентаэритрит O
муравьиная кислота
Пентиты и гекситы
CH>2>─CH─CH─ СН─CH>2 > CH>2>─CH─CH─ СН─СН─CH>2>
│ │ │ │ │ │ │ │ │ │ │
OH OH OH OH ОН OH OH OH OH ОН ОН
пентит гексит
Твёрдые, растворимые в воде вещества, сладкие на вкус. Для каждого из спиртов известно много стереоизомеров. Некоторые пентиты и гекситы встречаются в природе, например пентит адонит (в Adonis vernalis), стереоизомерные гекситы – маннит, дульцит, сорбит, идит. Все они имеют нормальный углеродный скелет и могут быть получены восстановлением соответствующих сахаров, которые являются их моноальдегидами.
НЕПРЕДЕЛЬНЫЕ СПИРТЫ
Одноатомные ненасыщенные спирты.
Олефины не могут нести гидроксил при углероде во втором валентном состоянии.
\ \
Структуры С=С─ неустойчивы и изомеризуются в С─С─ (правило Эльтекова ―
/ │ /│ ║
ОН Н О
Эрленмейера). Лишь в некоторых случаях такая изомеризация в заметной степени обратима и мы имеем дело с таутомерным равновесием:
\ \
С=С─ С─С─
/ │ /│ ║
ОН Н О
Для структур, в которых не несущий гидроксила непредельный атом не связан с электронооттягивающими группами (─ С─, NO>2 > и др.), правило Эльтекова-Эрленмейера
║
О
Имеет полную силу. Поэтому виниловый спирт и его гомологи не существуют, а при попытках их получить – перегруппировываются в ацетальдегид (и соответственно его гомологи) или в кетоны:
СН>2>=СН → СН>3>─ С─Н
│ ║
ОН О
Причина перегруппировки – проявление того же (мезомерного) эффекта, что и в хлористом виниле, но в этом случае подходящего до конца – до полной передачи электронных пар – и являющегося таким образом +Т-эффектом:
Н Н Н
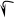
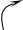
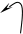 │ >**> _
│ │
│ >**> _
│ │
С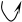
 Н>2>=С─
О─Н → СН>2>─С=О Н+
→ СН>3>─ С=О
Н>2>=С─
О─Н → СН>2>─С=О Н+
→ СН>3>─ С=О
**
Эффект этот протонизирует водород гидроксила и создаёт у второго ненасыщенного атома углерода с его δ зарядом удобное место атаки для иона водорода. В результате происходит изомеризация – переход протона к углероду.
Однако алкоголяты, а также простые и сложные эфиры винилового спирта не только существуют, но в последних двух случаях даже используются в промышленном масштабе в качестве мономеров. Разумеется, их приходится получать не прямым путём. При действии металлического лития или натрия в растворе в жидком аммиаке на ртутное производное ацетальдегида получаются алкоголяты винилового спирта (И.Ф. Луценко):
ClHgCH>2>─C=O + 2Me → CH>2>=C─OMe + MeCl + Hg, где Me = Li или Na.
│ │
H H
Простые и сложные виниловые эфиры получают присоединением к ацетилену спиртов (в присутствии КОН) и карбоновых кислот (в присутствии солей двухвалентной ртути, кадмия, цинка):
KOH
 ROH + HC≡CH
RO─CH=CH>2>
ROH + HC≡CH
RO─CH=CH>2>
Me2+; 70°C
 R─C─OH + HC≡CH
R─C─O─CH=CH>2>
R─C─OH + HC≡CH
R─C─O─CH=CH>2>
║ ║
O O
И з
виниловых эфиров особенно важен
винилацетат, полимеризующийся
гомолитически в поливинилацетат.
Последний используется для получения
прозрачных пластмасс, в производстве
триплекса (склеивание слоёв силикатного
стекла) и для получения поливинилового
спирта гидролизом поливинилацетата:
nCH>3>COOCH=CH>2
>
з
виниловых эфиров особенно важен
винилацетат, полимеризующийся
гомолитически в поливинилацетат.
Последний используется для получения
прозрачных пластмасс, в производстве
триплекса (склеивание слоёв силикатного
стекла) и для получения поливинилового
спирта гидролизом поливинилацетата:
nCH>3>COOCH=CH>2
>
 H>2>O
H>2>O
…

СН>2>─СН─ CН>2>─СН─
─… …
─СН>2>─СН─СН>2>─СН─
─…─
СН>2>─СН─ CН>2>─СН─
─… …
─СН>2>─СН─СН>2>─СН─
─…─
│ │ │ │
СН>3>С─О CН>3>С─О ОН ОН
║ ║
O O n /3 n/3
поливинилацетат оливиниловый спирт
Аллиловый спирт СН>2>=СН─СН>2>ОН – наиболее простой из непредельных спиртов с удалённым от двойной связи положением гидроксильной группы – по свойствам гидроксила мало отличается от алканолов. Само собой разумеется, что наличие двойной связи обусловливает его непредельные свойства и ряд характерных для непредельных углеводородов реакций. Промышленный способ получения аллилового спирта – гидролиз хлористого аллила, получаемого хлорированием пропилена при высокой температуре:
+OH-
C
 H>2>=CH─CH>3>
+ Cl>2> CH>2>=CH─CH>2>Cl
CH>2>=CH─CH>2>OH
H>2>=CH─CH>3>
+ Cl>2> CH>2>=CH─CH>2>Cl
CH>2>=CH─CH>2>OH
HCl
Ацетиленовые спирты
Эти вещества не получили большого значения и изучены сравнительно мало. Назовём из них один пропаргилловый спирт СН≡С─СН>2>ОН, который в настоящее время проще всего получают по методу Реппе:
CuC≡CCu
 НС≡СН + СН>2>О СН≡С─СН>2>ОН
НС≡СН + СН>2>О СН≡С─СН>2>ОН
Ацетилен
Он обладает обычной спиртовой функцией, при замене гидроксила способен к аллильной перегруппировке; имея ацетиленовый водород, может замещать его, как и ацетилен, на металлы, в частности на серебро и медь.
Бутиндиол НОСН>2>─С≡С─СН>2>ОН используется при получении бутадиена-1,3:
H>3>PO>4>
Н ОСН>2>─С≡С─СН>2>ОН
Н>2>С——СН>2>
ОСН>2>─С≡С─СН>2>ОН
Н>2>С——СН>2>
- H>2>O │ │
H>2>C CH>2>
> > \ /
O
NaPO>3>
Н >2>С——СН>2
> CH>2>=CH─CH=CH>2>
>2>С——СН>2
> CH>2>=CH─CH=CH>2>
│ │ - H>2>O
H>2>C CH>2>
\ /
O
АРОМАТИЧЕСКИЕ ОКСИСОЕДИНЕНИЯ
ФЕНОЛЫ
Термин «фенолы» происходит от старинного названия бензола «фен», введённого Лораном (1837 г.), и обозначает ароматическое вещество, содержащее гидроксил, связанное непосредственно с углеродом ароматического ядра. Фенолы, как и спирты могут содержать в своём составе, как одну, так и несколько гидроксильных групп. В зависимости от чиисла гидроксильных групп в молекуле различают одно, двух, трёх и многоатомные фенолы.
Структура и номенклатура.
Фенолы обычно называют как производные простейшего члена этого ряда фенола. Для метилфенолов имеется специальное название крезолы.
OH OH OH OH OH OH











 Cl
OH гидрохинон
Cl
OH гидрохинон
CH>3 > OH
Фенол охлорфенол мкрезол пирокатехин резорцин OH
OH OH



 Br Br
Cl
Br Br
Cl
Br NO>2> 2,4,6 трибромфенол 2хлор4нитрофенол
Физические свойства.
Табл. Фенолы
|
Фенол |
Т. плавления, °С |
Т. кип., °С |
Плотность, г/см3 |
|
Фенол Крезол о-, или 1,2- м-, или 1,3- п-, или 1,4-
|
41 30 11 36 |
182 191,5 202,8 202,5 |
1,072 1,0465 1,034 1,035 |
Простейшие фенолы представляют собой жидкости или низкоплавкие твёрдые вещества; изза образования водородных связей они обычно имеют высокие температуры кипения. Сам фенол заметно растворим в воде (9г. на 100г. воды), изза оразования водородных связей с водой; большинство других фенолов практически не растворимы в воде. Фенолы бесцветные вещества, если только они не содержат каких либо групп, обусловливающих появление окраски.
Простейший из фенолов – оксибензол (собственно, фенол) и его гомологи: о-, м- и п-крезолы содержатся в каменноугольной смоле. Дополнительные количества фенола, мировое потребление которого достигает миллионов тонн, получаются из бензола. Для этого используется (всё в меньших масштабах) старый метод щелочного плавления соли бензолсульфокислоты: 300 C
C >6>H>5>SO>3>Na
+ Na OH C>6>H>5>OH + Na>2>SO>3>
>6>H>5>SO>3>Na
+ Na OH C>6>H>5>OH + Na>2>SO>3>
Некоторое количество фенола получают гидролизом хлорбензола перегретым паром (450-500°С) над катализатором – силикагелем, промотированным ионами Cu2+ (Рашиг):
Силикагель: Cu2+
C >6>H>5>Cl
+H>2>O C>6>H>5>OH
+HCl
>6>H>5>Cl
+H>2>O C>6>H>5>OH
+HCl
Наибольшие перспективы развития имеет разложение перекиси кумола (изопропилбензола) разбавленными кислотами. Процесс состоит в следующем:
ООН
│
СН>3>─ СН─СН>3 >СН>3>─ С─СН>3>

 Н+
│ О>2>
│
Н+
│ О>2>
│



 + СН>3>─СН=СН>2> →
→ →
+ СН>3>─СН=СН>2> →
→ →
ОН
│
→ + СН>3>─ С─СН>3>
> > ║
О
Фенол – слабая кислота с константой диссоциации при комнатной температуре в водном растворе 1,3∙10-10.
Таким образом, он на несколько порядков кислее воды, не говоря уже о жирных спиртах, но гораздо слабее уксусной кислоты (1,8∙10-5). Фенол умеренно растворим в воде (8% при 15°С). Вода растворяется в феноле с образованием жидкого при комнатной температуре раствора. Сам фенол – бесцветное легкоплавкое (+41°С) кристаллическое вещество, вследствие окисления розовеющее на воздухе. Крезолы менее, чем фенол растворимы в воде, подобно фенолу хорошо растворимы в эфире, спиртах, хлороформе, бензоле.
Фенолы хорошо растворяются в водных растворах щелочей в результате образования фенолятов щелочных металлов:
A
 rOH
+ NaOH ArO- Na+ + H>2>O
rOH
+ NaOH ArO- Na+ + H>2>O
Гидролиз фенолята (обратная реакция) вследствие слабости кислотных свойств фенола заходит далеко, и требуется избыток щёлочи, чтобы сместить равновесие вправо. Уже двуокись углерода выделяет фенол из раствора фенолята.
Кислотные свойства фенольного гидроксила вызваны мезомерным взаимодействием с ароматическим ядром, что выражается символами:
H
 H+
H+ H+
H+
H+ H+
O O O O



 ║ >*>
║ >*>
║
║ >*>
║ >*>
║






 *
*
*
*
* *
Валентные электроны атома кислорода (в том числе и связывающие водород с кислородом) оказываются частично рассредоточенными в орто- и пара-положения бензольного ядра, а водородный атом гидроксила – протонизированным. Таким образом, бόльшая кислотность фенола (сравнительно со спиртами) – это другая сторона сильного орто-пара-ориентирующего действия гидроксила в реакциях электрофильного замещения
Реакции гидроксила фенолов
Образование фенолятов (см. выше).
Образование простых эфиров фенолов алкилированием фенолятов:
ArONa + RI → ArOR + NaI
ArONa + (CH>3>O)>2>SO>2> → ArOCH>3> + CH>3>O─SO>2>ONa
Образование сложных эфиров фенолов (в отличие от сложных эфиров спиртов) не может быть достигнуто взаимодействием их с кислотами, а только ацилированием фенолов (лучше в щелочной среде) галоидангидридами или ангидридами кислот:
A rONa
+ Cl─ C─R ArO─ C─R + NaCl
rONa
+ Cl─ C─R ArO─ C─R + NaCl
║ ║
O O
O=C─R
│
A rONa
+ O ArO─C─R + R─ C─ONa
rONa
+ O ArO─C─R + R─ C─ONa
│ ║ ║
O=C─R O O
Замещение гидроксила на хлор при действии PCl>5> протекает гораздо труднее, чем для спиртов, и с плохим выходом. В этом случае происходит главным образом хлорирование в ядро, причём PCl>5> превращается в PCl>3>. С PCl>3> в малой степени идёт замещение гидроксила на хлор, а в большей степени – образование трифенилфосфита (эфира фосфористой кислоты). С хлорокисью фосфора POCl>3> образуется фениловый эфир фосфорной кислоты.
При перегонке с цинковой пылью фенолы превращаются в углеводороды:
ArOH + Zn → ArH + ZnO
Реакции ароматического ядра фенолов
Гидроксил – один из сильнейших, а в щелочном растворе сильнейший орто-пара-ориентант. В соответствии с этим для фенолов легко проходят реакции электрофильного замещения.
Механизм электрофильного замещения в фенолах обычно отличается от замещения в бензоле, его гомологах и даже в эфирах фенолов. Это отличие связано с лёгкостью гетеролиза связи О─Н, поскольку вместо нестабильного и заряженного σ-комплекса промежуточно получается сравнительно устойчивое соединение с хиноидной структурой типа I:
 OH
O
OH
OH
O
OH
 (1) ║
(2)
(1) ║
(2)








 + A+
+ A+
/\
H A A
I
При этом установлено, что для большинства реакций фенолов первая стадия – быстрая и обычно обратимая, а вторая – медленная. В ряде случаев соединения типа I были выделены в свободном виде, правда, только для тех фенолов, в которых заняты все орто- и пара-положения (в случае обычных фенолов ароматизация совершается слишком быстро). Например:
OH O
B
 r
Br
Br ║ Br
r
Br
Br ║ Br




 HNO>3>
HNO>3>
 H>3>C
NO>2>
H>3>C
NO>2>
Br
Если в феноле о и пположения заняты, то может происходить (особенно при нитровании) замена имеющихся заместителей на другие группы. Лёгкость такого замещения увеличивается в следующей последовательности: Br<SO>3>H<H. Замена карбоксильной группы происходит даже при азосочетании.
Галогенирование фенолов.
В неводной среде галогенирование фенолов при соответствующих соотношениях реагентов приводит к смеси о- и п-галогенфенолов, далее к 2,4-дигалогенфенолам и, наконец, к 2,4,6-тригалогенфенолам (их лучше получать в водной щелочной среде). В случае орто- и пара-замещённых фенолов, например крезолов, занятые заместителем (например, метилом) места галогенированием не затрагиваются.
Бромирование фенола избытком бромной воды проходит по схеме:
OH OH O




 Br
Br Br ║ Br
Br
Br Br ║ Br






 +3Br>2
>
+Br>2>
+3Br>2
>
+Br>2>
 3HBr
HBr
3HBr
HBr
Br Br Br
Ориентирующая сила гидроксила, т.е. сообщение гидроксилом нуклеофильной активности п-углеродному атому, такова, что этот углерод и после замещения связанного с ним водородного атома способен воспринять электрофильную атаку электроположительного атома брома. Присоединение второго атома брома закрепляет циклогексадиеновую структуру.
 OH
O
OH
O
B


 r
Br
Br ║ Br
r
Br
Br ║ Br
Br BrBr Br Br + Br> >+ H+
Сульфирование фенолов.
Сульфирование фенола при комнатной температуре даёт в основном о-фенолсульфокислоту, при 100°С получается п-изомер, а в более жёстких условиях – 2,4-фенолдисульфокислота.
Нитрование фенолов.
Для получения мононитрофенолов приходится нитровать фенолы на холоду разбавленной азотной кислотой (~30%-ной), лучше всего получаемой смешением водного раствора селитры с серной кислотой (чтобы избежать присутствия окислов азота). Образуется смесь о- и п-нитрофенолов, из которой о-нитрофенол удаляют отгонкой с водяным паром, а п-изомер выделяют кристаллизацией. м-Изомер приходится готовить обходным путём, например из м-нитроанилина через м-нитрофенилдиазоний. 2,4-Динитрофенол проще всего получить гидролизом 2,4-динитрохлорбензола.
Тринитрофенол, называемый пикриновой кислотой, производят в промышленном масштабе, нитруя крепкой нитрующей смесью 2,4-фенолдисульфокислоту, получаемую сульфированием фенола, без выделения её из сульфирующей массы. При этом нитруется не только свободное шестое положение, но и сульфогруппы замещаются на нитрогруппы. Наличие в феноле сульфогрупп защищает его и от окисления и от действия окислов азота.
Нитрозирование фенолов.
При действии водного раствора азотистой кислоты фенол нитрозируется в пара-положение:
НО─ + HO─N=O → HO─ ─N=O
Нитрозофенол таутомерен монооксиму п-бензохинона:
HO─ ─N=O ↔ O= =N─OН
Электрофильные замещения в фенолах с образованием углерод-углеродной связи.
Таких реакций известно много. Они используются для получения бифункциональных соединений, например фенолокислот, фенолоальдегидов и фенолоспиртов.
При нагревании фенолята натрия в токе СО>2> образуется салициловокислый натрий (реакция Кольбе):
O
 Na
OH O
Na
OH O
│
 │ C
│ C



 ONa
ONa
+ CO>2> →
При действии на фенолят натрия (избыток щёлочи) четырёххлористого углерода также образуется салициловокислый натрий, а при действии хлороформа – салициловый альдегид:
O Na
OH ONa
Na
OH ONa
 NaOH
C
NaOH
C




 + CCl>4
>O + NaCl + H>2>O
+ CCl>4
>O + NaCl + H>2>O
O Na
OH H
Na
OH H


 NaOH
C
NaOH
C



 + CHCl>3>
O + NaCl + H>2>O
+ CHCl>3>
O + NaCl + H>2>O
Действием олефинов на фенолы в присутствии льюисовых кислот получают п-алкилфенолы (частный случай реакции Фриделя-Крафтса):
ОН OH
│ ZnCl>2 > │



 + RCH=CH>2>
+ RCH=CH>2>
│
RCH─CH>3>
C синильной кислотой (или нитрилами) в присутствии хлористого водорода фенолы дают иминоальдегидофенолы или иминокетонофенолы (реакция Геша), а после гидролиза иминогруппы получаются сами оксиоксосоединения:
OH OH OH
│ HCl │ H>2>O (H+) │







 + XCN
+ XCN
│ │
X─C=NH X─C=O
(X=H, арил или алкил)
Наиболее важная реакция этого рода – реакция фенолов с формальдегидом, которая протекает в присутствии как кислот, так и щелочей. При нагревании фенола (избытка) с формалином и серной кислотой происходит бурная реакция и образуется растворимый в спиртах, ацетоне и сложных эфирах полимер линейного строения – «новолак». При щелочной конденсации фенола с избытком формалина сначала образуется легкоплавкий сравнительно низкомолекулярный полимер «резол», подобно новолаку растворимый в органических растворителях. Это – так называемый термореактивный полимер: при нагревании происходит дальнейшая конденсация свободных оксиметиленовых групп с образованием метиленовых мостов, и полимер приобретает сетчатую структуру. Получаемый «резитол» нерастворим в органических растворителях, но сохраняет некоторую пластичность. При нагревании до 150°С конденсация идёт дальше и получается химически очень устойчивый, неплавкий и нерастворимый полимер – «резит», который можно нагревать до температуры ~300°С. Таковы три стадии процесса конденсации, объединяемые названием «бакелитизация» (по имени изобретателя бакелита – Бакеланда). Обычно резол перед последующей стадии конденсации смешивают с наполнителем (минеральным типа асбеста или органическим типа древесины, лигнина, целлюлозы) или пропитывают им древесину или волокнистые материалы и затем подвергают дальнейшей бакелитизации. Этот открытый в 1909 г. тип феноло-формальдегидных пластмасс и в настоящее время сохранил своё значение.
Химический смысл протекающих процессов выражается следующей примерной схемой:
OH

 CH>2>OH
CH>2>OH
OH OH OH








 + CH>2>O OH
CH>2>
+ CH>2>O OH
CH>2>









 CH>2>OH
CH>2>OH


CH>2>OH
OH OH OH












 CH>2>
CH>2 >
CH>2>
CH>2 >
 OH
OH
 OH OH
OH OH
OH OH
OH OH















 CH>2>
…CH>2>
CH>2>
…
CH>2>
…CH>2>
CH>2>
…
 CH>2>OH
CH>2>
CH>2>OH
CH>2>
OH


 OH
OH
OH
OH








… CH>2>
… CH>2>



 CH>2>
OH
CH>2>
OH
 CH>2>
CH>2>
CH>2>

Таким образом происходит постепенное «сшивание» метиленовыми мостами всё большего количества молекул фенола в хаотически построенные макромолекулы резола, резитола и, наконец, резита. Химическая стой кость резита объясняется не только тем, что значительное количество активных орто и параположений фенола замещены метиленовыми группами, сколько тем, что в следствие полной нерастворимости бакелита реагенты могут действовать на него только с поверхности.
Алифатические кетоны в кислой среде реагируют с фенолом, образуя диnоксифенилоктаны:
CH>3 >

 (H+)
(H+)
C

 H>3>COCH>3>
+ 2C>6>H>5>OH > > HO
C
OH
+ H>2>O
H>3>COCH>3>
+ 2C>6>H>5>OH > > HO
C
OH
+ H>2>O
CH>3 >
Такой 2,2бис(4'оксифенил)пропан (т.н. дифенилолпропан) применяется в синтезе пластмасс повышенной теплостойкости, получаемых путём этерификации фенольных гидроксилов ароматическими двухосновными кислотами типа терефталевой.
МНОГОАТОМНЫЕ ФЕНОЛЫ
Диоксибензолы
Изомерные диоксибензолы носят следующие названия: о-диоксибензол – пирокатехин, м-изомер – резорцин и п-изомер – гидрохинон. Это хорошо растворимые в воде, твёрдые, лишённые запаха вещества.
Пирокатехин известен как продукт декарбоксилирования при нагревании пиротокатеховой кислоты, находимой в растениях:

 t C
t C
Н
 О─
─С─ОН
→ НО─ +
СО>2>
О─
─С─ОН
→ НО─ +
СО>2>

 ║
║
HO O HO
Пирокатехин – сильный восстановитель, и, окисляясь гетеролитически (например, ионом Ag+), он превращается в о-бензохинон:

 OH
O
OH
O



 [O]
[O]



 +
H>2>O
+
H>2>O
OH O
Резорцин (м-оксибензол) получают в технике сплавлением со щёлочью м-бензолдисульфоната натрия:



 SO>3>Na
ONa
SO>3>Na
ONa

 + NaOH
+ 2Na>2>SO>3>
+ NaOH
+ 2Na>2>SO>3>


SO>3>Na ONa
Резорцин устойчивее своих изомеров к окислению. Кислотные его свойства выражены сильнее, чем у фенола. Уже водородом в момент выделения (амальгама натрия и вода) он восстанавливается в дигидрорезорцин (циклогександион-1,3):

 OH O
OH O

H>2>C
CH>2>
H>2>C
CH>2>



 + 2H
+ 2H
 H>2>C
O
H>2>C
O
OH CH>2>
Резорцин ещё легче, чем фенол, воспринимает разнообразные электрофильные атаки, так как обе его гидроксильные группы осуществляют согласованную ориентацию. Поэтому резорцин легко галоидируется, сульфируется, нитруется, нитрозируется и пр. Одно из его главных применений – синтез азокрасителей, в котором он служит азосоставляющей.
При исчерпывающем нитровании резоцина получается тринитрорезорцин, стифниновая кислота:
OH


 O>2>N
NO>2>
O>2>N
NO>2>
OH
NO>2>
во многом напоминающая пикриновую кислоту. Для карбоксилирования резоцина достаточно нагреть его в растворе бикарбоната натрия:
ONa OH




 + CO>2>
+ CO>2>
 ONa OH
ONa OH
O=COH
Получаемое соединение носит название резоциловой кислоты.
Гидрохинон получают восстановлением п-бензохинона:

 О= =О +
2Н
НО─ ─ОН
О= =О +
2Н
НО─ ─ОН
Как и пирокатехин, гидрохинон – сильный восстановитель, при окислении образующий п-бензохинон.
Пирокатехин и гидрохинон применяются как фотографические проявители, восстанавливающие бромистое серебро до металла.
Полиоксибензолы
Смежный триоксибензол называется пирогаллолом, так как получается пиролизом (декарбоксилированием) галловой кислоты:

 HO
HO
HO
HO



H
 O
COH
HO
+ CO>2>
O
COH
HO
+ CO>2>
 ║
║
HO O HO
выделяемой из продуктов гидролиза дубильных веществ типа танина.
Пирогаллол в щелочных растворах легко окисляется даже кислородом воздуха, поэтому такие растворы используются для поглощения кислорода. В фотографии пирогаллол применяется как проявитель.
Симметрический триоксибензол – флороглюцин в виде его производных очень распространён в растительном мире.
Обычно флороглюцин получают гидролизом симметрического триаминобензола (его готовят восстановлением тринитробензола):
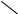 H>2>N
HO
H>2>N
HO

 H+
H+


 NH>2
>+ 3H>2>O
OH
+ 3NH+
NH>2
>+ 3H>2>O
OH
+ 3NH+
H>2>N HO
По свойствам флороглюцин похож на резорцин.
1,2,4-Триоксибензол можно синтезировать, присоединяя к п-бензохинону уксусный ангидрид и гидролизуя образовавшийся ацетет.
Гексаоксибензол получают подкислением продукта соединения металлического калия и окиси углерода:
OK OH



 KO
OK HO
OH
KO
OK HO
OH



 H+
H+


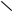


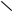 6СО + 6К
+ 6K+
6СО + 6К
+ 6K+
KO OK HO OH
OK OH
1