Болезнь Альцгеймера: симптоматология и терапия (работа 2)
Некогнитивные психические расстройства при болезни Альцгеймера: симптоматология и терапия
Многие
годы исследователи деменций основное
внимание уделяли клинике и терапии
нарушений памяти и когнитивного дефицита
и в меньшей степени нередко сопровождающим
деменцию некогнитивным расстройствам,
таким как различные психотические
симптомы и расстройства поведения.
Однако уже при первом описании болезни
Альцгеймера (БА) А.Alzheimer отметил наличие
у пациентки не только признаков
афатоапрактоагностической деменции,
но и слуховых галлюцинаций и бредовых
идей ревности. По данным различных
авторов, некогнитивные симптомы часто
сопровождают развитие процесса
ослабоумия. Описывают широкий круг
психотических феноменов: бредовые идеи,
подозрительность, галлюцинации,
аффективные нарушения, а также различные
поведенческие расстройства: агрессию,
двигательное беспокойство, бродяжничество
и др. Именно эти симптомы в большинстве
случаев вызывают беспокойство лиц,
опекающих больного, и часто приводят к
помещению пациента в психиатрические
стационары и учреждения опеки. Известно,
что адекватное лечение подобных
расстройств у больных с деменцией может
облегчить уход за ними в домашних
условиях и отсрочить госпитализацию.
Поведенческие нарушения представляют
собой важную составляющую БА, что
подтверждается значительным усилением
внимания к этой проблеме, которое
отмечается в последнее десятилетие.
Анализ публикаций последних лет
показывает, что наиболее актуальны
следующие вопросы: как часто встречаются
поведенческие нарушения, и в том числе
психотические расстройства, у больных
деменцией, как тесно они связаны с
этиологией болезни, ее тяжестью или
иными клиническими признаками заболевания.
До сих пор неясно, являются ли некогнитивные
расстройства только следствием
интеллектуального дефицита, связаны
ли патогенетически продуктивные
психопатологические нарушения с
нейрональными изменениями, вызывающими
ухудшение когнитивных функций или же
совершенно независимые патогенетические
механизмы несут ответственность за
когнитивные и некогнитивные нарушения.
Таблица 1. Распределение больных по
клиническим формам в соответствии с
МКБ-10
|
Диагностическая рубрика МКБ-10 |
Число больных |
|
|
абс. |
% |
|
|
Деменция при болезни Альцгеймера с ранним началом F00.0 |
5 |
31,2 |
|
Деменция при болезни Альцгеймера с поздним началом F00.1 |
1 |
6,3 |
|
Деменция при болезни Альцгеймера смешанного типа F00.2 |
10 |
62,5 |
По
данным B.Reisberg и соавт., более чем у 50%
больных БА на разных стадиях заболевания
отмечаются нарушения поведения. Частота
отдельных психотических и непсихотических
симптомов при БА оценивается по-разному.
Так, по данным J.Cummings и соавт. и E.Rubin и
соавт., бредовые расстройства встречаются
примерно у 30% больных БА. А.Burns и соавт.,
обследовав 178 больных БА, выявили, что
бредовые расстройства присутствовали
у 16% больных в начале заболевания и
только у 11% на протяжении 12 мес наблюдения.
В этом же исследовании было обнаружено,
что у 13% больных БА выявляются зрительные,
а у 10% – слуховые галлюцинации. Однако
сведения о распространенности
галлюцинаторных расстройств при БА
колеблются в весьма широких пределах
от 3% до 49% (E.Rubin и соавт., 1982). Депрессивные
симптомы, по мнению большинства
исследователей, наиболее часто встречаются
у больных БА: у 63% больных, по данным
А.Burns и соавт., и у 87% пациентов, по данным
A.Merriam и соавт. Из других непсихотических
расстройств наиболее часто при БА
выявляются такие поведенческие нарушения,
как агрессия, встречающаяся с частотой
от 20% до 65%, и бродяжничество, регистрируемое
у 26% пациентов (L.Teri и соавт., 1989).
Рис.
1. Выраженность некогнитивных нарушений
у больных БА в группах респондеров и
нереспондеров по шкале BEHAVE-AD до начала
терапии кветиапином.

Рис. 2. Динамика средних суммарных показателей выраженности некогнитивных расстройств в группах респондеров и нереспондеров у больных БА до и после окончания терапии кветиапином.

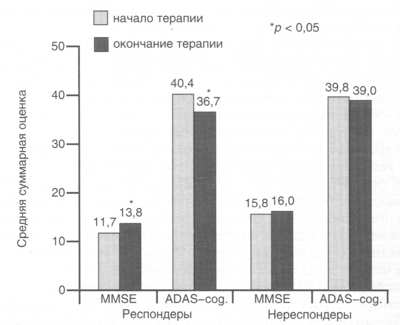
Рис. 3. Динамика средних суммарных показателей по шкалам MMSE и ADAS-cog. в группах респондеров и нереспондеров до и после окончания терапии кветиапином.
В
ряде исследований была установлена
достоверная обратная зависимость между
наличием у больных поведенческих
нарушений и выраженностью когнитивных
расстройств.
В некоторых
работах была показана связь между
некогнитивными расстройствами у больных
БА с изменениями определенных анатомических
структур мозга. Так, J.Cummings и соавт. (1995)
отметили связь между появлением бредовых
расстройств и вовлечением в
нейродегенеративный процесс лимбической
системы и базальных ганглиев. А.Burns и
соавт. обнаружили, что у больных БА с
бредовыми и депрессивными нарушениями
расширение боковых желудочков менее
выражено по сравнению с больными, не
имеющими таких расстройств. Установлено
также, что у больных с деменцией с
агрессивным поведением наиболее выражена
атрофия височных долей, а повышенная
речевая активность коррелирует с
расширением третьего желудочка и
атрофией лобных и затылочных долей.
Исследования с использованием
позитронно-эмиссионной томографии
показали, что у больных с поведенческими
нарушениями затронуты паралимбические
области лобной и височной коры. В
частности, наличие апатии у больных БА
коррелирует с большим снижением кровотока
в медиальной лобной области и в смежных
лобных и височных областях по сравнению
с больными БА без признаков апатии. У
больных БА без поведенческих нарушений
выявляются билатеральные теменные
изменения и менее выраженная патология
лобных и передневисочных областей.
Таблица
2. Средние показатели (M±SD) выраженности
некогнитивных расстройств в группах
респондеров и нереспондеров у больных
БА до и после лечения кветиапином
|
Симптомы по шкале BEHAVE-AD |
Респондеры |
Нереспондеры |
||
|
до начала терапии |
после окончания терапии |
до начала терапии |
после окончания терапии |
|
|
Параноидные и бредовые восприятия |
2,9 ± 2,5 |
0,8 ± 1,2* |
3,2 ± 4,1 |
1,6 ± 2,1 |
|
Галлюцинации |
0,8 ± 1,0 |
0,1 ± 0,3* |
1,0 ± 1,2 |
0,4 ± 0,9 |
|
Нарушение активности |
3,2 ± 2,8 |
0,5 ± 0,7** |
2,2 ± 2,5 |
0,6 ± 1,3 |
|
Агрессивность |
3,2 ± 2,2 |
0,5 ± 0,9** |
3,6 ± 3,6 |
1,2 ± 1,3 |
|
Нарушение суточного ритма |
1,4 ± 0,7 |
0,6 ± 0,5** |
2,4 ± 2,3 |
1,0 ± 1,0 |
|
Аффективные нарушения |
1,8 ± 1,5 |
0,7 ± 0,8** |
3,0 ± 1,0 |
1,8 ± 0,4* |
|
Тревога и фобии |
2,5 ± 1,2 |
1,2 ± 0,8** |
4,0 ± 2,4 |
3,4 ± 2,3 |
|
Суммарная оценка |
15,9 ± 4,5 |
4,2 ± 2,0** |
18,8 ± 7,5 |
10,2 ± 3,2* |
|
Примечание. Различия достоверны по сравнению с оценкой до начала терапии: *- p < 0,05; ** - p < 0,01. |
Лечение
некогнитивных расстройств у больных
БА является важным аспектом терапии
деменций, так как уменьшение поведенческих
и психотических нарушений нередко
улучшает и когнитивное функционирование
больных, облегчает уход за ними в домашних
условиях, тем самым способствуя продлению
догоспитального периода развития
заболевания. Для терапии некогнитивных
расстройств используют различные группы
психотропных препаратов: нейролептики,
антидепрессанты, бензодиазепины,
противосудорожные средства. Однако
наиболее часто для коррекции поведенческих
нарушений у больных с деменцией используют
нейролептики.
Применение
нейролептиков при БА признается
достаточно эффективным. Они снижают
агрессивность, беспокойство, тревогу,
враждебность пациентов, однако из-за
повышенной чувствительности к ним
наиболее пожилых больных их применение
часто ведет к возникновению побочных
эффектов и осложнений терапии.
К
числу наиболее частых нежелательных
эффектов нейролептической терапии у
больных с деменцией, в том числе
альцгеймеровского типа, относятся
экстрапирамидные побочные эффекты,
сонливость, ортостатическая гипотензия,
задержка мочи, запоры и когнитивное
снижение, связанное с терапией
нейролептиками.
По данным
W.M.Petrie и соавт., различные побочные
явления отмечены у 90% больных, получавших
нейролептическую терапию. R.Barnes и соавт.,
изучавшие сравнительную эффективность
терапии локзапином и тиоридазином
(сонапаксом) в сравнении с плацебо при
лечении поведенческих расстройств у
56 больных БА и деменцией другой этиологии,
отмечал побочные эффекты у 45% больных,
пролеченных локзапином, и 33% больных –
тиоридазином.
До сих пор не
определены эффективные и безопасные
дозы нейролептиков для пожилых больных
с деменциями. Многие исследователи
говорят о предпочтительности использования
низких доз нейролептиков. B.Reisberg и соавт.
использовали различные дозы тиоридазина
(от 10 до 250 мг/сут) для лечения поведенческих
нарушений у больных БА. Более чем у
половины больных (55,6%) был отмечен
достоверный позитивный эффект (при
средней дозе тиоридазина 55 мг/сут).
Однако при этом побочные эффекты
отмечались почти у половины больных,
включенных в исследование, наиболее
часто встречались повышенная сонливость,
сухость во рту и экстрапирамидные
расстройства.
Даже относительно
непродолжительное применение у больных
с деменцией альцгеймеровского типа
большинства известных нейролептиков,
трицеклических антидепрессантов и
бензодиазепинов сопровождается
антихолинергическими эффектами,
приводящими к усилению когнитивных
нарушений, вызванных дегенеративным
процессом в холинергических нейронах.
Таким образом, по мнению
большинства исследователей, самым
большим недостатком традиционных
нейролептиков является развитие
серьезных побочных явлений и осложнений
терапии у большого числа больных пожилого
возраста. Упомянутые побочные эффекты
в свою очередь осложняют течение
основного заболевания, приводя к усилению
когнитивных расстройств и аффективных
нарушений, что сопровождается утяжелением
социальной дезадаптации больных.
Поиск
психотропных средств, имеющих минимальные
антихолинергические эффекты, представляется
особенно актуальной задачей применительно
к лечению поведенческих и психотических
расстройств у больных БА. Поэтому
появление нового поколения атипичных
антипсихотических препаратов вносит
значительный вклад в совершенствование
современной антипсихотической терапии
деменций. Атипичные нейролептики имеют
значительное преимущество перед
традиционными, поскольку в клинически
эффективных дозах практически не
вызывают экстрапирамидных побочных
явлений. Атипичные нейролептики
воздействуют на более широкий спектр
психопатологических расстройств,
включая аффективные нарушения,
возбуждение, враждебность и собственно
психотическую симптоматику, развивающуюся
при различных формах деменций. Более
важным является то, что в терапевтических
дозах они практически не вызывают
экстрапирамидных и нейроэндокринных
побочных эффектов.
В настоящее
время в России зарегистрированы такие
атипичные антипсихотики, как рисперидон
(рисполепт), оланзепин (зипрекса) и
квеатипин (сероквель). Проведенные в
последние годы зарубежные мультицентровые
исследования по лечению этими препаратами
психотических и поведенческих расстройств
у больных деменциями различного генеза
подтвердили их высокую эффективность
и низкую частоту вызываемых ими побочных
эффектов.
Эффективность
рисперидона при лечении психотических
и поведенческих расстройств у пожилых
больных с деменцией оценивалась в двух
зарубежных мультицентровых
плацебо-контролируемых исследованиях.
В первое исследование продолжительностью
12 нед были включены 625 госпитализированных
больных БА (составивших 73% от общей
когорты больных), сосудистой деменцией
(15%) и сочетанной деменцией (12%). На этой
когорте больных проведено
плацебо-контролируемое исследование
с использованием различных доз рисперидона
(0,5, 1 и 2 мг/сут). Оценку состояния пациентов
проводили по шкале BEHAVE-AD. К моменту
окончания терапии статистически
достоверные различия в редукции
психотических и поведенческих расстройств
(по сравнению с группой больных, получавших
плацебо) были получены только в группе
пациентов, получавших рисперидон в дозе
1 и 2 мг/сут. Побочные явления, такие как
сонливость, периферические отеки,
экстрапирамидные симптомы, отмечались
чаще у больных, получавших большие дозы
рисперидона.
Второе
мультицентровое исследование эффектов
было проведено на группе 344 больных с
деменцией различного генеза. Эффективность
рисперидона (в дозе от 0,5 до 4 мг/сут)
оценивали в сравнении с аналогичными
дозами галоперидола и плацебо. Редукция
некогнитивных расстройств (психотического
и непсихотического уровня) на момент
окончания терапии оказалась достоверно
выше у больных, получавших рисперидон.
Достоверных различий в появлении
экстрапирамидных симптомов в группах
больных, получавших плацебо (у 11%) и
рисперидон (у 15%), не было установлено,
тогда как в группе больных, леченных
галоперидолом, они встречались достоверно
чаще (у 22%).
Последним препаратом
из введенных в практику атипичных
антипсихотиков является кветиапин
(сероквель). Кветиапин представляет
собой производное дибензодиазепина с
широким диапазоном аффинитета к различным
подтипам рецепторов центральной нервной
системы. Наибольшее сродство кветиапина
отмечается к 5-НТ2 серотонинергическим
при относительно низком взаимодействии
с дофаминовыми D1 и D2 рецепторами
(M.Goldstein, 1996). Наряду с этим по сравнению
с классическими нейролептиками у
кветиапина имеется низкий тропизм к
мускариновым и a1-адренергическим
рецепторам. Кветиапин проявляет
избирательность к мезолимбическим и
мезокортикальным дофаминовым рецепторам,
которые считаются ответственными за
развитие собственно антипсихотического
эффекта. В отличие от большинства
классических и некоторых атипичных
нейролептиков кветиапин оказывает
минимальное влияние на нигростриальную
дофаминовую систему, с которой связано
развитие неврологических экстрапирамидных
побочных симптомов. Все указанные
свойства позволяют считать кветиапин
эффективным антипсихотиком с относительно
благоприятным профилем побочных
эффектов.
Возможность
использования кветиапина в геронтопсихиатрии
изучали в большом мультицентровом
открытом исследовании, в котором препарат
применяли у пожилых больных (151 человек)
с различными психотическими расстройствами.
Исследование продолжалось 12 нед. Средняя
ежедневная доза составляла 100 мг/сут.
По данным D.Q.McManus и соавт., наиболее
частыми побочными эффектами, отмеченными
в период проведения исследования, были
сонливость (у 32% больных), головокружение
(14%), ортостатическая гипотензия (13%) и
ажитация (11%). Установлено значимое
улучшение состояния больных по шкалам
BPRS и CGI к концу исследования. Экстрапирамидные
побочные симптомы встречались у 6%
больных. Отдельно были проанализированы
результаты исследования в подгруппе
пациентов (40 человек) с болезнью
Паркинсона. Результаты этого анализа
показали, что кветиапин значимо уменьшал
выраженность психотической симптоматики
и не вызывал при этом ухудшения
двигательных симптомов паркинсонизма.
Более того, в период лечения кветиапином
выраженность последних расстройств
постепенно уменьшалась. Анализ
эффективности кветиапина у пациентов
с БА с симптомами враждебности (78 больных)
показал, что препарат значимо редуцировал
враждебное поведение.
В
настоящем сообщении приводятся данные
пилотного исследования эффективности
и безопасности применения кветиапина
(сероквеля) для лечения психотических
и поведенческих расстройств у больных
БА. Исследование проводили в
Научно-методическом центре по изучению
болезни Альцгеймера и ассоциированных
с ней расстройств НЦПЗ РАМН.
Клиническое
исследование выполняли как простое
открытое на невыборочной группе пациентов
с различными клиническими формами БА,
имеющих поведенческие расстройства
психотического и непсихотического
уровня. В исследование включено 16 больных
БА (3 мужчин и 13 женщин) в возрасте от 58
до 83 лет. 4 больных лечились в стационарных
условиях, 12 – амбулаторно. Распределение
больных по клиническим формам БА в
соответствии с диагностическими
рубриками МКБ-10, представлено в табл.
1.
Состояние 3 больных
соответствовало стадии мягкой деменции,
9 больных – умеренной деменции и 4 больных
– тяжелой деменции (по критериям шкалы
Clinical Dementia Rating – CDR). Средний возраст
включенных в исследование больных
составил 69,6 + 7,8 года. Длительность
заболевания колебалась от 2 до 20 лет и
в среднем составила 6,1 + 4,8 года.
Препарат
назначали в дозе 25 мг/сут (по 12,5 мг 2 раза
в день) и затем в течение последующих 5
дней дозу повышали до 50 мг/сут (по 25 мг
2 раза в день). Если на протяжении 7 дней
не отмечали улучшения в психическом
состоянии, дозу препарата повышали (не
более чем на 50 мг/сут). Максимальная
дозировка (у 1 больного) составила 200
мг/сут. Большинство больных (12 человек)
получали кветиапин в дозе 25–50 мг/сут.
До начала исследования больным не менее
чем на
48 ч отменяли
предшествующую нейролептическую
терапию. Общая продолжительность лечения
кветиапином составила 8 нед.
Клиническое
исследование выполняли по специально
разработанному протоколу с использованием
унифицированных индивидуальных карт
больных. Оценку эффективности терапии
проводили по психометрическим шкалам
ММSE, ADAS-cog. и шкалы поведенческой патологии
при БА (BEHAVE-AD).
Критериями
эффективности для итоговой оценки
результатов терапии было снижение
показателей по 1-й (симптоматологической)
части шкалы BEHAVE-AD на 50% и отсутствие или
незначительная выраженность психотических
и поведенческих расстройств после
окончания лечения по общей оценке (часть
2-я шкалы BEHAVE-AD).
До начала
терапии поведенческие нарушения,
оцениваемые по шкале BEHAVE-AD, распределялись
в исследуемой группе больных следующим
образом: параноидные и бредовые
расстройства выявлялись у 68,8% больных,
галлюцинации – у 50%, нарушение активности
– у 68%, агрессивность – у 75%, нарушение
суточного ритма, аффективные нарушения,
тревога и фобии были установлены у 87,5%
больных.
У большинства
больных бредовые расстройства отличались
фрагментарностью и ограничивались
высказываниями о "воровстве вещей",
без конкретных подозрений в адрес тех
или иных лиц (43,8%). Лишь у 2 больных
отмечались стойкие бредовые идеи ущерба,
направленные на конкретных лиц из
ближайшего окружения, а также бредовая
убежденность в том, что эти лица хотят
от них избавиться. В 2 случаях отмечены
бредовые идеи ревности в отношении
супругов. Галлюцинаторные расстройства
чаще всего были представлены зрительными
галлюцинациями (31,2%), слуховые обманы
восприятия отмечались реже – лишь у
18,8%.
Нарушение активности
проявлялось в попытках ухода из дома
или от опекающего лица (у 43,8% больных),
постоянно повторяющейся бесцельной
активностью (например, в виде перекладывания
и упаковывания вещей, постоянного
повторения одних и тех же вопросов или
просьб, многократной проверки наличия
каких-либо вещей, своей сумочки и т.д.)
у 50% больных, а также в неадекватном
поведении в виде излишней общительности
с незнакомыми людьми, оголении,
складировании предметов в неадекватных
местах и т.п. (у 50% больных).
Агрессивное
поведение практически у всех больных
проявлялось только на вербальном уровне,
и лишь у 2 больных присутствовали угроза
физической расправы и попытки нападения
на окружающих их лиц.
Нарушения
суточного ритма в основном проявлялись
частыми пробуждениями по ночам и заметным
укорочением ночного сна. Только у 2
пациентов произошла инверсия ритма
день/ночь с практически полным отсутствием
ночного сна и выраженной сонливостью
в дневное время.
Аффективные
нарушения были представлены исключительно
депрессивным настроением, у 50% больных
аффективные реакции сопровождались
плаксивостью.
Различной
степени выраженности тревога отмечалась
у 62,5% больных, фобии – у 68,8%, при этом у
50% пациентов выявлялся страх остаться
одному без опекающего его лица.
Исходная
оценка общего впечатления по шкале
BEHAVE-AD показала, что до начала терапии у
13 (81,2%) больных поведенческие нарушения
были выражены значительно, т.е. нарушения
поведения пациента приносят значительные
затруднения лицу, ухаживающему за
больным и/или их опасность для самого
больного была вероятной. У 3 (18,8%) больных
поведенческие нарушения были оценены
как умеренные, т.е. нарушения поведения
приносили определенные затруднения
лицу, ухаживающему за больным, и/или они
могли быть опасны для больного.
После
завершения терапии выраженность
поведенческих нарушений оценивалась
исследователем следующим образом:
нарушения поведения выражены умеренно
у 5 (31,2%) больных, незначительно у 8 (50%) и
отсутствуют у 3 (18,8%) больных.
Таким
образом, значимый терапевтический
эффект отмечался у 11 (68,8%) больных. У всех
этих пациентов отмечено снижение
выраженности психотических и поведенческих
симптомов на 50% и более, вследствие чего
эти пациенты были отнесены нами к группе
респондеров. Соответственно 5 (31,2%)
больных, у которых редукция средних
показателей по шкале BEHAVE-AD оказалась
меньше 50%, а общая оценка выраженности
психотических и поведенческих симптомов
к моменту окончания терапии характеризовалась
как умеренная, были отнесены к группе
нереспондеров.
Группы
респондеров и нереспондеров существенно
не отличались по возрасту (соответственно
70,2 ± 6,7 и 68,2 ± 10,7 лет) и длительности
заболевания (6,3 ± 4,7 и 5,6 ± 5,5 лет). Соотношение
больных с различной тяжестью деменции
в обеих группах существенно не различалось.
В группу респондеров вошли 2 (18,2%) больных
с мягкой деменцией, 6 (54,5%) с умеренной и
3 (27,3%) с тяжелой деменцией. В группе
нереспондеров оказались 1 (20%) больной
с мягкой деменцией, 3 (30%) с умеренной и
1 (20%) с тяжелой деменцией.
Среди
нереспондеров преобладали больные с
ранним началом БА – 3 (60%), у 2 (40%) пациентов
была сочетанная форма БА. В группе
респондеров у 8 (72,7%) больных диагностирована
сочетанная форма БА, у 1 (9,1%) – БА с поздним
началом и у 2 (18,2%) – БА с ранним
началом.
Средняя доза
кветиапина в группе респондеров составила
47,7 мг/сут, в группе нереспондеров – 90
мг/сут.
Сравнительный анализ
исходной тяжести психотических и
поведенческих нарушений в обеих группах
больных обнаружил, что в группе
нереспондеров (по сравнению с группой
респондеров) эти расстройства были
более выражены: соответственно средние
суммарные оценки по шкале BEHAVE-AD были
18,8 ± 7,5 и 15,9 ± 4,5. Кроме того, в группе
нереспондеров по сравнению с респондерами
были более выражены такие поведенческие
симптомы, как расстройства суточного
ритма, аффективные нарушения, тревога
и фобии. В группе больных, отнесенных к
респондерам, заметно более выраженными,
чем у нереспондеров, были нарушения
активности. По остальным показателям
шкалы BEHAVE-AD существенных различий между
группами респондеров и нереспондеров
выявлено не было (рис. 1).
В
процессе терапии кветиапином достоверное
улучшение суммарных средних показателей
по шкале BEHAVE-AD было установлено как в
группе респондеров, так и нереспондеров.
При этом в группе респондеров редукция
психопатологической симптоматики на
момент окончания терапии составила
73,5%, тогда как в группе нереспондеров –
только 45,7% (рис. 2).
Анализ
отдельных групп симптомов, представленных
в шкале BEHAVE-AD (табл. 2), показал, что после
окончания терапии в группе респондеров
отмечена достоверная положительная
динамика по всему спектру психотических
и поведенческих симптомов.
В
группе нереспондеров также отмечено
уменьшение выраженности психопатологической
симптоматики, однако достоверные
различия по сравнению с начальной
оценкой получены только в отношении
аффективной патологии (улучшение
настроения, снижение плаксивости).
Анализ
динамики когнитивных показателей (по
шкалам MMSE и ADAS-cog.) показал, что ни в одном
случае в процессе лечения кветиапином
не было выявлено их заметного ухудшения.
Наоборот, в группе респондеров к моменту
окончания терапии отмечено достоверное
улучшение когнитивных функций как по
шкале MMSE, так и по шкале ADAS-cog. (рис. 3). В
группе нереспондеров изменений
когнитивных функций, оцениваемых по
данным шкалам, не отмечалось.
Нежелательные
явления. Из 16 пролеченных больных
побочные явления наблюдались у 4 (25%),
однако ни в одном случае не было серьезных
нежелательных явлений. Чаще всего
больные отмечали мышечную слабость (3
человека; 18,8%), она проявлялась на 2-й
неделе терапии, а после снижения дозы
кветиапина исчезла. У 1 больного была
выявлена ортостатическая гипотензия
и еще у 1 больного – повышенная сонливость
в дневное время.
Как показали
основные результаты проведенного
исследования, кветиапин является
эффективным и безопасным средством при
лечении некогнитивных расстройств у
больных БА, о чем свидетельствует
отсутствие серьезных нежелательных
явлений, особенно, таких как экстрапирамидные
побочные симптомы.
Клиническая
эффективность кветиапина установлена
с помощью шкалы поведенческой патологии
при БА (BEHAVE-AD). Обнаружено, что в процессе
терапии кветиапином у больных БА
одинаково успешно редуцируется как
психотическая, так и поведенческая
патология. Следует отметить, что
выраженность психопатологической
симптоматики достоверно уменьшалась
при применении относительно малых доз
кветиапина от 25 до 100 мг/сут (в среднем
50 мг/сут).
При терапии
кветиапином у больных БА не только не
происходит усиления когнитивных
расстройств, но по мере уменьшения
психотических и поведенческих симптомов
наблюдается достоверное улучшение
когнитивных функций.
Таким
образом, кветиапин (сероквель) может
быть рекомендован к применению как
эффективное и безопасное средство для
лечения некогнитивных расстройств
психотического и непсихотического
уровня при БА.
Литература
к статье Колыханов, Селезнева
1.
Alzheimer A. Uber eine Eigenartige Erkrankung der Hirnrinde.
Allgemeine Zeitschrift fur Psychiatrie und Psychisch-Gerichtlich
Medicin 1907; 64: 146–8.
2. Cummings J., Miller B., Hill M.A.
et al. Neuropsychiatric aspects of multi-infarct dementia and
dementia of the Alzheimer type. Archives of Neurology 1987; 44:
389–93.
3. Rubin E., Drevets W., Burke A. The natural of
psychotic symptoms in senile dementia of the Alzheimer type. J. of
Geriatric Psychiatry and Neurology 1988; 1: 16–20.
4. Ryden M.
Aggressive behaviour in persons with dementia who live in community.
Alzheimer Disease and Related Disorder 1988; 2: 342–55.
5.
Burns A., Jacoby R., Levy R. Psychiatric phenomena in Alzheimer’s
disease. Br J of Psychiat 1990; 157: 72–94.
6. Reisberg B.,
Borenstein, Salob J. et al. Behavioral Symptoms in Alzheimer's
Disease: Phenomenology and Treatment. J Clin Psychiatry 1987; 48
(Suppl. 5): 9–I5.
7. Merriam A., Aronson N., Gaston P., et al.
The psychiatric symptoms of Alzheimer’s disease. Journal of the
American Geriatrics Society 1988; 36: 7–12.
8. Mega M.S.,
Cummings J.L., Fiorello T., Gornbein J. The spectrum of behavioral
changes in Alzheimer’s disease. Neurology 1996; 46 (1): 130–5.
9.
Swigar M., Benes F., Rothman S., et al. Behavioral correlates of CT
scan changes in older psychiatric patients. . Journal of the American
Geriatrics Society 1985; 33: 96–103.
10. Petrie W.M, Ban Т.А,
Berney S., et al. Loxapine in psychogeriatrics: A placebo- and
standard-controlled clinical investigation. J Clin Psychophamacol
1982; 2: 122–6.
11. Barnes R., Veith R., Okimoto J. et al.
Efficacy of antipsychotic medication in behaviourally disturbed
dementia patients. Am J Psychiatry 1982; 139: 1170–4.
12.
Gottlieb, G. L., McAllister, T. W., Gur, R. C. Depot neuroleptics in
the treatment of behavioral disorders in patients with Alzheimer's
disease. Journal of the American Geriatrics Society 1988; 36:
619–21.
13. Risse S. C., Lampe, T. H., & Cubberley, L.
(1987). Very low-dose neuroleptic treatment in two patients with
agitation associated with Alzheimer's disease. Journal of Clinical
Psychiatry, 48, 208.
14. DeDeyn P.P., Rabheru K., Rasmussen A. et
al. A randomized trial of risperidone, placebo and haloperidol for
behavioral symptoms of dementia. Neurology 1999; 53: 946–55.
15.
McManus DQ, Arvanitis LA, Kowalcyk BB, and the Seroquel Trial 48
Study Group. Quetiapine, a novel antipsychotic: experience in elderly
patients with psychotic disorders. J Clin Psychiatry 1999; 60:
292–8.
16. Katz I.R., Jeste D.V., Mintzer J.E. Comparison of
risperidone and placebo for psychosis and behavioral disturbances
associated with dementia: a randomized double-blind trial. J Clin
Psychiatry 1999; 60: 107–15.
17. Sailer C.F., Salama A.L.
Seroquel: biochemical profile of a potential atypical antipsychotic.
Psychopharmacology 1993; 112: 285–92.
18. Juncos J, Yeung P,
Sweitzer D, Arvanitis L, Nemeroff C. Quetiapine improves psychotic
symptoms associated with Parkinson's disease (poster). Presented at
the 37th Annual Meeting of the American College of
Neuropsychopharmacology; Las Croabas, PR; December 14–18, 1998.
19.
Schneider L., Yeung P., Sweitzer D., Arvanitis L.A. "SEROQUEL"
(quetiapine fumarate) reduces aggression and hostility in patients
with psychoses related to Alzheimer's disease (poster). Presented at
the 152th Annual Meeting of the American Psychiatric Association;
Washington, DC, May 15–20th, 1999.