Проблемы использования генетически модифицированных организмов
Предисловие
На страницах газет и других популярных изданий все чаще встречаются термины: "генетически модифицированный организм" (ГМО), "генетическая инженерия", "генетически модифицированные продукты питания".
Все эти термины по сути об одном - последних достижениях генетики. Причем эти достижения не ограничиваются просто познанием механизмов наследственности, а позволяют активно в них вмешиваться, изменять в желаемом направлении и в результате создавать новые сорта растений, обладающие полезными признаками, которые невозможно создать с помощью традиционной селекции, получать новые более эффективные лекарственные препараты. Все это стало реальностью благодаря разработке технологий, позволяющих выделять и изучать наследственный материал (ДНК), создавать его новые комбинации с помощью манипуляций, осуществляемых вне клетки, и переносить эти новые генетические конструкции в живые организмы.
В настоящее время трансгенные сорта сельскохозяйственных культур, устойчивые к гербицидам, вирусам, насекомым-вредителям, с улучшенными качественными характеристиками (улучшенный состав растительного масла) занимают посевные площади, превышающие 60 млн гектаров. Продукты питания, полученные из таких сортов, теперь уже не редкость на прилавках магазинов многих стран мира.
Но, у генной инженерии есть и другая, заставляющая насторожиться, сторона, которая связана с возможным изменением структуры генома конкретного трансгенного растения, с утечкой трансгенов и их передачей диким сородичам, с воздействием на "дикие" виды в природной экосистеме. Часто в ГМ-организм внедряется ген, отвечающий за устойчивость к антибиотикам в качестве гена-маркера. Гипотетически если такой ген резистентности к антибиотикам передастся болезнетворным бактериям, то они получат иммунитет против действия антибиотиков и тогда лечение обычными антибиотическими средствами становится менее эффективным.
В настоящее время отношение населения к генетически модифицированным продуктам далеко неоднозначно.
Потребители в США выражают в основном положительное отношение к генной инженерии, в ходе национального социологического опроса проведенного Международным Советом по информации в сфере продовольствия, установлено что 75% американцев воспринимаю применение биотехнологии как большой успех общества, 62 %американцев готовы купить ГМ-продукт, который характеризуется большей свежестью или улучшенным вкусом.
В то же время 44% европейцев рассматривают ГМ-продукты как серьезный риск для здоровья, только 22% потребителей готовы купить ГМ-продукты, а 30% европейцев и только 13 % американцев являются противниками технологии рекомбинации ДНК и считают, что эта технология не только рисковая, но и морально не приемлема.
Невзирая на длительное не восприятие европейским сообществом генно-инженерных продуктов, в настоящее время в Европейском союзе разрешение на использование в пищевых продуктах получили продуктовые компоненты из сортов генетически модифицированной сои, кукурузы и масличных культур.
Среди используемых продуктов - масла и сиропы, которые содержат "ГМ-производный материал", а также мука и крахмал. Эти компоненты могут использоваться во многих продуктах переработки, начиная с вегетарианских гамбургеров и заканчивая сухим печеньем и соусами, аналогично использованию компонентов, которые происходят из не ГМ-культур. Например, трансгенная соя входит в состав почти 60% продуктов, среди которых: колбасные изделия, пельмени, хлеб, шоколад, маргарин, мороженное, детское питание и др. На основе ГМ - компонентов производят такие пищевые добавки как: рибофлавин Е101, Е101А, карамель Е150, ксантан Е415, лецитин Е322, Е153, Е160d, Е162с, Е471, Е473, Е475, Е477, Е570, Е572, Е573, Е620-Е625 и др.
Как показали исследования "Гринпис", многочисленные компании с мировым именем используют ГМ-продукцию для производства своей продукции: "Нестле", "Кока-кола", "Данон", "Проктер энд Гембл", "Келлогс", "Юнилевер", "Макдональдс", "Симилак", "Кедбери", "Марс", "Пепси-кола", а с 2006 года к этому списку добавились: майонез "Кальве", йогурты "Эрманн", чипсы "Лейз", фасоль, горошек и другие продукты "Бондюэль".
В разных странах, особенно США, Канаде, Аргентине, трансгенные культуры занимают миллионы гектаров, и площади под этими культурами неуклонно растут.
Только в 2003 году около 7 млн. фермеров из 18 стран мира на 67,7 млн га земли (15 % всех площадей пригодных для земледелия) выращивали ГМ-растения, в настоящее время специалисты называют цифру 85 млн. га.
Растет урожайность и потребительские качества сельхозпродукции.
До сих пор однозначного ответа на вопрос о том, как влияет потребление трансгенных продуктов на здоровье людей нет.
По мнению специалистов, ответить на этот вопрос можно лишь после того как на свет появятся внуки тех, кто сегодня питается ГМО. Анализ состояния здоровья одного поколения людей не даст достоверной картины.
Знание потенциальных рисков применения ГМ источников пищи даст возможностью их исключить или снизить негативное действие.
При отсутствии контроля над генно-инженерной деятельностью, производством и реализацией ГМО теоретически риск сохраняется.
1. Особенности хранения и передачи генетической информации у живых организмов
Элементарной единицей живого является клетка - наименьшая жизнеспособная единица. По своему химическому составу все живые существа очень сходны. Основными компонентами всякой клетки являются дезоксирибонуклеиновая кислота (ДНК) - хранитель наследственной информации, рибонуклеиновые кислоты (РНК), белки, липиды и углеводы.
Изучение строения различных типов клеток позволило выявить существенные различия. По наличию ядра все организмы делятся на ядерные (эукариоты - грибы, растения, животные) и безъядерные (прокариоты - бактерии, цианобактерии). Прокариоты рассматривают как реликтовые формы, сохранившиеся с самых ранних времен биологической эволюции, а появление эукариотических форм, возникших из прокариот, - как величайший скачок в истории жизни.
Эукариоты имеют истинное ядро. Оно содержит основную часть генома эукариотической клетки. В хромосомах ДНК находится в комплексе с гистонами - белками основной природы. В эукариотической клетке имеются и другие органеллы, содержащие ДНК, - это митохондрии и пластиды (у растений), но в этих органеллах находится лишь очень малая часть клеточного генома, которая представлена молекулами ДНК, замкнутыми в кольцо. В эукариотической клетке имеются различные органеллы, выполняющие присущие только им функции.
Прокариоты не имеют окруженного мембраной ядра. ДНК в виде замкнутой в кольцо молекулы свободно располагается в цитоплазме. Эта "бактериальная хромосома" содержит всю необходимую для жизнедеятельности и размножения клетки информацию. Помимо нее у многих бактерий есть большое количество очень маленьких кольцевых молекул ДНК, называемых плазмидами. Плазмиды способны размножаться и передаваться другим бактериальным клеткам независимо от главной хромосомы. Они были впервые идентифицированы как генетические элементы, несущие гены устойчивости к антибиотикам. Впрочем, плазмиды могут удерживать и многие другие гены.
Информация о составе и строении всех веществ, в том числе и белков клетки, порядке их образования в ходе развития организма, то есть вся наследственная информация организма, закодирована в молекулах ДНК.
Каждая хромосома содержит по одной молекуле ДНК. Количество хромосом для каждого вида высших организмов является строго определенной постоянной величиной. Например, у человека 46 хромосом, у пшеницы - 42. Появление дополнительных хромосом или отсутствие какой-либо хромосомы может приводить к серьезным нарушениям в организме.
Важнейшее свойство клеток - способность делиться таким образом, что каждая из образовавшихся дочерних клеток ничем не отличается по хромосомному составу одна от другой и от материнской клетки.
Генетический код, записанный в хромосомах разных эукариотических и прокариотических организмов, универсален, несколько отличается от него только митохондриальный код.
Передача генетической информации в любой клетке основана на матричных процессах (репликации, транскрипции, трансляции).
Синтез дочерней цепи (репликация) молекулы ДНК происходит по матрице одной из двух родительских цепей с образованием новой двухцепочечной дочерней молекулы ДНК. (приложение А) При этом дезоксирибонуклеотиды встраиваются в дочернюю цепь согласно правилу комплементарности азотистых оснований (А-Т, Г-Ц).
Синтез молекулы РНК совершается в процессе транскрипции ДНК по матрице одной из двух цепей ДНК (приложение А). Такая матричная (информационная) РНК может рассматриваться как посредник между ДНК и белком.
Далее при синтезе белков генетическая информация, закодированная в последовательности триплетов азотистых оснований, транслируется в аминокислотную последовательность полипептидных цепей. Этот процесс называют трансляцией.
Биосинтез белка происходит на цитоплазматических структурах, называемых рибосомами. Рибосома, продвигается вдоль мРНК, последовательно выбирая из среды те аминокислоты, соединенные с транспортными РНК (тРНК), которые соответствуют кодирующим последовательностям нуклеотидов.
При этом последовательность кодонов в зрелой молекуле РНК определяет последовательность аминокислот в полипептидной цепи.
Ни одна клетка никогда не использует всю информацию, закодированную в ДНК ее хромосом. Клетки в организме разделяют свои функции - они специализированы. Клетки мозга не образуют инсулин, клетки печени - слюну, а клетки кожи - кости. Это же относится и к растениям: клетки корня не синтезируют зеленый пигмент хлорофилл, а клетки листа не образуют пыльцу или нектар.
Возникает вопрос: как клетка узнает, когда и какой белок синтезировать, с какого участка ДНК и в каком количестве?
Чтобы ответить на этот вопрос стоит рассмотреть схему иллюстрирующую концепцию выдвинутую в 1961 году Ф. Жакобом и Ж. Моно, которая получила название “концепции гена-оперона Жакобо-Моно”. (Приложение Б)
Согласно этой гипотезе кроме структурных генов, которые определяют последовательность аминокислот в молекуле белка, на ДНК существуют так называемые регуляторные гены или гены-регуляторы.
Участок гена-регулятора, который граничит со структурным геном называется оператором (оператор "включает" или "выключает" структурный ген). Оператор и структурные гены называются опероном.
Ген-регулятор содержит информацию о специальном белке-репресоре, который присоединяясь к оператору блокирует его активность - “выключает”. Если репресор не присоединяется к оператору, то он остается “включенным" - происходит транскрипция и синтез и-РНК с дальнейшей трансляцией.
Механизм блокирования оператора репресором довольно простой. В молекуле белка-репросора есть два активных участка. К одному из них может присоединяться молекула так называемого индуктора, а другим участком репресор присоединяется к оператору, который при этом блокирует весь оперон. Присоединение индуктора изменяет структуру репресора и он не способен присоединиться к оператору, и, таким образом, оператор “включает" структурный ген.
Функцию репресора могут выполнять продукты синтеза, которые появляются в излишке. Такие вещества носят название корепресоров.
Например, кишечная палочка синтезирует аминокислоту триптофан. При излишке этой аминокислоты она действует как корепресор, присоединяясь к белку-репресору. Потом они вместе присоединяются к гену-оператору и блокируют его активность.
В другом случае вещество, которое используется в метаболизме, присоединяется к репрессору и не дает ему возможности присоединиться к оператору. Оператор, на который теперь бездействует репрессор, “включает" синтез необходимых для метаболизма данного вещества ферментов. Примером такого механизма регуляции есть опять-таки кишечная палочка. При выращивании ее на питательной среде из глюкозы ген-оператор синтезирует соответствующий белок-репрессор. Он блокирует работу структурных генов и соответствующие ферменты не синтезируются. При внесении в питательную среду лактозы, она начинает действовать как индуктор, присоединяясь к репрессору. Оператор “освобождается” от репрессора и “включает" структурные гены, которые синтезируют ферменты для расщепления лактозы.
Более поздними исследованиями было установлено, что рядом с оператором расположен промотор. Он выполняет две функции. Первая - он предопределяет присоединение фермента (РНК - полимераза), который катализирует транскрипцию, вторая - он определяет спираль ДНК, с которой будет происходить транскрипция.
Еще один пример - функционирование гена, кодирующего образование инсулина (гормона, регулирующего содержание сахара в крови).
Специальная молекула-"посыльный", несущая сигнал о недостатке инсулина в крови, находит промотор гена, кодирующего инсулин, и присоединяется в определенном месте промотора, которое она может распознать. Это служит сигналом к включению механизма работы (экспрессии) гена. Когда инсулина в крови становится достаточно, поступает сигнал о "выключении" гена.
Селекционер, занимающийся выведением новых сортов растений или пород животных, может с помощью подбора родительских форм получить гибридное потомство, у которого активность отдельных генов выше или ниже по сравнению с обычным уровнем, характерным для какого-либо растения или животного. Это могут быть сорта картофеля с повышенным содержанием крахмала или сорта рапса, не содержащие в масле токсичные вещества типа эруковой кислоты. Но селекционер не может заставить листья того же рапса образовывать масло, которое обычно синтезируется в семенах, хотя в хромосомах клеток листа содержится вся нужная для этого информация. Конечно, можно попытаться "обмануть" растение, заставив его листья образовывать масло. Для этого необходимо у гена, кодирующего образование масло, поменять промотор, поставив его под промотор того гена, который функционирует в листьях. Однако здесь кончается традиционная селекция и начинается генетическая инженерия. [1, 2, 3, 4]
2. Способы изменения генома
2.1 Основные методы традиционной селекции: родственная гибридизация, отдаленная гибридизация, экспериментальный мутагенез
В основе традиционной селекции лежит поиск оптимального сочетания в одном организме генов, полученных от разных родительских форм. В этих целях проводят гибридизацию различных сортов или селекционных линий одного вида, обладающих какими-либо ценными признаками. Чем выше генетическая изменчивость внутри, тем, выше эффективность селекции.
Но есть виды сельскохозяйственных растений, у которых естественная внутривидовая изменчивость невысока (например, свекла). Многие ценные гены у видов культурных растений могут отсутствовать совсем (например, гены устойчивости к некоторым болезням). Поэтому в селекции получили широкое распространение методы, направленные на расширение генетического разнообразия вида с помощью экспериментального мутагенеза и отдаленной гибридизации. [2, 5]
Отдаленная гибридизация между культурными растениями и родственными дикими видами позволяет не только расширить генетическую изменчивость культурного вида, но, что наиболее важно, и привнести отдельные ценные гены от дикого вида, отсутствующие у культурного вида. Подобные скрещивания обычно являются весьма сложным делом, поскольку между видами существуют жесткие репродуктивные барьеры (невозможность развития пыльцы чужого вида, образование не жизнеспособных семян, образование фертильных семян).
Между видами существуют также жесткие барьеры, затрудняющие естественную рекомбинацию. Это означает, что хромосомы межвидового гибрида, полученные от разных видов, могут отличаться по количеству и гомологии (сходству). Отсутствие гомологии между хромосомами приводит к тому, что они не способны сближаться и обмениваться отдельными участками (а следовательно, и отдельными генами) в процессе образования половых клеток. В результате становится невозможным перенос нужных генов от дикого вида в генетический материал культурного вида. Поэтому отдаленная гибридизация может быть эффективна только в том случае, когда скрещиваются относительно близкие в эволюционном отношении виды. [5]
Проблема отсутствия рекомбинации у отдаленных гибридов может быть решена посредством удвоения у них количества хромосом. В этом случае каждая хромосома получит себе пару, и процесс образования половых клеток будет протекать нормально. Такие гибриды, объединяющие в своем геноме полные (т.е. двойные) наборы хромосом разных видов (их называют амфидиплоидами), широко распространены в природе. Наиболее известные из них - пшеница, слива. Селекционер, задумавший получить амфидиплоид с участием культурного и дикого вида, должен учитывать, что у этого гибрида помимо селекционно-ценных генов дикого вида будет присутствовать и полный набор нежелательных "дикарских" генов. Избавиться от них можно только путем возвратных скрещиваний с культурным видом, в ходе чего геном дикого вида замещается культурным и лишь отдельные ценные гены дикого вида сохраняются благодаря селекции. Однако эта процедура может быть эффективной только в случае относительно высокой гомологии хромосом скрещиваемых видов (то есть они должны быть относительно близкородственными). Круг замкнулся. Не случайно поэтому единственным амфидиплоидом, представляющим селекционную ценность из числа полученных искусственно, остается тритикале - гибрид между двумя культурными видами: пшеницей и рожью. [6, 7]
В случае экспериментального мутагенеза организм подвергается действию факторов, вызывающих различные нарушения в структуре ДНК: радиации, обработке химическими веществами, обладающими мутагенной активностью. Большинство индуцированных таким образом нарушений имеет неблагоприятные последствия для организма. Однако отдельные мутации могут быть весьма полезны с селекционной точки зрения.
2.2 Генная инженерия
Генетическая инженерия - это технология получения новых комбинаций генетического материала путем проводимых вне клетки манипуляций с молекулами нуклеиновых кислот и переноса созданных конструкций генов в живой организм, в результате которого достигается их включение и активность в этом организме и у его потомства.
Первый этап создания генно-инженерных организмов - выделение и идентификация отдельных генов (соответствующих фрагментов ДНК или РНК), которые собираются перенести другим организмам. Для этого из организмов, обладающих такими генами, с помощью специальных химических методов выделяют нуклеиновые кислоты и разрезают их на отдельные фрагменты, используя наборы ферментов - рестриктаз.
В 1973 году получена первая функционально активная молекула рекомбинантной ДНК.Г. Бойер и С. Коэн (США) сумели "пришить" к плазмиде E. coli фрагмент ДНК плазмиды другой бактерии и обнаружили, что такая химерная плазмида могла успешно функционировать в клетках E. coli, размножаться и передаваться другим клеткам как естественным путем, так и с помощью человека. Это означало, что таким образом можно получать многочисленные копии любых генов, то есть клонировать гены, нарабатывать требуемые для последующих манипуляций объемы генетического материала. В генетической инженерии в настоящее время используют различные микроорганизмы для клонирования генов, но чаще всего для этой цели привлекают хорошо изученную бактерию пищеварительного тракта человека - E. coli (кишечную палочку).
Ученые научились не только выделять и клонировать нужные гены, но и всесторонне их изучать: определять последовательности нуклеотидов в молекуле ДНК и аминокислот в белке, который кодирует ген, механизм регуляции его активности.
Все это позволило успешно осуществлять следующий этап создания генно-инженерных организмов: построение конструкций генов, которые предполагается перенести в геном реципиентного организма. Здесь не случайно речь идет о переносе не отдельных генов, а генетических конструкций, состоящих из нескольких генетических элементов: генов и регуляторных последовательностей. Как правило, конструкции собирают на основе определенных плазмид, к которым "пришивают" в нужной последовательности необходимые генетические элементы.
Как отмечалось выше, каждый ген имеет сложную систему регуляции своей активности, в отсутствие которой он просто не будет функционировать. Только для транскрипции гена (образования мРНК) обязательно наличие, помимо кодирующей области, также промотора, последовательности, обеспечивающей присоединение к мРНК поли А-хвоста, и последовательности, указывающей место окончания транскрипции. В придачу к этим обязательным элементам генетические конструкции могут содержать также регуляторные элементы, определяющие место и время активности переносимого гена (трансгена), другие гены (с соответствующими генетическими элементами), например так называемые селективные гены, с помощью которых выделяют трансформированные клетки реципиентного организма (клетки, в ДНК которых произошло встраивание трансгена) среди преобладающей массы трансформированных клеток.
Такие генетические конструкции "собирают" из фрагментов ДНК, которые могут принадлежать совершенно разным организмам, относящимся к весьма отдаленным систематическим группам, и даже с участием фрагментов ДНК, синтезированных искусственно.
Например, в плазмиду почвенной бактерии Agrobacterium tumefaciens (A, tumefaciens) встраивают ген, выделенный из ДНК рыбы (ген холодоустойчивости от камбалы), промотор у этого гена - от вируса мозаики цветной капусты, последовательности присоединения по-лиА-хвоста и окончания транскрипции (терминальные последовательности) - от A. tumefaciens, селективный ген устойчивости к канамицину - из транспозона (подвижный генетический элемент) E. coli, промотор и терминальные последовательности у этого гена те же, что и у гена холодоустойчивости. И вся эта генетическая конструкция предназначена для переноса в растительный организм.
Выбор промотора при создании трансгенных конструкций имеет особое значение. Существует общая закономерность: прокариотические промоторы могут обеспечить активность любого гена, в том числе и эукариотического только в прокариотическом организме (у бактерий, цианобактерий). В эукариотическом организме может функционировать только ген, имеющий эукариотический промотор. Поэтому при переносе генов от одного вида растений к другому можно использовать гены с их собственными промоторами. Но если в растение переносится бактериальный ген, то промотор у него должен быть заменен на растительный. В последнем случае часто используют промоторы от растительных вирусов. Вирусы по своей природе - существа исключительно активные. Ничто или практически ничто не может их остановить после того, как они нашли свою жертву (хозяина). Попав в клетку хозяина, вирусная ДНК интенсивно размножается и, клетки хозяина, активно воспроизводит себе подобных. Это происходит в силу того, что в процессе эволюции вирусы получили очень сильные промоторы, способные функционировать в любом генетическом окружении.
Проблема введения в растительную клетку чужеродной ДНК также в принципе решена. Используются два основных подхода.
Первый из них - агробактериальная трансформация. Это слегка модифицированный естественный процесс горизонтального (то есть между отдаленными в систематическом отношении группами организмов) переноса генов от бактерий в растения. В природе существует большая группа почвенных бактерий из рода Agrobacterium. Они могут вызывать у растений болезни типа рака - корончатый галл (опухоль) или "бородатые корни". Выяснено, что с помощью специального механизма бактерии передают в генетический материал растений небольшой фрагмент своей ДНК, содержащий гены, активность которых приводит к образованию у растений опухоли или многочисленных корней. В них синтезируются вещества - опины, являющиеся питательным субстратом исключительно для агробактерий. Ученые просто вырезали из переносимого фрагмента ДНК бактериальные гены, вызывающие болезнь, и заменили их нужными им генами с соответствующими регуляторными элементами. Агробактерии потом убивают с помощью антибиотиков, а из трансформированных клеток восстанавливают целое растение.
К сожалению, метод агробактериальной трансформации оказался недостаточно эффективным для большинства однодольных растений (хлебных злаков, кукурузы, лилейных и других). Поэтому для введения чужеродной ДНК в клетки таких растений чаще всего используют другой метод - бомбардировку клеток микроскопическими частицами из золота или вольфрама, на поверхность которых нанесена ДНК.
Процесс переноса и включения в генетический материал клеток растений чужеродной ДНК происходит в общем с небольшой частотой: в лучшем случае трансформированной оказывается одна клетка на тысячу. Поэтому необходимо каким-то образом отделить такие клетки от остальных, создать для их деления и дальнейшего развития наиболее благоприятные условия. В этих целях вместе с желаемым геном (например, устойчивости к насекомым-вредителям, вирусам, гербицидам) вводят и второй, так называемый селективный ген. Чаще всего для этого используют гены устойчивости к антибиотикам. Если после введения чужеродной ДНК поместить клетки на питательную среду с антибиотиком, то на ней способны будут расти только трансформированные клетки.
генетический модифицированный организм здоровье
Обычно в генетический материал клеток растений включается одна или две копии привнесенных генов. Многокопийность, как правило, сопровождается пониженной активностью привнесенных генов, а генотипы с несколькими копиями трансгенов не обладают требуемыми признаками и выбраковываются в ходе селекционного процесса. Даже в случае встраивания одной копии трансгена его активность может быть недостаточной. Поэтому получают много трансформантов, из которых отбирают лучшие по активности трансгенов и по комплексу хозяйственных признаков, без видимых мутаций и других нарушений.
Явление ослабления активности гена при увеличении числа его копий весьма широко используется в генетической инженерии для улучшения качественных характеристик сортов или пород. Так, с помощью привнесения дополнительных копий отдельных генов растений получены томаты с длительным сроком хранения, картофель с повышенным качеством крахмала (без амилозы), соя, рапс с улучшенным качеством масла, кофе без кофеина. В генетической инженерии животных таким образом снижают активность генов, ответственных за выработку белков-аллергенов (в креветках, в молоке коров, коз).
Итак, генно-инженерные организмы отличаются от исходных генотипов весьма незначительно: к 25 - 35 тысячам существующих генов добавляют один-два новых. При этом следят, чтобы активность собственных генов растения или животного не изменилась, чтобы не ухудшились его потребительские качества. [9, 10, 11, 12, 13]
3. Использование трансгенных организмов
Технологии получения ГМО позволяют значительно расширить возможности традиционной селекции. Более того, с помощью новой технологии можно получать такие организмы, которые в принципе нельзя получить, используя обычную селекцию. Она делает возможным решение проблем борьбы с болезнями, голодом, которые считались ранее практически неразрешимыми.
Например, в настоящее время в мире, по данным ВОЗ, насчитывается около 110 млн людей, страдающих диабетом. И эта цифра в ближайшие 25 лет может удвоиться. Диабет - опасное заболевание, которое вызывается нарушением работы поджелудочной железы, вырабатывающей гормон инсулин, необходимый для нормальной утилизации содержащихся в пище углеводов.
На начальных стадиях развития болезни достаточно использовать меры профилактики, регулярно следить за уровнем сахара в крови, потреблять меньше сладкого. Однако для приблизительно 10 миллионов пациентов показана инсулиновая терапия: они вынуждены ежедневно вводить в кровь препараты этого гормона.
Начиная с двадцатых годов прошлого века для этих целей использовали инсулин, выделенный из поджелудочных желез свиней и телят. Животный инсулин в основном аналогичен человеческому, однако между ними имеются и определенные различия. Так, в молекуле инсулина свиньи в отличие от человеческого в одной из цепей аминокислота треонин замещена аланином. Считается, что эти незначительные на первый взгляд отличия могут вызывать у отдельных пациентов серьезные осложнения (нарушение работы почек, расстройство зрения, аллергию). Кроме того, несмотря на высокую степень очистки, не исключена вероятность переноса вирусов от животных к людям. И наконец, число больных диабетом растет так быстро, что обеспечить всех нуждающихся животным инсулином уже не представляется возможным. Заметим также, что это весьма дорогое лекарство.
Разработка технологии производства искусственного инсулина является поистине триумфом генетики. Сначала с помощью специальных методов определили строение молекулы этого гормона, состав и последовательность аминокислот в ней. В 1963 году молекулу инсулина синтезировали с помощью биохимических методов. Однако осуществить в промышленном масштабе столь дорогостоящий и сложный синтез, включающий 170 химических реакций, оказалось сложно.
Ученым удалось осуществить в клетках E. coli биосинтез молекулы проинсулина, а не только ее отдельных цепей. Молекула проинсулина после биосинтеза способна соответствующим образом преобразовываться (формируются дисульфидные связи между цепями А и В), превращаясь в молекулу инсулина. Эта технология имеет серьезные преимущества, поскольку различные этапы экстракции и выделения гормона сведены к минимуму. При разработке такой технологии была выделена информационная РНК проинсулина. Используя ее в качестве матрицы, с помощью фермента обратной транскриптазы синтезировали комплементарную ей молекулу ДНК, которая представляла собой практически точную копию натурального гена инсулина. После "пришивания" к гену необходимых регуляторных элементов и переноса конструкции в генетический материал E. coli стало возможным производить инсулин на микробиологической фабрике в неограниченных количествах. Его испытания показали практически полную идентичность натуральному инсулину человека. Он намного дешевле препаратов животного инсулина, не вызывает осложнений.
Этот пример можно продолжить. Следует отметить, что в настоящее время технология рекомбинантных ДНК позволяет получать более дешевые и безопасные вакцины для лечения опаснейших инфекционных заболеваний (гепатита, полиомиелита и др.). Во многих случаях получение подобных вакцин традиционными методами попросту невозможно. На основе генно-инженерных биотехнологий созданы более совершенные методы диагностики и лечения болезней человека. Именно с генетической инженерией человечество связывает свои надежды на решение проблемы лечения практически неизлечимых пока болезней: рака, СПИДа, шизофрении, болезни Альцгеймера, наследственных болезней: талассемии, болезни Хантингтона, фиброзного цистита и др.
Несмотря на впечатляющие достижения генетической инженерии в области медицины, наибольший резонанс в обществе, однако, вызвало применение генетически модифицированных организмов для производства сельскохозяйственной продукции.
Любой новый, незнакомый продукт питания воспринимается с подозрением, возрастающим в случаях, когда распространяются слухи об опасности его для здоровья. Хотя в свое время бушевали страсти и вокруг обычных, но новых на то время для европейцев растительных продуктов - картофеля, кофе, кукурузы. Срабатывает принцип принятия мер предосторожности: если продукта не знаешь, лучше воздержаться от его потребления.
Сегодня о перспективах выращивания генно-инженерных сортов красноречиво свидетельствуют цифры, характеризующие их долю в общей площади под конкретной культурой. Для сои эти цифры составляет 55%, для хлопка - 21%, рапса - 16% и для кукурузы - 11%. В целом для четырех этих культур площади, занятые трансгенными сортами, составляют четвертую часть. Только в 2003 году около 7 млн. фермеров из 18 стран мира на 67,7 млн га земли (15 % всех площадей пригодных для земледелия) выращивали ГМ-растения, в настоящее время специалисты называют цифру 85 млн. га. Так, 42,8 млн гектаров (63% общей площади) приходится на США, далее следуют Аргентина - 13,9 млн гектаров (21%), Канада - 4,4 млн (6%), Бразилия - 3 млн (4%), Китай - 2,8 млн (около 4%) и Южная Африка - 0,4 млн гектаров (около 1%). На эти 6 стран приходится 99% всех посевных площадей трансгенных культур. ГМО выращивают также в Индии, Австралии, Испании, Румынии, Болгарии, Германии, Мексике, Уругвае, Колумбии, Гондурасе, на Филиппинах и в Индонезии, всего в 18 странах, заметную долю которых составляют развивающиеся страны.
Что же заставляет миллионы фермеров на всех континентах выращивать именно генно-инженерные сорта растений? Прежде всего, конечно же, рост доходов за счет снижения издержек производства и увеличения продуктивности растений. Так, только в 2002 году трансгенные сорта дали сельскохозяйственной продукции на 1,8 млрд тонн больше, чем обычные на тех же площадях, при этом пестицидов использовано на 21 тыс. тонн меньше, а доходы увеличились на 1,5 млрд долларов США.
Кроме финансовой прибыли выращивание ГМО несет ощутимые социальные и экологические выгоды. Сокращение обработки полей пестицидами и отказ от вспашки уменьшают интенсивность эксплуатации сельскохозяйственной техники и соответственно расход топлива и выбросы углекислого газа в атмосферу. Благодаря использованию менее вредных для окружающей среды гербицидов снижается химическая загрязненность воды и почвы. Предотвращается эрозия почвы, поскольку использование генетически модифицированных растений, устойчивых к гербицидам, позволяет перейти на щадящий беспахотный метод обработки почвы. Это, а также использование сортов с избирательной устойчивостью к насекомым-вредителям в условиях снижения интенсивности применения инсектицидов увеличивает биоразнообразие. На полях, занятых трансгенными сортами, отмечено увеличение численности популяций птиц, полезных насекомых.
Одной из основных проблем сельскохозяйственного производства является борьба с сорняками.
В индустриально развитых странах наряду с агротехническими мероприятиями (обработка почвы) для этих целей широко применяются гербициды, то есть химические препараты, способные тотально или избирательно подавлять рост растений.
Разработаны два способа использования гербицидов. Их применяют перед посадкой или севом растений, внося в почву либо опрыскивая тронувшиеся в рост сорняки. Однако этот способ не может в полной мере решить проблему, поскольку сорняки появляются и после всходов основной культуры, и в ходе всего периода вегетации. Кроме того, вносимые в почву гербициды, как правило, длительное время разлагаются, загрязняя окружающую среду.
Другой способ - обработка гербицидами вегетирующих растений. Он более эффективен, поскольку позволяет защищать посевы в течение всего сезона. Но при использовании гербицидов тотального действия возникают серьезные проблемы защиты культурных растений, не устойчивых к этим гербицидам. Для этого созданы специальные приспособления, позволяющие смачивать гербицидом более высокие сорные растения, не затрагивая культурные. Эта процедура значительно упрощается, если в распоряжении растениевода имеются сорта растений, устойчивые к используемому гербициду. С помощью традиционной селекции вывести такие сорта весьма сложно. В частности, не существует сортов сельскохозяйственных растений, толерантных к наиболее широко используемым гербицидам тотального действия: глифосату и глюфозинату.
Генетическая инженерия эту проблему решает довольно просто. Достаточно перенести в генетический материал растения нужный ген от устойчивых к гербицидам микроорганизмов. Ученые, изучая механизм действия гербицидов, выяснили, что чаще всего они воздействуют на один какой-либо важный для метаболизма растений фермент, связываясь с ним и таким образом ослабляя его активность. Это приводит к серьезным нарушениям роста и развития обработанных гербицидом растений, и они погибают. Среди бактерий легко можно обнаружить устойчивые генотипы, высевая их на питательную среду, в которую добавляют гербицид.
Безусловным лидером среди всех трансгенных культур является соя, устойчивая к гербициду глифосату. Появление генетически модифицированных сортов произвело настоящую революцию в технологии возделывания сои. Дело в том, что культурная соя развивается на ранних этапах вегетации весьма медленно. Да и конкурентоспособность взрослых растений тоже невысока. Это означает, что без применения гербицидов получить требуемый урожай сои практически невозможно.
Гербицид глифосат (Раундап) относится к гербицидам тотального действия. Его "мишенью" в растении является фермент 5-энолпиру-вилшикимат-3-фосфат синтаза (EPSPS), который играет важную роль в синтезе ароматических аминокислот (тирозина, фенилаланина и триптофана). Под действием гербицида у неустойчивых к нему растений наблюдаются симптомы азотного голодания (из-за недостатка названных аминокислот - "строительного материала" для синтеза белков), и они погибают в течение двух недель. Заметим, что глифосат относится к гербицидам нового поколения, для которых характерна относительная безопасность для здоровья человека и окружающей среды. Ведь его "мишень" имеется только у растений, грибов и бактерий и отсутствует у животных. Поэтому его токсичность для человека даже ниже, чем у поваренной соли. Кроме того, глифосат относительно быстро (приблизительно в течение недели) разрушается после попадания на растения или почву.
Кроме того, в полученной трансгенной сое отсутствуют селективные гены устойчивости к антибиотикам, поскольку сам ген устойчивости к глифосату можно использовать в качестве селективного. Около тысячи различных сортов устойчивой к глифосату сои, выращиваемых на разных континентах, получены с помощью традиционной селекции, в которой использовано в качестве источника мутантного EPSPS гена одно-единственное генно-инженерное растение с описанной выше генно-инженерной модификацией.
Таким образом, генетически модифицированные сорта сои отличаются от обычных только тем, что у них образуется два типа одного и того же фермента EPSPS. Первый - свой собственный, который может связываться гербицидом, и второй - привнесенный от бактерии, который не связывается с гербицидом. Именно наличие второго типа указанного фермента делает эти сорта устойчивыми к действию глифосата и сохраняет им жизнь после обработки посевов гербицидом. Уже тот факт, что бактериальный EPSPS способен выполнять функции растительного аналога, говорит об их значительном сходстве, в том числе и в смысле безопасности для здоровья человека.
Второй ключевой проблемой растениеводства является повышение эффективности контроля численности насекомых-вредителей (и других паразитов, например клещей) сельскохозяйственных культур. Для этих целей чаще всего используют пестициды - либо химические, либо биологические. Использование последних предпочтительнее с точки зрения безопасности для здоровья человека и окружающей среды. Однако эффективность химических средств защиты растений остается намного выше, чем биологических.
Среди биопестицидов широко используется так называемый Bt-токсин, который получают на микробиологических предприятиях путем культивирования почвенных бактерий - Bacillus thuringiensis. Данные бациллы были описаны в начале прошлого века, в тридцатые годы было установлено, что они способны вырабатывать токсичные для насекомых продукты, обладающие, высокой избирательностью действия. Это означает, что Bt-протеин, выделенный от одного определенного штамма бациллы, способен убивать определенный вид насекомых, например жуков, и не действует на других насекомых, например бабочек, пчел и т.д.
Избирательность обусловлена специфическим механизмом токсичности Bt-протеина. Попадая в пищеварительный тракт чувствительного к нему насекомого, Bt-протеин претерпевает изменения: под действием определенного протеолитического фермента в щелочной среде (рН 7,5 - 8,0); от исходной молекулы протеина отделяется небольшая часть (приблизительно равная одной трети молекулы), представляющая собой активную форму этого белка. Только она способна прикрепляться к специфическим рецепторам в средней части пищеварительного тракта насекомого и вызывать лизис (растворение) клеток, который приводит к образованию пор. Насекомое перестает питаться, происходит обезвоживание организма, и, в конце концов, наступает смерть. У нечувствительных к конкретным препаратам Bt-протеина насекомых описанные процессы не происходят, и Bt-протеин у них просто переваривается.
Естественно, Bt-протеин не представляет угрозы для теплокровных животных и человека, поскольку пищеварительный тракт у них устроен иначе, чем у насекомых, и у них другие протеолитические ферменты. Более того, Bt-протеин - весьма нестойкий белок, который легко денатурирует при нагревании, в кислой среде желудка, быстро переваривается желудочным соком (лишь разбавление желудочного сока в тысячу раз позволило построить кривую его деградации во времени: уже через десять минут от него не оставалось и следов). В остром эксперименте на мышах (15 дней скармливания Bt-протеина в дозах до 5 граммов на один килограмм веса) не установлено никаких отклонений в здоровье опытных особей. За почти сорокалетнюю историю использования препаратов на основе Bt-протеина не отмечено ни одного случая аллергий или его токсичности для людей, в том числе сотрудников предприятий, на которых его производят.
Особенно высокая эффективность трансгенного Bt-протеина отмечена на кукурузе и хлопке. Дело в том, что вредители этих культур - личинки мотыльков европейского точильщика кукурузы, хлопкового коробочного и розового коробочного червеца - находятся на поверхности растения в течение очень короткого времени. Затем они внедряются в ткани растения и прогрызают там ходы, нанося, таким образом, существенный урон здоровью растений и урожаю. Поскольку у трансгенных сортов Bt-протеин образуется во всех зеленых тканях растения и присутствует там постоянно, то это позволяет растению защищать себя от вредителей на протяжении всего периода вегетации. При этом трансгенный Bt-протеин высокоэффективен в исключительно низких концентрациях. Так, во всей зеленой массе кукурузы в период цветения на площади в 1 гектар содержится всего 8 - 16 граммов Bt-протеина. В конце сезона эта цифра имеет еще меньшее значение - 0,8 грамма. В зрелом зерне и в силосной массе Bt-протеин отсутствует вообще: его невозможно обнаружить даже с помощью самых чувствительных аналитических методов.
Для создания Bt-картофеля использован другой промотор - ats 1A малой субъединицы рибулозо-1,5-бифосфаткарбоксилазы любимого генетиками модельного растения Arabidopsis thaliana (мелкий сорняк из семейства Крестоцветных). Bt-ген, регулируемый фоточувствительным промотором, экспрессируется на свету в 100 раз сильнее, чем в темноте. Соответственно в клубнях Bt-протеина образуется в 100 раз меньше, чем в листьях. Если быть точным, речь идет о 0,09-0,053 микрограмма Bt-протеина на 1 грамм сырого веса клубней. Таким образом, чтобы потребить суточную дозу Bt-протеина, которую скармливали мышам в остром эксперименте (без каких-либо отрицательных последствий для их здоровья), человеку весом 70 килограммов необходимо съесть за сутки как минимум 700 тонн клубней!
Эти красноречивые данные свидетельствуют, что ни трансгенный картофель, ни трансгенная кукуруза не содержат в своем урожае продукта привнесенного им бактериального гена. То есть они полностью идентичны по своим потребительским свойствам сортам, полученным методами традиционной селекции.
Еще одной большой проблемой в выращивании культур являются вирусные болезни.
Вирусные болезни являются причиной весьма значительных потерь урожая для целого ряда культур, в первую очередь тех, которые размножаются вегетативно (клубнями, черенками, луковицами, прививкой), а также тыквенных, томатов и некоторых других. В связи с этим разработка принципиально новых подходов в борьбе с вирусными болезнями представляет большой практический интерес. Современные генно-инженерные технологии создания устойчивых к вирусам сортов растений базируются на использовании известного с незапамятных времен метода, получившего название перекрестной защиты (cross protection). Он основан на явлении повышенной устойчивости растений к агрессивным формам какого-либо вируса при условии, что оно было ранее заражено менее вредоносной формой того же самого вида вирусов. Механизм этого явления точно не выяснен, однако его достаточно широко используют в Японии для защиты томатов от поражения вирусами томатной и огуречной мозаики, в Бразилии для защиты цитрусовых (citrus tristera closterovirus), папайи (ringspot роtyvirus), кабачков цуккини.
В 1986 году Пауэл Абель с сотрудниками впервые получили устойчивые к мозаичному тобамовирусу растения табака путем переноса в их генетический материал гена этого вируса, кодирующего образование белка оболочки (coat protein - СР). С тех пор этот подход был успешно апробирован на многих растениях (свыше 30 видов) с более чем 50 вирусными СР. Позднее оказалось, что аналогичный, а иногда даже лучший результат достигается при использовании не СР-трансгенов, а генов, кодирующих другие протеины вирусов - ферментов репликазы, РНКазы.
Для генетической инженерии вирусоустойчивых форм в целях безопасности используют СР-гены, которые предварительно модифицируют таким образом, чтобы они не могли переноситься от растения к растению, либо выделяют СР-гены из естественных "нетрансмиссибельных" штаммов. Также оперируют генами от штаммов, не способных инфицировать растения в естественных условиях, либо манипулируют укороченными СР-генами, которые кодируют образование дефектных, нефункционирующих СР-протеинов. Оказалось, что можно обеспечить защиту от вирусов даже в тех случаях, когда встроен настолько дефектный СР-ген, что образовавшаяся при его считывании информационная РНК не способна к трансляции, то есть к синтезу соответствующего СР-протеина.
Из всего разнообразия полученных вирусоустойчивых форм для коммерческого использования допущены сравнительно немногие: папайя, устойчивая к вирусу пятнистости, две формы цукини, устойчивые к нескольким вирусам, и сорта картофеля с комплексной устойчивостью к колорадскому жуку (Bt-ген) и к одному из вирусов картофеля: игрек-вирусу (PVY) или вирусу скручивания листьев (PLRV).
Заметим, что описанная генно-инженерная технология защиты растений от вирусов позволяет получать сорта, в значительной мере идентичные по своим потребительским качествам сортам традиционной селекции. Человечество имеет длительную историю безопасного потребления продуктов трансгенов СР-протеинов, поскольку названные вирусные протеины постоянно присутствуют в пище из картофеля, кабачков и других растений. Более того, в обычных сортах концентрация этих белков может быть в десятки, а то и сотни раз выше, чем у трансгенных форм: ведь они-то не устойчивы к вирусам и поэтому накапливают их в своих тканях.
Одним из больших плюсов генной инженерии является улучшение сельскохозяйственных растений и их качественных характеристик.
Это группа исключительно ценных для потребителя форм, при получении которых не используются чужеродные гены. Добавляя в генетический материал растения дополнительные копии определенных генов, выделенных из собственной ДНК растения, можно добиться ослабления активности этих генов. В свою очередь это может привести к изменению качественных характеристик того продукта, в генетическом контроле биосинтеза которого задействованы данные гены.
Интересный пример использования явления "замолкания генов" - создание сортов трансгенного картофеля с улучшенным качеством крахмала. Крахмал, выделенный из обычных сортов картофеля, содержит две основные формы этого полисахарида: ветвистый - амилопектин и неветвистый - амилоза. Чем больше амилопектина и меньше амилозы, тем выше качество крахмала. Генно-инженерный сорт картофеля с повышенным качеством крахмала создан путем добавки дополнительной копии гена амилозы (в перевернутом по отношению к промотору виде, то есть в виде так называемой антисмысловой конструкции). В результате уровень менее ценной амилозы в крахмале трансгенного сорта был понижен практически до нуля.
Аналогичная "антисмысловая" генетическая конструкция использована и при создании трансгенного сорта томатов FLAVRSAVR с удлиненным периодом хранения плодов. Обычно в процессе созревания плоды томатов вскоре после покраснения постепенно теряют упругость, становятся мягкими и загнивают. Причиной этого является образование фермента полигалактуроназа, который деградирует пектин, находящийся в межклеточном пространстве плода. При создании трансгенного сорта была использована антисмысловая конструкция названного гена. В результате у полученного сорта полигалактуроназа образуется в пониженном количестве, благодаря чему спелые помидоры в течение продолжительного времени сохраняют товарный вид.
При создании трансгенного рапса с улучшенным составом масла использован более традиционный для генетической инженерии подход горизонтального переноса генов от неродственных видов. В генетический материал рапса был "подсажен" ген тиоэстеразы от калифорнийского лаврового дерева. Вследствие этого трансгенный сорт получил способность образовывать масло, в котором появились не свойственные для рапса лавровая и миристиновая жирные кислоты. Такое масло по качеству приблизилось к наиболее ценным растительным маслам: пальмовому и кокосовому.
Большой интерес представляет использование трансгенных растений в целях получения съедобных вакцин для повышения устойчивости организма человека к опасным заболеваниям.
Для этого предлагается достаточно простая схема. В генетический материал растения переносят небольшой фрагмент ДНК какого-либо патогена (чаще всего вируса). В результате в плодах такого трансгенного растения образуется определенный протеин, характерный для патогена (сам по себе он не может вызвать заболевание). При поедании этот протеин может достигать тонкого кишечника, где происходит его всасывание в кровь. Здесь он выступает в качестве чужеродного агента - антигена, к которому организм вырабатывает благодаря естественному механизму иммунитета соответствующие антитела. Теперь в случае попадания в организм активных вирусных частиц их ждет уже созданная система обороны, которая способна их обезвреживать. Используя описанную стратегию, удалось, например, получить растения бананов, поедание плодов которых индуцирует образование антител к вирусам папилломы, которые могут вызывать у людей некоторые формы рака.
Направления использования трансгенных растений могут быть совершенно неожиданными. Так, предлагается применять их для очистки почвы от загрязнений нефтью и тяжелыми металлами. Для этого в них встраивают соответствующие гены от микроорганизмов, способных утилизировать и деградировать эти вещества. В царстве микробов такие формы - не редкость. Самое удивительное, что растения табака с подобными свойствами уже получены. На очереди - создание генетически модифицированных растений, которые можно использовать непосредственно в практической деятельности, например различных древесных пород.
Как указывалось выше, растения - удобная система для производства съедобных вакцин. Оказалось, что аналогичный подход можно использовать для получения вакцин, обладающих контрацептивным (противозачаточным) действием. Для этого в их геном достаточно встроить гены, кодирующие антигены половых клеток (сперматозоидов) или половых гормонов, предлагается использовать их для относительно дешевого и гуманного регулирования численности популяций некоторых диких животных.
Ряд проектов имеет целью улучшение потребительских свойств продуктов, вырабатываемых животными или из животных. Речь, в частности, идет об улучшении качества шерсти овец, о выведении с помощью генетической инженерии пород крупного рогатого скота, в молоке которого снижена концентрация р-лактоглобулина, основного его аллергена, или изменено соотношение отдельных его белков.
Другой подход состоит в модификации отдельных генов для улучшения физико-химических свойств соответствующих протеинов молока с целью повышения содержания в нем кальция, изменения соотношения отдельных аминокислот, получения молока, сыр из которого созревает в более короткие сроки. Все это должно существенно улучшить потребительские и технологические свойства коровьего молока. Выиграют от этого и сами животные, поскольку улучшенное молоко - немаловажный фактор здоровья вскармливаемых им телят. Многие из этих подходов уже реализованы на модельных объектах (лабораторных мышах).
Свиньи с добавленным геном фитазы (один из ферментов переваривания пищи) эффективнее усваивают корма за счет лучшей усвояемости фосфора, что выражается в усилении их роста. К тому же это дает возможность в меньшей степени загрязнять окружающую среду фосфатами. Трансгенные свиноматки с добавленным им геном р-лактальбумина более эффективно вскармливают своих поросят.
В то же время конкретного практического выхода следует ожидать уже в ближайшее время в таком важном направлении генетической инженерии, как использование животных в качестве "биореакторов" для производства фармацевтических препаратов. Несмотря на то что и растения, и животные в отличие от микроорганизмов относятся к царству эукариот, тем не менее биология растительной и животной клеток все-таки существенно различается. Поэтому для производства некоторых животных рекомбинантных протеинов более целесообразно все-таки использовать животные организмы, нежели растительные. В настоящее время убедительно доказано, что с помощью молочных желез трансгенные животные способны производить всевозможные протеины, такие, как разные факторы крови, ферменты, моноклональные антитела, коллаген, фибриноген, шелк пауков и т.д.
Что может дать человечеству использование животных-биореакторов, можно проиллюстрировать на следующем примере. Совместным проектом российских и белорусских ученых предусмотрено создание системы производства двух лекарственных протеинов: проурокиназы и лактоферрина человека в молоке трансгенных коз. Проурокиназа - мощный тромболитический фермент, использование которого в первые часы после наступления инфаркта миокарда в 5 раз снижает смертность от этого заболевания. Стоимость одного курса лечения проурокиназой составляет в настоящее время около 1000 долларов США, что делает этот препарат малодоступным для большинства граждан. Между тем в таком лечении в России и Украине нуждаются более 400 тысяч кардиологических больных.
Примеров использования трасгенных организмов в разных сферах жизнеобеспечения очень много.
В приложении Б перечислены привнесенные признаки, продукты трансгенов (то есть протеины, ферменты, образующиеся в результате функционирования добавленных в растения генов), а также источники, откуда соответствующие гены были выделены.
Как видим, приведенные в примере, допущенные к использованию сорта растений, относящиеся к 16 видам, обладают 7 новыми признаками или их комбинацией. [11, 12, 13]
4. Биобезопасность генно-инженерной деятельности
4.1 Природа рисков для здоровья человека и окружающей среды связанных с ГМО
Любой трансгенный сорт растения отличается от исходного только тем, что в его генетическом материале к 25 - 30 тысячам существующих генов добавлен относительно небольшой фрагмент ДНК, в котором записана информация об одном-двух новых генах и их регуляторных элементах.
Активность этих добавленных генов в организме выражается в биосинтезе одного-двух новых для организма протеинов (ферментов или структурных белков). Поскольку генетическая инженерия может оперировать любыми генами, существующими в природе, а не только генами от организмов, состоящих в эволюционном родстве с отдельными видами культурных растений, как это делается в традиционной селекции, то продукты привнесенных генов (ферменты, протеины) могут выглядеть в генетически модифицированном организме как необычные, несвойственные, чужеродные для данного вида, которые в природе у него не встречаются.
Что касается рекомбинантных протеинов, то не во всех ГМО они являются абсолютно чужеродными, несвойственными для определенного вида соединениями.
Во-первых, существует достаточно большая группа трансгенных сортов растений, которые получены благодаря генетическим манипуляциям с их собственными генами (томаты с удлиненным периодом хранения, соя, рапс с улучшенным составом масла, картофель с улучшенным качеством крахмала, кофе без кофеина, табак без никотина и другие).
Во-вторых, многие весьма отдаленные в эволюционном плане организмы имеют большое количество идентичных путей метаболизма, и соответственно состав и строение ферментов, которые обеспечивают их реализацию, также идентичны. В качестве примера можно привести фермент EPSPS, который является ключевым в биосинтезе ароматических аминокислот у всех растений, грибов, бактерий. Бактериальный EPSPS, образующийся у трансгенной сои, толерантной к гербициду Раундап, вполне успешно выполняет соответствующие функции в растительном организме после обработки растений гербицидом, когда свой, растительный EPSPS сои дезактивирован.
Однако при оценке безопасности таких близких по функциональной активности генов следует обращать внимание не столько на сам белок - продукт трансгена, сколько на возможное изменение отдельных путей метаболизма трансгенного растения из-за повышения концентрации одного из их компонентов. В случае с тем же EPSPS при оценке безопасности генетически модифицированной сои принималось во внимание, что этот фермент катализирует реакцию, не лимитирующую конечную скорость синтеза ароматических аминокислот, поэтому, как и ожидалось, показатели их синтеза у ГМО не отличались от таковых у исходных растений.
В-третьих, последние научные данные, полученные в результате изучения строения генетического материала человека, некоторых животных и растений, существенно расширили наши представления о сходстве и отличиях генов разных систематических групп и вероятности их переноса от одной отдаленной систематической группы к другой (горизонтальный перенос генов).
Оказалось, что в геноме растения арабидопсис присутствует около сотни генов человека, в том числе таких, как ген рака молочной железы. Почвенная бактерия Agrobacterium tumefaciens регулярно переносит часть своих генов в растения, вызывая у них образование опухоли - корончатый галл. Это абсолютно естественный процесс, который с успехом используют и генные инженеры. Подобных примеров можно привести очень много.
Таким образом, то, что делают генетики, ни в коей мере не противоречит законам природы. Обмен генетической информацией между отдаленными видами в ней происходит постоянно. В отдельных случаях для этого требуются миллионы лет, а в некоторых это может происходить ежедневно и ежечасно.
Вторая основная группа рисков связана с самим фактом вставки трансгенов в генетический материал организма. Есть основания полагать, что встраивание трансгенов происходит случайным образом, то есть они могут встроиться практически в любую область молекул ДНК, содержащихся в трансформируемой клетке: в любую хромосому, любую часть хромосомы, если речь идет о высших организмах.
Чем это чревато? Прежде всего, тем, что привнесенный ген может затронуть область ДНК, которая кодирует структуру или регуляторные элементы какого-либо гена модифицируемого организма. Вероятность этого события в целом не так велика, как может показаться на первый взгляд. Дело в том, что генетический материал высших организмов устроен таким образом, что собственно генами и их регуляторными элементами занято менее 10% длины молекулы ДНК, что, как полагают, повышает стабильность, устойчивость молекулы ДНК к внешним воздействиям. Это означает, что гены на молекуле ДНК расположены не плотно один за другим, как кадры на кинопленке, а через большие промежутки, занятые некодирующими последовательностями нуклеотидов. Более того, даже в пределах кодирующих последовательностей генов (то есть той области молекулы ДНК, в которой записана информация о последовательности аминокислот в белке - продукте гена) имеются области, так называемые интроны, которые также не несут никакой генетической информации. Они вырезаются в ходе "созревания" молекулы информационной РНК, образовавшейся при транскрипции гена. Тем не менее вероятность того, что трансген может встроиться в область ДНК, уже занятую другим геном, все же существует.
Если при этом будет затронута область, кодирующая структуру поврежденного гена, то в результате продукт данного гена образовываться не будет. Этот ген как бы распадается на две неполноценные части: одна, передняя, имеет элементы, необходимые для начала транскрипции (образования информационной РНК), но не имеет терминальной последовательности, другая, задняя, имеет только терминальные элементы. К тому же обе части кодирующей области являются неполными. Очевидно, что аналогичный результат будет иметь место и в случае повреждения промотора или терминальных последовательностей.
Если затронутый ген выполняет какую-то важную функцию в организме, то отсутствие его продукта может иметь весьма печальные для него последствия, вплоть до потери жизнеспособности. Понятно, что до уровня коммерческого сорта генотипы с поврежденными генами дойти не могут в принципе.
Если в процессе встраивания будут затронуты другие регуляторные элементы - энхансеры ("усилители" активности генов) или сайлэнсеры ("замедлители"), то это может привести к изменению активности затронутых вставкой генов. Сорта растений, образующие какие-либо токсичные соединения (например, соланины картофеля) в концентрациях, безвредных для здоровья человека, в результате генетической модификации способны усилить их синтез до уровня, превышающего предельно допустимые значения. Такие генотипы уже становятся опасными для здоровья.
Наконец, третья основная группа рисков, связанных с генно-инженерными организмами, основана на неблагоприятных эффектах, вызванных переносом трансгенов другим организмам: вертикальным переносом генов от ГМО диким сородичам культурного вида или горизонтальным переносом генов, например селективных генов устойчивости к антибиотикам от генетически модифицированного растения микроорганизмам пищеварительного тракта. Здесь все понятно: гены и их продукты, безобидные у ГМО, могут оказаться весьма опасными в другой генетической и экологической среде. Так, приобретение болезнетворными бактериями пищеварительного тракта устойчивости к антибиотикам может существенно затруднить лечение болезней, которые они способны вызывать. [14,15,16]
4.2 Возможные неблагоприятные эффекты ГМО на здоровье человека
Среди потенциальных рисков для здоровья человека, связанных с использованием генно-инженерных организмов, рассматриваются следующие:
синтез новых для реципиентного организма белков - продуктов трансгенов, которые могут быть токсичными и/или аллергенными;
изменение активности отдельных генов живых организмов под влиянием вставки чужеродной ДНК, в результате которого может произойти ухудшение потребительских свойств продуктов питания, получаемых из этих организмов.
горизонтальная передача трансгенов другим организмам, в частности маркерных генов устойчивости к антибиотикам от ГМО микроорганизмам пищеварительного тракта.
Понятно, что когда говорят о рисках для здоровья человека, связанных с ГМО, имеют в виду прежде всего риски при потреблении продуктов, полученных из них или произведенных ими (например, молока от генетически модифицированных коров). Стратегия оценки безопасности генетически модифицированных продуктов питания основана на принципе "существенной эквивалентности", разработанном OECD (Организацией экономического сотрудничества и развития).
Для идентификации в новых продуктах и исходном сырье отличных от аналогов признаков, влияющих на уровень безопасности и питательную ценность пищевых продуктов, тщательному анализу подвергается информация, касающаяся характеристик исходного организма, от которого взят ген, предназначенный для трансгеноза, а также характера генетической модификации. Далее проводят сравнительный анализ генетически модифицированного организма и исходного (немодифицированного) организма. Для этого сопоставляют агрономические показатели, продукты встроенных генов, состав ключевых химических компонентов (в том числе питательных и антипитательных), профиль основных метаболитов, эффекты переработки исходного сырья.
Новый продукт (сорт растений) может быть:
эквивалентным по существенным признакам выбранному аналогу;
эквивалентным аналогу, за исключением одного (нескольких) существенного, хорошо определяемого признака;
не эквивалентным аналогу по существенным признакам.
Во 2-м и 3-м случаях проводится тщательная оценка безопасности отличных от исходного аналога признаков ГМО по таким показателям, как потенциальная токсичность, потенциальная аллергенность, возможность переноса генов устойчивости к антибиотикам микроорганизмам пищеварительного тракта, вероятность потенциального ухудшения пищевой ценности и усвоения питательных веществ.
Стратегия оценки потенциальной токсичности новых продуктов питания состоит в следующем. Если исследуемое, отличное от аналога, вещество является известным компонентом растительной пищи, имеющим длительную историю безопасного использования, исследования токсичности новых продуктов не являются обязательными.
В иных случаях осуществляются:
определение концентрации потенциальных токсинов в съедобных частях растений; установление удельного веса данного продукта в пищевом рационе определенных групп населения;
сравнение (для белков) их аминокислотной последовательности с таковой у известных токсинов и пищевых антагонистов (например, ингибиторов протеаз) по электронным базам данных;
оценка стабильности новых веществ к термической обработке;
определение скорости разрушения потенциальных токсинов в желудочно-кишечном тракте (в модельных системах);
анализ уровня токсичности новых веществ в модельных системах (культура клеток in vitro);
анализ токсичности в экспериментах по принудительному скармливанию лабораторным или домашним животным пищи, содержащей продукты, полученные из изучаемого генетически модифицированного организма, или ее новых компонентов в течение длительного времени (хронический эксперимент - продолжительность 1 - 2 года) либо в течение короткого времени, но с использованием высоких концентраций изучаемых продуктов (острый эксперимент - продолжительность около двух недель, концентрация изучаемого продукта трансгена до 5 граммов на килограмм веса животного).
Из всего многообразия трансгенных сортов можно выбрать фактически только единицы, у которых в результате генетической модификации образуются действительно новые, не характерные для обычных сортов данного вида соединения. Это ферменты фосфинотрицинацетилтрансфераза и неомицинфосфотрансфераза, которые обеспечивают дезактивацию соответственно гербицида глюфозината аммония (Либерти, Баста) и антибиотиков - аминогликозидов канамицина, неомицина, генетицина. Тем не менее и вещества, имеющие длительную историю безопасного использования, тоже проходят тщательную проверку.
В приложении В представлены некоторые из перечисленных выше характеристик белков - продуктов трансгенов, наиболее широко представленных в генно-инженерных растениях, допущенных для использования в хозяйственной деятельности.
Как видим, большинство белков - продуктов трансгенов относятся к нестойким соединениям: они легко денатурируют даже при относительно невысоких температурах (следовательно, разрушаются при переработке растительного сырья) и кислотности среды.
Все они быстро перевариваются в желудочном соке. Содержание их в растительных тканях очень низкое.
Это означает малую вероятность того, что перечисленные протеины могут вызывать аллергические реакции. Ведь для аллергенов характерны следующие признаки: устойчивость к перевариванию, к переработке, молекулярная масса 10-70 кдальтон, содержание в пище более чем 1%. Для того чтобы развилась аллергическая реакция, белок должен поступать в тонкий кишечник в практически неизмененном состоянии (там происходит его всасывание в кровь с последующим образованием антител).
Естественно, на практике обычно получают большое количество трансгенных форм, из которых в ходе последующей традиционной селекции отбирают образцы без видимых мутаций. Затем тщательнейшим образом изучают безопасность отобранных форм для здоровья человека и окружающей среды. В частности, анализируют содержание в растительном сырье как питательных так и потенциально опасных для здоровья веществ.
Так, результаты 1400 аналитических экспериментов, проведенных при изучении вышеупомянутой RR-сои (устойчивой к Раундаупу), подтвердили полную идентичность трансгенного и исходного сортов сои как по питательным, так и антипитательным свойствам.
В качестве первых фигурировали: содержание белка, жира, волокон, зольных элементов, углеводов, калорийность, влажность зерна, "питательные" свойства переработанного зерна - сухой муки, обезжиренной муки, белкового изолята, концентрата, лецитина, очищенного масла, дезодорированного масла и т.п. Не выявлено различий по специфическим жирным кислотам, аминокислотам, в частности ароматическим аминокислотам. Естественно, особое внимание было уделено "антипитательным" компонентам соевого зерна: ингибитору трипсина, лектинам, фитоэстрогенам, стахиозе и фитату. По содержанию этих веществ генетически модифицированный организм и исходная линия также не различались. Анализ "существенной эквивалентности" ГМО и исходной линии наиболее актуален для видов растений, которые в принципе могут быть опасными для здоровья человека: картофель, томаты (из-за токсичных гликоалкалоидов), хлопок (из-за токсичного госсипола) и некоторые другие.
Следующим фактором, который рассматривается в качестве потенциального неблагоприятного эффекта генетически модифицированных организмов на здоровье человека, является горизонтальный перенос трансгенов (прежде всего генов устойчивости к антибиотикам) от ГМО микрофлоре пищеварительного тракта человека и животных.
В состав любой трансгенной конструкции, как правило, входит помимо собственно трансгена и его регуляторных элементов и так называемый селективный (или маркерный) ген, необходимый для отбора трансформированных клеток. В качестве селективных генов обычно используют гены устойчивости к антибиотикам, которые уже утратили свое значение как антимикробные препараты из-за широко распространенной устойчивости микроорганизмов к этим антибиотикам.
Кроме того, вероятность переноса селективных генов из ДНК продуктов питания, полученных из генетически модифицированных организмов, к микроорганизмам пищеварительного тракта крайне низкая (она оценивается как приблизительно 10~17). Для этого требуется несколько крайне маловероятных событий: участок ДНК, содержащий селективный ген, не должен быть поврежден в процессе пищеварения, необходима гомология селективного гена или прилегающих к нему районов ДНК с ДНК хромосомы или плазмиды болезнетворной бактерии пищеварительного тракта, а для того, чтобы селективный ген экспрессировался в ней после переноса, он должен встроиться под подходящим прокариотическим промотором.
Если умножить вероятность горизонтального переноса селективного гена на возможные последствия такого переноса (появление одной новой бактерии с устойчивостью к антибиотику в придачу к тысячам уже существующих с такой же устойчивостью), то серьезно обсуждать подобные риски можно, пожалуй, только перед непросвещенной публикой в пропагандистских целях. Еще более несерьезным выглядит рассмотрение последствий переноса трансгенов или селективных генов в ДНК клеток человека: продолжительность жизни клеток эпителия пищеварительного тракта около 7 дней, никакого контакта пищи с половыми клетками человека не может быть в принципе.
Следовательно, наличие в трансгенных конструкциях селективных генов антибиотикоустойчивости не является опасным для здоровья человека и окружающей среды, но, учитывая озабоченность, а часто и неприятие общественностью этого факта, ученые прилагают усилия по разработке альтернативных селективных систем.
Так, все чаще в качестве селективных генов используют гены устойчивости к гербицидам (правда, экологи опасаются, что это приведет к росту гербицидоустойчивости сорняков), нетоксичным сахарам (типа ксилозы, маннозы, 2-деоксиглюкозы), гены индуцированной экспрессии фитогормонов и другие. Разработаны методы удаления селективных генов у трансформантов после проведения селективной процедуры или получения безмаркерных трансгенных линий с помощью котрансформации с последующим негативным отбором по селективным генам в беккроссных поколениях. [17,18, 19]
4.3 Неблагоприятные последствия высвобождения ГМО в окружающую среду
В представлении обывателя генетически модифицированные организмы ассоциируются прежде всего с якобы страшной опасностью, угрожающей здоровью населения. По мнению же специалистов, намного более существенными представляются риски для окружающей среды. Ведь первую группу рисков (для здоровья человека) можно оценить достаточно точно, чтобы их предупредить и практически полностью исключить.
В случае же с рисками для окружающей среды ситуация намного сложнее. Необходимо учитывать различные сложные взаимодействия организма и среды, многие из которых с трудом поддаются точной оценке или даже непредсказуемы. Особенно сложно бывает спрогнозировать отдаленные последствия, различные каскадные эффекты: ведь в дикой природе все взаимосвязано. Да и устранить возможные неблагоприятные последствия бывает очень сложно: если ГМО попали в окружающую среду, размножились и, что самое неприятное, передали свою генетическую информацию другим видам, то практически невозможно вернуть все в исходное состояние в случае обнаружения каких-либо неблагоприятных эффектов.
Возможны следующие неблагоприятные эффекты ГМО на окружающую среду:
разрушительное воздействие на биологические сообщества и утрата ценных биологических ресурсов в результате засорения местных видов генами, перенесенными от генетически модифицированных организмов;
создание новых паразитов, прежде всего сорняков, и усиление вредоносности уже существующих на основе самих ГМО или в результате переноса трансгенов другим видам;
выработка веществ - продуктов трансгенов, которые могут быть токсичными для организмов, живущих или питающихся на генетически модифицированных организмах и не являющихся мишенями трансгенных признаков (например, пчел, других полезных или охраняемых видов);
неблагоприятное воздействие на экосистемы токсичных веществ, производных неполного разрушения опасных химикатов, например гербицидов (значительное количество создаваемых в настоящее время ГМО - формы, устойчивые к гербицидам).
Как известно, в природе нет ничего лишнего: существует определенный баланс между отдельными видами в пределах любого биологического сообщества. Живые организмы находятся между собой в тесном контакте и взаимозависимости. Вероятность изменения биологического многообразия без вмешательства человека ничтожна. Увеличение численности популяции какого-либо вида в отдельные промежутки времени, например из-за колебаний климатических факторов, немедленно включает механизм, ограничивающий этот рост, и баланс между видами восстанавливается. Поэтому, говоря о первой группе риска из числа приведенных выше (разрушительное воздействие трансгенов на биологические сообщества), имеют в виду следующее. При переносе отдельных трансгенных признаков, прежде всего имеющих адаптивное значение в окружающей среде (устойчивость к холоду, жаре, засухе, засолению), от культурных сортов к их диким сородичам возможна ситуация, при которой последние могут приобрести дополнительные преимущества в борьбе за существование. А это чревато изменением того самого баланса между видами, существующего в природе. Последствия могут быть печальны: увеличение численности одних видов может сопровождаться снижением численности других и даже их утратой.
Проблема появления суперсорняков и супервредителей также фигурирует среди основных, когда рассматривают экологические риски, связанные с ГМО. Сорняки - это группа растений с определенным набором адаптивных признаков, которые помогают им существовать в окружающей среде, в том числе среди посевов культурных растений, несмотря на жесткую конкуренцию со стороны других организмов, а также постоянное воздействие со стороны человека, который пытается их искоренить.
Применение трансгенных сортов с инсектицидными свойствами (благодаря Bt-гену) сразу же породило вопрос: а не повлияют ли отрицательно эти сорта на биологическое разнообразие, воздействуя на насекомых, которые не являются "мишенью" трансгенного признака? Имеются в виду прежде всего такие полезные насекомые, как пчелы, божьи коровки, златоглазки. К счастью для природы, Bt-протеины отличаются высокой избирательностью своего действия. Тем не менее возможные негативные эффекты, связанные с нецелевым воздействием ГМО на другие организмы, обязательно тщательно взвешиваются при проведении оценки их биобезопасности.
Еще одним фактором риска считают возможное увеличение объемов применения гербицидов. В связи с тем, что первые ГМО обладали в основном признаками толерантности к гербицидам, возникло опасение, что их использование может привести к неблагоприятному воздействию на экосистемы токсичных веществ, производных неполного разрушения опасных химикатов, например гербицидов. Однако практика использования гербицидоустойчивых генетически модифицированных сортов показала противоположную тенденцию. Поскольку эффективность контроля над сорняками с помощью комбинации ГМО и соответствующего гербицида выше, чем в обычной практике применения химикатов, то общий объем гербицидов, внесенных на поля с генетически модифицированными сортами, оказывается ниже обычного. [20, 21, 22]
4.4 Государственное и международное регулирование безопасности генно-инженерной деятельности
До тех пор пока имеется элемент научной неопределенности относительно возможных неблагоприятных последствий генно-инженерной деятельности для здоровья человека и окружающей среды, она, в соответствии с принципом предосторожности, должна регулироваться на государственном уровне.
Задача эффективного государственного регулирования состоит обеспечении, с одной стороны, максимально благоприятные условия для развития генетической инженерии как одного из приоритетных научных направлений и, с другой стороны, гарантировать безопасность при осуществлении и использовании результатов и продуктов генно-инженерной деятельности.
Основными принципами государственной политики в области генетически-инженерной деятельности и обращения с ГМО должны является:
приоритетность сохранения здоровья человека и охраны окружающей среды по сравнению с получением экономических преимуществ от применения ГМО;
обеспечение мероприятий по соблюдению биологической и генетической безопасности при создании, исследовании и практическом использовании ГМО в хозяйственных целях;
контроль за ввозом на таможенную территорию Украины ГМО и продукции, полученной с их использованием, их регистрацией и обращением;
общедоступность информации о потенциальных рисках от применения ГМО, которые предполагается использовать в открытой системе и мерах по соблюдению биологической и генетической безопасности;
государственная поддержка генетически-инженерных исследований и научных и практических разработок в области биологической и генетической безопасности при создании, исследовании и практическом использовании ГМО в хозяйственных целях.
В большинстве развитых стран мира принято и эффективно функционирует специальное законодательство, касающееся биобезопасности, а также созданы соответствующие компетентные органы, которые претворяют его в жизнь.
В Украине в настоящее время система биобезопасности находится на начальных этапах формирования.
Первый шаг к ней осуществлён в ноябре 2008 года - в Украине был принят государственный стандарт, в соответствии с которым все продукты питания, содержащие генетически модифицированные организмы (ГМО), должны маркироваться. Также был принят закон "О государственной системе биобезопасности при создании, испытании, транспортировке и использовании генетически модифицированных организмов".
Задачами данного Закона являются:
охрана здоровья человека и окружающей среды при осуществлении генно-инженерной деятельности и обращении с ГМО;
обеспечения права граждан на безопасное использование ГМО;
создание условий для безопасного практического использования ГМО в хозяйственных целях;
определения прав и обязанностей субъектов рения при обращении с ГМО и установление их ответственности за нарушение законодательства;
защита граждан в случае причинения вреда их здоровью в результате потребления ГМО;
установление правовых основ международного сотрудничества в области генно-инженерной деятельности и обращения с ГМО.
Регулированию данным Законом подлежат: генетически-инженерная деятельность, осуществляемая в замкнутой системе; генетически-инженерная деятельность, осуществляемая в открытой системе; государственная регистрация ГМО и продукции, произведенной с их использованием; введение в обращение ГМО и продукции, произведенной с их использованием; экспорт, импорт и транзит ГМО.
Использования ГМО запрещается в промышленном производстве и введение в оборот ГМО, а также продукции, произведенной с применением ГМО, до их государственной регистрации.
Ввоз и транзит ГМО:
Запрещается ввоз на таможенную территорию Украины ГМО, а также продукции, произведенной с применением ГМО, до их государственной регистрации, за исключением таких, которые предназначены для научно-исследовательских целей или подержанных апробаций (испытаний).
Разрешение на ввоз ГМО, предназначенных для научно-исследовательских целей или подержанных апробаций (испытаний), предоставляется центральным органом исполнительной власти по вопросам образования и науки в порядке, установленном Кабинетом Министров Украины.
Разрешение на ввоз продукции, полученной с использованием ГМО, предназначенной для научно-исследовательских целей, предоставляется центральными органами исполнительной власти в соответствии с их полномочий, предусмотренных статьями 8-11 настоящего Закона, в порядке, установленном Кабинетом Министров Украины.
Ввоз пищевых продуктов, косметических средств, лекарственных средств, кормовых добавок и ветеринарных препаратов, содержащих ГМО или получены с их использованием, для непосредственного употребления по назначению возможно только при условии государственной регистрации соответствующих ГМО источников и включенной в этой части продукции. Порядок такого ввоза устанавливается Кабинетом Министров Украины. Разрешение на транзитное перемещение незарегистрированных в Украине ГМО предоставляется центральным органом исполнительной власти по вопросам экологии и природных ресурсов в порядке, установленном Кабинетом Министров Украины.
Транспортировка, хранение и утилизация ГМО
Транспортировка и хранение ГМО должно предусматривать осуществление комплекса мероприятий, предупреждающих неконтролируемое высвобождение ГМО в окружающую среду.
Учетная материал ГМО, полученный при испытаниях, непригодные или запрещенные к использованию ГМО, а также тара от них, подлежащих утилизации, уничтожению и обезвреживанию в порядке, который устанавливается центральным органом исполнительной власти по вопросам образования и науки и центральным органом исполнительной власти по вопросам экологии и природных ресурсов.
В системе международных отношений вопросы биобезопасности также вышли на первый план.
В 2000 году странами - Сторонами Конвенции о биологическом разнообразии принят Картахенский протокол по биобезопасности, основная цель которого - "содействие обеспечению надлежащего уровня защиты в области безопасной передачи, обращения и использования живых измененных организмов, являющихся результатом современной биотехнологии, способных оказывать неблагоприятное воздействие на сохранение и устойчивое использование биологического разнообразия, с учетом также рисков для здоровья человека и с уделением особого внимания трансграничному перемещению"
Основное положение Протокола состоит в требовании использовать процедуру заблаговременного обоснованного согласия до первого трансграничного перемещения ГМО, предназначенных для преднамеренного высвобождения в окружающую среду страны импорта. Это означает, что любое юридическое или физическое лицо, имеющее намерение ввезти в страну генетически модифицированный организм (например, семена сельскохозяйственных культур, предназначенные для посева), должно заблаговременно информировать об этом компетентные органы страны импорта, предоставив соответствующую информацию о ГМО, месте и времени его высвобождения. Ввоз ГМО осуществляется только в случае получения экспортером разрешения страны импорта, которое выдается после тщательного анализа рисков возможных неблагоприятных последствий высвобождения ГМО для здоровья человека и окружающей среды.
Живые организмы, попавшие в окружающую среду, не признают границ между государствами. Поэтому имеется возможность для непреднамеренного трансграничного перемещения ГМО. В связи с этим Стороны Протокола берут на себя обязательство принятия мер по регулированию рисков возможных неблагоприятных последствий высвобождения ГМО в окружающую среду. В число таких мер входит прежде всего выдвижение требования относительно проведения оценок рисков до первого высвобождения в окружающую среду ГМО, созданных в стране. Кроме того, в Протоколе подробно описаны действия Сторон в случае непреднамеренного высвобождения ГМО, которые могут оказать значительные неблагоприятные воздействия на здоровье человека и окружающую среду как в самой стране, так и в соседних странах при перемещении в них таких ГМО.
Каждая Сторона принимает необходимые правовые, административные и другие меры для выполнения своих обязательств, предусмотренных в рамках Протокола. Таким образом, присоединение к Картахенскому протоколу какой-либо страны не только обеспечивает возможность урегулирования вопросов, связанных с экспортом и импортом ГМО, но и создает предпосылки для создания национальной системы биобезопасности, которая является важнейшим атрибутом эффективного и безопасного использования достижений современных биотехнологий, развития генетической инженерии как одного из наиболее перспективных научных направлений. [23,24]
Вывод
Ситуация, которая сложилась с отношением к использованию ГМО, не является исключением в истории человечества. Так было всегда: любые новые продукты (кофе, томаты, картофель, кукуруза) европейцы вначале встречали, мягко говоря, с недоверием. Научные данные и уже имеющийся немалый опыт использования ГМО свидетельствуют о том, что большинство рисков, которые с ними связывают, являются скорее гипотетическими, чем реальными.
Основной принцип биобезопасности - принцип принятия мер предосторожности. Суть его не в том, что все, без исключения, созданное с помощью генетической инженерии опасно для здоровья человека и окружающей среды, а в том, что мы не можем пока с полной уверенностью говорить о совершенной безопасности любого трансгенного растения.
Нельзя сказать, что продукты, содержащие ГМО, абсолютно безопасны. Когда человек спешит пользоваться не до конца изученными законами, ничего хорошего не получается. А если к тому же подключается человеческие страсти, жадность, агрессия и другие "милые" черты человечества, то случается не маленькая катастрофа.
Из реальных опасностей можно выделить две.
Первая: не контролируемые эксперименты с генетикой могут нарушить биологическое разнообразие и даже изменить до неузнаваемости фауну и флору.
Вторая: недобросовестный исследователь или дилетант создает генную конструкцию с непредсказуемыми побочными эффектами. Учитывая помешанность человечества на прибыли и деньгах, существует большая вероятность того, что новый вид безо всяких испытаний попадет в широкое использование.
Поэтому, человечеству, конечно же, нужно быть аккуратными и основательными, но в тоже время не поддаваться на провокации о генных мутациях, которые не имеют под собой научных оснований.
Список использованных источников
1. А.П. Ермишин Генетически Модифицированные Организмы. Мифы и реальность. Минск: Тэхналогія, 2004. с.116
2. Ли А., Тинланд Б. Интеграция т-ДНК в геном растений: прототип и реальность. Физиология растений. 2000, том 47, № 3. с.354-359
3. Б. Глик, Дж. Пастернак. Молекулярная биотехнология - М.: Мир, 2002. с.117 - 139, с.156-167.
4. Н.А. Лемеза Л., В., Камлюк Н.Д. Лисов "Пособие по биологии", с.74-82, с.95-110, с.145-156.
5. Сингер М., Берг П. Гены и геномы. - Москва, 1998, с.13-18, с.54-59, с.78-93.
6. Зверева С.Д., Романов Г.А. Репортерные гены для генетической инженерии растений: характеристика и методы тестирования // Физиология растений. 2000. Т.47, № 3. с.479-488.
7. Стент Г., Кэлиндар Р. Молекулярная генетика. - Москва, 1981, с.31-40, с.46-48, с.95-99.
8. Сельскохозяйственная биотехнология: Учеб. / В.С. Шевелуха, Е.А. Калашникова, С.В. Дегтярев и др.: Под ред. В.С. Шевелухи. М.: Высш. школа, 1998. с.359, с.416.
9. Сердобинекий Л.А., Лаврова Н.В., Кукушкина Л.Н. "Применение генной инженерии в сельском хозяйстве". с.12-17, с.35, с.40
10. Патрушев Л.И. Искусственные генетические системы. - М.: Наука, 2004, с.28-36, с.66-73.
11. Щелкунов С.Н. Генетическая инженерия. - Новосибирск, 2008, с.92-96.
12. Лещинская И.Б. Генетическая инженерия - Москва, 2005, с.42-44,13. Пирузян Э.С. Основы генетической инженерии растений. М.: Наука, 1988.304 с.
14. Романов Г.А. Генетическая инженерия растении и пути решения проблемы биобезопасности, 2000. Том 47, № 3. с.343-353
15. Ангурец А.В. Классификация рисков при использовании ГМО. "Физиология трансгенных растений и проблемы биобезопасности". с.36-48, с.69, с.84-89.
16. Барановов В.С. Генная терапия - медицина XXI века // Соросовский образовательный журнал. № 3.1999. с.3 - 68.
17. Пуштаи А., Бардоч С. Ивен С. Генетически модифицированные продукты питания: потенциальное воздействие на здоровье человека. М., МСоЭС, 2004, с.27-44, С.90-103.
18. Фаворова О.О. Лечение генами - фантастика или реальность? Соросовский образовательный журнал. № 2.1997. с.21 - 27.
19. Егоров Н.С., Самуилов В.Д. Современные методы создания промышленных штаммов микроорганизмов Кн.2.1988.208 с
20. Лутова Л.А., Проворов Н.А., Тиходеев О.Н. и др. Генетика развития растений. СПб.: Наука, 200.539 с.
21. Кузнецов В.В. Возможные биологические риски при использовании генетически модифицированных сельскохозяйственных культур. "Вестник ДВО РАН" № 3, 2005, с.40-54.
22. Томилин Н.В., Глебов О.К. Генетическая трансформация клеток млекопитающих, 1986, С.62 - 82.
23. Албертс Б., Брей Д., Льюис Дж. И др. Молекулярная биология клетки.
Т.1 - 3. М.: Мир, 1994. с.23-27.
24. Розпорядження Каб. Мін. Укр. від 17 жовтня 2007 р. "Про схвалення Концепції національної екологічної політики України до 2020 р. "
25. Стратегія економічного і соціального розвитку України (2004-2015 роки)"Шляхи європейської інтеграції"2004, С.63-64, С.67, С.68.
Приложение А
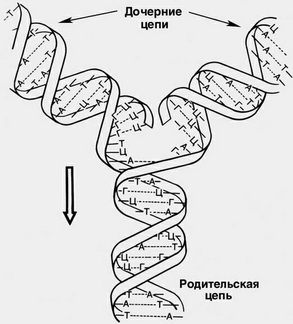
Схема 1 - иллюстрирующая механизм репликации ДНК: А - аденин, Г - гуанин, Ц - цитозин, Т - тимин.

Схема 2 - иллюстрирующая механизм транскрипции.
А - аденин, Г - гуанин, Ц - цитозин, Т - тимин.

Схема 3. - Механизм репрессии фермента, который катализирует синтез аминокислоты триптофана: ген-регулятор синтезирует неактивную молекулу белка-репрессора; если аминокислота триптофан в излишке, то она присоединяется к репрессору и активизирует его; активная молекула репрессора блокирует оператор; оператор прекращает синтез и-РНК и транскрипция не происходит; прекращается трансляция и фермент не синтезируется; прекращается синтез триптофана.
Приложение Б
|
Признак |
Генетический элемент |
Источник |
|
Удлинение сроков хранения плодов |
Полигалактуроназа |
Томаты Licopersicon esculentum |
|
Задержка созревания |
Синтаза 1-аминоцикло- пропан-1-углекислой кислоты |
Гвоздика Dianthus caryophyllus L. |
|
Задержка созревания |
Синтаза аминоциклопро-пан циклазы |
Томаты Licopersicon esculentum |
|
Мужская стерильность |
ДНК аденин метилаза |
E. coli |
|
Мужская стерильность |
Рибонуклеаза барназа |
Bacillus amyloliquefaciens |
|
Восстановление фертильности |
“barstar" - ингибитор рибонуклеазы барназа |
Bacillus amyloliquefaciens |
|
Устойчивость к гербицидам |
5-энолпирувилшики-мат-3-фосфат синтаза |
Кукуруза Zea mays |
|
Устойчивость к гербицидам |
Ацетолактат синтаза |
Линия арабидопсиса Arabidopsis thaliana, устойчивая к хлорсульфурону |
|
Устойчивость к гербицидам |
Ацетолактат синтаза |
Линия табака Nicotiana tabacum, устойчивая к сульфурону |
|
Устойчивость к гербицидам |
Ацетолактат синтаза |
Химера 2 устойчивых генов AHAS (S4-Hr4) |
|
Устойчивость к насекомым |
cry IF дельта-эндотоксин |
Bacillus thuringiensis var. aizawai |
|
Устойчивость к насекомым |
сгуЭС дельта-эндотоксин |
Bacillus thuringiensis sub>sp. Tolworthi |
|
Устойчивость к насекомым |
сгуЗА дельта-эндотоксин |
Bacillus thuringiensis sub>sp. Tenebrionis |
|
Устойчивость к насекомым |
Ингибитор протеазы |
Картофель Solanum tuberosum |
|
Измененный цвет |
Дигидрофлавонол редуктаза |
Петуния Petunia hybrida |
|
Измененный цвет |
Флавоноид Зр, 5р гидролаза |
Фиалка Viola sp. |
|
Измененный состав масла (жирных кислот) |
Дельта-12 десатураза |
Соя Glycine max |
|
Измененный состав масла (жирных кислот) |
Тиоэстераза |
Калифорнийское лавровое дерево Umbellularia californica |
|
Устойчивость к вирусу |
Протеин оболочки вируса PRSV |
Вирус кольцевой пятнистости папайи (PRSV) |
|
Устойчивость к вирусу |
Протеин оболочки вируса ZYMV |
Вирус желтой мозаики цуккини (ZYMV) |
Генетические элементы, привнесенные в допущенные к использованию трансгенные сорта сельскохозяйственных растений, и источники их происхождения
Приложение В
|
Белок |
Концентрация в тканях |
Время переваривания |
|
|
в желудочном соке |
в дуоденальном соке |
||
|
NPTII |
Картофель (клубни) - 2,7 мкг/г Хлопок (семена) - 7 мкг/г |
Половина - s 10 сек; полностью - 20 мин |
Половина - 2-5 мин |
|
EPSPS |
Хлопок (семена) - 60-70 мкг/г |
Половина - 15 сек |
Половина - 0 мин |
|
PAT |
1 мин; при рН 4 - 10 мин |
||
|
CPPVY |
s2 мкг/г (в 12-244 раза ниже естественного уровня) |
||
|
CRY IA (b) |
Кукуруза во время цветения 8-16 г/га; в конце вегетации sO,8 г/га; в зерне и силосе не обнаружен |
Разведение: 1: 1000-10 мин; 1: 100-5 мин 90% в течение 2 мин |
Не переваривается |
|
CRY IIIA |
Картофель: листья - 20-63 мкг/г; клубни - 0,1-0,6 мкг/г |
Аналогично CRY IA (b) |
Аналогично CRY I А (Ь) |
Характеристики белков-продуктов некоторых трансгенов