Развитие экологического мышления на уроках химии при изучении темы "Аминокислоты"
Курсовая работа
На тему
«Развитие экологического мышления на уроках химии при изучении темы «Аминокислоты»»
СОДЕРЖАНИЕ
Введение
Глава 1 . Чистые продукты питания и здоровье человека
Глава 2. Состояние изучаемого вопроса в современной российской школе
2.1. Аминокислоты
2.2. Способы получения
2.3. Химические свойства

2.4. Значение и применение аминокислот
Глава 3. Экологические особенности изучения темы «Аминокислоты»
Глава 4. Мои уроки
Литература
ВВЕДЕНИЕ
С первых шагов своего развития человек неразрывно связан с природой. Он всегда находился в тесной зависимости от растительного и животного мира, от их ресурсов и был вынужден повседневно считаться с особенностями распределения и образа жизни зверей, рыб, птиц. Представления древнего человека об окружающей среде не носили научного характера и были не всегда осознанными, но с течением времени они послужили источником накопления экологических знаний. Повсеместно растёт понимание того, что человечество разрушает окружающую среду и подрывает собственное будущее. Современная цивилизация осуществляет невиданное давление на природу. Планета земля как целое, включая воду, воздух, землю, недра, а также биологические объекты, не исключая и человека, является целостной системой. Экологические проблемы есть результат взаимодействия нашей цивилизации и окружающей среды в эпоху промышленного развития. Началом этой эпохи принято считать 1860 год, примерно в это время в результате бурного развития евроамериканского капитализма произошёл выход тогдашней промышленности на новый уровень.
Актуальность темы. Пища состоит из белков, жиров, углеводов, а белки в свою очередь состоят из аминокислот. Человек синтезирует некоторые аминокислоты, используя их в пищу и как добавка в корм животным. А как известно любой синтез сопровождается образованием отходов, и возникает проблема их вторичного использования или утилизации.
Цель моей работы заключалась в рассмотрении темы «Аминокислоты» и выявлении фактов, способствующих развитию экологического мышления на уроках химии при изучении данной темы. Для достижения цели были поставлены следующие задачи:
Рассмотреть как данная тема раскрывается в различных учебниках по химии.
Изучить прикладные и экологические аспекты данной темы.
Рассмотреть производство аминокислот и способы утилизации отходов.
Предложить конспект урока по данной теме.
Привести тесты и задачи общехимической и экологической направленности
ГЛАВА 1. ЧИСТЫЕ ПРОДУКТЫ ПИТАНИЯ И ЗДОРОВЬЕ ЧЕЛОВЕКА
Каждый человек знает, что пища необходима для нормальной жизнедеятельности организма. Но мы часто употребляем в пищу то, что вкусно, что можно быстро приготовить, и не очень задумываемся о полезности и доброкачественности употребляемых продуктов. Врачи утверждают, что полноценное рациональное питание – важное условие сохранения здоровья и высокой работоспособности, а для детей ещё необходимое условие роста и развития. Для нормального развития и поддержки жизнедеятельности организму необходимы белки, жиры, углеводы, витамины и минеральные соли в нужном ему количестве. Нерациональное питание является одной из главных причин возникновения сердечно-сосудистых заболеваний, заболеваний органов пищеварения, болезней, связанных с нарушением обмена веществ. Регулярное переедание, потребление избыточного количества углеводов и жиров - причина развития таких болезней обмена веществ, как ожирение и сахарный диабет. Рациональное питание - важнейшие и непременное условие профилактики не только болезней обмена веществ, но и многих других. Пищевой фактор играет важную роль не только в профилактике, но и в лечении многих заболеваний. Специальным образом организованное питание, лечебное питание, обязательное условие лечения многих заболеваний. Лекарственные вещества синтетического происхождения в отличие от пищевых веществ, являются для организма чужеродными. Многие из них могут вызвать побочные реакции, например, аллергию. В продуктах питания многие биологически активные вещества обнаруживаются в равных, а иногда и в более высоких концентрациях, чем в применяемых лекарственных средствах. Вот почему продукты, в первую очередь овощи, фрукты, семена, зелень применяют при лечении различных болезней. Многие продукты питания оказывают бактерицидные действия, подавляя рост и развитие различных микроорганизмов (яблочный сок, сок граната, сок клюквы). Но теперь появилась новая опасность - химическое загрязнение продуктов питания. Появилось и новое понятие - экологически чистые продукты. Каждому из нас приходилось покупать на рынке или в магазине крупные, красивые овощи или фрукты. Но, попробовав их, с огорчением выясняешь, что они водянистые и совсем невкусные. Обычно это происходит, когда сельскохозяйственные культуры выращивают с применением большого количества удобрений и ядохимикатов. Такая сельскохозяйственная продукция может иметь не только плохие вкусовые качества, но быть опасной для здоровья. Азот – составная часть жизненно важных для растений, а также для животных организмов соединений, например белков. В растения азот поступает из почвы, а затем через продовольственные и кормовые культуры попадает в организмы животных и человека. Сейчас сельскохозяйственные культуры чуть ли не полностью получают минеральный азот из химических удобрений, так как навоза и других органических удобрений уже не хватает для обеднённых азотом почв. Однако в отличие от органических удобрений в химических удобрениях не происходит свободного выделения в природных условиях питательных веществ. Значит, не получается и «гармонического» питания сельскохозяйственных культур, удовлетворяющего требования их роста. В результате происходит избыточное азотное питание растений и вследствие этого накопление в нём нитратов. Излишек азотных удобрений ведёт к снижению качества растительной продукции, ухудшению её вкусовых свойств, снижению выносливости растений к болезням, что, в свою очередь, вынуждает земледельца увеличивать применение ядохимикатов. Они также накапливаются в растениях. Повышенное содержание нитратов приводит к образованию нитритов, вредных для здоровья человека. Употребление такой продукции может вызвать у человека серьёзные отравления, и даже смерть. Особенно резко проявляется отрицательное действие удобрений и ядохимикатов при выращивании овощей в закрытом грунте. Это происходит потому, что в теплицах вредные вещества не могут беспрепятственно испаряться и уноситься потоками воздуха. После испарения они оседают на растения. Растения способны накапливать в себе практически все вредные вещества. Вот почему особенно опасна сельхоз. продукция, выращиваемая вблизи промышленных предприятий и крупных автодорог [1,2].
ГЛАВА 2. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
План изучения темы
Амины. Аминокислоты. Белки - 7 часов
Амины - органические основания
Анилин- представитель ароматических аминов, его практическое применение
Аминокислоты - амфотерные органические соединения. Строение, изомерия, свойства
Значение аминокислот. Синтез пептидов.
Белки - природные высокомолекулярные соединения. Химические функции белков.
Химические свойства белков. Проблема синтеза белка
Повторение и закрепление знаний по теме « Амины. Аминокислоты. Белки ».
Преподавание темы начинается с 11 класса, первого полугодия. При изучении этой темы пользуются учебником 11 класса химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман, также учебником за 11 класс под редакцией Н. С. Ахметова. Дидактическим материалом служит книга по химии для 11классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной работы по химии за 10-11 класса под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко. В 11 классе на изучение темы «Аминокислоты» отводится 1 час [4].
Кратко рассмотрим как данная тема освещается в различных учебниках по химии
2.1 Аминокислоты
Аминокислотами называются соединения, в молекулах которых содержатся одновременно аминные и карбоксильные группы.В зависимости от положения аминогруппы по отношению к карбоксильной группе различают α-, β-, γ-аминокислоты. Наибольшее значение в процессах жизнедеятельности играют α-аминокислоты, из них как раз состоят белки.
Чаще используют тривиальные названия. Наиболее важные кислоты представлены в таблице.
Таблица"Важнейшие α-аминокислоты"
|
Аминокислота |
Формула |
Условное обозначение |
Т>пл>0C |
|
Глицин |
|
Гли |
292 |
|
Аланин |
|
Ала |
297 |
|
Валин |
|
Вал |
315 |
|
Лейцин |
|
Лей |
337 |
|
Изолейцин |
|
Илей |
284 |
|
Аспаргиновая кислота |
|
Асп |
270 |
|
Глутаминовая кислота |
|
Глу |
249 |
|
Орнитин |
|
Орн |
140 |
|
Лизин |
|
Лиз |
224 |
|
Серин |
|
Сер |
228 |
|
Треонин |
|
Тре |
253 |
|
Цистеин |
|
цис-SH |
178 |
|
Цистин |
|
цис-S | цис-S |
260 |
|
Метионин |
|
Мет |
283 |
|
Фенилаланин |
|
Фен |
275 |
|
Тирозин |
|
Тир |
344 |
|
Триптофан |
|
Три |
382 |
|
Пролин |
|
Про |
299 |
|
Оксипролин |
|
Про-ОН |
270 |
|
Гистидин |
|
Гис |
277 |
|
Аргинин |
|
Арг |
238 |
|
Аспаргин |
|
Асн |
236 |
|
Глутамин |
|
Глн |
185 |
Физические свойства
Аминокислоты - бесцветные кристаллические вещества, хорошо растворяются в воде, температура плавления 230-300·С. Многие а-аминокислоты имеют сладкий вкус [5].
2.2 Способы получения
Для получения а-аминокислот в лабораторных условиях обычно используют два следующих способа.
1. Взаимодействие а-галогенкарбоновых кислот с избытком аммиака. В ходе этих реакций происходит замещение атома галогена в галогенкарбоновых кислотах (об их получении см. § 10.4) на аминогруппу. Выделяющийся при ЭТОМ хлороводород связывается избытком аммиака в хлорид аммония.
2. Гидролиз белков. При гидролизе белков обычно образуются сложные смеси аминокислот, однако с помощью специальных методов из этих смесей можно выделять отдельные чистые аминокислоты.
2.3 Химические свойства

Основные свойства аминов
 кислотные свойства карбоновых кислот
кислотные свойства карбоновых кислот
Амфотерные свойства
1. Взаимодействие с основаниями и с кислотами:
а) как кислота (участвует карбоксильная группа):
б) как основание (участвует аминогруппа)
2. Взаимодействие внутри молекулы- образование внутренних солей
3. Взаимодействие аминокислот друг с другом- образование пептидов
2.4 Значение и применение аминокислот
Аминокислоты и их производные используются в качестве лекарственных средств в медицине. Так глицин оказывает укрепляющее действие на организм и стимулирует работу мозга. Лизин и метионин применяются в качестве добавок в корм сельскохозяйственным животным. Человеческий организм может синтезировать 12 из 20 аминокислот. Остальные восемь должны поступать в организм в готовом виде вместе с белками пещи, поэтому они называются незаменимыми. Незаменимые аминокислоты включают изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан, валин и (для детей) гистидин. При ограниченном поступление такой аминокислоты в организм она становится лимитирующим веществом при построении любого белка, в состав которого она должна входить. Если такое случается, то единственное, что может предпринять организм, - это разрушить собственный белок, содержащий эту же аминокислоту. Большинство животных белков содержат все восемь незаменимых аминокислот в достаточных количествах. Любой белок, имеющий необходимое содержание всех незаменимых аминокислот, называется совершенным. Растительные белки несовершенны: в них низок уровень некоторых незаменимых аминокислот. Хотя ни один из растительных белков не может обеспечить нас всеми незаменимыми аминокислотами, смеси таких белков - могут. Такие комбинированные продукты питания, которые содержат взаимодополняющие (комплементарные) белки, входят в состав традиционной кухни всех народов мира [5,6].
ГЛАВА 3. ЭКОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ИЗУЧЕНИЯ ТЕМЫ «АМИНОКИСЛОТЫ»
Человеческое тело не может запасать белки, поэтому сбалансированное белковое питание требуется человеку каждый день. Взрослому человеку весом 82 кг требуется 79 г белка в день. Рекомендуется, чтобы при этом с белками поступало 10 - 12% всех калорий. L-триптофан - незаменимая аминокислота с обширным спектром действия. Он участвует в поддержании азотистого равновесия в обменных процессах, актах возбуждения и торможения, а также трансформации одного вида энергии в другой. Образующаяся из триптофана никотиновая кислота является важным компонентом в энергетическом обмене. L-триптофан регулирует функцию эндокринного аппарата, предупреждающего анемию, регулирующего кровяное давление, отвечающего за синтез гемоглобина. Особое значение эта аминокислота имеет в фармакологии, где она и ее производные применяются в качестве ингредиентов многих лекарственных средств. При таких тяжелых заболеваниях, как рак, туберкулез, диабет триптофан способствует нормальному функционированию различных систем организма. Недостаток его у человека и животных ведет к развитию пеллагры, поражению зубов, помутнению роговицы глаз, катаракты. Установлено, что у пациентов, имеющих активную форму депрессии, наблюдается пониженный уровень триптофана в плазме. Предполагают, что эта аминокислота стимулирует секрецию инсулина, который в свою очередь активизирует синтетазу жирных кислот в печени. L-триптофан содержится в препаратах, восстанавливающих функции мозга. Известно, что в зонах повышенной радиации и инсоляции и при лечении лучевой болезни употребление пищи, обогащенной L-триптофаном, повышает уровень серотонина и снимает такие отрицательные последствия, как геморрагический синдром. Триптофан используется как антиокислитель пищевых масел и жиров, в качестве общего повышения калорийности пищи, особенно содержащей бобовые и кукурузу. В Японии фирма Kyowa Hakko Ajinomoto производит L-триптофан для медицинских и пищевых целей с использованием штаммов микроорганизмов, работающих на низкомолекулярных субстратах. В Кыргызстане в рамках Государственных научно-технических и Целевых Комплексных программ СССР сотрудники ВНИИгенетика и специалисты Бишкекского завода антибиотиков создают уникальное опытно-промышленное производство по микробиологическому синтезу L-триптофана. На основе лабораторного регламента они отрабатывают технологию и выпуск аминокислоты методом глубинного выращивания штаммапродуцента Bactilis sub>tilis на мелассных средах. Технология получения аминокислоты представляет собой последовательный ряд операций, к которым относятся ферментация, обработка культуральной жидкости коагулянтами, выделение аминокислот из нативного раствора с помощью ионообменных смол, концентрирование растворов и очистка технического продукта осветляющими активированными углями. Необходимо отметить, что микробиологический синтез аминокислот связан с существенным расходом воды и образованием значительных количеств жидких и твердых отходов. Принимая во внимание, что в производстве L-триптофана необходимо соблюдать жесткий санитарно-гигиенический режим, создание малоотходной технологии является одной из актуальных проблем [7].
По регламенту все виды отходов, включая жидкие стоки, собирают, обезвоживают. Сухой шлам обеззараживают, затаривают в мешки для последующего захоронения. При выделении L-триптофана жидкие стоки образуются за счет промывных вод производственного оборудования, стадии ионообменной хроматографии, маточников кристаллизации, некондиционных растворов посевного материала и культуральной жидкости. Обеззараживание значительных объемов стоков (более 1 м3 на 1 кг целевой аминокислоты) создает дополнительные финансовые затраты, отражающиеся на себестоимости триптофана. Дифференцированные стоки, как показали исследования химического состава, могут служить сырьем для вторичной переработки. Учитывая, что сбрасываемые стоки имеют температуру выше 40oС, их можно рассматривать как готовый исходный субстрат для проведения процесса метаногенеза органического вещества. Бросовые осадки биомассы продуцентов аминокислот, образующиеся на стадии тепловой и химической обработки культуральной жидкости, и отработанные активированные угли со стадии осветления технического продукта так же, как и канализационные стоки имеют температуру 40-60oС, что служит положительным фактором в пользу анаэробного сбраживания органического вещества этого вида сырья метаногенным консорциумом микроорганизмов. [8]. Потребление аминокислоты метаногенным консорциумом микроорганизмов, т.е. практически полное разложение триптофана, как видно на рисунке, происходит в течение 18 суток и выходе биогаза свыше 10 мМ. На основании исследований установлено, что этот процесс происходит вначале с разложением линейной цепи, а затем деградации ароматического кольца аминокислоты.

Накопление биогаза и конверсия аминокислоты при анаэробной микробиологической конверсии триптофана.
Поскольку в жидких отходах содержание органических веществ (ОВ) может изменяться в зависимости от количества некондиционных растворов культуральной жидкости и маточников кристаллизации триптофана в условиях производства, стоки, получаемые от регламентных стадий выделения аминокислот рассматривают как технологические канализационные. О количестве ОВ в этих стоках, а их всего 9 видов, судят по показателям биологического (БПК) и химического (ХПК) потребления кислорода. Высокие значения этих двух показателей наблюдаются у промывных вод ионита ИА-1 после сорбции и в стоке после промывки производственного оборудования, соответственно для первого 300 и 400 и второго - 975 и 1400 мгО>2>/л. Технологические стоки собирают в один сборник, после усреднения и взаимной нейтрализации у них показатели БПК и ХПК приближаются к нормативному требованию и составляют 392-420 и 560-580 мгО>2>/л. Биоконверсия таких стоков в течение 1500 ч в термофильном режиме показала, что через 750 ч процесс образования метана выходит на стабильный режим, а полученный трансформированный раствор не требует дальнейшего обеззараживания, так как является экологическим жидким биоудобрением. В плане охраны окружающей среды метаногенез такого стока позволяет исключить из технологического цикла стадию стерилизации, высушивания и захоронения шлама. Реализация нового вида продукции - удобрения - существенно отражается на повышении общей рентабельности производства.
Биоконверсия трапных операций культуральных жидкостей (КЖ), маточников кристаллизации (МК) и их смесей показала, что при времени оборота реактора 552 ч степень конверсии органических веществ составляет 48,0; 21,6 и 34,8% (табл. 1). Для сопоставления результатов трансформации жидких отходов показатели по выходу биогаза и степени конверсии отнесены к единому компоненту - органическим веществам. Различная степень конверсии, как видно из табл. 2, повидимому, может трактоваться особенностями метаногенеза триптофана и других органоминеральных примесей, содержащихся в данных субстратах (табл. 2). Проведенные исследования свидетельствуют, что анаэробная обработка указанных жидких отходов метаногенным консорциумом микроорганизмов в производственном цикле приемлема и экономически оправдана, так как температура выбрасываемых продуктов составляет 40-60oС, и для них нет необходимости проводить дополнительный нагрев для осуществления процесса метаногенеза.
Таблица 1. Расчетные показатели конверсии отходов триптофана
|
Вид отхода |
Содержание сухих веществ, % |
Содержание органических веществ, % |
Выход биогаза, л/г ОВ |
Конверсия, ОВ,% |
|
КЖ триптофана |
10,2 |
90,5 |
0,387 |
48,0 |
|
Маточник кристаллизации (МК) |
35,4 |
88,0 |
0,154 |
21,6 |
|
Смесь КЖ + МК |
22,8 |
89,3 |
0,270 |
34,8 |
Таблица 2. Конверсия отработанных активных углей производства триптофана (временя удерживания - 23 суток)
|
Содержание органического вещества (ОВ), % |
Содержание углерода, % |
Содержание азота, % |
Превращение вещества в биогаз - исходное на угле |
Конвертированное |
|
90,91 |
92,75 |
72,8 |
4,94 |
4,45 |
В триптофановом производстве большие проблемы связаны с утилизацией осадков биомассы продуцентов триптофана (ОБПТ) и отработанных осветляющих активированных углей.
Крупномасштабная реализация биогазовой технологии в производстве триптофана требует выяснения степени конверсии ОВ названных продуктов. Биоконверсия отработанного активированного угля в микробиологическом синтезе триптофана обусловлена самой технологией использования осветляющих активированных углей. В условиях производства отработанный уголь представляет собой горячую массу, которая по регламенту высушивается и отправляется на утилизацию. При этом необходимо учитывать, что при сушке угля вместе с влагой десорбируется значительное количество загрязнений и происходит дополнительный расход энергоносителей. Исследования по биоконверсии отработанных активированных углей триптофанового производства позволяют сделать вывод, что при культивировании термофильного природного метаногенного консорциума на отработанных углях наблюдалась типичная картина, характерная для конверсии чистого триптофана (табл.2).При этом значение коэффициента газификации (КГ), вычисленное из отношения суммы выделившихся метана и диоксида углерода к органическому веществу, как видно из табл. 2, составляет 90%. Высокий процент сорбированных веществ углем, а также его мелкодисперсность позволяют рассматривать процесс биоконверсии в анаэробных условиях этого вида отхода экономически и экологически более выгодным. Превращение органического вещества водной суспензии осадка биомассы продуцента триптофана при времени удерживания 23 суток в термофильном режиме метаногенным консорциумом микроорганизмов, как показали исследования, составило 61%, и этот показатель значительно выше наблюдаемого для растворов КЖ (48%) и представленного в табл. 1.
Таблица 3
Состав субстрата для анаэробной конверсии из смеси отходов осадка биомассы продуцента триптофана и культуральной жидкости
|
№опыта |
Соотношение компонентов- культуральная жидкость, % |
Соотношение компонентов- осадок биомассы продуцента, % |
Содержание твердого вещества, % |
Содержание органического вещества, % |
|
1 |
90 |
10 |
19,2 |
86,0 |
|
2 |
80 |
20 |
28,2 |
81,7 |
|
3 |
75 |
25 |
32,7 |
79,5 |
|
4 |
50 |
50 |
55,1 |
68,6 |
|
5 |
25 |
75 |
77,6 |
57,5 |
Более высокий показатель деградации ОВ осадка биомассы продуцента триптофана, возможно, связан с содержанием в нем фосфатов и пептидов, которые выполняют роль активирующих ростовых примесей. Поэтому для сравнения был проведен метаногенез ОБПТ в различном соотношении с раствором культуральной жидкости (табл. 3).
Как и следовало ожидать, выход биогаза (0.43 л/г) и степень конверсии ОВ (57,8%) были выше для смеси ОБПТ+КЖ в соотношении 75:25.
Таким образом, одним из путей экологически оправданной утилизации отходов и обеззараживания стоков триптофанового производства может служить их довольно легко осуществимый метаногенез, который способен стать одной из альтернативных возможностей вторичного использования бросовых продуктов для выпуска экологического удобрения, повторного использования тепла и дополнительного получения энергоносителя в виде биогаза [9,10].
ГЛАВА 4. МОИ УРОКИ
Урок по теме: "Аминокислоты. Белки"
“Жизнь – это способ существования белковых тел, существенным моментом которого является постоянный обмен веществ с окружающей их внешней природой, причем с прекращением этого обмена веществ прекращается и жизнь, что приводит к разложению белка”.
Ф. ЭНГЕЛЬС
Цели:
обучающая: обеспечить сознательное усвоение учащимися важнейших химических законов, понятий, теорий в контексте изучения аминокислот и белков.
развивающая: формировать высокий уровень мыслительной деятельности, научить использовать в решении повседневных задач различные мыслительные приемы.
Воспитывающая: показать диалектическую взаимосвязь и взаимообусловленность химических фактов. Довести до учащихся мысль о том, что опровергаются только теории, факты опровергнуть нельзя. С помощью межпредметных связей способствовать формированию картины мира.
Оборудование:
Листы с заданиями экспресс теста, бланки ответа на тест (для каждого ученика по два листа, скрепленных скрепкой, между которыми вложена копировальная бумага). (Приложение 1)
Листы с текстом для изучения (по одному на парту). (Приложение 2)
Оформление доски:
На доске записана тема урока, на листах формулы и названия аминокислот, для изучения функций белков на листах: типы и примеры в центре записаны функции белков.
Оборудование для проведения лабораторного эксперимента:
Продукты питания: молоко, молочные продукты (простокваша, сметана, кефир, творог и др.), мука (смесь с водой), крупа (любая крупа, размоченная или разваренная до кашеобразного состояния), бобовые (горох, фасоль, бобы, соя), размельченные мясо и рыба, замоченные дрожжи, желатин.
Пробирки, 10%-ный раствор гидроксида натрия, 1%-ный раствор сульфата меди.
Методика проведения опыта: К 0,5 мл раствора белка добавляют столько же 10%-ного раствора гидроксида натрия (калия) и 6-10 капель 1%-ного раствора сульфата меди (II). Голубая окраска раствора, свойственная солям меди (II), по мере образования комплексного соединения переходит в сиреневую.
5. Листы с заданиями для работы в группах.
Этапы урока:
Вводное слово учителя. Постановка целей урока.
Экспресс – тест по темам «Аминокислоты. Белки». Проверка и обсуждение результатов.
Работа с текстом в парах по теме «История открытия и изучения белков».
«Типы белков и их функции в организме человека» дидактическая игра.
Лабораторный эксперимент по теме «Обнаружение белков в пищевых продуктах».
Рассказ учителя о превращениях белков в пищеварительной системе.
Решение познавательных задач с практическим содержанием (работа в группах).
Подведение итогов урока. Выставление оценок. Обозначение дальнейших тем.
ХОД УРОКА
1. Вводное слово учителя. Постановка целей урока.
Белки – это важнейшие для жизни вещества. Белки – основной структурный компонент тканей. Посмотрите на своего соседа. Все, что вы видите: кожа, волосы, глаза, ногти, - это белки. Костные ткани, кровь, мозг – все содержит белки. Кроме того, все ферменты, контролирующие химические процессы в организме, представляют собой белки. В каждом человеке десятки различных белков.
На предыдущих уроках мы с вами изучили состав, строение и свойства аминокислот, состав и структуру белков. Сегодня мы расширим наши знания. Узнаем истории открытия и изучения белков, о разнообразии белков, их функциях в организме человека, свойствах, проведем ряд опытов, подтверждающих наличие белков в продуктах питания, и обсудим превращения белков в пищеварительной системе. В завершение урока мы будем решать познавательные задания с практическим содержанием.
2. Экспресс – тест по темам «Аминокислоты. Белки». Проверка и обсуждение результатов.
Перед тем, как узнавать новое, мы должны вспомнить и обобщить ранее изученный материал. Для этого выполним тест. Ответы вы пишете через копировальную бумагу, таким образом, каждый из вас сможет сам проверить свою работу, выставить оценки и увидеть свои ошибки и исправить их.
Учащиеся выполняют задания теста. Учитель собирает один из листов с ответами. Далее идет обсуждение результатов теста и выставление оценок.
Критерии оценивания теста:
«5» - 7 правильных ответов.
«4» - 5-6 правильных ответов.
«3» - 4 правильных ответа.
3. Работа с текстом в парах по теме «История открытия и изучения белков»
После того, как в 1728 году Якоб Беккари (1682 —1766) впервые выделил белковое вещество из пшеничной муки, ученыее разных стран стали активно заниматься изучением строения белковых молекул. Результаты исследований показали чрезвычайно важную роль белков в жизнедеятельности животных и растений. Первую теорию строения белков выдвинул в 1844 году Геррит Ян Мульдер.
На ваших партах листы с отрывком из работ Мульдера и кратким изложением его теории. Ваша задача внимательно прочитать материал и выделить, в чем теория Мульдера верна, а в чем он заблуждался. Через 10 минут мы обсудим ваши наблюдения. Для удобства вы будете подчеркивать то, с чем вы согласны красной пастой, а с чем нет - черной.
Учащиеся работают с текстом, учитель консультирует пары, у которых возникли затруднения. Далее следует обсуждение и объяснение учителя о причинах несовершенства теории Мульдера.
Несовершенство теории Мульдера объясняется господствующей в то время в химии теорией радикалов. В 1846 году русский ученый Николай Лясковский установил, что эмпирические формулы белков, выведенные Мульдером, неприемлемы из-за допущенных ошибок в расчетах и, таким образом, не соответствуют данным химического анализа самого Мульдера. Лясковский показал, что вещество, принимаемое Мульдером за протеин, лишенный серы, на самом деле ее содержит, и избавиться от серы очень трудно. Поэтому нет оснований считать, что протеин является фундаментальным веществом для белков. Дальнейшее изучение белковых молекул показало, что они являются природными полимерами, построенными из остатков a -аминокислот.
4. «Типы белков и их функции в организме человека» дидактическая игра
Белки — незаменимый компонент живого организма, они необходимы как для его роста, так и для поддержания нормальной жизнедеятельности. В этих случаях происходит образование новых тканей. Вообще говоря, замена старых клеток на новые происходит очень часто. Например, красные кровяные клетки ежемесячно полностью обновляются. Клетки, выстилающие стенки кишечника, обновляются еженедельно. Каждый раз, принимая ванну, мы сбрасываем с себя мертвые клетки кожи.
Сейчас, используя наши знания из химии, биологии и повседневной жизни, мы будем соотносить типы белков и их функции в организме человека. На доске листы с отпечатанными на них типами белков. Рядом в столбик записаны вразброс их функции. Ваша задача соотнести их и подобрать пример того или иного типа белков. Итак, начинаем работу: работаем в парах. Тот, кто нашел соответствие, поднимает руку и выходит к доске.
|
ТИП |
ФУНКЦИЯ |
ПРИМЕР |
|
Структурные белки мышц |
Сокращение, обеспечение двигательных функций. |
Миозин (мышцы) |
|
Белки соединительных тканей |
Обеспечение целостности организма, защита от внешних воздействий |
Кератин (кожа, волосы, ногти); коллаген (сухожилия) |
|
Хромосомные белки |
Часть структуры хромосом |
Гистоны |
|
Белки мембран |
Контроль за потоком веществ внутрь и вовне организма, передача информации внутри организма |
Рецепторы |
|
Транспортные белки |
Переносчики кислорода и других веществ |
Гемоглобин |
|
Контролирующие белки |
Поддержание рН, солевого состава организма |
Сывороточный альбумин |
|
Ферменты |
Контроль метаболизма |
Протеазы |
|
Гормоны |
Регуляция процессов жизнедеятельности |
Инсулин, половые гормоны |
|
Защитные белки |
Антитела (защита от инфекций) |
Гаммаглобулин |
Учащиеся в тетрадях записывают таблицу.
5. Лабораторный эксперимент по теме «Обнаружение белков в пищевых продуктах»
Как уже было сказано, белки содержатся во всех тканях живых организмов. Биохимиками разработаны специальные реакции, позволяющие достоверно установить присутствие белка или определенных аминокислот. Такие реакции называют качественными, многие из них именные, т.е. носят имя первооткрывателя.
На урок вы принесли различные продукты питания
Биуретовая реакция — универсальная реакция на все белки, так как в ходе ее образуются координационные комплексные соединения ионов меди (II) с компонентами пептидных связей белков.
Учащиеся проводят эксперимент, используя разные продукты питания: молоко, молочные продукты (простокваша, сметана, кефир, творог и др.), муку (смесь с водой), крупу (любая крупа, размоченная или разваренная до кашеобразного состояния), бобовые (горох, фасоль, бобы, соя), размельченные мясо и рыбу, замоченные дрожжи, желатин. Затем учащиеся демонстрируют свои результаты и делают вывод о том, что белки – неотъемлемая часть пищи.
6. Рассказ учителя о превращениях белков в пищеварительной системе.
После того как вы съели какой-нибудь белок, ферменты, называемые протеазами, разрывают пептидные связи. Происходит это в желудке и тонком кишечнике. Свободные аминокислоты переносятся током крови сначала в печень, а потом во все клетки. Там из них синтезируются новые белки, необходимые организму. Если в организм поступило белка больше, чем надо, или организму требуется "сжечь" белки из-за недостатка углеводов, то эти реакции аминокислот происходят в печени; здесь азот из аминокислот образует мочевину, выделяемую из организма с мочой через мочевыводящую систему. Именно поэтому белковое питание дает лишнюю нагрузку на печень и почки. Оставшаяся часть молекулы аминокислоты либо перерабатывается в глюкозу и окисляется, либо превращается в жировые запасы.
Человеческий организм может синтезировать 12 из 20 аминокислот. Остальные восемь должны поступать в организм в готовом виде вместе с белками пещи, поэтому они называются незаменимыми. Незаменимые аминокислоты включают изолейцин, лейцин, лизин, метионин, фенилаланин, треонин триптофан, валин и (для детей) гистидин. При ограниченном поступление такой аминокислоты в организм она становится лимитирующим веществом при построении любого белка, в состав которого она должна входить. Если такое случается, то единственное, что может предпринять организм, - это разрушить собственный белок, содержащий эту же аминокислоту.
Большинство животных белков содержат все восемь незаменимых аминокислот в достаточных количествах. Любой белок, имеющий необходимое содержание всех незаменимых аминокислот, называется совершенным. Растительные белки несовершенны: в них низок уровень некоторых незаменимых аминокислот. Хотя ни один из растительных белков не может обеспечить нас всеми незаменимыми аминокислотами, смеси таких белков - могут. Такие комбинированные продукты питания, которые содержат взаимодополняющие (комплементарные) белки, входят в состав традиционной кухни всех народов мира.
Человеческое тело не может запасать белки, поэтому сбалансированное белковое питание требуется человеку каждый день. Взрослому человеку весом 82 кг требуется 79 г белка в день. Рекомендуется, чтобы при этом с белками поступало 10 - 12% всех калорий.
7. Решение познавательных задач с практическим содержанием (работа в группах)
Многие методы химии и химической технологии выросли из древних приемов «кухонных дел мастеров». Не зря немецкий физикохимик Вильгельм Фридрих Оствальд в свое время заметил, что «каждый химик должен протянуть руку кухарке и пожать ее как своему коллеге». Кулинарные операции, состав и свойства распространенных компонентов пищи не объяснишь без знания химии.
Пришло время показать ваши знания по химии, связав их со своей повседневной жизнью. Работать будем в группах по четыре человека. Каждая группа получит вопрос из кулинарии. Пользуясь литературой и своими конспектами, вы должны подготовить грамотный с точки зрения и химии, и кулинарии ответ.
После выполнения задания один представитель от группы озвучивает свой вопрос и дает на него ответ.
УРОК ПО ТЕМЕ: "СТРОЕНИЕ И СВОЙСТВА БЕЛКОВ"
Цель: Сформировать понятия белок, структуры белка, физические и химические свойства белков.
Ход урока
I. Организационный момент.
II. Актуализация знаний.
(Ученикам заранее предлагается повторить тему “Аминокислоты”).
Два ученика работают у доски.
Задание 1. Напишите формулы 2-аминопропановой кислоты (аланина) и 3-метил-2-аминобутановой кислоты (валина). Какие еще названия этих кислот Вы можете предложить?
Задание 2. Напишите формулу 2-аминоэтановой кислоты. Какие еще названия этой кислоты Вам известны? Составьте дипептид из двух остатков этой кислоты. Укажите место пептидной связи.
Фронтальная беседа.
Какие две функциональные группы входят в состав аминокислот?
Чем являются аминокислоты с точки зрения кислотно-основных свойств? За счет каких функциональных групп?
Дать понятие пептидной связи.
Могут ли аминокислоты образовывать водородные связи? За счет каких атомов?
Какие вещества называются полимерами? Приведите примеры известных вам полимеров.
III. Постановка познавательной задачи.
Учащиеся, которые работали около доски, отчитываются о выполненном задании.
Давайте посмотрим на доску, где изображен дипептид, состоящий из остатков одной и той же аминокислоты - глицина. Также на доске вы видите две отдельные формулы аминокислот – аланина и валина.
Скажите, на ваш взгляд, может ли образоваться дипептид из разных по составу аминокислот? Для того, чтобы ответить на этот вопрос, обратите внимание на место пептидной связи в дипептиде.

Глицин
 -аминоуксусная
кислота
-аминоуксусная
кислота

Аланин
 -аминопропионовая
кислота
-аминопропионовая
кислота
Да, так как в образовании пептидной связи принимают участие аминогруппа одной аминокислоты и карбоксильная группа другой аминокислоты, углеводородные радикалы не принимают участия в образовании пептидных связей.
Как вы думаете, возможно ли дальнейшее присоединение аминокислот к этому веществу? Ответ обоснуйте.
Да, возможно присоединение, так как у молекулы дипептида имеются свободные карбоксильная группа (С – конец) и аминогруппа (N - конец). Цепь может расти с двух сторон.

Ала-гли
Сколько вариантов соединения вы можете предложить?
Два. Когда аминокислота глицин стоит на первом месте и когда аминокислота глицин стоит на втором месте?

Ала-гли

Гли-ала
В клетках и тканях живых организмов обнаружено свыше 170 различных аминокислот, и из них 20 альфа-аминокислот входят в состав важнейших биологических веществ, называемых белками.
Итак, тема нашего урока “Белки. Строение и свойства”.
Давайте попробуем дать определение белков.
Белки - это биологические полимеры, состоящие из альфа-аминокислот.
Очень хорошо. Запишите это определение в свои рабочие листки.
Перед нами две полипептидные цепочки. Какой из пептидов, на ваш взгляд, может являться белком и почему?


Первая. Потому что образована альфа-аминокислотами.
Верно. Данная полипептидная цепочка представляет собой первичную структуру белка. Итак, за счет каких связей возникает первичная структура белка?
Первичная структура возникает за счет пептидных связей.

Верно. Давайте запишем это в таблицу.
Но белок гораздо более сложная система, чем полипептидная цепочка. Помимо первичной структуры белка необходимо рассматривать вторичную, третичную, а в некоторых случаях и четвертичную структуры.
В образовании вторичной структуры белка огромную роль играют водородные связи. В начале урока мы вспомнили с вами о том, какие атомы могут участвовать в образовании этого вида связи.
Водород и кислород, азот.
Существуют два типа вторичной
структуры ( -спираль
и
-спираль
и
 -структура),
но в основе каждого из них лежат водородные
связи.
-структура),
но в основе каждого из них лежат водородные
связи.

 -спираль
-спираль
Заполним рабочие листки.
Третичная структура белка – это
способ расположения
 -спирали
и
-спирали
и
 -слоя
в пространстве. Осуществляется за счет
нескольких типов связей, а именно:
-слоя
в пространстве. Осуществляется за счет
нескольких типов связей, а именно:
Ковалентные связи между атомами серы различных аминокислот (дисульфидные мостики S – S).
Гидрофильно-гидрофобные взаимодействия
Гидро – вода
Филос – любовь
Фобос – ненависть

Третичная структура белка.
Заполним рабочие листки.
Некоторые белки образуют четвертичную структуру, осуществляемую за счет все тех же водородных связей и сил электростатического притяжения.

Четвертичная структура белка гемоглобина.
Заполним рабочие листки.
Следует отметить, что белки “работают” правильно только в третичной или четвертичной структурах (если таковая имеется).
Мы рассмотрели строение и теперь переходим к свойствам белков. Ведь, как известно, свойства веществ основываются на их строении. Сначала рассмотрим физические свойства белков.
Белки – высокомолекулярные соединения, т.е. это вещества с высокой молекулярной массой от 5 тыс. до миллионов а.е.м. (6500 - инсулин; 32 млн. - белок вируса гриппа).
Растворимость белков в воде зависит от их функций. Молекулы фибриллярных белков вытянуты в длину, нитеобразны и склонны группироваться одна возле другой с образованием волокон. Это основной строительный материал для тканей: сухожилий, мускульных и покровных. Такие белки в воде не растворимы. Прочность белковых молекул просто поразительна! Человеческий волос прочнее меди и может соперничать со специальными видами стали. Пучок волос площадью 1 см2 выдерживает вес в 5 тонн, а на женской косе в 200 тыс. волосинок можно поднять груженый КамАз весом 20 тонн.
Глобулярные белки свернуты в клубочки. В организме они выполняют ряд биологических функций, требующих их подвижности, т.е. растворимости. Поэтому глобулярные белки растворимы в воде либо в растворах солей, кислот или оснований. Из-за большого размера молекул образуются растворы, называемые коллоидными.
Демонстрация растворения альбумина в воде.
Теперь переходим к химическим свойствам белков. И опять мы здесь увидим не совсем обычные химические реакции, так как белки являются полимерными молекулами. Посмотрите в свои рабочие карточки и ответьте на следующие вопросы:
Какие связи, по Вашему мнению, являются наиболее прочными: пептидные или водородные?
Пептидные, т. к. эта связь относится к ковалентной химической связи.
Какие структуры белков будут разрушаться быстрее и легче?
Четвертичная (если таковая имеется), третичная и вторичная. Первичная структура будет сохраняться дольше других, т.к. она образована более прочными связями.
Денатурация – это разрушение белка до первичной структуры (пептидные связи сохраняются).

Демонстрация опыта. В 5 небольших пробирок налить по 4 мл раствора альбумина. Первую пробирку нагреть в течении 6 – 10 с (до помутнения). Во вторую пробирку добавить 2 мл 3М HCl. В третью - 2 мл 3М NaOH. В четвертую – 5 капель 0,1 М AgNO>3>. В пятую – 5 капедь 0.1 М NaNO>3>.
После проведения опыта на рабочих листках учащиеся заполняют пробелы в следующей фразе:
Денатурация – это разрушение белка до структуры под действием , а также под действием растворов различных химических веществ ( , , солей) и радиации.
Будут ли белки после денатурации проявлять свои специфические свойства?
Большинство белков при денатурации утрачивают биологическую активность, т.к. белки проявляют свои специфические свойства только в высших структурах, т.е. третичной и четвертичной.
Как вы полагаете, можно ли разрушить первичную структуру белка?
Наверное, можно.
Это происходит в вашем организме каждый раз, когда в него поступает белковая пища! Сейчас мы будем рассматривать одно из самых важных свойств белков, а именно – гидролиз.
Гидролиз белка. При гидролизе белка происходит разрушение первичной структуры.
Какие вещества будут образовываться при гидролизе?
 -аминокислоты.
-аминокислоты.
Гидролиз – это разрушение структуры белка под действием , а так же водных растворов кислот или щелочей.
Подумайте, какое значение для нашего организма имеет гидролиз белков и где он происходит?
Получение аминокислот для нужд организма в результате процессов пищеварения, начинается в желудке, заканчивается в двенадцатиперстной кишке.
Цветные реакции белков – качественные реакции на белки.
а) Биуретовая реакция (Демонстрация опыта).
б) Ксантопротеиновая реакция (Демонстрация опыта).
Заполняем рабочие листки (обратить внимание на условия протекания этих реакций и их важность для проведения опытов на следующем уроке.) [7-9].
IV. Закрепление

ТЕСТЫ
1. Выберите формулу аминокислоты:

2. В задании 1 укажите химическую формулу амида.
3. В задании 1 укажите химическую формулу уреида.
4. Какая формула в
задании 1 может принадлежать
 -бутиролактаму?
-бутиролактаму?
5. Среди приведенных ниже химических формул укажите формулу аминокислоты, содержащей ароматический заместитель.
6. Какое вещество в задании 5 имеет название «пролин»?
7. Какое вещество (см. задание 5) является изомером антраниловой кислоты?
8. Подберите второе название для 2-амино-3-меркаптопропановой кислоты.
1)Валин.
2)Серин.
3)Тирозин.
4)Метионин.
5) Цистеин. +
6)Треонин.
7) Аспарагин.
9. Какое вещество в задании 8 является амидом аминокислоты? 7)
10. Какое название получит данная аминокислота по номенклатуре ИЮПАК:
H>2>N–(CH>2>)>4>–CH(NH>2>)–COOH?
1) 2,6-Диаминогексановая кислота. +
2)2,6-Диаминокапроновая кислота.
3) ,
,
 -Диаминокапроновая
кислота.
-Диаминокапроновая
кислота.
4) 1-Карбокси-1,5-диаминопентан.
11. В формуле
аминоуксусной кислоты стрелками показано
смещение электронной плотности по
 -связям:
-связям:
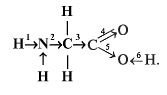
В каком месте направление смещения электронной плотности показано неправильно? В ответе укажите номер связи. (2)
12. Какой из пронумерованных атомов в молекуле глицина является объектом атаки электрофильных частиц? (1)

13. Известно, что аминокислоты представлены в водных растворах в виде биполярных ионов (цвиттер-ионов):

Определите ошибочное утверждение в описании строения и свойств цвиттер-иона.
1) Цвиттер-ион существует в растворах, у которых рН соответствует
зоэлектрической точке аминокислоты.
2) Биполярная частица не может проявлять кислотные свойства, т. к. в карбоксигруппе отсутствует ион Н+.
3) При добавлении в раствор более сильной кислоты карбоксигруппа приобретает свой обычный состав: –СООН.
4) В электрическом поле цвиттер-ион неподвижен.
5) Цвиттер-ионы образуют все аминокислоты независимо от строения радикала.
6) Водные растворы, содержащие указанные ионы, не изменяют окраски индикаторов. +
14. Выберите неверный пункт в описании строения и свойств аспарагиновой кислоты
НООС–СН>2>–СН(NН>2>)–СООН.
В водном растворе образует ионы, подвижные в электрическом поле.
Фиолетовый лакмус в растворе аспарагиновой кислоты приобретает красное окрашивание.
Ионы, образуемые аспарагиновой кислотой в водном растворе, в электрическом поле перемещаются к аноду.
4) Ионы аспарагиновой кислоты в электрическом поле неподвижны, т. к. представляют собой биполярные ионы. +
5) В водном растворе аспарагиновая кислота присутствует в следующей форме:

15. Все аминокислоты,
образующие белки, –
 -аминокислоты.
Их строение (за исключением пролина)
может быть представлено следующими
структурной и проекционной формулами:
-аминокислоты.
Их строение (за исключением пролина)
может быть представлено следующими
структурной и проекционной формулами:

Определите неверное утверждение в описании проекционной формулы аминокислоты и свойств молекулы.
1) Это оптически активное соединение вращает плоскость поляризованного света влево или вправо.
2)Данная аминокислота относится к D-ряду.
3) Принадлежность к D-ряду определяется вращением плоскости поляризации света. В данном случае наблюдается вращение плоскости поляризации вправо. +
4) Принадлежность к D- или к L-ряду определяется относительным расположением атома Н и NH>2>-группы при С-2 в пространстве, группы –СООН и –R должны быть удалены от наблюдателя. При изображении на плоскости удаленность показана вертикальной линией связи; приближенность к наблюдателю демонстрирует горизонтальная линия.
5) Аминокислота приведенной оптической конфигурации не может быть обнаружена в белках.
16. Какое утверждение в описании строения и свойств лизина

наиболее сомнительно?
1) Вещество может
быть названо
 ,
,
 -диаминокапроновой
кислотой.
-диаминокапроновой
кислотой.
2) Это незаменимая аминокислота, т. к. в организме человека невозможен ее синтез из более простых веществ.
3) Водные растворы лизина имеют рН > 7 и изменяют цвет индикаторов фиолетового лакмуса и бесцветного фенолфталеина.
4) В образовании
пептидной цепи белка у лизина участвуют
карбоксильная группа и
 -аминогруппа.
+
-аминогруппа.
+
17. При каких условиях возможно такое превращение:

1) Достаточно растворения исходного вещества в воде. В водном растворе устанавливается равновесие между указанными формами.
2) При добавлении к исходному веществу раствора кислоты.
3) При добавлении к водному раствору вещества раствора основания. +
4) Подобный переход наблюдается при действии на цвиттерион сил электрического поля.
5) Переход возможен только при действии на исходное вещество окислителей.
18. В какой форме существует аминокислота валин в растворе при рН, соответствующем изоэлектрической точке для данной аминокислоты?

19. Одним из способов получения аминокислот является синтез галогенсодержащих карбоновых кислот с последующим действием избытка аммиака. Для каких аминокислот наиболее приемлем данный способ получения?
1) -Аминокислот.
+
-Аминокислот.
+
2) -аминокислот.
-аминокислот.
3) -Аминокислот.
-Аминокислот.
4)
 -Аминокислот.
-Аминокислот.
20. Какое исходное вещество необходимо взять для получения аминокислоты по приведенной схеме:
NН>4>CN
+ Х

 -аминомасляная
кислота?
-аминомасляная
кислота?
Вещество Х – это:

21. Укажите наиболее вероятный продукт реакции метакриловой кислоты с аммиаком:



22. Какое вещество образуется в результате следующих превращений:

23. В данной схеме превращений определите вещество Х>1>:

24. В задании 23 определите конечный продукт цепочки превращений, вещество X>4> (укажите основной продукт).

25. Какое вещество Х
следует взять для получения
 -аминоизовалериановой
кислоты из метилового эфира нитроуксусной
кислоты:
-аминоизовалериановой
кислоты из метилового эфира нитроуксусной
кислоты:

1) СН>3>–СНСl–CН>3>. +
2)СН>3>–СН>2>–CН>2>Сl.
3)(СН>3>)>2>СН–СН>2>Сl.
4)СН>2>Сl–СН>2>–СH>3>.
5) (СН>3>)>3>ССl.
26. Выберите правильное утверждение, описывающее приведенную ниже схему:

1) Аминокислота проявила специфическое свойство, которое следует рассматривать как результат присутствия в молекуле одновременно NН>2>- и СООН-групп.
2) Аминокислота
проявила свойства основания, т. к.
изменения произошли по
 -группе,
которая определяет основные свойства
вещества.
-группе,
которая определяет основные свойства
вещества.
3) Аминокислота в таком состоянии не может проявлять свойства кислоты, т. к. в карбоксигруппе отсутствует атом водорода.
4) Аминокислота проявила свойство кислоты, т. к. в реакции отщепляются ионы Н+. +
5) Течение реакции по приведенной схеме невозможно.
27. Какое вещество вероятнее всего образуется в реакции
H>2>N–(СН>2>)>2>–СООН
+ РСl>5>
 ...
?
...
?

28. Аминокислоты могут быть проалкилированы с помощью ангидридов кислот. Вам предлагается определить продукт реакции, идущей по следующей схеме:

29. Какое условие
будет способствовать реакции этерификации
 -аминопропионовой
кислоты с этанолом:
-аминопропионовой
кислоты с этанолом:

1)Добавление щелочи.
2) Аминокислота должна быть взята в виде водного раствора.
3)Повышение давления.
4) Добавление соляной кислоты. +
30. Какое вещество является продуктом реакции этерификации аланина с этанолом в присутствии бромоводорода?

31. Каким веществом следует воспользоваться для получения


32. Какое вещество из предложенных в задании 31 при нагревании легко отщепляет аммиак и образует непредельную кислоту? (3)
33. Какая аминокислота из предложенных в задании 31 при нагревании отщепляет воду и может образовать производное дикетопиперазина? (1)
34. Какой из предложенных лактамов легче подвергается гидролизу?

35. Какая из нижеприведенных химических реакций при указанных условиях приведет к дезаминированию аминокислоты?

36. В ходе какой химической реакции (см. ответы к заданию 35) произойдет декарбоксилирование аминокислоты? (4)
37. Какая химическая реакция из приведенных в задании 35 приведет к образованию пропанамина? (4)
38. В какой реакции из приведенных в задании 35 образуется масляная кислота? (2)
39. Какое вещество образуется в результате полного гидролиза 3,6-диэтил-2,5-дикетопиперазина:

40. Возможно ли образование дипептида между указанными веществами при участии в химическом процессе атома Сl:

Выберите правильный ответ.
Да, возможно. Реакция сопровождается отщеплением НCl и образованием пептидной связи. +
Нет, пептидная связь образуется только при взаимодействии карбокси- и NН>2>-групп разных молекул аминокислот с отщеплением воды.
Нет, потому что атом Сl, имея свободные электронные пары, входит в сопряжение с р-орбиталями карбонильной группы. Вследствие этого cвязь С–Сl оказывается прочной. Дипептид не образуется.
Нет, дипептид по указанной схеме не образуется. Продуктом реакции является

Сколько различных дипептидов можно получить, используя только глицин и фенилаланин?
а) 1
б) 2
в) 3
г) 4 +
42. Реагируя с какими веществами при определенных условиях аминоуксусная кислота образует соль?
а) хлороводород +
б) этанол
в) гидроксид натрия +
г) серная разбавленная кислота +
43. Реагируя с какими веществами при определенных условиях глицин формирует пептидную связь?
а) хлороводород
б) гидроксид калия
в) альфа- аланин +
г) глицилглицин +
44. При гидролизе каких веществ можно получить аминокислоту?
а) глицилфенилаланин +
б) крахмал
в) белок
г) твердый жир +
45. Аминокислоту можно получить при взаимодействии аммиака с:
а) хлорбензолом
б) этилбромидом
в) 2- пропанолом
г) β- хлорпропионовой кислотой +
46. В молекуле белка содержится один атом серы и массовая доля серы в белке 0,32%. Вычислите значение молярной массы (г/моль) белка:
а) 1000
б) 10000 +
в) 1*
г)

47. Укажите название веществ,
которые реагируют с
 :
:
а) анилин
б) хлорид фениламмония +
в) глицин +
г) бромид триметиламмония +
48. С хлороводородом реагируют:
а) анилин +
б) хлорид метиламмония
в) глицин +
г) бромид триметиламмония +
49. Какие утверждения в отношении строения и свойств белков справедливы?
а) первичная структура- последовательность альфа- аминокислотных звеньев в линейной полипептидной цепи +
б) продукт реакции поликонденсации β—аминокислот
в) при гидролизе образует смесь различных альфа – аминокислот +
г) гемоглобин- белок с четвертичной структурой +
50. Какие из названных соединений обладают амфотерными свойствами?
а) метиламин
б) анилин
в) аминоуксусная кислота +
г) альфа- аланин +
51. Биполярный ион аминокислоты образуется в результате:
а) взаимодействия со щелочами
б) взаимодействия с галогеноводородами
в) образования полипептидов
г) внутренней нейтрализации +
52. Амин может образоваться в результате реакций:
а) гидролиза дипептида
б) взаимодействия бромида фениламмония с водным раствором щелочи+
в) внутренней нейтрализации аминокислоты
г) восстановления нитробензола водородом +
53. С какими веществами, перечисленными ниже реагирует гликокол:
а) бромоводород +
б) гидроксид калия +
в) 1- пропанол +
г) β- аланин +
54. Сколько пептидных связей входит в состав молекулы тетрапептида?
а) 1
б) 3 +
в) 2
г) 4
55. Реагируя с каким веществом глицин образует сложный эфир?
а) гидроксид натрия
б) этанол (кислая среда) +
в) бромоводород
г) аминоуксусная кислота
56. Реагируя с какими веществами хлороводород образует соль?
а) фенол
б) альфа- аланин +
в) анилин +
г) нитробензол
57. Чтобы выделить из бромида фениламмония фениламин нужно воспользоваться реактивом:
а) водой
б) водородом
в) водным раствором щелочи +
г) бромной водой
58. Процесс синтеза метионина включает:
а) 6 стадий
б) 2 стадии
в) 1 стадию
г) 5стадий +
59. Побочные продукты при синтезе метионина:
а) сероводород и циановодород +
б) серная кислота
в) формальдегид
г) фенол
60. Одним из промышленных способов метионина является:
а) синтез из метилового спирта +
б) синтез из ацетилена
в) синтез из азотной кислоты
г) синтез из элементарной серы [11].
|
Количество выполненных заданий, в % |
Оценка |
|
35-40 |
неудовлетворительно |
|
40-60 |
удовлетворительно |
|
60-95 |
хорошо |
|
95-100 |
отлично |
Литература
1.В.М.Комягин «Экология и промышленность».
2.Одум Ю. «Основы экологии» - М.:Мир, 1985г.
3.Никитин Д.П. Новиков Ю.В. Окружающая среда и человек. – М.: 1986г.
4. Горковенко М. Ю. Поурочные разработки по химии, Москва «ВАКО»,
5. Ахметов Н. С. Учебник для 11 класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
6.Рудзитис Г. Е., Фельдман Р. Г. Учебник для 11 класса средней школы. М.: Просвещение, 1992
7. Котова Т.А., Волкова М.В. Успехи в области производства и применения аминокислот. - М.:ОНТИТЭ Имикробиопром, 2003.
8. Опытно-промышленный регламент № 254 производства L-триптофана микробиологическим синтезом. - М.; Бишкек, 1994. - 195 с.
9. Литовченко И.В., Макаренко К.В., Стручалина Т.И. Проблемы и перспективы анаэробной микробиологической конверсии аминокислот в биогаз. - Фрунзе: Илим, 1990. - 20с. .
10. Литовченко В.В., Таштаналиев А.С., Стручалина Т.И.., Прохоренко В.В. Биотрансформация органических отходов производства аминокислот // / Изв. НАН КР. - 2001. - № 1-2. - С. 31-35.
11. Габриелян О.С., Остроумов И.Г., Остроумова Е.Е. Органическая химия в тестах, задачах, упражнениях. 10 класс: Учеб. пособие для общеобразовательных учреждений. – М.: Дрофа, 2004. – С. 190–215.
12. Энциклопедия для детей. Т. 17. Химия / Под ред. В.А. Володина. – М.: Аванта+, 2001. – С. 370–393
13. Барковский Е. В., Врублевский А. И. Тесты по химии, Минск, Юнипресс, 2002
14. Химия: Большой справочник для школьников и поступающих в вузы / Е. А. Алферова, Н. С. Ахметов, Н. В. Богомолова и др. М.: Дрофа, 1999. 485-498






















