Основы биохимии (работа 3)
КОНТРОЛЬНАЯ РАБОТА ПО БИОХИМИИ
Вопрос 1
Дайте характеристику различных видов РНК.
В клетках существует три главных типа РНК [1-5]: информационная, или матричная РНК (мРНК), рибосомная РНК (рРНК) и транспортная РНК (тРНК). В ядре клеток эукариот содержится РНК четвертого типа – гетероядерная РНК (гяРНК). Все эти три типа характеризуются определенным молекулярным весом и определенным нуклеотидным составом (табл. 1).
Таблица 1 Характеристика разных РНК E. coli [1,2]
|
Тип РНК |
Содержание, % |
Коэффициент седиментации, S |
Мr |
Число нуклеотидов |
|
рРНК |
80 |
23 6 5 |
1 млн. 500 тыс. 35 тыс. |
3 тыс. 1,5 тыс. 100 |
|
тРНК |
15 |
4 |
25 тыс. |
75 |
|
мРНК |
5 |
4-26 |
25 тыс.- 1 млн. |
75-3000 |
Молекулы у всех трех типов РНК одноцепочечны. Каждый из типов РНК включает несколько молекулярных видов. Для рРНК известно три основных вида; число видов тРНК доходит до 60, а число видов мРНК достигает сотен и даже тысяч. В большинстве клеток содержание РНК во много раз (от 5 до 10) превышает содержание ДНК.
мРНК. Содержит только четыре основания – А, Г, Ц и У. Она синтезируется в ядре в процессе транскрипции, в ходе которого нуклеотидная последовательность одной из цепей хромосомной ДНК ферментативным путем транскрибируется с образованием одиночной цепи мРНК. Основания образующейся цепи мРНК комплементарны основаниям соответствующей цепи ДНК. После завершения транскрипции мРНК переходит на рибосомы, где она используется в качестве матрицы, определяющей последовательность аминокислот в растущей полипептидной цепи. Каждый из тысяч различных белков, синтезируемых клеткой, кодируется специфической мРНК или специфическим участком мРНК.
тРНК. Молекулы тРНК сравнительно невелики. Их функция состоит в том, чтобы в ходе белкового синтеза переносить на рибосому определенные аминокислоты. Каждой из 20 аминокислот, обнаруженных в белках, соответствует, по крайней мере, одна тРНК. Молекулы тРНК могут находиться в свободной форме и могут быть "нагружены" специфическими аминокислотами. В тРНК, нагруженной аминокислотой, карбоксильная группа этой аминокислоты связана сложноэфирной связью с 3-гидроксилом концевого остатка адениловой кислоты на одном из концов полинуклеотидной цепи тРНК. Для тРНК характерно наличие, наряду с обычными основаниями А, Г, Ц, и У, довольно значительного количества необычных, или минорных оснований. Содержание их доходит до 10 % общего содержания оснований. Минорные основания представляют собой главным образом метилированные формы обычных оснований или их производные. Кроме того, молекулы тРНК содержат такие мононуклеотиды, как псевдоуридиловая или риботимидиловая кислоты. С конца полинуклеотидной цепи все тРНК содержат обычно остаток гуаниловой кислоты, связанный через 3-гидроксильную группу с соседним нуклеотидным остатком. Концевой остаток гуаниловой кислоты содержит добавочную фосфатную группу при 5-гидроксильной группе. На другом конце цепи все молекулы тРНК имеют одинаковую тринуклеотидную последовательность, а именно фЦфЦфА. 5-гидроксильная группа концевого остатка адениловой кислоты связана с предшествующим остатком цитидиловой кислоты; 2- и 3-положения адениловой кислоты свободны. Общую структуру тРНК поэтому можно изобразить в виде: фГ(фН)>75-90>фЦфЦфА ОН.
Свободная 2- или 3-гидроксильная группа концевого остатка адениловой кислоты в последовательности фЦфЦфА молекул тРНК ферментативно этерифицируется специфической в отношении данной тРНК -аминокислотой с образованием активной формы, называемой аминоацил-тРНК [2]:
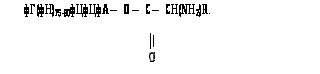
Остаток этой аминокислоты ферментативно переносится к концу растущей полипептидной цепи на поверхности рибосомы.
Вторичная структура тРНК. Все известные тРНК образуют "клеверный лист" – структуру, образующуюся с помощью водородных связей и состоящую из четырех стеблей (акцепторный, Д, антикодоновый и Т) и трех петель (Д, антикодоновой и Т). Некоторые тРНК имеют дополнительные петли и стебли. Каждый стебель состоит из двух антипараллельных цепей, основания которых образуют друг с другом уотсон-криковские пары с помощью водородных связей. Стебли имеют форму правой двойной спирали, известной как А-форма РНК. Третичная структура тРНК [1]. Молекула напоминает по форме букву Г. Она значительно более вытянута, чем глобулярные белки той же молекулярной массы. Акцепторный и Т-стебли уложены в пространстве таким образом, что образуют одну непрерывную спираль – "перекладину" буквы Г; антикодоновый и Д-стебли образуют "ножку". Эти две части содержат каждая около 10 пар оснований. Почти все основания в тРНК учавствуют в вандер-ваальсовых и гидрофобных взаимодействиях, стабилизирующих пространственную структуру молекулы.
Молекулы тРНК характеризуются наличием антикодона [3], который представляет собой 3 последовательных основания, с помощью которых распознается соответствующий кодон мРНК. Узнавание осуществляется путем образования уотсон-криковских водородных связей между основаниями кодона, с одной стороны, и антикодона – с другой, при условии, что полинуклеотидные цепи антипараллельны.
рРНК. Молекулы рРНК встречаются в различных формах и образуют в комплексе с белками рибосому – сложную органеллу, в которой происходит синтез белка. У некоторых молекул рРНК определена нуклеотидная последовательность. При анализе этих последовательностей обнаружены участки, в которых может происходить спаривание оснований и которые могут участвовать в образовании вторичной структуры, подобно тому, как это происходит в стеблях молекулы тРНК. Отрицательно заряженные фосфатные группы молекул рРНК взаимодействуют с положительно заряженными группами боковых цепей рибосомных белков (аргинин, лизин), что и стабилизирует комплекс белок – нуклеиновая кислота.
вопрос 2
Приведите реакцию, лежащую в основе синтеза белков, на примере получения тетрапептида ала-вал-цис-гли.
Синтез белка осуществляется путем последовательной поликонденсации отдельных аминокислотных остатков, начиная с амино-(N)-конца полипептидной цепи, в направлении к карбоксильному (С)-концу. Каждая аминокислота кодируется кодоном – последовательностью 3 нуклеотидов мРНк, т.е. триплетом. Декодирование мРНК происходит соответственно в направлении 5 3. Тетрапептид ала-вал-цис-гли может кодироваться следующей последовательностью нуклеотидов мРНК: ГЦУ-ГУУ-УГУ-ГГУ-УГА. Последний кодон (УГА) прерывает синтез белка. Указанная последовательность кодонов мРНК образуется в результате процесса транскрипции, ей соответствует следующая последовательность нуклеотидов ДНК: ЦГА-ЦАА-АЦА-ЦЦА-АЦТ.
Таким образом, состав белка в клетке определяется последовательностью нуклеотидов в мРНК и ДНК.
ВОПРОС 3
Приведите структурную формулу НАД (никотинамидадениндинуклеотида), покажите составные части.
Молекула НАД (рис. 1) состоит из двух мононуклеотидных единиц – аденозин-5-фосфата (см. рис. 1, А>1>) и никотинамиднуклеотида (см. рис. 1, А>2>), соединенных между собой ангидридной связью; их фосфатные группы образуют 5,5-пирофосфатный мостик (см. рис. 1, В).
ВОПРОС 4
Фосфатиды, их биологическое значение.
Фосфатиды [3-5] – это сложные липиды, отличительным признаком которых является присутствие в молекулах остатка фосфорной кислоты. В состав фосфатидов входят также глицерин, жирные кислоты, альдегиды и азотистые соединения (холин, этаноламин, серин). Важнейшие представители фосфатидов – глицерофосфатиды (фосфатидилхолин, фосфатидилэтаноламин, фосфатидилсерин, фосфатидилинозит, кардиолипин) и фосфосфинголипиды – сфингомиелины. Каждый класс фосфатидов объединяет множество однотипных молекул, содержащих различные жирные кислоты или альдегиды. При этом ненасыщенные жирные кислоты преимущественно находятся при 2-м углеродном атоме молекулы глицерина.
Фосфатиды широко распространены в природе. В качестве основных структурных компонентов они входят в состав клеточных мембран животных, растений и микроорганизмов, определяя их строение и проницаемость, а также активность ряда локализованных в мембранах ферментов. С белками фосфатиды образуют липопротеиновые комплексы. Различным биологическим мембранам присущ определённый состав фосфатидов. Так, кардиолипин – специфический митохондриальный фосфатид; сфингомиелин присутствует в основном в плазматических мембранах. В мембранах микроорганизмов всегда содержится фосфатидилглицерин и редко лецитин (в отличие от клеток животных).
вопрос 5
Каковы признаки авитаминоза В>2>? Что является источником этого витамина?
При недостаточном потреблении витамина В>2> у взрослого человека нарушается зрение и повреждаются слизистые оболочки полости рта. Витамин В>2> содержится в зерне, печени, мясе, молоке, яйцах [3].
вопрос 6
Какие аминокислоты являются незаменимыми в питании животных и человека? Приведите примеры.
Незаменимыми являются аминокислоты, которые не синтезируются в организме позвоночных (в том числе и человека) из аммиака [3].
Например [2], для белой крысы известно 10 незаменимых аминокислот: лизин, триптофан, гистидин, фенилаланин, лейцин, изолейцин, треонин, метионин, валин и аргинин.
вопрос 7
Что понимают под окислительным фосфорилированием? Каково значение этого процесса для организма?
Окислительное фосфорилирование [3-5] – это осуществляющийся в живых клетках синтез молекул аденозинтрифосфорной кислоты (АТФ) из аденозиндифосфорной (АДФ) и фосфорной кислот за счёт энергии окисления молекул органических кислот, образующихся в цикле трикарбоновых кислот. Окислительное фосфорилирование сопряжено с переносом электронов по цепи дыхательных ферментов, встроенных во внутреннюю мембрану митохондрий. Электроны поступают в дыхательную цепь от восстановленного НАДН или НАДФН и через кофермент Q, последовательно передаются от соединений с более отрицательным окислительно-восстановительным потенциалом к соединениям с более положительным потенциалом. Перенос электронов по цепи завершается восстановлением О>2> с помощью сложного ферментного комплекса - цитохромоксидазы.
Т. о., процесс окисления субстрата кислородом опосредован серией окислительно-восстановительных реакций; в результате каждой из этих реакций энергия, запасённая в молекуле окисляемого субстрата, освобождается небольшими порциями, что позволяет клетке использовать её более полно. Утилизация высвобождаемой энергии происходит в так называемых пунктах энергетического сопряжения. Синтез АТФ из АДФ и фосфата осуществляется ферментным комплексом АТФ-синтетазой (который может катализировать и обратную реакцию - расщепление АТФ).
Эффективность окислительного фосфорилирования оценивают с помощью отношения Р/О, т. е. количества фосфата, связанного при фосфорилировании АДФ, отнесённого к поглощённому О>2>. Одна молекула АТФ образуется при переносе 2 электронов через пункт энергетического сопряжения. Р/О при окислении
В результате окислительного фосфорилирования в клетках накапливается АТФ - важнейшее макроэргическое соединение, расходуемое затем на обеспечение энергией различных процессов жизнедеятельности.
вопрос 8
Гликолиз, его энергетический эффект и биологическое значение.
Гликолиз [3-5] – это процесс расщепления углеводов (гл. обр. глюкозы) в отсутствии кислорода под действием ферментов. Конечный продукт гликолиза в клетках животных – молочная (или масляная) кислота. В растительных клетках конечным продуктом гликолиза служит пировиноградная кислота. Освобождающаяся при гликолизе энергия используется в процессах жизнедеятельности. Гликолиз тесно связан с дыханием и брожением. Гликолиз – один из основных источников энергии в клетках. Переносчиком электронов и протонов в этих окислительно-восстановительных реакциях служат коферменты НАД и НАДН, имеющиеся в составе бактериальных клеток и митохондрий, или функционально близкие НАДФ и НАДФН, содержащиеся в хлоропластах. Суммарная реакция гликолиза:
С>6>Н>12>О>6> + 2Фн + 2АДФ 2С>3>Н>4>О>3> + 2АТФ + 2Н>2>О.
Для того чтобы проанализировать энергетику гликолиза, разделим суммарное его уравнение на два процесса, а именно: превращение глюкозы в лактат (экзотермический процесс) и образование АТФ из АДФ и фосфата (эндотермический процесс):
Глюкоза 2 Лактат, Gо>1> = -47,0 ккал;
2Фн + 2АДФ 2АТФ + Н>2>О, Gо>2> = 27,30 = +14,6 ккал.
Суммарная реакция:
С>6>Н>12>О>6> + 2Фн + 2АДФ 2С>3>Н>4>О>3> + 2АТФ + 2Н>2>О.
Gо>s> = Gо>1> + Gо>2> = -47,0 ккал + 14,6 ккал = -32,4 ккал.
Из данных об изменении свободной энергии становится ясно, что расщепление глюкозы до лактата сопровождается освобождением такого количества энергии, которого более чем достаточно для фосфорилирования двух молекул АДФ до АТФ. Легко подсчитать, что 14,6/47,0100, т.е. примерно 31 % свободной энергии, освобождающейся при расщеплении глюкозы до лактата, запасается в виде энергии фосфатных связей АТФ. Приведенный расчет относится к 1,0 М концентрациям; если же учесть истинные внутриклеточные концентрации реагентов и продуктов, то окажется, что эффективность гликолиза внутри клетки значительно выше 31 %.
Суммарный процесс гликолиза, даже с учетом сопутствующего образования АТФ, сопровождается все же очень сильным уменьшением свободной энергии, составляющим 32,4 ккал. Гликолиз представляет собой, таким образом, практически необратимый процесс, для которого состояние равновесия смещено почти полностью в сторону образования лактата. Тем не менее, большинство этапов этого процесса характеризуются сравнительно небольшими величинами изменения свободной энергии. Эти реакции обратимы, и соответствующие обратные реакции используются при биосинтезе глюкозы из лактата и других предшественников.
вопрос 9
Аэробная и анаэробная работоспособность организма.
Работоспособность организма – это способность совершать работу, требующая затраты (выделения) энергии. Энергия в организме высвобождается в процессе дыхания – окисления органических веществ (белков, жиров и углеводов) кислородом воздуха.
Следовательно, в анаэробных (бескислородных) условиях на фоне снижения уровня кислорода будет наблюдаться уменьшение интенсивности окисления органических веществ и, как следствие, снижение количества выделяемой энергии, а значит и уменьшение работоспособности организма.
В аэробных условиях, наоборот, на фоне возрастания уровня кислорода будет наблюдаться повышение интенсивности окисления органических веществ и, как следствие, увеличение количества выделяемой энергии, а значит и повышение работоспособности организма.
вопрос 10
Биохимические основы быстроты (скорости) как качества двигательной деятельности.
Двигательная деятельность обеспечивается с помощью миофибрилл – органелл клетки, отвечающих за сокращение. Основными компонентами миофибриллы являются мышечные нити. Последние бывают 2-х типов: толстые нити имеют диаметр 15 нм и содержат в основном нитевидный белок миозин, а тонкие имеют 7 нм в диаметре и состоят из актина, тропомиозина и тропонина [1].
Миозин построен из двух больших и четырех малых полипептидных цепей. Каждая большая цепь состоит из двух частей: вытянутого "хвоста", имеющего -спиральную конформацию, и глобулярной "головки". Хвосты обеих больших нитей заплетены друг вокруг друга, образуя сверхскрученную структуру длиной 140 нм. Глобулярная головка каждой большой цепи находится в комплексе с двумя малыми цепями; весь комплекс также является глобулярным. Таким образом, молекула миозина имеет две глобулярные головки и один фибриллярный двухцепочечный хвост.
Актин находится в миофибриллах в форме F-актина (F-фибриллярный). F-актин – это полимер, а мономерные единицы, из которых он построен, называются G-актином (G-глобулярный). По своей структуре F-актин похож на две нитки бус, в которых бусинками служат молекулы G-актина; нитки закручены друг вокруг друга в спиральную структуру с шагом 36-38 нм.
Молекула тропомиозина представляет собой тяж длиной 40 нм, образованный двумя переплетающимися -спиральными полипептидными цепями. Тропомиозин связан с F-актином. Каждая молекула тропомиозина охватывает семь G-актиновых глобул, причем соседние его молекулы немного перекрываются между собой, так что образуется непрерывная тропомиозиновая цепь, идущая вдоль F-актинового волокна. Поскольку F-актин состоит из двух ниток, с ним связаны и две тропомиозиновые цепочки.
Тропонин является комплексом трех белков: тропонина I, тропонина T и тропонина С. Он имеет в целом более или менее глобулярную форму и располагается на F-актине через правильные промежутки, равные примерно 38 нм.
Обеспечение сокращения энергией осуществляет АТФ. Глобулярные головки миозина связывают АТФ и быстро гидролизуют его, но не так легко освобождают продукты гидролиза – АДФ и Фн. F-актин, который связывается с миозином, образуя комплекс, называемый актомиозином, ускоряет отсоединение АДФ и Фн от миозиновых головок. Освободившиеся АТФ-связывающие участки актомиозинового комплекса могут связать новые молекулы АТФ, но, как только это происходит, индуцируется диссоциация актомиозина на актин и миозин. Такой цикл может повторяться многократно – в присутствии достаточного количества АТФ. Описанное взаимодействие актина и миозина лежит в основе молекулярного механизма сокращения.
Процесс сокращения включает в себя цикл наклона головок миозина, состоящий из 4-х стадий [1]:
Миозин в толстых нитях содержит связанные АДФ и Фн, но не связан с актином тонких нитей.
При поступлении сигнала к сокращению глобулярные миозиновые головки со связанными АДФ и Фн прикрепляются к актину (образуется актомиозин).
Образование актомиозина ускоряет освобождение АДФ и Фн, что сопровождается наклоном головок миозина; при наклоне головки происходит скольжение все еще прикрепленной к ней тонкой актиновой нити вдоль толстой, что приводит к укорочению саркомера.
АТФ связывается с миозиновыми головками в актомиозине, и это приводит к отсоединению актина от миозина, после чего гидролиз АТФ миозином возвращает систему к первой фазе цикла.
Регуляция быстроты сокращения опосредуется ионами кальция. При низких концентрациях Са2+ тропонин и тропомиозин препятствуют взаимодействию актина с миозином [1]. Когда приходит нервный импульс и происходит деполяризация мембраны клеток, внутриклеточный уровень Са2+ повышается, это вызывает Са2+-зависимое изменение конформации тропонина, которое передается тропомиозину, и в результате тропомиозин меняет свое положение на актиновой нити так, что ее связывающие участки становятся доступными для головок миозина.
литература
Рис Э., Стернберг М. Введение в молекулярную биологию. – М.: Мир, 2002. – 142 с.
Ленинджер А. Биохимия. – М.: Мир, 1974. – 957 с.
Реймерс Н.Ф. Популярный биологический словарь. – М.:Наука, 1990. – 544 с.
Третьяков Н.Н. Физиология и биохимия сельскохозяйственных растений. – М.: Колос, 2000. – 640 с.
Красильникова Л.А., Авксентьева О.А., Жмурко В.В. и др. Биохимия растений. – Р-д: Феникс, 2004. – 224 с.
