Кинетика действия ферментов
Кинетика действия ферментов
Кинетические исследования ферментативных реакций необходимы не только для количественного определения ферментов и сравнения скоростей их функционирования, но, в еще большей степени, для расшифровки механизмов ферментативных реакций. В этих целях, прежде всего, необходимо уметь корректно вычислять кинетические параметры ферментативных реакций, оценивать конкурентный или неконкурентный характер действия ингибиторов. Рассмотрим основные уравнения, описывающие ферментативную кинетику и способы вычислений. Основное внимание будет уделено не строгости математического вывода уравнений, а правильному их использованию для получения достоверных результатов.
При выводе кинетических уравнений количественно характеризующих ферментативную активность, обычно делают следующие допущения.
1. Фермент и субстрат образуют фермент-субстратный комплекс за счет сил физической природы. Из этого комплекса в дальнейшем освобождаются фермент и продукт. Таким образом, химической реакцией является только второй этап – распад фермент-субстратного комплекса:

2. Концентрация субстрата обычно значительно выше концентрации фермента. Поэтому при рассмотрении начальных скоростей реакции, когда
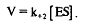
3. Константа диссоциации определяется соотношением:

концентрация продукта очень низка, обратимостью второй стадии можно пренебречь. Следовательно, – const., а скорость образования продукта равна:
Поскольку общая концентрация фермента равна сумме концентраций свободного фермента и фермента, связанного в комплекс, то + или = –.

Подставляя значение [Е] = [Е>0>] — [ES] из (4), получаем:

С другой стороны, из уравнения следует:

В уравнении выражение к>+2> можно рассматривать как максимальную скорость, достигаемую, когда концентрация фермент-субстратного комплекса численно равна общей концентрации фермента. Следовательно:
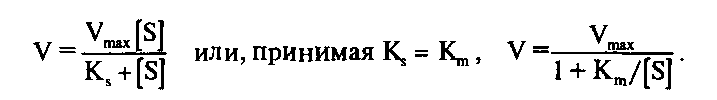
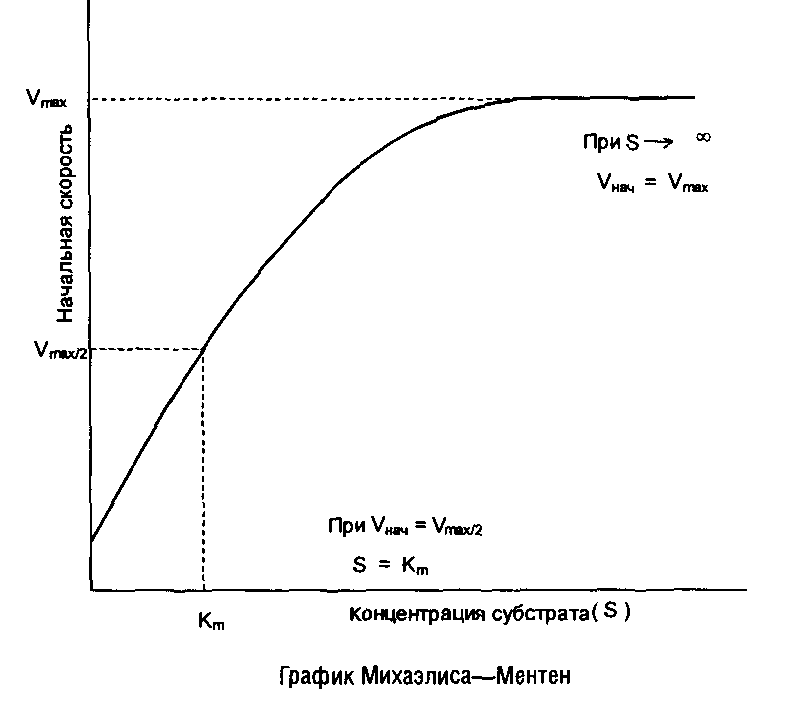
Выражение есть не что иное, как уравнение Михаэлиса–Ментен для ферментативной кинетики, а величина К>га> = K>s> представляет собой меру сродства фермента к субстрату. Численно она равна такой концентрации субстрата, при которой начальная скорость ферментативной реакции составляет половину максимальной скорости. Уравнение графически выражается гиперболой.
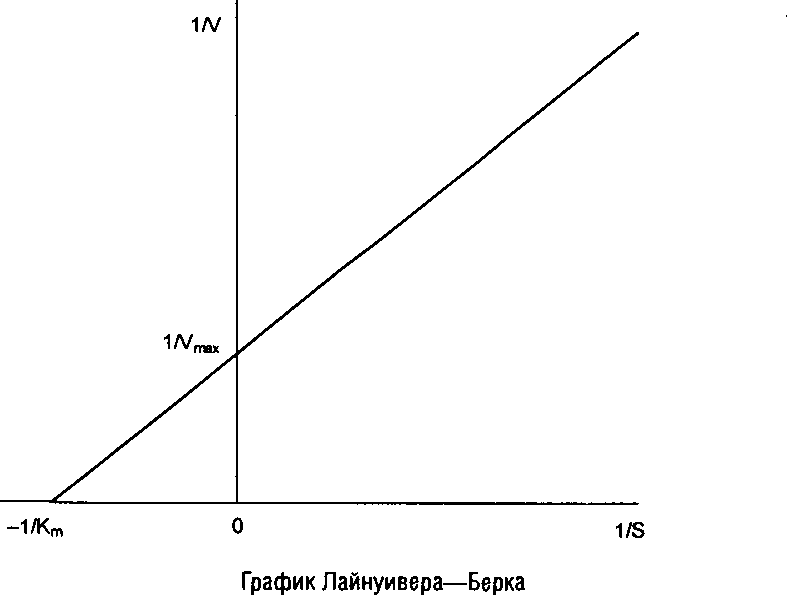
Для практического определения кинетических параметров этот график неудобен, к тому же требует использования концентраций субстрата, «насыщающих» фермент, что не всегда достижимо при ограниченной растворимости субстрата. Поэтому обычно стремятся преобразовать уравнение Михаэлиса–Ментен в такую форму, чтобы графически оно изображалось прямой линией. Чаще всего для этого используют метод Лайнуивера–Берка, представляя уравнение Михаэлиса–Ментен в виде уравнения прямой линии:
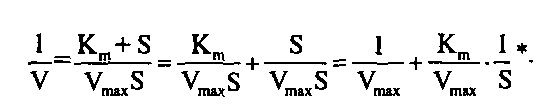
Последнее выражение называют уравнением Лайнуивера–Берка и для расчета кинетических параметров используют график, построенный в координатах: 1/V против 1/S. В результате получается прямая, отсекающая на оси ординат отрезок, равный 1/V, а на продолжении оси абсцисс отрезок, равный – 1/К>га>. Однако следует отметить, что при использовании графика Лайнуивера–Берка точки в области высоких концентраций субстрата располагаются слишком густо, а положение прямой линии во многом зависит от точек в области низких концентраций субстрата, где определение скорости менее надежно. Кроме того, реальные экспериментальные данные не всегда адекватно аппроксимируются в виде прямой линии.
Поэтому предложено еще несколько приемов для определения кинетических параметров. Метод Эди–Хофсти также основан на преобразовании уравнения Михаэлиса–Ментен. Умножив обе части уравнения на и преобразовав, получим:
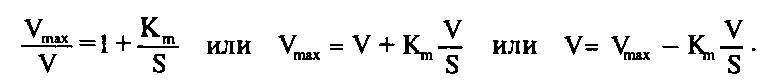
График этого уравнения в координатах V против V/S представляет собой прямую линию, отсекающую на осях ординат и абсцисс отрезки, равные V>max>H V>m>>>>>x>/ К>го> соответственно.
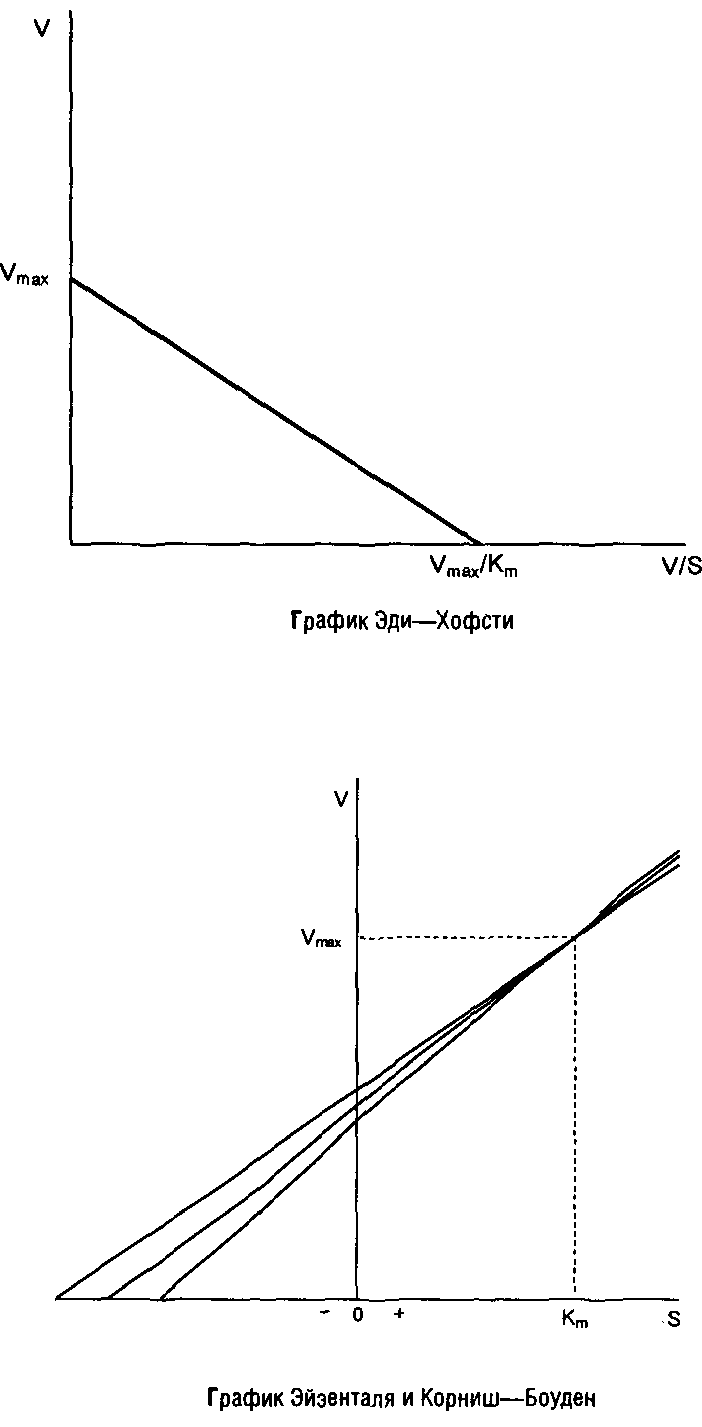
В некоторых случаях для вычисления кинетических параметров удобнее использовать метод Эйзенталя и Корниш–Боуден, основанный на преобразованном уравнении Михаэлиса–Ментен:
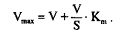
В этом случае для каждого значения V и S строится прямая в координатах V и S. Точка пересечения всех этих прямых имеет координаты: V>max> и К>т>.
Ингибирование ферментов
Изучение подавления активности ферментов служит одним из способов расшифровки механизма их действия. Подходом к решению последней задачи является изучение специфичности действия ферментов. В свою очередь, это требует корректного измерения кинетических параметров в присутствии изучаемого аналога субстрата. Рассмотрим способы определения характера взаимоотношений субстратов, их аналогов и ингибиторов ферментативной активности путем вычисления ряда кинетических параметров.
При этом, если константа диссоциации комплекса K>s> = K>m>> >равна:
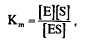

Ингибиторы ферментов можно разделить на две основные группы: обратимые и необратимые. После удаления ингибитора первого типа активность фермента восстанавливается; во втором случае ингибитор удалить не удается или активность фермента не восстанавливается даже после удаления ингибитора. Необратимое ингибирование достигает максимума, когда весь фермент связан с ингибитором. Обратимое ингибирование достигает состояния равновесия, положение которого определяется константой ингибирования, характеризующей сродство фермента к ингибитору. Схема обратимого ингибирования приведена ниже:
При конкурентном ингибировании субстрат и ингибитор связываются с одним и тем же активным центром фермента. В присутствии ингибитора снижается сродство фермента к субстрату. Величина не изменяется, так как при «насыщающей» концентрации субстрат вытесняет ингибитор из комплекса с ферментом.
При неконкурентном ингибировании субстрат и ингибитор связываются с разными центрами фермента. При этом величина К>га >не изменяется, а величина V>max> снижается.
Возможны также промежуточные или альтернативные случаи, например, когда ингибитор связывается не с ферментом, а с фермент-субстратным комплексом, как в случае бесконкурентного ингибирования, при котором изменяются оба кинетических параметра.
Для определения типа ингибирования обычно используют график Лайнуивера–Берка, полученный для данного субстрата в отсутствие и в присутствии ингибитора.
При конкурентном ингибировании, если определена величина К>т> в присутствии ингибитора, можно рассчитать константу ингибирования по следующей формуле:

При неконкурентном ингибировании с помощью определения измененной величины V можно рассчитать К. по следующей формуле:

Все биохимические процессы в клетке взаимосвязаны и взаимозависимы, тем не менее часть из них преимущественно выполняет функцию построения клеточного материала, а часть – снабжения источниками энергии этих «строительных работ». Поэтому принято разделять биохимические процессы на два основных типа: ассимиляционные, называемые анаболизмом, включающим синтез низкомолекулярных предшественников и построения из них молекул биополимеров, и диссимиляционные, называемые катаболизмом, состоящим в обеспечение источника энергии, «энергетического привода», приводящего в движение анаболизм.
Рассмотрим основные механизмы процессов трансформации энергии в клетке, т.е. механизмы катаболических процессов.
Пути и механизмы преобразования энергии в живых системах
Главная задача энергетического метаболизма – аккумуляция энергии, полученной в результате окислительно-восстановительных превращений субстратов в такую форму, которая может быть использована для роста клеток и осуществления всех их функций.
Основными формами аккумуляции энергии в клетках являются трансмембранная разность электрохимических потенциалов ионов, а также «макроэргические» химические соединения.
В клетках, как и в неживых системах, самопроизвольно протекают только те химические процессы, которые приводят к уменьшению свободной энергии системы, т.е. той доли общей энергии, которая может быть превращена в работу. Такие реакции называют экзэргоническими. Напротив, если ДОО, то реакция не может протекать самопроизвольно, так как требует притока энергии.
Уравнение Гиббса описывает взаимосвязь между свободной энергией, энтальпией и энтропией.
Кратко рассмотрим основные уравнения химической термодинамики.
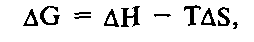
где ДН – изменение энтальпии; AS – изменение энтропии.
При реакциях в растворах изменение свободной энергии определяется уравнением:

где R – газовая постоянная; Т – абсолютная температура;
– константа равновесия химической реакции.
При стандартных условиях каждая химическая реакция характеризуется свободной энергией, вычисляемой по формуле:
AG° = -2,303 RT lgK или AG = -1,363 lgK>eq> ккал/моль-1 при 25C.
При окислительно-восстановительных реакциях изменение свободной энергии определяется уравнением:

где п – количество перенесенных электронов:
F – число Фарадея: заряд одного моля электронов; Е «' – стандартный окислительно-восстановительный потенциал для окислителя и восстановителя, В.
Эти уравнения удобно применять при расчетах. Например, можно подсчитать, сколько энергии выделяется в результате дыхания;

Таким образом, AG = 2 • 23062 кал • моль-1 - В-[0,815 - (-0,32)] В = 52351 кал/моль.
Классификация энергетических процессов
Энергетические процессы в нефототрофных организмах подразделяются на аэробные и анаэробные в зависимости от участия или не участия в них молекулярного кислорода.
Аэробное дыхание – энергетический процесс, при котором конечным акцептором электронов окисляемого субстрата, передающихся по электрон-транспортной цепи, является молекулярный кислород.
В анаэробном дыхании конечными акцепторами электронов становятся другие окислители: нитрат-, сульфат-анионы, катионы металлов, органические вещества.
Брожение – энергетический процесс, при котором электроны передаются непосредственно от донора к акцептору без участия электрон-транспортной цепи: гликолиз, молочнокислое брожение и др.
Перечисленные процессы можно классифицировать на основе механизма образования АТР, являющегося основным макроэр-гическим соединением, запасающим энергию в своих химических связях. Различают образование АТР в результате переноса электронов по дыхательной цепи – окислительное фосфорилирование, а также образование АТР в процессах, не связанных с переносом электронов по цепи – субстратное фосфорилирование. В настоящее время первый тип процессов правильнее называть образованием АТР за счет трансформации энергии трансмембранного электрохимического потенциала или сокращенно – мембранным фос-форилированием.
У фототрофных организмов основным способом запасания энергии является фо-тофосфорилирование, т.е. образование АТР за счет трансформации энергии ТЭП, формируемого путем утилизации световой энергии.
Роль АТР и ТЭП в запасании энергии
АТР был открыт в 1929 г. К. Фиске и И. Суббароу, а в 1930 г. В. Энгельгард показал возможность его образования в процессе переноса электронов по дыхательной цепи. В 1941 г. Ф. Липман выдвинул концепцию, рассматривающую АТР как «конвертируемую энергетическую валюту».
Почему в процессе эволюции именно АТР выпала такая роль? Для этого есть несколько причин, обусловленных свойствами данного соединения.

Если необходима энергия ненамного большая, чем 10 ккал/моль — по реакции Б. При необходимости энергии, значительно превышающей 10 ккал/моль, используется несколько молекул АТР в одном процессе. Иногда дополнительная энергия выделяется при сорбции АТР на ферменте.
1. Изменение свободной энергии при гидролизе фосфоангидридных связей довольно велико – около 10 ккал / моль. Когда необходима энергия меньшая или равная 10 ккал / моль, гидролиз идет по
Скорость неферментативного гидролиза АТР мала, т.е. молекула химически стабильна, и запасенная в ней энергия не рассеивается в виде тепла при спонтанном гидролизе. Однако замена Р на As резко повышает лабильность. Этим обстоятельством объясняется ингибиторное действие арсената на энергетический метаболизм: конкурируя с ортофосфатом, он включается вместо него в АТР, а образовавшееся соединение подвергается спонтанному гидролизу.
Малые размеры молекулы АТР позволяют ей свободно проникать в различные участки клетки, в то же время цитоплазматическая мембрана для нее непроницаема, следовательно, «утечка» АТР не происходит.
«Выбор» АТР как нуклеотида был вызван, по-видимому, необходимостью взаимодействия с белками, так как взаимодействие белков с моно- и полинуклеотидами лежит в основе жизнедеятельности.
«Выбор» в качестве пуриновой части молекулы аденозина, вероятно, обусловлен его промежуточными электроннодонорными и акцепторными свойствами, что обеспечивает взаимодействие с широким кругом партнеров. Кроме того, среди азотистых оснований аденин наиболее устойчив к действию ультрафиолета, что могло иметь значение на ранних этапах формирования живых систем.
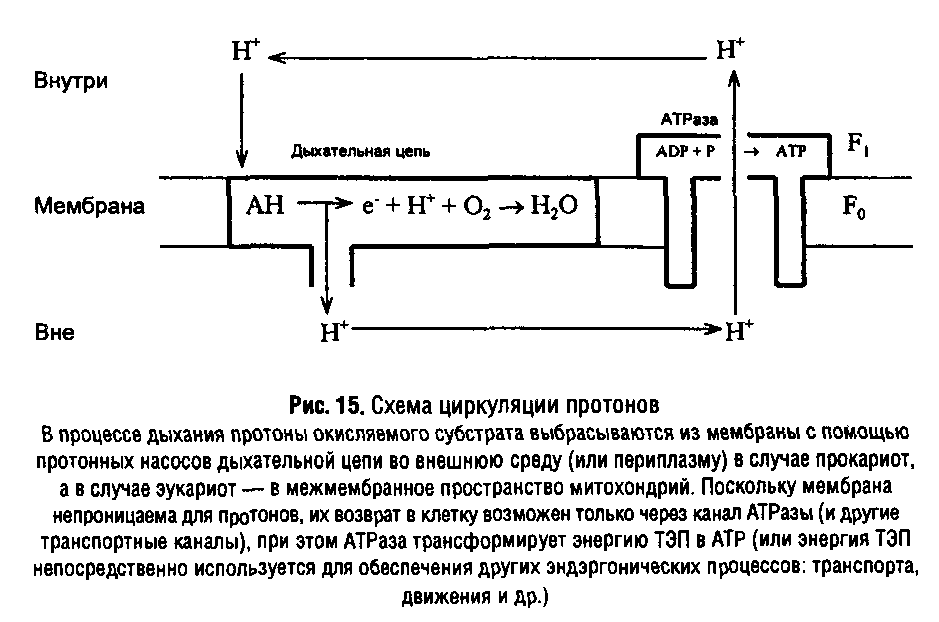
При описании механизма образования АТР путем мембранного фосфорилирования в настоящее время общепринятой является хемиосмотическая теория сопряжения окисления и фосфорилирования, предложенная П. Митчеллом в 1961 г. Согласно этой теории в «сопрягающих» мембранах локализованы два типа систем, способных к транслокации протонов: электрон-транспортная цепь и Н+-АТРаза, координированная работа которых приводит к формированию трансмембранной разности электрохимического потенциала протонов, – а затем АТР. Таким образом, первичной формой запасания энергии при дыхании является ТЭП.
Количество энергии, запасенной в форме ТЭП, прямо пропорционально количеству транслоцированных протонов: AG – пДц>н+ >и складывается из двух составляющих: химической и электрической:
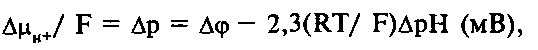
где 2,3RT/ F = Z = 59 мВ при 25°С;
Др – протондвижущая сила.
Для образования АТР необходима AG около 250 мВ. Примерно такая величина ТЭП и создается на мембранах митохондрий и прокариотических клеток, хотя вклад каждой из составляющих различен. Например, у ацидофильных бактерий ТЭП практически полностью состоит из ЛрН, а у алкалофилов – из Л<р.
Важно отметить, что АТРазный комплекс может не только утилизировать ТЭП с образованием АТР, но и формировать его за счет гидролиза АТР, осуществляя таким образом взаимное превращение этих двух форм энергии.
Первичные и вторичные генераторы ТЭП
Первичные генераторы используют энергию света или химических связей субстратов для формирования ТЭП. АТР в этих процессах не участвует. К первичным генераторам ТЭП относятся:
дыхательная цепь, содержащая от 1 до 3 протонных насосов;
фотосинтетическая цепь, содержащая 1–2 протонных насоса;
бактериродопсин галофильных архебактерий;
системы экскреции кислых продуктов брожения у бактерий в неионизированной форме.
Вторичные генераторы используют энергию АТР для формирования ТЭП. Они представляют собой Н+-АТФазы, основной функцией которых является не синтез, а гидролиз АТР. Такие АТРазы характерны для цитоплазматической мембраны анаэробных бактерий, плаз-малеммы клеток эукариот, мембраны вакуолей растений и грибов.
Таким образом, основные пути трансформации энергии в клетке можно суммировать в виде схемы.

Энергетический заряд и энергетическая эффективность роста
Количество АТР, образующегося в разных метаболических путях, различается во много раз. Так, при катаболизме глюкозы по гликолитическому пути с последующим включением цикла трикарбоновых кислот и дыхания образуется 38 моль АТР на моль глюкозы.
У некоторых бактерий в дыхательной цепи существует лишь два пункта сопряжения и количество образованного АТР составит 26 моль на моль глюкозы. Сам по себе гликолиз в анаэробных условиях приводит к образованию лишь 2 молей АТР на моль глюкозы.
Не только общее количество синтезированного АТР, но и расход АТР на образование единицы биомассы сильно зависит от типа метаболизма. Так, например, при выращивании бактерий на среде с глюкозой 1 моль АТР обеспечивает образование 27 г. биомассы, тогда как на среде с С0>2> 1 моль АТР – только 5 г биомассы. При различных типах анаэробных брожений выход биомассы на моль синтезированного АТР все же достаточно постоянен и составляет около 10. Этот показатель получил обозначение Y>ATp> и используется для характеристики роста наряду с экономическим коэффициентом.
Определенная часть клеточной энергии затрачивается на процессы, не связанные непосредственно с ростом. Их называют процессами поддержания жизнедеятельности. Затраты на поддержание жизнедеятельности составляют 10–20% всех энергетических расходов.
Важное значение имеет не только абсолютное количество АТР в клетке, но и соотношение компонентов аденилатной системы, так как АТР, ADP и AMP являются мощными регуляторами метаболических процессов.
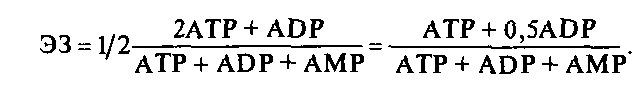
Д. Аткинсон ввел понятие энергетического заряда, как меры «заполнения» аденилатной системы макроэргами.
Теоретически ЭЗ может варьировать от 0 до 1, однако реально в экспоненциально растущих клетках он составляет 0,8–0,9, а при снижении его величины до 0,5 клетка погибает.
Основные типы сопряжения энергетических и конструктивных процессов
Первоначально биологи подразделяли все живые организмы по типу питания на две группы: автотрофов и гетеротрофов.
В настоящее время применяется более детальная классификация, основанная на указании природы источника энергии и природы источника углерода.
Таким образом, растения следует отнести к фото-лито-автотрофам, а животных – к хемооргана – гетеротрофам. Всего же при сочетании этих характеристик возможны восемь основных типов соотношений между энергетическими и конструктивными процессами.
Некоторые организмы способны осуществлять только одни из перечисленных типов питания, тогда как другие могут переключаться с одного типа питания на другой. Последние организмы называют факультативными.
Таблица 1. Основные типы питания
|
Источник энергии |
Донор электронов |
Источник углерода |
Тип питания |
Организмы-представители |
|
Неорганические вещества |
С0>2> |
Хемолитоавтотрофия |
Прокариоты |
|
|
Химические |
Органич. вещества |
Хемолитогетеротрофия |
Прокариоты |
|
|
реакции |
Органические вещества |
С0>2> |
Хеморганоавто-трофия |
Прокариоты |
|
Органич. вещества |
Хемоорганоге-теротрофия |
Животные и многие прокариоты |
||
|
Источник энергии |
Донор электронов |
Источник углерода |
Тип питания |
Организмы-представители |
|
Неорганические вещества |
со>2> |
Фотолитоавтотрофия |
Растения, цианобакте-рии, пурпурные и зеленые бактерии |
|
|
Свет |
Органич. вещества |
Фотолитогетеротрофия |
Прокариоты |
|
|
Органические вещества |
со>2> |
Фотоорганоавтотрофия |
Прокариоты |
|
|
Органич. вещества |
Фотоорганогетеротрофия |
Прокариоты |