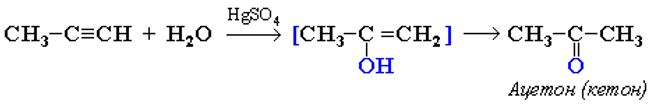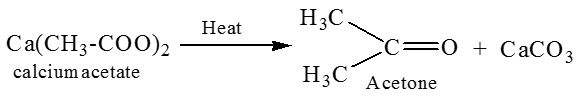Всероссийская Проверочная Работа ВПР Химия 11 класс – Вариант 1
Всероссийская Проверочная Работа ВПР Химия 11 класс Вариант 1 Всероссийская Проверочная Работа
Вариант подготовлен учительницей химии Гимназии-интернат №4 Корневой Лилией Федоровной
Инструкция по выполнению работы
Проверочная работа включает в себя 15 заданий. На выполнение работы по химии отводится 1 час 30 минут (90 минут).
Оформляйте ответы в тексте работы согласно инструкциям к заданиям. В случае записи неверного ответа зачеркните его и запишите рядом новый.
При выполнении работы разрешается использовать следующие дополнительные материалы:
– Периодическая система химических элементов Д.И. Менделеева;
– таблица растворимости солей, кислот и оснований в воде;
– электрохимический ряд напряжений металлов;
– непрограммируемый калькулятор.
При выполнении заданий Вы можете использовать черновик. Записи в черновике проверяться и оцениваться не будут.
Советуем выполнять задания в том порядке, в котором они даны. Для экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения всей работы у Вас останется время, Вы сможете вернуться к пропущенным заданиям.
Баллы, полученные Вами за выполненные задания, суммируются. Постарайтесь выполнить как можно больше заданий и набрать наибольшее количество баллов.
Желаем успеха!
1. Дисперсной называют систему, в которой одно вещество в виде мелких частиц распределено в объёме другого.
Дисперсная фаза – это вещество, которое присутствует в дисперсионной системе в меньшем количестве. Она может состоять и из нескольких веществ.
Дисперсионная среда – это вещество, которое присутствует в дисперсионной системе в большем количестве, и в объеме которого распределена дисперсная фаза.
Заполните таблицу агрегатные состояния дисперсионной среды и фазы
| Дисперсионная среда | Дисперсионная фаза | Пример дисперсной системы |
| Туман | ||
| Плазма крови |
| Дисперсионная среда | Дисперсионная фаза | Пример дисперсной системы |
| газ | Жидкость | Туман |
| жидкость | жидкость | Плазма крови |
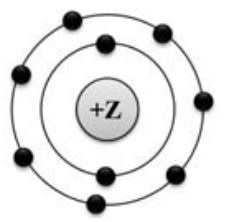
2. На рисунке изображена модель электронного строения атома некоторого химического элемента.
На основании анализа предложенной модели выполните следующие задания:
- определите химический элемент, атом которого имеет такое электронное строение;
- укажите количество протонов, которые содержит этот элемент;
- укажите количество заполненных энергетических уровней;
- определите максимальную валентность этого элемента
Ответы запишите в таблицу.
| Символ химического элемента | Количество протонов | Количество заполненных энергетических уровней | Максимальная валентность |
| Символ химического элемента | Количество протонов | Количество заполненных энергетических уровней | Максимальная валентность |
| F | 9 | 1 | I |
3. С увеличением заряда ядра атомов наблюдается постепенное закономерное изменение свойств элементов и их соединений от металлических к типично неметаллическим, что связано с увеличением числа электронов на внешнем энергетическом уровне.
Учитывая эти закономерности, расположите в порядке увеличения неметаллических свойств, следующие элементы: Na, Cl, Al, Si.
Запишите обозначения элементов в нужной последовательности.
Ответ: ____________________________
Na, Al, Si, Cl
4. Атом водорода, соединенный с атомом фтора, кислорода или азота (реже – хлора, серы или других неметаллов), может образовывать еще одну дополнительную связь. Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ+) к атому электроотрицательного элемента, имеющего отрицательный заряд δ−. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах.
Из предложенных соединений выберите 2 соединения, между молекулами которых образуются водородные связи: этаналь, этанол, водород, аммиак, кислород.
Запишите ответ в отведенном месте:
- _________________________
- _________________________
1) этанол 2) аммиак
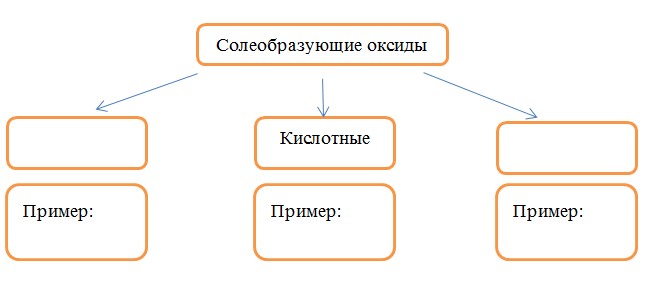
5. Солеобразующие оксиды классифицируют на три группы, как показано на схеме. В эту схему впишите пропущенные названия групп и приведите по два примера химических формул веществ, принадлежащих данной группе.
Элементы ответа:
Записаны названия групп: основные, амфотерные
SO2, N2O5, CrO3, Mn2O7
Al2O3, Cr2O3, ZnO, BeO
Записаны формулы веществ соответствующих групп
Прочитайте следующий текст и выполните задания 6–8.
Сульфат бария часто используется при рентгеновских исследованиях желудочно-кишечного тракта как радиоконтрастное вещество, так как тяжёлые атомы бария хорошо поглощают рентгеновское излучение. Хотя все растворимые соли бария ядовиты, сульфат бария практически нерастворим в воде (и в соляной кислоте, которая содержится в желудочном соке), поэтому он нетоксичен. Для рентгенографического исследования органов пищеварения пациент принимает внутрь суспензию сульфата бария («баритовую кашу») с содержанием бария 58,7 %.
Сульфат бария получают взаимодействием растворимых солей, оксида, пероксида или гидроксида бария с серной кислотой или растворимыми сульфатами. В аналитической химии сульфат бария применяют как хорошую гравиметрическую форму для определения сульфат-ионов и ионов бария в гравиметрическом анализе.
Кроме того сульфат бария используется как цветовой компонент для пиротехнических средств, так как ионы бария способствуют окрашиванию пламени в зеленый цвет. В настоящее время для этих целей в основном используют нитрат бария, за счет того, что он является сильным окислителем и способствует энергичному горению пиротехнической смеси.
6.
1) Составьте молекулярное уравнение реакции получения сульфата бария из пероксида бария, которая упоминалась в тексте.
Ответ: _____________________________________________________
2) Объясните, почему сульфат бария не оказывает токсического влияния на организм.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Элементы ответа:
- BaO2 + H2SO4 = BaSO4 +H2O2
- Сульфат бария в силу низкой растворимости в воде не является токсичным для организма веществом, в отличие от всех растворимых солей бария, и поэтому возможно его применение в качестве рентгеноконтрастного вещества.
7.
1) Составьте молекулярное уравнение реакции между хлоридом бария и сульфатом натрия.
Ответ: _________________________________________________________________
2) Объясните, какие особенности этой реакции позволяют использовать хлорид бария в аналитической химии.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Элементы ответа:
- BaCl2 + Na2SO4 = BaSO4 + 2NaCl
- В результате этой реакции образуется нерастворимое вещество – сульфат бария, осадок белого цвета (качественная реакция на сульфат ионы и ионы бария)
8.
1) Составьте сокращенное ионное уравнение реакции между хлоридом бария и сульфатом натрия.
Ответ: _____________________________________________________________
2) Объясните, почему нитрат бария предпочтительней сульфата бария в качестве цветового компонента для пиротехнических средств
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Элементы ответа:
- Ba2+ + SO4 2- = BaSO4
- Нитрат бария является сильным окислителем и способствует энергичному горению пиротехнической смеси.
9. Дана схема окислительно-восстановительной реакции
PH3 + KMnO4 + H2SO4 → MnSO4 + H3PO4 + K2SO4 + H2O
1) Составьте электронный баланс этой реакции
______________________________________________________________________
2) Укажите окислитель и восстановитель
______________________________________________________________________
3) Расставьте коэффициенты в уравнении реакции
______________________________________________________________________
Элементы ответа:
1) Составлен электронный баланс:
P-3 -8 ē → P+5 5
Mn+7 + 5 ē → Mn+2 8
2) Указано, что PH3 за счет P-3 является восстановителем,
а KMnO4 за счет Mn+7 является окислителем;
3) Составлено уравнение реакции:
5PH3 + 8KMnO4 +12 H2SO4 →8 MnSO4 +5 H3PO4 +4 K2SO4 + 12H2O
10. Дана схема превращений: Al → Na[Al(OH)4] → AlCl3 → Al(OH)3
Напишите молекулярные уравнения реакций, с помощью которых можно осуществить указанные превращения
- ________________________________________________________________
- ________________________________________________________________
- _________________________________________________________________
Написаны уравнения реакций, соответствующие схеме превращений:
Al → Na[Al(OH)4] → AlCl3 → Al(OH)3
- 2 Al + 2NaOH + 6 H2O → 2 Na[Al(OH)4] + 3H2
- Na[Al(OH)4] + 4HCl (избыток) → NaCl + AlCl3 + 4H2O
- AlCl3 + 3 KOH → Al(OH)3 + 3 KCl
11. Установите соответствие между названием органического вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
| НАЗВАНИЕ ВЕЩЕСТВА
А) Толуол Б) Ацетилен В) Этанол
|
КЛАСС/ГРУППА
1) спирты 2) алкены 3) арены 4) алкины |
Запишите в таблицу выбранные цифры под соответствующими буквами.
Ответ:
| А | Б | В |
| А | Б | В |
| 3 | 4 | 1 |
12. В предложенные схемы химических реакций вставьте формулы пропущенных веществ и расставьте коэффициенты
- CaC2 + H2O → …….. + ……………….
- CH3NH2 + ……….. → ……….. + N2 + H2O
Элементы ответа:
- CaC2 + H2O → Ca(OH)2 + HC≡CH
- CH3NH2 + HNO2 → CH3OH + N2 + H2O
4CH3NH2 + 9O2 →4 CO2 + 2N2 + 10H2O
13. Сырьем для производства серной кислоты служат самородная сера и сульфидные руды. Среди них наибольшее значение имеет железный колчедан – пирит FeS2. В природе он залегает массивными плотными слоями, из которых добывается в виде кусков, которые дробят и измельчают. При производстве серной кислоты из пирита сернистый газ получают путем обжига железного колчедана.
Какая масса пирита необходима для получения 67,2 л сернистого газа (н.у.)? Запишите подробное решение задачи.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
Элементы ответа:
1. Составлено уравнение реакции обжига пирита
4FeS2 + 11O2 = 2Fe2O3 + 8SO2
2. n(SO2) = V(SO2)/ Vm = 67,2 л/ 22,4 л/моль = 3 моль
n(FeS2) = n(SO2)/2 = 3моль/2 = 1,5 моль
3. m(FeS2) = n* M = 1,5 моль * 120г/моль = 180 г.
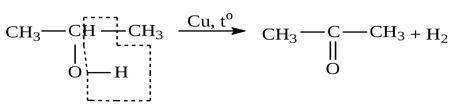
14. Ацетон является популярным растворителем, применяется как сырье для синтеза многих важных химических продуктов, таких как уксусный ангидрид, метилметакрилат. Ацетон является естественным метаболитом, производимым организмами млекопитающих, в том числе и человеческим организмом. В соответствии с приведенной ниже схемой составьте уравнения реакций получения ацетона. При написании уравнений реакций используйте структурные формулы органических веществ.
1) _______________________________________________________
2) _______________________________________________________
3) _______________________________________________________
Написаны уравнения реакций, соответствующие схеме превращений:
1.
15. Глауберова соль Na2SO4.10H2O применяется при лечении желудочно-кишечных заболеваний как слабительное. Сколько (г) Na2SO4.10H2O нужно для приготовления 250 г раствора, с массовой долей Na2SO4, равной 5%. Запишите подробное решение задачи.
Ответ:__________________________________________________________________________
________________________________________________________________________________
________________________________________________________________________________
1) m(Na2SO4 = -omega%(Na_2SO_4)}{100%}=.png)
250.0,05 = 12,5 г;
2) Na2SO4 ® Na2SO4.10H2O
v(Na2SO4) = v(Na2SO4.10H2O)
}{M(Na_2SO_4)}=-frac{m(Na_2SO_4.10H_2O)}{M(Na_2SO_4.10H_2O)}.png)
m(Na2SO4.10H2O) = 12,5.322/142 = 28,4 г.
Ответ: 28,4 г.