Иммобилизованные БАС как основа создания ЛФ нового поколения. Примеры носителей. Методы
Алтайский Государственный Медицинский Университет
Кафедра фармацевтической технологии
Реферат
"Иммобилизованные БАС как основа создания ЛФ нового поколения. Примеры носителей. Методы"
Подготовила:
Прасолова Ю., 452 гр.
Проверила : Талыкова Н.М.
Барнаул, 2010
Ферменты - вещества белковой природы и поэтому неустойчивы при хранении, а также чувствительны к тепловым воздействиям. Кроме того, ферменты не могут быть использованы многократно из-за трудностей в отделении их от реагентов и продуктов реакции. Решить эти проблемы помогает создание иммобилизованных ферментов. Начало этому методу было положено в 1916 году, когда Дж.Нельсон и Е.Гриффин адсорбировали на угле инвертазу и показали, что она сохраняет в таком виде каталитическую активность. Сам термин "иммобилизованные ферменты узаконен в 1971 году, и означает любое ограничение свободы передвижения белковых молекул в пространстве.
Сущность иммобилизации ферментов — прикрепление их в активной форме к нерастворимой основе или заключение в полупроницаемую мембранную систему. Прикрепление фермента к носителю осуществляется адсорбционно, химической связью или путем механического включения фермента в органический или неорганический гель (в капсулу и т. п.). При этом допускается прикрепление фермента только за счет функциональных групп, не входящих в активный центр фермента и не участвующих в образовании фермент-субстратного комплекса. Носитель фермента или матрица может иметь вид зернистого материала, волокнистой структуры, пластинчатой поверхности, пленок или тканей, полых волокон, трубочек, капсул и т. д. Имеет значение размер частиц носителя. Важно иметь большую поверхность, поэтому рекомендуются небольшие частицы диаметром 0,1—0,2 мм. Носитель фермента может быть как природное вещество, так и синтетический полимер.
Преимущества иммобилизованных ферментов перед нативными предшественниками:
1. Гетерогенный катализатор легко отделим от реакционной среды, что дает возможность остановить реакцию в любой момент, использовать фермент повторно, а также получать чистый от фермента продукт.
2. Ферментативный процесс с использованием иммобилизованных ферментов можно проводить непрерывно, регулируя скорость катализируемой реакции и выход продукта.
3. Модификация фермента целенаправленно изменяет его свойства, такие как специфичность (особенно в отношении макромолекулярного субстрата), зависимость каталитической активности от рН, ионного состава и других параметров среды, стабильность к денатурирующим воздействиям.
4. Можно регулировать каталитическую активность иммобилизованных ферментов путем изменения свойств носителя действием физических факторов, таких как свет и звук. Иммобилизовать ферменты можно как путем связывания на нерастворимых носителях, так и путем внутримолекулярной или межмолекулярной сшивки белковых молекул низкомолекулярными бифункциональными соединениями, а также путем присоединения к растворимому полимеру.
Классификация носителей для ферментов
Для получения иммобилизованных ферментов используется ограниченное число как органических, так и неорганических носителей. К носителям предъявляются следующие требования (Дж.Порат, 1974):
высокая химическая и биологическая стойкость;
высокая химическая прочность;
достаточная проницаемость для фермента и субстратов, пористость, большая удельная поверхность;
возможность получения в виде удобных в технологическом отношении форм (гранул, мембран);
легкая активация;
высокая гидрофильность;
невысокая стоимость.
Классификация носителей схематично представлена на рисунке 1
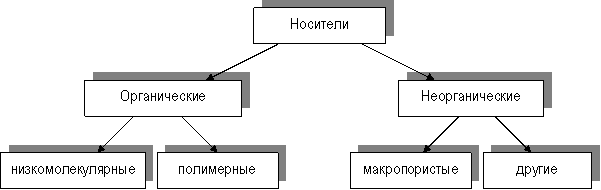
Рис1 Классификация носителей для иммобилизованных ферментов
Следует отметить, что органические носители (как низко-, так и высокомолекулярные) могут быть природного или синтетического происхождения. Природные полимерные органические носители делят в соответствии с их биохимической классификацией на 3 группы: полисахаридные, белковые и липидные.
Синтетические полимеры также можно разделить на группы в связи с химическим строением основной цепи макромолекул: полиметиленовые, полиамидные, полиэфирные.
Для иммобилизации ферментов наиболее широко используются природные полисахариды и синтетические носители полиметильного типа, остальные применяются значительно реже. Большое значение природных полимеров в качестве носителей для иммобилизации объясняется их доступностью и наличием реакционно-способных функциональных групп, легко вступающих в химические реакции. Характерной особенностью этой группы носителей также является их высокая гидрофильность. Недостаток природных полимеров - неустойчивость к воздействию микроорганизмов и довольно высокая стоимость.
Наиболее часто для иммобилизации используются такие полисахариды, как целлюлоза, декстран, агароза и их производные. Целлюлоза гидрофильна, имеет много гидроксильных групп, что позволяет модифицировать её, замещая эти группы. Для увеличения механической прочности целлюлозу гранулируют путем частичного гидролиза, в результате которого разрушаются аморфные участки. На их место для сохранения пористости между кристаллическими участками вводят химические сшивки. Гранулированную целлюлозу довольно легко превратить в различные ионообменные производные, такие как ДЭАЭ-целлюлоза, КМЦ и т.д.
Широко распространены носители на основе декстрана, выпускаемые под названием "сефадексы". При высушивании они легко сжимаются, в водном растворе сильно набухают. В этих носителях размер пор в геле регулируется степенью сшитости. К группе декстранов относят и крахмал. Химически модифицированный крахмал сшивается агентами, такими как формальдегид. Таким способом был получен губчатый крахмал, обладающий повышенной устойчивостью по отношению к ферментам, гидролизу. Водорастворимые препараты на основе декстрана часто применяются как носители лекарственных средств в медицине.
Хорошим носителем считается агар. Его свойства улучшаются после химической сшивки, например, диэпоксидными соединениями. Такой агар становится устойчивым к нагреванию, прочен, легко модифицируется.
Белки в качестве носителей обладают рядом достоинств: вместительны, способны к биодеградации, могут применяться в качестве тонкой (толщиной 80 мкм) мембраны. Иммобилизацию ферментов на белковых носителях можно проводить как в отсутствие, так и в присутствии сшивающих агентов. Белки используются и в фундаментальных биологических исследованиях, и в медицине. К недостаткам белков в качестве носителей относят их высокую иммуногенность (за исключением коллагена и фибрина). Наиболее для иммобилизации используются структурные (кератин, фибрин, коллаген), двигательные (миозин) и транспортные (альбумин) белки.
Синтетические полимерные носители применяются для ковалентной и сорбционной иммобилизации ферментов, для получения гелей, микрокапсул. Полимеры на основе стирола применяются сорбционной иммобилизации. Они могут иметь макропористую, изопористую структуру, а также гетеропористую структуру. Для получения полимерных гидрофильных носителей широко используется акриламид - производное акриловой кислоты.
Широкое распространение получил метод включения ферментов и клеток в полиакриламидный гель, имеющий жесткую пространственную сетчатую структуру. Полиакриламидный гель устойчив к химическим воздействиям. Очень интересную группу представляют полиамидные носители. Это группы различных гетероцепных полимеров с повторяющейся амидной группой -С(О)-NH-. Например, полимеры на основе N-винилпирролидона используются для получения иммобилизованных ферментов, способных медленно распадаться в организме. Кроме того, они биологически инертны, что особенно важно при использовании в медицинских целях. Существенным недостатком большинства полимерных носителей является их способность накапливаться в организме. В этом отношении предпочтение отдается природным полимерам, которые гидролизуются ферментами. Поэтому в состав лекарственных препаратов часто входит декстран, а из синтетических носителей - полимеры на основе N-винилпирролидона. В настоящее время ведутся эксперименты по созданию синтетических полимеров, расщепляющихся с образованием нетоксичных продуктов обмена.
Методы иммобилизации ферментов
Существует два основных метода иммобилизации ферментов: физический и химический.
Физическая иммобилизация ферментов представляет собой включение фермента в такую среду, в которой для него доступной является лишь ограниченная часть общего объема. При физической иммобилизации фермент не связан с носителем ковалентными связями. Существует четыре типа связывания ферментов:
- адсорбция на нерастворимых носителях;
- включение в поры геля;
- пространственное отделение фермента от остального объема реакционной системы с помощью полупроницаемой перегородки (мембраны);
- включение в двухфазную среду, где фермент растворим и может находиться только в одной из фаз.
Перечисленные подходы проиллюстрированы рисунке 2.
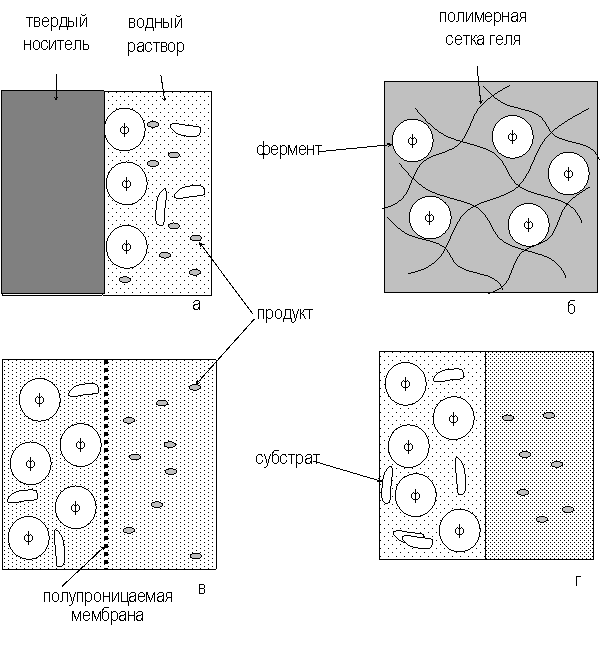
Рис. 2. Способы иммобилизации ферментов: а - адсорбция на нерастворимых носителях, б – включение в поры геля, в – отделение фермента с помощью полупроницаемой мембраны, г – использование двухфазной реакционной среды
Адсорбционная иммобилизация является наиболее старым из существующих способов иммобилизации ферментов, начало ей было положено еще в 1916 г. Этот способ достаточно прост и достигается при контакте водного раствора фермента с носителем. После отмывки неадсорбировавшегося белка иммобилизованный фермент готов к использованию. Удерживание адсорбированной молекулы фермента на поверхности носителя может обеспечиваться за счет неспецифических ван-дер-ваальсовых взаимодействий, водородных связей, электростатических и гидрофобных взаимодействий между носителем и поверхностными группами белка. Вклад каждого из типов связывания зависит от химической природы носителя и функциональных групп на поверхности молекулы фермента. Взаимодействия с носителем могут оказаться настолько сильными, что сорбция биокатализатора может сопровождаться разрушением его структуры. Например, при адсорбции некоторых растительных клеток на гранулах цитодекса клеточная стенка деформируется, повторяя рельеф поверхности частиц носителя. Преимуществом метода адсорбционной иммобилизации является доступность и дешевизна сорбентов, выступающих в роли носителей. Им также можно придать любую конфигурацию и обеспечить требуемую пористость. Важным фактор - простота применяемых методик. При адсорбционном связывании можно решить и проблему очистки фермента, так как связывание белка с носителем во многих случаях достаточно специфическое. К сожалению, прочность связывания фермента с носителем не всегда достаточно высока, что ограничивает применение метода. К недостаткам адсорбционной иммобилизации следует отнести отсутствие общих рекомендаций, позволяющих сделать правильный выбор носителя и оптимальных условий иммобилизации конкретного фермента.
Некоторых из перечисленных затруднений можно избежать при иммобилизации ферментов путем включения в гели. Суть этого метода иммобилизации состоит в том, что молекулы фермента включаются в трехмерную сетку из тесно переплетенных полимерных цепей, образующих гель. Среднее расстояние между соседними цепями в геле меньше размера молекулы включенного фермента, поэтому он не может покинуть полимерную матрицу и выйти в окружающий раствор, т.е. находится в иммобилизованном состоянии. Дополнительный вклад в удерживание фермента в сетке геля могут вносить также ионные и водородные связи между молекулой фермента и окружающими ее полимерными цепями. Пространство между полимерными цепями в геле заполнено водой, на долю которой обычно приходится значительная часть всего объема геля. Например, широко применяемые гели полимеров акриловой кислоты в зависимости от концентрации полимера и его природы содержат от 50 до 90% воды.
Для иммобилизации ферментов в геле существует два основных способа. При одном из них фермент помещают в водный раствор мономера, а затем проводят полимеризацию, в результате чего образуется полимерный гель с включенными в него молекулами фермента. В реакционную смесь часто добавляют также бифункциональные (содержащие в молекуле две двойные связи) сшивающие агенты, которые придают образующемуся полимеру структуру трехмерной сетки. В другом случае фермент вносят в раствор готового полимера, который затем каким-либо образом переводят в гелеобразное состояние. Способ иммобилизации ферментов путем включения в полимерный гель позволяет создавать препараты любой геометрической конфигурации, обеспечивая при этом равномерное распределение биокатализатора в объеме носителя. Метод универсален, применим для иммобилизации практически любых ферментов, полиферментных систем, клеточных фрагментов и клеток. Фермент, включенный в гель, стабилен, надежно защищен от инактивации вследствие бактериального заражения, так как крупные клетки бактерий не могут проникнуть в мелкопористую полимерную матрицу. В то же время, эта матрица может создавать значительные препятствия для диффузии субстрата к ферменту, снижая каталитическую эффективность иммобилизованного препарата, поэтому для высокомолекулярных субстратов данный метод иммобилизации не применим вообще.
Общий принцип иммобилизации ферментов с использованием мембран заключается в том, что водный раствор фермента отделяется от водного раствора субстрата полупроницаемой перегородкой. Полупроницаемая мембрана легко пропускает небольшие молекулы субстрата, но непреодолима для крупных молекул фермента. Существующие модификации этого метода различаются лишь способами получения полупроницаемой мембраны и ее природой. Водный раствор фермента можно включать внутрь микрокапсул, представляющих собой замкнутые сферические пузырьки с тонкой полимерной стенкой (микрокапсулирование). При двойном эмульгировании получается водная эмульсия из капель органического раствора полимера, содержащих, в свою очередь, еще более мелкие капли водного раствора фермента. Через некоторое время растворитель затвердевает, образуя сферические полимерные частицы с иммобилизованным в них ферментом. Если вместо водонерастворимого отвердевающего полимера используются жидкие углеводороды с высокой молекулярной массой, метод называется иммобилизацией путем включения в жидкие мембраны. К модификациям метода иммобилизации ферментов с использованием полупроницаемых оболочек относятся также включение в волокна ( при этом вместо капель, содержащих ферменты, получаются нити) и включение в липосомы. Применение систем мембранного типа позволяет получать иммобилизованные препараты с высоким содержанием фермента. Метод, как и предыдущий, достаточно универсален, т.е. применим как ферментам, так и к клеткам, а также их фрагментам. Благодаря высокому отношению поверхности к объему и малой толщине мембраны удается избежать значительных диффузионных ограничений скорости ферментативных реакций. Основной недостаток мембранных систем - невозможность ферментативного превращения высокомолекулярных субстратов.
При иммобилизации ферментов с использование систем двухфазного типа ограничение свободы перемещения фермента в объеме системы достигается благодаря его способности растворяться только в одной из фаз. Субстрат и продукт ферментативного превращения распределяются между обеими фазами в соответствии с их растворимостями в этих фазах. Природа фаз подбирается таким образом, что продукт накапливается в той из них, где фермент отсутствует. После завершения реакции эту фазу отделяют и извлекают из нее продукт, а фазу, содержащую фермент, вновь используют для проведения очередного процесса. Одним из важнейших преимуществ систем двухфазного типа является то, что они позволяют осуществлять ферментативные превращения макромолекулярных субстратов, которые невозможны при применении жестких носителей с ограниченным размером пор.
Главным отличительным признаком химических методов иммобилизации является то, что путем химического взаимодействия на структуру фермента в его молекуле создаются новые ковалентные связи, в частности между белком и носителем. Препараты иммобилизованных ферментов, полученные с применением химических методов, обладают по крайней мере двумя важными достоинствами. Во-первых, ковалентная связь фермента с носителем обеспечивает высокую прочность образующегося конъюгата. При широком варьировании таких условий, как рН и температура, фермент не десорбируется с носителя и не загрязняет целевых продуктов катализируемой им реакции. Это особенно важно при реализации процессов медицинского и пищевого назначения, а также для обеспечения устойчивых, воспроизводимых результатов в аналитических системах. Во-вторых, химическая модификация ферментов способна приводить к существенным изменениям их свойств, таких как субстратная специфичность, каталитическая активность и стабильность. Химическая иммобилизация ферментов является искусством, уровень которого определяется, в первую очередь, умением экспериментатора. Основная задача экспериментатора заключается в формировании новых ковалентных связей в молекуле фермента при использовании его функциональных групп, несущественных для проявления его каталитической активности. При химической модификации фермента его активный центр желательно защищать. При сопоставлении различных приемов иммобилизации химические методы для крупномасштабных биотехнологических процессов кажутся малопривлекательными из-за сложности и дороговизны. В промышленных процессах обычно используются те или иные методы физической иммобилизации.
Применение иммобилизованныхферментов
Особенно ощутимый вклад иммобилизованные ферменты внесли в тонкий органический синтез, в анализ, в медицину, в процессы конверсии энергии, в пищевую и фармацевтическую промышленности.
Для синтетической органической химии важно то, что в двухфазных реакционных средах фермент сохраняет каталитическую активность даже при исключительно малом содержании воды, поэтому равновесие катализируемой реакции (выход продукта) экспериментатор может регулировать в широких пределах, подбирая нужный органический растворитель. Иммобилизованные ферменты дали толчок к созданию принципиально новых методов "безреагентного" непрерывного анализа многокомпонентных систем органических (в ряде случаев и неорганических) соединений.
В будущем важную роль в контроле окружающей среды и в клинической диагностике должны сыграть такие методы, как биолюминесцентный анализ и иммуноферментный анализ.
В медицине иммобилизованные ферменты открыли путь к созданию лекарственных препаратов пролонгированного действия со сниженной токсичностью и аллергенностью. Иммобилизационные подходы способствуют решению проблемы направленного транспорта лекарств в организме.
Проблемы биоконверсии массы и энергии в настоящее время пытаются решить микробиологическим путем. Тем не менее иммобилизованные ферменты вносят ощутимый вклад в осуществление фотолиза воды и в биоэлектрокатализ.
Заслуживает внимание и использование иммобилизованных ферментов в процессах переработки лигноцеллюлозного сырья.
Иммобилизованные ферменты могут использоваться и как усилители слабых сигналов. На активный центр иммобилизованного фермента можно подействовать через носитель, подвергая последний ультразвуковой обработке, механическим нагрузкам или фотохимическим превращениям. Это позволяет регулировать каталитическую активность системы фермент - носитель под действием механических, ультразвуковых и световых сигналов. На этой основе были созданы механо- и звукочувствительные датчики и открыт путь к бессеребряной фотографии.
Промышленные процессы с применением иммобилизованных ферментов внедрены прежде всего в пищевую и фармацевтическую промышленность. В пищевой промышленности с участием иммобилизованных ферментов идут процессы получения глюкозо-фруктовых сиропов, глюкозы, яблочной и аспарагиновой кислоты, оптически активных L- аминокислот, диетического безлактозного молока, сахаров из молочной сыворотки и др.
В медицине иммобилизованные ферменты используются также как лекарственные препараты, особенно в тех случаях, когда необходимо локальное воздействие. Кроме того, биокатализаторы широко используются в различных аппаратах для перфузионной очистки различных биологических жидкостей. Возможности и перспективы использования в медицине ферментов в иммобилизованном состоянии гораздо шире, чем достигнутые на сегодняшний день, именно на этом пути медицину ждет создание новых высокоэффективных методов лечения.