Аллельные варианты генов-кандидатов подверженности туберкулезу у русского населения Западной Сибири
Аллельные варианты генов-кандидатов подверженности туберкулезу у русского населения Западной Сибири
Оглавление
Список сокращений
Введение
1. Обзор литературы
1.1 Роль наследственных факторов в возникновении и развитии туберкулеза
1.2 Молекулярные механизмы патогенеза туберкулеза у человека
1.3 Физиологические функции белковых продуктов генов-кандидатов подверженности туберкулезу, их роль в патогенезе заболевания
2. Материал и методы исследования
2.1 Обследованные группы населения
2.1.1 Характеристика контрольной выборки
2.1.2 Характеристика выборки больных туберкулезом
2.1.3 Характеристика семейной выборки пробандов, больных туберкулезом
2.2 Методы исследования
2.2.1 Клинико – лабораторные методы исследования
2.2.2 Молекулярно – генетические методы анализа полиморфизма генов
2.2.3 Генетико – статистические методы анализа
3. Результаты и обсуждение
3.1 Распространенность полиморфизма генов NRAMP1, VDR, IL12B, IL1B, IL1RN среди здоровых лиц (контрольная группа)
3.2 Анализ связи полиморфизма генов NRAMP1, VDR, IL12B, IL1B, IL1RN с туберкулезом
3.3 Анализ накопления случаев туберкулеза в семьях больных
3.4 Анализ связи полиморфизма генов NRAMP1, VDR, IL12B, IL1B, IL1RN с патогенетически важными параметрами болезни
3.4.1 Анализ ассоциаций исследованных генов с качественными признаками туберкулеза
3.4.2 Анализ ассоциаций исследованных генов с количественными признаками туберкулеза
Заключение
Выводы
Список литературы
Список сокращений
ТБ – туберкулез
ВОЗ – всемирная организация здравоохранения
МБТ – микобактерии туберкулеза
ГЗТ – гиперчувствительность замедленного типа
СОЭ – скорость оседания эритроцитов
РХФ – равновесие Харди-Вайнберга
NRAMP1 – макрофагальный белок, ассоциированный с естественной ресистентностью
NRAMP1 – ген макрофагального белка, ассоциированного с естественной резистентностью
MBP – маннозо - связывающий белок
TNFα – фактор некроза опухолей α
TNFА – ген фактора некроза опухолей α
VDR – ген рецептора к витамину D
HLA – главный комплекс гистосовместимости человека
INF-γ – гамма интерферрон
IL-1β – интерлейкин-1β
IL-12β – интерлейкин-12β
IL1B – ген интерлейкина-1β
IL12B – ген интерлейкина-12β
IL1RN – ген антагониста рецептора к интерлейкину-1β
Введение
По данным Всемирной организации здравоохранения (ВОЗ) от туберкулеза (ТБ) ежегодно умирают более двух миллионов человек во всем мире. В связи с этим в 1993 г. ТБ объявлен всемирной опасностью. Несмотря на наметившиеся тенденции к стабилизации и позитивную динамику отдельных показателей, эпидемиологическая ситуация по туберкулезу в Российской Федерации остается сложной [Перельман М.И., 2001; Онищенко Г.Г., 2003; Ерохин В.В., 2003; Белиловский и др., 2003]. В 27 субъектах РФ уровень заболеваемости значительно выше, чем по стране, причем наибольшие показатели отмечены в Сибирском федеральном округе [Мурашкина Г.С. и др., 1999; Краснов В.А., 2004]. Таким образом, ТБ является одной из самых серьезных медико-социальных проблем здравоохранения, как Томской области, так и в целом России [Перельман М.И., 2003; Стрелис А.К., 2004].
Несомненно, ключевым звеном патогенеза заболевания является проникновение микобактерий туберкулеза (МБТ) в организм человека. Однако нельзя недооценивать роль предрасполагающих факторов, к которым относят возраст больного, сопутствующие заболевания, неблагоприятное влияние факторов внешней среды, различные патологические состояния специфического и неспецифического иммунитета [Давыдовский И.В., 1962].
Известно, что туберкулезной инфекции свойственен выраженный клинический полиморфизм [Пузик В.И. и др., 1973]. Основой для такой вариабельности клинического течения болезни является не только внешние средовые причины, но и генетически детерминированные [Апт А.С и др., 1982; Хоменко А.Г., 1990]. Благодаря врожденной относительной резистентности человека к туберкулезу заболевает лишь малая часть инфицированных МБТ, в то время как, по данным ВОЗ, инфицируется практически каждый третий житель планеты.
Близнецовые и генетико-эпидемиологические исследования установили важную роль наследственности в развитии туберкулеза [Чуканова В.П. и др., 2001; Kallman F., Reisner D., 1943; Comstock G.W., 1978; Fine P.E.M., 1981].
С генетической точки зрения ТБ, как и большинство инфекционных заболеваний, относят к мультифакториальной патологии, которая представляет собой результат сложного взаимодействия большого числа генов с разнообразными факторами окружающей среды [Мороз А.М., Торонджадзе В. Г., 1977; Березовский Б.А. и др., 1986]. Современные достижения в области молекулярной генетики открыли новые перспективы в изучении патогенеза болезней: появилась возможность идентифицировать гены, продукты экспрессии которых принимают участие в развитии патологических состояний [Hill A. V. S., 1999].
Важнейший этап патогенеза туберкулеза - персистенция возбудителя в фагосомах макрофагов [Авербах М.М. и др., 1982; Литвинов В.И. и др., 1983]. Макрофаги поглощают патоген в очагах воспаления, но часто теряют способность элиминировать его в лизосомах, что в итоге приводит к их массированному размножению и последующему выходу из погибших клеток [Myrvik Q. et al., 1984]. В связи с этим в число генов-кандидатов туберкулеза входят гены, продукты которых участвуют в процессе фагоцитоза микобактерий. Современные характеристики туберкулезной инфекции диктуют необходимость контроля прохождения микобактерии по эндосомально – лизосомальному пути.
Одним из методов анализа роли генетических факторов в возникновении и развитии распространенных заболеваний является исследование ассоциаций генетических маркеров с заболеваниями [Пузырев В.П., 2000; Collins F.S., 1999; McKusick V., 2000]. В основе такой ассоциации маркера с болезнью могут лежать три причины. Во-первых, наличие ассоциации может свидетельствовать о том, что ассоциированный локус и есть ген или один из генов болезни. Во-вторых, причиной ассоциации может быть неравновесие по сцеплению между маркерным локусом и локусом болезни. И, наконец, ассоциация может быть артефактом, возникшим вследствие подразделенности популяции [Пузырев В.П., Степанов В.А., 1997]. Феномен ассоциации генетического маркера с заболеванием или каким-либо признаком болезни определяется дифференциальной приспособленностью носителей разных генотипов [Алтухов Ю.П., 2003].
Одним из приоритетных направлений в активном выявлении туберкулеза является определение групп риска. Формирование этих групп требует методологически правильного подхода, основанного на четком знании факторов, определяющих повышенный риск заболевания [Горбач Н.А. и др., 2004]. Методами молекулярной медицины было установлено, что у человека гены многих ферментов, рецепторов и других белков характеризуются наличием одного или нескольких структурных полиморфизмов, которые не приводят к значимым изменениям первичной структуры белка, и соответственно, очевидным патологическим последствиям, но оказывают влияние на функциональную активность кодируемых белков. Эти специфические для конкретной патологии маркеры могут быть выявлены задолго до ее клинической манифестации, что позволит определить группы риска, организовать их мониторинг, а в случае необходимости, предложить индивидуально обоснованную профилактику и превентивную терапию. Таким образом, идентификация генов и их аллелей, участвующих в определении чувствительности или резистентности к туберкулезу, позволит не только глубже проникнуть в фундаментальные механизмы иммунитета и патологии этой инфекции, но и будет способствовать усовершенствованию лечебно-профилактических мероприятий.
Настоящее исследование является фрагментом изучения подверженности к туберкулезу в различных этнических группах, которое проводится в ГУ НИИ медицинской генетики ТНЦ СО РАМН под руководством академика РАМН В.П. Пузырева. Получены результаты исследования роли генов-кандидатов в возникновении и развитии туберкулеза у тувинцев [Рудко А.А., 2004]. Нами изучено влияние генов NRAMP1 (ген макрофагального белка, ассоциированного с естественной резистентностью), VDR (ген рецептора к витамину D), IL12B (ген интерлейкина 12В), IL1B (ген интерлейкина 1В), IL1RN (ген антагониста рецептора к интерлейкину 1В) на предрасположенность к туберкулезу у русских г. Томска. Выбор сходных полиморфизмов генов для оценки резистентности к ТБ у тувинцев и русских позволил провести сравнительный анализ распространенности исследованных маркеров у больных и здоровых представителей данных этнических групп населения.
Цель исследования: изучить роль полиморфных вариантов генов NRAMP1, VDR, IL12B, IL1B и IL1RN в возникновении и развитии туберкулеза у русских жителей г. Томска.
Задачи исследования:
Изучить распространенность и межлокусное взаимодействие полиморфных вариантов гена NRAMP1 (469+14G/C, D543N, C274T, 1465-85G/A), аллельных вариантов генов VDR (B/b, F/f), IL12В (A1188C), IL1B (+3953A1/A2), IL1RN (VNTR) у русских г. Томска.
Оценить частоту встречаемости больных туберкулезом среди родственников больных и здоровых лиц.
Провести анализ ассоциаций полиморфизма исследуемых генов с туберкулезом.
Исследовать влияние изучаемых аллельных вариантов на варьирование патогенетически значимых признаков болезни.
Провести сравнительный анализ русских г. Томска и жителей Тувы по распространенности исследованных генов, гаметическому неравновесию между парами полиморфизмов генов и выявленным ассоциациям.
Научная новизна:
Впервые получены сведения о распространенности аллельных вариантов генов NRAMP1, VDR, IL12B, IL1B, IL1RN у русских жителей г. Томска. Проведен межпопуляционный сравнительный анализ генов-кандидатов туберкулеза у русских и тувинцев, установивший отличия в распределении генотипов и частот аллелей по всем исследованным генетическим маркерам. Показано, что структура неравновесия по сцеплению между полиморфизмами гена NRAMP1 идентична у русских и тувинцев. Изучено влияние полиморфизма генов-кандидатов туберкулеза на возникновение и развитие различных клинических вариантов заболевания. Впервые выявлены ассоциации полиморфизма +3953А1/А2 гена IL1B c ограниченным деструктивным ТБ легких, VNTR полиморфизма гена IL1RN и полиморфизма 274С/Т гена NRAMP1 с распространенной деструктивной формой заболевания, полиморфизма 1465-85G/A гена NRAMP1 с первичным туберкулезом и полиморфизма 1188А/С гена IL12B как с распространенным деструктивным туберкулезом легких, так и с первичной по генезу формой патологии. Показана связь полиморфизма генов IL12B, NRAMP1 и VDR с патогенетически важными для ТБ качественными и количественными характеристиками патологического процесса: объемом поражения ткани легкого, деструктивными изменениями, уровнем палочкоядерных нейтрофилов, а также СОЭ у женщин.
Практическая значимость:
Полученные результаты исследования полиморфизма генов-кандидатов туберкулеза представляются важными для формирования представлений о взаимосвязи особенностей генофондных параметров популяции с закономерностями распространения этого инфекционного заболевания, позволяют глубже проникнуть в фундаментальные механизмы иммунитета и патологии ТБ. Сведения о вкладе полиморфизма исследованных генетических маркеров в формирование вариабельности подверженности к этому заболеванию, а также в определение различий клинических проявлений болезни, могут быть использованы при организации профилактических и лечебных мероприятий. Полученные данные могут быть полезны в уточнении стратегии формирования групп риска по заболеванию туберкулезом.
1. Обзор литературы
1.1 Роль наследственных факторов в возникновении и развитии туберкулеза
Туберкулез известен с глубокой древности. Об этом свидетельствуют многочисленные литературные данные и исторические факты. Научные материалы палеонтологов указывают на древний возраст микобактериальной инфекции. На костях древнеегипетских мумий эпохи бронзы удалось обнаружить несколько бесспорных туберкулезных поражений. Большая заслуга в этом принадлежит английскому исследователю Арманду Рафферу (1921) [Холмовская М.Б., 1997].
Некоторые признаки легочной чахотки описаны в египетских папирусах, а так же в произведениях древнейших китайских ученых и в священных книгах индусов [Хоменко А.Г., 1990]. Уже в те времена исследователи пытались объяснить вопрос, который интересовал многих. Почему некоторые люди более подвержены туберкулезу, чем другие?
Решалась эта проблема различными учеными по-разному, в зависимости от уровня знаний в тот или иной период человеческой истории. Гиппократ, а так же его современники считали туберкулез наследственной болезнью: "Некоторые – более устойчивы в болезнях, другие совершенно не способны им противостоять. Как от родителей эпилептиков рождаются дети-эпилептики, так от чахоточных рождаются дети предрасположенные к чахотке" [Цит. по Рабухин А.Е., 1959].
Однако уже в те времена высказывалась мысль о заразности легочной чахотки. Так в Персии, по свидетельству Геродонта, обычно изолировали не только "прокаженных, но и чахоточных и золотушных" больных, запрещали им оставаться в городах и поддерживать какую-либо связь с окружающим населением [Рабухин А.Е., 1948].
С открытием возбудителя туберкулеза роль наследственности при этом заболевании фактически перестала признаваться. В течение длительного времени во фтизиатрии основное внимание уделялось изучению возбудителя болезни, патологических изменений и их клинических проявлений.
В настоящее время общепризнанно, что этиологическим фактором туберкулеза являются микобактерии туберкулеза (МБТ). Туберкулез – инфекционное заболевание, которое отличается преимущественно хроническим течением различных клинических форм, своеобразием специфических иммунологических и морфологических проявлений. Однако проникновение в организм возбудителя туберкулеза является необходимым, но недостаточным условием для развития болезни. В патогенезе туберкулеза немаловажную роль играют так называемые способствующие факторы. К таким факторам относят некоторые свойства макроорганизма (пол, возраст, сопутствующие заболевания, общая реактивность организма и т.д.), вирулентность микобактерии туберкулеза и массивность инфицирования, а также воздействие внешней среды (неблагоприятная микросоциальная среда, социально-гигиенические факторы и низкий экономический уровень жизни), при котором происходит инфицирование. Иногда роль сопутствующих факторов в этиологии туберкулеза выступает на первое место [Давыдовский И.В., 1962].
Несомненно, что семейное накопление туберкулеза обусловлено общностью внешнесредовых факторов, воздействующих на каждого члена семьи. Но даже в условиях тесного семейного контакта с бактериовыделителем не все члены семьи заболевают туберкулезом. Если проследить историю взаимодействия человеческой популяции с возбудителями инфекционных болезней, то можно заметить, что эпидемии особо опасных заболеваний не заканчивались полным вымиранием. Выживали индивиды - возможно, носители определенных генетических систем, имеющих отношение к сопротивляемости соответствующим инфекциям [Хоменко А.Г., 1990].
Туберкулез отличается клиническим полиморфизмом, что проявляется различными формами заболевания – от малых с бессимптомным течением до обширных деструктивных процессов в легких с выраженной клинической картиной, а также наличием туберкулезного процесса различной локализации в других органах [Пузик В.И. и др., 1973]. По-видимому, причины такого разнообразия проявлений туберкулеза могут определяться не только неблагоприятным сочетанием внешних факторов, но и внутренними, наследственными причинами.
Степень влияния наследственных факторов на возникновение и течение болезни при разной патологии неодинакова. В одних случаях генетически могут быть детерминированы несовместимые с жизнью дефекты, в других – речь может идти об одном из многих компонентов патогенеза заболевания.
Чувствительность к туберкулезу у разных видов животных существенно варьирует: от врожденной резистентности крыс, до крайней подверженности у морских свинок. Кроме того, существуют внутривидовые отличия в подверженности к данному заболеванию [Гамалея Н.Ф., 1939; Авербах М.М. и др., 1980; Сабадаш Е.В. и др., 2002].
Аналогичным образом человеческая популяция проявляет врожденную относительную резистентность к туберкулезу [Апт А.С. и др., 1982; Авербах М.М. и др., 1982; Мороз А.М., 1984]. Благодаря этому заболевает лишь малая часть инфицированных МБТ, в то время как по данным ВОЗ инфицируется практически каждый третий житель планеты. Подобная избирательность свидетельствует о том, что не все члены популяции в равной степени подвержены туберкулезу.
Исследуя группу больных туберкулезом методом изучения их родословных, В. Г. Штефко (1930) провел параллели между конституциональными признаками и заболеванием. Так же он установил различное течение болезни у лиц разной национальности. Полученные данные позволили предположить существование наследственной предрасположенности к туберкулезу.
Выявление при профилактических флюрографических обследованиях рентгенположительных лиц с зажившими элементами перенесенной первичной инфекции, у которых наступило спонтанное излечение, также свидетельствует о том, что не все люди в равной степени подвержены заболеванию туберкулезом в условиях заражения микобактериями туберкулеза.
Б. А. Березовский и соавт. (1986) провели анализ частоты болезни среди родственников больных туберкулезом, не находившихся в контакте с последними, а также в контрольной группе здоровых лиц. Полученные результаты выявили достоверные различия в сравниваемых группах, при этом частота туберкулеза среди родителей и сибсов пробанда более чем в 5 раз превышала таковую в популяции. На основании этих данных было сделано предположение, что наряду с известными, достаточно изученными причинами возникновения туберкулеза легких определенное значение в его развитии имеют генетические факторы.
Анализ 33 больных рецидивирующим туберкулезом с бактериовыделением после завершенной химиотерапии показал, что из 25 лиц находившихся с этими больными в контакте, 5 остались неинфицированными. В тоже время среди остальных туберкулинположительных лиц из контакта не отмечено случаев заболевания туберкулезом [Golli V. et al., 1981].
Сходные результаты получили и другие авторы, наблюдавшие за лицами из семейного контакта с 458 больными туберкулезом в течение 4 лет после выявления источника инфекции. Всего за 4 года было выявлено, что среди 1250 лиц из семейного контакта заболели лишь 48 из них преимущественно на 1-ом и 2-ом году наблюдения [Kameda K. et al., 1983].
H. Hara и соавторы (1982) приводят данные о том, что из 28 человек, находящихся в контакте с бациллярными больными, лишь у 6 на протяжении 2,5 лет был установлен туберкулез.
Под руководством академика РАМН А. Г. Хоменко было осуществлено комплексное генетико-эпидемиологическое исследование, в котором принимали участие 522 многодетные семьи узбекской, туркменской, молдавской этнических групп. Задача данного исследования сводилась к определению коэффициента наследуемости (подверженности, предрасположенности). Для этого обследовали более 5000 родственников первой и второй степени родства по отношению к пробандам, которые страдали туберкулезом легких.
Результаты исследования установили семейное накопление туберкулеза среди различных групп родственников разной степени родства. При этом в семьях пробандов, которые болели деструктивным туберкулезом легких и являлись бактериовыделителями, частота туберкулеза среди родственников первой степени родства значительно превышала частоту заболевания среди населения не только при наличии семейного контакта (в 7,2 раза), но и при отсутствии тесного семейного контакта (в 5 раз). Кроме того, аналогичным образом во всех обследованных этнических группах в семьях родственников первой степени родства, где пробанды болели недеструктивными формами туберкулеза без бактериовыделения, частота туберкулеза легких в 4,3 раза превышала частоту заболевания среди населения сопоставимого возраста [Чуканова В. П. и др., 2001].
У родственников второй степени родства (племянников пробандов), которые не состояли в семейном контакте с пробандами, установлено, что частота туберкулеза среди них превышала частоту заболевания среди населения соответствующего возраста в 2-2,5 раза. Учитывая более отдаленную степень родства, увеличение частоты заболевания в этой группе родственников в большей мере подчеркивает значение генетических факторов в семейном накоплении заболевания. Выявленные закономерности распространения туберкулеза позволяют считать, что среди кровных родственников больных туберкулезом легких риск развития болезни значительно выше, чем среди всего населения.
Особый способ клинико-генеалогического изучения предрасположен-ности к болезням – изучение заболеваемости индивидов, генетически не родственных с больным туберкулезом (супруги пробандов, приемные дети), но связанных с ним общностью семейных средовых влияний. Анализ распространенности туберкулеза среди супругов пробандов, не состоящих в кровном родстве с больными туберкулезом, но находившихся с ними в семейном контакте, установил, что частота туберкулеза легких в этой группе достоверно не отличалась от частоты заболевания среди населения обследованных этнических групп [Чуканова В. П. и др., 1995].
На основании проведенных популяционных исследований были выявлены этнические особенности в патогенезе и клиническом течении туберкулеза [Хаудамова Г.Т., 1991; Хоменко А.Г., 1996; Stead W.W., 1992; Bellamy R., 1998]. Анализ заболеваемости туберкулезом органов дыхания основных этнических групп Казахстана (казахов и русских) выявил повышенный риск (в 3 раза) заболевания коренного населения [Хауадамова Г.Т., 1991].
Вероятно, большая часть такой этнически зависимой предрасположенности обусловлена факторами внешней среды, то есть определенными традициями данной популяции, экономическими причинами и т. д. Однако имеются данные о том, что более подвержены туберкулезу популяции, происходящие с территорий свободных от этого заболевания [Bellamy R., 1998; Stead W.W., 1992]. Данное положение легко объяснимо с точки зрения естественного отбора. Резистентность к туберкулезной инфекции создавалась и поддерживалась в процессе симбионтных отношений макро- и микроорганизмов [Земскова З.С., Дорожкова И.Р., 1984].
С целью разделения генетических и средовых эффектов и оценки их соотносительного вклада в этиологию и патогенез туберкулеза были предприняты близнецовые исследования [Kallman F., Reisner D., 1943; Comstock G.W., 1978; Fine P.E.M., 1981]. Эти работы показали, что заболеваемость туберкулезом монозиготных близнецов в среднем в 3,5 раза выше, чем дизиготных.
Полученные в ходе близнецовых исследований факты свидетельствовали о генетической подоплеке туберкулеза, однако, не предоставили данных о типе наследования заболевания. Генетический анализ восприимчивости и резистентности к туберкулезу, проведенный на лабораторных животных, показал, что наследование этих признаков носит сложный, полигенный характер [Lurie M.B. et al., 1952; Lynch C.J. et al., 1965].
На основании экспериментальных исследований была выдвинута гипотеза мультифакториального типа наследования предрасположенности к туберкулезу легких [Мороз А. М., Торонджадзе В. Г., 1977]. Позднее Б. А. Березовский и соавт. (1986) сравнили имеющиеся сведения по генетике туберкулеза с критериями мультифакториального наследования, предложенными J.H. Edwards (1969). Полученные в ходе сравнения результаты подтвердили высказанную ранее гипотезу.
С генетической точки зрения, мультифакториальные заболевания представляют результат сложного взаимодействия большого числа генов с разнообразными факторами окружающей среды. В отличие от менделирующей патологии, в основе которой лежат редко встречаемые "главные гены", но со значительными эффектами, при мультифакториальных болезнях генетическая система полигенов представлена огромным числом аллельных вариантов генов, эффекты которых в отдельности незначительны. Однако их совокупное действие формирует неблагоприятный "генетический фон", который под влиянием дополнительных факторов реализуется в патологический фенотип [Пузырев В. П., 2003].
Современные представления о генетической составляющей мультифакториальных заболеваний во многом связаны с концепцией подверженности и порогового проявления мультифакториального фенотипа [Falconer D., 1965; Edwards J.H., 1969]. Согласно этой концепции, подверженность к заболеванию наследственно обусловлена, но реализация ее возможна только при взаимодействии с факторами среды. Патологический фенотип проявляется при пересечении некоего "порога" подверженности, описываемого количественными признаками. Порог подразумевает наличие резкого качественного различия: за этим порогом на шкале подверженности располагаются пораженные индивиды [Фогель Ф., Мотульски А., 1989].
Развитие молекулярно-генетических технологий позволило решить проблему идентификации конкретных генетических систем, ответственных за предрасположенность к мультифакториальным заболеваниям. Картирование генов осуществляется в рамках двух стратегий: генов-кандидатов и позиционного клонирования [Пузырев В.П., Степанов В.А., 1997].
Ген определяется как кандидатный, если продукт его экспресии вовлечен в развитие болезни. Анализ ассоциации полиморфизма генов-кандидатов с изучаемой болезнью или патологическими признаками позволяет установить их патогенетическую роль и, таким образом, "картировать" ген заболевания. При позиционном клонировании определение генов подверженности проводится путем анализа сцепления заболевания и маркерами с установленным положением на хромосоме. Это дает возможность картировать болезни, для которых не известны не только гены-кандидаты, но даже детали развития болезни.
Идентификация генов и их аллелей, от экспресии которых зависит чувствительность или резистентность к туберкулезу позволила бы глубоко проникнуть в фундаментальные механизмы иммунитета и патологии этой инфекции. В результате появилась бы возможность использовать методы генетического типирования для выявления среди здоровых людей групп с генетически повышенным риском заболевания, требующих первоочередных мер профилактики и, вероятно, особого подхода к вакцинации [Кобринский Б.А., 1987].
Сложность патогенеза, а так же различия в клиническом проявлении туберкулеза предполагают, что число генов-кандидатов заболевания достаточно велико (табл. 1). При этом вклад каждого из них в суммарную подверженность различен [Hill A.V.S., 1998]. Дело еще более осложняется действием факторов внешней среды, значительно модифицирующих положение порога подверженности туберкулезу. Кроме того, большое значение для определения генов сложнонаследуемых заболеваний имеет также выбор популяции для исследования. Индивидуальные сочетания аллелей генов предрасположенности, формирующие риск заболевания, являются уникальными для каждой популяции, что может быть одной из причин невоспроизводимости в разных выборках результатов анализа сцепления болезни с маркером [Terwilliger J.D. et al., 1997].
Таким образом, само по себе картирование генов туберкулеза еще не исчерпывает все проблемы генетики данной патологии. Следующим за картированием шагом, по-видимому, является изучение совместного действия комплекса генов предрасположенности, выявление его основных функциональных звеньев, установление особенностей взаимодействия с факторами негенетической природы – вот задачи, которые необходимо решить для понимания механизмов нормальной и патологической реализации генетической информации.
Таблица 1 Гены-кандидаты подверженности туберкулезу
|
Ген |
Хромосомная локализация (MIM) |
Название белкового продукта |
Функция белка |
|
NRAMP1 |
2q35 (600266) |
Макрофагальный протеин 1, ассоциированный с естественной резистентностью |
Транспорт двухвалентных ионов металлов, киллинг внутриклеточно расположенных МБТ |
|
VDR |
12q12-q14 (601769) |
Рецептор к витамину D |
Связывание с витамином D, активация клеточного иммунитета |
|
IL1А, IL1В |
2q14(147760) 2q14(147720) |
Интерлейкин 1 Интерлейкин 1 |
Активация клеточного иммунного ответа |
|
IL12В |
5q31.1-q33.1 (161561) |
Интерлейкин 12 |
Индукция синтеза IFN- |
|
IFNG |
12q14 (147570) |
Интерферон |
Активация Т-лимфоцитов, макрофагов |
|
TNFА |
12р13.2 (191190) |
Фактор некроза опухолей |
Индукция формирования гранулемы |
|
NOS2 |
17р13.1-q25 (600719) |
Индуцибельная синтаза оксида азота |
Цитотоксическое действие |
|
MBP |
10q11.2-q21 (154545) |
Маннозо-связывающий белок |
Активация системы комплемента |
|
HLA |
6p21.3 (142860) |
Главный комплекс гистосовместимости |
Регуляция силы иммунного ответа |
|
IL1RN |
2q14.2 (147679) |
Антагонист рецептора к интерлейкину-1 |
Угнетение провоспалительного эффекта |
|
IL12R |
19p113.1 (601604) |
Рецептор к интерлейкину 12 |
Связывание интерлейкина 12 на поверхности клеток-мишеней |
1.2 Молекулярные механизмы патогенеза туберкулеза у человека
Туберкулез – хроническое инфекционное заболевание, протекающее с внутриклеточным (в макрофагах) паразитированием микобактерий [Myrvik Q. N. et al., 1984]. Несмотря на самую современную химиотерапию, лечение туберкулеза, как правило, бывает длительным и не всегда эффективным. Одной из причин безуспешного лечения данной инфекции по общепринятому мнению является недостаточная эффективность защитных механизмов макроорганизма, в значительной мере генетически обусловленных. Сведения об участии иммунной системы, складывающихся межклеточных взаимодействиях, накопленные за последние десятилетия, изменили (уточнили) представления о патогенезе туберкулеза.
Туберкулез чаще всего развивается в результате заражения МБТ, которые выделяет в окружающую среду больной человек. Респираторный тракт, а так же кишечник являются входными воротами инфекции. Таким образом, основной путь проникновения патогена – аэрогенный, но возможен и алиментарный. Определенную роль при аэрогенном заражении играет система мукоцилиарного клиренса, позволяющая вывести попавшие в бронхи частицы пыли, капельки слизи, слюны, мокроты, содержащие микроорганизмы. Аналогичным образом, при алиментарном пути проникновения микобактерий защитную роль играет переваривающая функция желудочно-кишечного тракта.
После проникновения патогена в легкие важную роль в защите от инфекции играют альвеолярные макрофаги. Эти клетки непосредственно подавляют рост бактерий, фагоцитируя их, а также они участвуют в реакциях клеточного противотуберкулезного иммунитетах [Авербах М.М. и др., 1982; Литвинов В.И. и др., 1983; Myrvik Q. N. et al., 1984].
Процесс фагоцитоза можно разделить на несколько следующих друг за другом этапов. В первую очередь бактерия прикрепляется к фагоциту, затем следует фаза поглощения микроорганизма, и как следствие ингибиция роста или уничтожение инфекта.
Процесс прикрепления микобактерий к фагоцитам осуществляется посредством рецепторов комплемента, маннозных рецепторов и других рецепторов клеточной поверхности макрофага. Взаимодействие между маннозными рецепторами и инфектом происходит при помощи гликопротеина клеточной стенки микобактерий, имеющего маннозный остаток на обращенной во внешнюю среду части молекулы [Schlesinger L. S., 1996].
Мутации генов, белковые продукты которых вовлечены в механизмы иммунологической защиты, определяют степень резистентности к инфекциям. Маннозо-связывающий белок (МВР) является Са-зависимым белком плазмы крови. Выявлено, что у человека этот белок осуществляет функцию активатора системы комплемента, кроме того, он действует непосредственно как опсонин, взаимодействуя с рецепторами макрофагов [Hill A.V.S., 1998].
Исследовали взаимосвязь полиморфизма гена МВР с чувствительностью к легочному туберкулезу в Индии. Анализ показал, что с туберкулезом ассоциированы три точечных замены в исследуемом гене [Selvaraj P. et al., 1999]. Аналогичное исследование, проведенное в Гамбии, выявило связь полиморфных вариантов данного гена с развитием легочной формы туберкулеза [Bellamy R. et al., 2000].
Фагоцитирующая клетка выбрасывает окружающие микроорганизм псевдоподии, которые затем сливаются на периферии, образуя окруженную мембраной вакуоль [Ерохин В.В., 1974; Leake E.S., Myrvik Q.N., 1971]. Микобактерии, находящиеся в фагосоме попадают под воздействие целого ряда неблагоприятных факторов, направленных на их уничтожение. К таким факторам можно отнести слияние фагосомы с лизосомами, содержащими литические ферменты [Jeckett P. S. et al., 1978]. Так же макрофаг способен производить реактивные радикалы кислорода и азота, играющие, вероятно, основную роль в уничтожении инфекта внутри макрофага [Nelson N., 1999]. Установлено, что "нокаутированные" по гену индуцибельной синтазы оксида азота (NOS2) мыши не способны противостоять туберкулезной инфекции, у них наблюдался усиленный рост M. tuberculosis в легких, селезенке и печени. Макрофаги этих мышей не производили NO и инфекция распространялась [Jackett P. S. et al., 1978; Walker L., Lowrie D. B., 1981].
Если макроорганизм не в состоянии устранить внутриклеточно размножающихся микобактерий, то в результате хронического воспаления в месте освобождения антигенов происходит скопление большого числа макрофагов, которые выделяют фиброгенные факторы и стимулируют образование грануляционной ткани и фиброза. Возникшая гранулома представляет собой попытку организма ограничить распространение персистирующей инфекции. Однако при интенсивном размножении микобактерий в организме человека и малоэффективном фагоцитозе выделяется большое количество токсичных веществ и индуцируется гиперчувствительность замедленного типа (ГЗТ), которая способствует выраженному экссудативному компоненту воспаления с развитием казеозного некроза. В процессе разжижения казеозных масс микобактерии получают возможность бурного внеклеточного размножения, что обусловливает прогрессирование туберкулеза [Ройт А., 1991, 2000].
Важную роль в противотуберкулезной защите играет, секретируемый макрофагами и моноцитами цитокин – фактор некроза опухолей (TNF). Он принимает участие в индукции формирования гранулемы, а так же способствует активации Т-клеток, тем самым повышая антибактериальную активность макроорганизма [Kindler V. et al., 1989; Mohan V. P. et al., 2001]. На модели мышей с "нокаутированным" геном, кодирующим рецептор для TNF, продемонстрировано существенное значение фактора некроза опухолей для выживания в условиях туберкулезной инфекции [Flynn J. L. et al., 1995]. В настоящее время известно несколько мутаций гена TNFА, находящегося в локусе главного комплекса гистосовместимости, однако их связь с туберкулезом не выявлена. Так, в небольшом исследовании, проводившемся в Гамбии, не обнаружили ассоциации полиморфизма 308G/A гена TNFА с клинически подтвержденным туберкулезом. Такой же результат был получен при поиске взаимосвязи полиморфизма гена TNFА c туберкулезом в Бразилии [Knight J. C., Kwiatkowski D., 1999].
При поиске конкретных генетических систем, отвечающих за развитие восприимчивости или резистентности к туберкулезу, в первую очередь обращалось внимание на главный комплекс гистосовместимости человека – HLA-систему, в которой расположены гены иммунного ответа. При этом продукты данного комплекса – антигены HLA – выступали в качестве биологических маркеров. Результаты анализа ассоциаций аллелей HLA-комплекса с туберкулезом показали связь DR-локуса с заболеванием, к тому же выявили высокую рассовую и этническую специфичность. В русской популяции заболевание ассоциировалось с В5, В14 и В17 антигенами HLA-комплекса [Хоменко А.Г., 1996]. Вероятно, гены комплекса HLA оказывают влияние на восприимчивость к туберкулезу, регулируя силу иммунного ответа и обуславливая этнические различия в подверженности ТБ.
Также была выявлена ассоциативная взаимосвязь ряда генетических маркеров – фенотипов крови с возникновением туберкулеза и с характером уже возникшего заболевания. Анализировали распределение фенотипических и генных частот 9 генетических локусов белков крови: ингибитора протеаз, трансферрина, фосфоглюкомутазы 1, кислой эритроцитарной фосфотазы 1, гаптоглобина, витамин-Д-транспортирующего белка, глиоксалазы 1, комплемента и эстеразы Д. При этом выявили существование различий между больными туберкулезом легких и практически здоровыми людьми. Эти различия выражаются в накоплении у больных туберкулезом одних фенотипов и в уменьшении частот других фенотипов. Следует отметить, что полученный эффект касался в основном одних и тех же 6 белковых локусов, что подтверждает их реальное значение в дифференциации между больными ТБ и здоровыми людьми [Богадельникова И.В., 1999].
С целью картирования генов предрасположенности к туберкулезу группа исследователей провели широкомасштабное сканирование генома с использованием 299 высокоинформативных ДНК – маркеров у 173 пар сибсов, полностью конкордантных по развитию туберкулеза [Bellamy R. et al., 2000]. При этом выявили 2 локуса предрасположенности – на длинных плечах хромосомы 15 и Х [Cervino A.C.L. et al., 2002].
На основании экспериментальных исследований, проведенных А.М. Морозом и В.Г. Торонджадзе (1977), были выявлены две линии мышей, оппозитные по своей чувствительности к туберкулезной инфекции. У резистентных линий после внутривенного заражения микобактериями туберкулеза наблюдаются длительный латентный период и медленное развитие инфекционного процесса, выражающееся в персистенции микобактерий на фоне незначительных гранулематозно измененных тканей, не приводящих к гибели животных. В то же время заражение мышей чувствительной линии приводит к быстрому размножению микобактерий в тканях, образованию гранулем в легких, селезенке, печени и быстрой гибели животных [Авербах М.М. и др., 1980; Мороз А. М., 1984]. На этих линиях исследователи изучили некоторые механизмы естественной резистентности и приобретенного иммунитета и высказали предположение, что устойчивость к инфекциям во многом зависит от способности макрофагов подавлять рост микобактерий в своей цитоплазме. Проведенные позднее эксперименты на 60 мышах двух линий, одна из которых чувствительна, другая устойчива к туберкулезной инфекции, полностью подтвердили данное предположение [Ельшанская М. П. и др., 1985].
Важнейший этап патогенеза туберкулеза - персистенция возбудителя в фагосомах макрофагов. Макрофаги поглощают патоген в очагах воспаления, но часто теряют способность элиминировать его в лизосомах, что в итоге приводит к их массированному внутриклеточному размножению и последующему выходу из погибших клеток. Получены данные, свидетельствующие о том, что имеются существенные различия в судьбе фагосом, содержащих вирулентные и авирулентные микобактерии, поскольку только первые препятствуют их слиянию с лизосомами [Myrvik Q. et al., 1984; Frenkel G. et al., 1986].
С точки зрения развития новых подходов к лечению туберкулеза очевидна необходимость контроля прохождения микобактерий по эндосомально-лизосомальному пути: от ранней эндосомы - к поздней, от поздней эндосомы – к лизосоме.
1.3 Физиологические функции белковых продуктов генов-кандидатов подверженности туберкулезу, их роль в патогенезе заболевания
Одним из генов предрасполагающих к развитию туберкулеза является NRAMP1 (от англ. Natural-Resistance-Associated Macrophage Protein 1 gene – ген макрофагального протеина 1, ассоциированного с естественной резистентностью). Более того, R. Bellamy и соавт. (1998) отнесли NRAMP1 к основным кандидатным генам туберкулеза у человека. Белковый продукт этого гена имеет вес около 60 кД, он локализован в лизосомальном компартменте покоящегося макрофага, но во время фагоцитоза он работает на мембране фагосомы [Gruenheid S. et al., 1997]. Nramp1 участвует в процессах активации макрофагов, являясь ключевым звеном в механизме транспорта нитритов из внутриклеточных компартментов в более кислую среду фаголизосомы, где он способен вступать в химическую реакцию с образованием NO [Blackwell J. M., Searle S., 1999].
Белок входит в семейство функционально связанных мембранных белков (к этому семейству относят также Nramp2), ответственных за транспорт двухвалентных катионов, таких как Fe2+, Mn2+, Zn2+, Cu2+ [Jabado N. et al., 2000; Cellier M. et al., 2001].
Известно, что ионы металлов являются жизненно важными элементами, участвующими во многих метаболических реакциях, происходящих в каждой живой клетке. Следовательно, недостаток, избыток или отсутствие данных элементов может привести к развитию какого-либо патологического состояния или даже к гибели клетки. Постоянство ионов металлов в организме обеспечивается регуляцией их потребления, хранения и выведения. Для того чтобы поддерживалась необходимая концентрация ионов, каждая клетка обладает определенной системой, обеспечивающей транспорт веществ через мембрану. Сбой этой системы или ее части может повлечь за собой потерю равновесия между выведением и поступлением веществ, что приведет к изменению внутриклеточной концентрации ионов. Недостаточный транспорт ионов может оказаться причиной нехватки жизненно важных метаболических элементов, а чрезмерное их накопление может вызвать токсическое воздействие этих же веществ, ведущее к гибели клетки. Возможно, что антибактериальная функция Nramp1 заключается в создании неблагоприятной для бактерии окружающей среды внутри фагосомы [Gruenheid S. et al., 2000; Barton C.H. et al, 1999].
Во время фагоцитоза микроба макрофаг продуцирует активные кислородные метаболиты, которые являются токсичными для бактерии. Выживание патогена во время кислородозависимой перестройки метаболизма фагоцита обеспечивается микробными ферментами, большинство из которых содержат ионы металлов в своих активных центрах [Cellier M. et al., 1994].
В свою очередь истощение запаса ионов металлов в фагосоме, вызванное транспортной деятельностью макрофагального белка ассоциированного с естественной резистентностью, приводит к снижению продукции металлосодержещих ферментов поглощенной бактерией.
Следовательно, дефекты продукции или функции Nramp1 могут приводить к нарушению его транспортной функции и, как следствие, к повышению чувствительности к внутриклеточным патогенам, таким как микобактерии (рис. 1) [Barton C.H. et al., 1999].
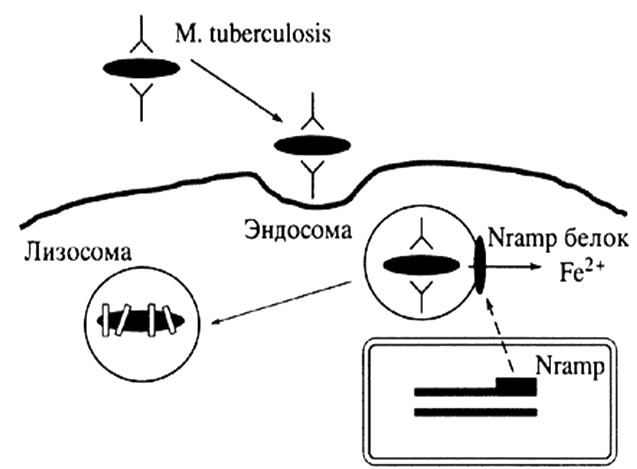
Рис. 1. Схема антибактериального действия NRAMP1 [по Пальцеву М.А., 2002]
Опыты, проведенные на инбредных мышах, показали, что уровень естественной резистентности к внутривенному заражению низкими дозами M. bovis (BCG) контролируется одним геном, локализованным в проксимальном регионе мышиной хромосомы 1. Этот локус обозначили как Bcg (также он известен как Lsh или Ity). Два различных фенотипа Bcg были ассоциированны с чувствительностью (Bcg-s) и с резистентностью (Bcg-r) на ранней стадии инфекции, вызванной M. bovis, M. avium, M. lepraemurium, Leishmania donovani, Salmonella typhimurium [Bredley D.J., 1977; Forget A. et al., 1981].
Экспериментальные исследования показали, что через 3 недели после заражения 10 КОЕ M. bovis (BCG) из селезенки мышей Bcg-s высевается на 3-4 порядка больше микобактерий, чем из селезенки мышей Bcg-r [Gros P. et al., 1981].Результаты исследований на моделях мышей позволили утверждать, что высокая чувствительность линий мышей Bcg/Lsh/Ity к заражению внутриклеточными патогенами объясняется дефектом локализованного на 1-ой хромосоме гена в локусе Bcg [Blackwell S.M. et al., 1994; Skamene E., 1994].
При помощи позиционного клонирования изолировали кандидатный ген и обозначили его как Nramp1 [Vidal S.M. et al., 1993]. Позже было подтверждено, что Nramp1 и ген, расположенный в локусе Bcg, идентичны [Govoni G. et al., 1996]. У лабораторных мышей ген Nramp1 имеет 2 аллеля Nramp1-s (восприимчивый, рецессивный) и Nramp1-r (резистентный, доминантный) [Malo D. et al., 1993].
Секвенирование матричной РНК Nramp1 от восприимчивых и резистентных линий мышей показало, что подверженность к инфекции связана с заменой глицина на аспарагиновую кислоту в позиции 169 (G169D) внутри 4-ого трансмембранного домена белка [Malo D. et al., 1994]. Элиминация функции Nramp1 у "нокаутированных" мышей (Nramp1-/-) приводит к повышению восприимчивости к группе бактериальных возбудителей, хорошо адаптированных к выживанию в макрофаге [Govoni G., Gros P., 1998].
Однако нельзя не учитывать, что в выше перечисленных экспериментах на мышах использовался штамм M. bovis (BCG), а он является авирулентным для человека. Более того, E. Medina и R. North (1998) показали, что в то время как Nramp1 действительно контролирует резистентность мышей к заражению M. bovis, резистентность к заражению M. tuberculosis, вероятно, не связана с мутациями данного локуса. Мыши с мутантным (чувствительным к заражению M. bovis) фенотипом не отличались по чувствительности к заражению M. tuberculosis от мышей с резистентным (дикого типа) фенотипом.
Учитывая полученные результаты, G. Govoni и P. Gros (1998) сделали вывод, что возбудители, не попадающие под контроль Nramp1, либо отличаются своим поведением внутри макрофага, либо не являются внутриклеточными паразитами. Эти данные свидетельствуют, что Nramp1 играет важную роль в резистентности к микобактериям и некоторым другим возбудителям инфекций у мышей, а его человеческий гомолог, вероятно, связан с подобными инфекциями у людей.
Такой человеческий гомолог гена Nramp1, обозначенный как NRAMP1, клонировали и картировали на человеческой хромосоме 2q 35 [Cellier M. et al., 1996]. В данном гене содержится 15 экзонов различной протяженности, разделенных интронами, размер которых также широко варьирует [Marquet S. et al., 2000]. Описано 9 полиморфных вариантов гена NRAMP1, которые, вероятно, влияют на функцию гена [Liu J. et al., 1995].
С целью изучения функции гена было проведено исследование различных полиморфизмов NRAMP1 у западных африканцев в Гамбии всвязи с туберкулезом в местной популяции. Четыре полиморфизма гена - 5`(CA)n, INT4, D543N, 3`UTR были ассоциированы с туберкулезом (р=0,03; р=0,009; р=0,008; р<0,001 соответственно). 5`(CA)n 201 п.о. аллель находился в неравновесии по сцеплению с одним из аллелей полиморфизма INT4 (Р<0,001). Полиморфизм D543N также проявил неравновесие по сцеплению с делецией в 3`UTR регионе гена (р<0,001). Аллельные варианты INT4 и 3`UTR гена NRAMP1 были незначительно связаны друг с другом и статистически значимо ассоциированы с туберкулезом [Bellamy R. et al., 1998]. Таким образом, при изучении связи NRAMP1 с туберкулезом у африканцев было обнаружено, что изменчивость данного гена связана с вариабельностью восприимчивости к туберкулезу.
Аналогичным образом, было проведено изучение различных полиморфных вариантов гена NRAMP1 в корейской популяции. Материалом для исследования послужили образцы крови от 192 пациентов с лабораторно подтвержденным туберкулезом легких. Как показал анализ, в исследуемой этнической группе туберкулез был ассоциирован с полиморфизмом 3`UTR гена NRAMP1 [Ryu S. et al., 2000].
По всей видимости, отличия в модели аллельной ассоциации гена с туберкулезом можно объяснить генетической гетерогенностью разных этнических групп. Так, например, анализ японской популяции показал различия в ассоциации гена с туберкулезом в двух группах пациентов: первая – жители города Токио, вторая – жители города Осака. Была обнаружена слабая зависимость между полиморфизмом D543N и туберкулезом в популяции Токио (р=0,045), и, напротив, имелась существенная связь с полиморфизмом (GT)n гена NRAMP1 в обеих популяциях [Gao P.S. et al., 2000]. К тому же была показана ассоциация полиморфизма D543N гена NRAMP1 с формированием деструкции при туберкулезе [Abe T. et al., 2003]. Для полиморфизмов D543N и 3`UTR найдена ассоциация с туберкулезом (р=0,041, р=0,030 соответственно) в китайской популяции [Liu W. et al., 2004].
Если в упомянутых выше исследованиях материалом послужили образцы крови от не родственных между собой индивидов больных туберкулезом, то в исследовании, проведенном в Гвинее (Конакри) тестировались 44 семьи на предмет ассоциации между NRAMP1 и туберкулезом. Каждая из этих семей содержала как минимум одного сибса больного туберкулезом. Всего было проанализировано 160 образцов крови путем тестирования по трем полиморфизмам: 5`(CA)n, 3`UTR, INT4. Для обработки полученных результатов был применен TDT-тест, при помощи которого обнаружили статистически значимую ассоциацию полиморфизма INT4 гена NRAMP1 с туберкулезом [Cervino A.C.L. et al., 2000].
Недавно был проведен поиск связи этого гена с туберкулезом в России (Башкортостан, Тува). При сравнении частот генотипов в группах больных инфильтративным туберкулезом легких и здоровых индивидов жителей Башкортостана была найдена ассоциация полиморфизма 3`UTR с подверженностью к туберкулезу (χ2 =21,34, OR=6,83) [Имангулова М.М. и др., 2004]. При аналогичном исследовании тувинцев показана связь с туберкулезом для варианта 1465-85G/A гена NRAMP1 (χ2 =6,40, р=0,041) [Рудко А.А., 2004].
Однако несколько исследований предоставили негативные результаты. Так, не было найдено связи полиморфных вариантов гена NRAMP1 с туберкулезом в эндемичной популяции Морокко и Дании [Soborg C. et al., 2002; Baghdadi J. et al., 2003]. Итак, несмотря на некоторую неопределенность в функции полиморфных вариантов гена NRAMP1, его ассоциация с данным заболеванием подтверждена в различных популяционных исследованиях (табл. 2).
Возможность с большой надежностью определять группы высокого риска, используя ДНК-типирование детей, чьи родители больны туберкулезом, для выявления тех, кто унаследует неблагоприятные аллели, была бы очень важна. По мнению R. J. North и E. Medina (1998), основное препятствие для более или менее надежного определения групп риска путем типирования по гену NRAMP1 – относительно слабый вклад этого гена в общую структуру генетически обусловленной восприимчивости и резистентности к туберкулезу.
Таблица 2 Обзор исследований полиморфных вариантов гена NRAMP1 при туберкулезе
Популяция |
Количество пациентов с ТБ |
Количество здоровых лиц |
Исследованные полиморфизмы |
Ассоциации с ТБ |
Авторы |
|
Гамбия |
410 |
417 |
5’(CA)n, INT4, D543N, 3’UTR |
INT4, 3’UTR |
Bellamy R. et al., 1998 |
|
Корея |
192 |
192 |
D543N, 3’UTR |
3’UTR |
Ryu S. et al., 2000 |
|
Япония |
267 |
202 |
(GT)n, INT4, D543N, 3’UTR |
D543N, (GT)n |
Gao P.S. et al., 2000 |
|
Гвинея |
44 семьи |
- |
5’(CA)n, INT4, 3’UTR |
INT4 |
Cervino et al., 2000 |
Дания |
104 |
176 |
5’(CA)n, INT4, D543N, 3’UTR |
- |
Soborg C. et al., 2002 |
Морокко |
116 семей |
- |
274С/Т, INT4, 1465-85G/A, D543N, 3’UTR, (GT)n |
- |
Baghdadi J. et al., 2003 |
|
Россия (Башкор-тостан) |
108 |
195 |
D543N, 3’UTR |
3’UTR |
Имангулова М.М. и др., 2004 |
|
Россия (Тува) |
238 |
263 |
274С/Т, INT4, 1465-85G/A, D543N, |
1465-85G/A |
Рудко А.А. и др., 2004 |
|
Китай |
120 |
240 |
INT4, D543N, 3’UTR |
D543N, 3’UTR |
Liu W. et al., 2004 |
Способность уничтожать внутриклеточных паразитов зависит от стадии активации макрофагов и приобретается ими под действием цитокинов, в частности, под действием гамма интерферона (IFN-), которые выделяются стимулированными лимфокинпродуцирующими Т-клетками [Ройт А., 1991]. Цитокины представляют собой группу полипептидных медиаторов, участвующих в формировании и регуляции защитных реакций организма. К цитокинам относят интерфероны, колониестимулирующие факторы, интерлейкины, хемокины, трансформирующие ростовые факторы, группа фактора некроза опухолей и некоторые другие. К общим главным свойствам цитокинов, объединяющим их в самостоятельную систему регуляции, относятся: плейотропизм и взаимозаменяемость биологического действия, отсутствие антигенной специфичности действия, саморегуляция продукции и формирование цитокиновой сети. Цитокины в первую очередь регулируют развитие местных защитных реакций в тканях с участием различных типов клеток крови, эндотелия, соединительной ткани и эпителиев. Гиперпродукция цитокинов ведет к развитию системной воспалительной реакции и может служить причиной развития ряда патологических состояний [Симбирцев А.С., 2002].
Мутации генов некоторых цитокинов, играющих важную роль в механизмах иммунологической защиты против микобактерий, а так же мутации генов кодирующих рецепторы к этим интерлейкинам могут играть свою роль в предрасположенности к туберкулезу. Так, генетически измененные мыши ("нокауты"), лишенные гена, кодирующего IFN- или рецептор к нему, очень чувствительны к заражению микобактериями [Flynn J. et al., 1993]. Описаны также случаи летальной БЦЖ инфекции у детей с врожденным дефектом экспрессии рецепторов к IFN- [Altare F. еt al., 1998]. Примечательно, что в литературе не встречается описание пациентов с генетическим недостатком IFN-. Вероятно, такие мутации являются фатальными.
Роль макрофагов в противотуберкулезном иммунитете не ограничивается фагоцитозом. Второй основной функцией клеток макрофагального ряда является презентация переработанных микобактериальных антигенов, что необходимо для запуска последующих иммунологических реакций [Покровский В.И. и др., 1979]. Кроме того, макрофаги участвуют в синтезе важнейших медиаторов иммунного ответа при туберкулезе, таких как интерлейкин-1 (ИЛ-1) и др. [Chensue S. et al., 1986]. ИЛ-1 является ключевым элементом в развитии воспаления, биологический эффект которого опосредуется через специфические клеточные рецепторные комплексы. Регуляция действия данного цитокина осуществляется посредством рецепторного антагониста интерлейкина-1, который конкурентно взаимодействует с рецептором к ИЛ-1 и, таким образом, ингибирует провоспалительный эффект [Tarlow J.K. et al., 1993].
S. Chensue и соавторы (1986) считают, что продукция интерлейкина-1 мононуклеарными клетками периферической крови больных является специфическим индикатором активности процесса, более выраженным, чем показатели СОЭ или С-реактивного белка, и предлагают использовать этот показатель для диагностики активного туберкулеза и контроля за эффективностью лечения больных.
В одной из работ была исследована in vitro способность макрофагов синтезировать интерлейкин-1 в ответ на воздействие синтетического активатора макрофагов мурамилдипептида у больных туберкулезом и здоровых доноров. Обнаружено, что макрофаги больных отличает пониженная способность секретировать этот цитокин [Селедцова Г.В. и др., 1991]. Причем при фиброзно–кавернозной форме туберкулеза наблюдалось более выраженное снижение продукции ИЛ-1, чем при инфильтративном туберкулезе [Хонина Н.А. и др., 2000] В настоящее время многие цитокины, в том числе и интерлейкин-1, применяются в клинической практике в виде лекарственных препаратов. Была изучена эффективность лечения больных туберкулезом с применением в комплексной терапии рекомбинантного ИЛ-1. Наблюдения показали, что использование препарата беталейкина повышает эффективность лечения по закрытию полостей распада, уменьшению и фрагментации специфических фокусов, степени выраженности остаточных изменений [Скворцова Л.А. и др., 2003].
Возможно, неспособность макрофагов активироваться для продукции ИЛ-1 под влиянием стимула связана с мутацией в гене, кодирующем этот цитокин. Было показано, что ген, кодирующий интерлейкин-1 – IL1B находится на хромосоме 2q14, а недалеко от этого гена на участке 2q14.2 расположен ген рецепторного антагониста ИЛ-1 – IL1RN [Patterson D. et al., 1993; Nicklin M.J.H. et al., 1994]. Известны два биаллельных полиморфизма в гене IL1В в позициях – 511 и +3953 [Giovine F.S. et al., 1993; Pociot F. et al., 1992]. Так же описан VNTR полиморфизм во втором интроне гена IL1RN, обусловленный тандемным повтором участка из 86 п.о. от 2 до 6 раз. Пяти аллелям VNTR полиморфизма в зависимости от частоты встречаемости были присвоены следующие названия: самый частый аллель – А1 (четыре повтора), второй по частоте аллель А2 (два повтора), А3 (пять повторов), А4 (три повтора), А5 (шесть повторов) [Tarlow J.K. et al., 1993].
Анализ полиморфизма кластера генов интерлейкина-1 (IL1A, IL1B, IL1RN) у африканцев показал взаимосвязь IL1A, IL1RN с чувствительностью к туберкулезу. Так, гетерозиготы по аллелю 2 VNTR полиморфизма гена IL1RN статистически значимо реже встречались среди больных туберкулезом, чем в контрольной группе. Однако авторы отмечают отсутствие влияния полиморфизма IL1B на подверженность туберкулезу [Bellamy R., Ruwende C., 1998]. В другом исследовании не было найдено различий в частотах генотипов IL1RN между выборками больных легочным туберкулезом и контрольной [Selvaraj P. et al., 2000].
Wilkinson R.J. и соавторы (1999) не обнаружили различий в частотах генотипов полиморфизма генов IL1B и IL1RN в группах больных туберкулезом и здоровых индивидов. Между тем было показано, что стимулированная in vitro микобактериями туберкулеза секреция IL-1RN у IL-1RNА2 индивидов выше, чем у IL1RNА2- индивидов. Таким образом, с аллелем 2 (2 повтора) VNTR полиморфизма связано повышение продукции IL1RN. В исследовании было описано влияние полиморфизма +3953А1/А2 IL1B на экспрессию продукта гена. В дополнение к этому авторы обнаружили ассоциацию IL1RNА2-/IL1B(+3953)А1+ гаплотипа с низкой экспрессией IL1RN и повышенным уровнем IL-1, что проявляется в провоспалительном фенотипе [Wilkinson R.J. et al., 1999].
Ген, кодирующий интерлейкин-12β (IL12В) также можно рассматривать в качестве кандидата при развитии туберкулезной инфекции, так как продукт данного гена играет ключевую роль в клеточном иммунном ответе [Тотолян А.А., Фрейдлин И.С., 2000]. Brightbill H. D. и соавторы (1999) продемонстрировали, что бактериальные лиганды (липопротеины) стимулируют выработку IL-12 макрофагами человека посредством активации Toll-like рецепторов на поверхности макрофага. Интерлейкин -12 связывается с 1 и 2 комплексом рецептора к IL-12 на поверхности Т-хелперов и других клеток-киллеров. В свою очередь, Т-хелперы продуцируют IFN-, который связывается с R1/R2 комплексом рецептора к IFN- на поверхности макрофагов и активирует их. Активированные макрофаги устремляются к месту нахождения микобактерий и активно их поглощают [Rook G. A. W. et al., 1985]. Таким образом, гибель микобактерий внутри макрофага осуществляется в результате сложных, опосредованных цитокинами, взаимодействий лимфоцитов и фагоцитов.
Интерлейкин 12 имеет 2 цепи, массой 35 kD (р35), кодируемая IL12А и массой 40 kD (р40), кодируемая IL12В. Тогда как IL12р40 главным образом взаимодействует с рецептором IL121 на поверхности Т-хелпера, IL12р35 в первую очередь сцепляется с IL122. Используя иммунопреципитацию, Oppmann B. и соавторы (2000) определили, что IL12В и р19 формируют растворимый комплекс, который они назвали IL23. Анализ установил, что IL23, подобно IL12, связывается с рецептором IL121. Не так давно были выявлены цитокины IL18 и IL29 имеющие сходство в функции с IL12 и IL23.
Ген NKSF2 (от англ. Natural Killer Cell Stimulatory Factor 2 – альтернативное название IL12) был картирован в дистальной области длинного плеча 5 хромосомы [Warrington J.A. et al., 1992]. В дальнейшем при помощи ПЦР анализа ДНК клеток гибридов был определен участок на хромосоме 5q31-33, где локализован IL12В [Sieburth D. et al., 1992]. J. A Warrington. и U Bengtsson. (1994) используя методы физического картирования, определили порядок расположения и относительное расстояние между 12 генами в 5q31-33 регионе. Ген IL12В был одним из них.
Группа исследователей картировала ген IL12в на 11 хромосоме мыши [Noben-Trauth N. et al., 1996]. Используя модель животного, были получены экспериментальные данные о роли гена IL12В в защите от туберкулезной инфекции. Элиминация функции IL12в у "нокаутированных" мышей (IL12р40-/-) при условии их инфицирования вирулентным штаммом М. tuberculosis приводила к распространенной туберкулезной инфекции и гибели животного. Однако мыши с генотипом IL12р35-/- не проявляли повышенной чувствительности к туберкулезу. Данное наблюдение наводит на мысль о значительной роли субъединицы р40 интерлейкина-12 в развитии резистентности к туберкулезу [Cooper A. M. et al., 2002].
Генетический дефицит IL12 или IL12R приводит к частичной или полной недостаточности выработки IFN-. Как правило, вакцина BCG и непатогенные микобактерии не вызывают у человека заболевания, однако известны случаи, когда они приводили к развитию тяжелой распространенной инфекции. Так было описано несколько пациентов с генетическим дефектом выработки IL12р40 и IL12р70 (комплекс судъединиц р40 и р70), большинство из которых страдали от диссеминированной инфекции М. bovis BCG. Недавно был обнаружен мононуклеотидный полиморфизм гена IL12В в 3`-UTR, обусловленный заменой А на С [Cervino A.C.L. et al., 2000]. Эта информация дает возможность оценить роль изменчивости гена IL12В в формировании полигенной подверженности к туберкулезу.
Если рассмотреть патогенез туберкулеза, возникает множество привлекательных кандидатов на роль "причинного" гена. Одним из таких генов, предположительно влияющих на исход отношений между человеком и микобактерией, является ген рецептора к витамину Д (VDR) [Uitterlinden A.G. et al., 2004]. Витамин Д – это группа родственных стероидов, одним из важнейших среди которых является так называемый Д>3> (холекальциферол). Главный эффект активированного витамина Д>3> (1,25(ОН)>2>Д>3>) или кальцитриола – стимуляция активной адсорбции кальция и фосфата из кишечника. К тому же кальцитриол оказывает влияние на клетки крови – модулирует пролиферацию и дифференциацию лимфоцитов, а также способствует конверсии циркулирующих моноцитов в макрофаги [Rigby W. F., 1988; Bellamy R., Hill A. V. S., 1998].
Активизированные макрофаги в свою очередь также способны к образованию кальцитриола. При туберкулезе этот локально продуцируемый кальцитриол может активизировать "проглатывание" и элиминацию МБТ макрофагами и минимизировать тканевую деструкцию [Davies P.D.O., 1985; Cadranel J. et al., 1988]. Исследования in vitro показали, что метаболиты витамина Д могут усиливать способность моноцитов человека ограничивать размножение внутриклеточно расположенных микобактерий туберкулеза. В то время как добавление одного рекомбинантного человеческого IFN- к пулированным моноцитам человека не оказывало влияния на их туберкулостатическую активность, введение в данную систему дополнительно кальцитриола приводило к полной остановке роста микобактерий [Rook G.A.W. et al., 1986; Denis M., 1991].
Все перечисленные эффекты холекальциферола осуществляются посредством специальных рецепторов, которые присутствуют во многих клетках и органах, в том числе в лимфоцитах периферической крови и моноцитах [Griffin M.D. et al., 2003]. Такая широкая распространенность рецепторов к витамину Д говорит о том, что данный стероид и его метаболиты регулируют деятельность многих систем организма.
Локализация гена кодирующего рецептор к витамину Д определена у человека на хромосоме 12q12-q14 [Labuda M., 1991]. Известны его полиморфные варианты, наиболее часто из которых исследуются три полиморфизма: F/f, T/t, B/b. Обозначение и название этих полиморфных маркеров произошло от первых букв рестриктаз, используемых для их детекции в ПДРФ-анализе (FokI, TagI, BsmI).
Результаты исследования, проведенного в Западной Африке (Гамбия) методом случай – контроль, выявили статистически значимую ассоциацию tt генотипа VDR гена с резистентностью к легочному туберкулезу [Bellamy R., 2000]. Подобная работа была проведена в Китае, результаты которой показали наличие ассоциации ff генотипа VDR гена с подверженностью к ТБ [Liu W. et al., 2004].
Однако в популяции Перу статистически значимой ассоциации различных полиморфизмов гена VDR с туберкулезом найдено не было [Roth D. E. еt al., 2004]. В другом исследовании было показано, что большую роль в предрасположенности к ТБ играют гаплотипы гена VDR [Bornman L. et al., 2004]. В Лондоне была проведена работа, в результате которой исследователи определили наличие связи между дефицитом холекальциферола в организме человека и активным туберкулезом. Наряду с этим, авторы продемонстрировали отрицательное влияние комбинации генотипов ТТ и Tt, а так же генотипа ff с недостатком витамина Д на резистентность к ТБ [Wilkinson R.J. et al., 2000].
В другом исследовании было показано, что генотип tt VDR гена ассоциирован с подверженностью к легочному туберкулезу у женщин, а, в свою очередь, ТТ генотип – с резистентностью к ТБ у женщин [Selvaraj P. et al., 2000]. Таким образом, витамин Д, действуя через рецепторы и модулируя функцию макрофагов, может повышать противотуберкулезную защиту человека. Данное утверждение отчасти объясняет тот факт, что заболеваемость туберкулезом выше в течение холодных сезонов года, когда кожный синтез кальцитриола от экспозиции солнца понижен и серологический уровень витамина Д более низкий [Chan T.Y., 2000].
Однако известно, что действие продукта экспрессии гена рецептора витамина D оказывает умеренное влияние на полную чувствительность к туберкулезу [Hill A.V.S., 2001]. К тому же, роль кальцитриола в антибактериальном иммунитете не однозначна, поскольку он наряду с активизацией макрофагов проявляет такие эффекты, как угнетение пролиферации лимфоцитов, снижение продукции иммуноглобулина и синтеза цитокинов [Bellamy R., Hill A.V.S., 1998; Wilkinson R. J. et al., 2000].
В целом, можно отметить, что в настоящее время имеется достаточно разрозненная информация о генетических основах подверженности к туберкулезу, а так же, видимо, общее количество генов, в той или иной мере влияющих на развитие этого инфекционного заболевания, гораздо выше. Таким образом, поиск новых генов-кандидатов туберкулеза, а так же изучение полиморфизма известных генов-кандидатов в популяциях различного этнического состава и их вклада в общую подверженность к заболеванию представляется на сегодняшний день важной задачей, решение которой позволит определить новые подходы к более эффективному лечению и профилактике ТБ.
2. Материал и методы исследования
2.1 Обследованные группы населения
Настоящее исследование включало три аспекта: анализ популяционной распространенности полиморфизма генов NRAMP1, VDR, IL1B, IL1RN и IL12В, оценку их патогенетической значимости в отношении туберкулеза, а также влияние исследуемых генов на патогенетически важные параметры заболевания. В соответствии с этим, первую часть работы выполнили на материале популяционной выборки здоровых жителей г. Томска (140 человек). Вторая и третья часть исследования проведена на материале выборки больных туберкулезом (304 человека) и их семей (42 семьи, 109 человек), живущих в г. Томске и Томской области.
Работа выполнена на базе ГОУ ВПО Сибирский государственный медицинский университет Росздрава и ГУ НИИ медицинской генетики ТНЦ СО РАМН. Набор материала для исследования осуществлялся в Областной Томской клинической туберкулезной больнице, Детском легочно-туберкулезном отделении Железнодорожной больницы, Областной детской туберкулезной больнице, а также Областном противотуберкулезном диспансере, в соответствии с этическими нормами с обязательным получением согласия испытуемых.
2.1.1 Характеристика контрольной выборки
В качестве контрольной группы использовалась популяционная выборка, сформированная для настоящего исследования на основе ДНК–банка ГУ НИИ медицинской генетики ТНЦ СО РАМН. Все лица, вошедшие в эту группу, были русскими. Основным критерием отбора образцов было отсутствие родства между индивидами. В данную выборку вошли индивиды никогда не болевшие туберкулезом по анамнестическим данным (140 человек), средний возраст которых составил 61,819,4 лет. Частично ее составили индивиды (118 человек) не родственные между собой и не имеющие по результатам клинического и параклинического обследования легочной патологии. Остальная часть контрольной группы (22 человека) включала пациентов, которым первоначально ошибочно был выставлен диагноз туберкулеза, но затем при более детальном обследовании данное заболевание было исключено. Таким образом, этих индивидов можно считать здоровыми от ТБ.
2.1.2 Характеристика выборки больных туберкулезом
Исследованная выборка больных туберкулезом была сформирована из индивидов, не родственных между собой. Выборка была однородной как по расовой принадлежности, так и по этническому происхождению, средний возраст составил 30,615,4 года. Все пациенты были русскими; женщин – 99 (32,6%), средний возраст которых составил 26,3 14,6 года, мужчин –205 (67,4%), средний возраст – 32,8 15,4 лет.
Диагноз туберкулеза легких устанавливался на основании данных микроскопии мокроты с обязательным рентгенологическим исследованием легких для определения формы заболевания и распространенности специфического процесса (общепринятые методы).
Обследованные пациенты имели следующие клинические формы туберкулеза: у 43 человек был диагностирован первичный туберкулез (у 35 – туберкулез внутригрудных лимфоузлов, у 3 – первичный туберкулезный комплекс, у 2 – плеврит туберкулезной этиологии первичного периода, у 2 – гематогенно-диссеминированный туберкулез легких), 150 пациентам был поставлен диагноз инфильтративного туберкулеза легких, 65 – диссеминированный туберкулез легких, 27 пациентам – очаговый туберкулез, у пятерых обследованных индивидов развилась казеозная пневмония, у 4 – фиброзно–кавернозный туберкулез легких, такому же количеству больных был выставлен диагноз туберкуломы легких, 3 пациентам – туберкулез почек, 2 – туберкулез бронха, 1 – плеврит туберкулезной этиологии.
2.1.3 Характеристика семейной выборки пробандов, больных туберкулезом
Исследованная семейная выборка была зарегистрирована по пробандам – больным туберкулезом, находившихся на лечении в противотуберкулезных учреждениях г. Томска в период с 2000 по 2004 г. Всего было обследовано 42 семьи (109 человек), в том числе 25, зарегистрированных по пробандам – детям в возрасте от 1 года до 15 лет. Семнадцать семей было выбрано по взрослым пробандам в возрасте от 17 до 48 лет (табл. 3).
Таблица 3 Структура семейного материала выборки изученной по полиморфным ДНК-маркерам генов NRAMP1, VDR, IL1B, IL12B, IL1RN
|
Выборка |
Количество детей в семье |
Всего |
||||
|
1 |
2 |
3 |
4 |
5 |
||
|
Полные семьи (изучены оба родителя и дети) |
19(57) |
0 |
0 |
0 |
1(7) |
20(64) |
|
Неполные семьи (изучен один родитель и дети) |
16(32) |
1(3) |
0 |
0 |
0 |
17(35) |
|
Нет данных о родителях |
0 |
5(10) |
0 |
0 |
0 |
5(10) |
Примечание. В скобках указано количество индивидов.
Часть пробандов–детей составили мальчики (n=10), а девочек было в 1,5 раза больше (n=15). Средний возраст пробандов–детей разного пола достоверно не различался (7,2 года у мальчиков и 7,5 лет у девочек). Среди взрослых пробандов было 7 женщин (средний возраст – 19,8 лет) и 10 мужчин (средний возраст – 23,9 лет). Всем пробандам был поставлен диагноз туберкулеза, причем первичный и вторичный генез заболевания встречался с одинаковой частотой. Среди обследованных родственников пробандов первой степени родства было 28 лиц мужского пола, из них 8 человек болели туберкулезом, и 39 -женского, из них с туберкулезом 14.
2.2 Методы исследования
2.2.1 Клинико-лабораторные методы исследования
Клинико – эпидемиологический анализ больных туберкулезом включал: возраст начала заболевания, социальную категорию, вредные привычки (курение, злоупотребление алкоголем, употребление наркотиков), сопутствующую патологию, наличие контакта с туберкулезным больным, а также данные о туберкулезе у родственников больного. Анализу подвергались выраженность клинических проявлений (жалобы, объективный статус больного), результаты лабораторных и инструментальных методов исследования (микроскопия и посев мокроты на МБТ, чувствительность к противотуберкулезным препаратам, рентгенологическое исследование легких, общий анализ крови) на момент начала заболевания.
Для решения задачи по оптимизации и стандартизации сбора информации о больном ТБ была разработана специальная карта "Унифицированный носитель информации", содержащая блоки, охватывающие сведения о жалобах больного, эпидемиологическом анамнезе, анамнезе заболевания, объективном статусе, результатах лабораторного и инструментального обследования. В дальнейшем на основании сведений из этих карт была создана электронная база данных в формате Microsoft Excel.
2.2.2 Молекулярно – генетические методы анализа полиморфизма генов
Всего было изучено 9 полиморфных вариантов пяти генов – кандидатов подверженности туберкулезу. Исследовали 4 полиморфных варианта гена NRAMP1: 469+14G/C (INT4) – трансверсия гуанина на цитозин в 4 интроне, С274Т – консервативная замена в 3 экзоне, 1465-85 G/A – транзиция в 13 интроне и D543N – неконсервативная замена цитозина на аденин в 15 экзоне; два полиморфизма VDR гена: B/b, F/f; полиморфный вариант IL1B гена в 5 экзоне +3953А1/А2; VNTR полиморфизм гена IL1RN, расположенный во 2 интроне. Также выборки генотипировали по полиморфизму гена IL12В, обусловленному трансверсией аденина на цитозин в 3`-UTR области (табл. 4).
Для генотипирования индивидов по указанным полиморфизмам использовали образцы тотальной ДНК, выделенной из цельной венозной крови по стандартной неэнзиматической методике [Маниатис Т. и др., 1984; Lahiri D. et al., 1992]. Выделенную ДНК замораживали и хранили при температуре -20 С до проведения эксперимента. Генотипирование осуществляли с помощью полимеразной цепной реакции (ПЦР), используя структуру праймеров и параметры температурных циклов, описанных в литературе (табл.5).
Смесь для ПЦР содержала 0,5-2,0 мкл специфической пары праймеров с концентрацией 1 о.е./мл, 1,2-1,8 мкл 10 буфера для амплификации с концентрацией MgCl>2> 0,5-2,0 mM, 0,5-1,0 е. а. Taq ДНК-полимеразы ("Сибэнзим", "Медиген", Новосибирск) и 100-200 нг геномной ДНК. Смесь помещали в 0,5 мл пробирки типа "Эппендорф", наслаивали сверху минеральное масло для предотвращения испарения и амплифицировали в автоматических минициклерах "MJ Rеsearch" (США) и "БИС 108" (Россия-Новосибирск).
Программа амплификации включала предварительную денатурацию при 94С в течении 5 минут, с последующими 30-35 циклами отжига при температуре 60С (1мин.), элонгации цепи при 72С (40 сек.) и денатурации при 94С (40 сек.). Программу завершала финальная элонгация при 72С в течение 3 минут. Амплификат подвергали гидролизу соответствующей рестриктазой (табл.5) при оптимальной для фермента температуре в течении 12-24 ч. Рестрикционная смесь включала 5-7 мкл амплификата, 1,0-1,2 мкл 10 буфера для рестрикции, поставляемого фирмой – производителем ("Сибэнзим", Новосибирск), и 1-5 единиц активности фермента (в зависимости от эффективности его работы). Продукты рестрикции фракционировали в 3% агарозном геле при напряжении 120 В в течении 30 минут. Фрагменты ДНК окрашивали бромистым этидием и визуализировали в ультрафиолетовом свете.
Таблица 4Структура материала популяционных выборок г. Томска и Томской области, изученных по полиморфным ДНК-маркерам генов NRAMP1, VDR, IL1B, IL12B, IL1RN
|
Ген |
Полиморфизм |
Выборка больных туберкулезом |
Выборка здоровых индивидов |
|
NRAMP1 |
469+14G/C |
279 |
137 |
|
D543N |
278 |
139 |
|
|
1465-85G/A |
279 |
135 |
|
|
274C/T |
299 |
116 |
|
IL12B |
1188А/С |
279 |
129 |
VDR |
B/b |
293 |
108 |
|
F/f |
298 |
113 |
|
IL1B |
+3953A1/A2 |
301 |
139 |
IL1RN |
VNTR |
299 |
140 |
Таблица 5 Характеристики исследованных полиморфизмов
Ген |
Полимор-физм |
Структура праймеров |
tо отжига прай-меров, оС |
Фермент рестрик-ции |
Продукты гидролиза, п. н. |
Литература |
|
|
Аллель «дикого» типа |
Мутантный аллель |
||||||
|
|
274C/T |
5’-tgccaccatccctatacccag –3’ 5’-tctcgaaagtgtcccactcag –3’ |
60 |
Mnl I |
167;37;12 bp |
102;65;37;12 bp |
Liu J. et al., 1995 |
|
469+14G/C |
5’-tctctggctgaaggctctcc –3’ 5’-tgtgctatcagttgagcctc – 3’ |
60 |
Apa I |
624 bp |
455;169 bp |
||
|
1465-85G/A |
5’-gcaagttgaggagccaagac –3’ 5’-acctgcatcaactcctcttc –3’ |
60 |
Bsе 1I |
142;75;24 bp |
102;75;40;24 bp |
||
|
D543N |
5’-gcatctccccaattcatggt –3’ 5’-aactgtcccactctatcctg –3’ |
60 |
Bme 18I |
126;79;39 bp |
201;39 bp |
||
|
IL12 |
A1188C |
5’-ttctatctgatttgcttta –3’ 5’-tgaaacattccatacatcc –3’ |
43 |
Taq I |
233 bp |
165;68 bp |
Hall M. A. еt al., 2000 |
|
VDR |
B/b |
5’-aacttgcatgaggaggagcatgtc-3’ 5’-ggagaggagcctctgtcccatttg-3’ |
60 |
Pct I |
813 bp |
505;308 bp |
Wilkinson R.J. et al., 2000 |
|
F/f |
5’-agctggccctggcactgactctgctct-3’ 5’-atggaaacaccttgcttcttctccctc-3’ |
60 |
Fok I |
267 bp |
197;70 bp |
||
|
IL1B |
+3953A1/A2 |
5’-gttgtcatcagactttgacc-3’ 5’-ttcagttcatatggaccaga-3’ |
58 |
Taq I |
220 bp |
148; 72 bp |
Wilkinson R.J. et al., 1999 |
|
|
VNTR |
5’-tcctggtctgcaggtaa-3’ 5’-ctcagcaacactcctat-3’ |
60 |
А1-410 п.о. (4 повтора); А2-240 п.о. (2 повтора) А3-500 п.о. (5 повторов); А4-325 п.о. (3 повтора) А5-595 п.о. (6 повторов) |
Tarlow J.K. et al., 1993 |
2.2.3 Генетико – статистические методы анализа
Распределение генотипов по исследованным полиморфным локусам проверяли на соответствие равновесию Харди-Вайнберга (РХВ) с помощью точного теста Фишера [Вейр Б., 1995]. Рассчитывали ожидаемую гетерозиготность полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN [Nei M., 1975]. Относительное отклонение ожидаемой гетерозиготности от наблюдаемой (D) рассчитывали по формуле:
D=(h>obs>–h>exp>)/h>exp>,
где h>obs> и h>exp> – ожидаемая и наблюдаемая гетерозиготность соответственно.
Для анализа ассоциации маркеров исследуемых генов с туберкулезом, а также с качественными патогенетически важными признаками заболевания, сравнивали частоты аллелей и генотипов в группах больных и здоровых индивидов, используя критерий χ2 с поправкой Йетса на непрерывность. При численностях генотипов менее пяти использовали точный тест Фишера. В дополнение к этому об ассоциации разных генотипов (или их комбинаций) с заболеванием судили по величине отношения шансов (odds ratio (OR)), которая показывает, во сколько раз выше вероятность заболеть для индивида с определенным генотипом (или комбинацией генотипов) [Pearce N., 1993].
OR= (A/B)/(C/D), где
А – число (процент) людей с данным генотипом (комбинацией генотипов) в группе больных;
С - число (процент) людей с данным генотипом (комбинацией генотипов) в группе здоровых;
В – число (процент) индивидов, не имеющих данного генотипа (комбинации генотипов) в группе больных;
D - число (процент) индивидов, не имеющих данного генотипа (комбинации генотипов) в группе здоровых.
Значения OR>1 указывают на возможную положительную ассоциацию с заболеванием. Обсуждение величин OR проводили при уровне значимости не более 5%.
На материале семейной выборки больных изучение ассоциаций полиморфизма исследованных генов с туберкулезом проводили с использованием теста на неравновесие при переносе (Transmission/Disequilibrium Test, TDT), который в случае диаллельного маркерного локуса М сводится к анализу таблицы сопряженности 22, где в ячейках матрицы суммированы случаи наследования и не наследования от родителей больными детьми маркерных аллелей [Spielman R. S. et al., 1993].
a – число случаев наследования аллеля М>1> от родителей М>1>М>1>;
b – число случаев наследования аллеля М>1> от родителей М>1>М>2>;
c – число случаев наследования аллеля М>2> от родителей М>1>М>2>;
d – число случаев наследования аллеля М>2> от родителей М>2>М>2>;
Используются данные только от гетерозиготных родителей. Статистика теста рассчитывается по формуле:
TDT=(b-c)2/(b+c)
и в случае верной нулевой гипотезы (Н>0>: нет ассоциации) асимптотически распределена как χ2 с 1 степенью свободы.
С целью выявления ассоциации маркеров исследуемых генов с количественными, патогенетически важными признаками туберкулеза, проводили сравнение средних значений уровней метрических показателей у носителей разных генотипов с помощью однофакторного дисперсионного анализа по Фишеру и теста LSD. При наличии зависимости признака от пола показатели анализировались отдельно в группе мужчин и женщин. В случае влияния возраста на количественный параметр проводилась его корректировка, которая осуществлялась с помощью уровня линейной регрессии и рассчитывалась по формуле [Лильин Е.Т. и др., 1984]:
y=x+b(t>0 >-t),
где y – коррегированное значение исходной величины (х) признака;
t – возраст индивида
t>0 >– определенный возраст, к которому приводятся все значения;
b – коэффициент линейной регрессии признака по возрасту, который рассчитывается по формуле:
b=r>xt>/s>t>2
где r>xt> – коэффициент корреляции признака с возрастом;
s>t>> >- стандартное отклонение возраста в выборке.
Проверку на нормальность распределений осуществляли с помощью критерия Колмогорова-Смирнова и Лилифорса. В случае неравных дисперсий использовали непараметрические тесты Манна-Уитни, Краскела-Уоллиса и медианный тест [Лакин Г.Ф., 1990]. Сравнение дисперсий проводили по критерию Левене.
Расчеты гаметического неравновесия между парами молекулярно-генетических маркеров проводили по Hill W. G. (1974). Все расчеты осуществляли с помощью программ "STATISTICA for Windows 6.0" и "Microsoft Excel 7.0".
3. Результаты и обсуждение
Учитывая поставленные задачи, исследование включало три аспекта: изучение популяционной распространенности полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN, анализ связи исследованных генов с туберкулезом и поиск ассоциаций с патогенетически важными параметрами заболевания у русских жителей г. Томска. К настоящему времени получены результаты исследования аллельных вариантов генов подверженности к ТБ у тувинцев, выполненного по аналогичной схеме и с использованием того же набора полиморфизма генов [Рудко А.А. и др., 2003]. Это дало возможность провести сравнение полученных результатов между русскими жителями г. Томска и тувинцами.
3.1 Распространенность полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN среди здоровых лиц (контрольная группа)
В настоящее время во многих популяциях мира достаточно широко исследованы полиморфные варианты гена NRAMP1, и в меньшей степени изучена распространенность аллелей генов VDR, IL12B, IL1B, IL1RN [Рудко А.А. и др., 2003; Имангулова М.М. и др., 2004; Bellamy R. et al., 1998; Ryu S. et al., 2000; Cervino A.C.L. et al., 2000;. Gao P. S., 2000; Baghdadi J. et al., 2004; Liu W. et al., 2004;]. Результаты исследований показали, что полиморфизм этих генов вносит вклад в возникновение туберкулеза.
Однако известно, что восприимчивость к инфекционному заболеванию определяется одновременно многими генами с различным вкладом каждого из них в формирование того или иного патологического фенотипа. К тому же, один и тот же ген может участвовать в формировании чувствительности (или резистентности) к нескольким инфекционным заболеваниям. Вероятно, для каждого гена (и их ансамблей) существует свое "поле действия", которое модифицируется средой [Пузырев В.П., 2000]. Сочетания генов предрасположенности к болезни могут быть неодинаковы в популяциях, обусловливая различия в подверженности к заболеванию у разных народов. В связи с этим перспективным направлением исследований генетических основ предрасположенности к туберкулезу является изучение вкладов конкретных сочетаний аллелей в подверженность к болезни в различающихся как по расовой, так и по этнической принадлежности популяциях.
У здоровых жителей г. Томска распределение генотипов по всем изученным полиморфным вариантам гена NRAMP1 (469+14G/C, D543N, 1465-85 G/A, 274 C/T), VDR (B/b, F/f), а также генов интерлейкинов (полиморфизм 1188A/C гена IL12B, полиморфизм +3953 A1/A2 гена IL1B) соответствовало ожидаемому при равновесии Харди-Вайнберга (РХВ), причем для большинства полиморфизмов наблюдаемая гетерозиготность (H>obs>) превышала ожидаемую (H>exp>) (табл.6). Лишь для частот генотипов VNTR полиморфизма гена IL1RN показано отклонение от ожидаемых при РХВ (χ2=16,75 р=0,010). При этом наблюдаемое количество гомозигот А2А2 превышало ожидаемое в 2,5 раза, а уровень гетерозиготности был меньше ожидаемого (D= –0,280). Возможно, этот факт объясняется тем, что анализируемая популяционная группа индивидов была выбрана не случайным образом из общей популяции, а включала только здоровых в отношении туберкулезной инфекции.
Сравнение распространенности полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN у здоровых от туберкулеза русских и тувинцев показало статистически значимые отличия между этими этническими группами, которые имели место в распределении, как частот аллелей, так и генотипов по большинству изученных генов (табл. 7). Максимальные отличия между сравниваемыми этническими группами выявлены для полиморфизма B/b гена VDR, VNTR полиморфизма гена IL1RN и 1188А/С гена IL12B.
Таблица 6 Частоты аллелей и генотипов исследованных генов у здоровых жителей г. Томска
Ген |
Поли-морфизм |
Гено-типы |
N.O. |
N.E. |
Частота аллеля |
χ2 (df) |
H>obs> |
H>exp> |
D |
|
NRAMP1 |
469+14 G/C |
GG GC CC |
97 38 2 |
98,22 35,56 3,22 |
G= 0,847 |
0,44 (1) |
0,277 |
0,260 |
+0,069 |
|
D543N |
DD DN NN |
127 12 0 |
127,26 11,48 0,26 |
D= 0,957 |
0,01 (1) |
0,086 |
0,083 |
+0,045 |
|
|
1465-85 G/A |
GG GA AA |
73 47 15 |
68,98 55,04 10,98 |
G= 0,715 |
2,60 (1) |
0,348 |
0,408 |
-0,146 |
|
|
274C/T |
CC CT TT |
80 34 2 |
81,11 31,78 3,11 |
C= 0,836 |
0,37 (1) |
0,293 |
0,274 |
+0,070 |
|
IL12B |
1188 A/C |
AA AC CC |
85 43 1 |
87,92 37,15 3,92 |
A= 0,826 |
2,75 (1) |
0,333 |
0,288 |
+0,157 |
VDR |
B/b |
BB Bb bb |
19 63 26 |
23,61 53,77 30,61 |
b= 0,532 |
2,93 (1) |
0,583 |
0,498 |
+0,172 |
|
F/f |
FF Ff ff |
42 54 17 |
42,13 53,73 17,13 |
F= 0,611 |
0,00 (1) |
0,478 |
0,476 |
+0,005 |
|
IL1B |
+3953 A1/A2 |
A1A1 A1A2A2A2 |
90 44 5 |
90,24 43,51 5,24 |
A1=0,806 |
0,00 (1) |
0,317 |
0,313 |
+0,011 |
|
IL1RN |
VNTR |
A1A1 A1A2 A1A3 A1A4 A2A2 другие |
93 27 4 3 12 1 |
86,49 40,94 3,96 2,20 4,84 1,57 |
A1= 0,786 A2= 0,186 A3= 0,018 |
16,8* (6) |
0,250 |
0,347 |
-0,280 |
Примечание. N.O. и N.E. – наблюдаемая и ожидаемая численности генотипов соответственно; χ2 – критерий для сравнения ожидаемого и наблюдаемого распределения генотипов; d.f. – число степеней свободы; H>obs> и H>exp> – соответственно наблюдаемая и ожидаемая гетерозиготность; D – относительное отклонение наблюдаемой гетерозиготности от ожидаемой; * – p < 0,05
Таблица 7 Частоты аллелей и генотипов исследованных генов у русских жителей г. Томска и тувинцев
Ген |
Полимор-физм |
Генотип / аллель |
Русские N (%) |
Тувинцы N (%) |
p |
NRAMP1 |
469+14 G/C |
GG GC CC |
97 (70,8) 38 (27,7) 2 (1,5) |
224 (85,2) 36 (13,7) 3 (1,1) |
0,002 |
|
G |
0,847 |
0,920 |
0,002 |
||
|
D543N |
DD DN NN |
127 (91,4) 12 (8,6) 0 (0) |
198 (75,3) 57 (21,7) 8 (3) |
0,000 |
|
|
D |
0,957 |
0,861 |
0,000 |
||
|
1465-85 G/A |
GG GA AA |
73 (54,1) 47 (34,8) 15 (11,1) |
162 (61,6) 88 (33,5) 13 (4,9) |
0,057 |
|
|
G |
0,715 |
0,783 |
0,040 |
||
|
274 C/T |
CC CT TT |
80 (69) 34 (29,3) 2 (1,7) |
207 (78,7) 49 (18,6) 7 (2,7) |
0,072 |
|
|
C |
0,836 |
0,880 |
0,127 |
||
|
IL12B |
1188 A/C |
AA AC CC |
85 (65,9) 43 (33,3) 1 (0,8) |
104 (39,5) 119 (45,3) 40 (15,2) |
0,000 |
|
A |
0,826 |
0,622 |
0,000 |
||
|
VDR |
B/b |
BB Bb bb |
19 (17,6) 63 (58,3) 26 (24,1) |
2 (0,8) 88 (33,5) 173 (65,7) |
0,000 |
|
b |
0,532 |
0,825 |
0,000 |
||
|
F/f |
FF Ff ff |
42 (37,2) 54 (47,8) 17 (15) |
148 (56,3) 98 (37,3) 17 (6,4) |
0,001 |
|
|
F |
0,611 |
0,749 |
0,000 |
||
|
IL1B |
+3953 A1/A2 |
A1A1 A1A2 A2A2 |
90 (64,7) 44 (31,7) 5 (3,6) |
197 (74,9) 61 (23,2) 5 (1,9) |
0,086 |
|
A1 |
0,806 |
0,865 |
0,035 |
||
|
IL1RN |
VNTR |
A1A1 A1A2 A2A2 другие |
93 (66,4) 27 (19,3) 12 (8,6) 8 (5,7) |
190 (72,5) 31 (11,8) 1 (0,4) 40 (15,3) |
0,000 |
|
A1 A2 A3 |
0,786 0,186 0,018 |
0,849 0,069 0,013 |
0,000 |
Примечание. N – численность лиц с соответствующими генотипами; р – достигнутый уровень значимости
У русских г. Томска по сравнению с тувинцами аллели b гена VDR и А1 гена IL1RN встречались реже, а аллель 1188А гена IL12B – чаще. Кроме того, рассматриваемые популяционные группы статистически значимо различались по частотам аллелей и генотипов полиморфизмов 469-14G/C, D543N гена NRAMP1 и F/f гена VDR. Так, у русских чаще, чем у тувинцев наблюдали аллель 543D и реже аллель 469+14G гена NRAMP1. Индивиды, гомозиготы и гетерозиготы по аллелю f гена VDR, чаще встречались среди жителей г. Томска. Распределение генотипов полиморфизма 1465-85G/A гена NRAMP1 и +3953A1/A2 гена IL1B в исследованных популяционных группах не отличалось, однако частоты аллелей этих полиморфизмов были статистически значимо ниже у русских. Лишь для варианта 274С/Т гена NRAMP1 не найдено отличий по частотам аллелей и генотипов у русских и тувинцев.
К настоящему времени накоплены результаты многочисленных исследований роли генов-кандидатов туберкулеза в патогенезе заболевания у представителей различных этнических групп. Это позволило провести сравнительный анализ частот генотипов между русскими г. Томска и другими изученными популяциями мира. Найдены статистически значимые отличия русских от других этносов по частотам аллелей генов NRAMP1, VDR, IL12B (табл. 8).
Частота аллеля 469+14G NRAMP1 у жителей г. Томска оказалась статистически значимо ниже, чем у африканцев из Гамбии, но выше, чем у китайцев [Bellamy R. et al., 1998; Liu W. et al., 2004]. Самым широко исследованным полиморфизмом гена NRAMP1 оказался D543N. Во все изученных популяциях этот генный маркер был низко полиморфным. Русские отличались по частоте аллелей D543N от коренных жителей Башкирии, у которых аллель 543N вообще не обнаружен [Имангулова М.М. и др., 2004]. При сравнении с другими исследованными популяциями (китайцы, корейцы, японцы, татары, гамбийцы) статистически значимых отличий для этого полиморфного варианта не показано (рис. 2, табл. 8) [Имангулова М.М. и др., 2004; Bellamy R. et al., 1998; Ryu S. et al., 2000; Gao P. S. et al., 2000; Liu W. et al., 2004].
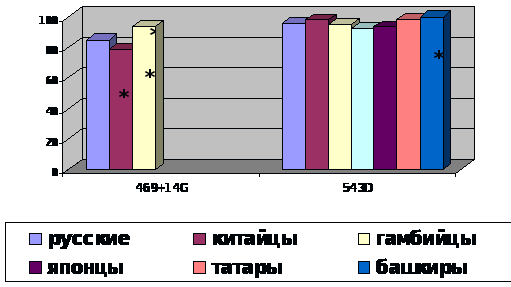 Рис.
2. Частоты аллелей гена NRAMP1
у русских г. Томска и в других популяциях
мира (по данным литературы). * – р < 0,05
Рис.
2. Частоты аллелей гена NRAMP1
у русских г. Томска и в других популяциях
мира (по данным литературы). * – р < 0,05
Таблица 8 Частоты аллелей генов-кандидатов туберкулеза в различных популяциях мира в сравнении с русскими г. Томска
|
NRAMP1 / 469+14 G/C |
||||||
|
Популяции |
Китайцы |
Гамбийцы |
||||
|
Частота ал. χ2 (p) |
G=0,785 3,83 (0,050) |
G=0,934 18,65 (0,000) |
||||
NRAMP1 / D543N |
||||||
|
Популяции |
Китайцы |
Корейцы |
Японцы |
Гамбийцы |
Татары |
Башкиры |
|
Частота аллеля χ2 (p) |
D=0,981 1,84 (0,175) |
D=0,925 2,38 (0,123) |
D=0,933 1,30 (0,254) |
D=0,948 0,16 (0,690) |
D=0,983 0,94 (0,333) |
D=1,00 5,57 (0,018) |
VDR / F/f |
||||||
|
Популяции |
Китайцы |
Индийцы (Лондон) |
||||
|
Частота аллеля χ2 (p) |
F=0,604 0,01 (0,935) |
F=0,806 20,28 (0,000) |
||||
|
IL1B / +3953A1/A2 |
||||||
|
Популяции |
Индийцы (Лондон) |
|||||
|
Частота аллеля χ2 (p) |
A1=0,794 0,05 (0,825) |
|||||
|
IL1RN / VNTR |
||||||
|
Популяции |
Индийцы (Лондон) |
|||||
|
Частота аллеля χ2 (p) |
A1=0,719 A2=0,241 A3=0,039 A4=0 7,15 (0,067) |
|||||
|
IL12B / 1188A/C |
||||||
|
Популяции |
Англичане |
Камерунцы |
Греки |
Ирландцы |
||
|
Частота аллеля χ2 (p) |
А=0,835 0,06 (0,812) |
А=0,625 18,37 (0,000) |
А=0,7890,98 (0,323) |
А=0,802 0,23 (0,629) |
Примечание. χ2 – критерий использован для сравнения частот аллелей; р – достигнутый уровень значимости
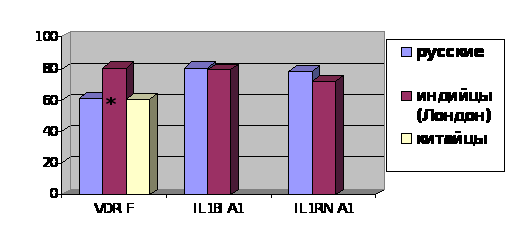
Рис. 3. Частоты аллелей полиморфизма F/f гена VDR, +3953A1/A2 гена IL1B, VNTR гена IL1RN у русских г. Томска и в других популяциях (по данным литературы). * – р < 0,05
Не показано различий при сравнении частот аллелей полиморфизма F/f гена VDR у русских г. Томска и китайцев [Liu W. et al., 2004]. Однако при сравнении с индийцами Лондона найдены статистически значимые отличия [Wilkinson R.J. et al., 2000]. В исследованной выборке русских аллель F гена VDR встречался реже (рис. 3, табл. 8).
Для полиморфных вариантов +3953А1/А2 гена IL1B и VNTR гена IL1RN не выявлено отличий частот аллелей у русских и индийцев Лондона. Аллель 1188А гена IL12B у жителей г. Томска встречался чаще, чем у камерунцев (χ2 =18,37 р=0,000). Не выявлено различий в распространенности этого маркера при сравнении с англичанами, ирландцами и греками (рис. 4, табл. 8) [Hall M.A. et al., 2000].
Установленные различия частот аллелей сравниваемых генов между русским населением г. Томска и другими популяциями мира свидетельствуют об этнической специфичности генов-кандидатов подверженности к туберкулезу. Возможно, это является одной из причин дифференциальной распространенности ТБ в этнических группах. Интересными представляются выявленные отличия по частотам аллелей для всех анализируемых маркеров у русских г. Томска при сравнении с жителями Тувы. Кроме того, известно, что по частотом аллелей рассматриваемых генов тувинцы значительно отличались не только от русских, но и от представителей иных популяционных групп [Рудко А.А. и др., 2003]. Вероятно, этот факт обусловлен длительной изоляцией тувинцев от других этносов, что привело к формированию уникального генофонда [Пузырев В.П. и др., 1999].

Рис. 4. Частоты аллелей полиморфизма 1188А/С гена IL12B у русских г. Томска и в других популяциях мира (по данным литературы). * – р < 0,05
Известно, что между неаллельными генами, расположенными близко на хромосоме, может возникнуть неравновесие по сцеплению в силу того, что в процессе мейоза кроссинговер между ними происходит реже, чем между далеко расположенными локусами. К тому же, под воздействием факторов популяционной динамики (естественного отбора) "сцепленными" могут оказаться гены, локализованные на разных хромосомах [Животовский Л.А., 1984]. Поэтому был проведен анализ гаметического неравновесия между исследованными полиморфными вариантами.
Известно, что гены NRAMP1, IL1B и IL1RN расположены на длинном плече второй хромосомы, ген VDR – на двенадцатой, а ген IL12B – на пятой хромосоме. У русских г. Томска установлено, что в неравновесии по сцеплению находятся четыре пары полиморфизмов гена NRAMP1: 469+14G/C и 274C/T, 469+14G/C и 1465-85G/A, 274C/T и 1465-85G/A, D543N и 1465-85G/A (табл. 9). Во всех случаях неравновесия в фазе притяжения были часто встречающиеся аллели.
Полиморфизм 274С/Т расположен в третьем экзоне гена, а 469+14G/C – в четвертом интроне. Такая локализация их в гене легко обьясняет наблюдаемое между ними сцепление (+0,104). Полиморфизм 1465-85G/A и D543N находятся в 13 интроне и 15 экзоне соответственно, что обусловливает неравновесие по сцеплению между ними (+0,017). Сила сцепления между полиморфизмом 1465-85G/A и вариантами 469+14G/C, 274C/T была примерно на одном уровне и составила +0,078 и +0,085, соответственно. Интересным представляется тот факт, что пары полиморфизмов гена NRAMP1, оказавшихся в неравновесии по сцеплению, были идентичны у тувинцев и русских [Рудко А.А., 2004]. Кроме того, у жителей г. Томска, в фазе притяжения оказались аллели гена VDR: b и F, сила сцепления между ними составила +0,053.
Аллельный вариант F/f гена VDR у русских оказался в фазе отталкивания с полиморфизмами 469+14G/C, 274C/T, 1465-85G/A гена NRAMP1, мера неравновесия для них была –0,040, -0,039, -0,058, соответственно. Во всех случаях в фазе отталкивания оказались часто встречаемые аллели.
Таблица 9 Неравновесие по сцеплению между парами исследованных полиморфных вариантов генов у русских г. Томска
|
Ген |
NRAMP1 |
IL12B |
VDR |
IL1B |
IL1RN |
|||||
|
Ген |
Полимор-физм |
469+14G/C |
274C/T |
1465-85 G/A |
D543N |
1188 A/C |
F/f |
B/b |
+3953 A1/A2 |
VNTR |
|
NRAMP1 |
469+14 G/C |
- |
+0,104 |
+0,078 |
+0,078 |
-0,009 |
-0,040 |
-0,012 |
-0,030 |
+0,002 |
|
274C/T |
70,39 |
- |
+0,085 |
+0,002 |
-0,019 |
-0,039 |
-0,003 |
-0,026 |
+0,003 |
|
|
1465-85 G/A |
29,94 |
29,79 |
- |
+0,017 |
-0,041 |
-0,058 |
-0,027 |
-0,014 |
+0,016 |
|
|
D543N |
1,54 |
0,085 |
4,69 |
- |
+0,001 |
-0,010 |
-0,005 |
-0,001 |
+0,013 |
|
|
IL12B |
1188A/C |
0,505 |
1,88 |
7,08 |
0,029 |
- |
+0,011 |
+0,016 |
+0,018 |
-0,000 |
|
VDR |
F/f |
6,12 |
4,92 |
7,68 |
1,05 |
0,361 |
- |
+0,053 |
-0,012 |
+0,008 |
|
B/b |
0,465 |
0,03 |
1,47 |
0,221 |
0,730 |
4,65 |
- |
+0,006 |
-0,010 |
|
|
IL1B |
+3953 A1/A2 |
5,88 |
3,63 |
0,747 |
0,017 |
1,85 |
0,371 |
0,104 |
- |
-0,023 |
|
IL1RN |
VNTR |
0,024 |
0,042 |
0,890 |
3,08 |
0,001 |
0,162 |
0,217 |
2,65 |
- |
Примечание. Над центральной диагональю указаны значения меры неравновесия по сцеплению (D), под диагональю – соответствующее значение χ2 для теста на неравновесие по сцеплению. Выделены величины, для которых достигнутый уровень значимости составил 5% и менее
Т
64
акже в фазе отталкивания находились аллели 1465-85G гена NRAMP1 и 1188А гена IL12B, 469+14G гена NRAMP1 и +3953А1 гена IL1B, мера сцепления для них была –0,041 и –0,030.Естественный отбор в теории популяционной генетики является важнейшим фактором эволюции, вызывающим адаптивные изменения в генетической структуре популяций. В случае формирования гаметического неравновесия между маркерами под воздействием естественного отбора, определенные комбинации аллелей разных локусов дают селективные преимущества их носителям и, следовательно, сохраняются при отборе и накапливаются в популяции [Алтухов Ю.П., 2003].
3.2 Анализ связи полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN с туберкулезом
Туберкулез – инфекционное заболевание, обладающее клиническим полиморфизмом. Специфическая гранулема – субстрат болезни – может развиться в любом органе или ткани [Cтруков А.И., Кауфман О.Я., 1989; Ерохин В.В., Земскова З.С., 2003]. Современная классификация туберкулеза, в основу которой положено два признака: локализация процесса и клинико – рентгенологические особенности форм, насчитывает 23 основных клинических формы туберкулеза [Хоменко А.Г., 1996]. Такое разнообразие проявлений одного заболевания определяют множество факторов. Несомненно, в этом случае играют немаловажную роль свойства самой микобактерии туберкулеза, такие как вирулентность, резистентность к противотуберкулезным препаратам, а также массивность инфекции. От состояния естественных защитных сил организма (барьерная функция слизистой оболочки дыхательных путей и желудочно-кишечного тракта) также будет зависеть исход встречи человека и микобактерии туберкулеза.
Результаты современных генетических исследований не оставили сомнений в существовании наследственной предрасположенности к туберкулезу [Хоменко А.Г., 1996; Чуканова В.П., 2001; Hill A.V.S., 1999]. Они показали, что одной из причин, определяющих такое разнообразие клинических проявлений, является полиморфизм генов, чьи продукты экспрессии вовлечены в патогенез заболевания. В то же время, пока не ясно, какие именно варианты генов имеют решающее значение. В связи с этим важно изучить вклад конкретных сочетаний аллелей в развитие болезни.
В исследованной выборке 304 больных туберкулезом русских жителей г. Томска и Томской области проанализировано распределение генотипов и частот аллелей полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN (табл. 10). Выявлено отклонение наблюдаемого распределения генотипов полиморфизма B/b гена VDR от ожидаемого при РХВ (χ2=6,95; р=0,008) за счет повышенной гетерозиготности (табл. 10). Учитывая неслучайный характер отбора индивидов в выборке, можно предположить наличие вероятного вклада гена VDR в патогенез туберкулеза. Для исследованных полиморфизмов генов NRAMP1, IL12B, IL1B, IL1RN в общей группе больных туберкулезом отклонение от РХВ не показано.
Известно, что у жителей Тувы больных туберкулезом выявлено отклонение от РХВ для полиморфизмов 1465-85G/A и D543N гена NRAMP1 за счет пониженного количества гетерозигот в обоих случаях и для полиморфизмов B/b и F/f гена VDR за счет повышенной гетерозиготности [Рудко А.А., 2004]. Таким образом, как для русских, так и для тувинцев, больных туберкулезом, характерно повышенное количество гетерозигот B/b гена VDR. Сравнение частот аллелей и генотипов у русских и тувинцев, больных туберкулезом, показало статистически значимые отличия для всех исследованных полиморфных маркеров (табл. 11). Максимальная степень отличий частот аллелей и генотипов показана для полиморфизма B/b гена VDR.
Таблица 10 Частоты аллелей и генотипов исследованных полиморфизмов у больных туберкулезом
|
Ген |
Поли-морфизм |
Гено-типы |
N.O. |
N.E. |
Частота аллеля |
χ2 (d.f.) |
H>obs> |
H>exp> |
D |
|
NRAMP1 |
469+14 G/C |
GG GC CC |
179 94 6 |
183,07 85,86 10,07 |
G= 0,810 |
2,25 (1) |
0,337 |
0,308 |
+0,095 |
|
D543N |
DD DN NN |
263 14 1 |
262,23 15,54 0,23 |
D= 0,971 |
1,28 (1) |
0,050 |
0,056 |
-0,099 |
|
|
1465-85 G/A |
GG GA AA |
126 126 27 |
128,03 121,94 29,03 |
G= 0,677 |
0,25 (1) |
0,452 |
0,437 |
+0,033 |
|
|
274C/T |
CC CT TT |
163 122 14 |
167,82 112,37 18,81 |
C= 0,749 |
2,01 (1) |
0,408 |
0,376 |
+0,086 |
|
IL12B |
1188 A/C |
AA AC CC |
162 100 17 |
161,09 101,82 16,09 |
A= 0,760 |
0,05 (1) |
0,358 |
0,365 |
-0,018 |
VDR |
B/b |
BB Bb bb |
49 168 76 |
60,37 145,26 87,37 |
b= 0,546 |
6,95* (1) |
0,573 |
0,496 |
+0,157 |
|
F/f |
FF Ff ff |
124 134 40 |
122,42 137,16 38,42 |
F= 0,641 |
0,12 (1) |
0,450 |
0,460 |
-0,023 |
|
IL1B |
+3953 A1/A2 |
A1A1 A1A2 A2A2 |
169 108 24 |
165,21 115,57 20,22 |
A1 0,741 |
1,16 (1) |
0,359 |
0,384 |
-0,066 |
IL1RN |
VNTR |
A1A1 A1A2 A1A3 A1A4 A2A2 A2A3 другие |
158 100 10 1 25 4 1 |
152,43 110,16 11,53 0,43 19,90 4,17 0,38 |
A1= 0,714 A2= 0,258 A3= 0,027 |
6,35 (6) |
0,385 |
0,422 |
-0,088 |
Примечание. Обозначения см. табл. 6
Таблица 11 Сравнение частот аллелей и генотипов у русских и тувинцев с ТБ
|
Полимор-физм |
Гено-типы |
Частоты (%) |
p |
Ал-лели |
Частоты |
p |
||
|
русские |
тувинцы |
русские |
тувинцы |
|||||
|
NRAMP1 |
||||||||
|
469+14 G/C |
GG GC CC |
179 (64,2) 94 (33,7) 6 (2,1) |
198 (85) 32 (13,7) 3 (1,3) |
0,000 |
G |
0,810 |
0,918 |
0,000 |
|
D543N |
DD DN NN |
263 (94,6) 14 (5) 1 (0,4) |
191 (80,9) 39 (16,5) 6 (2,6) |
0,000 |
D |
0,971 |
0,892 |
0,000 |
|
1465-85G/A |
GG GA AA |
126 (45,2) 126 (45,2) 27 (9,6) |
153 (65,7) 63 (27) 17 (7,3) |
0,000 |
G |
0,677 |
0,794 |
0,000 |
|
274C/T |
CC CT TT |
163 (54,5) 122 (40,8) 14 (4,7) |
190 (80,5) 45 (19,1) 1 (0,4) |
0,000 |
C |
0,749 |
0,900 |
0,000 |
|
IL12B |
||||||||
|
1188 A/C |
AA AC CC |
162 (58) 100 (35,8) 17 (6,2) |
90 (38,6) 102 (43,8) 41 (17,6) |
0,000 |
A |
0,760 |
0,605 |
0,000 |
|
VDR |
||||||||
|
B/b |
BB Bb bb |
49 (16,7) 168 (57,3) 76 (26) |
3 (1,3) 82 (35) 149 (63,7) |
0,000 |
b |
0,546 |
0,812 |
0,000 |
|
F/f |
FF Ff ff |
124 (41,6) 134 (45) 40 (13,4) |
125 (53,6) 102 (43,8) 6 (2,6) |
0,000 |
F |
0,641 |
0,755 |
0,000 |
|
IL1B |
||||||||
|
+3953 A1/A2 |
A1A1 A1A2 A2A2 |
169 (56,1) 108 (35,9) 24 (8) |
185 (79,1) 47 (20) 2 (0,9) |
0,000 |
A1 |
0,741 |
0,891 |
0,000 |
Примечание. р – достигнутый уровень значимости при сравнении частот аллелей и генотипов
У русских с ТБ и здоровых по сравнению с жителями Тувы чаще наблюдали гомозиготный по аллелею В и гетерозиготный генотипы. Среди жителей г. Томска, больных туберкулезом, по сравнению с тувинцами статистически значимо чаще встретились аллели 469+14C, 1465-85A, 274T гена NRAMP1, f гена VDR, и +3953А2 гена IL1В, реже регистрировались аллели 543N гена NRAMP1 и 1188С гена IL12B. В целом можно отметить, что отличия в распределении генотипов и аллелей между русскими и тувинцами были идентичными у больных и здоровых: у русских с туберкулезом преобладали те же аллели генов, что и у здоровых.
При сравнении распределений генотипов и частот аллелей в выборках больных и здоровых лиц, живущих в г. Томске и Томской области, выявлены статистически значимые отличия для полиморфизма 274С/Т гена NRAMP1 и трех генов, принимающих участие в продукции интерлейкинов (табл. 12). Так, у больных туберкулезом статистически значимо чаще регистрировался гетерозиготный генотип 274С/Т гена NRAMP1 (OR=1,66, 95%CI:1,02–2,71; p=0,040). Лица, обладающие гомозиготным генотипом 274С/C чаще встречались среди здоровых (OR=0,54, 95%CI:0,33–0,87; р=0,010). Показаны отличия частот аллелей у больных и здоровых для полиморфизма +3953 А1/А2 гена IL1B (p=0,036) за счет повышения доли аллеля А2 у больных туберкулезом. В тоже время, не найдено отличий при сравнении распределения генотипов этого полиморфизма гена IL1В (табл. 12).
Различия по VNTR полиморфизму гена IL1RN в выборках больных и здоровых касались как частот аллелей, так и частот генотипов. Аллель А2 статистически значимо чаще встречался у пациентов с туберкулезом. При сравнении частот генотипов выявлено более высокое количество гетерозигот А1/А2 у больных туберкулезом по сравнению с контролем (OR=2,10, 95%CI:1,26–3,51, р=0,003) (табл. 12). В противоположность этому у африканцев гетерозиготы по аллелю А2 IL1RN статистически значимо реже встречались у больных туберкулезом, чем в контрольной группе [Bellamy R., Ruwende C., 1998].
Найдена ассоциация полиморфизма 1188А/С гена IL12В с туберкулезом. Установлено, что распределение генотипов и частота аллелей в группах больных и здоровых различаются. В выборке больных статистически значимо чаще встречаются гомозиготы по аллелю 1188С (р=0,035). В данном случае вероятность заболеть туберкулезом обладателей гомозиготного генотипа 1188С/С значимо выше, чем у индивидов с гомозиготным генотипом 1188А/А и гетерозиготным (OR=8,31, 95%CI:1,15–169,30, р=0,030) (табл. 12). Несмотря на отклонение распределения генотипов от ожидаемого при РХВ полиморфизма B/b гена VDR у больных туберкулезом, не показано отличий между больными и здоровыми.
Диагноз туберкулеза устанавливается на основании наличия у больного характерных жалоб, эпидемиологического анамнеза, анамнеза заболевания, клинических симптомов, характерных изменений в общем анализе крови и рентгенологической картины. Однако только при обнаружении микобактерий туберкулеза (МБТ) в мокроте диагноз туберкулеза можно считать верифицированным [Рабухин А.Е.,1976].
Учитывая это, при дальнейшем анализе из общей группы больных была выделена выборка пациентов с бактериовыделением (МБТ+) (n=234). При сравнении распределения генотипов и частот аллелей в группах больных лабораторно подтвержденным туберкулезом и контрольной, найдены статистически значимые отличия для полиморфизма 274С/Т гена NRAMP1, аллельного варианта +3953 А1/А2 гена IL1B, VNTR полиморфизма гена IL1RN и полиморфизма 1188А/С IL12В (табл. 13). Частота аллеля 274Т гена NRAMP1 была выше в группе больных (р=0,009). Показана протективная роль генотипа 274С/С (OR=0,53, 95%CI: 0,32– 0,88, р=0,012).
Таблица 12 Статистические показатели для сравнения частот аллелей и генотипов у больных туберкулезом и здоровых
|
Ген |
Полимор-физм |
Гено-типы |
Сравнение |
OR (95%CI) |
|
|
Генотипов р |
Аллелей р |
||||
|
NRAMP1 |
469+14 G/C |
GG GC CC |
0,393 |
0,229 |
0,74 (0,46–1,18) 1,32 (0,83–2,13) 1,48 (0,27–10,77) |
|
D543N |
DD DN |
0,283 |
0,377 |
1,66 (0,70–3,88) 0,56 (0,24–1,34) |
|
|
1465-85 G/A |
GG GA AA |
0,134 |
0,312 |
0,70 (0,45–1,08) 1,54 (0,99–2,41) 0,86 (0,42–1,76) |
|
|
274C/T |
CC CT TT |
0,009 |
0,020 |
0,54* (0,33–0,87) 1,66* (1,02–2,71) 2,80 (0,59–18,13) |
|
|
IL12B |
1188 A/C |
AA AC CC |
0,035 |
0,044 |
0,72 (0,45–1,13) 1,12 (0,70–1,78) 8,31* (1,15–169,30) |
|
VDR |
B/b |
BB Bb bb |
0,925 |
0,791 |
0,94 (0,51–1,76) 0,96 (0,60–1,54) 1,10 (0,64–1,91) |
|
F/f |
FF Ff ff |
0,705 |
0,469 |
1,20 (0,75–1,93) 0,89 (0,57–1,41) 0,88 (0,46–1,69) |
|
|
IL1B |
+3953 A1/A2 |
A1A1 A1A2 A2A2 |
0,108 |
0,036 |
0,70 (0,45–1,08) 1,21 (0,77–1,90) 2,32 (0,82–7,10) |
|
IL1RN |
VNTR |
A1A1 A1A2 A2A2 |
0,030 |
0,023 |
0,57* (0,36–0,88) 2,10* (1,26–3,51) 0,97 (0,45–2,13) |
Примечание. р - достигнутый уровень значимости; OR – величина отношения шансов; (95%CI) - доверительный интервал для OR; * - р < 0,05
Таблица 13 Статистические показатели для сравнения частот аллелей и генотипов у больных лабораторно подтвержденным туберкулезом и здоровых
|
Полимор-физм |
Гено-тип |
N |
р |
OR (95% СI) |
Частота аллеля |
р |
|
NRAMP1 |
||||||
|
274С/Т |
CC CT TT |
126 94 12 |
0,021 |
0,53* (0,32–0,88) 1,64* (0,99–2,73) 3,11 (0,64–20,47) |
C=0,746 |
0,009 |
|
IL12B |
||||||
|
1188 А/С |
AA AC CC |
125 82 12 |
0,044 |
0,69 (0,43–1,11) 1,20 (0,74–1,94) 7,42* (0,99–154,58) |
A=0,758 |
0,046 |
|
IL1B |
||||||
|
+3953 А1/А2 |
A1A1 A1A2 A2A2 |
131 82 21 |
0,080 |
0,69 (0,44–1,09) 1,16 (0,73–1,87) 2,64 (0,91–8,21) |
A1=0,735 |
0,036 |
|
IL1RN |
||||||
|
VNTR |
A1A1 A1A2 A2A2 другие |
121 79 21 11 |
0,042 |
0,55* (0,35–0,87) 2,16* (1,28–3,68) 1,06 (0,48–2,38) - |
А1=0,707 A2=0,267 A3=0,024 A4=0,002 |
0,029 |
Примечание. р - достигнутый уровень значимости; OR – величина отношения шансов; (95%CI) - доверительный интервал для OR; N – количество индивидов с определенным генотипом; *- p < 0,05
Рисковыми для туберкулеза оказались генотипы 274С/Т и 274Т/Т гена NRAMP1. Не найдено отличий в распределении частот генотипов +3953 А1/А2 полиморфизма гена IL1B, в то время как аллель А2 статистически значимо чаще встречался в группе больных лабораторно подтвержденным туберкулезом, чем в группе здоровых индивидов (р=0,036) (табл. 13). Ассоциация VNTR полиморфизма гена IL1RN, а имменно связь А2 аллеля с туберкулезом, прослеживается как в общей выборке больных, так и в группе пациентов с наличием МБТ в мокроте. При анализе результатов подсчета отношения шансов показана более высокая подверженность туберкулезу индивидов с генотипом А1/А2 (OR=2,16, 95%CI:1,28–3,68, p=0,003). Протективным эффектом обладал полиморфизм А1А1 гена IL1RN (OR=0,55).
Для полиморфизма 1188А/С гена IL12B выявлены различия между больными туберкулезом МБТ+ и здоровыми по частотам аллелей (р=0,046) и генотипов (р=0,044). У больных туберкулезом чаще, чем в контрольной группе регистрировался гомозиготный генотип 1188С/С, риск развития туберкулезного процесса у этих индивидов был в семь раз выше, чем у обладателей других генотипов этого полиморфизма.
Различают первичный туберкулез, который развивается в ранее не инфицированном МБТ организме, а также вторичный генез туберкулеза, когда заболевание возникает при повторном инфицировании. Микобактерии туберкулеза проникают в организм различными путями. При небольшом их количестве, слабой вирулентности и при достаточной устойчивости организма они могут не вызвать специфических изменений на месте внедрения, а также и при лимфо–гематогенном рассеивании. Возникает состояние латентного микробизма [Земскова З.С., Дорожкова И.Р., 1984]. В дальнейшем может развиться инфицирование МБТ, когда возбудитель находится в макроорганизме, но человек не заболевает туберкулезом. При других условиях в результате первичного заражения образуются туберкулезные очаги в том или ином органе (первичный туберкулез).
Если же на фоне инфицирования в организм дополнительно попадет новая порция вирулентных микобактерий, может развиться заболевание, которое будет иметь вторичный генез (вторичный туберкулез). Наличие факторов, приводящих к снижению общей и местной резистентности организма, таких как курение, сахарный диабет, кортикостероидная терапия, лечение цитостатиками, ВИЧ-инфицирование и другие, увеличит вероятность этого события. Также вторичный туберкулез может возникнуть в результате обострения перенесенного в прошлом первичного процесса.
Патогенетические механизмы первичных и вторичных форм туберкулеза разнятся. Поэтому различаются и клинические формы, характерные для этих двух групп. Если для первичного туберкулеза свойственно поражение лимфатических узлов средостения или мезентериальных и, как осложнение, легочной ткани (исключение составляет первичный туберкулезный комплекс, при котором первичный аффект формируется в легком), то при вторичном генезе туберкулеза, как правило, поражается легочная ткань.
В связи с этим фактом можно предположить, что резистентность макроорганизма к первичному и вторичному туберкулезу обусловлена разными факторами иммунитета, а значит, варианты генов, приводящие к предрасположенности к разным по генезу формам туберкулеза, также будут различаться. В ходе дальнейшего анализа больные туберкулезом были поделены на две группы в зависимости от того, на каком этапе симбиоза человека и микобактерии произошло заболевание. В выборку больных с первичным туберкулезом были отнесены пациенты, у которых выставили диагнозы: туберкулез внутригрудных лимфоузлов (n=36), первичный туберкулезный комплекс (n=3), гематогенно-диссеминированный туберкулез легких первичного периода (n=2), плеврит туберкулезной этиологии первичного периода (n=2). Сравнение частот аллелей и распределений генотипов в выборках больных первичным туберкулезом и контрольной показало наличие ассоциации с заболеванием полиморфизма 1465-85G/A гена NRAMP1: найдены статистически значимые различия частот аллелей (р=0,047) и генотипов (р=0,004) этого полиморфизма в группах больных и здоровых. У заболевших первичным туберкулезом чаще, чем в контрольной группе, встречался гетерозиготный генотип 1465-85G/A, риск заболевания у этих индивидов был три раза выше, чем у обладателей других генотипов этого полиморфизма (OR=3,16, 95%CI:1,47–6,86; р=0,002) (табл. 14). Показано, что генотип 1465-85G/G чаще регистрировался у здоровых индивидов (OR=0,33, 95%CI:0,15–0,73; р=0,005), таким образом, установлена его протективная роль в отношении первичного туберкулеза.
Таблица 14 Cтатистические показатели для сравнения частот аллелей и генотипов полиморфизма 1465-85 G/A гена NRAMP1 у больных туберкулезом первичного периода и здоровых
|
Полиморфизм |
Гено-тип |
N |
р |
OR (95%CI) |
Частота аллеля |
р |
|
1465-85 G/A |
GG GA AA |
12 27 4 |
0,004 |
0,33* (0,15–0,73) 3,16* (1,47–6,86) 0,82 (0,22–2,86) |
G=0,593 |
0,047 |
Примечание. Обозначения см. табл. 13
Известно, что продукт гена Nramp1 у мышей участвует в процессе фагоцитоза, влияя на судьбу МБТ в макроорганизме. Кроме того, на мышах показано, что именно ранняя фаза инфекции с микобактериями туберкулеза штамма BCG находится под контролем гена Nramp1 [Scamene E. et al., 1980]. По всей видимости, дефект продукции или функции человеческого гомолога Nramp1 при первой встрече человека с микобактерией может способствовать возникновению заболевания. Тогда, как в организме инфицированного ранее индивида срабатывают механизмы иммунологической защиты, и мутации в гене, а следовательно и дефекты белка NRAMP1 не оказывают подобного влияния.
Ранее показано, что полиморфизм 1465-85G/A гена NRAMP1 оказывает предрасполагающую роль к инфильтративному туберкулезу у тувинцев [Рудко А.А., 2004]. Частота гомозигот А/А этого полиморфизма была практически в два раза выше у больных ТБ, чем у здоровых. Учитывая результаты исследования генетических основ подверженности к туберкулезу русских и тувинцев, можно отметить, что ген NRAMP1 оказывает влияние на предрасположенность к заболеванию, проявляя этническую специфичность.
Выборку больных с вторичным происхождением туберкулеза составили пациенты с установленным диагнозом инфильтративного туберкулеза легких (150 человек), диссеминированного туберкулеза легких (65 человек), очагового туберкулеза (27 человек), казеозной пневмонии (5 человек), впервые выявленного фиброзно–кавернозного туберкулеза легких (4 человека), туберкуломы (4 человека), туберкулеза почечной паренхимы (3 человека), туберкулеза бронха (2 человека), плеврита туберкулезной этиологии (1 человек). Всем больным диагноз туберкулеза был установлен впервые.
При сравнении частот аллелей и распределений генотипов ассоциацию с вторичным туберкулезом продемонстрировали полиморфизм 274С/Т гена NRAMP1, полиморфный маркер гена IL1В, VNTR полиморфизм гена IL1RN, а также ген IL12B (табл. 15). Аллель 274Т гена NRAMP1 чаще встречался в группе больных (р=0,005), причем у лиц гетерозиготных по этому полиморфизму риск заболеть туберкулезом возрастал в 1,75 раза (95%СI:1,06–2,88; p=0,026), а у гомозигот 274Т/Т шанс заболеть был в пять раз выше, чем у обладателей других генотипов этого полиморфизма (95%CI:1,07–33,72; p=0,037).
Показано, что генотип 274С/С статистически значимо чаще встречался у здоровых лиц (OR=0,51, 95%CI:0,31–0,82; p=0,005). В целом, сравнивая результаты, полученные при исследовании частот аллелей и генотипов у больных первичным и вторичным туберкулезом, можно отметить, что разные полиморфизмы гена NRAMP1 оказывают неравнозначное влияние на предрасположенность к туберкулезу у русских г. Томска.
Таблица 15 Статистические показатели для сравнения частот аллелей и генотипов у больных вторичным туберкулезом легких и здоровых
|
Полимор-физм |
Гено-тип |
N |
р |
OR (95% СI) |
Частота аллеля |
р |
|
NRAMP1 |
||||||
|
274С/Т |
CC CT TT |
136 108 13 |
0,010 |
0,51* (0,31–0,82) 1,75* (1,06–2,88) 5,01* (1,07–33,72) |
C=0,739 |
0,005 |
|
IL1B |
||||||
|
+3953 А1/А2 |
A1A1 A1A2 A2A2 |
146 92 21 |
0,103 |
0,70 (0,45–1,10) 1,19 (0,75–1,89) 2,36 (0,82–7,34) |
A1=0,741 |
0,041 |
|
IL1RN |
||||||
|
VNTR |
A1A1 A1A2 A2A2 другие |
134 89 23 12 |
0,025 |
0,55* (0,35–0,86) 2,20* (1,31–3,72) 1,04 (0,48–2,31) - |
А1=0,705 A2=0,269 A3=0,023 A4=0,003 |
0,019 |
Примечание. р - достигнутый уровень значимости; OR – величина отношения шансов; (95%CI) - доверительный интервал для OR; N – количество индивидов с определенным генотипом; *- p < 0,05
Показано, что полиморфизм 1465-85 G/A гена NRAMP1 проявил связь с первичным туберкулезом. Учитывая, что при аналогичном сравнении частот генотипов и аллелей в выборках больных вторичными формами туберкулеза и здоровых, различий не было найдено, полученные данные позволяют предположить наличие влияния этого полиморфизма на более раннее возникновение заболевания. Полиморфный вариант 274С/Т оказался ассоциированным с вторичным генезом заболевания. Для маркеров D543N и 469+14G/C гена NRAMP1 не показано предрасполагающего влияния на ТБ у русских жителей г. Томска.
Известно, что IL–1β является провоспалительным цитокином, а значит, его варианты могут приводить к ослаблению защитной реакции организма и, как следствие, способствовать заболеванию при наличии возбудителя в организме. Выявлены различия частот аллелей при сравнении группы контроля и больных вторичным туберкулезом, при которых заболевание ассоциированно с аллелем А2 IL1В (χ2=4,17, р=0,041). Продукт гена IL1RN является рецепторным антагонистом IL–1β, выполняя функцию специфического блокатора биологического действия IL–1β. Показано, что аллель А2 приводит к увеличению продукции белка IL–1RN [Wilkinson R. J. et al., 1999].
Выявлено статистически значимое увеличение частоты аллеля А2 VNTR полиморфизма гена IL1RN у больных по сравнению с контролем (χ2=9,92, р=0,019). Распределение генотипов этого полиморфизма также различалось в группах лиц с вторичным туберкулезом и здоровых (χ2=14,49, р=0,025): у больных чаще регистрировался гетерозиготный генотип А1/А2, риск развития заболевания у них был выше более чем в 2 раза, по сравнению с лицами с другими генотипами этого полиморфизма (95%CI: 1,31–3,72, р=0,002). Протективная роль в развитии вторичного туберкулеза показана для генотипа А1/А1, так как он статистически значимо чаще встречен у здоровых (OR=0,55, 95%CI: 0,35–0,86, р=0,007).
В целом, сравнение общей группы больных туберкулезом, выборки пациентов–бактериовыделителей, больных вторичным ТБ с контрольной выборкой показало аналогичные результаты, то есть связь полиморфизмов 274С/Т гена NRAMP1, +3953 А1/А2 гена IL1B и VNTR гена IL1RN с заболеванием. Общую выборку больных на 86% составили пациенты с вторичным туберкулезом. При первичном туберкулезе, как правило, не встречается выделение МБТ с мокротой [Рабухин А.Е., 1976]. В исследовании жителей г. Томска только один больной с первичным туберкулезным комплексом был бактериовыделителем. Так, выборка больных туберкулезом МБТ+ практически на 100% состояла из пациентов с туберкулезом вторичного периода. Таким образом, полиморфизм 274С/Т гена NRAMP1, +3953 А1/А2 полиморфизм гена IL1B и VNTR полиморфизм IL1RN проявили ассоциацию с вторичным туберкулезом. Тем более, что ассоциации, найденные при сравнении первичного туберкулеза с контролем, затрагивали иные гены.
Найдена связь полиморфизма 1188А/С гена IL12B как с первичным, так и с вторичным туберкулезом, причем генотип 1188С/С чаще встречался у больных, чем у здоровых (табл. 16). Это наблюдение вполне объяснимо, поскольку известно, что IL-12 участвует в активации макрофагов посредством Т-хелперов, вырабатывающих INF-γ, а активизированные макрофаги, в свою очередь, устремляются к месту нахождения микобактерий и активно их поглощают. Вероятно, варианты гена IL12B влияют на подверженность заболеванию у неинфицированных МБТ и инфицированных ранее людей.
Кроме анализа связи генетических маркеров с заболеванием по типу случай–контроль был использован метод оценки ассоциации болезни с генетическими маркерами на семейном материале с помощью Transmission Disequilibrium Test (TDT). Метод оценивает предпочтительность переноса аллеля М1 больному потомку от М1М2 гетерозиготных родителей.
Если аллель М1 переносится существенно больше, чем в половину раз, можно заключить, что маркерный локус сцеплен с локусом предрасположенности к заболеванию, и что аллель М1 положительно ассоциирован с аллелем, который увеличивает восприимчивость к заболеванию, или является таковым [Spielman R.S. et. al., 1993].
Таблица 16 Статистические показатели для сравнения частот аллелей и генотипов полиморфизма 1188А/С гена IL12B у больных различным по генезу туберкулезом и здоровых
|
Выборка больных ТБ |
Генотипы 1188А/С |
Сравнение |
OR(95%CI) |
p |
||
|
генотипов |
аллелей |
|||||
|
ТБ первичного периода |
АА |
27 |
р=0,012 |
р=0,370 |
0,93(0,42–2,06) |
0,997 |
|
АС |
11 |
0,71(0,30–1,64) |
0,500 |
|||
|
СС |
4 |
13,47(1,35–326,42) |
0,013 |
|||
|
ТБ вторичного периода |
АА |
135 |
р=0,041 |
р=0,041 |
0,69(0,43–1,10) |
0,120 |
|
АС |
89 |
1,20(0,75–1,94) |
0,491 |
|||
|
СС |
13 |
7,43(1,00–153,87) |
0,023 |
Примечание. Обозначения см. табл. 12
Расчет TDT провели для всех исследованных полиморфных маркеров, за исключением D543N гена NRAMP1, для которого TDT не был рссчитан из-за низкой гетерозиготности родителей пробандов (табл. 17). Анализ показал наличие связи полиморфизма 1188А/С гена IL12B с туберкулезом. Дети, больные туберкулезом, лишь в 13% случаев наследовали от родителей аллель 1188А, тогда как аллель 1188С – в 87%.
Таблица 17 Число аллелей, унаследованных больными потомками от гетерозиготных родителей
|
Ген |
Полиморфизм |
Аллели |
Количество перенесенных аллелей |
TDT |
p (d.f.=1) |
|
NRAMP1 |
469+14G/C |
G |
10 |
1,00 |
0,317 |
|
С |
6 |
||||
|
1465-85G/A |
G |
12 |
0,15 |
0,695 |
|
|
A |
14 |
||||
|
274C/T |
C |
9 |
0,06 |
0,808 |
|
|
T |
8 |
||||
|
IL12B |
1188A/C |
A |
2 |
8,07 |
0,005 |
|
C |
13 |
||||
|
VDR |
B/b |
B |
6 |
2,00 |
0,157 |
|
b |
12 |
||||
|
F/f |
F |
11 |
0,00 |
1,000 |
|
|
f |
11 |
||||
|
IL1B |
+3953A1/A2 |
A1 |
9 |
0,05 |
0,818 |
|
A2 |
10 |
||||
|
IL1RN |
VNTR |
A1 |
9 |
0,60 |
0,439 |
|
не А1* |
6 |
Примечание. р – достигнутый уровень значимости; d.f. – число степеней свободы; * - аллели А2 и А3
Найденная связь изменчивости гена IL12B закономерна, поскольку продукт экспрессии этого гена – IL–12 является ключевым цитокином для усиления клеточно-опосредованного иммунного ответа и инициации эффективной противоинфекционной защиты. Он секретируется макрофагами в ответ на индукцию микробными компонентами и продуктами, активирует дифференцировку Т-лимфоцитов, повышает их цитотоксическую активность, усиливает пролиферацию естественных киллеров, Т-лимфоцитов и продукцию других цитокинов. Главный эффект – индукция синтеза INF-γ. Характер течения и исход многих инфекций зависят от способности возбудителя индуцировать синтез IL-12 [Тотолян А.А., Фрейдлин И.С., 2000]. Таким образом, у русских жителей г. Томска установлена ассоциация полиморфизма 1188А/С гена IL12B с заболеванием: индивиды-носители аллеля 1188С в большей степени подвержены туберкулезу, как первичному, так и вторичному. Важным обстоятельством с точки зрения достоверности является тот факт, что показанная связь маркера с заболеванием выявлена как методом случай – контороль, так и TDT на семейном материале.
3.3 Анализ накопления случаев туберкулеза в семьях больных
В практической деятельности фтизиатры выделяют такое понятие, как семейный контакт по туберкулезу. Оно подразумевает наличие тесного семейного общения родственников и неродственных индивидов с больным туберкулезом. Также выделяют смежное понятие - семейный туберкулез. О таком туберкулезе говорят, когда больны родственники пациента. При сравнении частоты встречаемости родственников, больных туберкулезом, у заболевших этой инфекцией и у здоровых индивидов, были выявлены отличия (χ2=15,67, р<0,001) (табл. 18). Показано, что вероятность заболеть туберкулезом выше у индивидов, в семьях которых имеются лица, перенесшие это заболевание (OR=3,63, 95%CI:1,84–7,31; р<0,000). У больных частота туберкулеза среди родственников первой степени родства в 3,63 раза выше по сравнению с родственниками первой степени родства здоровых индивидов.
Таблица 18 Частота заболевания туберкулезом родственников больных данным инфекционным заболеванием и здоровых индивидов
|
Выборка |
Нет тубер-кулеза в роду |
Имеют родственников с туберкулезом |
Кол-во родствен-ников 1 степени родства с туб-зом |
Кол-во родствен-ников 2 степени родства с туб-зом |
||
|
Из них 1 степени родства |
Из них 2 степени родства |
Из них 1 и 2 степени родства |
||||
|
Здоровые n=97 |
84 (86,6%) |
1 (1%) |
11 (11,4%) |
1 (1%) |
2 |
14 |
|
Больные туберкулезом n=225 |
144 (64%) |
59 (26,2%) |
12 (5,3%) |
10 (4,5%) |
93 |
25 |
Примечание. n – численность группы
Необходимо отметить, что учитывались родственники I и II степени родства, перенесшие туберкулез, но не имеющие тесного семейного контакта в период болезни с обследуемыми индивидами. Таким образом, в данном случае туберкулезный контакт, как причину накопления случаев заболевания у родственников индивидов больных ТБ, можно исключить.
К тому же исследование распространенности туберкулеза среди супругов пробандов, не состоящих в кровном родстве с больными туберкулезом, но находившихся с ними в семейном контакте, проведенное В.П. Чукановой с соавт. (1995), показало, что частота туберкулеза легких в этой группе не отличалась от частоты заболевания среди населения обследованной этнической группы. Кроме того, было установлено, что в семьях пробандов, которые болели деструктивными формами инфекции, частота туберкулеза среди родственников первой степени родства превышала в пять раз частоту заболевания среди населения при отсутствии семейного контакта [Чуканова В.П. и др., 1995]. В аналогичном исследовании, проведенном ранее, получены сходные результаты: в роду здоровых туберкулез встречался в пять раз реже, чем у больных [Березовский Б.А. и др., 1986]. Можно заметить, что в исследовании жителей г. Томска увеличение заболеваемости среди родственников больных несколько ниже. Возможно, это обусловлено социальными, демографическими, или другими причинами. Повышение частоты туберкулеза у родственников больных по сравнению со здоровыми, свидетельствует в пользу имеющегося мнения о наследственной предрасположенности к инфекционным заболеваниям, в том числе к туберкулезу.
При дальнейшем анализе выборку больных разделили на две группы: первую группу составили пациенты, родственники которых болели туберкулезом, вторую – те, среди родственников которых не было заболевших этой инфекцией. Учитывались родственники I и II степени родства. При сравнении частот аллелей у больных первой и второй группы установлено, что в выборке больных семейным туберкулезом статистически значимо чаще встречался аллель 543N гена NRAMP1 (χ2=6,08, р=0,014).
Полиморфизм D543N гена NRAMP1 является наиболее исследованным в различных популяциях мира из всех аллельных вариантов этого гена. Показана его значимость в подверженности к туберкулезу у японцев и китайцев [Gao P. S. et al., 2000; Liu W. et al., 2004]. Однако у русских г. Томска не найдено ассоциаций этого полиморфизма с заболеванием. Вероятно, полученное накопление аллеля 543N гена NRAMP1 в группе больных, чьи родственники заболели ТБ, по сравнению с больными, у которых здоровые родственники, можно объяснить неравновесием по сцеплению с другим полиморфизмом этого гена, значимым для туберкулеза.
3.4 Анализ связи полиморфизма генов NRAMP1, IL12B, VDR, IL1B, IL1RN с патогенетически важными параметрами болезни
Учитывая поставленные задачи, поиск ассициаций исследуемых полиморфизмов с патогенетически важными параметрами болезни проведен в два этапа: во-первых, анализировали качественные, патогенетически значимые признаки туберкулеза, во-вторых, проведен анализ связи генов с количественными показателями болезни.
3.4.1 Анализ ассоциаций исследованных генов с качественными признаками туберкулеза
Патоморфологические изменения в органах и тканях при туберкулезе многообразны, обусловлены биологическими закономерностями воспалительной реакции, а также особенностями возбудителя болезни, зависят от формы, стадии, локализации и распространенности патологического процесса. Туберкулез относят к хроническим гранулематозным заболеваниям, для которых характерно одинаковое построение гранулем, состоящих из эпителиоидных клеток, гигантских клеток Пирогова-Лангханса и лимфоцитов [Струков А.И., Кауфман О.Я., 1989]. В основе воспаления лежат фазы экссудации, альтерации и пролиферации, однако они не всегда четко выражены и не всегда сохраняется их последовательность. Туберкулезные бугорки могут быть экссудативными (преимущественно лимфоцитарные), продуктивными (эпителиоидно-гигантоклеточные), некротическими, что зависит от вирулентности МБТ, а также от особенностей иммунной реактивности инфицированного макроорганизма [Пузик В.И. и др., 1973; Ерохин В.В., Земскова З.С., 2003]. Степень выраженности различных фаз воспаления также зависит от характера ткани, в которой развивается патологический процесс. Так, экссудация и альтерация будут более резко выражены в рыхлых тканях, и менее – в плотных [Хоменко А.Г., 1996].
Для оценки влияния вариантов генов NRAMP1, VDR, IL1B, IL12B, IL1RN на изменчивость признаков болезни, определяемых рентгенологическими методами, проведен поиск ассоциаций генетических маркеров с наличием деструкции в легочной ткани при туберкулезе и с объемом поражения легкого. При этом пользовались определенным алгоритмом сравнения (рис. 5).
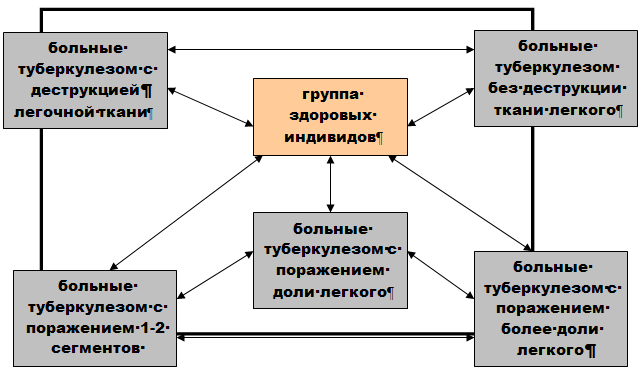
Рис. 5 Алгоритм сравнения групп больных туберкулезом и здоровых индивидов
Выборка больных вторичными формами туберкулеза легких была разделена на две группы в зависимости от наличия деструкции легочной ткани: первую составили 184 больных с экссудативно-некротическим и пролиферативно-некротическим типом воспалительной реакции (инфильтративный туберкулез в фазе распада, диссеминированный туберкулез в фазе распада, казеозная пневмония, фиброзно-кавернозный туберкулез легких); во вторую отнесены 52 больных туберкулезом с отсутствием некроза ткани легкого (диссеминированный туберкулез легких в фазе инфильтрации, инфильтративный туберкулез без распада, очаговый туберкулез, туберкулома).
При сравнении распределений генотипов и частот аллелей исследуемых полиморфизмов в этих группах выявлены статистически значимые отличия.
Так, частота аллелей и генотипов полиморфизма 469+14G/C гена NRAMP1 в выборке больных с экссудативно-некротическим и пролиферативно-некротическим типом воспалительной реакции отличалась от соответствующих значений, у больных с пролиферативным и экссудативным типом воспалительной реакции: у больных деструктивным туберкулезом легких частота аллеля 469+14C была выше (табл. 19).
Таблица 19 Частота аллелей и генотипов полиморфизма 469+14G/C гена NRAMP1 у больных туберкулезом с различным типом воспалительной реакции ткани легкого
|
Группы больных туберкулезом |
Гено-типы |
N |
Сравнение генотипов р |
Аллели |
Сравнение аллелей р |
|
Больные туберкулезом с деструкцией легочной ткани |
GG GC CC |
108 60 5 |
0,048 |
G=0,798 |
0,027 |
|
Больные туберкулезом без деструкции легочной ткани |
GG GC CC |
39 8 1 |
G=0,896 |
Примечание. N – численность генотипов; р – достигнутый уровень значимости
Ассоциация 469+14G/C полиморфизма NRAMP1 гена, возможно, обусловлена функциональной значимостью белкового продукта гена. Белок, NRAMP1 участвует в процессе фагоцитоза и таким образом обеспечивает защиту организма от внутриклеточных микробных агентов. Вероятно, 469+14C аллель снижает функциональную активность NRAMP1, влияя на течение возникшего заболевания и обусловливая развитие деструктивных процессов при вторичном туберкулезе легких. Показано, что у японцев формирование деструкции при туберкулезе также связано с изменчивостью гена NRAMP1, ассоциацию проявил полиморфизм D543N [Abe T. et al., 2003].
При сравнении больных туберкулезом с деструкцией и без таковой со здоровыми, выявлены ассоциации аллеля 274T гена NRAMP1, +3953А2 гена IL1B, 1188С гена IL12B и аллеля А2 VNTR полиморфизма гена IL1RN с распадом ткани легкого (табл. 20). Полиморфные варианты IL1B и IL1RN регулируют эффект IL-1β и таким образом участвуют в моделировании иммунного ответа [Tarlow J.K. et al., 1993]. Обнаружено, что макрофаги больных туберкулезом отличает пониженная способность секретировать ИЛ-1β [Селедцова Г.В. и др., 1991]. Причем при деструктивном процессе наблюдалось более выраженное снижение продукции ИЛ-1, чем при отсутствии некроза легочной ткани [Хонина Н.А. и др., 2000].
Показано, что экспрессия мРНК IL-1β, индуцированная МБТ выше у субьектов IL1В(+3953)А1+ и ниже – у индивидов с IL1В(+3953)А1- гаплотипом. Также известно, что А2 аллель IL1RN приводит к повышению продукции мРНК и секреции белка IL-1RN [Wilkinson R.J. et al., 1999].
Учитывая близкое расположение IL1B и IL1RN на хромосоме 2, предположили, что гены, кодирующие эти белки, наследуются не независимо друг от друга, то есть между локусами имеется неравновесие по сцеплению. С целью подтверждения или опровержения данной гипотезы, между IL1B и IL1RN в выборке больных деструктивным туберкулезом были произведены расчеты неравновесия по сцеплению.
Таблица 20 Статистические показатели для сравнения частот генотипов и аллелей в группах больных туберкулезом с деструкцией и без деструкции ткани легкого со здоровыми индивидами
|
Поли-морфизм |
Наличие деструкции |
Гено-тип |
N |
Частота аллеля у больных |
Сравнение со здоровыми |
|
|
генотипов |
аллелей |
|||||
|
NRAMP1 |
||||||
|
274C/T |
+ |
CC CT TT |
96 74 11 |
С=0,735 |
р=0,013 |
р=0,005 |
|
- |
CC CT TT |
29 17 1 |
С=0,798 |
р=0,671 |
р=0,506 |
|
|
IL1B |
||||||
|
+3953 A1/А2 |
+ |
A1A1 A1A2 A2A2 |
100 63 21 |
А1=0,715 |
р=0,022 |
р=0,008 |
|
_ |
A1A1 A1A2 A2A2 |
26 20 1 |
А1=0,766 |
р=0,378 |
р=0,497 |
|
|
IL12B |
||||||
|
1188A/С |
+ |
AA AC CC |
94 67 12 |
А=0,737 |
р=0,012 |
р=0,013 |
|
_ |
AA AC CC |
31 15 1 |
А=0,819 |
р=0,750 |
р=0,986 |
|
|
IL1RN |
||||||
|
VNTR |
+ |
A1A1 A1A2 A2A2 другие |
93 60 20 9 |
А1=0,690 А2=0,283 А3=0,030 |
р=0,056 |
р=0,017 |
|
_ |
A1A1 A1A2 A2A2 другие |
29 18 2 2 |
А1=0,765 А2=0,216 А3=0,020 |
р=0,262 |
р=0,684 |
Примечание. Обозначения см. табл. 19
Показано наличие неравновесия по сцеплению между генами, причем +3953А1 аллель IL1B и А1 аллельVNTR полиморфизма IL1RN оказались в фазе отталкивания, мера неравновесия для них составила –0,033 (р=0,009). Известно, что неравновесие по сцеплению возникает между неаллельными генами, расположенными на одной хромосоме столь близко, что частота кроссинговера приближается к нулю. Также гаметическое неравновесие может наблюдаться между генами, локализованными на разных хромосомах, что является результатом действия факторов популяционной динамики, например, естественного отбора [Животовский Л.А., 1984].
При сравнении частоты гаплотипа IL1RN*A1A1/IL1B*A1A1 в группах больных туберкулезом и здоровых индивидов найдено, что статистически чаще это сочетание встречается в контрольной выборке (χ2=9,10, р=0,003). Причем риск заболеть туберкулезом у носителей этого гаплотипа равен 0,50 (0,31–0,79). Таким образом, у русских жителей г. Томска гаплотип IL1RN*A1A1/IL1B*A1A1 имеет протективный эффект в отношении заболевания туберкулезом.
Для оценки тяжести туберкулезного процесса определяют распространенность патологического образования в пораженном органе. Выборку больных вторичным туберкулезом легких разделили на три группы в зависимости от объема поражения. Первую группу составили 68 больных с ограниченным по протяженности туберкулезным процессом (1-2 сегмента). Во вторую группу вошли 37 пациентов, у которых туберкулез локализовался в пределах одной доли. Третью группу составили 115 больных с распространенной формой заболевания (объем поражения – больше доли).
При сравнении этих групп найдены ассоциации генетических маркеров с распространенностью специфического процесса при туберкулезе (табл. 21). В группе больных ТБ с объемом поражения ткани легкого более доли статистически значимо чаще, чем в выборке пациентов с туберкулезом с поражением легкого менее доли, регистрировали индивидов, обладающих гомозиготным по аллелею 469+14С гена NRAMP1 и гетерозиготным генотипом (р=0,043). Таким образом, можно говорить о вкладе 469+14С аллеля гена NRAMP1 не только в формирование деструкции при туберкулезе, но и в увеличение зоны поражения. Хотя полиморфизм 469+14G/С гена NRAMP1 не проявил связь с туберкулезом, его "мутантный" аллель негативно влиял на течение возникшего заболевания, обусловливая распад ткани легкого и увеличивая объем поражения. Противоположным действием на течение туберкулезного процесса обладал полиморфизм B/b гена VDR. Аллель b этого маркера ассоциирован с ограниченным по распространенности вторичным туберкулезом (р=0,021).
Кроме того, с объемом поражения ткани легкого при вторичном туберкулезе проявили ассоциацию полиморфизмы +3953А1/А2 IL1B, 1188А/С IL12B и полиморфизм VNTR IL1RN. Различалась частота генотипов и аллелей в группе контроля и в группах больных туберкулезом разным по площади поражения ткани легкого (табл. 22).
Таблица 21 Частота аллелей и генотипов в группах больных туберкулезом с разным объемом поражения легочной ткани
|
Полиморфизм |
Генотипы |
N (%) |
Объем поражения легкого* |
Более доли |
Доля |
Менее доли |
|
NRAMP1 |
||||||
|
469+14 G/C |
GG GC CC |
60 (56,6) 41 (38,7) 5 (4,7) |
Более доли |
- |
р=0,016 |
|
|
GG GC CC |
26 (70,3) 11 (29,7) 0 (0) |
Доля |
р=0,043 |
- |
р=0,875 |
|
|
GG GC CC |
47 (72,3) 17 (26,2) 1 (1,5) |
Менее доли |
р=0,707 |
- |
||
|
VDR |
||||||
|
B/b |
BB Bb bb |
22 (20) 63 (57,3) 25 (22,7) |
Более доли |
- |
р=0,895 |
р=0,021 |
|
BB Bb bb |
7 (18,9) 22 (59,5) 8 (21,6) |
Доля |
р=0,973 |
- |
||
|
BB Bb bb |
3 (4,4) 44 (64,7) 21 (30,9) |
Менее доли |
р=0,011 |
- |
Примечание. Обозначения см. табл. 19; * - над диагональю показан уровень р для сравнения частот аллелей, под диагональю - уровень р для сравнения частот генотипов
Таблица 22 Частоты генотипов и аллелей в выборках больных туберкулезом с разным объемом поражения ткани легкого в сравнении с контрольной группой
|
Ген |
Поли-морфизм |
Объем поражения легкого |
Частота у больных |
Сравнение со здоровыми |
|||
|
генотипы |
N |
аллели |
генотипы |
аллели |
|||
|
NRAMP1 |
274C/T |
Более доли |
CC CT TT |
54 51 8 |
С=0,704 |
р=0,002 |
р=0,001 |
|
IL1B |
+3953 A1/А2 |
Менее доли |
A1A1 A1A2 A2A2 |
35 25 8 |
А1=0,699 |
р=0,038 |
р=0,015 |
|
IL12B |
1188 A/С |
Более доли |
AA AC CC |
61 37 8 |
А=0,750 |
р=0,022 |
р=0,058 |
|
IL1RN |
VNTR |
Более доли |
A1A1 A1A2 A2A2 другие |
59 37 13 6 |
А1=0,687 А2=0,287 А3=0,026 |
р=0,057 |
р=0,018 |
Примечание. Обозначения см. табл. 19
Найденная связь 274С/Т гена NRAMP1 представляется закономерной, поскольку этот полиморфизм также показал ассоциацию с деструктивным туберкулезом, а процессы некроза ткани и распространения воспаления взаимосвязаны. Обнаружена ассоциация генотипа 1188С/С IL12B с распространенным туберкулезным процессом. К тому же, учитывая результаты, полученные при сравнении общей группы больных туберкулезом и здоровых, а также данные анализа семейной выборки, можно суммировать, что у индивидов - обладателей генотипа 1188С/С IL12B предрасположенность к туберкулезу выше, чем у обладателей генотипов 1188А/А и 1188А/С, причем носители генотипа 1188С/С в большей степени рискуют заболеть тяжелым распространенным туберкулезом с деструкцией легочной ткани.
Несмотря на то, что биологические эффекты IL-1β и IL-1RN разнонаправленные, показано, что аллель +3953 А2 IL1В и аллель А2 VNTR полиморфизма IL1RN предрасполагают к возникновению распада легочной ткани при туберкулезе. Однако, что касается распространенности туберкулезного поражения, то аллель +3953 А2 IL1В ассоциирован с небольшой (1-2 сегмента) зоной воспаления, а аллель А2 VNTR полиморфизма IL1RN, напротив, с распространенным процессом.
Таким образом, полиморфизмы 469+14G/C гена NRAMP1 и B/b гена VDR оказывают влияние на течение возникшего заболевания. Изменчивость 274С/Т гена NRAMP1, 1188А/С IL12B, +3953А1/А2 IL1B и VNTR IL1RN предрасполагают к возникновению ТБ, причем все перечисленные маркеры кроме изученного полиморфизма гена IL1B способствуют заболеванию распространенным деструктивным туберкулезом. Полиморфизм +3953А1/А2 гена IL1B обусловливает подверженность к ограниченному туберкулезу с деструкцией ткани легкого у русских г. Томска.
При изучении ассоциаций с патогенетически важными для ТБ качественными признаками у тувинцев выявлена связь генетических маркеров с деструктивным процессом в легком.
Ассоциированными с распадом ткани легкого при туберкулезе оказались полиморфизм B/b гена VDR и полиморфизм VNTR гена IL1RN [Рудко А.А., 2004]. При сравнении найденных у тувинцев и русских ассоциаций можно отметить, что в обеих группах показана связь полиморфизма VNTR (аллеля А2) гена IL1RN с деструкцией при туберкулезе.
Наряду со сходством показаны и отличия. У русских г. Томска этот полиморфизм оказывал влияние на уровне предрасположенности к ТБ, тогда как у тувинцев обусловливал различное клиническое проявление возникшего заболевания. Как у русских, так и у тувинцев найдено влияние полиморфизма B/b гена VDR на течение туберкулезной инфекции. В выборке жителей г. Томска аллель b был ответственен за небольшой объем поражения легкого, а у тувинцев – за отсутствие деструкции при ТБ.
3.4.2 Анализ ассоциаций исследованных генов с количественными признаками туберкулеза
Туберкулез характеризуется специфическими проявлениями признаков, многие из которых имеют не качественную, а количественную природу. В связи с этим, одним из важных аспектов изучения генетических основ туберкулеза представляется анализ наследственной составляющей количественных признаков, существенных в патогенезе заболевания. С целью оценки влияния полиморфизма генов NRAMP1, VDR, IL1B, IL12B, IL1RN на течение туберкулезного процесса проведен поиск ассоциаций изучаемых маркеров с количественными, патогенетически важными признаками туберкулеза.
В эту часть исследования включили группу больных вторичным туберкулезом легких (181 человек), которую на 91% (165 человек) составили пациенты с распространенным туберкулезом, остальным был выставлен диагноз очагового туберкулеза легких и туберкулемы. Для остальных пациентов с вторичным ТБ показатели общего анализа крови на момент начала заболевания оказались недоступны.
Оценивали влияние изученных полиморфизмов на показатели крови при туберкулезе легких: гемоглобин, эритроциты, лейкоциты, скорость оседания эритроцитов (СОЭ), уровень палочкоядерных и сегментоядерных нейтрофилов, эозинофилов, лимфоцитов и моноцитов. Известно, что некоторые параметры крови зависят от пола и возраста индивида. Так, у русских г. Томска, больных туберкулезом показана зависимость от пола и возраста для лейкоцитов, СОЭ и моноцитов. В связи с этим перечисленные показатели анализировали отдельно в группе мужчин и женщин, к тому же вводилась поправка на возраст. Учитывая статистически значимые отклонения распределений большинства исследованных признаков от закона Гаусса по данным теста Колмогорова–Смирнова, сравнение проводилось с помощью непараметрических критериев Краскела–Уоллиса и Манна-Уитни [Гланц С., 1998].
Обнаружены ассоциации исследованных генов с рядом количественных показателей (табл. 23). Для полиморфизма 1188А/С гена IL12B показана связь с уровнем СОЭ и выраженностью палочкоядерного сдвига влево лейкоцитарной формулы, при этом генотип 1188А/С ассоциирован с повышением уровня палочкоядерных нейтрофилов независимо от пола больного и со значительным повышением уровня СОЭ у женщин при туберкулезе. В норме у женщин скорость оседания эритроцитов состаляет от 4 до 15 мм в час [Гольдберг Е.Д., 1989]. Так, полиморфизм 1188А/С гена IL12B проявил дифференциальное влияние на уровень СОЭ у представителей разного пола.
Полиморфизм F/f гена VDR проявил ассоциацию с уровнем сегментоядерных нейтрофилов. Среднее количество сегментоядерных нейтрофилов для обладателей генотипа ff составило 54%, в то время как для носителей других генотипов этот показатель равнялся 59%. В норме у здоровых уровень сегментоядерных нейтрофилов составляет 42,9% – 59,3% [Гольдберг Е.Д., 1989]. Таким образом, выявленная ассоциация прогностически нейтральна для туберкулеза, поскольку средний уровень сегментоядерных нейтрофилов при любом варианте гена оставался в пределах нормы. Для полиморфизмов генов NRAMP1, IL1B, IL1RN и варианта B/b гена VDR не показано связи с количественными признаками туберкулеза.
Таким образом, с помощью дисперсионного анализа удалось установить ассоциацию гена IL12B с количественными патогенетически важными признаками туберкулеза: палочкоядерным сдвигом лейкоцитарной формулы влево и с уровнем СОЭ у женщин. Известно, что степень ядерного сдвига нейтрофилов влево и уровень повышения СОЭ совпадают с активностью и тяжестью туберкулезного процесса [Шмелев Н.А., 1959; Кан Е.Л., 1972].
Таблица 23 Средние значения количественных признаков у носителей разных генотипов исследованных полиморфизмов
|
Ген/ Поли-морфизм |
Гено-типы |
N |
Признак |
Среднее значение признака |
S.D. |
р для теста Краскела - Уоллиса |
р для LSD теста |
|
IL12B 1188A/C |
AA |
97 |
Палочко-ядерные нейтрофи-лы (%) |
5,206 |
4,943 |
0,031 |
АА-АС* 0,007 |
|
AC |
60 |
7,567 |
5,782 |
АС-СС* 0,907 |
|||
|
CC |
11 |
7,364 |
5,372 |
СС-АА* 0,201 |
|||
|
AA |
34 |
СОЭ у женщин (мм/ч) |
24,765 |
19,285 |
0,010 |
АА-АС* 0,006 |
|
|
AC |
24 |
39,833 |
20,466 |
АС-СС* 0,044 |
|||
|
CC |
4 |
17,750 |
21,608 |
СС-АА* 0,507 |
|||
|
VDR F/f |
FF |
73 |
Сегменто-ядерные нейтрофи-лы (%) |
59,890 |
9,389 |
0,039 |
FF-Ff* 0,552 |
|
Ff |
75 |
59,000 |
9,063 |
Ff-ff* 0,034 |
|||
|
ff |
20 |
54,100 |
8,012 |
ff-FF* 0,006 |
Примечание. N - численность генотипов; S.D. - стандартное отклонение; р - достигнутый уровень значимости; * - указаны генотипы, для которых сравнивали среднее значение признака
Важным обстоятельством является то, что ген IL12B проявил связь, как с туберкулезом, так и с качественными и количественными признаками заболевания. Кроме того показана ассоциация IL12B с туберкулезом, выявленная при помощи TDT – теста, анализирующего семейные данные. Это свидетельствует о неслучайном характере полученных ассоциаций и о том, что изученный ген играет важную роль в формировании подверженности к туберкулезу у русского населения г. Томска. Однако в исследовании тувинцев не показано ассоциаций с этим геном [Рудко А.А., 2004].
Интересным представляется то, что у жителей Тувы при поиске ассоциаций с количественными признаками туберкулеза найдена связь полиморфизма B/b гена VDR с количеством палочкоядерных нейтрофилов и полиморфизма VNTR гена IL1RN с уровнем СОЭ. Аллель b гена VDR оказался ассоциирован с нормальным количеством палочкоядерных нейтрофилов при туберкулезе, а аллель В – с палочкоядерным сдвигом влево лейкоцитарной формулы. Аллель А2 гена IL1RN проявил связь со значительным повышением СОЭ при ТБ у тувинцев [Рудко А.А., 2004]. В целом можно отметить, что при сравнении полученных ассоциаций полиморфизмов с качественными и количественными параметрами туберкулеза у русских г. Томска и у жителей Тувы найдены отличия по всем исследованным признакам, что говорит об этнической зависимости генетических основ подверженности к туберкулезу.
Заключение
При изучении роли генов–кандидатов подверженности туберкулезу в этиологии и клинических проявлениях заболевания использован следующий алгоритм работы. На первом этапе проведен анализ популяционной распространенности исследуемых полиморфизмов. Второй этап заключался в определении ассоциаций генетических маркеров с туберкулезом. Третий этап включал поиск связи аллельных вариантов генов с качественными и количественными патогенетически значимыми параметрами заболевания. Кроме того, проведен сравнительный анализ полученных результатов с исследованием тувинской популяции, выполненным ранее по той же методологии [Рудко А.А., 2004].
Изучена популяционная распространенность полиморфных вариантов генов NRAMP1, VDR, IL1B, IL1RN, IL12B у русских г. Томска. Это дало возможность провести сравнение между характерными особенностями распространения аллелей генов–кандидатов туберкулеза в различных популяциях мира. При этом выявлена специфичность их распространения у жителей г. Томска. Результаты сравнительного анализа представляются важными с точки зрения обнаружения связи между особенностями распределения частот аллелей генов–кандидатов туберкулеза и заболеваемостью этой инфекционной патологией в различных популяциях.
При сравнении частот аллелей и генотипов у русских и тувинцев показаны отличия практически по всем исследованным полиморфизмам, кроме варианта 274С/Т гена NRAMP1, однако статистические показатели сравнения генотипов для этого полиморфизма были пограничными (р=0,064). Структура неравновесия по сцеплению между парами полиморфных вариантов гена NRAMP1 оказалась идентичной у русских и тувинцев. Неравновесие между другими исследованными генетическими маркерами отличалось в изученных этнических группах. При сравнении частот аллелей и генотипов у больных туберкулезом русских и тувинцев выявлены отличия по всем полиморфизмам. В целом при межпопуляционном сравнении особенностий распределения аллелей генов-кандидатов ТБ и складывающихся межлокусных взаимодействиях у русских и тувинцев выявлены значительные отличия, что представляется важным с точки зрения генетической эпидемиологии.
Первостепенное внимание было уделено поиску ассоциаций полиморфизма генов NRAMP1, VDR, IL1B, IL1RN, IL12B с туберкулезом. Основой в проведенном исследовании вклада генов–кандидатов туберкулеза в формирование подверженности к заболеванию служил комплексный подход, заключающийся в характеристике полиморфизма этих генов, как на популяционном уровне, так и на семейном. При сравнении частот аллелей и генотипов у больных и здоровых установлена связь полиморфизма 1188А/С IL12B с туберкулезом (р=0,044 и р=0,035 соответственно), причем у носителей генотипа 1188С/С риск заболеть первичным туберкулезом возрастал в 13 раз, а вторичными формами инфекции – в 8 раз. Полученная связь генетического маркера с патологией методом случай–контроль подтверждена на семейной выборке больных. Дети с туберкулезом лишь в 13% случаев наследовали от родителей аллель 1188А, тогда как аллель 1188С - в 87% (TDT=8,07, р=0,005). С другими исследованными генами–кандидатами туберкулеза ассоциаций по данным теста TDT не получено. Также показано, что полиморфизм 1188А/С гена IL12B ассоциирован не с любым клиническим вариантом вторичного туберкулеза легких, а лишь с распространенным (объем поражения – более одной доли) (р=0,022), деструктивным ТБ (р=0,012).
Выявлено наличие ассоциации с заболеванием полиморфизма 1465-85G/A гена NRAMP1. У заболевших первичным туберкулезом чаще, чем в контрольной группе встречался гетерозиготный генотип 1465-85G/A (р=0,004), риск заболевания у этих индивидов был в 3 раза выше, чем у обладателей других генотипов этого полиморфизма. К тому же показана протективная роль в отношении первичного туберкулеза для генотипа 1465-85G/G NRAMP1.
Показана связь полиморфизма 274С/Т гена NRAMP1 с вторичным туберкулезом легких, причем с деструктивными (р=0,005) и распространенными (р=0,002) формами. Индивиды с генотипом 274С/Т преобладали в 1,66 раза в группе больных по сравнению с контролем. Лица, обладающие генотипом 274С/C, статистически значимо чаще встречались среди здоровых (OR=0,54).
В результате проведенного анализа установлена значимость VNTR полиморфизма гена IL1RN при туберкулезе. Частота аллеля А2 была выше в группе больных по сравнению с контролем (р=0,023). При сравнении частот генотипов выявлена предрасполагающая к ТБ роль гетерозигот А1/А2 (OR=2,10, р=0,030). Установлено, что выявленная ассоциация VNTR гена IL1RN c патологией обусловлена связью этого полиморфизма с вторичными формами туберкулеза легких, так как распределение генотипов различалось в группах лиц с вторичным генезом заболевания и здоровых (р=0,025), а в выборках с первичным туберкулезом и контрольной отличий не показано. Кроме того выявлена связь этого маркера с распространенным (р=0,018) и деструктивным (р=0,017) вторичным туберкулезом легких.
Ген IL1B, продукт экспрессии которого является провоспалительным цитокином, проявил статистически значимую связь с вторичным деструктивным туберкулезом легких. Аллель А2 полиморфизма +3953 этого гена чаще определяли у больных, чем у здоровых (р=0,008). Распределение генотипов в группе больных деструктивными формами заболевания и здоровых также различалось (р=0,022). Кроме того аллель А2 оказался ассоциирован с небольшим объемом туберкулезного поражения в легком (1-2 сегмента) (р=0,015) (рис. 6)
При определении неравновесия между полиморфизмами генов IL1B и IL1RN показано, что аллель +3953А1 и аллель А1 полиморфизма VNTR находятся в фазе отталкивания, мера неравновесия для них составила –0,033 (р=0,009). При сравнении частоты гаплотипа IL1RN*A1A1/IL1B*A1A1 в группах больных туберкулезом и здоровых индивидов найдено, что статистически чаще это сочетание встречается в контрольной выборке (р=0,003). При этом риск заболеть туберкулезом у носителей этого гаплотипа был равен 0,50. Таким образом, гаплотип IL1RN*A1A1/IL1B*A1A1 имеет протективный эффект и защищает его обладателя от заболевания туберкулезом.
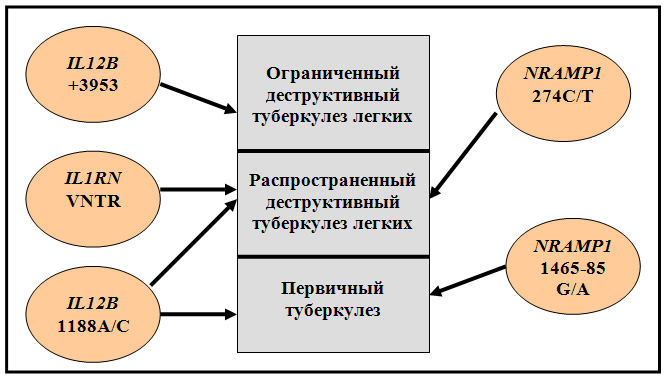
Рис. 6. Ассоциации исследованных генов с туберкулезом
При анализировании анамнестических данных показано, что родственники индивидов больных туберкулезом, не имеющие контакта с пробандами, страдают от этого заболевания чаще, чем родственники здоровых людей (OR=3,63, p<0,000). Это свидетельствует о наследственной предрасположенности к туберкулезу.
При сравнении выявленных ассоциаций исследованных генов с ТБ у русских г. Томска и коренных жителей Тувы показаны значительные отличия. Результаты, полученные при изучении тувинского этноса, свидетельствуют о незначительном вкладе исследованных полиморфизмов в формирование подверженности к туберкулезу [Рудко А.А., 2004]. У жителей г. Томска, напротив, получены ассоциации для 5 из 9 исследованных полиморфизмов генов-кандидатов предрасположенности к ТБ. Такие отличия в проявлении эффекта изученных генов, вероятно, обусловлены разным генетическим фоном у русских и тувинцев. Известно, что каждый ген действует не самостоятельно, а во взаимодействии со множеством других генов, следовательно, эффекты генов проявляют зависимость от того генетического фона, на котором действует ген.
Установлено, что полиморфизмы 469+14G/C гена NRAMP1 и B/b гена VDR не предрасполагают к туберкулезу, однако они оказывают влияние на течение возникшего заболевания. При сравнении распределений генотипов и частот аллелей 469+14G/C гена NRAMP1 в группах больных туберкулезом с деструкцией легочной ткани и больных туберкулезом без деструкции выявлены статистически значимые отличия. Так, частота аллеля 469+14С этого гена в выборке больных с экссудативно-некротическим и пролиферативно-некротическим типом воспалительной реакции была выше, чем в группе больных с пролиферативными и экссудативным типом воспалительной реакции (р=0,027). Кроме того, этот полиморфизм оказался значимым в определении обьема поражения при туберкулезе легких. Частота аллеля 469+14С в группе больных распространенным туберкулезом превышала таковую в группе больных с ограниченной формой заболевания (р=0,016).
Таким образом, можно говорить о вкладе 469+14С аллеля гена NRAMP1 не только в формирование деструкции при туберкулезе, но и в увеличение зоны поражения. Показано влияние полиморфизма B/b гена VDR на распространенность зоны туберкулезного поражения, поскольку аллель b статистически значимо чаще выявляли у больных с легочным поражением в пределах 1-2 сегментов (р= 0,011).
Обнаружены ассоциации исследованных генов с рядом количественных показателей. Для полиморфизма 1188А/С гена IL12B показана связь с уровнем СОЭ и выраженностью палочкоядерного сдвига влево лейкоцитарной формулы, при этом аллель 1188С ассоциирован с повышением палочкоядерных нейтрофилов независимо от пола больного (р=0,031), а генотип 1188АС – с значительной степенью повышения СОЭ у женщин (р=0,010) (рис. 7).
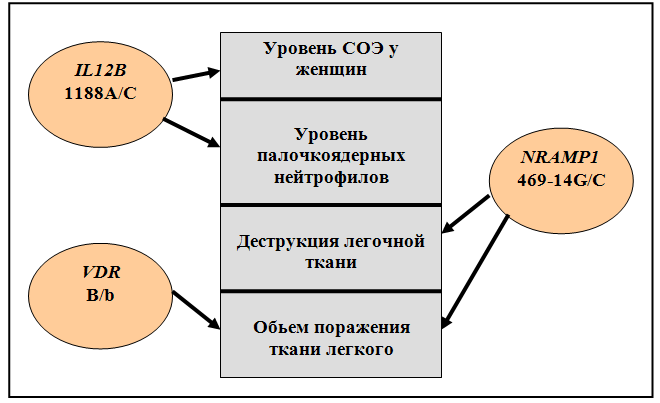
Рис. 7. Ассоциации исследованных генов с качественными и количественными, патогенетически значимыми параметрами туберкулеза
При сравнении показанных ассоциаций исследованных полиморфизмов генов с патогенетически важными параметрами ТБ у русских и тувинцев выявлены различия. У коренных жителей Тувы максимально значимыми с точки зрения прогнозирования клинического течения туберкулезного процесса оказались полиморфизм B/b гена VDR и полиморфизм VNTR гена IL1RN. Для этих генетических маркеров выявлены ассоциации с деструкцией при ТБ, повышением СОЭ и со сдвигом лейкоцитарной формулы влево [Рудко А.А.,2004]. У жителей г. Томска ассоциированными с перечисленными параметрами туберкулеза оказались другие полиморфизмы. Таким образом, при межпопуляционном сравнении генов-кандидатов подверженности к ТБ у русских и тувинцев выявлены отличия, как по генетической структуре популяций, так и по вовлеченности в формирование генетической основы предрасположенности к туберкулезу и его особенностей клинического течения.
Функциональные механизмы, определяющие полученные ассоциации, возможно, связаны с действием продуктов экспрессии этих генов на патогенез заболевания. В случае подтверждения этой гипотезы, аллели 1465-85А гена NRAMP1, 1188С гена IL12B могут стать маркерами предрасположенности к первичному туберкулезу, а аллели 274Т гена NRAMP1, A2 VNTR полиморфизма гена IL1RN, +3953A2 гена IL1B, 1188С гена IL12B – маркерами подверженности к вторичному туберкулезу с деструкцией легочной ткани (рис. 6). Кроме того, зная генотип больного по полиморфизмам 469+14G/С гена NRAMP1 и B/b гена VDR, вероятно можно будет прогнозировать течение туберкулезного процесса (рис. 7). В целом, полученные данные позволят глубже проникнуть в патогенез туберкулеза, его отдельных клинических форм, также они представляются важными для формирования представления о связи между частотой аллелей генов-кандидатов ТБ и особенностями распространения этого инфекционного заболевания.
Выводы
Выявлены особенности в распределении частот аллелей, изученных генов–кандидатов подвержености к туберкулезу, у русских жителей г. Томска по сравнению с другими популяциями мира. При сравнении с тувинцами показаны отличия в распределении генотипов и частот аллелей по всем рассматриваемым генам, как у здоровых индивидов, так и у больных туберкулезом.
У русских жителей г. Томска наблюдается неравновесие по сцеплению между четырьмя парами полиморфизмов гена NRAMP1: 469+14G/C и 274C/T (D=+0,104), 469+14G/C и 1465-85G/A (D=+0,078), 274C/T и 1465-85G/A (D=+0,085), D543N и 1465-85G/A (D=+0,017) и между полиморфизмами B/b и F/f гена VDR (D=+0,053). Структура неравновесия по сцеплению между полиморфизмами гена NRAMP1 не отличается от таковой у тувинцев.
Родственники индивидов больных туберкулезом заболевают этой инфекцией чаще, чем родственники здоровых лиц, даже при отсутствии семейного контакта с больным пробандом (OR=3,63, p<0,000).
Полиморфные варианты 1188A/C гена IL12B и 1465-85G/A гена NRAMP1 ассоциированны с туберкулезом первичного генеза у русских г. Томска. Распространенный вторичный туберкулез с деструкцией легочной ткани связан с изменчивостью по 274С/Т гена NRAMP1, 1188A/C гена IL12B, VNTR гена IL1RN, а ограниченный вторичный туберкулез с деструкцией легочной ткани – с полиморфизмом +3953А1/А2 гена IL1B.
Генотип 1465-85G/G NRAMP1 проявляет протективный эффект при первичном туберкулезе (OR=0,33, p=0,005), а генотипы 274С/С гена NRAMP1 (OR=0,51, p=0,005), А1/А1 IL1RN (OR=0,55, p=0,007) и гаплотип IL1RN*A1A1/IL1B*A1A1 (OR=0,50, p=0,003) – при вторичном туберкулезе. Рисковыми генотипами для туберкулеза являются 1465-85G/A NRAMP1 (OR=3,16, p=0,002) и 1188C/C IL12B (OR=13,47, p=0,013) при первичном генезе заболевания, 1188C/C IL12B (OR=7,43, p=0,023), 274С/Т NRAMP1 (OR=1,75, p=0,026), 274Т/Т NRAMP1 (OR=5,01, p=0,037) и А1/А2 IL1RN (OR=2,20, p=0,002) при вторичном туберкулезе.
Для полиморфизмов 1188А/С гена IL12B, 469+14G/C гена NRAMP1 и B/b гена VDR выявлена ассоциация с качественными и количественными патогенетически важными признаками туберкулеза: уровнем палочкоядерных нейтрофилов, показателем скорости оседания эритроцитов у женщин, деструкцией ткани легкого и объемом поражения легочной ткани при туберкулезе.
Выявлены отличия в структуре генетической компоненты подверженности к туберкулезу у русских и тувинцев, заключающиеся в разном вкладе исследуемых генов в формирование предрасположенности к заболеванию и в клинические проявления туберкулеза.
Список литературы
Авербах М.М. Иммунология и иммунопатология туберкулеза. - М.: Медицина, 1976. - 311с.
Авербах М. М., Литвинов В. И., Гергерт Г. В. Иммунологические аспекты легочной патологии. - М.: Медицина, 1980. - 113 с.
Авербах М. М., Гергерт В. Я., Мороз А. М. и др. Современные аспекты фтизиоиммунологии // Сб. трудов ЦНИИТ. – 1982. - С. 3-9.
Авербах М. М., Мороз А. М., Апт А. С. и др. Межлинейные различия чувствительности мышей к туберкулезу // Иммунология. - 1980. - №2. - С. 42-43.
Алтухов Ю. П. Генетические процессы в популяциях. – М.: ИКЦ "Академкнига", 2003. – 431 с.
Алтухов Ю. П., Курбатова О. Л. Наследственность человека и окружающая среда. – М.: Наука, 1984. – С. 7-34.
Апт А. С., Никоненко Б. В., Мороз А. М., Авербах М. М. Генетический анализ факторов, детерминирующих восприимчивость к туберкулезу // Бюл. Эксперимю биол. – 1982. – № 12. – С. 83-85.
Апт А. С. Генетические аспекты выявления групп риска по туберкулезу // Проблемы туберкулеза. - № 10. – С. 65-68.
Белиловский Е. М., Борисов С. Е., Дергачев А. В. и др. Заболеваемость туберкулезом в России: ее структура и динамика // Проблемы туберкулеза. – 2003. - № 7. – С. 4-11.
Березовский Б. А., Мостовой Ю. М., Пухлик Б. М., Михей Л. В. Проверка гипотезы мультифакториального типа наследования предрасположенности к туберкулезу легких // Проблемы туберкулеза. – 1986. – №2. – С.24-26.
Богадельникова И. В., Сергеев А. С., Агапова Р. К., Перельман М. И. Исследование уровней гетерозиготности у больных туберкулезом легких с различной эффективностью лечения // Вестник РАМН. – 2000. – № 3. – С. 15-21.
Вахидова Г. А., Еремеев В. В., Убайдуллаев А. М. Иммунологические механизмы патогенеза туберкулеза // Проблемы туберкулеза. – 1991. – № 5. – С. 69-71.
Вейр Б. Анализ генетических данных. – М.: Мир, 1995. – 400 с.
Визель А. А., Гурелева М. Э. Туберкулез. – М.: ГЭОТАР Медицина, 2000. - 208 с.
Галактионов В. Г. Иммунология. – М.: МГУ, 1998. – 440 с.
Гамалея Н. Ф. Инфекция и иммунитет. – М.: Медицина, 1939. – 280 с.
Гланц С. Медико-биологическая статистика. – М.: Практика, 1998. - 459 с.
Гольдберг Е. Д. Справочник по гематологии с атласом микрофотограмм. – Томск: Изд-во Том. Ун-та, 1989. – 468 с.
Давыдовский И. В. Проблема причинности в медицине. – М.: Медицина, 1962. – 728 с.
Еремеев В. В. Взаимодействие макрофаг-микобактерия в процессе реакции микроорганизма на туберкулезную инфекцию // Проблемы туберкулеза. – 2004. – № 8. – С. 3-7.
Ерохин В. В. Основные итоги и перспективы работы сотрудничающего центра ВОЗ по борьбе с туберкулезом в Российской Федерации. // Проблемы туберкулеза. – 2003. – № 3. – С. 11-21.
Ерохин В. В. Субклеточная морфология легких при экспериментальном туберкулезе // Автореф. дис. д-ра мед. наук. – М., 1974 – 42 с.
Ерохин В. В., Земскова З. С. Современные представления о туберкулезном воспалении // Проблемы туберкулеза. – 2003. – № 3. – С. 11-21.
Животовский Л. А. Интеграция полигенных систем в популяциях. Проблемы анализа комплексных признаков. – М.: Наука, 1984. – 183 с.
Животовский Л. А. Статистические методы анализа частот генов в природных попкляциях // М.: ВИНИТИ, 1983. – Т. 8. – С. 76-104.
Земскова З. С., Дорожкова И. Р. Скрыто протекающая туберкулезная инфекция. – М: Медицина, 1984. – 224 с.
Имангулова М. М., Бикмаева А. Р., Хуснутдинова Э. К. Исследование полиморфных локусов D543N и 3-UTR гена NRAMP1 у больных инфильтративным туберкулезом легких в Башкортостане // Медицинская генетика. – 2004. – № 8. – Т. 4. – С. 376-379.
Имангулова М. М., Бикмаева А .Р., Хуснутдинова Э. К. Полиморфизм кластера гена интерлейкина 1 у больных туберкулезом легких // Цитокины и воспаление. – 2005. – № 1. – Т. 4. – С. 36-41.
Кан Е. Л. Изменения в системе крови и их диагностическое значение / Руководство по туберкулезу органов дыхания. – М., 1972. - С.116-128.
Клеточная биология легких в норме и при патологии. / Под ред. В. В. Ерохина, Л. М. Романовой // М.: Медицина, 2000. – 469 с.
Кноринг Б. Е., Фрейдлин И. С., Симбирцев А. С. и др. Характер специфического иммунного ответа и продукция цитокинов мононуклеарами крови больных разными формами туберкулеза легких // Медицинская иммунология. – 2001. – Т. 3. - № 1. – С. 61-69.
Кобринский Б. А. Формирование групп риска и прогноз развития заболеваний // Вестник АМН. – 1987. – № 4. – С. 85-89.
Краснов В. А. Калачев И. В. Степанов Д. В. и др. Перспективы развития противотуберкулезной помощи населению Сибири. // Проблемы туберкулеза. – 2003. - № 5. – С. 3-6.
Лакин Г. Ф. Биометрия. – М.: Наука, 1990. – 300 с.
Лильин Е. Т., Трубников В. И., Ванюков М. М. Введение в современную фармакогенетику // М.: Медицина, 1984. – 160 с.
Литвинов В. И., Чуканова В. П., Маленко А. Ф. и др. Проблемы иммуногенетики болезней легких // Сборник трудов ЦНИИ туберкулеза МЗ СССР. – 1983. – Т. 37. – С. 16-19.
Литвинов В. И., Гергерт В. Я., Мороз А. М. и др. Иммунология туберкулеза: современное состояние проблемы // Вестник РАМН. – 1999. – №7. – С. 8-11.
Маниатис Т., Фрич Э., Сэмбук Дж. Методы генетической инженерии. Молекулярное клонирование. – М.: Мир, 1984. – 480 с.
Меньшиков В.В. Лабораторные методы исследования в клинике. - М.: Медицина, 1987. - 350с.
Мороз А. М. Иммуногенетические механизмы резистентности к туберкулезу (экспериментальное исследование) / Дис. д-ра мед. наук. – М., 1984. – 42 с.
Мурашкина Г.С., Алексеева Т.В., Ревякина О.В., Новикова Н.М. Туберкулез в западной Сибири //Современная фтизиатрия и проблемы туберкулеза XXI века. - Тезисы докладов. - 1999. - С.5.
Онищенко Г. Г. Эпидемическая ситуация в Российской Федерации и меры по ее стабилизации // Проблемы туберкулеза. – 2003. - № 11. – С. 4-9.
Пальцев М. А. Молекулярная медицина // Вестник молодых ученых. – 2002. - № 4. – С. 64-84.
Пальцев М. А. Значение биомедицинских фундаментальных исследований для фтизиатрии // Проблемы туберкулеза. – 2004. - № 3. – С. 3-7.
Патофизиология: учебник для медицинских вузов / Под ред. В. В. Новицкого, Е. Д. Гольдберга // Томск: Из-во Том. ун-та, 2001. – 716 с.
Перельман М. И., Хомяков Ю. Н., Киселев В. И. и др. Молекулярная медицина и лечение туберкулеза // Проблемы туберкулеза. – 2001. - № 5. – С. 5-7.
Перельман М. И. Основные итоги противотуберкулезной работы в России в 2001 г. // Проблемы туберкулеза. – 2003. - № 2. – С. 3-11.
Пименов Е. В., Тотолян А. А., Бывалов А. А. и др. Современные представления о патогенезе инфекционных заболеваний // Вестник РАМН. – 2003. – № 6. – С. 3-9.
Покровский В. И., Авербах М. М., Литвинов В. И., Рубцов И. В. Приобретенный иммунитет и инфекционный процесс. – М.: Медицина, 1979. – 280 с.
Пузик В. И., Уварова О. А., Авербах М. М. Патоморфология современных форм легочного туберкулеза. – М.: Медицина, 1973. – 244 с.
Пузырев В. П. Генетика мультифакториальных заболеваний: между прошлым и будущим // Медицинская генетика. – 2003. – Т.2. № 12. – С. 498-508.
Пузырев В. П., Никитин Д. Ю., Напалкова О. В. Ген NRAMP1: структура, функция и инфекционные болезни человека // Молекулярная генетика, микробиология и вирусология. – 2002. – №3. – С.34-40.
Пузырев В. П., Степанов В. А. Патологическая анатомия генома. – Новосибирск: Наука, 1997. – 224 с.
Рабухин А.Е. Туберкулез органов дыхания у взрослых. – М.: Медицина, 1976. - 328с.
Рабухин А. Е. Исторический очерк развития учения о туберкулезе. Руководство по туберкулезу. – М., 1959 – 134 с.
Рабухин А. Е. Эпидемиология и патогенез легочного туберкулеза.– М., 1948 – 120 с.
Ридер Г. Л. Эпидемиологические основы борьбы с туберкулезом // Пер. с англ. – М.: Весь Мир. – 2001. – 192 с.
Ройт А. Основы иммунологии. – М.: Мир, 1991. – 327 с.
Ройт А., Бростофф Дж., Мейл Д. Иммунология. – М.: Мир, 2000. – 592 с.
Рудко А. А. Аллельные варианты генов подверженности к туберкулезу у тувинцев / А.А. Рудко: Автореф. дисс. канд. мед. наук. - Томск, 2004. - 20 с.
Рудко А. А., Ондар Э. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов NRAMP1 и IL12B у больных туберкулезом и здоровых жителей республики Тыва / Актуальные проблемы сохранения здоровья населения Республики Тыва // Под ред. Ондар Э. А., Монгуш Р. Ш. – Вып. 3. – Кызыл: ТывГУ, 2003. – С. 55-62.
Рудко А. А., Ондар Э. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов NRAMP1 и IL12B у больных туберкулезом Республики Тыва / Сборник тезисов "Вопросы сохранения и развития здоровья населения Севера и Сибири" / Красноярск, 2003. – С. 372-374.
Рудко А. А., Ондар Э. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов-кандидатов подверженности к туберкулезу у населения Республики Тыва / Сборник тезисив 3-го съезда генетиков и селекционеров России "Генетика в XXI веке: современное состояние и перспективы развития" / М. – 2004. – С. 93.
Рудко А. А., Фрейдин М. Б. Генетика предрасположенности к туберкулезу / Генетика человека и патология: Сборник научных трудов / Под. ред. В. П. Пузырева. – Вып. 6. – Томск: "Печатная мануфактура". – 2002. – С. 170-176.
Рудко А. А., Фрейдин М. Б. Генетические основы подверженности к туберкулезу // Тихоокеакский медицинский журнал. – 2002. - №1(8). – С. 61-61.
Рудко А. А., Фрейдин М. Б., Пузырев В. П. Полиморфизм генов NRAMP1 и IL12B у больных туберкулезом Республики Тыва / Сборник тезисов 13-го национального конгресса по болезням органов дыхания / Санкт-Петербург, 2003. – С. 289.
Сабадаш Е. В., Павлов В. А., Кравченко М. А. и др. К вопросу о формировании естественной резистентности к туберкулезу / Материалы междун. конф. "Туберкулез – старая проблема в новом тысячелетии", 1-5 июля 2002г. – М.: Медицина и жизнь. – С. 150-151.
Селедцова Г. В., Козлов В. А. Иммунорегуляторные свойства моноцитов/макрофагов у больных туберкулезом легких // Проблемы туберкулеза. – 1991. - № 5. – С. 54-56.
Сергеев А. С., Богадельникова И. В., Агапова Р. К., Перельман М. И. Анализ уровней гетерозиготности по локусам PL, TF, PGM1, ACP1, HP, GC, GLO1, C3 и ESD у больных туберкулезом легких с различной эффективностью лечения // Генетика. – 2001. – Т.37. № 12. – С. 1673-1680.
Симбирцев А. С. Цитокины – новая система регуляции защитных сил организма // Цитокины и воспаление. – 2002. – Т.1.№ 1. – С. 9-16.
Скворцова Л. А., Павлова М. В., Виноградова Т. И., Арчакова Л. И. Комплексная терапия туберкулеза легких с применением рекомбинантных интерлейкинов // Проблемы туберкулеза. – 2003. – № 10. – С. 9-12.
Скутко А.Я. Особенности клиники деструктивных и кавернозных форм туберкулеза легких у впервые выявленных больных //Врачебное дело. - 1970. - №12. - С.61-65.
Состояние противотуберкулезной помощи населению сибирского и дальневосточного федеральных округов по итогам работы в 2003 году / Под ред. В. А. Краснова // Новосибирск. – 2004. – 122 с.
Справочные материалы по эпидемиологии туберкулеза в Сибирском и Дальневосточном федеральном округах / Выездное заседание президиума СО РАМН 19 мая 2004 г., г. Новосибирск.
Стрелис А.К. Актовая речь //Современная фтизиатрия и проблемы туберкулеза XXI века. - Томск, 1999. - 69с.
Стрелис А. К. Туберкулез сегодня – инфекционный агрессор и бомба замедленного действия / Сборник трудов международной научно-практической конференции "Проблемы туберкулеза и современные пути их решения", 7-8 октября 2004 г. – Томск. – С. 19-23.
Струков А. И. Формы легочного туберкулеза в морфологическом освещении. – М., 1948. – 160 с.
Cтруков А.И. Кауфман О.Я. Гранулематозное воспаление и гранулематозные болезни. - М: Медицина, 1989. - 184с.
Тотолян А. А., Фрейдлин И. С. Клетки иммунной системы. - СПб.: Наука, 2000. – 231 с.
Туберкулез. Руководство для врачей / Под ред. А. Г. Хоменко. – М.: Медицина, 1996. – 496 с.
Уварова О. А., Ильина Т. Я., Зикеев В. В. Взаимосвязь морфологических иммунных реакций и характера туберкулезного процесса в легких // Проблемы туберкулеза. – 1981. – № 4. – С. 65-68.
Урсов И. П. Эпидемиология туберкулеза. – Новосибирск, 1997. – 112 с.
Флейс Д. Статистические методы для изучения таблиц долей и пропорций. - М.: Финансы и статистика, 1989. – 319 с.
Фогель Ф., Мотульски А. Генетика человека: Пер. с англ. – М.: Мир, 1989. – Т.1 – 313 с.
Фрейдлин И.С. Система мононуклеарных фагоцитов. - М., 1984. - 272с.
Хаудамова Г. Т. Риск заболевания туберкулезом основных этнических групп Казахстана // Проблемы туберкулеза. – 1991. – №4. – С. 22-25.
Холмовская М. Б. Исторический очерк развития медико-биологического учения о туберкулезе. – М., 1997. – 247 с.
Хоменко А. Г. Проблемы наследственности при болезнях легких. – М.: Медицина, 1990. – 240 с.
Хонина Н. А., Никонов С. Д., Шпилевский С. В. и др. Особенности иммунитета у больных с различными формами туберкулеза легких // Проблемы туберкулеза. – 2000. – №1. – С. 30-32.
Чуканова В. П., Сергеев А. С., Мороз А. М., Гафуров К. Г. Роль наследственных факторов при туберкулезе // Проблемы туберкулеза. – 1981. – №11. – С. 46-50.
Чуканова В. П., Литвинов В. И., Поспелов Л. Е., Слогоцкая Л. В. Значение факторов наследственной предрасположенности в развитии и течении легочного туберкулеза // Проблемы туберкулеза. – 1995. – №2. – С. 6-9.
Чуканова В. П., Поспелов Л. Е., Маленко А. Ф. Значение факторов наследственной предрасположенности при туберкулезе и других гранулематозных заболеваниях легких // Проблемы туберкулеза. – 2001. – №2. – С. 33-36.
Шевченко Ю. Л. Борьба с туберкулезом в России на пороге ХХ1 века // Проблемы туберкулеза. – 2000. - № 3. – С. 2-5.
Шмелев Н.А. Цитологический анализ крови и его значение при туберкулезе. -М.: Медицина, 1959. – 112 с.
Штефко В. Г. Туберкулез и конституция. – Л., 1930. – 240 с.
Ярилин А. А. Симбиотические взаимоотношения клеток иммунной системы // Иммунология. – 2001. - №4. – С. 16-20.
Ярилин А. А. Межклеточная кооперация при иммунном ответе // Вестник РАМН. – 1999. - №4. – С. 25-29.
Abe T., Linuma Y., Ando M. et al. Nramp1 polymorphisms susceptibility and clinical features of tuberculosis // J. Infect. Dis. – 2003. – Vol. 46. – P. 215-220.
Abel L., Casanova J. L. Genetic predisposition to clinical tuberculosis: bridging the gap between simple and complex inheritance // Am. J. Hum. Genet. – 2000. – Vol. 67. – P. 274-277.
Abel L., Dessein A. J. The impact of host genetics on susceptibility to human infectious diseases // Curr. Opin. Immunol. – 1997. – Vol. 9. – P. 509-516.
Altare F., Jouanguy E., Lamhamedi S. et al. Mendelian susceptibility to mycobacterial infection in man // Curr. Opin. Immunol. – 1998. – Vol. 10. – P. 413-417.
Baghdadi J. E., Remus N., Benslimane A. et al. Variants of the human NRAMP1 gene and susceptibility to tuberculosis in Morocco // Int. J. Tuberc. Lung Dis. – 2003. – Vol. 7(6). – P. 599-602.
Barton C. H., Biggs T. E., Baker S. T. et al. Nramp1: a link between intracellular iron transport and innate resistance to intracellular pathogens // J. Leuk. Biol. – 1999. – Vol. 66. – P.757-762.
Bellamy R. Genetic susceptibility to tuberculosis in human populations // Thorax. – 1998. – Vol. 53. – P. 588-593.
Bellamy R. Identifying genetic susceptibility factors for tuberculosis in Africans: a combined approach using a candidate gene study and a genome-wide screen // Clin. Science. – 2000. – Vol. 98. – P.245-250.
Bellamy R. The natural resistance-associated macrophage protein and susceptibility to intracellular pathogens // Microbes and Infection. – 1999. – Vol. 1. – P. 23-27.
Bellamy R., Beyers N., McAdam K. P. W. J. et al. Genetic susceptibility to tuberculosis in Africans: a genome-wide scan // Proc. Natl. Acad. Sci. USA. – 2000. – Vol. 97. – P. 8005-8009.
Bellamy R., Hill A. V. S. Genetic susceptibility to mycobacteria and other infectious pathogens in humans // Curr. Opin. Immunol. – 1998. – Vol. 10. – P. 483-487.
Bellamy R., Ruwende C., Corrah T. et al. Assessment of the interleukin 1 gene cluster and other candidate gene polymorphisms in host susceptibility to tuberculosis // Tuber. Lung. Dis. – 1998. – Vol. 79(2). – P. 83-89.
Bellamy R., Ruwende C., Corrah T. et al. Tuberculosis and chronic hepatitis B virus infection in Africans and variation in the vitamin D receptor gene // J. Infect. Dis. – 1999. – Vol. 179. – P. 721-724.
Bellamy R., Ruwende C., Corrah T. et al. Variations in the NRAMP1 gene and susceptibility to tuberculosis in west Africans // N. Engl. J. Med. – 1998. – Vol. 338(10). – P. 640-644.
Blackwell J. M., Barton C. H., White J. K. et al. Genetic regulation of leishmanial and mycobacterial infections: the Lsh/lty/Bcg gene story continues // Immunol. Lett. – 1994. – Vol. 43. – P. 99-107.
Blackwell J. M., Barton C. H., White J. K. et al. Genomic organisation and sequence of the human NRAMP gene: identification and mapping of a promoter region polymorphism // Mol. Med. – 1995. – Vol.1. – P. 194-205.
Blackwell M. J., Searle S. Genetic regulation of macrophage activation: understanding the function of Nramp1 (= Ity/Lsh/Bcg ) // Immunol. Lett. – 1999. – Vol. 65. – P. 73-80.
Bornman L., Campbell S. J., Fielding K. et al. Vitamin D receptor polymorphisms and susceptibility to tuberculosis in west Africa: a case-control and family study // J. Infect. Dis. – 2004. – Vol. 190(9). – P. 1631-1641.
Bradley D. J. Regulation of Leishmania populations within the host. II. Genetic control of acute susceptibility of mice to Leishimania donovani infection // Clin. Exp. Immunol. – 1977. – Vol. 30. – P. 130-140.
Brightbill H. D., Libraty D. H., Krutzik S. R. et al. Host defense mechanisms triggered by microbial lipoproteins through toll-like receptors // Science. – 1999. – Vol. 285. – P. 732-736.
Cadranel J., Hance A. J., Milleron B. et al. The production of 1,25(OH)2D3 by cells recovered by bronchoalveolar lavage and the role of this metabolite in calcium homeostasis // Am. Rev. Respir. Dis. – 1988. – Vol. 138. – P. 984-989.
Canonne-Hergaux F., Gruenheid S., Govoni G., Gros P. The Nramp1 protein and its role in resistance to infection and macrophage function // Proc. Assoc. Am. Physicians. – 1999. – Vol. 111(4). – P. 283-289.
Cellier M., Belouchi A., Gros P. Resistance to intracellular infections: comparative genome analysis of NRAMP // Trends Genet. – 1996. – Vol. 92. – P. 201-204.
Cellier M., Govoni G., Vidal S. et al. Human natural resistance-associated macrophage protein: cDNA cloning, chromosomal mapping, genomic organization, and tissue-specific expression // J. Exp. Med. – 1994. – Vol. 180. – P. 1741-1752.
Cellier M., Bergevin I., Boyer E. et al. Polyphyletic origins of bacterial Nramp transporters // Trends Genet. – 2001. – Vol. 17. – № 7. – P. 365-370.
Cervino A. C. L., Lakiss S., Sow O. et al. Fine mapping of a putative tuberculosis – susceptibility locus on chromosome –15q11-13 in African families // Hum. Mol. Genet. – 2002. – Vol. 11. – P. 1598-1603.
Cervino A. C. L., Lakiss S., Sow O., Hill A. V. S. Allelic association between the NRAMP1 gene and susceptibility to tuberculosis in Guinea – Conakry // Ann. Hum. Genet. – 2000. – Vol. 64. – P. 507-512.
Chan T. Y. Vitamin D deficiency and susceptibility to tuberculosis // Calcif. Tissue. Int. – 2000. – Vol. 66(6). – P. 476-478.
Chensue S. W., Davey V. P., Remick D. G., Kunkel S. L. Release of interleukin-1 by peripheral blood mononuclear cells in patiens with tuberculosis and active inflammation // Infect. Immun. – 1986. – Vol. 52, № 1. – P. 341-343.
Comstock G. W. Tuberculosis in twins: a reanalysis of the Prophit study // Am. Rew. Respir. Dis. – 1978. – Vol. 117. – P. 621-624.
Cooper A. M., Kipnis A., Turner J. et al. Mice lacking bioactive IL-12 can generate protective, antigen-specific cellular responses to mycobacterial infection only if the IL-12 p40 sub>unit is present // J. Immun. – 2002. – Vol. 168. – P. 1322-1327.
Cooper A. M., Magram J., Ferrante J., Orme I. M. Interleukin 12 (IL-12) Is crucial to the development of protective immunity in mice intravenously infected with Mycobacterium tuberculosis // J. Exp. Med. - 1997. - Vol. 186(1). - P. 39-45.
Davies P. D., Brown R. C., Woodhead J. S. Serum concentrations of vitamin D metabolites in untreated tuberculosis // Throax. – 1985. – Vol. 40. – P. 187-190.
Denis M. Killing of Mycobacterium tuberculosis within human monocytes: activation by cytokines and cacitriol // Clin. Exp. Immunol. – 1991. – Vol. 84. – P. 200-206.
Dorman S. E., Holland S. M. Interferon-γ and interleukin-12 pathway defects and human disease // Cytokine Growth Factor Rev. - 2000. - Vol. 11. - P. 321-333.
Edwards J. H. Familial predisposition in man // Brit. Med. Bull. – 1969. – V. 25. – P. 58-64.
Falconer D. S. The inheritance of liability to certain diseases, estimated from the incidence among relatives // Ann. Hum. Genet. – 1965. – V. 29. – P. 51-76.
Fine P. E. M. Immunogenetics of susceptibility to leprosy, tuberculosis and leishmaniasis: An epidemiological perspective // Int. J. Leprosy. – 1981. – Vol. 49. – P. 437-454.
Flynn J. L., Goldstein M. M., Triebold K. J. et al. IL-12 increasis resistance of BALB/c mice to mucobacterium tuberculosis infection // J. Immunol. – 1995. – Vol. 155. – P. 2515-2524.
Flynn J. L., Chan J., Triebold K. J. et al. An essential role for interferon gamma in resistance to mucobacterium tuberculosis infection // J. Exp. Med. – 1993. – Vol. 178. – P. 2249-2254.
Forget A., Skamene B., Gros P. et al. Differences in response among inbred strains of mtce to infection with small doses of mycobacterium bovis (BCG) // Infect. Immun. – 1981. – Vol. 32. – P. 42-50.
Gao P. S., Fujishima S., Mao X.-Q. et al. Genetic variants of NRAMP1 and active tuberculosis in Japanese populations // Clin. Genet. - 2000. – Vol. 58. – P. 74-76.
Giovine F. S., Takhsh E., Blakemore A. I. F., Duff G. W. Single base polymorphism at-511 in the human interleykin-1β gene // Hum. Mol. Genet. – 1993. – Vol. 1. – P. 450.
Golli V., Ghitulescu I., Ionescu N. et al. Clinical and epidemiological significance of isolated culture Koch bacillus after conclusion of chemotherapy // Pneumoftiziol. – 1981. – Vol. 30, №1. – Р. 55-58.
Govoni G., Gros P. Macrophage NRAMP1 and its role in resistanse to microbial infections // Inflam. Res. – 1998. – Vol. 47, №7. – P. 277-284.
Govoni G., Vidal S., Gauthier S. et al. The Bcg/Ity/Lsh Locus: genetic transfer of resistance to infections in C57BL/6J mice transgenic for the Nramp1Gly169 allele // Infect. Immun. – 1996. – Vol. 64. – P. 2923-2929.
Greenwood C. M. T., Fujiwara T. M., Boothroyd L. J. et al. Linkage of tuberculosis to chromosome 2q35 loci, including NRAMP1, large aboriginal canadian family // Am. J. Hum. Genet. – 2000. – Vol. 67. – P. 405-416.
Griffin M. D., Xing N., Kumar R. Vitamin D and its analogs as regulators of immune activation and antigen presentation // Annu. Rev. Nutr. – 2003. – Vol. 23. – P. 117-145.
Gros P., Skamene E., Forget A. Genetic control of natural resistance to Mycobacterium bovis (BCG) in mice // J. Immunol. – 1981. – Vol. 127, №6. – P. 2417-2421.
Gruenheid S., Gros P. Genetics susceptibility to intracellular infections: Nramp1, macrofage function and divalent cations transport // Curr. Opin. Microbiol. – 2000. – Vol. 3. – P. 43-48.
Gruenheid S., Pinner E., Desjardins M., Gros P. Natural resistance to infection with intracellular pathogens: the Nramp1 protein is recruited to the membrane of the phagosome // J. Exp. Med. – 1997. – Vol. 185. – P. 717-730.
Hall M. A., McGlinn E., Coakley G. et al. Genetic polymorphism of IL-12 p40 gene in immunemediated disease // Genes and Immunity. – 2000. – Vol. 1. – P. 219-224.
Hara H., Matsushima T., Soejima R. et al. A tuberculosis epidemic. An outbreak of cases in a furniture company // Kekkaku. - 1982. – Vol. 57, №9. – P. 491-496.
Hill A. V. S. Genetics and genomics of infectious disease susceptibility // Brit. Med. Bull. – 1999. – Vol. 55, №2. – P. 401-413.
Hill A. V. S. The immunogenetics of human infectious disease // Annu. Rev. Immunol. – 1998. – Vol. 16. – P. 593-617.
Hill W. G. Estimation of linkage disequilibrium in random mating populations // Hereditary. – 1974. – Vol. 33. – P. 229-479.
Jabado N., Jankowski A., Dougaparsad S. et al. Natural resistance to intracellular infections: natural resistance-associated macrophage protein 1 (NRAMP1) functions as a pH-dependent manganese transporter at the phagosomal membrane // J. Exp. Med. – 2000. – Vol. 192, № 9. – P. 1237-1247.
Jackett P. S., Aber V. R., Lowrie D. B. Virulence of Mycobacterium tuberculosis and susceptibility to peroxidative killing systems // J. Gen. Microbiol. – 1978. – Vol. 107(2). – P. 273-278.
Kallman F. J., Reisner D. Twin studies on the significance of genetic factors in tuberculosis // Am. Rev. Tuberc. – 1942. – Vol. 47. – P. 549-574.
Kameda K., Kuchii N., Horii F. et al. A study on the family contacts examination of tuberculosis patients // Kekkaku. – 1983. – Vol. 58, №1. – P. 33-37.
Kindler V., Sppino A. P., Grau G. E. et al. The inducing role of tumor necrosis factor in the daveloptment of bactericidal granulomas during BCG infection // Cell. – 1989. – Vol. 56. – P. 731-740.
Knight J. C., Kwiatkowski D. Inherited variability of tumor necrosis factor production and susceptibility to infectious disease // Proc. Assoc. Am. Physicians. – 1999. – Vol. 111. – № 4. – P. 290-298.
Kramnik I., Dietrich W. F., Demant P., Bloom B. R. Genetic control of resistance to experimental infection with virulent Mycobacterium tuberculosis // Proc. Natl. Acad. Sci. USA. – 2000. – Vol. 97(15). – P. 8560-8565.
Labuda M., Ross M. V., Fujiwara T. M. et al. Two hereditary defects related to vitamin D metabolism map to the same region of human chromosome 12q.II // Cytogenet. Cell Genet. – 1991. - Vol. 58. – P. 1978.
Lahiri D. K., Bye S., Nunberg J. I. et al. Anon-organic and non-enzymatic eztraction method gives higher yields of genomic DNA from whole-blood samples than do nine other methods used // J. Biochem. Biophys. Methods. – 1992. – Vol. 25. – P. 193-205.
Liu J., Fujiwara T. M., Buu N. T. et al. Identification of polymorphisms and sequence variants in the human homologue of the mouse natural resistance – associated macrophage protein gene // Am. J. Hum. Genet. – 1995. – Vol. 56. – P. 845-853.
Liu W., Cao W. C., Zhang C. Y. et al. VDR and NRAMP1 gene polymorphisms in susceptibility to pulmonary tuberculosis among the Chinese Han population: a case-control study // Int. J. Tuberc. Lung Dis. – 2004. – Vol. 8(4). – P. 428-434.
Lurie M. B., Zappasodi P., Dannenberg A. M., Weiss G. H. On the mechanism of genetic resistance to tuberculosis and its mode of inheritance // Am. J. Hum. Genet. – 1952. – Vol. 4. – P. 302-314.
Lynch C. J., Pierce-Chase C. H., Dubos R. A genetic study of susceptibility to experimental tuberculosis in mice infected with mammalian tubercle bacilli // J. Exp. Med. – 1965. – Vol. 121. – P. 1051-1070.
Malo D., Vogan K., Vidal S. et al. Haplotype mapping and sequence analysis of the mouse Nramp gene predict susceptibility to infection with intracellular parasites // Genomics. – 1994. – Vol. 23. – P. 51-61.
Marquet S., Lepage P., Hudson T. J. et al. Complete nucleotide sequence and genomic structure of the human NRAMP1 gene region on chromosome region 2q35 // Mamm. Genome. – 2000. – Vol. 11. – P. 755-762.
Mohan V. P., Scanga C. A., Yu K. Effects of Tumor Necrosis Factor alpha on host immune respons in chronic persistent tuberculosis: possible role for limiting Pathology // Infect. Immun. – 2001. - № 3. – P. 1847-1855.
Myrvik Q., Leake E. Wright M. Disruption of fhagosomal membranes of normal alveolar macrophages by the H37Rv strain of M. tuberculosis. A correlate of virulence // Am. Rev. Resp. Dis.— 1984. — Vol.129. – P.322-328.
Nei M. Molecular population genetics and evolution. – New York, Amsterdam: North-Holland publishing companu, Oxford American Elsevier publishing company, 1975. – 288 p.р.
Nelson N. Metal ion transporters and homeostasis // EMBO J. – 1999. – Vol. 18. – P. 4361-4371.
Nicklin M. J. H., Weith A., Duff G. W. A physical map of the region encompassing the human interleykin-1-alpha, interleykin-1-beta, and interleykin-1 receptor antagonist genes // Genomics. – 1994. – Vol. 19. – P. 382-384.
Noben-Trauth N., Schweitzer P. A., Johnson K. R. et al. The interleukin-12 beta sub>unit (p40) maps to mouse chromosome 11 // Mamm. Genome. – 1996. – Vol. 7. – P 392.
North R. J., Medina E. How important is Nramp1 in tuberculosis? // Trends Microbiol. – 1998. – Vol. 6, №11. – P. 441-443.
Oppmann B., Lesley R., Blom B. et al. Novel p19 protein engages IL-12p40 to form a cytokine, IL-23, with biological activites similar as distinct from IL-12 // Immunity. – 2000. – Vol. 13. - P. 715-725.
Orme I. M., Cooper A. M. Cytokine / chemokine cascades in immunity to tuberculosis // Immunol. Today. – 1999. – Vol. 20. – P. 307-311.
Ottenhoff T. H. M., Verreck F. A. W., Lichtenauer-Kaligis E. G. R. et al. Genetics, cytokines and human infectious disease: lessons from weakly pathogenic mycobacteria and salmonellae // Nature Genetics. – 2002. - Vol. 32. – P. 97-104.
Patterson D., Jones C., Hart I. et al. The human interleukin-1 receptor antagonist (IL1RN) gene is located in the chromosome 2q14 region // Genomics. – 1993. – Vol. 15. – P. 173-176.
Pearce N. What does the odds ratio estimate in a case-control study? // Int. J. Epidemiol. – 1993. – Vol. 26 № 6. – P. 1189-1192.
Pоciot F., Molving J., Wogensen L. et al. A TaqI polymorphism in the human interleykin-1 beta (IL-1 beta) gene correlates with IL-1 beta sacretion in vitro // Eur. J. Clin. Invest. – 1992. – Vol. 22. – P. 396-402.
Rigby W. F. The immunobiology of vitamin D // Immunol. Today. – 1988. – Vol. 9. – P. 54-58.
Rook G. Role of activated macrophages in the immunopathology of tuberculosis // Brit. Med. Bull.— 1988.— Vol.44, №3.— P.611—623.
Rook G., Steele J., Fraher L. et al. Vitamin D3, gamma interferon, and control of mucobacterium tuberculosis by human monocytes // Immunology. – 1986. – Vol. 57. – P. 159-163.
Roth D. E., Soto G., Arenas F. et al. Association between vitamin D receptor gene polymorphisms and response to treatment of pulmonary tuberculosis // J. Infect. Dis. – 2004. – Vol. 190(5). – P.920-927.
Ryu S., Park Y. K., Bai G. H. et al. 3’UTR polymorphisms in the NRAMP1 gene are associated with susceptibility to tuberculosis in Koreans // Int. J. Tuberc. Lung Dis. – 2000. – Vol. 4, № 6. – P. 577-580.
Schlesinger L. S. Entry of Mycobacterium tuberculosis into mononuclear phagocytes // Curr. Top. Mycrobiol. Immunol. – 1996. – Vol. 215. – P. 71-96.
Schlesinger L. S. Role of mononuclear phagocytes in M. tuberculosis pathogenesis // J. Invest. Med. – 1996. – Vol. 44. – P. 312-323.
Selvaraj P., Kurian S. M., Uma H. et al. Influence of non-MHC genes on lymphocyte response to Mycobacterium tuberculosis antigens and tuberculin reactive status in pulmonary tuberculosis // Indian J. Med. Res. – 2000. – Vol. 112. – P. 86-92.
Servaraj P., Narayanan P. R., Reetha A. M. Association of vitamin D receptor genotypes with the susceptibility to pulmonary tuberculosis in femele patients and resistance contacts // Indian J. Med. Res. – 2000. – Vol. 111. – P. 172-179.
Sevaraj P., Narayanan P. R., Reetha A. M. Association of functional mutant homozygotes of the mannose binding protein gene with susceptibility to pulmonary tuberculosis in India // Tuberc. Lung. Dis. – 1999. – Vol. 79. – P. 221-227.
Sieburth D., Fabs E. W., Warrington J. A. et al. Assignment of NKSF/IL-12, a unique cytokine composed of two unrelated sub>units, to chromosomes 3 and 5 // Genomics. – 1992. – Vol. 14. – P. 59-62.
Skamene E., Kongshavn P. A. L., Landy M. Genetic control of natural resistance to infection and malignancy – New York: Academic Press.,1980. – 280 p.р.
Skamene E. The Bcg gene story // Immunobiology. – 1994. – Vol. 191. – P. 451-460.
Soborg C., Andersen A. B., Madsen H. O. et al. Natural resistance-associated macrophage protein 1 are associated with microscopy-positive tuberculosis // J. Infect. Dis. – 2002. – Vol. 186 - № 4. – P. 517-521.
Spielman R. S., McGinnis R. E., Ewens W. J. Transmission test for linkage disequilibrium: the insulin gene region and insulin-dependent diabetes mellitus (IDDM) // Am. J. Hum. Genet. – 1993. – Vol. 52. – P. 506-516.
Spielman R. S., Ewens W. J. The TDT and other family-based tests for linkage disequilibrium and association // Am. J. Hum. Genet. – 1996. – V. 59. – P. 983-989.
Stead W. W. Genetics and resistance to tuberculosis: could resistance be enhanced by genetics engineering? // Ann. Int. Med. – 1992. – Vol. 116. – P. 937-941.
Stead W. W., Senner J. W., Reddick W. T., Lofgren J. P. Racial differences in susceptibility to infection by Mycobacterium tuberculosis // N. Engl. J. Med. – 1990. – Vol. 322. – P.422-427.
Tarlow J. K., Blakemore I. F., Lennard A. et al. Polymorphism in human IL-1 receptor antagonist gene intron 2 is caused by variable numer of an 860-bp tandem repeat // Hum. Genet. – 1993. – Vol. 91. – P. 403-404.
Uitterlinden A. G., Fang Y., Meurs J. B. et al. Genetics and biology of vitamin D receptor polymorphisms // Gene. – 2004. – Vol. 338(2). – P. 143-156.
Vidal S. M., Malo D., Vogan K. et al. Natural resistance to infection with intracellular parasites: isolation of a candidate for Bcg // Cell. – 1993. – Vol. 73, №3. – P. 469-485.
Walker L., Lowrie D. B. Killing of Mycobacterium microti by immunologically activated macrophages // Nature. – 1981. – Vol. 293. – P. 69-71.
Warrington J. A., Bailey S. K., Armstrong E. et al. A radiation hybrid map of 18 growth factor, growth factor receptor, hormone receptor, or neurotransmitter receptor genes on the distal region of the long arm of chromosome 5 // Genomics. – 1992. – Vol. 13. – P. 803-808.
Warrington J. A., Bengtsson U. High-resolution physical mapping of human 5q31-q33 using three methods: radiation hybrid mapping, interphase fiuorescence in situ hybridization, and pulsed-field gel electrophoresis // Genomics. – 1994. – Vol. 24. – P. 395-398.
Wilkinson R. J., Lieweiyn M., Toossi Z. et al. Influence of vitamin D deficiency and vitamin D receptor polymorphisms on tuberculosis among Gujarati Asians in west London: a case-control study // Lancet. – 2000. – Vol. 355. – P. 618-621.
Wilkinson R. J., Patel P., Llewelyn M. et al. Influence of Polymorphism in the Genes for the Interleukin (IL)-1 Receptor Antagonist and IL-1β on Tuberculosis // J. Exp. Med. – 1999. – Vol. 189 (12). – P. 1863-1873.
Yang Y. S., Kim S. J., Kim J. W., Koh E. M. NRAMP1 gene polymorphisms in patients with rheumatoid arthritis in Koreans // J. Korean Med. Sci. – 2000. - № 15. – P. 83-87.
Zaahl M. G., Robson K. J. H., Warnich L. et al. Expression of SLC11A1 (NRAMP1) 5’-(GT)n repeat: Opposite effect in the presence of - 237C → T // Blood Cells, Molecules, and Diseases. – 2004. – Vol. 33. – P. 45-50.
 NRAMP1
NRAMP1 IL1RN
IL1RN