Оптимізація інтегрованого захисту посівної цибулі від шкідників на основі виділення головних екологічних та економічних чинників та застосування нових агентів біологічного методу
ВСТУП
Актуальність теми. Оптимізація інтегрованого захисту овочевих культур від шкідників є основою для екологізації цієї галузі рослинництва. Це тим більш важливо, що відносно овочевої продукції постійно підвищуються санітарні та екологічні вимоги.
Оптимізація захисту рослин стала найбільш актуальною в останні роки, про що свідчить значна література, присвячена цій проблемі. За різного відсотку насичення біометодом у системі захисту відбуваються певні зміни, що впливає на загальну ефективність обраної тактики. Дослідження їх дозволяє не тільки окреслити основні підходи до захисту тієї чи іншої культури протягом тривалого періоду, але й спрогнозувати підсумковий економічний результат за умов надання переваги хімічному або біологічному методу диференціюючи їх за ступенем насиченості. Таким чином, цей підхід є важливим етапом розробки стратегії і тактики регулювання чисельності шкідників, що особливо відчутно в умовах пошуку компромісу між біологічним та хімічним методами.
Актуальність питання для інтегрованого захисту очевидна, оскільки саме порогові рівні дають можливість управління фітосанітарною обстановкою в агроценозах.
Таким чином, всі названі оптимізаційні напрямки є важливими в сучасних технологіях інтегрованого захисту рослин і спрямованими на поглиблення його екологізації.
Мета і завдання досліджень. Обгрунтування оптимізації інтегрованого захисту посівної цибулі від шкідників на основі виділення головних екологічних та економічних чинників та застосування нових агентів біологічного методу.
Відповідно до поставленої мети вирішували такі завдання:
- випробовувати Фітоспорин, мікробіологічний препарат, діючою речовиною якого є живі клітини і спори бактерії Bacillus sub>tilis 26Д 1 млрд. кл/мл.;
- випробовувати Гаупсин, Бактофіт, Трихдермін-Р;
- побудувати модель оздоровлення агроценозу посівної цибулі від забруднюючих факторів.
Об’єкти досліджень. Посівна цибуля, біопрепарати Фітоспорин, Гаупсин, Бактофіт, Трихдермін-Р
Предмет досліджень. Ефективність біопрепаратів щодо підвищення урожайності цибулі посівної та захисту її від шкідників.
Практичне значення одержаних результатів.
Побудовано екологізовані сівозміни вирощування цибулі посівної в Лісостепу України з урахуванням використання біологічних препаратів
РОЗДІЛ 1.
ЛІТЕРАТУРНИЙ ОГЛЯД
1.1 Основні напрями розвитку світового біотехнологічного бізнесу
Найбільший розвиток біотехнологія отримала у 20 сторіччі і у першу чергу завдяки відкриттю антибіотиків. У 1896 році Б. Гозіо з грибків виділив перший антибіотик, який назвав “мікофеноловою” кислотою; подальше його вивчення провів Е. Дюшен. У 1913 році К. Айсберг виділив пеніцилінову кислоту, а у 1928 А. Флемінг зробив опис культури пеніцилюма. В подальшому було створено перший промисловий антибіотик – пеніцилін. Економічна важливість антибіотиків наочно проявляється у вартості світового збуту чотирьох найбільш поширених груп антибіотиків – пеніцилінів, цефалоспоринів, тетрациклінів та еритроміцинів – вже у 1978 році вона складала 42 млрд. дол. США. З них близько по 1 млрд. дол. складала частка пеніцилінів та тетрациклінів, 500 млн. дол. – цефалоспоринів. У 1980 році світове виробництво антибіотиків складало приблизно 25 тис. т (Сассон, 1987).
Починаючи з середини 60-х років 20 сторіччя, у зв’язку з зростаючою складністю виділення ефективних антибіотиків і поширенням стійкості до сполук, які набули найбільшого поширення, у великої кількості патогенних бактерій, дослідники перейшли від пошуку нових антибіотиків до модифікації структури тих, що вже існували. До 1974 року виробництво напівсинтетичних антибіотиків сягнуло 28,5 тис. т. Крім останніх до 80-х років значний розвиток отримало і біотехнологічне виробництво первинних метаболітів, ферментів, капсульних полісахаридів.
Подальший розвиток біотехнології найтісніше пов’язаний з методами генної інженерії і цікаво простежити становлення цього бізнесу на прикладі США, як сучасного лідера у виробництві біотехнологічної продукції.
За обсягами продукції та числу зареєстрованих патентів США поруч з Японією займають перше місце у переліку країн де біотехнологічна промисловість успішно розвивається.
З 1978 року федеральний уряд США підтримує різні біотехнологічні дослідження, особливо пов’язані з рекомбінантними ДНК. Так, Національний інститут здоров’я уклав тільки в період з 1978 по 1985 рік 365 контрактів відносно досліджень в цій галузі на загальну суму 42 млн. дол. У 1975 –1980 рр. у 25 компаній, що займалися генною інженерією було вкладено більше як 266 млн. дол. За період 1979 – 1982 рр. число таких компаній зросло до 145. Особливих успіхів у застосуванні і розробці технологій, що пов’язані з рекомбінантними ДНК, досягли компанії “Цетус” (1971), “Генентек” (1976), “Генекс” (1977) та “Біоген” (1978), загальні фонди яких у 1980 році перевищували 400 млн. дол. Поруч з названими чотирма компаніями в США було створено цілу низку біотехнологічних фірм. Крім того, більшість фармацевтичних підприємств оволоділи методами генної інженерії. Так, дослідницькі програми фірми “Елі Ліллі” були тісно пов‘язані з ферментацією, сільським господарством та медициною; “Пфіцер” і “Хофман – Ла Рош” активно працювали над створенням інтерферону; “Ліджон” зосередила зусилля на покращенні методів бродіння і виробництва антибіотиків; лабораторії “Г.Д. Серл” вели дослідження в галузі вірусології; компанія “Дюпонт” з 1979 року проводила дослідницьку програму пов‘язану з генетикою включаючи розвиток методів рекомбінантної ДНК (Сассон, 1987).
У середині 80-х років 20 сторіччя намітилася тенденція до перебудови і концентрації біотехнологічної промисловості. Так, у 1980-1981 роках у цю галузь було вкладено близько 1,5 млрд. дол. США. До кінця цього періоду ситуація на ринках збуту сприяла діяльності молодих, технологічно озброєних компаній. Однак, вже до кінця 1983 року 50 компаній з 150 припинили своє існування. Успіх мали лише ті, що змогли концентрувати свої зусилля на вузьких галузях з потенціальними можливостями для розширення, впливати на ціни своєї продукції захопивши не менше 70–80% ринку та випускати високо специфічні і патентно здатні продукти.
Розуміння необхідності пошуку нових ніш у біотехнологічному бізнесі призвело до того, що сфера діяльності багатьох компаній переорієнтувалася з фармацевтики і медицини у сільське господарство, зокрема, в рослинництво, де основними задачами були підвищення урожайності, прискорення росту культур та стійкість до шкідників і хвороб. Саме в цій галузі стали працювати компанії “Еллайд кемікалз”, “Дау” та “Дюпонт”. Серед фармацевтичних фірм “Еллі Ліллі” відводила 35% свого бюджету на агрономічні дослідження. Фірма “Атлантік річфілд” створила в Дубліні (США) науково-дослідний інститут з питань культури рослинних клітин. “Сіба” проводила біотехнологічні дослідження силами своєї фармацевтичної групи і надавала фінансову допомогу подібним дослідам інших компаній. Нафтова корпорація “Оксідентайл ойл” придбала компанію “Зоекон”, головним напрямком діяльності якої було дослідження проблем біологічного контролю. “Монсанто” у 1981 році відкрила молекулярно–біологічне відділення з науковим центром у Сент – Луїсі (США). Завданням центру були дослідження саме в області агрономії. Таким чином, у 1981 році загальна кількість компаній, що застосовували біотехнологічні підходи до розвитку сільського господарства перевищувала 50 (Сассон, 1987).
Крім того, і біотехнологічні компанії так званої “першої хвилі” перенесли частину своїх досліджень в сферу агробіології. Фірма “Цетус”, наприклад, спеціально для вирішення біотехнологічних задач створила відповідну лабораторію. Основні фірми, які займалися виробництвом сортового насіння, також зацікавилися подібними дослідженнями. Так, “Пайонір хібред інтернейшел”, один з найбільших виробників гібридного насіння кукурудзи, організувала мікробіологічне відділення.
Наслідком подібної активізації біотехнологічного бізнесу стало те, що в галузі захисту рослин і рослинництва було створено цілу серію біопрепаратів, які містили в якості активних речовин бактерії, віруси, гриби, нематоди, протозоа; розроблено технології напрацювання ентомофагів та виробництва феромонів, регуляторів росту комах та рослин, екстрактів рослин і врешті решт – створено трансгенні рослини.
Взагалі, світовий збут біопестицидів у 1990 році оцінювався у розмірі 120 млн. дол. США, що складало 0,5% всього обсягу світового ринку агрохімії і вартість якого на той же момент становила 24 млн. дол.. США. З цієї кількості близько 90% збуту біопестицидів представлено бактерією Bacillus thuringiensis – це 1–2% світового ринку інсектицидів. (Про популярність препаратів на основі Bacillus thuringiensis говорять і дані щодо кількості зареєстрованих торгових марок в деяких країнах: в США – 180, в країнах Європейської співдружності – 120, при тому що перший Bt–препарат було зареєстровано лише у 1961 році).
За оцінками експертів, збут біопестицидів зростає на 10–20% щорічно і у 2000 році, на думку деяких аналітиків повинен був сягнути 1 млрд. дол. США (Neale, 1997). Однак, дійсні масштаби виробництва і реалізації біопестицидів дещо інші і за останніми даними, мають наступний вид (табл. 1.1).
Таблиця 1.1 Світові обсяги виробництва засобів захисту рослин від шкідливих комах
Засоби захисту |
Виробництво по роках, млн. дол. США |
||
|
1991 |
1996 |
2001 |
|
|
Мікробіологічні препарати |
157 |
219 |
318 |
|
Ентомопатогенні нематоди |
4 |
30 |
70 |
|
Хижаки, паразити |
35 |
47 |
60 |
|
БАР–феромони, кайромони тощо |
60 |
80 |
158 |
|
Рослинні препарати |
70 |
81 |
90 |
|
Всього |
326 |
457 |
696 |
|
Хімічні інсектициди |
9358 |
9597 |
9212 |
|
Всього |
9634 |
10054 |
9908 |
Потрібно сказати, що на сьогодні у світі зацікавленість у засобах захисту рослин, які виробляються на основах біотехнологічних процесів, значно зросла. Традиційно висока частка в цьому асортименті належить біоінсектицидам. В більшості країн фундаментальні і прикладні проблеми біометоду вирішуються на рівні національних програм. Досягнутий рівень біологізації рослинництва коливається від 1,5–2,0% (США) до 9-10% (Швеція), але в середньому щорічно збільшується на 4-5%. В Німеччині, Англії, Швеції на значних площах сільськогосподарських угідь реалізована ідея повної відмови від застосування засобів хімізації сільського господарства на основі впровадження принципів біологізації землеробства з метою виробництва гарантовано екологічно чистої продукції рослинництва і тваринництва (НТП УААН “Розробити ... основи розвитку промисловості по виробництву засобів біологізації ... , 1999).
Асортимент біопрепаратів дуже широкий. Так, наведемо лише основні, найбільш відомі препарати: дипел, біоград, біотрол (США), бактоспеін (Франція), біоспор 2802 (Німеччина), турінжин (Румунія), бактуцид, екзобак (Італія), бацилін (Польща), ентеробактерін, дендробацилін, бітоксібацилін, БІЛ, гомелін, лепідоцид, бактокуліцид (Росія, країни СНД) (Патыка и др., 1998).
Велику роль у сучасному біотехнологічному бізнесі відіграють трансгенні рослини. На сьогодні Bt–захищена картопля, бавовник та кукурудза введені у практику комерційного сільського господарства США, ці культури вирощуються в Канаді, Мексиці, Аргентині, Австралії, Китаї, Іспанії, Франції, Португалії, Південній Африці, Росії та Румунії. На протязі останніх років виробники сільськогосподарської продукції перейняли ці рослини в якості ефективного способу збільшення урожаїв і ведення стабільного господарства. В США загальна площа під трансгенним бавовником, кукурудзою та картоплею у 1998 році перевищувала 2,71 млн. га, що склало 17% загальних площ під бавовником, 18% – під кукурудзою і 4% – під картоплею (табл.1.2).
Загальна ж площа під трансгенними культурами у всьому світі зросла з 1,7 млн. га у 1996 році до 50 млн. га у 2009 (табл.1.3).
Таблиця 1.2 Посівні площі під трансгенними культурами в США у 2009 р.
|
Культура |
Посівна площа, млн. акр. |
Частка від загальної посівної площі,% |
|
Кукурудза на зерно |
5,83 |
18 |
|
Бавовник |
0,93 |
17 |
|
Картопля |
0,02 |
4 |
Серед компаній, які створюють трансгенні культури лідером є “Монсанто”. До її активу входять сорти картоплі групи Новий Лист – Рассет Бербанк, Суперріор, Атлантік, стійкі до колорадського жука, сорти сої, бавовнику, цукрових буряків, ріпаку, тютюну та кукурудзи стійкі до гербіцидів. Крім того готуються до виходу на ринок такі екзотичні модифікації, як блакитний бавовник, фрукти, що містять більшу кількість вітамінів у порівнянні до звичайних, картоплю з незначним вмістом води – така властивість дозволить економити олію при смаженні.
Таблиця 1.3 Площі зайняті трансгенними культурами у світовому масштабі
|
Рік |
Площі, млн. га |
|
1996 |
1,7 |
|
1997 |
11,0 |
|
1998 |
28,8 |
|
1999 |
39,9 |
|
2000 |
44,2 |
|
2009 |
50,0 |
Так, ще у 1987 році на дослідній станції “Монсанто” було проведено польові випробування на стійкість генетично модифікованих рослин тютюну до гліфосату. У 1988 – випробовували генетично змінені сорти томатів з підвищеною стійкістю до шкідників.
На початку 1998 року тільки в США посіви трансгенних сортів сої фірми “Монсанто” займали 14%, а до кінця того ж року їх планувалося збільшити до 30%, трансгенні сорти бавовнику цієї ж компанії у 1997 році вирощувалися на 13,5% площ під цією культурою. Взагалі ж “Монсанто” вирощує більш як 30 видів культурних рослин з зміненою ДНК. Серед інших компаній, які працюють в цій галузі можна назвати найбільших виробників генетично зміненої кукурудзи – “Новартіс сідс” (у складі “Сенгента”); “Сіба сідс АГ” (Bt –176); “Нортруп Кінг” (раніш “Сандос”) (Bt –11).
Таким чином, ми коротко розглянули основні етапи історії біотехнологічного бізнесу з давнини до наших днів і можемо бачити як він розвивався разом з науково-технічним прогресом.
1.2 Історія зародження мікробіологічного методу регулювання чисельності шкідливих комах в Україні
Виникнення і початок розвитку мікробіологічного методу регулювання чисельності шкідників пов’язане насамперед з ім’ям І.І. Мечнікова та його науковими дослідженнями у 70-х роках ХІХ сторіччя (Резник, 1973). Саме в цей період в південних регіонах Росії спостерігалися спалахи розмноження хлібного жука, збитки від якого тільки в період 1870 – 1880 рр. склали 100 млн. карбованців золотом і на 50% знизили експорт пшениці.
Вивчаючи цього шкідника Мечніков відмітив спорадичну загибель личинок комахи від мікроскопічного пліснявого гриба названого ним у 1878 році зеленою мускардиною (Metaerhizium anisopline). До цього часу вже було відоме подібне захворювання, що викликалося білою мускардиною, на тутовому шовкопряді у Франції (вивчення хвороби провів Л.Пастер). Вивчивши вплив погодних умов на ураження комах вчений винайшов ефективний засіб пригнічення популяції хлібного жука шляхом штучного інфікування його збудником мускардинозу (в дослідах гинуло до 70% особин). Вперше про цей метод було оповіщено наукову громадкість на з’їзді представників земств південних губерній, який був скликаний восени 1878 року в Одесі. (Вивчаючи личинок шкідника І.І.Мечніков описав і бактеріальне захворювання, що викликається Bacillus salutarius, одночасно запропонувавши використовувати грунт з трупами личинок для штучного поширення хвороби. У 1879 році вчений зробив доповідь про це на засіданні Новоросійської спілки природників та опублікував брошуру “Хвороби личинок хлібного жука” (Воловник, 1979) та статтю в “Земледельческой газете” “О болезнях свекловичного жука” (Мечников, 1879). Незабаром І.І. Мечніков сумісно з Л.Є. Ценковським, Шабельським, а пізніше і О.О. Ковалевським, розробляє методи напрацювання вказаного мікроорганізму для практичного використання в якості засобу боротьби (Левитский, Ковалевский, 1880; Воловник, 1979; Васильєв, Лісовий, 1996).
Так, був запропонований наступний спосіб напрацювання мускардини: в ящик з грунтом, заселеним ураженими личинками хлібного жука, проводять поступове (по мірі їх загибелі) підселення нових – при цьому підвищується концентрація спор і, відповідно, патогенності субстрату.
І.І. Мечніков винайшов, що Metaerhizium anisopline може добре рости і утворювати спори в цукровому розчині, в висячих краплинах, але забезпечити ріст гриба в великих обсягах рідини не вдавалося. Проблема була вирішена лише коли О.О. Ковалевським (за іншими даними – професором Веріго (Мартиньони, 1964) був запропонований оригінальний метод одержання мускардини на живильному середовищі – стерилізованому пивному суслі.
Роботи по новому методу захисту від шкідників викликали неоднозначну оцінку широких кіл як вчених, так і практиків. Особливо критичне відношення до нього склалося після виступів І.І. Мечнікова і Л.Є. Ценковського на ентомологічному з’їзді 1882 року.
Цікавим буде згадати, що професором Л.Є. Ценковським, відносно хлібного жука, було вперше запропоновано метод оцінки норми витрати грибного препарату на основі мускардини. Щоб визначити необхідну кількість препарату, потрібно на основі значень розмірів (ширини і довжини) окремої спори гриба, розрахувати, скільки спор розміститься в 1 мм2, а потім і на 1 га (1 десятині). За розрахунками професора Деларю, якщо покрити десятину шаром чистого мускардинового борошна у 0,008 мм (подвійна ширина спори), то норма витрати буде становити 0,25–0,20 аршинів3/десятину. При використанні не чистого препарату, а у суміші з наповнювачем (ґрунтом), але отриманого у зразковому розсаднику, професор Зайкевич визначив, що порожнини займають половину всього об’єму кубічної одиниці ґрунту, отже норма витрати такого препарату зросте до 0,4 аршину3/десятину. У випадку, коли використовується препарат отриманий у звичайному розсаднику, і, відповідно, в ньому міститься менше спор, шар його збільшується у 10–30 разів. Так, наприклад, норма витрати для розсадника, концентрація спор гриба вирощеного в якому становить 0,05% зразкового, буде дорівнювати 8 аршинів3/десятину.
Наступний етап пов’язаний з розвитком цукрової промисловості, самому існуванню якої почав загрожувати звичайний буряковий довгоносик, що нечувано розмножився в той час в основних бурякосійних регіонах. Про це свідчать дані щодо розмірів посівів, пересівів та загинувши з вини бурякового довгоносика плантацій цукрових заводів, що входили у склад Всеросійської Спілки цукрозаводчиків (табл. 1.4).
З метою перевірки ефективності нового методу було залучено ентомолога І.М. Красильщика, який у 1883 році прибув у м. Сміла Київської губернії – маєток графа Бобринського – одного з монополістів виробництва цукру, що погодився надати проекту фінансову підтримку, за досить короткий строк опанував основні методики вивчення хвороб комах. Виробництво налагодили тільки в 1884 році, коли І.І.Мечніков винайшов середовище для мускардини – пивне сусло сильно розбавлене водою, а власник маєтку погодився надати одну з будівель під “мускардиновий завод”.
Таблиця 1.4 Деякі дані щодо шкодочинності бурякових довгоносиків на плантаціях цукрових буряків наприкінці ХІХ сторіччя у європейській частині Росії
|
Роки |
Посіяно навесні, дес. |
Пересіяно, дес. |
Знищено і не пересіяно, дес. |
|
1891–1892 |
284162 |
14290 |
10948 |
|
1892–1893 |
281798 |
59056 |
26388 |
|
1893–1894 |
313503 |
27749 |
11170 |
|
1894–1895 |
308668 |
13288 |
4944 |
|
1895–1896 |
317100 |
10547 |
2315 |
|
1896–1897 |
327061 |
17126 |
5590 |
|
1897–1898 |
372501 |
21961 |
8578 |
|
1898–1899 |
408539 |
62952 |
7226 |
|
1899 |
467543 |
дані відсутні |
26083 |
|
В середньому |
28371 |
10771 |
Почалося виробництво мускардини фабричним шляхом з максимальною механізацією процесу. Завдяки методиці, розробленої І.М. Красильщиком, робочі виконували лише дуже прості операції. Засіви здійснювали в герметично закритих металевих плоских і широких чанах. При цьому операції з культивування здійснювалися в замкненій системі труб, непроникних для пилу і сторонніх спор бактерій і грибів. Для запобігання частій стерилізації, свіже стерильне середовище вводили до контейнерів без попередньої їх стерилізації, після збору старого середовища з спорами; грибні спори, які залишалися в сосуді, автоматично давали початок наступній культурі. Ось деякі технологічні дані виробництва, наведені І.М.Красильщиком: між посівом і збором проходило 14–15 діб при 250С, в подальшому цей період, було зменшено до 5–8 діб, на 1 м2 середовища отримували 180–220 г спор (для боротьби з звичайним буряковим довгоносиком на 1 га потрібно було до 8 кг спор, за іншими даними – 4–6 кг або 400–600 кг суміші з сухим піском – на 1 вагову частину брали 99 вагових частин піску). При заводському способі виробництва, при розрахункових потужностях установки на 16 тонн, вартість виробництва кількості мускардини необхідної для захисту 1 га склала б 4 крб., при більших потужностях ця сума була б ще меншою. Відомо, що установка в Смілі виробила за 4 місяці 1884 року 54 кг спор. Таким чином, в результаті нескладних розрахунків легко визначити – в експериментальній установці щоденно функціонувало близько 2,3 м2 поверхні свіжого середовища (Мартиньони, 1964).
Були проведені досліди в скляних садках, які дали чудові результати. Але, так як для виробничого випробовування препарату на 70–100 га потрібно було 400 кг мускардини, то він був відкладений. У 1885 році Спілка цукрозаводчиків асигнувало 10 тис. золотих карбованців на масштабні випробовування, завод було модернізовано. Однак, в результаті кризи су цукрової промисловості програма цих виробничих експериментів не була виконана.
Вдруге питання щодо боротьби з буряковим довгоносиком за допомогою мікробіологічних засобів, або, як тоді називали, мікологічного методу, було піднято у 1900 році. Директор лабораторії Інституту Пастера в Парижі, І. Даниш (Деніч), з асистентом доктором К.Візе та М.Отфіновським, а також декількома помічниками організували на хуторі Миколаївка, поблизу Сміли, по дорученню і за фінансової підтримки Всеросійської Спілки Цукрозаводчиків дослідну ентомологічну станцію, діяльність якої почалася з вивчення грибних захворювань бурякового довгоносика (Васильєв, Лісовий, 1996). Досить цікавою є методика тих дослідів. Так, проводилися вони в особливих клітках з тонкої металевої сітки, розміром до 100 м2, які були поставлені посеред плантації. До одної з кліток було у травні випущено близько 20 пудів довгоносиків обсипаних спорами зеленої мускардини; до другої – близько 50 пудів шкідників заражених білою мускардиною. В результаті при розкопках у вересні виявилося всього лиш 50% уражених комах. Дослідження велися протягом 1900–1901 років і за цей період Даниш опублікував три звіти де відобразив як методи застосування мускардини для боротьби з довгоносиком так і технології штучного напрацювання гриба. Особливу увагу дослідник звернув на норми витрати препарату безпосередньо у сільськогосподарській практиці. Так, він рекомендує притримуватися наступних показників: 4–10 фунтів мускардини на десятину (середня норма) (1,6–4 кг/га) на полях з давньою культурою цукрових буряків при 6-річній сівозміні; мінімальна норма – 2 фунти на десятину (0,8 кг/га) можлива на полях з дуже давньою культурою (більше 30 років) при 3-х річній сівозміні; максимальна норма – близько 20 фунтів (8 кг/га) необхідна для цілинних земель, на полях, зо знаходилися під буряками всього 1–2 рази або в місцях недавньої появи бурякового довгоносика.
У 1927 році І. Ліндеманом на Миронівській дослідній станції були знову повторені досліди зараження бурякових довгоносиків зеленою мускардиною. Одночасно були закладені також і досліди з червоною мускардиною (Sorosporella uvella). Спори вносили у грунт у вигляді порошку у суміші з землею. Кількість порошку зеленої мускардини коливалася від 1 до 58 г/4 м2, червоної – 4,5 – 288 г на ту ж площу. При розкопках наступного року виявилося, що на ділянках, де була внесена червоно мускардина ураження комах грибом підвищилося вдвічі у порівнянні до контролю. Від внесення ж у грунт зеленої мускардини помітного ефекту одержано не було.
Роботи російських вчених зацікавили і закордонних спеціалістів і вже у 1910 році Дж. Росер успішно застосував мускардину проти шкідливої цикадки, К. Фредерікс – проти жука–носорога в 1913, К. Уоленгрен – проти стеблового метелика. У 1911 році проти сарани в Аргентині за допомогою обприскувача Д’Ерель з великим ефектом застосовує бактеріальні культури у нормі 1,5 л/га . У 1918 році бактерії використовують проти непарного шовкопряда.
Велику відомість отримали багаторічні досліди по боротьбі з травневим хрущем, що проводилися у Франції ле–Мулем. Останнім використовувався гриб Botrytis tenella, збудник білої мускардини комах. У 1923 році ле–Муль повідомив про вдалі досліди застосування проти личинок травневого хруща цього збудника, вірулентність якого була посилена шляхом проведення через личинок того ж травневого хруща але в лабораторних умовах. Культура гриба була рекомендована ле–Мулем для боротьби з виноградними листокрутками.
Для масового отримання культури гриба була побудована фабрика. Але виробничі досліди з зараженням травневого хруща культурою, що вироблялася на цьому підприємстві, не виправдала сподівань і були припинені, так як не дивлячись на введення у грунт до 5 кг культури на гектар, не вдавалося викликати штучне зараження личинок травневого хруща.
В подальшому дослідження в цій області стають все більш різноманітними і численними. Життєздатною виявилась, наприклад, ідея М.А. Теленги щодо комбінованого застосування мікроорганізмів з сублетальними дозами інсектицидів (Воловник, 1979).
Незважаючи на те, що справжній розквіт мікробіологічного метода і пов’язаної з ним промисловості був ще попереду наведений історичний екскурс дає можливість оцінити внесок України в цю галузь біотехнології.
1.3 Загальний стан виробництва і застосування мікробних препаратів
Ситуація з виробництвом та застосуванням мікробіологічних препаратів в нашій країні досить складна – постійну реєстрацію має лише декілька препаратів. Таких широковідомих промислових препаратів як бітоксибацилін, лепідоцид, дендробацилін в Україні не виробляють і надходять вони в незначній кількості з Росії та Казахстану. Вітчизняні препарати – боверин та гаупсин до цього часу не отримали поширення внаслідок відсутності реєстрації. Існують незначні потужності для напрацювання триходерміну, призначеного для боротьби з кореневими гнилями.
У 70-80-х роках завдяки широкомасштабним цілеспрямованим дослідженням у колишньому СРСР вдалося створити мережу біолабораторій і біофабрик, зокрема в Україні їх нараховувалося близько 300. Сьогодні ця кількість скоротилася до 100 біолабораторій (табл. 3.1), але й ті що залишилися виробляють переважно ентомофагів. Тим не менше, можливості для застосування біопрепаратів існують і вони добре відомі як вченим так і практикам, а відповідно є і перспектива формування попиту на цю продукцію. Наведемо лише декілька цифр по найбільш відомим препаратам для порівняння (табл. 1.5). Як бачимо, істотно зростають обсяги застосування бітоксибациліну, дендробациліну, ризоплану; падають – боверину, лепідоциду, бактороденциду.
За останніми підрахунками потреба ж України в обсягах захисних заходів з використанням мікробіологічних препаратів, а саме: ризоплану, агату-25к, бактороденциду, лепідоциду, дендробациліну, бітоксибациліну, гаупсину та триходерміну складає 13,88 млн. га (табл. 1.6).
Таблиця 1.5 Наявність біолабораторій в Україні станом на 2000 рік
|
Область |
Всього біолабо-раторій |
Обласні |
Районні госпрозр. |
При тепл. комбінатах |
|
|
бюджетні |
госпрозр. |
||||
|
Республіка Крим |
7 |
1 |
– |
2 |
4 |
|
Вінницька |
11 |
– |
– |
11 |
– |
|
Волинська |
2 |
1 |
– |
– |
1 |
|
Дніпропетровська |
4 |
– |
1 |
3 |
– |
|
Донецька |
2 |
1 |
– |
– |
1 |
|
Житомирська |
3 |
– |
1 |
2 |
– |
|
Закарпатська |
1 |
– |
1 |
– |
– |
|
Запорізька |
1 |
– |
1 |
– |
– |
|
Івано-Франківська |
1 |
1 |
– |
– |
– |
|
Київська |
11 |
– |
– |
9 |
2 |
|
Кіровоградська |
5 |
– |
1 |
4 |
– |
|
Луганська |
– |
– |
– |
– |
– |
|
Львівська |
1 |
1 |
– |
– |
– |
|
Миколаївська |
2 |
– |
1 |
1 |
– |
|
Одеська |
7 |
– |
1 |
6 |
– |
|
Полтавська |
5 |
– |
1 |
4 |
– |
|
Рівненська |
3 |
1 |
– |
2 |
– |
|
Сумська |
4 |
– |
– |
4 |
– |
|
Тернопільська |
4 |
1 |
– |
3 |
– |
|
Харківська |
5 |
1 |
– |
2 |
2 |
|
Херсонська |
4 |
1 |
– |
3 |
– |
|
Хмельницька |
– |
– |
– |
– |
– |
|
Черкаська |
19 |
– |
– |
19 |
– |
|
Чернівецька |
1 |
1 |
– |
– |
– |
|
Чернігівська |
1 |
1 |
– |
– |
– |
|
Всього |
104 |
11 |
8 |
75 |
10 |
Таблиця 1.6 Обсяги застосування найбільш відомих мікробіопрепаратів у 1998 та 2000–2001 роках
|
Препарат |
Обсяги застосування, тис. га |
||
|
1998 |
2000 |
2001 |
|
|
бактороденцид |
937,4 |
420,015 |
506,37 |
|
бітоксибацилін |
2,9 |
6,705 |
1,07 |
|
лепідоцид |
8,8 |
5,82 |
3,66 |
|
дендробацилін |
1,3 |
4,08 |
0,1 |
|
гомелін |
3,4 |
дані відсутні |
дані відсутні |
|
ризоплан |
23,5 |
27,19 |
22,65 |
|
боверін |
4,5 |
0,028 |
дані відсутні |
|
триходермін |
0,14 |
0,098 |
0,03 |
|
бактокумарін |
дані відсутні |
дані відсутні |
1,62 |
|
Всього |
981,94 |
463,836 |
535,5 |
Як бачимо, у порівнянні до 1998 року у 2000 суттєво зростають обсяги застосування бітоксибациліну, дендробациліну, різоплану; падають – боверіну, лепідоциду, бактороденциду. Однак, у 2001 році ситуація стає ще гіршою – майже у 7 разів зменшується застосування бітоксибациліну, у 2 – лепідоциду, у 40 – дендробациліну, у 3 – триходерміну, навіть застосування такого популярного препарату як ризоплан зменшилося на 17%.
Детальна інформація щодо використання мікробіопрепаратів і їх потреби для сільського господарства країни за основними культурами наведена в таблицях 3.3 і 3.4. Як бачимо, мікробіометод на сьогодні застосовується на площі 0,54 млн. га при необхідності 13,88 млн. га. Таким чином, співвідношення існуючого до необхідного складає 1:25. Якщо ж взяти конкретно за культурами, то картина буде мати наступний вигляд:
зернові колосові 1:10
цукрові буряки 1:1500000
соняшник 1:510000
картопля 1:1420
кормові культури 1:7
овочеві культури 1:532
плодові культури 1:276
виноград 1:35
овочі закритого грунту 1:73
зернобобові культури 1:380000
Представлені співвідношення наочно показують стан справ з біологізацією захисту сільськогосподарських культур в Україні. Так, захист мікробіологічними препаратами картоплі необхідно збільшити у 1420 разів, овочів – у 532, плодових – у 276, винограду – у 35, овочів закритого грунту – у 73 рази; захист цукрових буряків, соняшника, зернобобових мікро біопрепаратами взагалі не проводиться. На цьому фоні порівняно непогані показники мають кормові і зернові колосові – перші потребують збільшення частки мікробіометоду в захисті “лише” у 7, другі – у 10 разів.
Таблиця 1.7 Застосування мікробіологічних засобів захисту рослин в Україні в 2009 році.
|
Культури |
Обсяг захисних заходів із застосуванням мікробіологічних препаратів, га |
||||||||
|
різоплан |
боверін |
бітокси-бациллін |
лепідоцид |
бакто-роденцид |
бакто-кумарин |
дендро-бациллін |
біопрепарати зах.грунта |
Загальний обсяг |
|
|
зернові колосові (озимі) |
25305 |
- |
- |
- |
270001 |
60100 |
- |
- |
355406 |
|
цукрові буряки |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
соняшник |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
картопля |
40 |
19,8 |
1905 |
- |
- |
- |
- |
- |
1964,8 |
|
зернобобові |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
багаторічні трави |
- |
- |
- |
- |
144626 |
16600 |
- |
- |
161226 |
|
овочі |
16,9 |
2,6 |
1800 |
810 |
- |
- |
- |
- |
2629,5 |
|
садові культури |
13 |
4,1 |
3000 |
3410 |
560 |
- |
1380 |
- |
8367,1 |
|
виноград |
1700 |
- |
- |
1600 |
- |
- |
2700 |
- |
6000 |
|
захищений грунт |
- |
- |
- |
- |
- |
- |
- |
98,3 |
98,3 |
|
інші |
15,6 |
2,2 |
- |
- |
4828 |
1100 |
- |
- |
5945,8 |
|
Разом |
27090,5 |
28,7 |
6705 |
5820 |
420015 |
77800 |
4080 |
98,3 |
541637,5 |
Таблиця 1.8 Потреба України в обсязі щорічних захисних заходів з використанням мікробіологічних засобів захисту рослин на період 2001-2005 рр. (за даними ІТІ “Біотехніка”)
|
Культура |
Обсяг захисних заходів із застосуванням мікробіологічних препаратів, тис. га |
|||||||||
|
різоплан |
Агат-25 |
бакто-роденцид |
лепідоцид |
дендро-бациллін |
бітокси-бациллін |
гаупсин |
трихо-дермін |
біопрепарати захищ. грунту |
загальний обсяг |
|
|
зернові колосові |
1100 |
600 |
1830 |
- |
- |
- |
- |
- |
- |
3530 |
|
зернобобові |
380 |
- |
- |
- |
- |
- |
- |
- |
- |
380 |
|
соняшник |
510 |
- |
- |
- |
- |
- |
- |
- |
- |
510 |
|
цукрові буряки |
- |
- |
- |
1500 |
- |
- |
- |
- |
- |
1500 |
|
картопля |
930 |
- |
- |
- |
- |
1860 |
- |
- |
- |
2790 |
|
овочі |
350 |
- |
- |
350 |
350 |
350 |
- |
- |
- |
1400 |
|
кормові культури |
- |
- |
1250 |
- |
- |
- |
- |
- |
- |
1250 |
|
садові культури |
- |
- |
- |
660 |
330 |
660 |
660 |
- |
- |
2310 |
|
виноград |
- |
- |
- |
140 |
- |
70 |
- |
- |
- |
210 |
|
захищений грунт |
- |
- |
- |
- |
- |
- |
- |
0,9 |
6,3 |
7,2 |
|
Разом |
3270 |
600 |
3080 |
2650 |
680 |
2940 |
660 |
0,9 |
6,3 |
13887,2 |
1.4 Сучасна ситуація із застосуванням біопрепаратів у рослинництві
Сьогодні в Україні зареєстровано близько десяти біопрепаратів, а саме:
– фунгіцид Агат-25 К, т.п. (інактивовані бактерії Pseudomonas aureofaciens Н 16 – 2%, біологічно активні речовини культуральної рідини – 38%);
– інсектицид Актофіт, 0,2% к.е. (аверсектин);
– полі функціональний препарат Азотофіт, к.с. (суспензия несимбиотических вільноживущих азотфиксирующих бактерій Azotobacter crhoococcum), препарат є протруювачем насіння, оскільки має чітко виражену фунгіцидну дію та частково замінює азотні добрива;
– Бактофіл марки А, р. (Azopirilus brasilense, Azotobacter vinelandi, Bacillus megaterium, Bacillus polymyxa, Pseudomonas fluorescens, Streptomyces albus – 3x108 клітин/мл);
– Бактофіл марки Б, р. (Azospirilum lipoferum, Azotobacter vinelandi, Bacillus megaterium, Bacillus circulans, Bacillus sub>tilis, Pseudomonas fluorescens, Micrococcus roseus – 3x108 клітин/мл);
– інсектицид Вірін НШ, р. (поліедри вірусу ядерного поліедрозу непарного шовкопряда, 0,5%);
– інсектицид Вірін Діпріон, р. (поліедри вірусу ядерного поліедрозу рудого соснового пильщика, 0,5%);
– інсектицид Вірін-ЗСП, р. (поліедри вірусу ядерного поліедрозу звичайного соснового пильщика, 0,5%);
– фунгіцид Сімтес, в.р. (лужний екстракт плодових тіл афілофоральних грибів і соку борщевика Сосновського та ВАС, ТУ У30721813-001-2001);
– фунгіцид Фітоцид (суміш живих клітин та спор Bacillus sub>tilis).
Багато це чи мало, і чи достатньо? Проведемо невеличкий аналіз. Візьмемо кількість зареєстрованих препаратів за різні періоди. Результати досить показові (рис.1.1). У 2001 році тимчасову реєстрацію мали лише п’ять продуктів, а саме: Вірін-Діпріон, р., Вірін-ЗСП 0,3-0,5% р., Вірін-НШ 0,3-0,5% р., Клепс, п. (бактерії Klebsiella oxytoca BH-13 титр 1012 куо/г, та Bacillus mucilaginosus B-4901 титр 106-8 куо/г) та Фітоверм, 0,2% к.е. (аверсектин). Майже всі вони (крім Клепса) мали експериментальну реєстрацію.
Станом на 2003 рік ситуація змінилася, але зміни ці стосувалися лише асортименту біопрепаратів, кількість залишилася незмінною – 5 препаратів і всі вони були зареєстровані тимчасово. На той період дозволені для використання біопрепарати представляли Агат 25К, т.п. (Pseudomonas aureofaciens Н 16), Актофіт, 0,2% к.е. (аналог Фітоверму), Клепс, п., Мікосан (марок Н та В), 3% в.р.к. (лужний екстракт афілофорального гриба Fomas fomentanus, хітозан) та препарат Сімтес, в.р (лужний екстракт плодових тіл афілофоральних грибів і соку борщевика Сосновського та ВАС).
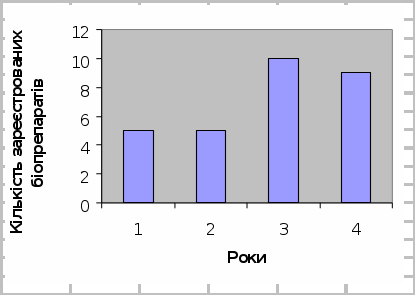
Рис.1.1 Динаміка реєстрації біопестицидів в Україні
1– 2001; 2–2003; 3–2004; 4–2007
За наступний, 2004 рік вдвічі зростає кількість зареєстрованих біопрепаратів. На ринок виходять, щоправда з експериментальною реєстрацією, продукти Інституту сільськогосподарської мікробіології УААН – Альбобактерин та Поліміксобактерин (для бактеризації насіння цукрових буряків, діюча речовина: відповідно фосформобілізуючі бактерії Achromobacter album BНДІСГМ В-322 Д, 5 млрд клітин/мл та Bacillus polymyxa BНДІСГМ В-324 Д, 5 млрд клітин/мл). Цікаво, що ці два продукти з’являються одночасно у чотирьох препаративних формах: гельній, рідкій, вермикулітній та сухій. В цей же час експериментальну реєстрацію отримують Бактофіт, з.п. (живі бактеріальні клітини Bacillus sub>tilis штаму ИПМ-215 та антибіотик Бацифіт), Бактофіт марок А і Б, р. (комплекс бактерій), Мікофунгіцид (Триходермін), п. (міцелій і хламідоспори гриба Trichoderma viride штаму 16 ЦКМ F-59М), а також відомий ще за часів Радянського Союзу бренд Лепідоцид, р (Bacillus thuringiensis var. kurstaki (3-й серотип) штам Z-52). Нажаль а ні Триходермін, а ні Лепідоцид не утримали свої позиції і на сьогодні ці два препарати, що відмінно зарекомендували себе у виробництві відсутні у «Переліку пестицидів та агрохімікатів, дозволених до використання в Україні».
У поточному році експериментальну реєстрацію мають лише два продукти з 9-ти зареєстрованих (Актофіт, 0,2% к.е. та Бактофіл марок А і Б). З нових торгових марок на ринку з’явилися Азотофіт та Фітоцид. (Для довідки – діюча речовина Азотофіта – бактерия Azotobacter crhoococcum. Препарат використовується як протруйник насіння, оскільки має чітко виражену фунгіцидну дію, а крім того частково замінює азотні добрива. Дія Фитоциду ґрунтується на використанні у його складі живих клітин та спор бактерій-антагонистів Bacillus sub>tilis, що інгібують розвиток своїх конкурентів – мікроорганізмів-збудників захворювань як в зелених частинах рослини так і в її коренях.
Незважаючи на періодичну ротацію асортименту у арсеналі виробників сільськогосподарської продукції є 9-10 біопрепаратів щорічно. Та чи можуть задовольнити вони сучасного виробника, вирішити весь спектр проблем захисту рослин у розрізі величезного різноманіття шкідливих організмів та сільськогосподарських культур.
Динаміка така: у 2001 році 80% зареєстрованих біопродуктів були представлені інсектицидними препаратами, у 2003 їх частка скоротилася до 20%, а у 2004 році зменшилася до 10%. Сьогодні ми маємо п’ять біопрепаратів, дія яких спрямована проти комах–шкідників, а це вже більше 55 % (рис.1.2).
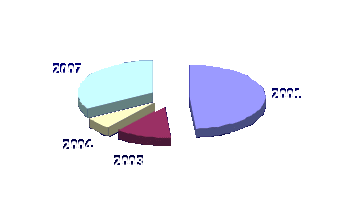
Рис.1.2 Частка інсектицидів в асортименті біологічних препаратів
2001–80%; 2003–22%; 2004–10%; 2007–55%
Співвідношення між хімічними інсекто-акарицидами і фунгіцидами у 2001 році складало 1 : 1,24; 2003 – 1 : 1,19; 2004 – 1 : 1,16; 2007 – 1 : 1,39. Отже, на фоні відносної стабільності названого співвідношення сьогодні спостерігається поступова «перебудова» на користь продуктів, що мають фунгіцидну дію. З біопрепаратами все навпаки – стрімко зростає частка саме інсектицидів. У трьох з п’яти продуктів діюча речовина представлена поліедрами вірусів, в одному – комплексом бактерій і в одному – аверсектином. Жоден з зареєстрованих препаратів не має діючої речовини на основі Bacillus thuringiensis. І це при тому, що, як ми вже зазначали, світова індустрія біоінсектицидів ґрунтується саме на цьому мікроорганізмі (так звані Bt-препарати).
Неможна обійти мовчанням досить важливу течію у асортименті мікробіологічних препаратів. Мова піде про поліфункціональність. Дійсно, якщо ми уважно поглянемо на перелік біопрепаратів, то побачимо – більшість з них передбачається використовувати досить «вузьким» шляхом. Так, Актофіт, Вірін НШ, Вірін Діпріон, Вірін-ЗСП можна застосовувати лише обприскуванням, Бактофіл – внесенням у грунт. В той же час Агат-25 К та Сімтес зареєстровані і для обробки насіння і для обприскування посівів. Цікавим в цьому розрізі біопродуктом є Азотофіт. Його застосовують при обробці насіння, розсади, підживленні та обприскуванні рослин в період вегетації. При насіннєвій обробці бактерії, які є діючою речовиною препарату, вкривають насінину, а після проростання переміщуються на коріння, утворюючи навколо нього своєрідний «захисний екран». Завдяки цій здатності Азотофіт здатен замінити хімічні протруйники та заощадити на внесенні азотних добрив. Подібна поліфункціональність є непоганим додатковим «плюсом» при визначенні конкурентноспроможності нової торгової марки на сучасному ринку.
Отже, підсумовуючи, визначимо найбільш актуальні тенденції сектору біопрепаратів:
– загальне зростання кількості зареєстрованих біопродуктів;
– зростання частки інсектицидних препаратів (порівняно до біофунгіцидів);
– повна відсутність на українському ринку препаратів на основі Bacillus thuringiensis;
– тенденція до використання «розкручених» брендів;
– поява поліфункціональних препаратів (як відносно цільового об’єкта, так і відносно способу застосування).
1.5 Біологічні агенти для виробництва мікробіологічних препаратів для застосування проти шкідників і хвороб на овочевих культурах
Гриб Verticillum lecanii (Zimm.) Viegas належить до порядку Moniliales класу Недосконалих грибів (Fungi imperfecti). Гриби цього роду широко поширені в субтропічних районах нашої країни (Евлахова, 1974; Огарков, Огаркова, 1985).
Verticillum lecanii на середовищі Чапека утворює округлі, повстяні, щільні, дещо при підняті над субстратом до центру колонії. Забарвлення останніх – біле. Розміри колоній на 7 добу культивування – 25–30 мм, на 14 – 45–55мм. При старінні культури грибниця порошить. На різних ентомологічних об’єктах структура міцелію може різнитися. Так, на гусені Galleria mellonella L. міцелій утворюється повстяно–павутинистий, на імаго Trialeurodes vaporariorum Westw. – повстяний щільний. Гіфи тонкі, септировані, конідієносці одиночні, прості, розширені у основи (1,5–2,0 мкм), звужуються до верхівки (1мкм) або ж з одного міжвузля виходять до чотирьох конідієносців завдовжки 15–25 мкм, рідше вони розгалужені з різною кількістю фіалід: від 3 до 6, розміри 34–90 х 1,5–2,0 мкм. Конідії в темних, сферичних головках – 7,5–26 мкм, безкольорові, вузько овальні або видовжені з закругленими кінцями, розміри – 2,4–5,4 х 1,6–4,2 мкм (Евлахова, 1974; Коваль, 1974; Огарков, Огаркова, 1985).
Ентомопатогенний гриб Verticillum lecanii здатний уражувати яйця, імаго та личинки тепличної білокрилки, деякі види пильщиків та попелиць (Евлахова, Швецова, Щепетильникова, 1961; Swiezynska, Gornas, 1976; Куликов, 1977; Hall, Burges, 1979; Соловей, 1980; Бондаренко, Буймистру, Гулий, 1985; Митина, Сергеев, Павлюшин, 1997). Крім того, відомо, що Verticillum lecanii є мікофільним грибом і антагоністом деяких фітопатогенних грибів (Spencer, Tatkey, 1981; Котляревский, Павлюшин, 1986).
Зовнішні ознаки хвороби виявляються через 5–6 діб після ураження комахи і супроводжується деякими змінами в її забарвленні. В цей період в центрі личинки з’являється світло–коричнева пляма, яка обплямована міцелієм гриба. Під мікроскопом видно також дві оранжеві плями і розгалужені конідієносці з головками конідій. На 10 добу розвитку хвороби білий пухнастий міцелій гриба повністю вкриває тіло личинки і може поширитися на 2–4 мм за його межі. Уражене грибом імаго гіфами прикріплюється до поверхні листя і є джерелом подальшого розповсюдження інфекції в колонії шкідника (Чалков, 1986).
Verticillum lecanii є еврибіонт ним видом і може розвиватися при температурі від 5 до 320С. Тривалі температури, що перевищують поріг 320С згубно діють на конідії, однак, при змінній температурі гриб здатний уражувати комах навіть у тому випадку, коли температура вдень підіймається до 380С, але вночі тримається на рівні 16–200С (Бондаренко, Буймистру, Гулий, 1985).
Оптимальними умовами для проростання спор, росту та розвитку міцелію, а також споруляції патогенна є температура повітря 22–260С і відносна вологість 95–100% (Котляревский, Павлюшин, 1986). Короткочасне зменшення вологості до 60–70% не знижує ефективності паразита. Життєздатність гриба зберігається протягом 15 діб при температурі до –150С (Чалков, 1986). Verticillum lecanii дуже чутливий до ультрафіолетового випромінювання – доза 110 Дж/м2 викликає загибель 90% клітин (Юрченко, Павлюшин, 1993).
Гриб Beauveria bassiana Vuillemin (Balsamo) належить до групи недосконалих грибів Fungi imperfecti порядку Moniliales (Hyphomycetales), родини Mycedinaceae. Гриб є факультативним паразитом і уражує більш як 100 видів комах, викликаючи мікоризне захворювання – білу мускардину.
Зараження комах відбувається за допомогою спор через зовнішні покрови, дихальну або травну системи (Вейзер, 1972; Schaerffenberg, 1957). Процес розвитку гриба починається через 10 годин після попадання спор і може тривати декілька діб (Вейзер, 1972). В місцях проникнення утворюється темна пляма неправильної форми з концентричними колами, які виникають в результаті реакції фенолоксидази на повітря. Гіфи (завтовшки 3–5 мкм, прозорі з перетинками), що сягнули певного розміру відділяються від первинної ростової трубки, яка залишається в покровах комахи і поступово відмирає (Вейзер, 1972). З гіф, шляхом розпаду утворюються булавовидні гіф альні тільця завдовжки 7–18 мкм і завширшки 3 мкм, які гемолімфою розносяться по всьому тілу (Вейзер, 1972). Розмноження гіфальних тілець здійснюється шляхом поділу і брунькування (Евлахова, 1974), при цьому в гемолімфу виділяються токсини (Суздальская, 1958; Шехурина, 1964).
В комахах, що загинули, утворюються конідієносці розміром від 2,5–5,5х1,5–2,5 мк до 15,5–25,5х1,5–3,0 мк, на розгалуженнях яких утворюються по 2 і більше ендоконідій на невеликих ніжках. Ендоконідії – циліндричні 2–7 мк завдовжки і 2,3 мк в діаметрі, проростають і утворюють гіфи на яких виникає наступне “покоління” ендоконідій. Таким чином, маса гіф повністю заповнює тіло ураженої комахи, труп якої спочатку має консистенцію творогу, а потім ущільнюється і твердіє (Вейзер, 1972).
При наявності вологи гіфи проростають на поверхню тіла комахи і утворюють конідії з конідієносцями (Вейзер, 1972; Евлахова, 1974). Після утворення великої кількості конідій вони збираються у щільні кулеподібні головки, які сидять на основних гіфах або широких бічних відгалуженнях (Штейнхауз, 1952). Конідієносці – кулеподібні (діаметр 1–4 мк; 1,5–5,5х1–3 мк) (Вейзер, 1972).
В період спороутворення Beauveria bassiana утворює кристали, кількість яких залежить від штаму, при цьому штами, що утворюють меншу кількість кристалів є більш вірулентними (Гораль, 1973).
Тіло ураженої комахи поступово перетворюється у склероцій, у якого по мірі висихання і достигання потовщується оболонка, плазма стає густою і він набуває зеленого кольору. Інфекційними стадіями гриба є повітряні конідії і ендоконідії (Вейзер, 1972).
Найбільш оптимальними для розвитку гриба є температура 24–280С і відносна вологість повітря 94–100% (Hart et al., 1955; Вейзер, 1972; Кальвиш, 1974; Храмеева, Попов, 1983; Тюльпанова и др., 1987). При цьому кожен штам збудника має визначений діапазон і оптимум температур та відносної вологості повітря залежно від кліматичної зони де їх було виділено (Кальвиш, 1974).
Гриб культивується на живильних середовищах різного складу. Для виробництва препаратів використовуються два способи: поверхневий та глибинно–поверхневий.
Гриби роду Aschersonia належать до порядку Sphaeropsidales класу Недосконалих грибів (Fungi imperfecti) і є пікнідіальною стадією гриба Hypocrella. Природні ареали цих грибів – тропічні і субтропічні регіони. Окремі раси мають індійське, китайське, кубинське, в’єтнамське і тринідатське походження.
Ашерсонія паразитує на комахах родин Aleurodidae та Lecaniidae уражуючи личинок перших трьох віків. Проникнення гриба у організм комахи відбувається через зовнішні покрови, при цьому спори утворюють ростки (при вологості повітря не менше 80%). Через 5–6 діб комаха набуває жовтого кольору і виділяє краплю рідини. На 10–15 добу личинки, що загинули, повністю обростають міцелієм, утворюючи пустули, характерного для кожного виду гриба кольору. На личинках білокрилки пустули звичайно невеликі і не утворюють спор, тому повторного зараження комах грибом не відбувається (Бабчук, Шилина и др., 1986). Початок спороутворення відмічається на 15–18 добу. Спори – веретеноподібні, безкольорові утворення довжиною 10–15 мкм і шириною 2–5 мкм, утворюються у стромах. Спори добре змочуються водою, тобто є гідрофільними. За посушливих погодних умов гриб зберігається у вигляді спор і міцелію на муміфікованих комахах.
При культивуванні гриба на сусло–агаровому середовищі спори, в залежності від строку зберігання, проростають на 2–5 добу, утворюючи білу, припідняту з рівними краями колонію, розміром до 5 мм в діаметрі. На 8–10 добу колонія розростається і набуває видо– або формоспецифічного забарвлення. Масове утворення спор в ексудаті відбувається, залежно від раси, на 20–45 добу. Оптимальними для розвитку гриба є температура 24–280С і відносна вологість повітря не нижче 80% (Соловей, Гораль, 1986; Бабчук, Шилина и др., 1986).
Гриб Trichoderma lignorum (Tode) Harz належить до родини Mucedinaceae (Moniliaceae) порядку Hyphomycetales класу Недосконалих грибів (Fungi imperfecti) і є типовим ґрунтовим сапрофітом (Федоринчик, 1977).
Ріст гриба розпочинається через 5–6 годин після посіву культури (Буймистру, 1977), а при температурі 24–280С – через 0,5–1,0 годину (Федоринчик, Тиллаев, 1973). Конідії утворюються на 2 день (Буймистру, Филипов и др., 1987) і по мірі росту культури спороношення проходить постійно протягом 70–80 годин від посіву, повний цикл розвитку конідіальної стадії завершується за 3 доби (Сейкетов, 1982). Конідії – одноклітинні, округлі діаметром 2,5–3,75 мк, жовто– або темно–зелені (Канивец и др., 1940; Сейкетов, Исабаева, 1962; Билай, 1964; Билай, Пидопличко, 1970; Федоринчик, Тиллаев, 1973; Бондаренко, 1978; Сейкетов, 1982; Филипов и др., 1987). На кінцях вилчасто або трійчасто розгалужених конідієносців, конідії зібрані у головки по 10–20 штук, які в умовах підвищеної вологості розпадаються на окремі спори (Канивец и др., 1940; Федоринчик, Тиллаев, 1973; Сейкетов, 1982). Міцелій гриба безкольоровий, утворює дерновинки (Билай, Пидопличко, 1970; Бондаренко, 1978). Діаметр вегетативної гіфи в середньому дорівнює 8–15 мк (Сейкетов, 1982). Після 3–4 діб росту, міцелій, внаслідок спороутворення набуває зеленого кольору, останній змінюється від світло– до темно–зеленого, що залежить від віку культури (Буймистру, Филипов и др., 1987; Сейкетов, 1982). Крім конідій гриб утворює безкольорові хламідіоспори діаметром 7,5–15 мк, які потрапивши у сприятливі умови проростають, утворюючи грибницю з конідієносцями і спори (Канивец и др., 1940; Федоринчик, Тиллаев, 1973; Бондаренко, 1978; Сейкетов, 1982). Спори гриба стійкі до сонячних променів (Алекси–Месхишвили, 1964), однак у темряві міцелій розвивається значно краще і, відповідно, спор утворюється більше ніж при освітленні.
Антагоністичні властивості триходерми проявляються подвійно: по-перше, гриб продукує антибіотики, що є токсинами для збудників захворювань рослин; по-друге, дрібні гіфи антагоністу, обплітаючи гіфи патогена, порушують його обмін речовин і призводить до загибелі. Триходерма сприяє також підвищенню фунгіцидної активності клітинного соку і тим самим – підвищенню стійкості до захворювань (Билай, 1956; Билай, Заневич, 1958; Димович, 1960; Лаврентьева, 1989; Павловская и др., 1998; Марютин, Билык, 1990; Muckhopahyay et al., 1992).
Всі штами, які продукують антибіотики, мають сильний специфічний запах. При порівнянні спектру дії антибіотиків видно, що у культуральних рідинах дія останніх сильніше проявляється відносно бактерій, тоді як у летючих антибіотиків – до грибів. В природних умовах обидві форми прояви антагонізму є взаємодоповнюючими (Сейкетов, 1982).
Гриби роду Ampelomyces відносяться до порядку Picnidiales класу Недосконалих грибів (Fungi imperfecti). Розвиток їх у природі відмічено, головним чином, на міцелії, конідіях та клейстокарпіях борошнисто росяних грибів. У зв’язку з цим відкриваються широкі перспективи для використання видів даного роду як агентів біологічної боротьби з хворобами рослин (Кобахидзе, 1965; Рудаков, 1979; 1981; Пузанова, 1981; Давидова, Рудаков, Гановская, 1985).
Взагалі, проведений аналіз поширення грибів Ampelomyces показав, що вони розвивалися на борошнисто росяних грибах, які уражують рослини з 32 родин. Найбільш значний ступінь розвитку видів роду Ampelomyces відмічався на збудниках борошнистої роси, що паразитують на рослинах родин Asteraceae, Fabaceae, Cucurbitae, Rosaceae, Apiaceae, Polygonaceae. На борошнисторосяних грибах, які уражують родини Poaceae та Solanaceae, гіперпаразит не був виявлений (Пузанова, 1991). За даними Блюмера (Blumer, 1933), П. Пилдмаа (1964), М.В. Горленко (1983), О.Л. Рудакова (1979; 1981) та Пуза нової (1984) строга спеціалізація у представників Ampelomyces відсутня.
Ураження структур хазяїна проходить шляхом проростання конідій та утворення росткових трубок, які руйнують клітинну оболонку і проникають всередину клітини, внаслідок чого остання роздувається. Через 3–5 діб в клітині закладаються пікніди, які поступово темнішають: уражений міцелій борошнистої роси набуває сірого кольору. На поверхні міцелію також закладаються пікніди, у яких формується велика кількість одноклітинних, безкольорових, одноядерних пікноспор. З крапельною вологою, вітром, комахами вони розносяться і створюють нові осередки. Для проростання пікноспор необхідна крапельно–рідка волога і досить широкий діапазон температур – 6–300С (оптимум 20–240С). При температурі 200С проростання проходить через 8–10 годин. Перші ознаки ураження гіперпаразитом помітні через 3–4 доби, а на 5–6 добу формуються нові пікніди. У природних умовах гриб зимує на рослинних рештках з міцелієм борошнистої роси або на багаторічних культурах під лусками бруньок, де зберігається міцелій гриба–хазяїна (Бондаренко, Буймистру, Гулий и др., 1985).
Bacillus sub>tilis. B. sub>tilis належить до роду Bacillus родини Bacilliaceae і є сапрофітним організмом (Трисвятский, 1941). Утворення спор починається з моменту переходу популяції вегетативних клітин в стаціонарну фазу. У разі несприятливих умов відбувається спороутворення первинної клітини без попереднього поділу (Смирнов и др., 1982). Термін, необхідний для утворення спори залежить від температури (при 140С – 72 год., 200С – 48, 250С – 40, 300С – 38, 350С – 33, 380С – 22) (Николаев, 1932).
Проростання спор залежить як від температури так і від реакції середовища (оптимум рН=7–8). При 250С спори проростають в інтервалі рН від 5 до 10, при 50С і будь якому значенні рН спори взагалі не проростають (Николаев, 1932). Розмножується B. sub>tilis як простим поділом так і шляхом брунькування (Стрешинский, 1955; Шахбанов, 1970). Поділ вегетативної клітини залежить від температури (при 300С – 30 хв., 250С – 45 хв., 200С – 90 хв.) (Николаев, 1932). В клітинах, що не утворюють спори, формуються кристалоподібні структури (сферичні субодиниці діаметром 70–80 мкм) з частотою 0,1–2% від загальної чисельності клітин (Kaneko, Matsushima, 1973; 1975; Ермакова и др., 1977).
B. sub>tilis – термотолерантний мікроорганізм, максимальна температура за якої можливий ріст колонії – 600С, мінімальна – 10–120С, оптимальна – 37–500С (Мирзоева, 1959). Рухливі вегетативні клітини мають закруглену форму (1,5–3,5х0,6–0,7 мкм) і утворюють ланцюжки, або існують окремо (Горовиц–Власова, 1933; Трисвятский, 1941; Мирзоева, 1959).
Відповідно Красильникову (1958) B. sub>tilis при культивуванні утворює колонії всіх типів, характерних для своєї групи (B. sub>tilis, B. meseutericus, B. cereus, B. brevis, B. lichenoformis). Мірзоєва (1959) поділяє культури бактерії на наступні варіанти: галузисто–складчасті (виникають на м’ясо–лептонному агарі (МПА); гладкі (агарові і картопляні середовища); слизово–складчасті (МПА, картопляні та деякі інші середовища). На глюкозному агарі всі варіанти дають нитяний наліт (рожевий або жовтий).
B. sub>tilis утворює антибіотики, частина з яких пригнічує багато видів бактерій і грибів (Африкян, 1959), а саме: Verticillium dahliae (Ukteda, Sholberg, 1986); Fusarium oxysporum (Picci et al., 1985; Suen et al., 1985; Filipi et al., 1987); Rhizoctonia solani, Helmintosporium oryzae, H. noddusum, H. sativum, Sclerotium sclerotium, S. cepivorum (Ukteda, Sholberg, 1986).
B. sub>tilis має і ентомоцидні властивості – штам 22/2 var. niger здатний викликати загибель гусені тутового шовкопряда від 37,5 до 90% (Аретинська, 1976).
Бактерії роду Pseudomonas.
Pseudomonas aureofaciens. Бактерія є рухомою грамвід’ємною паличкою розміром 0,5–0,6х1,5–3,0 мкм. Спор і включень оксимасляної кислоти не утворює. На м’ясо–лептонному агарі колонії округлі, гладкі, блискучі, пастоподібні, на м’ясо–лептонному бульйоні активно ростуть утворюючи рівномірну каламуть. Виділяє в середовище жовто–зелений флуоресцентний пігмент, характерний для багатьох видів бактерій цього роду. Крім того, утворює червоно–оранжевий пігмент, який дифундує в середовище і є сумішшю феназін–карбонових кислот. Оптимальна температура для росту 270С, при 420С бактерія не розмножується.
Pseudomonas aureofaciens є облігатним аеробом, засвоює аміачні і нітратні форми азоту, глюкозу використовує лише окисним шляхом, а крім неї ще близько 60 органічних сполук: арабінозу, мальтозу, маннозу, галактозу, фруктозу, цукрозу, трехгалозу, глюконат, різні органічні кислоти (оцтову, лимонну, яблучну, масляну, молочну тощо), ароматичні та інші циклічні сполуки (бензойну, оксибензойну, фенілоцтову і хинну кислоти), амінокислоти (аланін, лейцин, валін, лізін, аспарагін, пролін, тірозін, фенілаланін, триптофан тощо) (Гораль, 1998).
Pseudomonas fluorescens Migula, 1895. Бактерія є рухомою грамвід’ємною паличкою розміром 1–2х0,6 мкм. Добре розвивається на живильних середовищах, багатих органічними речовинами, а також на синтетичних середовищах з мінеральним азотом, на м’ясо–лептонному агарі, середовищах, у склад яких входить картопля, на середовищі Чапека. Колонії безкольорові або білі, гладкі, блискучі. Аероб, оптимум росту спостерігається при температурі 250С.
Характерною особливістю цього виду є зовнішня мікроструктура колоній. За малого збільшення мікроскопу поверхня колоній має характерну сітчасту або чарункову будову. Дана ознака стійка і виявляється майже на всіх середовищах, але краще на м’ясо–лептонному агарі та на синтетичних середовищах. В бульйоні утворює каламуть та плівку, середовища набувають жовтувато–зеленого флуоресціюючого кольору. Пігмент – флуоресцин не розчиняється у спирті і хлороформі, але добре розчинний у воді. Бактерія швидко розріджує желатин, молоко не звертає, деякі штами лише пептонізують його. Переважна більшість штамів відновлює нітрати до нітрітів або вільного азоту. Утворюють кислоту на глюкозі та цукрозі, а також велику кількість вітамінів і інших додаткових живильних речовин. (Рождественський, Васильєв, 1940; Красильников, 1949).
Фунгістична дія бактерій роду Pseudomonas пов’язана з пригніченням грибів і фітопатогенних бактерій антибіотиками (феназінові пігменти і похідні флюроглюцину) та іншими біологічно активними метаболітами (Худяков, Шилер, Савадеров, 1965; Гарагуля, 1975; Есипов, Аданин, Баскуков, 1975; Howell, Stipanovic, 1979; Рубан, 1986; Смирнов, Киприанова, 1990), а також сидерофорами – сполуками, які здійснюють транспорт заліза (Бойко и др., 1984; Cook, 1985; Neilands,Valenta, 1985; Рубан, 1986) і утворюючи з ним стабільні компоненти, успішно конкурують за цей елемент з сидерофорами фітопатогенних грибів, які мають меншу константу зв’язування заліза (Kloepper, Schroth, 1981; Cook, 1985; Cook, Weller, 1987). Існують дані про пригнічення Pseudomonas таких грибів як Rhizoctonia solani, Sclerotinia sclerotiorum, Phytophtora megasperma, Gaeumannomyces graminis (Гораль, 1998). Штами P. aureofaciens також мали антагоністичну дію на нематод – Aphilenchoides asterocaudatus, Ditylenchus destructor (Смирнов, Киприанова, 1990). Pseudomonas діють і на комах (яблунева плодожерка, непарний, тутовий і кільчастий шовкопряди, яблунева міль, колорадський жук, травневий і червневий хрущі, кімнатна муха тощо), викликаючи у останніх септицемію – захворювання, яке характеризується виділенням ураженими комахами бактеріальної маси з зеленуватим або жовтуватим флуоресціюючим пігментом (Вейзер, 1972).
Бактерії Ісаченко Salmonella enteritidis var. Issatschenko, що використовуються для боротьби з гризунами, за культурально–морфологічними, біохімічними та серологічними властивостями належать до роду Salmonella, серотипу S. enteritidis (група Д), мають соматичні антигени (рецептори 1, 9, 12) та жгутикові Н–антигени (рецептори g і m). Характерною ознакою бактерій Ісаченко є їх чутливість до лізоциму – у них, на відміну від бактерій Данича, лізоцим індукує вивільнення профага, перетворюючи його у вірулентну форму. Бактерії є короткими (1–2 мкм), рухомими, грамвід’ємними паличками з закругленими краями, добре забарвлюються аніліновими барвниками, при певних умовах утворюють капсулу, спор не утворюють. Бактерії Ісаченко добре ростуть на звичайних щільних і рідких середовищах з рН 7,2–7,4 – м’ясо–лептонному агарі, желатині, м’ясо–лептонному бульйоні, молоці, горохових, дріжджових тощо. На щільних середовищах при оптимальних умовах росту утворюють круглі, гладкі, прозорі колонії з рівними краями і синюватим відливом розміром 0,5–3 мм, на елективних середовищах (Ендо, Плоскірева) – круглі безкольорові колонії, на рідких – рівномірну каламуть і тонку поверхневу плівку, яка легко розбивається при струшуванні. Факультативні аероби, оптимальна температура росту 370С.
Бактерії Ісаченко мають строгу вибіркову патогенність. Така вибірковість існує навіть в межах ряду гризунів: для одних видів ці бактерії високо вірулентні (більшість мишей та полівок), для інших – менш вірулентні (пацюки, піщанки, ховрахи), а для третіх – їх патогенність проявляється настільки слабо, що не викликає загибелі тварин навіть при зараженні великими дозами.
Численними дослідами встановлено – бактерії Ісаченко не є небезпечними для людей, багатьох свійських і диких тварин (Кандыбин и др., 1987; Кандыбин, 1989).
1.6 Ефективність мікробних препаратів відносно ентомологічних, фітопатологічних об’єктів та гризунів за літературними даними
Ефективність застосування мікробних препаратів відносно шкідливих комах, гризунів, а також хвороб рослин доцільно представити у табличній формі.(табл.1.9)
Таблиця 1.9 Ефективність застосування мікробних препаратів відносно шкідливих комах, гризунів, а також хвороб рослин
|
Препарат |
Культура |
Об’єкт |
Результат застосування |
Джерело |
|
|
1 |
2 |
3 |
4 |
5 |
|
|
Вертицилін–Р титр106 спор/мл |
огірки закр. грунту |
теплична білокрилка |
біол. еф. 84–100% |
Слободянюк и др., 1993 |
|
|
72–94% |
Фокін та ін., 2002 |
||||
|
павутинний кліщ |
81–92% |
Андреева, Штерншис, 1995 |
|||
|
теплична білокрилка |
78% |
Ярошенко, Вяткина, Алещенко, 1996 |
|||
|
культури закр. грунту |
м’яка несправжня щитівка |
73% |
|||
|
Вертицилін зерновий |
огірки закр. грунту |
теплична білокрилка |
54,5–89,5% |
Касперович, Соловей, 1992 |
|
|
99,43–98,91% |
Лаппа, Гораль та ін., 1992 |
||||
|
47–85% |
Фокін та ін., 2002 |
||||
|
Боверін 2 кг/га 5–10 кг/га титр 103–106 спор/мл 1 кг /1000м2 у 400 л води 0,5 кг/га 2 кг/га 8 кг/га |
трави |
саранові |
95,2% |
Хлопцева, 1985 |
|
|
кобилки |
47–84% |
Штерншис, Цветкова, 2002 |
|||
|
запаси борошна |
суринамський борошноїд |
100% |
Searle, Doberski, 1984 |
||
|
плодові (яблуня) |
зим. гусінь яблуневої плодожерки |
63% |
Барабанов, Штайн, 1997 |
||
|
томати закр. грунту |
пасленовий мінер |
20–53% |
Борисов, Ущеков, 1997 |
||
|
огірки закр. грунту |
тютюновий трипс |
80% |
Прохоренкова, 1991 |
||
|
картопля |
личинки колорадського жука 4 віку |
тех. еф. 44% |
Гораль, Лаппа, 1973 |
||
|
77% |
|||||
|
100% |
|||||
|
загинуло 57,2% |
Гораль, Лаппа, Пєтровський, 1976 |
||||
|
огірки закр. грунту |
теплична білокрилка |
біол. еф. 93,55% |
Лаппа, Гораль та ін., 1992 |
||
|
71,64% |
|||||
|
Боверін–Р 0,5л/3л води титр 4х 106 бластоспор/мл |
огірки закр. грунту |
попелиця |
біол. еф. 73% |
Ярошенко, Вяткина, Алещенко, 1996 |
|
|
павутинний кліщ |
73% |
||||
|
теплична білокрилка |
81,2% |
Касперович, Соловей, 1992 |
|||
|
86% |
Фокін та ін., 2002 |
||||
|
Триходермін сухий титр109 спор/г 5,4х109 спор/г, 4 кг/т 30 кг/га 4х109 спор/г, 20 кг/га 12–16г/кг 2,3х109 спор/г 109 спор/г |
огірки |
біла гниль |
зниж. ураж. на 30% |
Лаппа, Гораль, 1987 |
|
|
морква |
сухі гнилі |
ураж. 2,7–5,4% |
Фокін, Ткаленко, Гораль, 2001 |
||
|
капуста |
судинний бактеріоз |
біол. еф. 69,6–76,7% |
|||
|
слизовий бактеріоз |
66,4–73,5% |
||||
|
огірки |
кореневі гнилі |
47,5% |
|||
|
озима пшениця |
кореневі гнилі |
зниж. ураж. на 21% |
Коваленко, Коваленко,1992 |
||
|
альтернаріоз |
зниж. ураж. на 94,5% |
||||
|
картопля |
чорна ніжка, парша, ризоктонія |
зниж. ураж. на 90% |
|||
|
квасоля |
біла гниль |
зниж. ураж. на 81,9% |
|||
|
різоктоніоз |
зниж. ураж. на 55,2% |
||||
|
картопля |
фітофтороз |
біол. еф. 17–18% |
Триходермин не только защищает раст., 1995 |
||
|
овочі закр. грунту |
кореневі гнилі |
70–83% |
Матвеева, 2002 |
||
|
томати |
комплекс хвороб |
81,7% |
Хакимов, Абдулаев, 1992 |
||
|
огірки |
аскохітоз |
зниж. ураж. на 47% |
Прохоренкова, 1991 |
||
|
кореневі гнилі |
зниж. ураж. на 47% |
Винокурова, 1991 |
|||
|
капуста |
чорна ніжка |
зниж. ураж. на 47% |
|||
|
тютюн |
Pythium |
ефект. 76% |
Филипчук и др., 1995 |
||
|
Eusarum |
72% |
||||
|
овочі закр. грунту |
кореневі гнилі |
біол. еф. 78–80% |
Гузь, 1997 |
||
|
зниж. ураж. на 75% |
Доброхотов, 1998 |
||||
|
соняшник |
біла гниль |
на 30% |
Дуденко, Лаппа та ін., 2000 |
||
|
сіра гниль |
76% |
||||
|
Триходермін–Р титр 1,5х109 спор/мл 5х107–5х108 спор/мл 200 мл/росл. 2 л/т |
капуста |
слизовий бактеріоз |
біол. еф. 55,2–61,9% |
Фокін, Ткаленко, Гораль, 2001 |
|
|
судинний бактеріоз |
55,2–61,9% |
||||
|
морква |
хвороби |
77,7–81,9% |
Ткаленко, 2000 |
||
|
сухі гнилі |
ураж. 3,9–6,0% |
Фокін, Ткаленко, Гораль, 2001 |
|||
|
виноград |
сіра гниль |
зниж. ураж. на 70% |
Коваленко, Коваленко,1992 |
||
|
аскохітоз |
на 80% |
||||
|
плодові |
“молочний блиск” |
на 94% |
|||
|
суниці |
різоктоніоз |
на 18–46% |
|||
|
томати |
кореневі гнилі |
біол. еф. 76% |
Ярошенко, Вяткина, Алещенко, 1996 |
||
|
бура плямистість |
61% |
||||
|
огірки |
аскохітоз |
зниж. ураж. на 78,4% |
Гринько, 1992 |
||
|
сіра гниль |
на 87,6% |
||||
|
біла гниль |
на 85,2% |
||||
|
ячмінь |
гельмінтоспоріоз |
біол. еф. 10,5–26,5% |
Помелова, Воронова, 1999 |
||
|
фузаріоз |
29,5–100% |
||||
|
овочі закр. грунту |
галова нематода |
зниж. ураж. на 34% |
Есельсон, 1999 |
||
|
озима пшениця |
септоріоз колоса |
біол. еф. 55,3–68,1% |
Гаврилов, Бойко, 2001 |
||
|
Ашерсонія титр 8х105 спор/г 2х106 спор/г 6х106 спор/г 8х106 спор/г 8х107 спор/г |
огірки закр. грунту |
теплична білокрилка |
98,91% |
Лаппа, Гораль та ін., 1992 |
|
|
загин. лич. 30,4% |
Приймак, Чижик, 1975 |
||||
|
42,5% |
|||||
|
52,7% |
|||||
|
66,4% |
|||||
|
92,7% |
|||||
|
Ампеломіцин 2,5–3х105–107 спор/г 0,5% 21,6х109 спор/г 3х105–3х106 |
огірки закр. грунту |
борошниста роса |
затримка прояви хвор. на 21 добу |
Боярин, 1994 |
|
|
біол. еф. 80% |
Прохоренкова, 1991 |
||||
|
яблуня |
зниж. ураж. на 88,9% |
Парий, Пузанова, 1990 |
|||
|
на 19,6–46,2% |
Новицкая, 1990 |
||||
|
суниці |
на 15,8–18,2% |
||||
|
огірки, петрушка, кріп, щавель |
тех. еф. 88,2–98,5% |
Бондаренко, Буймистру и др., 1985 |
|||
|
Гаупсин 1% 109 кл./мл 50 г/ц 0,5–1% 1% 109 кл./мл |
соняшник |
біла гниль |
зниж. ураж. на 20% |
Дуденко, Лаппа та ін., 2000 |
|
|
сіра гниль |
біол. еф. 50% |
||||
|
озима пшениця |
кореневі гнилі |
97,32% |
Гораль, Лаппа, 1994 |
||
|
ячмінь |
зниж. ураж. на 80% |
||||
|
яблуня |
яблунева плодожерка |
біол. еф. 93–95% |
Арешников и др., 1989 |
||
|
парша |
зниж. ураж. на 75–90% |
||||
|
Malacosoma neustria |
загибель на 4 добу 12,5% |
Фокін, Коровін, 2001 Фокин, Коровин, 2001 Фокин, Коровин, 2001а |
|||
|
Aporia crataegi |
18,75% |
||||
|
Ризоплан 1% 50 г/ц 2,5 л/т 20 мл/кг титр 1011 кл/мл 4 л/га 1 л/т |
соняшник |
біла гниль |
зниж. ураж. на 20% |
Дуденко, Лаппа та ін., 2000 |
|
|
сіра гниль |
біол. еф. 30% |
||||
|
озима пшениця |
кореневі гнилі |
21,6% |
Гораль, Лаппа, 1994 |
||
|
ячмінь |
зниж. ураж. на 80% |
||||
|
озима пшениця |
кореневі гнилі |
біол. еф. 40–56% |
Гузь, 1997 |
||
|
септоріоз |
56–60% |
||||
|
борошниста роса |
42–46% |
||||
|
ячмінь |
гельмінтоспоріоз |
26,5–43,2% |
Помелов, Воронцова, 1999 |
||
|
фузаріоз |
29,5–100% |
||||
|
озиме жито |
рінхоспоріоз |
54,6–57,6% |
Назарова и др., 1995 |
||
|
бура іржа |
86,9% |
||||
|
стеблова іржа |
70–80,5% |
||||
|
тютюн |
Pythium |
72% |
Филипчук и др., 1995 |
||
|
Eusarium |
62% |
||||
|
картопля |
фітофтороз |
затримка прояви хв. на 8–12 діб |
Кузнецова, Филипов, 1995 |
||
|
капуста |
чорна ніжка |
біол. еф. 76–94% |
Джалилов и др., 1994 |
||
|
судинний бактеріоз |
зниж. ураж. на 66–45% |
||||
|
слизовий бактеріоз |
на 80–94% |
||||
|
томати закр. грунту |
кореневі гнилі |
біол. еф. 76% |
Ярошенко, Вяткина, Алещенко, 1996 |
||
|
картопля |
фітофтороз |
затримка прояви хв. на 5 діб |
Кузнецова и др., 1996 |
||
|
озима пшениця |
кореневі гнилі |
зниж. ураж. на 63,4% |
Титаренко, Вяткина, Алещенко, 1995 |
||
|
бактеріоз |
на 24,8% |
||||
|
томати |
фітофтороз |
біол. еф. >70% |
|||
|
цукрові буряки |
церкоспорилез |
||||
|
Бактофіт титр 1011 кл/мл 4 л/га 2 л/т 1% |
картопля |
фітофтороз |
затримка прояви хв. на 5 діб |
Кузнецова и др., 1996 |
|
|
огірки закр. грунту |
борошниста роса |
біол. еф. 60% |
Ярошенко, Вяткина, Алещенко, 1996 |
||
|
озима пщениця |
бактеріоз |
зниж. ураж. на 60,3% |
Титаренко, Вяткина, Алещенко, 1995 |
||
|
септоріоз колоса |
біол. еф. 55,3–68,1% |
Гаврилов, Бойко, 2001 |
|||
|
огірки закр. грунту |
борошниста роса |
32,37–34,2% |
Лаппа, Гораль та ін., 1992 |
||
|
соняшник |
біла гниль |
зниж. ураж. на 42% |
Дуденко, Лаппа та ін., 2000 |
||
|
сіра гниль |
біол. еф. 30% |
||||
|
Бактороденцид зерновий титр 0,12–0,14 х 109 спор/г 1–2 кг/га |
озима пшениця |
звичайна полівка |
тех. еф. 65,3–78,9% |
Серебрякова, Минина, Владимирова, 1985 |
|
|
багаторічні трави |
70,9–81,4% |
||||
|
скирти тюкованої соломи |
звичайна полівка, домова та лісова миші, сірий хом’як |
69,5% |
|||
|
квітковий розсадник |
суспільна полівка |
86,9% |
|||
|
пасовиська |
звичайна полівка |
79,8% |
|||
|
лісосмуги |
84% |
||||
|
різні культури |
комплекс мишоподібних гризунів |
70–90% |
Кандибин, 1995 |
||
|
культури закритого грунту |
75–85% |
Есельсон, 1999 |
агроценоз біопрепарат цибуля хвороба
РОЗДІЛ 2
МІСЦЕ ТА УМОВИ ПРОВЕДЕННЯ ДОСЛІДЖЕНЬ
Дослідження проводились в типових умовах Лісостепу та Степу в 2009-2010 роках. В Лісостепу: в ПСП “Мартусівка”, на приватних ділянках населення селищ Мартусівка Бориспільського району, Київської області, а також села Петрушки та урочища Китаївське, Києво-Святошинського району в зоні м. Києва.
Методологічно робота складалася з: лабораторних та польових досліджень з метою вивчення ефективності окремих прийомів технологій захисту овочевих культур; статистичних методів обробки даних – встановлення вірогідності отриманих результатів лабораторних та польових досліджень на основі кореляційного, дисперсійного та регресійного аналізу.
Таблиця 2.1 Характеристика метеорологічних факторів Лісостепу за 2007-2009 рр.
(Бориспільський р-н, Київської обл.)
|
Основні показники |
Місяці та декади |
|||||||||||
|
травень |
червень |
липень |
серпень |
|||||||||
|
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
1 |
2 |
3 |
|
|
Температура повітря, оС а) середня багаторічна б) 2007 року в) 2008 року ґ) 2009 року |
13,5 15,7 15,8 17,4 |
15,5 13,9 15,6 19,4 |
16,1 13,1 17,2 21,3 |
17,7 14,7 15,3 19,1 |
17,7 17,9 19,318,2 |
19,0 18,0 20,8 16,6 |
18,7 23,0 23,1 20,3 |
19,6 24,9 25,520,6 |
19,4 25,3 22,8 23,0 |
19,8 22,0 9,0 20 |
18,7 21,8 19,8 18,5 |
17,0 18,2 18,9 19,4 |
|
Опади, мм а) середні багаторічні б) 2007 року в) 2008 року ґ) 2009 року |
140 3 13 3 |
9 15 24 15 |
20 12 137 6 |
22 70 120 3 |
23 47 0 8 |
27 39 35 10 |
35 19 0 21 |
20 9 0 15 |
23 17 18 0 |
16 5 22 18 |
22 0 114 37 |
20 35 0 2 |
|
Вологість повітря, % а) середня багаторічна б) 2007 року в) 2008 року ґ) 2009 року |
65 62 64 50 |
65 65 61 58 |
65 60 67 55 |
69 81 80 48 |
69 76 67 56 |
69 77 66 70 |
72 70 60 73 |
72 70 59 72 |
72 66 63 62 |
71 65 70 68 |
71 60 72 71 |
71 70 64 61 |
За даними Гідрометеорологічної служби України та власними спостереженнями, у 2009 році в Лісостепу (табл. 2.1) промерзання грунту на рівні –1оС спостерігалось максимум на глибині 55 см. Середньодобова температура навесні та в червні місяці була нижчою за середньорічні показники і відзначалась значною кількістю опадів. Похолодання тривало до початку 2-ї декади червня. Далі з цього періоду впродовж липня – серпня спостерігалось різке підвищення температури, яке часто переходило в спеку.
В 2008 році взимку грунт промерзав до 70 см, середньодобова температура навесні та в червні місяці була дещо вищою за середню багаторічну і відзначалась значною кількістю опадів. Далі в липні спостерігалася сильна спека з повною відсутністю опадів – ГТК – 0,2 (табл.2.2).
Таблиця 2.2 Показники ГТК різних сезонів
|
Рік |
Запорізька обл. |
Київська обл. |
||||||
|
травень |
червень |
липень |
серпень |
травень |
червень |
липень |
серпень |
|
|
2007 |
1,6 |
0,5 |
0 |
0 |
1,3 |
1,1 |
0,7 |
1,0 |
|
2008 |
0,1 |
0,7 |
0,2 |
0,9 |
1,6 |
2,3 |
1,3 |
1,4 |
|
2009 |
0,4 |
0,6 |
2,0 |
0,1 |
0,8 |
0,5 |
1,0 |
1,2 |
|
Середній багаторічний (норма) |
0,77 |
0,65 |
0,76 |
0,47 |
1,36 |
1,36 |
1,36 |
1,36 |
Розмір дослідних ділянок під час польових дослідів становив 50 м2 (7,2 м на 7,2 м). Ділянки з варіантами були розміщені рендомізовано у трьох повторностях.
Статистичну обробку даних проводили за допомогою комп’ютерних програм MSExcel, Statgraphics та Statististica 0.5 (АНОВА).
РОЗДІЛ 3
ЕКСПЕРИМЕНТИ ІЗ ЗАСТОСУВАННЯ БІОПРЕПАРАТУ ФІТОСПОРІН НА ПОСІВНІЙ ЦИБУЛІ
Фітоспорин, мікробіологічний препарат, діючою речовиною якого є живі клітини і спори бактерії Bacillus sub>tilis 26Д 1 млрд. кл/мл. Препарат проявляє дезінфікуючі і захисні властивості, підвищує стійкість рослин до збудників хвороб, є ефективним проти широкого спектру грибкових та бактеріальних хвороб таких як парша, фітофтороз, чорна ніжка, кореневі гнилі, борошниста роса тощо. Дія препарату побудована на антагонізмі бактерії Bacillus sub>tilis до мікроорганізмів – збудників захворювань. Антагоністи інгібують розмноження своїх конкурентів як в тканинах зелених частин рослини так і в коренях.
Фітоспорин застосовують шляхом:
– обробки насіння (замочування);
– обробка розсади та цибулин перед висаджуванням (замочування коренів);
– підживлення рослин;
– обробка грунту перед висадкою розсади на грядки, в теплиці або парники;
– обприскування зеленої частини рослин.
Ефективність Фітоспорину полягає насамперед у стимуляції проростання насіння, захисту насіння і рослин від фітопатогенних організмів, підвищенні урожаю сільськогосподарських культур на 30%, можливості використання протягом всієї вегетації рослин.
Дані щодо впливу Фітоспорину на урожайність культур на прикладі посівної цибулі наведені у таблиці 1.
Як бачимо, урожай посівної цибулі сорту Сонячна за різних способах застосування зростає від 19 до 41%, сорту Київська від 19 до 51%, Урожайна 15 відкритого грунту до 15,6, закритого – 27%. Дослідами в умовах закритого грунту встановлено, що Фітоспорин формує прибавку урожаю посівної цибулі на рівні 10–54%, при чому 54% прибавка відмічається у вересні. За загальним урожаєм препарат забезпечує прибавку 42%. Крім того внесення Фітоспорину підвищує біологічну активність грунту на 83–94%.
Перелік хвороб, які мали місце у 2009-2010 роках містить: склеротиніоз (Sclerotinia graminearum), тифульоз (Typhula graminum), гельмінтоспоріоз (Helminthosporium sativum), фузаріоз (Fusarium avenacum), сніжну плісняву (Fusarium nivale), борошнисту росу (Oidium moniliosdes) та буру іржу (Puccinia triticina).
Таблиця 3.1 Вплив Фітоспорину на урожайність посівної цибулі, ц/га
|
Культура/ сорт |
Контроль |
Застосування Фітоспорину |
Зростання урожаю,% |
Спосіб застосування |
|
Лагідний (відкритий грунт) Сорти для закритого грунту (плівкові теплиці без опалення) |
456 |
481 |
5,5 |
намочування кореневої системи у роз-чині конц. 10 мл/1 л води |
|
456 |
466 |
2,2 |
намочування кореневої системи у роз-чині конц. 5 мл/1 л води |
|
|
456 |
527 |
15,6 |
обприскування рослин роз-чином конц. 0,25 мл/ 1л води |
|
|
5,1 кг/м2 |
6,2 кг/м2 |
27,0 |
обприскування розчином конц. 1000 мл/ т води |
|
|
гібрид Вокал |
452 |
649 |
43,6 |
замочування насіння про-тягом 2–3 год. У розчині конц. 100 мл / 10 л води |
|
452 |
623 |
37,8 |
обробка роз-сади розчином конц. 100 мл / 10 л води |
|
|
452 |
537 |
18,8 |
дворазове обприскування рослин роз-чином конц. 1000 мл / т води |
|
|
452 |
681 |
50,7 |
триразове обприскування рослин роз-чином конц. 1000 мл / т води |
|
|
Робер |
180 |
215 |
19,4 |
одноразове підживлення 0,2 л розчину / росл. конц. 5 мл / 10 л води |
|
180 |
227 |
26,1 |
дворазове підживлення 0,2 л розчину / росл. конц. 5 мл / 10 л води |
|
|
Гудмен |
186 |
257 |
38,2 |
одноразове підживлення 0,2 л розчину / росл. конц. 5 мл / 10 л води |
|
186 |
263 |
41,4 |
дворазове підживлення 0,2 л розчину / росл. конц. 5 мл / 10 л води |
Особливо серйозну проблему ці захворювання становлять на полях, засіяних не протруєним насінням, або ж протруєним неякісними чи фальсифікованими хімічними препаратами. Все це за сприятливих погодних умов може призвести до розвитку епіфітотій і викличе необхідність активного застосування хімічних препаратів, «підводним каменем» проблеми є недоцільність застосування хімічних фунгіцидів за понижених температур весняного періоду. Бактерія–антагоніст Bacillus sub>tilis, яка є діючою речовиною Фітоспорину, здатна ефективно «працювати» проти збудників захворювань вже за температури 1,5оС (до 30 оС) (табл. 3.2).
Таблиця 3.2 Температура, за якої відбувається зараження рослин збудниками захворювань
|
Збудник |
Температура, за якої відбувається зараження, оС |
Доцільність застосування у момент зараження |
|
|
Хімічні фунгіциди |
Фітоспорин |
||
|
Sclerotinia graminearum |
3–30 |
– |
+ |
|
Typhula graminum |
2,5–30 |
– |
+ |
|
Helminthosporium sativum |
2,5–30 |
– |
+ |
|
Fusarium avenacum |
3–30 |
– |
+ |
|
Fusarium nivale |
2,5–30 |
– |
+ |
|
Oidium moniliosdes |
3–30 |
– |
+ |
|
Puccinia triticina |
2,5–30 |
– |
+ |
Більшість інших мікробіологічних препаратів, які мають фунгіцидні властивості працюють за більш високих температур. Наприклад, Verticillum lecanii (діюча речовина препаратів Вертицилін та Вертицилін–Р) може розвиватися за температури від 5 до 32 оС, за оптимуму 22–26 оС. Оптимум же для Trichoderma lignorum (діюча речовина препаратів Триходермін та Триходермін–Р) – 24–28 оС, Ampelomyces (д.р. препарату Ампеломіцин) – 20–24 оС, при діапазоні від 6 до 30 оС, Pseudomonas aureofaciens (д.р. Ризоплану) – 27 оС, Pseudomonas fluorescens (д.р. Бактофіту) – 25 оС. Крім того деякі препарати, як наприклад Ампеломіцин є ефективним щодо обмеженого кола збудників захворювань (борошнисторосяні гриби).
Варто навести деякі економічні показники: норма використання Фітоспорину залежно від способу використання 300 мл/т насіння або 200 мл/га, отже вартість обробки становить 66 і 44 гривні відповідно. Порівняння ціни обробки Фітоспорином з такою провідних хімічних фунгіцидів, яка добре відома практикам, дає підстави визнати його приоритетним при виборі препаратів для використання у виробництві.
РОЗДІЛ 4
ЕКСПЕРИМЕНТИ ІЗ ЗАСТОСУВАННЯ МІКРОБІОЛОГІЧНИХ ПРЕПАРАТІВ ВІДНОСНО БАГАТОЇДНИХ ШКІДНИКІВ ЦИБУЛІ ПОСІВНОЇ
Незважаючи на велику кількість досліджень присвячених ролі мікробіометоду у регулюванні чисельності ґрунтових шкідників, капустянці уваги приділялося мало – з вітчизняних, можна назвати лише роботи Е.Р. Клечковського (пропонує внесення зеленої мускардини та боверії у ями з гноєм, які закладаються у осінній період) і В.Ф. Дрозди (рекомендує застосування препаратів метаризину та боверину у складі принад: на 1 кг розвареного зерна 30 г олії та 50-70 г біопрепарату; згадує про ураження яєць шкідника в гніздових камерах та личинок молодших віків білою мускардиною). Деякі дослідження відносно північноамериканських видів капустянок (Scapteriscus vicinus, Scapteriscus borellii) – по вивченню Beauveria bassiana, Sorosporella - Syngliocladium та вірусів проводилися і в США (Pendland, Boucias, 1987; Boucias, Maruniak, Pendland, 1987; Fowler, 1989; Xia, Hertl, Brandenburg, 2000).
У зв’язку з необхідністю введення до технологій захисту рослин від шкідників елементів, які були б безпечні для навколишнього середовища, тобто біологізації захисних заходів, нами проведено деякі пошукові дослідження, щодо впливу на капустянку звичайну бактеріальних та грибкових препаратів.
Оцінка сучасних мікробіологічних препаратів1 у захисті від капустянки посівної цибулі у відкритому ґрунті. В таблиці 4.1 представлено результати досліду відносно впливу обробки насіння цибулі різними титрами мікробних препаратів на пошкодження сходів капустянкою.
Таблиця4.1 Вплив обробки насіння посівної цибулі мікробіологічними препаратами на пошкодження сходів капустянкою звичайною
|
Варіант |
Початкова кількість рослин, шт. |
Знищено рослин |
|||||
|
5.06 |
12.06 |
26.06 |
|||||
|
шт. |
% |
шт. |
% |
шт. |
% |
||
|
Гаупсин 2116+2687 (титр10х109 бак. кл./мл) |
20 |
2,7 |
13,5 |
3 |
15 |
3 |
15 |
|
Гаупсин 2116+2687 + Емістим |
20 |
12 |
60 |
12 |
60 |
12,3 |
61,5 |
|
Бактофіт B. sub>tilis ІПМ 215 (титр 5х109 спор/мл) |
20 |
9,7 |
48,5 |
10 |
50 |
10,7 |
53,5 |
|
Бактофіт + Емістим |
20 |
10,3 |
51,5 |
10,7 |
53,5 |
11,7 |
58,5 |
|
Тріходермін–Р (титр1,5х109 спор/мл) |
20 |
6,7 |
33,5 |
7,3 |
36,5 |
7,3 |
36,5 |
|
Тріходермін–Р + Емістим |
20 |
9 |
45 |
10 |
50 |
10 |
50 |
|
Емістим |
20 |
10,7 |
53,5 |
10,7 |
53,5 |
10,7 |
53,5 |
|
Контроль (вода) |
20 |
10 |
50 |
10 |
50 |
10,7 |
53,5 |
|
НІР>05> |
6,72 |
6,3 |
6,3 |
Результати досліду показують, що у варіанті з гаупсином 2116+2687 на 5.06 капустянка знищила 13,5% рослин, на 12.06 – 15%; також і 26.06 відсоток випаду складає 15. В інших варіантах ефективність значно менша і залишається на рівні контролю. Так у варіанті, де застосовували гаупсин 2116+2687 з емістимом в період сходів було знищено 60% рослин, в подальшому цей показник майже не змінювався. Схожа картина спостерігається у варіантах з бактофітом та бактофіт у поєднанні з емістимом: 5.06 – 48,5% і 51,5%; 12.06 – 50% і 53,5%; 26.06 – 53,5% і 58,5% відповідно. Варіант з рідким тріходерміном та у поєднанні з бактофітом дає більшу ефективність у порівнянні до інших (крім гаупсину 2116+2687): 5.06 – 33,5 і 45%; 12,06 та 26.06 – 36,5 і 50% відповідно. Емістим окремо не давав істотної ефективності: 5,06 – 53,5%; 12.06 та 26.06 – 53,5%. В контрольному варіанті випади у зв’язку з живленням капустянки звичайної становили 50%. Аналіз даних показує, що в разі обробки насіння розчином біопрепаратів статистично достовірну різницю у порівнянні до контролю має лише застосовування гаупсину 2116+2687 (суміш фунгіцидного і інсектицидного штамів). Емістим в усіх варіантах невілював ефект від використання біопрепаратів. Так у варіанті з гаупсином пошкодження становило ~15%, а у варіанті з тим же гаупсином, але у поєднанні з емістимом – 60%. Подібне спостерігалося по відношенню до бактофіту і бактофіту з емістимом – ~49% і ~54%; триходерміну – Р і триходерміну–Р з емістимом – ~35% і ~47%.
Вплив Bacillus sub>tilis 52 на капустянку звичайну. Оскільки найбільш ефективним методом регулювання чисельності капустянки звичайної вважається застосування принад, було оцінено вплив культуральної рідини Bacillus sub>tilis 5 у складі зернової живильної принади. Результати досліду наведені в таблиці 4.2.
Таблиця 4.2 Вплив Bacillus sub>tilis 5, у складі живильної принади, на капустянку звичайну
|
Стадія онтогенезу |
Час з моменту поїдання принади, діб |
|||||||
|
0,04 |
3 |
5 |
7 |
14 |
20 |
25 |
35 |
|
|
Імаго |
+ |
+ |
+ |
+ |
+ |
+ |
– |
– |
|
Личинки 4 віку |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
Личинки 6 віку |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
+ |
|
“+” - особини живі; “–“ - особини загинули |
Дані таблиці 6.9 показують, що в ході експерименту спостерігається загибель тільки імаго і лише на 25 добу після вживання принади з мікробіологічним агентом. Личинки ж, взагалі не виявили жодних ознак впливу бактерій. Таким чином, результати свідчать про несприйнятливість шкідника до зернових принад на основі Bacillus sub>tilis 5 при вказаному титрі.
РОЗДІЛ 5
МОДЕЛЮВАННЯ ПРОЦЕСУ ОЗДОРОВЛЕННЯ АГРОЦЕНОЗУ ПОСІВНОЇ ЦИБУЛІ ПРИ ЗАСТОСУВАННІ БІОПРЕПАРАТІВ ДЛЯ ЗАХИСТУ РОСЛИН
Уявимо агроценоз за дуже несприятливих обставин, а саме: монокультура в який протягом ряду років використовувались хімічні інсектициди з однаковою діючою речовиною. В такому разі через n-ну кількість років ми отримаємо генотипи шкідників «забруднені» генами резистентності, що унеможливить подальше проведення захисних заходів без істотної зміни асортименту діючих речовин. Відповідно класичної концепції дрейфу генів, ген резистентності або зникне з популяції через певну кількість поколінь, або закріпиться в ній. Зрозуміло, що перший сценарій буде мати місце за умови розірвання хімічного «кола», а другий – якщо застосування класу хімічних речовин до якого виникла резистентність буде тривати. Тривалість елімінації гену тим більша, чим довший був період неправильного застосування хімічних засобів.
Елімінацію гена резистентності можна прискорити застосувавши більш екологічні методи – ентомофаги, мікробіометод тощо.
Отже загальний принцип «оздоровлення» популяції шкідника зводиться до збільшення швидкості елімінації гена резистентності, яку можна представити як відношення періоду екологізації до попереднього періоду використання хімічного методу з урахуванням річної кількості генерацій шкідника.
Але оскільки ентомокомплекс на тій чи іншій культурі складається із значної кількості шкідників, то правомірно, для побудови загальної моделі враховувати кількість шкідників всього комплексу для даної зони.
Нижче ми представимо гіпотетичну модель накопичення генів резистентності у комплексі з дев’яти ентомологічних об’єктів за умови 5–річного застосування торгових марок хімічних інсектицидів з однаковою діючою речовиною та 1-річної екологізації (рис.5.1). Площа поверхні, утворена осями «кількість поколінь», «період екологізації» та «період застосування хімічних препаратів» відповідно до комплексу шкідників, віддзеркалює процес накопичення (поширення в популяціях) генів резистентності і дає можливість визначити точки найбільш ефективного впливу на популяції шкідників для зменшення їх впливу. Так, на гіпотетичній моделі вирізняється максимум, «утворений» попелицями за умови розвитку 30 поколінь на рік. Введення на цій ділянці моделі біометоду істотно вирівняло б показники з накопичення резистентності в ентомокомплексі.
Рис. 5.1 Гіпотетична модель накопичення генів резистентності у ентомокомплексі за умови 5 –річного застосування торгових марок хімічних інсектицидів з однаковою діючою речовиною та 1- річної екологізації
Якщо взяти реальний ентомокомплекс, наприклад для посівної цибулі (табл.5.1), то для за умов, наприклад 5-ти років поспіль застосування хімічних інсектицидів без ротації діючих речовин та 3-х років екологізації, отримаємо швидкість елімінації гена резистентності на рівні 0,0023 для зони Лісостепу і 0,002 для зони Степу. Але навіть за несприятливих умов швидкість подолання резистентності можна збільшити, якщо хоча б частково ввести в систему захисту біологічний метод, наприклад застосування трихограми відносно комплексу лускокрилих (капустяної молі, вогнівки, лучного метелика, капустяного та ріпного біланів, озимої і капустяної совок, совки-гамми).
Таблиця 5.1 Тривалість розвитку представників ентомокомплексу в агроценозі посівної цибулі (в перерахунку на 1 рік)
|
№ |
Вид |
Кількість поколінь |
|
|
Лісостеп |
Степ |
||
|
1 |
Капустянка звичайна Gryllotalpa gryllotalpa L. |
0,5 |
1 |
|
2 |
Вуховертка городня Forficula tomis Kol. |
1 |
1 |
|
3 |
Попелиця Brevicoryne brassicae L. |
30 |
30 |
|
4 |
Польовий клоп Lygus pratensis L. |
3 |
3 |
|
5 |
Клоп Polymerus cognatus Fieb. |
2 |
3 |
|
6 |
Графозома смугаста Graphosoma lineatum L. |
1 |
2 |
|
7 |
Гірчичний клоп Eurydema ornate L. |
1 |
1 |
|
8 |
Клоп Eurydema oleracea L. |
1 |
1 |
|
9 |
Клоп Eurydema ventrale Kol. |
1 |
3 |
|
10 |
Трипс тютюновий Thrips tabaci Lindemann. |
3 |
5 |
|
11 |
Тускляк насіннєвий Amara similata Gyll. |
1 |
1 |
|
12 |
Червневий хрущ Amphimallon solstitialis L. |
0,5 |
0,5 |
|
13 |
Західний травневий хрущ Melolontha melolontha L. |
0,25 |
0,25 |
|
14 |
Хрущик Phyllopertha horticola L. |
1 |
1 |
|
15 |
Epicometis hirta Poda. |
1 |
1 |
|
16 |
Бронзівка смердюча Oxythyrea junesta Poda. |
1 |
1 |
|
17 |
Зернівка повитицева Euspermophagus sericeus Geoffr. |
1 |
1 |
|
18 |
Ковалик степовий Agriotes gurgistanus Fald. |
0,25 |
0,33 |
|
19 |
Ковалик темний Agriotes lineatus L. |
0,25 |
0,25 |
|
20 |
Ковалик смугастий Agriotes obscurus L. |
0,2 |
0,2 |
|
21 |
Квіткоїд Meligethes aeneus F. |
1 |
1 |
|
22 |
Блішка чорна Phyllotreta atra F. |
1 |
1 |
|
23 |
Світлонога блішка Phyllotreta nemorum L. |
1 |
1 |
|
24 |
Синя блішка Phyllotreta nigripes F. |
1 |
1 |
|
25 |
Хвиляста блішка Phyllotreta undulate Kutsch. |
1 |
1 |
|
26 |
Смугаста блішка Phyllotreta vittula Redt. |
1 |
1 |
|
27 |
Прихованохоботник Ceutorrhynchus assimilis Payk. |
1 |
1 |
|
28 |
Стебловий прихованохоботник Ceutorrhynchus quadridens Panz. |
1 |
1 |
|
29 |
Чорний барид Baris carbonariae Boh. |
1 |
1 |
|
30 |
Ріпаковий барид Baris chlorizans Germ. |
1 |
1 |
|
31 |
Зелений барид Baris coerulescens Scop. |
1 |
1 |
|
32 |
Міль Plutella maculipennis Curt. |
4 |
5 |
|
33 |
Капустяна вогнівка Evergestis forficalis L. |
2 |
3 |
|
34 |
Лучний метелик Margaritia sticticalis L. |
2 |
3 |
|
35 |
Білан Pieris brassicae L. |
2 |
4 |
|
36 |
Ріпний білан Pieris rapae L. |
2 |
2 |
|
37 |
Озима совка Agrotis segetum Schiff. |
2 |
3 |
|
38 |
Совка Mamestra brassicae L. |
2 |
2 |
|
39 |
Совка-гамма Autographa gamma L. |
3 |
3 |
|
40 |
Пильщик Athalia rosae L. |
2 |
2 |
|
41 |
Болотяна довгоніжка Tipula paludosa Meig. |
1 |
1 |
|
42 |
Весняна цибулева муха Delia (Hylemyia) brassicae Bouche. |
2 |
2 |
|
43 |
Літня цибулева муха Delia (Hylemyia) floralis Fall. |
1 |
1 |
Цей варіант розвитку подій представлено рисунку 5.2 Швидкість при цьому зросте до 0,003 для обох агрокліматичних зон, тобто на 30%. І це при тому, що біологічним методом регулювалась чисельність 18,6% видів, що входили ентомокомплексу, або 22,1% загальної річної кількості генерацій для Лісостепу і 25,4% - для Степу.

Рис.5.2 Модель накопичення генів резистентності у комплексі шкідників посівної цибулі за умови часткової екологізації захисних заходів – застосування трихограми відносно лускокрилих.
РОЗДІЛ 6
МІСЦЕ ЦИБУЛІ ПОСІВНОЇ В ЕКОЛОГІЗОВАНИХ СІВОЗМІНАХ ЛІСОСТЕПУ УКРАЇНИ
Екологізація, яка передбачає 100%-ве насичення біометодом захисту культури в конкретний період може стосуватися:
– «оздоровлення» агроценозу;
– отримання максимально чистої овочевої продукції (з урахуванням оптимального урожаю).
Рекомендована для південно-західної частини Лісостепу схема спрямована на отримання екологічно-чистої капусти, цибулі, огірків та ранніх овочів, які споживають у свіжому вигляді(табл. 6.1).
Таблиця 6.1 Локалізація періодів використання біометоду при вирощуванні овочів для споживання у свіжому вигляді
|
№ поля |
Культура |
|
1 |
Люцерна |
|
2 |
Люцерна |
|
3 |
Томати розсадні, перець, баклажани |
|
4 |
Цибуля, столові коренеплоди |
|
5 |
Капуста, огірки |
|
6 |
Збірне поле (ранні овочеві) |
|
7 |
Томати безрозсадні |
|
8 |
Ярі зернові з підсівом люцерни |
|
9 |
Люцерна |
|
10 |
Люцерна |
Спрямування наступної схеми (для тієї ж зони) також переважне отримання чистої овочевої продукції. Причому наголос робиться на зеленні, ранні овочі, огірки та розсадні томати(табл.6.2).
Таблиця 6.2 Локалізація періодів використання біометоду при вирощуванні зеленних, ранніх овочів, огірків та розсадних томатів
|
№ поля |
Культура |
|
1 |
Люцерна |
|
2 |
Люцерна |
|
3 |
Томати розсадні |
|
4 |
Зеленні |
|
5 |
Огірки |
|
6 |
Томати |
|
7 |
Ранні овочеві + літній посів люцерни |
|
8 |
Люцерна |
|
9 |
Люцерна |
|
10 |
Томати розсадні |
За впровадження наступної сівозміни доцільно зробити «ставку» на «м’який» захист овочевого гороху, розсадних томатів, перцю та баклажанів. Тобто знову ж тієї продукції, яку можна реалізувати у свіжому вигляді(табл.6.3).
Таблиця 6.3 Локалізація періодів використання біометоду при вирощуванні овочевого гороху, цибулі, розсадних томатів, перцю та баклажанів
|
№ поля |
Культура |
|
1 |
Люцерна |
|
2 |
Люцерна |
|
3 |
Томати розсадні, перець, баклажани |
|
4 |
Овочевий горох |
|
5 |
Озима пшениця |
|
6 |
Томати безрозсадні |
|
7 |
Кукурудза на зелений корм з підсівом люцерни |
|
8 |
Цибуля |
|
9 |
Люцерна |
|
10 |
Томати розсадні, перець, баклажани |
Поблизу санаторно-курортних зон захист рослин необхідно орієнтувати на отримання максимально чистої овочевої продукції (цибуля, редиска, капуста, огірки, томати)(табл.6.4).
Таблиця 6.4 Локалізація періодів використання біометоду при вирощуванні овочів у санаторно-курортних зонах
|
№ поля |
Культура |
|
1 |
Люцерна |
|
2 |
Томати |
|
3 |
Редиска, пізньостигла капуста |
|
4 |
Огірки |
|
5 |
Цибуля |
|
6 |
Столові коренеплоди |
|
7 |
Ячмінь з підсівом люцерни |
|
8 |
Люцерна |
|
9 |
Томати |
|
10 |
Редиска, пізньостигла капуста |
Зона обслуговування переробної промисловості повинна орієнтуватися також на вирощування екологічно-чистих овочів. У запропонованих нижче двох схемах введених у Київській області це – овочевий горох, томати, цибуля, капуста, огірки, кабачки, баклажани, столові буряки тощо(табл.6.5).
Таблиця 6.5 Локалізація періодів використання біометоду при вирощуванні овочевої продукції для переробки у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом люцерни |
|
2 |
Люцерна |
|
3 |
Люцерна |
|
4 |
Томати розсадні, цибуля |
|
5 |
Овочевий горох |
|
6 |
Озима пшениця |
|
7 |
Томати безрозсадні; цибуля |
|
8 |
Капуста, огірки, столові коренеплоди та інші овочеві |
|
9 |
Ярі зернові з підсівом люцерни |
|
10 |
Люцерна |
Таблиця 6.6 Локалізація періодів використання біометоду при вирощуванні овочевої продукції у зоні обслуговування переробного підприємства в Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом люцерни |
|
2 |
Люцерна |
|
3 |
Люцерна |
|
4 |
Томати, цибуля |
|
5 |
Огірки, кабачки |
|
6 |
Столові коренеплоди |
|
7 |
Горох, пізня капуста, пізні огірки, столові буряки |
|
8 |
Пасльонові |
|
9 |
Ярі зернові з підсівом люцерни |
|
10 |
Люцерна |
Ще один варіант «сировинної овочевої» сівозміни орієнтований виключно на обслуговування виробництва консервованого зеленого горошку та зеленої цибулі. Очевидно, що він повинен захищатися без застосування хімічних інсектицидів(табл.6.7).
Таблиця 6.7 Локалізація періодів використання біометоду при вирощуванні зеленого горошку та цибулі
|
№ поля |
Культура |
|
1 |
Овочевий горох + післяжнивні посіви |
|
2 |
Озима пшениця |
|
3 |
Цибуля |
|
4 |
Овочевий горох + післяжнивні посіви |
|
5 |
Озима пшениця |
|
6 |
Безрозсадні томати |
|
7 |
Овочевий горох + післяжнивні посіви |
|
8 |
Озима пшениця |
|
9 |
Безрозсадні томати |
|
10 |
Овочевий горох + післяжнивні посіви |
У центрально-східній частині Лісостепу з поміж овочевих сівозмін часто використовують схеми чергування овочевих з багаторічними травами, просапними та зерновими. Дві з них наведені нижче. За такого підходу біологізація системи захисту охоплює такі культури як томати, огірки, капусту, цибулю та столові коренеплоди(табл.6.8)
Таблиця 6.8 Локалізація періодів використання біометоду при вирощуванні овочів у центрально-східній частині Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом люцерни |
|
2 |
Люцерна |
|
3 |
Люцерна |
|
4 |
Томати |
|
5 |
Огірки |
|
6 |
Озима пшениця |
|
7 |
Цибуля та столові коренеплоди |
|
8 |
Капуста |
|
9 |
Збірне поле |
|
10 |
Ярі зернові з підсівом люцерни |
Таблиця 6.9 Локалізація періодів використання біометоду при вирощуванні овочів у центрально-східній частині Лісостепу ( другий варіант)
|
№ поля |
Культура |
|
|
1 |
Рання картопля, ранні овочі і літній посів люцерни |
|
|
2 |
Люцерна |
|
|
3 |
Люцерна |
|
|
4 |
Томати |
|
|
5 |
Огірки |
|
|
6 |
Цибуля |
|
|
7 |
Капуста |
|
|
8 |
Збірне поле |
|
|
9 |
Рання картопля, ранні овочі і літній посів люцерни |
|
|
10 |
Люцерна |
При вирощування овочевих на зрошенні у центрально-східній частині Лісостепу часто використовують варіант сівозміни, спрямований на переважне вирощування капусти, томатів, перцю, баклажанів, огірків, цибулі та столових коренеплодів. Охопити екологічним захистом їх за 40%-вої стратегії насичення системи захисту біологічними методами можна на чорноземах і каштанових грунтах (друга схема)(табл.6.10).
Таблиця 6.10 Локалізація періодів використання біометоду при вирощуванні овочів у центрально-східній частині Лісостепу на зрошенні
|
№ поля |
Культура |
|
1 |
Люцерна |
|
2 |
Люцерна |
|
3 |
Капуста |
|
4 |
Томати, перець, баклажани |
|
5 |
Огірки, кукурудза на силос |
|
6 |
Озима пшениця |
|
7 |
Цибуля, столові коренеплоди |
|
8 |
Картопля |
|
9 |
Ярі зернові з підсівом люцерни |
|
10 |
Люцерна |
Таблиця 6.11 Локалізація періодів використання біометоду при вирощуванні овочів у центрально-східній частині Лісостепу на зрошенні ( другий варіант)
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом люцерни |
|
2 |
Люцерна |
|
3 |
Люцерна |
|
4 |
Огірки |
|
5 |
Томати |
|
6 |
Цибуля |
|
7 |
Капуста |
|
8 |
Збірне поле |
|
9 |
Ярі зернові з підсівом люцерни |
|
10 |
Люцерна |
Наступна запропонована овочева сівозміна орієнтована на вирощування капусти, цибулі, томатів та ранньої картоплі(табл.6.12).
Таблиця 6.12 Локалізація періодів використання біометоду при вирощуванні капусти, огірків, томатів та ранньої картоплі у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом люцерни |
|
2 |
Люцерна |
|
3 |
Люцерна |
|
4 |
Капуста |
|
5 |
Томати |
|
6 |
Цибуля |
|
7 |
Рання картопля |
|
8 |
Озима пшениця |
|
9 |
Цибуля, столові коренеплоди |
|
10 |
Збірне поле |
Дещо змінений варіант сівозміни введеної у Харківській області передбачає вирощування моркви. Оскільки останню, як елемент дитячого харчування дуже важливо довести до споживача у максимально «екологічному» вигляді, то тактика за 40%-вої стратегії захисту дещо зміниться. Вона обов’язково повинна охопити моркву(табл..6.13).
Таблиця 6.13 Локалізація періодів використання біометоду при вирощуванні капусти, цибулі, томатів та моркви у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі з підсівом трав |
|
2 |
Багаторічні трави |
|
3 |
Багаторічні трави |
|
4 |
Цибуля |
|
5 |
Томати |
|
6 |
Капуста |
|
7 |
Інші овочеві |
|
8 |
Морква |
|
9 |
Ярі з підсівом трав |
|
10 |
Багаторічні трави |
Досить проста схема, спрямована переважно на богарне вирощування цибулі, томатів, огірків та капусти в умовах Харківської області(табл.6.14).
Таблиця 6.14 Локалізація періодів використання біометоду при богарному вирощуванні цибулі, капусти, огірків та томатів у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Пар |
|
2 |
Цибуля |
|
3 |
Томати безрозсадні, столові буряки |
|
4 |
Огірки; інші гарбузові |
|
5 |
Капуста безрозсадна |
|
6 |
Кукурудза на силос |
|
7 |
Пар |
|
8 |
Озима пшениця |
|
9 |
Томати безрозсадні, столові буряки |
|
10 |
Огірки; інші гарбузові |
За використання такої ж тактики і стратегії як у попередньому варіанті для захисту цибулі, томатів, овочевого гороху, огірків та кабачків у сировинній зоні консервного заводу (Черкаська область) може забезпечити значний економічний та екологічний виграш(табл.6.15).
Таблиця 6.15 Локалізація періодів використання біометоду при вирощуванні овочевої у сировинній зоні консервного заводу у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Зернові з підсівом багаторічних трав |
|
2 |
Багаторічні трави |
|
3 |
Озима пшениця |
|
4 |
Томати, цибуля |
|
5 |
Овочевий горох |
|
6 |
Збірне поле (перець, баклажани) |
|
7 |
Кукурудза на силос |
|
8 |
Томати |
|
9 |
Огірки, кабачки, столові коренеплоди, овочевий горох |
|
10 |
Зернові з підсівом багаторічних трав |
Орієнтуватися на застосування біометоду для захисту цибулі, томатів і капусти (два наступні варіанти сівозмін, у тому числі другий – на чорноземах та темно-сірих лісових грунтах без зрошення) в умовах правобережного Лісостепу доцільно за умови 40%-вої стратегії(табл.6.16).
Таблиця 6.16 Локалізація періодів використання біометоду при екологізації вирощування цибулі, томатів та капусти у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом конюшини |
|
2 |
Конюшина (два укоси) |
|
3 |
Огірки |
|
4 |
Томати |
|
5 |
Цибуля, столові коренеплоди |
|
6 |
Капуста |
|
7 |
Збірне поле |
|
8 |
Ярі зернові з підсівом конюшини |
|
9 |
Конюшина (два укоси) |
|
10 |
Огірки |
|
Другий варіант (на чорноземах та темно-сірих лісових грунтах без зрошення) |
|
|
1 |
Вико-вівсяна сумішка на сіно з підсівом конюшини |
|
2 |
Конюшина |
|
3 |
Огірки |
|
4 |
Томати |
|
5 |
Цибуля |
|
6 |
Капуста пізня |
|
7 |
Столові коренеплоди |
|
8 |
Вико-вівсяна сумішка на сіно з підсівом конюшини |
|
9 |
Конюшина |
|
10 |
Огірки |
Представлена сівозміна рекомендована для умов лівобережного Лісостепу (на чорноземах без зрошення) і спрямована на вирощування цибулі, огірків, томатів та пізньої капусти(табл.6.17).
Таблиця 6.17 Локалізація періодів використання біометоду при вирощуванні цибулі, огірків, томатів та капусти на чорноземах без зрошення у зоні Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом люцерни |
|
2 |
Люцерна 1-го року |
|
3 |
Люцерна 2-го року |
|
4 |
Огірки |
|
5 |
Томати |
|
6 |
Цибуля |
|
7 |
Капуста пізня |
|
8 |
Збірне поле |
|
9 |
Ярі зернові з підсівом люцерни |
|
10 |
Люцерна 1-го року |
Орієнтація на вирощування екологічно-чистих цибулі і томатів за умови «40%-вої» стратегії західному Лісостепу дозволить отримати непоганий економічний виграш(табл.6.18).
Таблиця 6.18 Локалізація періодів використання біометоду при екологізації вирощування цибулі та томатів у західному Лісостепу
|
№ поля |
Культура |
|
1 |
Озиме жито з підсівом конюшини |
|
2 |
Конюшина |
|
3 |
Цибуля |
|
4 |
Томати |
|
5 |
Цибуля, часник, столові коренеплоди |
|
6 |
Озиме жито з підсівом конюшини |
|
7 |
Конюшина |
|
8 |
Огірки |
|
9 |
Томати |
|
10 |
Цибуля, часник, столові коренеплоди |
Отримання екологічно-чистих цибулі, огірків, кабачків та капусти при введенні нижченаведеної сівозміни (Львівська область) також можливе за використання нижченаведеної сівозміни(табл.6.19).
Таблиця 6.19 Локалізація періодів використання біометоду при екологізації вирощування цибулі, огірків, кабачків та капусти у західному Лісостепу
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом конюшини |
|
2 |
Конюшина |
|
3 |
Огірки, кабачки |
|
4 |
Томати, цибуля |
|
5 |
Капуста |
|
6 |
Збірне поле (коренеплоди та інші овочеві) |
|
7 |
Ярі зернові з підсівом конюшини |
|
8 |
Конюшина |
|
9 |
Огірки, кабачки |
|
10 |
Томати, цибуля |
Наступні овочеві сівозміни орієнтовані на промислове вирощування переважно огірків, томатів, цибулі та капусти. Нижче представлені три схеми, рекомендовані для піщаних грунтів та мінеральних грунтів без зрошення. Якщо поставити за мету отримання максимально чистого урожаю огірків та томатів за першою схемою, то доцільно використати тактику 40%-го насичення біометодом. Для другого варіанту розміщення овочевих варто зупинитися на тактиці суцільного переміщення періодів застосування біометод. У цьому разі «біометодом» можна охопити огірки, томати, баклажани, перець, цибулю, зеленні овочеві та капусту. Для третьої схеми за необхідності вирощування цибулі, огірків, томатів, капусти і столових коренеплодів без застосування «важких» методів захисту, рекомендуємо застосовувати також 40%-ву тактику(табл.6.20).
Таблиця 6.20 Локалізація періодів використання біометоду при екологізації промислового вирощування овочів
|
№ поля |
Культура |
|
1 |
Люпин на силос |
|
2 |
Огірки |
|
3 |
Томати |
|
4 |
Цибуля, столові коренеплоди |
|
5 |
Збірне поле |
|
6 |
Капуста |
|
7 |
Люпин на силос |
|
8 |
Огірки |
|
9 |
Томати |
|
10 |
Цибуля, столові коренеплоди |
Таблиця 6.21 Локалізація періодів використання біометоду при екологізації промислового вирощування овочів (другий варіант)
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом багаторічних трав |
|
2 |
Багаторічні трави |
|
3 |
Огірки |
|
4 |
Томати; баклажани, перець |
|
5 |
Цибуля, зеленні овочеві культури |
|
6 |
Капуста |
|
7 |
Столові коренеплоди |
|
8 |
Ярі зернові з підсівом багаторічних трав |
|
9 |
Багаторічні трави |
|
10 |
Огірки |
Таблиця 6.22 Локалізація періодів використання біометоду при екологізації промислового вирощування овочів (третій варіант)
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом багаторічних трав |
|
2 |
Багаторічні трави |
|
3 |
Цибуля |
|
4 |
Капуста |
|
5 |
Томати |
|
6 |
Столові коренеплоди |
|
7 |
Капуста |
|
8 |
Збірне поле |
|
9 |
Ярі зернові з підсівом багаторічних трав |
|
10 |
Багаторічні трави |
На мінеральних зрошуваних грунтах можливість отримати чисту продукцію огірків, кабачків, томатів, цибулі, зеленних овочевих та капусти дає наступна сівозміна(табл.6.23).
Таблиця 6.23 Локалізація періодів використання біометоду при екологізації вирощування овочів на мінеральних зрошуваних грунтах
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом багаторічних трав |
|
2 |
Багаторічні трави |
|
3 |
Багаторічні трави |
|
4 |
Огірки, кабачки |
|
5 |
Томати |
|
6 |
Цибуля, зеленні овочеві культури |
|
7 |
Капуста |
|
8 |
Столові коренеплоди |
|
9 |
Ярі зернові з підсівом багаторічних трав |
|
10 |
Багаторічні трави |
Вирощування ранніх огірків, гороху, цибулі, ранньої білоголової та цвітної капусти на мінеральних зрошуваних грунтах передбачає зміщення періодів застосування біологічних методів саме до цих культур(табл.6.24).
Таблиця 6.24 Локалізація періодів використання біометоду при вирощуванні ранніх овочів на мінеральних зрошуваних грунтах
|
№ поля |
Культура |
|
1 |
Ранні огірки, кабачки, горох, після збирання яких сіють багаторічні трави |
|
2 |
Багаторічні трави або томати, баклажани, перець |
|
3 |
Цибуля, часник, столові коренеплоди |
|
4 |
Рання та пізня білоголова та цвітна капуста |
|
5 |
Томати |
|
6 |
Ранні огірки, кабачки, горох, після збирання яких сіють багаторічні трави |
|
7 |
Багаторічні трави або томати, баклажани, перець |
|
8 |
Цибуля, часник, столові коренеплоди |
|
9 |
Рання та пізня білоголова та цвітна капуста |
|
10 |
Томати |
За розміщення овочевої сівозміни на торфовищах за нижченаведеними двома схемами варто застосовувати або тактику «суцільного переміщення періодів» застосування біометоду, отримуючи урожай картоплі, цибулі, капусти та столових коренеплодів без пестицидного навантаження та або тактику, коли планується біологічний захист моркви, картоплі та капусти, з порівняно високим виграшем людини у врожайності цих культур (табл.6.25).
Таблиця 6.25 Локалізація періодів використання біометоду при вирощуванні овочів на торфовищах
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом багаторічних трав |
|
2 |
Багаторічні трави |
|
3 |
Багаторічні трави |
|
4 |
Картопля |
|
5 |
Цибуля, середня і пізня капуста |
|
6 |
Кукурудза на силос |
|
7 |
Столові коренеплоди |
|
8 |
Ярі зернові з підсівом багаторічних трав |
|
9 |
Багаторічні трави |
|
10 |
Багаторічні трави |
Таблиця 6.26 Локалізація періодів використання біометоду при вирощуванні овочів на торфовищах (другий варіант)
|
№ поля |
Культура |
|
1 |
Однорічні трави |
|
2 |
Морква |
|
3 |
Кукурудза на зелений корм |
|
4 |
Картопля |
|
5 |
Столові буряки |
|
6 |
Капуста |
|
7 |
Однорічні трави |
|
8 |
Морква |
|
9 |
Кукурудза на зелений корм |
|
10 |
Картопля |
На мінеральних грунтах зони Лісостепу для ефективного вирощування огірків, цибулі, томатів та капусти рекомендують наступні сівозміни. Якщо зосередити застосування біометоду за 40%-вої стратегії біологізації захисту рослин саме на цих культурах, то забезпечити це можна(6.27).
Таблиця 6.27 Локалізація періодів використання біометоду при вирощуванні огірків, цибулі, томатів та капусти на мінеральних грунтах в зоні Полісся
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом багаторічних трав |
|
2 |
Цибуля |
|
3 |
Огірки |
|
4 |
Томати |
|
5 |
Капуста |
|
6 |
Огірки |
|
7 |
Томати |
|
8 |
Ярі зернові з підсівом багаторічних трав |
|
9 |
Багаторічні трави |
|
10 |
Огірки |
Таблиця 6.28 Локалізація періодів використання біометоду при вирощуванні огірків, цибулі, томатів та капусти на мінеральних грунтах (другий варіант)
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом конюшини |
|
2 |
Цибуля |
|
3 |
Огірки |
|
4 |
Томати |
|
5 |
Цибуля |
|
6 |
Рання і середня капуста |
|
7 |
Огірки |
|
8 |
Томати, баклажани, перець |
|
9 |
Ярі зернові з підсівом конюшини |
|
10 |
Конюшина |
На дерново-підзолистих грунтах Полісся за умови вирощування екологічно-чистої продукції огірків, томатів, цибулі та капусти варто орієнтуватися на «40%-ву» стратегію захисту(табл.6.29).
Таблиця 6.29 Локалізація періодів використання біометоду при вирощуванні огірків, цибулі, томатів та капусти на дерново-підзолистих грунтах
|
№ поля |
Культура |
|
1 |
Ярі зернові з підсівом конюшини |
|
2 |
Конюшина |
|
3 |
Огірки |
|
4 |
Томати |
|
5 |
Цибуля |
|
6 |
Столові коренеплоди |
|
7 |
Капуста |
|
8 |
Збірне поле |
|
9 |
Ярі зернові з підсівом конюшини |
|
10 |
Конюшина |
ВИСНОВКИ
1. На сьогодні, враховуючи загальний економічний стан держави, доцільно запропонувати наступні перспективні напрямки досліджень і шляхи покращення ситуації:
Розробити національну комплексну програму “Біопестициди України”, в якій:
обґрунтувати доцільність наукового пошуку в цій галузі;
показати виконані розробки за попередні роки, спадкоємність досліджень, можливі нові технологічні рішення на етапах підбору вірулентних штамів, технологій отримання препаратів, а також їх використання в системах захисту рослин;
розрахувати щорічну потребу для споживачів України, показати переваги, недоліки, шляхи вирішення, економічні обрахунки, шляхи фінансування.
Конкурсний відбір та генетична селекція найбільш перспективних штамів грибних та інших патогенів комах з наступним використанням їх як діючої речовини біопрепаратів;
2. Сформувати основну стратегію захисту овочевих культур відкритого та закритого грунту з визначенням домінуючих та сприйнятливих до дії мікробіологічних агентів видів фітофагів; забезпечити виробничників штамами вертициліуму, ашерсонії, триходерми, боверії, обґрунтувати технології використання грибних препаратів як самостійно, так і сумісно з іншими, у тому числі з ентомо– та акарифагами для боротьби з такими шкідниками, як оранжерейна білокрила, трипси, павутинні кліщі;
3. Розробка технологій вирощування овочевих культур, зокрема цибулі посівної з використанням мікробіопрепаратів (бактеріальних, грибних, вірусних) дозволяє підвищити її урожайність на 30-35%.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
Алекси–Месхишвили А.Г. К изучению биологии бумаго-разрушающих грибов // Сообщения АН Груз. ССР. – 1964. – Т.36. – №2. – С. 455–456.
Андреева И.В., Штерншис М.В. Микробиологические препараты против паутинного клеща в теплицах // Защита растений. – 1995. – №11. – С. 41–42.
Аретинська Т.Б. Ентомопатогенні властивості деяких штамів бактерій групи sub>tilis – meseutericus // Мікробіол. журнал. – 1976. – Т.38. –Вип..5. – С.591–593.
Африкян Э.К. Энтомопатогенные бактерии и их значение. – Ереван: Изд–во АН Арм.ССР, 1973. – 420 с.
Ахмедов Р.М. Результаты применения боверина против колорадского жука (Leptinotarsa decemlineata Say.) в условиях Кусарского района Азербайджанской ССР / В кн.: Использование микроорганизмов для борьбы с вредными насекомыми в сельском и лесном хозяйстве. – Иркутск, 1981. – С. 105–112.
Бабчук И.В., Шилина О.В., Гораль В.М., Жигаев Г.Н. и др. Рекомендации по борьбе с оранжерейной белокрылкой в защищенном грунте. – К.: Урожай, 1986. – 32 с.
Барабанов В.А., Штайн С.Е. Место биометода в плодовом саду // Защита и карантин растений. – 1997. – №6. – С. 9–10.
Билай В.И. Летучие антибиотики грибов рода Trichoderma Pers. // Микробиология. – 1956. – Т.21. – Вып.4. – С. 458–465.
Билай В.И., Заневич В. Е. К вопросу о природе антагонизма грибов рода триходерма / В кн.: Антибиотики. – К.: Изд. АН УССР, 1961. – 183 с.
Билай В.И., Пидопличко Н.М. Токсинообразующие микроскопические грибы и вызываемые ими заболевания человека и животных. – К.: Наукова думка, 1970. – 291 с.
Бойко О.И., Колесова Э.А., Киприанова Е.Л. и др. Флюоресцирующие бактерии рода Pseudomonas, выделенные из различных эколого–географических зон СССР и их антагонистические свойства // Материалы VI съезда Украинского микробиол. об–ва. – К.: Наукова думка, 1984. – С. 124–125.
Бондаренко Н.В. Биологическая защита растений. – Л.: Колос, 1978. – 256 с.
Борисов Б.А., Ущеков А.Т. Энтомофильные грибы–гифомицеты против пасленового минера // Защита и карантин растений. – 1997. – №5. – С. 10–11.
Боярин В.В. Биозащита огурцов в теплицах не только возможна, но и необходима // Защита растений. – 1994. – №6. – С.36–37.
Буймистру Л.Д. Влияние некоторых факторов внешней среды на гриб Trichoderma lignorum в культуре / В кн.: Грибные и вирусные болезни сельскохозяйственных культур Молдавии. – Кишинев: Штиинца, 1977. – С. 53–59.
Васильев В.П., Лесовой М.П. История защиты растений от вредителей и болезней в Украине. – К.: Аграрна наука, – 132 с.
Вейзер Я. Микробиологические методы борьбы с вредными насекомыми. – М.: Колос, 1972. – 640 с.
Винокурова Т.П. Триходермин против болезней в защищенном грунте // Защита растений. – 1991. – №1. – С. 16.
Воловник С.В. У истоков биометода // Защита растений. – 1979. – №11. – С. 40.
Гаврилов А.А., Бойко А.П. Биопрепараты для защиты озимой пшеницы от болезней // Защита и карантин растений. – 2001. – №1. – С. 29.
Гарагуля А.Д. Антибиотическое действие бактерий на фитопатогенные грибы. – Автореф. дис. … канд. биол. наук. – К., 1975. – 28с.
Гораль В.М. К вопросу оценки вирулентности конидий Beauveria bassiana (Bals) Vuill // Микол. и фитопатол. – 1973. – Т.7. – Вып.4. – С. 353–356.
Гораль В.М., Гораль С.В., Лаппа Н.В. Регламент производства нового микробиологического препарата Вертицилн – Р. – К., 2000. – 40 с.
Гораль В.М., Лаппа Н.В. Вплив боверіну в різних концентраціях на личинок колорадського жука // Захист рослин. Зб. наук. праць. – 1973. – Вип.18. – С. 33–41.
Гораль В.М., Лаппа Н.В., Пєтровський Б.Є. Вплив боверіну на тривалість життя і плодючість імаго колорадського жука // Захист рослин. Зб. наук. праць. – 1976. – Вип.23. – С. 53–56.
Гораль В.М., Лаппа Н.В., Смірнов В.В., Кіпріанова Е.А., Бойко О.І., Гарагуля О.Д., Салій А.І. Ефективність припосівної обробки насіння бактеріальними препаратами в боротьбі з кореневими гнилями зернових культур // Захист рослин. Зб. наук. праць. – 1994. – Вип.41. – С. 107–112.
Гораль С.В. Обґрунтування прийомів оптимізації малотоннажної технології виробництва грибних і бактеріальних засобів захисту рослин. – Дис. канд. с.–г. наук. – К., 1998. – 141 с.
Гораль С.В. Особливості культивування ентомопатогенного гриба Verticillium lecanii (Zimm.) Viegas. за глибинною технологією // Захист рослин. Зб. наук. праць. – 1999. – Вип.45. – С. 83–87.
Горленко М.В. Мучнисторосяные грибы Московской области. – М.: Изд–во МГУ, 1983. – 72 с.
Горовиц–Власова Л.М. Определитель бактерий. – М.–Л.: Снабтехиздат, 1933. – 172 с.
Гринько Н.Н. Биологическая защита стеблей огурца от гнилей // Защита растений. – 1992. – №5. – С. 19–20.
Гузь А.Л. Биометод на полях Адыгеи // Защита и карантин растений. – 1997. – №1. – С. 15–16.
Давыдова Е.П., Рудаков О.Л., Гановская Л.А. Получение спор микофильных грибов Ampelomyces Ces. ex Schlecht. при глубинном выращивании // Микол. и фитопатол. – 1985. – Т.19. – Вып.1. – С. 9–11.
Дементьев Г.С., Струлович М.И. Виноторговля. В кн. Энциклопедия виноградарства. – Т.1. – Кишинев: Глав. ред. Молдавской Сов. Энциклопед., 1986. – С. 251.
Джалилов Ф.С., Корсак И.В., Перебитюк А.Н. Ризоплан против бактериозов капусты // Защита растений. – 1994. – №9. – С. 20.
Димович В.О. Дія летких антибіотиків різних культур Trichoderma на фітопатогенні бактерії і гриби // Мікробіол. журнал. – 1960. – Т.22. – С.32–38.
Доброхотов С.А. Агат–25К в теплицах // Защита и карантин растений. – 1998. – №9. – С. 23.
Дуденко В.П., Лаппа Н.В., Гораль С.В., Гораль В.М. Екологічна оптимізація захисту соняшника // Тези доп. конф. “Оптимізація структури агроландшафтів і раціонального використання ґрунтових ресурсів (Київ, 4–7 липня 2000р)”. – К., 2000. – С. 53.
Евлахова А.А. Энтомопатогенные грибы. – Л.: Наука, 1974. – 260 с.
Евлахова А.А., Швецова О.И., Щепетильникова В.А. Биологические методы борьбы с вредными насекомыми. – Л.–М.: Гос. изд. с.–х. лит., 1961. – 96 с.
Ермакова Л.Н., Смирнова Т.А., Алиханян С.И. Кристаллические включения мутанта Bacillus sub>tilis с измененным спектром протеиназ // Докл. АН СССР. – 1977. – Вып. 236. – №4. – С. 1001–1003.
Есельсон В.А. Биометод в Калининградской области // Защита и карантин растений. – 1999. – №11. – С. 11.
Есипов С.Е., Аданин В.М., Баскунов Б.П. Новый антибиотически активный флюроглюцид из Pseudomonas aurantica // Антибиотики. – 1975. – 20. – №2. – С. 1077–1081.
Кальвиш Т.К. Влияние температуры и относительной влажности воздуха на мускардиновые грибы // Изв. СО АН СССР (сер. биол. наук). – 1974. – Т.5. – №1. – С. 66–77.
Кандыбин Н.В. Бактериальные средства борьбы с грызунами и вредными насекомыми: Теория и практика. – М.: Агропромиздат, 1989. – 172с.
Кандыбин Н.В. Проблемы микробиометода // Защита растений. – 1995. – №6. – С. 10–11.
Кандыбин Н.В., Корешкова Г.Н. Технологический регламент производства влажного зернового бактороденцида. – М.: Госагропром РСФСР, 1987. – 30 с.
Кандыбин Н.В., Серебрякова Л.К., Корешкова Г.Н. Микробиологический метод борьбы с вредными грызунами и перспектива его развития // Тр. ВНИИСХ микробиол. – Т.49. – 1980. – С.137–149.
Канивец И.И., Омельчук А.В., Харитон Е.Г. Почвенный гриб триходерма лигнорум (Trichoderma lignorum). – К.: ВНИИ сах. пром., 1940. – 56 с.
Касперович Е.В., Соловей Е.Ф. Испытания заводского вертицилина // Защита растений. – 1992. – №9. – С. 22.
Кобахидзе Д.М. О роли Cicinnobolus Ceratii De Bary в подавлении Podosphaera leucotricha // Бот. жур. – 1965. – Т.50. – №9. – С. 1307–1309.
Коваленко Н.М., Коваленко Т.Д. Триходермин: опыт исследования и применения // Защита растений. – 1992. – №9. – С. 20–22.
Коваль Э.З. Определитель энтомофильных грибов СССР. – К.: Наукова думка, 1974. – 260 с.
Котляревский Д.И., Павлюшин В.А. Гетерокариоз у энтомопатогенного гриба Verticillium lecanii (Zimm.) Viegas. // Микол. и фитопатол. – 1986. – Т.20. – Вып.5. – С. 362–365.
Красильников Н.А. Определитель бактерий и актиномицетов. – М.–Л.: Изд–во АН СССР, 1949. – 832 с.
Красильников Н.А. Почвенно–климатические факторы изменчивости
Кузнецова М.А., Филиппов А.В. Ризоплан и фитофтороз картофеля // Защита растений. – 1995. – №8. – С. 18–19.
Кузнецова М.А., Филиппов А.В., Щербакова Л.А. Микробиологические препараты для защиты картофеля от фитофтороза // Защита и карантин растений. – 1996. – №6. – С. 16–17.
Куликов Н.С. Грибные болезни массовых вредителей сельскохозяйственных растений на Сахалине и возможности их использования в биологической борьбе. – Автореф. дис. … канд. биол. наук. – Л., 1977. – 22 с.
Культивирование и применение грибов против вредителей и болезней в защищенном грунте. Методические рекомендации / А.И. Бондаренко, А.Д. Буймистру, В.В. Гулий, С.И. Никольская и др. Под ред. В.В. Гулия. – Кишинев: ВНИИБМЗР, 1985. – 86 с.
Лаврентьева Е.В. Триходерма. – М.: Госагропром РСФСР, ЦНТИПР, 1989. – 6 с.
Лаппа Н.В., Гораль В.М. Биопрепараты против вредителей и болезней растений для использования в защищенном грунте. – К.: Реклама, 1987. – 4 с.
Лаппа Н.В., Гораль В.М. Регламент производства сухого боверина. – К., 1968. – 32 с.
Лаппа Н.В., Гораль С.В., Склярів В.І., Шведова Л.Г., Третьяков В.П., Захараш В.І. Ефективність застосування нових форм біопрепаратів у боротьбі з шкідниками тепличних культур // Захист рослин. Зб. наук. праць. – 1992. – Вип.39. – С. 50–53.
Марютин Ф.Н., Билык Н.А. Эффективность применения триходермина в борьбе с фузариозным увяданием и корневыми гнилями огурцов в защищенном грунте // Тр. Латв. с.–х. акад. – 1990. – №261. – С. 52–58.
Мартиньони М.Э. Массовое производство возбудителей болезней насекомых. В кн. Биологическая борьба с вредными насекомыми и сорняками. – М.: Колос, 1968. – С.439–459.
Матвеева В.А. Биометод в Кузбасе // Защита растений. – 2002. – №5. – С. 24.
Методические рекомендации по биологической защите овощных культур от вредителей и болезней в открытом грунте / В.Ф. Дрозда, Н.В. Лаппа, В.М. Гораль и др. – К.: Винницкая КОНТИП, 1990. – 80 с.
Мирзоева В.А. Бактерии группы сенной и картофельной палочек (Bacillus sub>tilis и Bacillus meseutericus). – М.: Изд–во АН СССР, 1959. – 175с.
Митина Г.В., Сергеев Г.Е., Павлюшин В.А. Влияние биохимических и морфолого–культуральных особенностей природных изолятов Verticillium lecanii (Zimm.) Viegas. на вирулентность в отношении личинок оранжерейной белокрылки // Микол. и фитопатол. – 1997. – Т.31. – Вып.1. – С. 57–64.
Назарова Л.Н., Наговицин В.А., Черемыскина В.Г. Против комплекса болезней озимой ржи // Защита растений. – 1995. – №8. – С. 18–19.
Новицкая Л.Н. Использование биопрепарата ампеломицина в борьбе с мучнисторосяными грибами на плодово–ягодных культурах // Тезисы докл. конф. “Биологический метод защиты растений (Минск, 18–19 апреля 1990г)”. – Минск, 1990. – С. 241–242.
Огарков Б.Н., Огаркова Г.Р. Энтомопатогены Cephlosporium Cda. на вредных насекомых в Иркутской области // Микол. и фитопатол. – 1985. – Т.19. – Вып.6. – С. 474–477.
Павловская Ж.И., Михайлова Р.В., Лобанок А.Г., Мороз И.В., Кобзарева В.С. Антагонистические свойства Trichoderma lignorum (Tode) Harz ОМ 534 и Gliocladium catenulatum Gilman et Abbot 453 в отношении Fusarium sambucinum Fuckel // Микол. и фитопатол. – 1998. – Т.32. – Вып.3. – С. 41–46.
Парий И.Ф., Пузанова Л.А. Эффективность биопрепарата (ампеломицина) в борьбе с мучнистой росой яблони // Тезисы докл. конф. “Биологический метод защиты растений (Минск, 18–19 апреля 1990г)”. – Минск, 1990. – С. 246–247.
Патыка Т.И., Кузнецова Л.Н., Колбасова В.В., Патыка В.Ф. Физиолого-биохимические и энтомоцидные свойства эффективных штамов Bacillus thuringiensis // Бюлетень Ін-та с.-г. мікробіол. – №2. – 1998. – С. 21-23.
Помелов А.В., Воронцова Н.И. Опыт применения биопрепаратов на ячмене // Защита и карантин растений. – 1999. – №7. – С.16.
Приймак Т.А., Чижик Р.І. Обґрунтування можливості застосування гриба ашерсонії в боротьбі з оранжерейною білокрилою // Захист рослин. Зб. наук. праць. – 1975. – Вип.22. – С. 53–56.
Природоохранная технология защиты растений / Б.А. Арешников, В.П. Васильев, В.М. Гораль и др. Под ред. М.П. Лесового. – К.: Урожай, 1989. – 168 с.
Прохоренкова Л.Г. Биометод в теплицах Пермской области // Защита растений. – 1991. – №7. – С.14.
Пузанова Л.А. Гиперпаразиты рода Ampelomyces Ces. ex Schlecht. и возможность их применения для борьбы с возбудителями мучнистой росы растений // Микол. и фитопатол. – 1984. – Т.18. – Вып.4. – С. 333–337.
Пузанова Л.А. Изучение грибов рода Ampelomyces Ces. ex Schlecht. для биологической борьбы с возбудителями мучнистой росы растений в условиях Краснодарского края. – Автореф. дис. … канд. биол. наук. – Краснодар, 1981. – 24 с.
Пузанова Л.А. Распространение гиперпаразитов рода Ampelomyces Ces. ex Schlecht. на мучнисторосяных грибах Северного Кавказа и их значение в ограничении возбудителя // Микол. и фитопатол. – 1991. – Т.25. – Вып.5. – С. 438–442.
Пылдмаа П. Данные о некоторых Deuteromycetes, обитающих вместе с ржавчинными и мучнисторосяными грибами. – Таллин: Изд–во АН ЭССР, 1966. – С. 25.
Резник С. Мечников. – М.: Молодая гвардия, 1973. – 368 с.
Розробити науково-технічні основи розвитку промисловості по виробництву засобів біологізації рослинництва та їх застосування в системах екологічного землеробства. – НТП УААН на 2001-2005 рр. (Проект). – 2000. – 25с.
Рубан Е.Л. Физиология и биохимия представителей рода Pseudomonas. – М.: Наука, 1986. – 198 с.
Рудаков О.Л. Грибы рода Ampelomyces Ces. ex Schlecht // Микол. и фитопатол. – 1979. – Т.13. – Вып.2. – С. 104–110.
Рудаков О.Л. Микофильные грибы, их биология и практическое значение. – М., 1981. – 160 с.
Сассон А. Биотехнология: свершения и надежды. – М.: Мир, 1987. – 416 с.
Сейкетов Т.Ш. Грибы рода триходерма и их использование в практике. – Алма–Ата: Наука, 1982. – 248 с.
Сейкетов Т.Ш., Исабаева М.К. К систематике представителей рода Trichoderma выделенных из почв Казахстана // Тр. ин–та микробиол. и вирусол. – 1962. – Т.6. – С. 16–24.
Серебрякова Л.К., Минина Г.Н., Владимирова Г.А. Эффективность зернокостного бактороденцида в борьбе с вредными грызунами // Тр. ВНИИСХ микробиол. – Т.55. – 1985. – С.104–108.
Слободянюк Г.А., Игнатьева Т.Н., Андреенко О.Н. Система защиты огурца от тепличной белокрылки // Защита растений. – 1993. – №4. – С. 45.
Смирнов В.В., Киприанова Е.А. Бактерии рода Pseudomonas. – К.: Наукова думка, 1990. – 264 с.
Смирнов В.В., Резник С.Р., Василевская И.А. Спорообразующие аэробные бактерии – продуценты биологически активных веществ. – К.: Наукова думка, 1982. – 280 с.
Соловей Е.Ф. Гетерогенность популяции Verticillium lecanii (Zimm.) Viegas. // Микол. и фитопатол. – 1980. – Т.14. – Вып.5. – С. 400–404.
Соловей Е.Ф., Гораль В.М. Методические указания по культивированию и применению энтомопатогенных грибов рода Asehersonia против оранжерейной белокрылки. – М.: Госагропром СССР, 1986. – 33 с.
Суздальская М.В. Белая мускардина вредной черепашки // Тр. ВИЗР. – 1958. – Вып.9. – С. 341–368.
Твердюков А.П., Никонов П.В., Ющенко Н.П. Ампеломицин // Защита растений. – 1994. – №6. – С. 34.
Технология применения биологических препаратов в борьбе с вредителями овощных, плодовых культур и картофеля. Методические рекомендации / В.М. Гораль, В.Ф. Дрозда, Н.В. Лаппа, Л.И. Антонюк. – К.: Киевоблагропром, 1987. – 20 с.
Титаренко Л.Н., Вяткина Г.Г., Алещенко М.Н. Применение ризоплана на Северном Кавказе // Защита растений. – 1995. – №8. – С. 16–17.
Ткаленко Г.М. Розробити екологічно безпечні засоби захисту овочевих культур від приховано живучих двокрилих шкідників і хвороб // Звіт НДР “Розробити біологічні методи боротьби з шкідниками і хворобами сільськогосподарських культур як складової частини інтегрованого захисту рослин, 1996–2000рр” Держреєстрація №0197 U 012337. – ІЗР УААН, 2000. – С. 54–71.
Трисвятский Л.А. Микроорганизмы зерна и муки. – М.: Заготиздат, 1941. – 176 с.
Триходермин не только защищает растения // Защита растений. – 1995. – №11. – С. 12–13.
Тюльпанова В.А., Тюльпанов В.Г., Козлова Т.Л., Малиновский А.Л., Реушева Н.В. Метаболические особенности гриба Beauveria bassiana (Bals.) Vuill. при поверхностном и глубинном культивировании // Микол. и фитопатол. – 1987. – Т.21. – Вып.3. – С. 259–265.
Федоринчик Н.С. Успехи и перспективы использования микроорганизмов для биологической борьбы с вредными насекомыми и возбудителями болезней растений в Нечерноземной зоне // Тр. ВИЗР. – 1977. – Вып.53. – С. 19–29.
Федоринчик Н.С., Тиллаев Х.Т. Гриб триходерма в борьбе с вилтом хлопчатника. Методические рекомендации. – Ташкент: Фан, 1973. – 40 с.
Филипчук О.Д., Плотникова Т.В., Ярошенко В.А., Вяткина Г.Г. Биологическая защита рассады табака от болезней // Защита растений. – 1995. – №8. – С. 18–19.
Филлипов Н.Н., Попов Н.А., Бондаренко А.И. Биологический метод борьбы с вредителями и болезнями овощных культур в защищенном грунте. – Кишинев: МолдНИИНТИ, 1987. – 53 с.
Фокін А.В., Коровін О.А. Аналіз трофічної активності гусені Malacosoma neustria L. та Aporia crataegi L. // Інтегрований захист плодових культур і винограду. Зб. наук. статей. – Ужгород: Закарпат. територ. відділ зах. росл., 2000. – С. 131–133.
Фокин А.В., Коровин А.А. Влияние биопрепаратов на трофическую активность гусениц кольчатого шелкопряда и боярышницы // Защита и карантин растений. – 2001. – №9. – С. 38.
Фокин А.В., Коровин А.А. Влияние микробиологических препаратов на процесс окукливания Aporia crataegi L. (Pieridae: Lepidoptera) // Материалы X международного симпозиума “Нетрадиционное растениеводство: Эниология. Экология и здоровье” (2–9 сентября 2001 г., Алушта). – Алушта, 2001. – С. 524–525.
Фокин А., Гораль С. Технологии малотоннажного производства микробиологических средств защиты растений в Украине // Тезисы докл. сипозиума МОББ/ВПРС “Биоценотическая регуляция – основа современных систем интегрированной защиты сельскохозяйственных культур” (2–5 июля 2001 г., Познань, Польша). – Познань, 2001. – С. 59.
Фокін А.В., Ткаленко Г.М., Гораль С.В. Вивчення впливу біологічних препаратів на збудників хвороб овочевих культур // Звіт НДР ”Теоретично обґрунтувати та створити екологічно безпечні мікробні препарати, виявити нові патогени і розробити способи їх застосування, 2001р”. – ІЗР УААН, 2001. – С. 20–30.
Фокін А.В., Лаппа Н.В., Гораль В.М., Гораль С.В. Мікробіологічний захист у теплицях // Захист рослин. – 2002. – №7. – С. 15–16.
Хакимов А.Х., Абдуллаев Б.Я. Триходермин против фузариоза томатов // Защита растений. – 1992. – №8. – С. 25.
Хлопцева Р.И. Микробиологические средства защиты сельскохозяйственных культур от вредных насекомых. – М.: ВНИИЕЭИСХ, 1985. – 60 с.
Храмова Т.В., Попова А.И. Влияние температуры, относительной влажности воздуха и рН среды на развитие Beauveria bassiana // Микробиол. журнал. – 1983. – Т.45. – №1. – С. 43–46.
Худяков Я.П., Шкляр М.С., Савадеров Е.П. Антибиотик антифунгин, образуемый бактериями рода Pseudomonas // Прикладная биохим. и микробиол. – 1965. – №2. – С. 186–190.
Чалков А.А. Биологическая борьба с вредителями овощных культур защищенного грунта. – М.: Россельхозиздат, 1986. – 95 с.
Шахбанов А.Л. Образование спор у Bacillus sub>tilis и изучение их ультраструктур // Тр. ВНИИ вет. санитарии. – 1970. – Т.36. – С. 9–11.
Шелестова В.С., Гончаренко О.І., Дрозда В.Ф., Панько Н.П. Екологічні основи захисту плодового саду від шкідників з максимальним використанням біологічних засобів. – К., Видавничий центр НАУ, 2001. – 98с.
Шехурина Т.А. Патогенез мускардины вредной черепашки // Докл. ВАСХНИЛ. – 1964. – №7. – С. 16–18.
Штейнхауз Э. Патология насекомых. – М.: Изд–во ин. лит., 1952. – 445 с.
Штерншис М.В., Цветкова В.П. Микробиологический метод контроля саранчевых // Защита и карантин растений. – 2002. – №6. – С. 26–27.
Юрченко Л.В., Павлюшин В.А. Получение мутантов у энтомопатогенного гриба Verticillium lecanii (Zimm.) Viegas. // Микол. и фитопатол. – 1993. – Т.27. – Вып.3. – С. 21–25.
Ярошенко В.А., Вяткина Г.Г., Алещенко М.Н. Биометод в теплицах Кубани // Защита и карантин растений. – 1996. – №9. – С.47.
Cook J. Biological control of plant pathogens: Theory to application // Phytopathology. – 1985. – 75. – №1. – P. 25–29.
Cook R.J., Weller D.M. Management of take–all in consecutive crops of wheat or barley // Innovative approaches to plant disease control. – New York: J. Wiley a sons inc., 1987. – P. 41–76.
Filippi C., Bagnoli G., Volterrani M., Picci G. Antagonistic effects of soil bacteria on Fusarium oxysporum Schlecht f. sp. dianthi (Prill and Del) Snyd and Hans. III Relation between protection against fusarium wilt in carnation and bacterial antagonists colonization on roots // Plant and Soil. – 1987. – V.98. – №2. – Р. 161–167.
Hall R.A., Burges H.D. Control of aphids in glasshouses with the fungus, Verticillium lecanii // Ann. Appl. Biol. – 1979. – V.93. – №3. – Р. 235–246.
Hart M.P., MacLeod D.M. An apparatus for determining of temperature and humidity on germination of fungus spores // Canad. J. Bot. – 1955. – V.33. – P. 289–292.
Howell C.R., Stipanovic R.D. Control of Rhizoctonia solani on cotton seedlings with an antibiotic produced by the bacterium // Phytopathology. – 1979. – 69. – №5. – P. 480–482.
Kaneko S., Matsushima H. Crystal inclusions in sporulating Bacillus sub>tilis cells // Spores VI. Select. Pap. 6–th Int. Spore Conf., 1974. – Washington, 1975. – P. 580–585.
Kaneko S., Matsushima H. Crystal–like structure in the sporulation cells of Bacillus sub>tilis 168 // Electron. Microse. – 1973. – V.22. – №2. – P. 217–219.
Kloepper J.W., Schroth M.N. Pseudomonas siderophores: a mechanism explaining disease–suppressive soils // Phytopathology. – 1981. – 71. – №2. – P. 232.
Metschnikov I. Zur Lehre uber Insektenkrankheiten // Zool. Anz. – 3. – 1880. – P. 44–47.
Mukhopadhyay A.N., Shrestha S.M., Mukherjee P.K. Biological seed treatment for control of soil borne plant pathogens // JAO Plant Prot. Bull. – 1992. – V.40. – №1–2. – P. 21–30.
Neale M. C. Biopesticides - harmoniration of registration requirements within EU directive 91/ 414-an industry view // Bull. OEPP. – 27. – 1997. – №1. – P. 89-93.
Neilands J.B., Valenta V.R. Iron–containing antibiotics // Met. jons. boil. syst. – 1985. – 19. – P. 313–333.
Picci G., Bagnoli G., Filippi C. Influenza della carica di Bacillus sub>tilis M 51 nella rizosfera di garofano e sulla durata dell effeto protettivo venso Fusarium oxysporum f. sp. dianthi // Dif. plante. – 1985. – V.8. – №2. – Р. 107–113.
Schaerffenberg B. Beauveria bassiana (Vuill) Link als Parasit des Kartoffelkafers (Leptinotarsa decemlineata) // Auz. Shadlingskunde. – 1957. – 30. – №5. – S. 69–74.
Searle T., Doberski Z. An investigation of the entomogenous fungus Beauveria control agent for Oryzaephilus surinamensis // J. Stored. Prod. Res. – 1984. – V.20. – №1. – P. 17–23.
Spencer D.M., Tatkey P.T. Parasitic effects of Verticillium lecanii on two rust fungi // Trans. Brit. Mycol. Soc. – 1981. – V.77. – №3. – Р. 532–542.
Suen G., Schorth M.N., Mc Cain A.H. Reduction of fusarium wilt of carnation with suppressive soils and antagonistic bacteria // Plant Desease. – 1985. – V.69. – №12. – P. 1071–1075.
Swiezynska H., Gornas E. Owadobojcze grzyby na niektorych gatunkach borecznikow (Hymenoptera: Diprionidae) w latach 1971–1975 // Sylwan. – 1976. – V.120. – №8. – S. 47–56.
Uktede R.S., Sholberg P.L. In vitro inhibition of plant pathogens by Bacillus sub>tilis and Enterobacter aerogenes and in vivo control of two postparves cherry diseases // Can. J. Microbiol. – 1986. – V.32. – №12. – P. 963–967.
1 препарати було виготовлено у Відділі мікробіологічного методу захисту рослин Інституту захисту рослин УААН
2 препарат було виготовлено в Інституті мікробіології та вірусології ім. Заболотного НАНУ під керівництвом доктора біологічних наук І.К. Курдиша