Главные элементы жизни: азот и фосфор
ОТЧЁТ ПО ХИМИИ
ЛЕКЦИЯ №4
ТЕМА:
ГЛАВНЫЕ ЭЛЕМЕНТЫ
ЖИЗНИ:
АЗОТ И ФОСФОР
Масленниковой Инны
9 «Б» класс
Общая характеристика подгруппы азота.
Подгруппу азота составляют пять элементов: азот, фосфор, сурьма, мышьяк и висмут. Это элементы V группы периодической системы Д. И. Менделеева На внешнем энергетическом уровне их элементы имеют по пять электронов – ns2np3. Поэтому высшая степень окисления этих элементов равна +5, низшая -3, характерна и +3.
Свойства элементов подгруппы азота
|
Свойства |
N |
P |
As |
Sb |
Bi |
|
Заряд ядра |
7 |
15 |
33 |
51 |
83 |
|
Валентные электроны |
2s22p3 |
3s23p3 |
4s24p3 |
5s25p3 |
6s26p3 |
|
Энергия ионизации атома, эВ |
14,5 |
19,5 |
9,8 |
8,6 |
7,3 |
|
Относительная электроотрицательность |
3,07 |
2,1 |
2,2 |
1,87 |
1,67 |
|
Степень окисления в соеденениях |
+5, +4, +3, +2, +1, -3, -2, -1 |
+5, +4, +3, +1, -3, -2 |
+5, +3, -3 |
+5, +3, -3 |
+5, +3, -3 |
|
Радиус атома |
0,071 |
0,13 |
0,15 |
0,16 |
0,18 |
|
Температура плавления |
-209,9 |
44,3 |
816,9 |
630,8 |
271,4 |
|
Температура кипения |
-195,9 |
279,9 |
615,9 |
1634,9 |
1559,3 |
С водородом элементы подгруппы азота образуют соединения состава RH>3>. Молекулы RH>3> имеют пирамидальную форму. В соединениях связи с водородом более прочные, чем в соответствующих соединениях подгруппы кислорода и особенно подгруппы галогенов. Поэтому водородные соединения элементов подгруппы азота в водных растворах не образуют ионов водорода. С кислородом элементы подгруппы азота образуют оксиды общей формулы R>2>O>3> и R>2>O>5>. Оксидам соответствуют кислоты HRO>2> и HRO>3> (и ортокислоты H>3>RO>4>, кроме азота). В пределах подгруппы характер оксидов изменяется так: N>2>O>3> – кислотный оксид; P>4>O>6> – слабокислотный оксид; As>2>O>3> – амфотерный оксид с преобладанием кислотных свойств; Sb>2>O>3 >- амфотерный оксид с преобладанием основных свойств; Bi>2>o>3 >– основный оксид. Таким образом, кислотные свойства оксидов состава R>2>O>3> и R>2>O>5 >уменьшаются с ростом порядкового номера элемента. В подгруппе с ростом порядкового номера неметаллические свойства убывают, а металлические усиливаются. Этим объясняется уменьшение прочности водородных соединений RH>3> от NH>3> к BiH>3>, а также уменьшение прочности кислородных соединений в обратном порядке.
Элементы V А-подгруппы открывались в разное время, знания о них накапливались на протяжении столетий, постепенно увеличиваясь и углубляясь.
Хронология открытия химических элементов V А-подгруппы
|
Элемент |
Дата и авторы открытия |
Город, страна |
|
N |
1772г, Д. Резердорф |
Эдинбург, Шотландия |
|
P |
1669г, Х. Брант |
Гамбург, Германия |
|
As |
1250г, Альберт Великий |
Больштедт, Германия |
|
Sb |
Известен с древних времён |
|
|
Bi |
Известен с XV века |
Степени окисления N и Р и отвечающие им соединения
|
N-3 |
NH>3>, Mg>3>N>2>, NH>4>OH, NH>4>Cl |
|
N-2 |
N>2>H>4> |
|
N-1 |
N>2>H>2>, NH>2>OH |
|
N0 |
N, N>2> |
|
N+1 |
N>2>O |
|
N+2 |
NO |
|
N+3 |
N>2>O>3>, HNO>2>, NaNO>2>, NCl>3> |
|
N+4 |
NO>2>, N>2>O>4> |
|
N+5 |
N>2>O>5>, HNO>3>, KNO>3> |
|
P-3 |
PH>3> |
|
P-2 |
P>2>H>4> |
|
P0 |
P, P>2>, P>4> |
|
P+3 |
PCl>3>, P>2>O>3>, H>3>PO>3> |
|
P+5 |
PCl>5>, P>2>O>5>, P>4>O>10>, HPO>3>, H>3>PO>4>, H>4>P>2>O>2>, Na>3>PO>4>, CaHPO>4> |
Азот.
Азот в природе встречается главным образом в свободном состоянии. В воздухе объёмная доля его составляет 78,09%. Соединения азота в небольших количествах содержатся в почвах. Азот входит в состав белковых веществ и многих естественных органических соединений. Общее содержание азота в земной коре 0,01%. В технике азот получают из жидкого воздуха: воздух переводят в жидкое состояние, а затем испарением отделяют азот от менее летучего кислорода (t>кип> азота -195,8оС, кислорода -183оС). Полученный таким образом азот содержит примеси благородных газов (преимущественно аргона). Чистый азот можно получить в лабораторных условиях, разлагая при нагревании нитрит аммония:
 t
t
NH>4>OH>2>=N>2 >+ H>2>O
Атом азота имеет следующее строение:
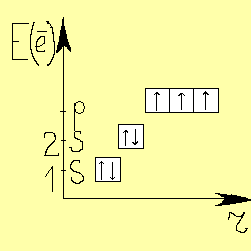
Молекула азота образована тройной ковалентной связью атомов: двумя пи-связями и одной сигма - связью. Молекула азота распадается на атомы при температуре 2000оС. Жидкий азот хранится в сосуде Дьюра.
Физические свойства азота. Азот – газ без цвета, вкуса и запаха, легче воздуха, растворимость в воде меньше, чем у кислорода.
Химические свойства азота. Молекула азота состоит из двух атомов, длина между ними очень мала, Тройная связь и её малая длина делают молекулу весьма прочной. Этим объясняется малая реакционная способность азота при обычной температуре.
При комнатной температуре азот непосредственно соединяется с литием:
6Li + N>2> = 2Li>3>N
C другими металлами он реагирует лишь при высоких температурах, образуя нитриды:
t o t o
3Сa + N>2> = Ca>3>N>2> 2Al + N>2> = 2AlN
С водородом азот соединяется в присутствии катализатора при высоком давлении и температур
 N>2
>+
3H>3>
2NH>3>
N>2
>+
3H>3>
2NH>3>
При температуре электрической дуги (3000-4000оС) азот соединяется с кислородом:

 N>2
+ >O>2>
2NO
N>2
+ >O>2>
2NO
Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака такова:
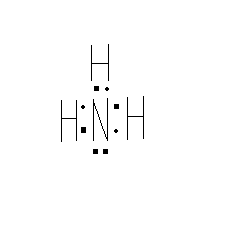
П олучение
и применение аммиака. В
лабораторных условиях аммиак обычно
получают слабым нагреванием смеси
хлорида аммония с гашеной известью:
олучение
и применение аммиака. В
лабораторных условиях аммиак обычно
получают слабым нагреванием смеси
хлорида аммония с гашеной известью:
2NH>4>Cl + Ca (OH)>2> = CaCl>2> + 2NH>3> + 2H>2>O
Основным промышленным способом получения аммиака является синтез его из азота и водорода. Реакция экзотермичная и обратимая:

 N>2
+ >3H>2>
2NH>3>
+ 92кДж
N>2
+ >3H>2>
2NH>3>
+ 92кДж
Она протекает только в присутствии катализатора Губчатого железа с добавками активаторов - оксидов алюминия, калия, кальция, кремния (иногда и магния)
Физические свойства аммиака. Аммиак – бесцветный газ с характерным резким запахом, почти в два раза легче воздуха. При увеличении давления или охлаждении он легко сжимается в бесцветную жидкость. Аммиак хорошо растворим в воде. Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При кипячении растворённый аммиак улетучивается из раствора.
Химические свойства аммиака. Большая растворимость аммиака в воде обусловлена образованием водородных связей между их молекулами. Гидроксид – ионы обуславливают слабощелочную (их мало) реакцию аммиачной воды. При взаимодействии гидроксид - ионов с ионами NH>4>+ снова образуются молекулы NH>3 >и > >H>2>O, соединённые водородной связью, т. е. реакция протекает в обратном направлении. Образование ионов аммония и гидроксид – ионов в аммиачной воде можно выразить уравнением.


 NH>3>
+ H>2>O NH>3>
.
H>2>O NH>4>+
+ OH—
NH>3>
+ H>2>O NH>3>
.
H>2>O NH>4>+
+ OH—
В аммиачной воде наибольшая часть аммиака содержится в виде молекул NH>3>, равновесие смещено в сторону образования аммиака, поэтому она пахнет аммиаком. Тем не менее водный раствор аммиака по традиции обозначают формулой NH>4>OH и называют гидроксидом аммония, а щелочную реакцию раствора аммиака объясняют как результат диссоциации молекул NH>4>OH:

 NH>4>OH NH>4>+
+ OH—
NH>4>OH NH>4>+
+ OH—
А так как в растворе аммиака в воде концентрация гидроксид – ионов невелика, то гидроксид аммония относится к слабым основаниям.
Аммиак сгорает в кислороде и в воздухе (предварительно подогретом) с образованием азота и воды:
4NH>3> + 3O>2> = 2N>2> + 6H>2>O
В присутствии катализатора [например, оксида хрома (III )] реакция протекает с образованием оксида азота (II) и воды:
Cr>2>O>3>
4NH>3> + 5O>2> = 4NO + 6H>2>O
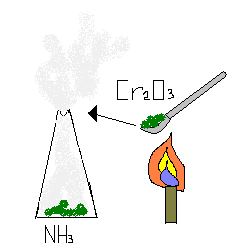
Аммиак взаимодействует с галогенами, при этом выделяется азот и водородное соединение галогена:
2NH>3> + 3Br>2> = 6HBr + N>2>
2NH3 + 3Cl>2> = 6HCl + N>2>
Аммиак – сильный восстановитель. При нагревании он восстанавливает оксид меди (II), а сам окисляется до свободного азота:
3Cu+2O + 2N—3H>3> = 3Cu0 + N>2>0 + 3H>2>O
2N—3 – 6e = N>2 >1
> >Cu2+ + 2e = Cu 3
Аммиак взаимодействует с перманганатом калия:
NH>3> + KMnO>4> = N>2> + H>2>O + MnO>2> +KOH
Добавление аммиака изменяет цвет раствора:
Важным химическим свойством аммиака является его взаимодействие с кислотами с образованием солей аммония. В этом случае к молекуле аммиака присоединяется ион водорода кислоты, образуя ион аммония, входящей в состав соли:
H
 NH>3>
+ H+Cl--
[H N H]Cl
NH>3>
+ H+Cl--
[H N H]Cl
H
Связь между ионами NH>4> и Cl ионная, в ионе NH>4> четыре связи ковалентные, причём три из них полярные и одна по донорно – акцепторном механизму.
Соли аммония.
Соли аммония и аниона кислоты. По строению они аналогичны соответствующим солям однозарядных ионов металлов. Соли аммония получаются пи взаимодействии аммиака или его водных растворов с кислотами. Например:
NH>3> + HNO>3> = NH>4>NO>3>
NH>3>. H>2>O + HNO>3 >= NH>4>NO>3> + H>2>O
Они проявляют общие свойства солей, т.е. взаимодействуют с растворами щелочей, кислот и других солей:
(NH>4>)Cl + NaOH = NaCl + H>2>O + NH>3 >
>  >>КОНЦ>>.>
>>КОНЦ>>.>
2NH>4>Cl + H>2>SO>4> = (NH>4>)>2>SO>4> + 2HCl
(NH>4>)>2>SO>4> + BaCl>2> = 2NH>4>Cl + BaSO>4 >
Все аммонийные соли при нагревании разлагаются или возгоняются, например:

 (NH>4>)>2>CO>3>
= 2NH>3 >+
H>2>O
CO>2 >
(NH>4>)>2>CO>3>
= 2NH>3 >+
H>2>O
CO>2 >
>  >NH>4>NO>2>
= 2H>2>O
+ N>2>
>NH>4>NO>2>
= 2H>2>O
+ N>2>

 NH>4>Cl
NH>3 >+
HCl
NH>4>Cl
NH>3 >+
HCl
(NH>4>)>2>Cr>2>O>7> = Cr>2>O>3> + 4H>2>O + N>2 >
> >
>
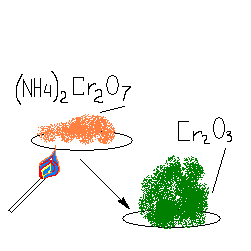 >
>
Качественная реакция на ион аммония. Очень важным свойством солей аммония является их взаимодействие с растворами щелочей. Этой реакцией обнаруживают соли аммония (ион аммония) по запаху выделяющегося аммиака или по появлению синего окрашивания влажной лакмусовой бумажки:

 NH>4>+
+ OH
H>2>O
+ NH>3>
NH>4>+
+ OH
H>2>O
+ NH>3>
Реакцию проводят так: в пробирку с испытуемой солью или раствором вводят раствор щелочи и смесь осторожно нагревают. В случае присутствия иона аммония выделятся аммиак.
Оксиды азота.
Азот образует шесть кислородных соединений, в которых проявляет степени окисления от +1 до +5: N>2>+1O, N+2O, N>2>+3O>3>, N+4O>2>, N>2>+4O>4>, N>2>+5O>5>. При непосредственном соединении азота с кислорода образуется только оксид азота (II) NO, другие оксиды получают косвенным путем. N>2>O и NO – несолеобразующие оксиды, остальные – солеобразующие. Из всех оксидов азота наибольшее значение имеют оксиды азота (II) и азота (IV) как промежуточные продукты в производстве азотной кислоты.
Оксид азота (II) NO – бесцветный газ, плох растворимый в воде (его можно собирать в цилиндре над водой). Оксид азота (II) соединяется с кислородом воздуха, образуя бурый газ – оксид азота (IV):
2NO +O>2> = 2NO>2>
В лабораторных условиях оксид азота (II) получают при взаимодействии разбавленной азотной кислоты и меди:
 3Cu + 8HNO>3>
= 3Cu(NO>3>)>2>
+ 4H>2>O
+ 2NO
3Cu + 8HNO>3>
= 3Cu(NO>3>)>2>
+ 4H>2>O
+ 2NO
Оксид азота (II) получают также окислением аммиака кислородом воздуха в присутствии катализатора платины. Он постоянно образуется в воздухе во время грозы под действием электрических зарядов.
О ксид
азота (IV)
NO
–
газ бурого цвета со специфическим
запахом, тяжелее воздуха, ядовит,
раздражает дыхательные пути. В лабораторных
условиях NO>2>
получают при взаимодействии
концентрированной азотной кислоты и
меди:
ксид
азота (IV)
NO
–
газ бурого цвета со специфическим
запахом, тяжелее воздуха, ядовит,
раздражает дыхательные пути. В лабораторных
условиях NO>2>
получают при взаимодействии
концентрированной азотной кислоты и
меди:
Cu + 4HNO>3> = Cu(NO>3>)>2> + H>2>O + 2NO>2>
и
 ли
при прокаливании кристаллического
нитрата свинца:
ли
при прокаливании кристаллического
нитрата свинца:
2Pb(NO>3>)>2> = 2PbO + 4NO>2 >+ O>2 >
При взаимодействии оксида азота (IV) с водой образуется азотная и азотистая кислоты:
2NO>2> + H>2>O = HNO>3> + HNO>2>
HNO>2> малоустойчива, особенно при нагревании. Поэтому при растворении NO>2> в теплой воде образуется азотная кислота и оксид азота (II):
3NO>2> + H>2>O =2HNO>3> + NO
В избытке образуется только азотная кислота:
4NO>2> + 2H>2>O + O>2> = 4HNO>3>
Оксид азота (IV) – сильный окислитель; уголь, фосфор, сера горят в нем, а оксид серы (IV) окисляется до оксида серы (VI).
Азотная кислота.
Получение азотной кислоты. В лабораторных условиях азотная кислота получается из её солей действием концентрированной серной кислоты:
KNO>3> + H>2>SO>4> = HNO>3> + KHSO>4>
Реакция протекает при слабом нагревании (сильное нагревание разлагает HNO>3>).
В промышленности азотная кислота получается каталитическим окислением аммиака, который в свою очередь, образуется как соединения водорода и азота воздуха. Весь процесс получения азотной кислоты можно разбить на три этапа:
Окисление аммиака на платиновом катализаторе до NO:
4NH>3> + 5O>2> = 4NO +6H>2>O
Окисление кислородом воздуха NO до NO>2>:
2NO + O>2> =2NO>2>
Поглощение NO>2> водой в присутствии избытка кислорода:
4NO>2 >+ 2H>2>O + O>2> = 4HNO>3>
Физические свойства. Азотная кислота – бесцветная жидкость с едким запахом. Она гигроскопична, «дымит» на воздухе, т. к. пары её с влагой воздуха образуют капли тумана. Смешивается с водой в любых соотношениях. Кипит при 86оС.
Химические свойства. В HNO>3> валентность азота равна 4, степень окисления +5
Разбавленная азотная кислота проявляет все свойства кислот. Она относится к сильным кислотам. В водных растворах диссоциирует:

 HNO>3>
H+
+NO>3>—
HNO>3>
H+
+NO>3>—
Под действием теплоты и на свету частично разлагается:
4HNO>3> = 4NO>2> + 2H>2> O + O>2 >
Поэтому хранят её в прохладном месте.
Важнейшее химическое свойство азотной кислоты состоит в том, что она является сильным окислителем и взаимодействует почти со всеми металлами.
Применение. Большие количества её расходуются на приготовление азотных удобрений, взрывчатых веществ, лекарственных веществ, красителей, пластических масс, искусственных волокон других материалов. Дымящая азотная применяется в ракетной технике в качестве окислителя ракетного топлива.
При взаимодействии азотной кислоты, с металлами водород, как правило, не выделяется: он окисляется, образуя воду. Кислота же, в зависимости от концентрации и активности металла, может восстанавливается до соединений:
+5 +4 +3 +2 +1 0 -3 -3
HNO>3> ---- NO>2> ----HNO>2> ---- NO ---- N>2>O ----N>2> ---- NH>3>(NH>4>NO>3>)
Образуется также соль азотной кислоты. От концентрации азотной кислоты зависит и продукт, образовавшийся в результате реакции:
Концентрированная азотная кислота не действует на железо, хром, алюминий, золото, платину и тантал, при взаимодействии с другими тяжелыми металлами образуется оксид азота (IV), при взаимодействии с щелочными и щелочно – земельными металлами образуется оксид азота (I).
Разбавленная азотная кислота при взаимодействии с щелочно – земельными металлами, а также с цинком и железом с образованием NH>3>(NH>4>NO>3>). При взаимодействии с тяжелыми металлами образуется оксид азота (II).Например,
Конц.
Ag + 2HNO>3 >= AgNO>3> + NO>2> H>2>O
Разб.
3Ag + 4HNO>3> = 3AgNO>3> + NO + 2H>2>O
Достаточно активный металл цинк в зависимости от концентрации азотной кислоты может восстанавливать ее до оксида азота (I) N>2>O, свободного азота N>2> и даже до аммиака NH>3>, который с избытком азотной кислоты дает нитрат аммония NH>4>NO>3>. В последнем случае уравнение реакции следует записать так:
4Zn + 10HNO>3> (очень разб.) = 4Zn(NO>3>)>2> + NH>4>NO>3> + 3H>2>O
Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот:
3P + 5HNO>3> + H>2>O = 3H>3>PO>4> + 5NO
C + 4HNO>3> = CO>2> + H>2>O + 4NO>2>
Одноосновная кислота образует только соли, называемые нитратами. Они получаются при действии ее на металлы, их оксиды и гидроксиды. Нитраты натрия, калия, аммония и кальция называются селитрами: NaNO>3> – натриевая селитра, KNO>3> – калийная селитра, NH>4>NO>3> – аммиачная селитра, Ca(NO>3>)>2> – кальциевая селитра. Селитры используются главным образом как минеральные азотные удобрения. Кроме того, KNO>3> применяется для приготовления черного пороха.
Фосфор.
Фосфор – аналог азота, т. к. электронная конфигурация валентных электронов, как и у азота, s2p3. Однако по сравнению с атомом азота атом фосфора характеризуется меньшей энергией ионизации и имеет больший радиус. Это означает, что неметаллические признаки у фосфора выражены слабее, чем у азота. Поэтому для фосфора реже встречаются степень окисления -3 и чаще +5. Мало характерны и другие степени окисления.
Нахождение в природе. Общее содержание фосфора в земной коре составляет 0,08%. В природе фосфор встречается только в виде соединений; важнейшее из них – фосфат кальция – минерал апатит.
Физические свойства. Фосфор, в отличие от азота имеет несколько аллотропных модификаций: белый, красный, черный и др.
Белый фосфор – бесцветное и очень ядовитое вещество. Получается конденсацией паров фосфора. Не растворяется в воде, но хорошо растворяется в сероуглероде. При длительном слабом нагревании белый фосфор переходит в красный.
Красный фосфор – порошок красно – бурого цвета, не ядовит, нерастворим в воде и сероуглероде, представляет смесь нескольких аллотропных модификаций, которые отличаются друг от друга цветом и некоторыми свойствами.
Черный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Получается длительным нагреванием белого фосфора при очень большом давлении.
Химические свойства. В химическом отношении белый фосфор сильно отличается от красного. Так, белый фосфор легко окисляется и самовоспламеняется на воздухе, поэтому его хранят под водой. Красный фосфор не воспламеняется на воздухе, но воспламеняется при нагревании свыше 240оС. При окислении белый фосфор светится в темноте – происходит непосредственное превращение химической энергии в световую. В жидком и растворенном состоянии, а также в парах при температуре ниже 800оС фосфор состоит из молекул Р>4>. При нагревании выше 800оС молекулы диссоциируют:

 Р>4 >2Р>2>.
Последние при температуре выше 2000оС
распадаются на атомы:
Р>4 >2Р>2>.
Последние при температуре выше 2000оС
распадаются на атомы:
Р
 >2
>2Р.
Атомы фосфора могут объединяться в
молекулы Р>2>,
Р>4>
и полимерные вещества.
>2
>2Р.
Атомы фосфора могут объединяться в
молекулы Р>2>,
Р>4>
и полимерные вещества.
Фосфор соединяется со многими простыми веществами – кислородом, галогенами, серой и некоторыми металлами, проявляя окислительные и восстановительные свойства:
2P + 3S =P>2>S>3> 2P + 3Ca = Ca>3>P>2>
Реакции с белым фосфором идут легче, чем с красным. Соединения фосфора с металлами называются фосфидами; они легко разлагаются водой с образованием фосфина РН>3> – очень ядовитого газа с чесночным запахом:
 Ca>3>P>2>
+ 6H>2>O
= 3Ca(OH)>2>
+ 2PH>3>
Ca>3>P>2>
+ 6H>2>O
= 3Ca(OH)>2>
+ 2PH>3>
По аналогии с NH>3> фосфин способен к реакциям присоединения:
РН>3> + НI = РН>4>I
Оксиды фосфора.
Оксид фосфора (III) Р>2>О>3> – воскообразная кристаллическая масса, плавящаяся при 22,5оС. Получается сжиганием фосфора при недостатке кислорода. Сильный восстановитель. Не ядовит.
Оксид фосфора (V) Р>2>О>5> – белый гигроскопичный порошок. Получается при горении фосфора в избытке воздуха или кислорода. Он очень энергично соединяется с водой, а также отнимает воду от др. соединений. Применяется как осушитель для жидкостей и газов.
Оксиды и все кислородные соединения фосфора намного прочнее аналогичных соединений азота, что следует объяснить ослаблением неметаллических свойств у фосфора по сравнению с азотом.
Фосфорные кислоты.
Оксид фосфора (V) взаимодействуя с водой, образует кислоту НРО>3>, последняя при кипячении с избытком воды образует фосфорную кислоту Н>3>РО>4>, при нагревании Н>3>РО>4>, образуется дифосфорная кислота Н>4>Р>2>О>7>.
3Р>4>О>10> + 6Н>2>О = 4Н>3>(РО>3>)>3>
Н>3>(РО>3>)>3> + 3Н>2>О = 3Н>3>РО>4>
2Н>3>РО>4> = Н>4>Р>2>О>7> + Н>2>О
Наибольшее практическое значение имеет фосфорная кислота, т. к. её соли – фосфаты – используются в качестве удобрений.
Фосфорная кислота – белое твердое вещество. С водой смешивается в любых соотношениях. В отличие от азотной кислоты не является окислителем и не разлагается при нагревании, что объясняется наибольшей устойчивостью степени окисления +5 из всех возможных для фосфора.
Азот и фосфор – это главные элементы жизни, они находятся в человеческом организме и необходимы для роста и питания каждому.
