Разработка технологического процесса получения биоразлагаемых полимеров на основе молочной кислоты
Разработка технологического процесса получения биоразлагаемых полимеров на основе молочной кислоты
Поскольку полимерная упаковка является удобной, дешевой, эстетичной, то ожидать ее полной замены на бумажную, стеклянную, тканевую или из других безвредных материалов бесперспективно.
В связи с этим актуальна и необходима разработка промышленных процессов получения новых высокомолекулярных соединений, которые сохраняли бы все физико-механические и эксплуатационные свойства выпускаемых в настоящее время многотоннажных пластиков, но вместе с тем были бы способны к биоразложению в условиях окружающей среды в течение непродолжительного промежутка времени [4 - 6].
Полимолочная кислота - полиэфир на основе молочной кислоты - соответствует этим требованиям, обладая высокими потребительскими свойствами и способностью к биоразложению под (воздействием влаги, света и соответствующих микроорганизмов.
Еще одно достоинство полимолочной кислоты, как альтернативы традиционным полимерам, заключается в том, что исходным сырьем для ее получения служат возобновляемые растительные продукты, главным образом глюкоза, что создает дополнительный стимул для развития производства зерна.
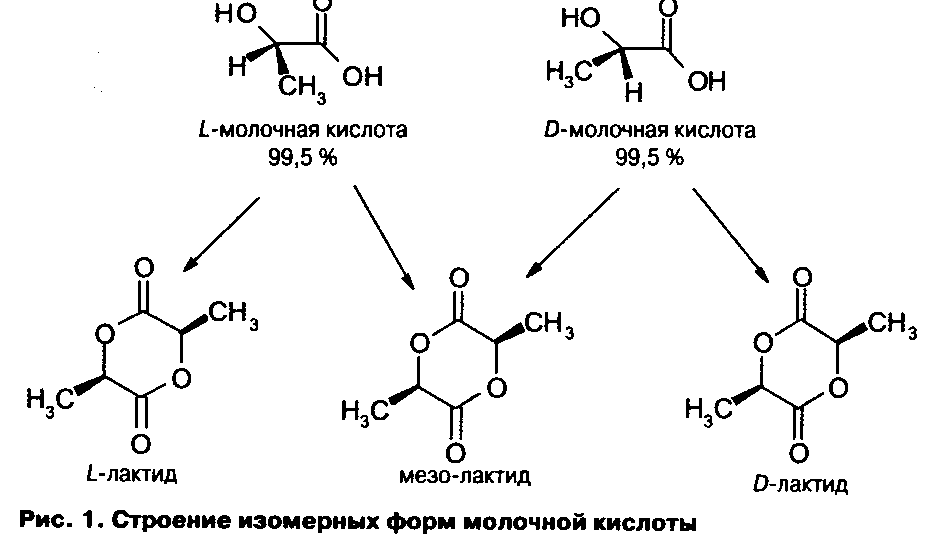
При получении пластиков на основе полимолочной кислоты с высокими физико-механическими свойствами используется оптически чистая молочная кислота, представляющая собой L - или D-изомеры.
Ниже основное внимание будет уделено проблеме синтеза и превращения // -молочной кислоты, как наиболее широко используемой для промышленного производства полилактида (полимолочной кислоты). Саму молочную кислоту получают путем ферментации глюкозы с использованием в качестве микробных продуцентов различных штаммов бактерий или мицелиалъных грибов рода Rhizopus [9 - 12].
При использовании бактериальных продуцентов достигается более 90 % конверсии глюкозы в молочную кислоту, при этом доля // -молочной кислоты может составлять более 98 %. Достоинство бактериальных штаммов - высокая скорость синтеза молочной кислоты (средняя скорость более 5 г/л в час). Некоторые бактериальные продуценты позволяют проводить ферментацию при повышенной температуре (выше 50 аС), что существенно снижает требования к стерильности процесса. Недостатком бактериальных продуцентов считается необходимость использования в ходе ферментации относительно дорогих компонентов питательных сред.
Штаммы мицелиальных грибов Rhizopus как продуценты молочной кислоты способны обеспечить практически 100 % -ное образование L*формы, при этом они более кислототолерантны. Важно отметить, что при ферментации грибов Rhizopus используются более дешевые питательные среды. Полученная после ферментации культуральная жидкость бесцветна и содержит значительно меньше трудноотделяемых примесей, чем жидкость, полученная при использовании бактериальных штаммов.
К достоинствам Rhizopus oryzae относится также способность превращать в молочную кислоту различные сахара, в том числе пентозы. Для этих продуцентов разработаны ферментационные процессы получения молочной кислоты из различных гидролиза-тов Rhizopus.
К числу недостатков этих грибов можно отнести образование наряду с молочной кислотой других органических кислот и спиртов (до 10 %).
В настоящее время в промышленности обычно реализуется периодический процесс ферментации, когда на первом этапе выращивается биомасса микробного продукта, а на втором осуществляется синтез молочной кислоты при добавлении в ферментационную среду необходимого количества глюкозы. В таких процессах полный цикл ферментации составляет 48 - 72 ч.
биоразлагаемый полимер полимолочная кислота
Во всех известных ферментационных процессах эффективный синтез молочной кислоты возможен только при рН = 5 + 7, что требует использования различных нейтрализующих агентов, преимущественно основных соединений кальция. Образующиеся соли молочной кислоты в дальнейшем подкисляют и после дополнительных этапов очистки из реакционной массы выделяется /молочная кислота высокой степени чистоты.
В процессе ферментации в качестве нейтрализующих агентов можно использовать и гидроксид натрия (образуются водорастворимые соли), что в дальнейшем позволит решить вопросы выделения и очистки кислоты с использованием мембранных технологий, что значительно сократит количество сточных вод и твердых отходов, однако в настоящее время такие процессы менее рентабельны.
Одним из перспективных направлений создания высокоэффективного процесса получения оптически активной молочной кислоты является разработка способов ферментации при низких значениях рН. Для решения этой задачи требуется создание рекомбинантных продуцентов, устойчивых в кислой среде и способных осуществлять синтез молочной кислоты в аэробных условиях с получением дополнительной энергии при окислении кислородом.
Существующие технологии получения молочной кислоты позволяют обеспечить конкурентоспособность производства полилактида по сравнению с традиционными полимерами, благодаря чему в настоящее время производство молочной кислоты в мире активно развивается.
Именно на основе молочной кислоты проводились исследования по разработке условий олигомеризации молочной кислоты, получения циклического лактида и превращения его в полимолочную кислоту.
При разработке процесса олигомеризации 85 % -ной водной // -молочной кислоты на первой стадии отрабатывался способ отгонки растворной воды при нагреве смеси до температуры ПО - 125 "С при нормальном давлении. При этом вода легко отгонялась до получения 90 - 95 % -ного раствора молочной кислоты. Дальнейшая отгонка растворной воды была затруднена, поэтому для ее удаления применяли вакуум 100 - 200 мм рт. ст. с барботированием сухого азота через раствор молочной кислоты.
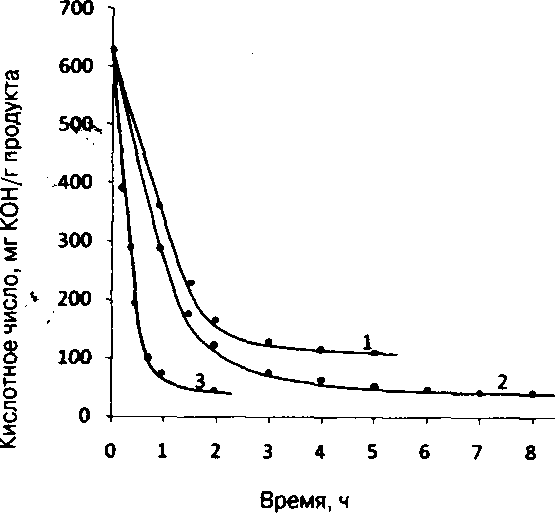
Процесс удаления растворной воды в лабораторных условиях в вакууме продолжался 3 - 5 ч. При этом в реакторе оставалась безводная молочная кислота с кислотным числом 400мгКОН/г продукта. Последнее указывает на то, что при отгонке воды в предлагаемом режиме начинался процесс олигомеризации с образованием незначительного количества димерных и тримерных продуктов конденсации молочной кислоты. Теоретическое значение кислотного числа мономерной молочной кислоты равно 623 мгКОН/г продукта.
Необходимо отметить, что при отгонке воды наблюдался заметный унос молочной кислоты, особенно на заключительной стадии, когда процесс проводился в вакууме. Кислотность водного погона в течение отгонки колебалась от 5 до 20 мгКОН/г. В отогнанной воде содержалось молочной кислоты в количестве до 3 % по массе общей загрузки. В промышленных условиях эту кислоту необходимо регенерировать и возвращать в технологический процесс.
Проведение чисто термической поликонденсации молочной кислоты при атмосферном давлении и температуре 100 - 110 С обеспечивает получение низкомолекулярного олигомера со средней степенью полимеризации. В связи с этим был выполнен комплекс исследований по использованию различных каталитических систем поликонденсации молочной кислоты с целью получения олигомеров с заданной молекулярной массой 800 - 1200.
В качестве катализаторов изучали различные по природе системы: оксид цинка и пара-толуол-сульфокислоту. При исследовании оксида цинка в качестве каталитической системы олигомеризации процесс проводили при поэтапном повышении температуры.
В обезвоженную молочную кислоту загружали 1,5% оксида цинка, набирали вакуум 50 мм рт. ст. и систему нагревали до 115 - 120 'С с постоянным барботированием сухого азота. После двухчасового нагрева реакционной массы ее кислотное число равнялось 150 мгКОН/г продукта.
С целью повышения степени поликонденсации молочной кислоты температуру реакционной массы поднимали до 150 - 170°С и продолжали нагрев еще 2,5 ч. При этом значение кислотного числа понижалось незначительно и достигало 120 мгКОН/г продукта (см. рисунок), что соответствовало степени поликонденсации молочной кислоты 5 и средней молекулярной массе ~ 400. За время реакции олигомеризации в присутствии ZnO в приемнике с водой собиралось - 20 % по массе общей загрузки молочной кислоты с кислотностью 260 мгКОН/г продукта. Последнее говорит о том, что кроме реакционной воды происходил унос молочной кислоты и ее низкомолекулярных олигомеров.
Несмотря на довольно жесткие условия олигомеризации в присутствии катализатора ZnO, ice же не удалось получить олигомер молочной кислоты с молекулярной массой, оптимальной для получения лактида.
Для достижения необходимой степени поликонденсации молочной кислоты в качестве катализатора олигомеризации была исследована пара-толуолсульфо-кислота, которая широко применяется для получения сложных эфиров на основе карбоновых кислот и спиртов. Реакцию олигомеризации молочной кислоты в присутствии 0,5 - 2 % пара-толуолсульфокислоты проводили в среде азеотропирующих растворителей.
Опыты с использованием в качестве растворителя циклогексана и 0,5 % катализатора проводили при 80 - 85 *С, однако выделение воды при этом не наблюдалось. По этой причине циклогексан был заменен на более высококипящий растворитель - толуол и количество катализатора увеличили до 1 - 2 %. В этих условиях удалось получить олигомер со средней степенью поликонденсации 10 - 15, что соответствовало молекулярной массе 720 - 1100.
Однако несмотря на получение олигомера с заданной молекулярной массой, использование растворителя в промышленных условиях нежелательно, поэтому с целью исключения растворителя синтез олигомера отрабатывали в присутствии, 2 % катализатора при 140 - 160 'С и вакууме 50 - 75 мм рт. ст. в течение 1,5 - 2 ч. В результате получили продукт с кислотным числом 40 - 50 мгКОН/г продукта (см. рисунок), что соответствовало средней молекулярной массе 900 - 1200. Именно такой олигомер использовали в дальнейшем для получения лактида.
Процесс лактидизации полученных олигомеров проводили в присутствии свежеприготовленной цинковой пыли в реакторе, снабженном термометром, подводящей трубкой для азота, насадкой Вюрца, соединенной с нисходящим холодильником с приемником. После загрузки олигомера, содержащего 2 % катализатора лактидизации, в системе набирали вакуум 200 мм рт. ст. и медленно поднимали температуру реакционной массы до 170 - 190 С, повышай вакуум до 90 мм рт. ст. При этом в приемнике, охлажденном льдом, конденсировался светло-желтый продукт.
В процессе отработки стадии лактидизации установлено, что оптимальными условиями образования лактида с выходом 75 % является температура реакционной массы 190 - 200 С и давление 90 - 120 мм рт. ст. Именно в таких условиях наблюдался постоянный стабильный погон лактида при 125 - 130 "С.
С целью очистки полученного лактида-сырца его перекристаллизовывали из этилацетата и получали белые кристаллы с температурой плавления 94,8 "С [14].
Полученное значение температуры плавления близко к литературным данным для лактида, что указывает на отсутствие процесса рацемизации исходной молочной кислоты в результате воздействия высоких температур при олигомеризации оптически активной кислоты и последующей лактидизации. Сохранение оптической чистоты лактида является важным показателем, так как биоразлагаемые пластики, полученные на основе молочной кислоты, обладают более высокими физико-механическими свойствами по сравнению с оптически неактивными аналогами. Строение и чистота полученного лактида исследовались методом ПК-спектроскопии. Спектры снимали на спектрофотометре Specord М80 в области 4000 - 400 см1. Для записи спектров из образцов были приготовлены таблетки, спресованные с КВг.
Установлено, что в ИК-спектре лактида, содержащего две карбоксильные группы в шестичленном кольце, наблюдается сложный эффект взаимодействия, вследствие чего происходит смешение карбонильных полос поглощения (по сравнению с карбоксильной группой б-лактонов) с проявлением максимумов при 1776 и 1764 см'. Поглощение С-О-С-группы лактида наблюдается в области 1300 - 1050 см"' в виде нескольких полос.
После отделения лактида в процессе лактидизации олигомолочной кислоты в реакционном кубе остается черный хрупкий пек в количестве г 20 % по массе исходного продукта, поэтому следует искать пути повышения конверсии олигомера в лактид (использовать более эффективные катализаторы лактидизации, оптимизировать аппаратурно-технологическое оформление).
С целью уменьшения количества образующегося кубового остатка был проверен способ дробной загрузки, а не сразу всей массы смеси олигомера молочной кислоты с катализатором в реактор лактидизации. Несмотря на определенные сложности при дозировке реакционной массы в рабочий реактор, выдерживаемый при 190 - 210 С и вакууме 100 - 150 мм рт. ст., наблюдалось более равномерное выделение лактида в течение всего процесса дозагрузки и, самое главное, уменьшение образования пека в кубе и, как следствие, более высокая конверсия олигомера.
Перекристаллизованный и высушенный оптически активный лактид в дальнейшем использовали в качестве исходного продукта при получении полимолочной кислоты в присутствии октоата олова как катализатора полимеризации.
Следует отметить, что механизм полимеризации лактида в присутствии октоата олова, несмотря на длительные исследования, не совсем ясен. При поликонденсации лактида в присутствии металлосодержащих катализаторов скорость поликонденсации зависит не только от природы основного катализатора (в рассматриваемом случае диоктоата олова), но и от присутствующих в системе следов примесей - сокатализаторов (вода, спирты, следы исходной молочной кислоты). Следы исходной молочной кислоты также способны участвовать в процессе координации с образованием шестичленного промежуточного цикла, состоящего из лактида, металлоорганического катализатора и соответствующего гидроксилсодержащего производного [15, 16].
Исходя из сказанного, открытие лактидного кольца и его полимеризация в полимолочную кислоту в присутствии диоктоата олова и протоносодержащего соединения можно представить следующим образом:
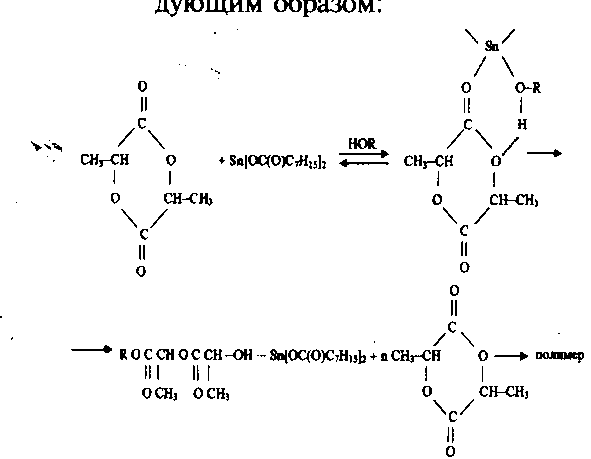
Однако не известно, как количество катализатора и температурно-временные параметры процесса полимеризации влияют на величину молекулярной массы образующейся полимолочной кислоты.
С целью определения влияния количества катализатора на ход полимеризации исследовали системы с содержанием 0,05; 0,1; 0,3; 0,6; 1,0 и 1,5 % октоата олова (по отношению к лактиду).
На первом этапе приготовления смеси лактид-катализатор систему нагревали до жидкого состояния и, тщательно перемешивая, получали однородную массу, которую загружали в ампулы. Приготовленные образцы выдерживали при температуре 120 - 150 Сив процессе прогрева через определенные промежутки времени отбирали пробы и растворяли содержимое в хлороформе. Затем для отделения высокомолекулярных фракций полимолочной кислоты от низкомолекулярных проводили высаждение метанолом и полученный полимер сушили до постоянной массы при 65°С. С увеличением количества катализатора от 0,3 до 1,5 % наблюдалось резкое снижение образования высокомолекулярной полимолочной кислоты. В среднем оно составляло 15 - 30 % в зависимости от концентрации катализатора, в то время как в присутствии 0,05 и 0,1 % высокомолекулярная фракция составляла 70 - 75 %.
Что касается влияния временного фактора полимеризации лактида в присутствии 0,05 и 0,1 % октоата олова при 150°С, то заметного отличия в температуре плавления полученной полимолочной кислоты не наблюдалось: она составляла 152 - 158°С. Молекулярная масса полученных образцов полимолочной кислоты, определенная методом гель-проникающей хроматографии, находилась в пределах от 15000 до 36000.
Анализ и сравнение снятых ИК-спектров синтезированной полимолочной кислоты показали, что все образцы по строению близки друг к другу. В ИК-спектрах наблюдались характерные полосы поглощения сложноэфирной группировки около 1764 см-' - валентные колебания С=0-группы, а в области 1300 - 1050 см1 проявлялись ассиметричные и симметричные колебания С-О-С-групп. Валентные колебания алифатических С-Н-групп отмечались в области 3000 - 2850 см1.
Выделенная полимолочная кислота представляла собой белый сыпучий порошок, из которого после модификации и пластификации были изготовлены пленки и прутки, обладающие высокими физико-механическими и эксплуатационными свойствами.
Таким образом, исходя из выполненного объема исследований и полученных результатов по процессу синтеза полимолочной кислоты из глюкозы, технологическую схему производства биоразлагаемого полимера на основе молочной кислоты можно представить следующими основными стадиями:
ферментация глюкозы до молочной кислоты;
выделение и очистка молочной кислоты;
олигомеризация молочной кислоты;
образование лактида;
получение полимолочной кислоты.
Решение вопросов оптимизации технологического процесса получения полимолочной кислоты с достижением максимальных показателей конверсии на каждой стадии позволит обеспечить высокий выход товарного продукта с минимальным количеством сточных вод и твердых отходов. Получаемый полимерный продукт должен обладать не только высокими потребительскими свойствами и биоразлагаемостью, но и приближаться по стоимости к упаковке, выпускаемой в настоящее время на основе многотоннажных бионеразлагаемых полимеров.
Определенность конечной цели и понимание проблемы в научном плане по созданию высокопроизводительного процесса получения биоразлагаемых пластиков требует прежде всего решения вопросов совершенствования используемых штаммов, каталитических систем стадии олигомеризации, лактидизации и полимеризации с получением полимолочной кислоты с заданной молекулярной массой. В производственном плане требуется решить задачи современного аппаратурно-технологического оформления процесса на всех стадиях, что в перспективе обеспечит создание высокотехнологичного конкурентоспособного производства биоразлагаемых пластиков на основе полимолочной кислоты и позволит в значительной степени решить сложные экологические проблемы "полимерного мусора".
Биоразлагаемые полимеры на основе полимолочной кислоты
В настоящее время производство синтетических пластмасс в мире достигло 150 млн. т в год и продолжает расти. Полимерные продукты играют большую роль в промышленности и жизни человека. После использования полимерные промышленные и бытовые отходы попадают в мусорные отвалы. Как быть и что делать с пластмассовым мусором становится глобальной экологической проблемой [1], от решения которой в значительной степени зависит экологическая ситуация в мире.
Для очистки окружающей среды от пластмассовых отходов и снижения антропогенной нагрузки на человека и окружающую среду активно реализуются два основных подхода:
захоронение (хранение отходов на свалках);
утилизация.
Наиболее щадящим способом является утилизация полимерных отходов.
Повторная переработка в некоторой степени решает проблему загрязнения окружающей среды полимерными продуктами. Однако сбор и сортировка полимерных отходов, прежде всего упаковочной тары, приводит к удорожанию получаемых мосле переработки изделий. Кроме того, качество рециклизованного полимера оказывается существенно ниже, чем первичного продукта.
Сжигание и пиролиз, даже при применении методов дожигания и утилизации тепла отходящих газов, также кардинально не улучшают экологическую обстановку.
По мнению специалистов, радикальным решением проблемы "полимерного мусора" является создание и освоение широкой гаммы полимеров, способных при соответствующих условиях биодеградировать на безвредные компоненты [2].
Именно биоразлагаемость высокомолекулярных соединений и будет тем приоритетным направлением, которое позволяет исключить значительное число проблем загрязнения окружающей среды, возникающих при использовании бытовых товаров, а во многих случаях и продукции технического назначения из синтетических полимеров [3].
В настоящее время мировая промышленность в основном ориентирована на использование и переработку практически невозобновляемого углеводородного и каменноугольного сырья. Возможно, эти виды ресурсов будут исчерпаны уже в следующем столетии. Именно поэтому в ряде развитых стран мира проводятся широкие научно-технические исследования по применению растительного возобновляемого сырья для разработки новых видов полимерных материалов. Эти полимеры привлекательны не только с точки зрения используемого для их получения сырья, но и имеющихся у них преимуществ в области утилизации отходов.
Бурное развитие производства таких материалов, первоначально предназначавшихся исключительно для медицинских изделий, позволило разработать подходы к решению глобальной проблемы утилизации твердых полимерных отходов.
К сожалению, в России пока не уделяется должного внимания разработкам такого типа.
Анализ литературных источников в области разработки биоразлагаемых полимеров за последние годы указывает на активное развитие направления производства полимеров на основе гидроксикарбоновых кислот. Столь пристальное внимание к этому классу соединений обусловлено тем, что еще в 1925 г. было установлено, что полигидроксимасляная кислота под воздействием различных видов микроорганизмов разлагается до С0>2 >и Н>2>0. Полиэфиры на основе других гидроксикарбоновых кислот (гликолевой, молочной, валериановой или капроновой) ведут себя аналогично.
Для получения соответствующих полиэфиров указанных кислот используются их димерные производные - гликолиды, лактиды в случае гликолевой и молочной кислот, либо у - или е-лактоны для валериановой и капроновой кислот [4].
Среди биодеградируемых материалов полимолочная кислота, синтезируемая из мономеров, получаемых путем микробиологической переработки растительного сырья (ферментативным брожением декстрозы сахара или мальтозы, сусла зерна или картофеля), занимает лидирующее производство (140 тыс. т в 2002 г.; 250 - в 2005 г., 400 тыс. т в 2007 г.).
Важным достоинством полимолочной кислоты (полилактида) является то, что этот прозрачный, бесцветный термопластичный полимер может быть переработан всеми способами, применяемыми для переработки известных термопластов. Из листов можно термоформовать подносы, тарелки, упаковку для пищевых продуктов, имплантаты для медицины. Он опробован также в качестве полимера для получения волокон, пленок, связующего для целлюлозных нетканых материалов [5]. Несмотря на все перечисленные достоинства полилактида, широкое внедрение его в качестве полимера бытового и технического назначения до последнего времени сдерживается небольшими объемами выпуска, низкой производительностью технологических линий и, как следствие, высокой стоимостью продукции. В связи с этим особое внимание в настоящее время разработчики полиэфиров уделяют вопросам удешевления получаемых биоразлагаемых продуктов за счет создания высокопроизводительных технологических процессов. Активную работу в совершенствовании технологии производства молочной кислоты проводят фирмы Cargill Inc. (США) и PURAC (Испания) [3].
Молочная (2-гидроксипропи-оновая кислота), СН, - СН (ОН) - COOH) существует в L - и D-изомерных формах. Кроме того, существует ее рацемическая форма. Продукт, получаемый в процессах ферментации (брожения), содержит до 99,5 % 1-изо-мера и 0,5 % Д-изомера [6]. Молочная кислота, представляющая собой бесцветные кристаллы, гигроскопична, легко образует циклический димер - лактид (рис.1).
Лактид также существует в виде оптически активных L - и /) - форм и неактивного рацемата и может полимеризоваться с образованием высокомолекулярных полимеров. Однако высокомолекулярные полилактиды, полученные из оптически неактивных или оптически малоактивных лактидов, вследствие случайной ориентации заместителей в цепи не обнаруживают кристалличности. Они отличаются высокой растворимостью в различных органических растворителях/ низкой температурой плавления, хорошей термопластичностью и не используются для получения волокон. Изготовление высокомолекулярных волокнообразующих полилактидов возможно лишь из оптически активных мономеров.
Поли-Х-лактид (PLA) - полимер с высокой степенью кристалличности, достигающей 70 - 80 %, со средней плотностью 1,270 г/см1 при плотности аморфных и кристаллических областей 1,248 и 1,290 г/см3 соответственно [6], с температурой стеклования 48,5°С. Термоокислительная деструкция поли-i-лактида начинается при 240 - 250 "С. Он растворим во многих органических растворителях, таких, как хлорированные алифатические и ароматические углеводороды, ацетонитрил, диок-сан, тетрагидрофуран. Полилактид не растворим в воде и в водно-спиртовых смесях, не токсичен и не вызывает тканевой реакции отторжения [7J. Полилактид относится к алифатическим полиэфирам и к биосовместимым термопластикам.
Наиболее часто используется первый метод вследствие более высокой чистоты исходного димера.
В основе процесса лежит получение дилактида, а затем его полимеризация. Первичная стадия синтеза включает получение предконденсата, который затем термически деполимеризуется до дилактида. Свойства результирующего волокнообразующего полилактида зависят в большой степени от чистоты дилактидного мономера, что требует его тщательной очистки. Полимеризация дилактида происходит с раскрытием цикла, и образующийся линейный полилактид содержит примерно 5 % непрореагировавшего мономера. Такой полимер может подвергаться гидролизу, если его использовать для дальнейшей переработки в волокна или изделия. Поэтому PLA подвергается обязательной очистке от мономера.
Значительный интерес для получения биоразлагаемых полимеров представляют сополимеры молочной кислоты, поскольку появляется возможность создания полимеров с регулируемой скоростью биодеструкции. Особенно это важно для полимеров и волокон на их основе, используемых в медицине.
Волокна, полученные из PLA, не уступают по прочности волокнам, полученным из других полиэфиров, в частности из полигликолида, и вследствие гидрофобной природы исходного полимера они устойчивы к гидролизу даже в кипящей воде. Продукты биодеструкции волокон из PLA (молочная кислота) являются нормальным метаболитом и не оказывают токсического воздействия на организм. Однако скорость биоразложения (период полураспада равен 168 дням) PLA достаточно велика и не позволяет его использовать в общей и специальной хирургии для ушивания мягких тканей, особенно в случае применения в качестве хирургического материала с короткими (до 1 года) сроками рассасывания. Использование PLA в медицине ограничено изготовлением костных протезов, костных винтов и имплантантов для костных тканей. Текстильные материалы из PLA обладают хорошими характеристиками, из них изготовляют комфортное белье и модную одежду, занавески и драпировочные материалы. Они не содержат вредных примесей, вызывающих аллергическую реакцию при контакте с телом человека [8J.
Введение сомономера в PLA позволяет существенно сократить время биологической деструкции полимера и расширить область его применения, прежде всего в медицине, производстве упаковочной тары, в качестве пластификаторов и связующих.
Наиболее перспективным сомономером, например, для изделий медицинской техники представляется гликолид, который может быть получен из гликолевой или монохлоруксусной кислот.
Ранее во ФГУП "ВНИИСВ" были разработаны биодеградируемые шовные хирургические материалы на основе полигликолила, которые выпускаются в небольших объемах.
Полигликолид, являясь простейшим полиэфиром, в котором благодаря близкому расположению сложноэфирных групп сильно выражены межмолекулярные взаимодействия, обладает высокой степенью кристалличности, а также чрезвычайной гидролитической нестабильностью. Полигликолид обладает приемлемыми сроками рассасывания в живом организме (6 - 12 мес), однако вследствие гидролитической нестабильности довольно быстро (до 20 сут) теряет около 60 % прочности, что накладывает определенные ограничения на его использование в качестве хирургического материала.
Поэтому значительный интерес представляет синтез сополимеров различного состава на базе молочной и гликолевой кислот (или гликолида и лактида), в которых сочетаются свойства этих двух полимеров и имеется возможность контролировать скорость биодеструкции.
Полимеры могут быть получены с различными молекулярными массами и структурой макромолекул, позволяющей варьировать степень взаимодействия между макромолекулами. На основе лактида и гликолида возможно получение целого семейства сополиэфиров, свойства которых будут отличаться в пределах определенного диапазона.
В литературе отмечается высокая склонность гликолида к полимеризации по сравнению с лактидом. Исследования относительной реакционной способности лактида и гликолида в процессе их сополимеризации показали, что для цепи растущего гликолида втрое более предпочтительно присоединение другой единицы гликолида, а для цепи растущего лактида в пять раз предпочтительнее присоединение гликолида. То и другое ведет к образованию блоков гликолида, разделенных единичными лактидными остатками. Поэтому сополимеры гликолевой и молочной кислот имеют широкий диапазон составов, причем гликолид полимеризуется преимущественно при низких конверсиях, а лактид встраивается в большей степени, когда гликолид уже исчерпан [10].
С увеличением содержания лактидных фрагментов в макромолекуле его сополимера с гликолидом повышается гидрофобность, но уменьшается кристалличность. Изменяя количество и время введения мономера, можно целенаправленно изменять тонкую структуру материала и его свойства, например время полной деструкции полимера.
Сополимеры гликолида и лактида разлагаются путем простого гидролиза до гликолевой и молочной кислот, которые перерабатываются (в случае медицинского применения) через обычные метаболические пути. Скорость гидролиза зависит от таких факторов, как размер и гидрофильность полимерного имплантанта, мономерность состава, степень кристалличности полимера, рН и температура окружающей среды. Сроки разложения меньше для полимеров с более низкой молекулярной массой, большей гидрофильностью и большим содержанием аморфной части, а также при более высоком содержании гликолида в сополимерах.
В процессе отработки синтеза биоразлагаемых сополимеров использовались лактоны, полученные на стендовой установке пиролиза. Лактоны очищались от примесей мономеров (молочной и гликолевой кислот) двух-трехкратной перекристаллизацией осушенным этилацетатом и от олигомерных оксикислот холодной экстракцией сухим этилацетатом. По результатам потенциометрического титрования содержание карбоксильных групп примесей в циклических димерах не превышало 2-103 моль/кг, температура плавления полученных мономеров составляла 79°С для гликолида и 94°С для L-лактида, что соответствует разработанным техническим требованиям к их качеству и температурным характеристикам [11].
Сополимеризацию i-лактида с гликолидом проводили в ампулах из термостойкого стекла при температуре 140, 150, 160, 170°С при следующих соотношениях гликолид: лактид соответственно: 1,68: 6,70; 2,74: 6,10; 4,9: 4,9; 9,55: 2,33 моль/л. В качестве инициатора процесса использовали хлорид олова (SnCl>2>-2HiO), а регулятора молекулярной массы - лауриловый спирт (CHj-fCH),,-CHiOH) в виде 1 % растворов в серном эфире. После загрузки реагентов систему трижды вакуумировали и заполняли азотом, а затем помещали в термостат с температурой 100 С. По окончании расплавления реакционной смеси начинали процесс сополимеризации в выбранном диапазоне температур. В ходе эксперимента были проведены исследования влияния температуры процесса, состава реакционной среды, концентрации инициатора и регулятора молекулярной массы на кинетику процесса сополимеризации и свойства получаемых полимеров.
Выход сополимера и кинетику расхода мономеров в ходе процесса синтеза исследовали методами гравиметрии и ЯМР-спектроскопии. Спектры ЯМР-образца сополилактида, полученного при соотношении концентраций 1-лактид: гликолид, равном 6,1: 2,74, снимали в диметилсульфоксида при 100 "С на спектрометре "Tesla BS-497" с рабочей частотой 100 МГц. Химические сдвиги определяли по тетраметилсилану и растворителю как внутренним стандартам. Результаты исследования микроструктуры гликолида с лакти-дом представлены на рис.2 и в табл. I.
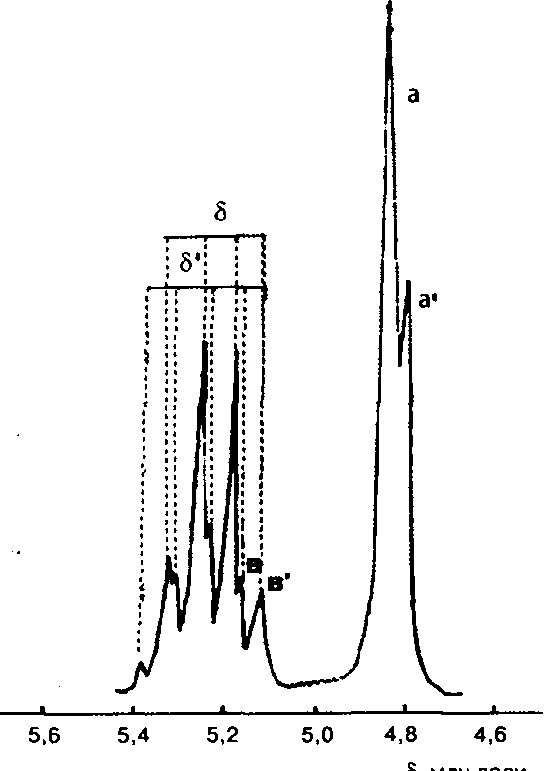
Для интерпретации спектров полимеризующейся системы использовали литературные и экспериментальные значения химических сдвигов сигналов мономеров. В ЯМР-спектре сополимера гликолида с L-лакти-дом присутствуют сигналы, имеющие химические сдвиги гомополимеров гликолида и L-лактида, а также два новых сигнала (синглет 4,81 млн доли и квартет 5,27 млн доли), которые следует отнести к сигналам протонов (см. рис.1), соответствующих перекрестному акту роста ц$пи (а, в). Можно предположить, что химические сдвиги метильных протонов лактида в перекрестном акте и в последовательности лактидных звеньев отличаются, по-видимому, очень мало (т.е. с'=с):
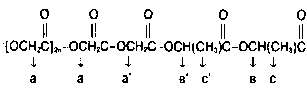
Путем интегрирования сигналов ЯМР-спектров сополимеров, выделенных на различных стадиях сополимеризации, проанализировано изменение их микроструктуры в ходе процесса. Обнаружено, что содержание лактидных СН-групп в сополимере, относящихся к перекрестным актам роста цепи, по сравнению с общим содержанием этих групп на ранних стадиях сополимеризации выше, чем в конце процесса. Это хорошо согласуется с данными о кинетике расхода сомономеров в исследуемой системе.
Образующиеся при синтезе сополимеры имеют блочную структуру, причем близкий по составу к чередующемуся сополимер можно получить в случае сополимеризации смеси с соотношением 1-лактид: гликолид, равным 6,1: 2,74, причем процесс должен быть остановлен сразу после конверсии гликолида.
Поэтому в качестве базового соотношения 1-лактид: гликолид было выбрано указанное соотношение. Кроме того, данные по биоабсорбции сополилактидов в воде при t = 37 *С указывают на тот факт, что наименьшими сроками разложения обладают именно сополимеры лактида и гликолида в диапазоне концентраций i-лактида 25 - 75 % по массе.
На основании результатов выполненных лабораторных исследований были определены условия получения образцов сополилактидов на экспериментальной лабораторной установке, которая включает в себя реактор из коррозионно-стойкой стали объёмом 0,01 м снабжённый ленточной мешалкой со шнековым наконечником и фильерой, и узел литья и гранулирования.
После загрузки реакционной смеси в реактор аппарат герметизировали и, с целью удаления кислорода и влаги воздуха, попеременно вакуумировали и азотировали. После этого включали электрообогрев и мешалку. Устанавливали число оборотов мешалки 5 - 10 мин. Расплавление реакционной смеси проводили при температуре 100 "С под азотной подушкой в течение 30 - 40 мин. По окончании расплавления температуру в аппарате повышали до рабочей и начинали синтез сополимера. О ходе процесса судили по изменению расхода энергии (AU) на перемешивание реакционной смеси. По достижении AU равной 0,2 - 0,25 та сополимер выгружали через фильеру давлением азота до 3 кгс/см! при работающей мешалке и гранулировали.
Процесс синтеза экспериментальных образцов сополилактидов проводили при температуре 172 ±2°С. Состав реакционной смеси, г: 670 /. - лактид (75 %); 220 гликолил (25 %). В качестве инициатора реакции использовали хлорид олова SnCl) - 2HiO (масса 0,225 г), а регулятора - лауриловый спирт (9,0 г).
Таким образом, введение в состав PLA гликолидных звеньев приводит к существенному сокращению сроков биоабсорбции в биологической среде сополимеров на базе лактонов молочной и гликолевой кислот по сравнению с гомопол и мерами.
В настоящее время исследования продолжаются в направлении разработки технологии и аппаратурного оформления процесса получения PLA и ее сополимеров.
В заключение следует подчеркнуть, что для успешного решения проблемы создания в Российской Федерации производства биоразлагаемых полимеров необходима консолидация всех исследователей, работающих в данной области, и осуществление серьезных инвестиций, в том числе государственных.
Исследованы варианты синтеза сополимеров из гликолида и L-лактида в диапазоне температур 140 - 170 "С и при соотношении концентраций (L-лактид: гликолид) равном 6,7: 1,68; 6,1: 2,74; 4,9: 4,9; 2,33: 9,55 моль/л в присутствии инициатора процесса хлорида олова SnCI>2>*2HiO и регулятора молекулярной массы - лаурилового спирта. Полученные результаты подтверждают блочную структуру сополимеров.
Отработан способ синтеза сополилактида соотношения L-лактид: гликолид = 6,1: 2,74. Получены образцы полимера со среднемассовой молекулярной массой 27 000 - 28 000 при конверсии продукта 92 - 94 % и образцы многофиламентной нити на их основе.
Литература
Фомин В.А., Гузеев В.В. // Пластические массы. 2001. № 2.
Попов А.В. // Тара и упаковка. 2007. №3.
Макаревнч А.В. и др. // Пластические массы. 1996. № 1.
Материалы для поликонденсации / Под ред. Дж. Стилла. М.: Мир, 1976.
В. linnemann, М. Sri Harwoko, Н. Gries. // Chemical Fibers Inter-national. 2003.
Хомяков A. K. // Химическая энциклопедия. Т.3. М.: Изд. БРЭ, 1992.
Энциклопедия полимеров // Ред. коллегия под руков. В.А. Кабанова. Т.2. М., 1977.
Перепелкин К.Е. // Химия и химическая технология волокон. 2002. №.2.
Kricheldorf H. R., Fecbner В. Polylactones // Biomacromolecules. 2002. V.3.
Барская И.Г., Людвиг Е.Б., Тарасов С.Г., Голове кий Ю. к. // Высокомолекулярные соединения. Г9Я5.29.)