Начала кондуктометрии
Начала кондуктометрии
Кондуктометрия занимается изучением электропроводности растворов. В этой области электрохимии принято оперировать 2-мя характерными величинами: удельной электропроводностью (k - каппа) и эквивалентной электропроводностью (l ). Поясним физический смысл этих величин.
Удельной электропроводностью называется электропроводность электрического проводника площадью сечения 1 кв. метр и длиной 1 метр. Единицей измерения является Сименс на метр (См/м), хотя чаще используются и другие единицы измерения. Например, приборы, измеряющие удельную электропроводность, имеют обыкновение показывать результат в мкСм/см, а в различных справочниках встречается другая единица измерения - Ом-1м-1. (Этот факт не должен смущать, поскольку См/м = Ом-1м-1.)
Эквивалентной электропроводностью называется удельная электропроводность 1н раствора электролита:
|
l = k / C , |
(1) |
где С - концентрация электролита в г-экв/м3.
Кондуктометрия располагает несколькими законами, знать которые крайне необходимо!
1. В очень разбавленных растворах
(предельно разбавленных) эквивалентная
электропроводность (l>0>) является
постоянной характеристикой раствора,
не зависящей от изменения концентрации
электролита. Говоря простым языком, это
означает, что в разбавленных растворах
электропроводность прямопропорциональна
количеству заряженных частиц - ионов.
Для
растворов сильных электролитов область
предельного разбавления простирается
до концентрации 0,0001н, а с небольшой
погрешностью можно считать границей
предельного разбавления концентрацию
0,001н.
Для расчетов в области больших
концентраций существует формула
Кольрауша, но ее нельзя использовать
для прогноза, поскольку она носит явно
эмпирический характер:
l = l>0> + K C 1/2, (2)
где К - эмпирическая константа.
(Более
точно описывает свойства раствора
формула Онзагера, но расчеты с ее
применением очень сложны!)
2. Предельная эквивалентная электропроводность раствора электролита равна сумме эквивалентных электропроводностей катиона и аниона:
l>0> = l>0>+ + l>0>-. (3)
Пользуясь этим определением, легко сделать прогноз электропроводности любого раствора:
k = (l>0>+ + l>0>-) С. (4)
Например, удельная электропроводность
0,0005н раствора хлористого калия будет
равна 6,505 10-6 Ом-1 м-1
(18 0С), поскольку 6,505 10-6 = (l>0>K
+ l>0>Cl) С =(0,00655 + 0,00646)
0,0005н.
Полученный результат неплохо
согласуется с экспериментальным
значением 6,405 10-6 Ом-1 м-1.
Не составляет труда рассчитать удельную электропроводность раствора, состоящего из смеси различных ионов:
k = S l>0i >C>i >. (5)
(С справочными данными можно ознакомиться в таблице.)
Однако, приведенные выше расчеты верны только для растворов сильных электролитов. Для слабых электролитов необходимы дополнительные расчеты, связанные с вычислением доли свободных ионов от общего ионов. За примером далеко ходить не надо. Например, эквивалентная электропроводность 0,0001н раствора уксусной кислоты составляет 0,0107 Ом-1 м2 г-экв-1 (18 0С). Расчет по формуле (3) дает величину 0,0349 Ом-1 м2 г-экв-1 (18 0С). В связи с такими большими различиями, нет сомнения в том, что необходимо ввести поправку на частичную диссоциацию молекул уксусной кислоты. Расчеты показывают, что уксусная кислота концентрации 0,0001н создает кислотность среды pH=4,67. При этом степень диссоциации кислоты составляет 33,9%. Несложный пересчет эквивалентной электропроводности дает уточненную величину 0,0118 Ом-1 м2 г-экв-1 (18 0С), что довольно близко к экспериментально полученной величине 0,0107 Ом-1 м2 г-экв-1 (18 0С).
3. Эквивалентные электропроводности подавляющего числа ионов близки друг к другу по величине. Анализ экспериментальных данных показывает, что при 18 0С для катионов l>0>=0,0053 +/- 0,0019 Ом-1 м2 г-экв-1 и для анионов l>0>=0,0055 +/- 0,0027 Ом-1 м2 г-экв-1. При 25 0С l>0>=0,0062 +/- 0,0023 Ом-1 м2 г-экв-1 для катионов и l>0>=0,0064 +/- 0,0031 для анионов. Исключение составляют ионы H+, OH-, Fe(CN)>6>3-, Fe(CN)>6>4-, электропроводности которых аномально высоки:
Ион Эквивалентная электропроводность,
l
>0>, Ом-1 м2 г-экв-1
18 0С 25 0С
H+ 0,0315 0,03497
1/3 Fe(CN)>6>3- - 0,01009
1/4 Fe(CN)>6>4- - 0,01105
OH- 0,0174 0,01976
Интересно сделать расчет самой малой концентрации, которую позволяют определять кондуктометры с ценой деления 0,1 мкСм/см. Оказывается, что для большинства солей пределом обнаружения служит величина 8 10-7н. Для кислот предел обнаружения равен 2 10-7н.
4. Температура анализируемого раствора оказывает существенное влияние на измеряемые величины удельной электропроводности. В настоящее время не существует способа удовлетворительного описания влияния температуры на электропроводность. Причина такого положения дел кроется в слишком большом влиянии индивидуальной природы растворенных веществ на температурный коэффициент. С уверенностью можно сказать только одно: при повышении температуры на один градус удельная электропроводность раствора в среднем увеличивается на 1-2,5%.
Прямые кондуктометрические измерения.
Аналитическое использование кондуктометрии обладает характерными чертами, связанными с низкой селективностью кондуктометрического детектирования. В самом деле, близкие значения эквивалентных электропроводностей ионов не позволяют говорить о том, что какой-либо ион может целиком определять электропроводность всего раствора. Таким образом, измерения электропроводности может приносить реальную аналитическую пользу только в том случае, если соотношение ионов в анализируемой смеси неизменно от пробы к пробе. Это, так называемая, задача определения разбавления исходного раствора. Примерами могут служить анализ промывных вод в ваннах отмывки гальванического производства, контроль за приготовлением технологических растворов в производственных условиях и т.п.
Кондуктометрическое титрование.
Несомненно, большими аналитическими возможностями обладает кондуктометрическое титрование. Титрование позволяет восполнить недостаток селективности определения применением селективного к анализируемому иону титранта. Известны примеры кислотно-основного, осадительного, комплексонометрического титрований. Точность кондуктометрического титрования составляет 1%, но если принять меры по термостатированию анализируемого раствора, то точность определения можно в несколько раз увеличить.
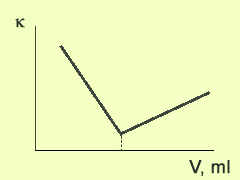
Типичный вид кривой кондуктометрического титрования представлен на рисунке 1.
|
|
|
Рис. 1. |
Точка эквивалентности на графике находится пересечением двух прямых. Одна прямая (до точки эквивалентности) отражает изменение концентрации анализируемого иона и ионов титранта, а другая (после точки эквивалентности) является следствием увеличения концентрации ионов титранта.
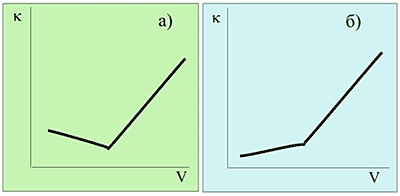
Однако не всегда кривая титрования имеет такой вид. На рис.2 приведены в качестве примера кривые титрования, полученные в результате различных аналитических определений.
|
|
|
Рис. 2. |
Вид кривых очевидно различен. В связи с этим возникает закономерный вопрос о причинах различий и возможности прогнозирования вида кривой на основании данных о свойствах анализируемого иона и вещества титранта. В большинстве случаев прогноз возможен, поскольку вид кривой титрования определяется разностью эквивалентных электропроводностей анализируемого иона и ионов, составляющих вещество титранта.
Рассмотрим несложный расчет, позволяющий прогнозировать вид кривой титрования. Прежде всего, нужно ясно представить себе перечень ионов, принимающих участие в процессе титрования. Пусть нам предстоит определить хлорид с помощью осадительной реакции с нитратом серебра (рис. 2а):
Cl- + Ag+ + NO>3>- = AgCl + NO>3>-.
Не вызывает сомнения, что в процессе титрования до точки эквивалентности происходит уменьшение ионов Cl- и NO>3>-. Увеличение концентрации ионов Ag+ практически не происходит, так как серебро осаждается ионом Cl-. В связи с этим можно утверждать, что динамика электропроводности происходит со скоростью, пропорциональной сумме
-l >0>Cl + l >0>NO3 =-0,00655 + 0,00617 = -0,00038 Ом-1 м2 г-экв-1.
Знак '-' перед электропроводностью l >0>Cl говорит о том, что концентрация Cl в результате титрования уменьшается. Знак '+' перед l >0>NO3 свидетельствует об увеличении концентраци NO>3>.
Полученное в итоге отрицательное число -0,00038 Ом-1 м2 г-экв-1> >указывает на то, что при титрованиии до точки эквивалентности электропроводность раствора уменьшается.
После точки эквивалентности электропроводность будет повышатьcя, так как эту ветвь титрования полностью определяет титрант, т.е. ионы Ag и NO>3>:
l >0>Ag + l >0>NO3 = 0,005436 + 0,00617 = 0,011606 Ом-1 м2 г-экв-1.
Прошу обратить внимание на то, что полученное число положительно, что говорит об увеличении электропроводности раствора с каждой порцией титранта.
Кривой титрования (рис. 2б) на рисунке может соответствовать титрование ацетата натрия соляной кислотой. Почему? Потому, что до точки эквивалентности электропроводность раствора будет возрастать, а не убывать как в предыдущем случае:
-l >0>ацетат + l >0>Cl = -0,0034 + 0,00655 = 0,00315 Ом-1 м2 г-экв-1.
В заключении хочу предупредить о том, что любое отклонение кривой титрования от описанных выше видов, должно настораживать, так как при этом увеличивается вероятность появления больших систематических ошибок. Подозрение должны вызывать нелинейные ветви кривой титрования, максимум на кривой титрования и т.п.
Список литературы
Для подготовки данной применялись материалы сети Интернет из общего доступа