Особливості підвищення ефективності навчальної діяльності в спеціалізованих класах з поглибленим вивченням хімії на уроках з теми "Залізо та його сполуки"
Міністерство освіти і науки України
Полтавський державний педагогічний університет ім. В. Г. Короленка
Кафедра хімії
Особливості підвищення ефективності навчальної діяльності в спеціалізованих класах з поглибленим вивченням хімії на уроках з теми «Залізо та його сполуки»
Полтава 2007
Зміст
Вступ
І. Шляхи й засоби підвищення ефективності навчальної діяльності в спеціалізованих класах з поглибленим вивченням хімії
1.1 Головні методичні ідеї лекційно-семінарської системи
1.2 Особливості використання опорних конспектів-схем на уроках хімії в спеціалізованих класах
1.3 Тренінгові методики у вивченні хімії за лекційно-семінарською системою
1.3.1 Картки-завдання для самостійної роботи
1.3.2 Картки з хімії перетворень по темі “Залізо та його сполуки”
Рівень 1.
Рівень 2.
Рівень 3.
Відповіді.
1.4 Психолого-педагогічні аспекти викладення хімії у спеціалізованих класах
ІІ. Дидактичні основи навчання хімії у спеціалізованих класах. Розробка уроків-модулів з теми “Залізо та його сполуки”
2.1 Комплексна дидактична мета
2.2 Ферум, будова атома Феруму. Фізичні властивості заліза
Варіант 1.
Варіант 2.
2.3 Ферум в природі. Одержання заліза в лабораторії та промисловості
2.4 Хімічні властивості заліза
2.5 Сполуки Феруму: оксиди, гідроксиди, солі. Якісні реакції на Fe2+ та Fe3+
Варіант 1.
Варіант 2.
2.6 Семінарське заняття “Залізо та його сполуки”
Варіант 1.
Варіант 2.
2.7 Сплави заліза: чавун і сталь. Застосування сплавів і сполук феруму
2.8 Практична робота “Розв’язування задач з теми “Метали”
2.9 Атестація з теми “Метали побічних груп “Залізо”
2.10 Методична розробка інтегрованого уроку хімії та географії “Металургійний комплекс чорна металургія України”
2.11 Методична розробка дидактичного модуля за темою “Залізо та його сполуки” для класів з поглибленим вивченням математики й фізики
ІІІ. Експериментальні дослідження впровадження лекційно-семінарської системи при вивченні теми “Залізо та його сполуки”
3.1 Хід та організація дослідження у класах з поглибленим вивченням хімії
3.2 Результати експериментального навчання в класах з поглибленим вивченням хімії
3.3 Хід та організація дослідження в фізико-математичних класах
3.4 Результати дослідження в фізико-математичних класах
Висновок
Література
Додатки
Вступ
У ХХІ столітті Національна доктрина розвитку освіти в Україні має забезпечити підготовку людей високої культури – кваліфікованих спеціалістів, здатних до творчої праці, професійного розвитку, мобільності в освоєнні і впровадженні новітніх наукомістких та інформаційних технологій. Останнє можливе лише за умови мисленнєвої культури, внесення її в реальність педагогічної діяльності. Тому були створені класи з поглибленим вивченням хімії, де талановиті діти, які вчаться свідомо і самостійно можуть реалізувати свої можливості. Тому нами була розроблена спеціальна навчальна методика в якій ми поєднали лекційно-семінарську систему з модульною системою навчання, яка дозволяє повніше реалізувати можливості учнів, інтенсифікувати навчальний процес, навчити, їх розв’язувати проблеми, застосовуючи свій інтелект, волю, почуття, пам’ять, мислення.
Вже починаючи з перших уроків вивчення теми “Залізо та його сполуки” за новою методикою школярі начинають засвоювати знання в тому темпі, який зумовлюється їхніми пізначальними здібностями. Це дає можливість здібним і особливо обдарованим дітям максимально розвивати власні позитивні задатки, збільшувати інтелектуальний потенціал.
У процесі навчання учні завжди повертаються до раніше вивченого (використовуючи опорні схеми) і розглядають його з різних позицій на більш складному рівні, що дає можливість слабшим учням закріпити, сильнішим поглибити знання.
Метою даної роботи є:
1. Теоритично розробити методичні підходи до вивчення теми “Залізо та його сполуки”, у класах з поглибленим вивченням хімії.
2. Обгрунтувати доцільність використання таких методичних підходів, які найбільш повно враховують особливості прояву пізнавального інтересу і активізують пізнавальну діяльність учнів при вивченні теми “Залізо та його сполуки”.
3. Видача практичних рекомендацій по застосуванню поданих в роботі матеріалів в шкільному курсі хімії та у реальному навчальному процесі, у проведенні студентських науково-практичних конференцій, а також під час розробки занять з інших тем курсу хімії.
І. Шляхи й засоби підвищення ефективності навчальної діяльності в спеціалізованих класах з поглибленим вивченням хімії
Перед навчальними закладами освіти стоїть завдання - всебічно вдосконалювати навчально-виховний процес, який би забезпечував розширення обсягу й підвищення міцності знань, умінь і навичок учнів, розвиток їх індивідуальних та творчих здібностей.
Навчання хімії служить загальним цілям виховання підростаючого покоління, озброює учнів знаннями, необхідними для розбудови держави, сприяє формуванню у школярів наукового світогляду, допомагає виховувати їх у дусі патріотизму, відданості своєму народові. Батьківщині.
Розвиток сучасної науки й техніки ставить перед школою нові завдання. Випускник сучасної школи, який житиме й працюватиме в новому тисячолітті, повинен володіти певними якостями:
самостійно здобувати необхідні знання, вміло застосовуючи їх на практиці;
критично мислити, грамотно працювати з інформацією;
бути комунікабельним, контактним у різних соціальних групах;
самостійно працювати над розвитком власного інтелекту, культурного й морального рівня.
Сформувати такі якості можна лише за рахунок підвищення ефективності навчальної діяльності.
Активізація мислення стала найважливішою частиною перебудови школи відповідно до міжнародних загальноосвітніх стандартів. Зміст і обсяг підготовки учнів згідно з цими стандартами мають відповідати вимогам сьогодення, забезпечити високий загальноосвітній рівень громадян України, їх інтеграцію в Європейський освітній простір. Якість уроку, відхід від шаблонної системи його організації, оволодіння новими технологіями - ось що необхідно сучасному вчителю. Знання разом з творчими здібностями стають головним показником усебічно розвинутої особистості.
Говорячи про перспективу шкільної хімічної освіти, треба пам'ятати, що хімія — загальноосвітній предмет, необхідний не лише для вивчення теоретичних основ науки, а й для зв'язку з життям.
Реформування середніх навчальних закладів освіти пов'язано з подальшим посиленням практичної спрямованості предметів природничого циклу. Учні матимуть можливість зацікавитися предметом, і тоді він зможе відіграти важливу роль у їхній професійній орієнтації.
Основною метою сучасної школи є створення такої системи навчання, яка б задовольнила освітні потреби кожного учня відповідно до його здібностей, інтересів та можливостей. Щоб досягти цієї мети, дирекція школи вирішила змінити ставлення учня й учителя до навчального процесу. Виходячи з того, що учнів, які не можуть досягти необхідного рівня знань та вмінь при невеликих витратах часу, у школі наявно близько 5%, талановитих учнів, які вчаться у високому темпі й досягають високих показників, теж 5%, а звичайних дітей - близько 90%, було вирішено створити спеціалізовані класи з поглибленим вивченням хімії. Цього вимагала і необхідність залучити до праці висококваліфікованих спеціалістів - хіміків.
Отже, вирішили, що кожен учень, який навчається у спеціалізованому класі, повинен працювати над навчальним матеріалом свідомо та самостійно, а вчитель повинен керувати навчальним предметом, не нав'язуючи дітям власних установок, які, як правило, гальмують природний розвиток дитини. Ми, опрацювавши безліч методичної літератури, прийшли до висновку, що у спеціалізованих класах потрібно використовувати лекційно-семінарську систему в поєднанні з блочно-модульною та контрольно-коригувальною системами навчання, які дозволяють повніше реалізувати можливості розливального навчання, інтенсифікувати навчальний процес, навчити учнів розв'язувати проблеми, застосовуючи свій інтелект, волю, почуття, пам'ять, мислення.
Для цього:
1. Весь навчальний матеріал поділяється на різні за обсягом частини (порції,або модулі). Визначальними принципами поділу є дидактична мета і характерні особливості теми.
2. Для кожного учня записується алгоритм навчання, де зазначається тема,мета, рекомендована література, дається опорний конспект, міні-підручник, складений вчителькою, перелік задач, розрахункових та експериментальних, вправ, тестових завдань. Користуючись певним набором довідкової та навчальної літератури, учень засвоює відповідну порцію матеріалу.
3. Учень не може перейти до наступного кадру програми, якщо добре не оволодіє змістом попереднього.
4. Зміст окремих кадрів програми (міні-модулів) диференціюється відповідно до здібностей учнів, а також з урахуванням ступеня їх просування у навчанні.
5. У процесі навчання намагаємося спланувати роботу таким чином, щоб діяв принцип диференціації складності та міцності засвоєння знань.
6. Записані у міні-підручниках завдання включають проведення досліджень,аналіз, самостійне вивчення певних явищ, фіксацію результатів вивчення у вигляді моделей цих явищ, таблиць. Часто учні самостійно складають опорні конспекти з певних тем.
7. Виконання цих завдань носить теоретичний характер і вводить учнів у лабораторію наукової думки, допомагає їм набувати досвіду, формувати творче мислення.
8. У процесі навчання поряд з індивідуальною роботою широко використовується як групова, так і колективна форми навчальної діяльності.
З метою підвищення рівня засвоєння знань на уроках у класах з поглибленим вивченням хімії ми використовуємо контрольно-коригувальну технологію навчання, яка дає можливість організувати індивідуальні освітні траєкторії учнів із врахуванням їхніх здібностей, індивідуальних особливостей, мотивації, а також того рівня інформації, що необхідно подати.
Впроваджуючи нестандартні форми навчання, вчитель хімії Полтавського НВК(школи-ліцею) №28 Стародубцева Є.Г. дозволяє учням спеціалізованих класів, починаючи з перших уроків цілеспрямованої хімічної освіти, засвоювати знання у тому темпі, який зумовлюється їхніми пізнавальними здібностями. Дають можливість здібним і особливо обдарованим дітям максимально розвивати власні позитивні задатки, збільшувати творчий інтелектуальний потенціал. Дозволяє максимально наблизити навчальний матеріал до реального життя, спонукає учнів постійно оновлювати ці знання. У процесі навчання учні завжди повертаються до раніше вивченого і розглядають його з різних позицій на більш складному рівні, що дає можливість слабшим учням закріпити, а сильним поглибити знання.
Учень має можливість не лише більш свідомо ставитися до навчання, але й спостерігати динаміку особистого просування в засвоєнні навчального матеріалу, своєчасно коригувати свою пізнавальну діяльність. Навчання учнів у спеціалізованих класах спонукає їх працювати не лише на уроках, але й в позаурочний час: займатися у гуртках, на курсах, в Малій академії наук.
У класах з поглибленим вивченням хімії в 80-90% учнів сформована високорозвинена цілеспрямована навчальна діяльність. Всі учні вступають на хімічні факультети вузів, успішно складають іспит з хімії. Таких учнів у нас налічується близько 300. рівень успішності учнів спец. класів вищий порівняно з рівнем успішності їх однолітків на 60%.
1.1 Головні методичні ідеї
Гарний урок неможливий без натхнення і педагогічної інтуїції. Саме тоді він результат творчості, а не ремесла. Разом з тим гарний урок це втілення точно спланованого задуму вчителя.
1.Добровільність навчання (діти повинні з бажанням ідти на урок, почувати себе комфортно, не боятися). Для цього потрібен не тільки професіоналізм вчителя, але й створення сприятливого мікроклімату на уроці, мотивація навчальної діяльності учнів на кожному уроці - "Люблю те, чого навчаю, люблю тих, кого навчаю".
2.3абезпечення 100% зайнятості учнів на уроці, яка досягається застосуванням різноманітних способів навчання. Встановлено, що ефективність засвоєння прямо залежить від ступеня активізації учнів і залучення їх до процесу навчання. Застосування різноманітних методик робить процес навчання дійсно творчим, забезпечує зацікавленість учнів, допомогає розумінню та засвоєнню матеріалу.
З.Застосування тематичного планування, яке передбачає проведення різних типів уроків:
встановлення міжпредметних зв'язків та зв'язків між темами;
основний обсяг знань, якими повинен оволодіти учень;
основні уміння, яких мають набути учні;
самостійні роботи, які допоможуть учням і вчителеві перевірити знання з основних питань теми і досягти кінцевого результату;
- обсяг розрахункових задач з кожної теми, який допоможе, з одного боку,
засвоїти новий теоретичний матеріал, а з іншого - надасть можливості закріпити вміння розв'язувати задачі різних типів.
4.У процесі вивчення кожної теми доцільною буде лекція, де головною умовою є генералізація матеріалу, який подає вчитель. Вчитель повинен довести дітям головну думку. Найбільш повно це досягається в процесі модульного навчання - "заглиблення" в основи всього курсу.
5.Багаторазове повторення на різних рівнях засвоєння матеріалу. Для цього потрібно застосовувати різні форми контролю.
6.Розвиток творчої самостійності учнів. Цьому сприяє використання групових дискусій, проведення різноманітних семінарів, навчання учня учнем, творчі самостійні роботи дітей.
7.Формування уміння школярів працювати з довідковою літературою та складати тези, конспекти, схеми.
1.2 Особливості використання опорних конспектів-схем на уроках хімії в спеціалізованих класах
Процес навчання учнів є більш ефективним, коли він ґрунтується не тільки на викладанні матеріалу в традиційній формі, але й відображається у стислих конспектах або опорних схемах.
Принцип побудови опорних конспектів при вивченні теми „Залізо та його сполуки" ґрунтується на поширеному уявленні про будову атома даного елементу та його можливі значення ступенів окиснення. Наведені в міні-посібнику, а також в розробках модулів, опорні конспекти дають відповіді на вузлові питання теми за планом: речовина, знаходження у природі, будова, властивості, одержання, застосування. Опорні конспекти дозволяють уявити всю тему в цілому, що полегшує учням завдання встановлювати генетичний зв'язок між різними класами неорганічних сполук, які утворює елемент, та давати характеристику їх властивостям.
Використання таких опорних конспектів дає можливість учителю і учням економити час і використовувати його для практичного застосування знань, розв'язання розрахункових задач.
Використання розроблених опорних конспектів дає змогу упродовж вивчення програмного матеріалу спрямувати творчу діяльність учнів у необхідному напрямку. Це також допомагає виділити головні блоки, відшліфувати вивчення окремих компонентів конспекту, встановити логічні зв'язки між компонентами, зробити висновки за окремим блоком або за всією схемою. У процесі вивчення учбових тем учні оформлюють кожен конспект в окремому зошиті-словнику. У ньому поряд з основними поняттями і хімічними термінами подається матеріал, за яким можна повторити головні питання з усього курсу хімії
Спираючись на прийом багаторазового повторення конспекту, використовуючи колективні форми організації навчальної діяльності дітей, сприяємо таким чином глибокому засвоєнню матеріалу кожним учнем.
У процесі навчання за опорними конспектами потрібен цілий арсенал різноманітних ефективних методів, що спроможні зацікавити учнів. За даними іноземних фахівців, середній рівень засвоєння інформації визначається в залежності від кількості використаних методів навчання і може бути описаний у вигляді „Піраміди засвоєння" (дод. 1)
„Піраміда засвоєння" свідчить, що ефективність засвоєння учнями інформації прямо залежить від ступеня активізації, залучення їх до процесу навчання. Саме різноманітність методів і робить процес навчання дійсно творчим, збуджує зацікавленість учнів, полегшує розуміння і засвоєння матеріалу. Форми роботи, наведені в „Піраміді засвоєння", зміцнюють навички групової роботи, підвищуючи здатність учнів до співпраці з іншими.
У процесі вивчення кожної теми за опорними конспектами обов'язковою є лекція (5% засвоєння). Це швидкий спосіб забезпечення учнів необхідною інформацією. Вона, безумовно, дуже корисна, але й має свої недоліки, бо переводить учнів у становище пасивних слухачів.
Власне читання (10% засвоєння) - індивідуальне або групове - не дає належного ефекту при засвоєнні матеріалу. Тому його треба поєднувати з іншими, більш інтенсивними методами навчання.
Аудіо-візуальнші метод (20% засвоєння) передбачає під час складання опорного конспекту використання вчителем діафільмів та фільмів, підсилює ефективність навчального процесу.
Демонстрування (30% засвоєння) сприяє впровадженню у навчальний процес ідей проблемно-розвиваючого навчання, встановленню генетичних зв'язків між існуючими класами, дозволяє підтвердити хімічні властивості певної сполуки. При цьому учні отримують інформацію за допомогою різних органів чуття.
Якщо в процесі обговорення або складання опорного конспекту використовувати групові дискусії (50% засвоєння), то активізується розумова діяльність учнів, розвивається їх уміння висловлювати свої власні ідеї та думки.
Можна запропонувати учням самим скласти опорний конспект та обговорити його в групі своїх однокласників (бригаді). Це - активне навчання (70% засвоєння). Учень, який склав опорний конспект, може виступити перед своїми товаришами у ролі вчителя. Навчання учнем інших учнів забезпечує 90% засвоєння. Тому протягом усього курсу хімії особливе значення має саме робота бригадирів зі своїми бригадами: у підлітковий період вплив однолітків є дуже важливим.
Значну роль у навчанні відіграє контроль знань, умінь учнів. Опорні схеми допомагають інтенсифікувати цей процес.
Важливим завданням учителя є навчання учнів умінь і навичок раціонально вчитися. Це означає, що навчання будь-якого навчального предмета треба розглядати як навчання учнів власної діяльності з вивчення й оволодіння змістом навчального предмета.
Успішність власної діяльності учнів з вивчення й оволодіння змістом навчального предмета залежить від багатьох факторів. У психолого-педагогічних дослідженнях звичайно викликають інтерес такі фактори: по-перше, рівень розвитку пізнавальних процесів учня; по-друге, рівень розвитку його здібностей; по-третє, характер мотивації його навчальної діяльності і т.ін.
Дійсно, всі ці фактори в сукупності своєї є необхідними передумовами успішної діяльності учня. Але не треба забувати, що велике значення в оволодінні знаннями буде мати фактор самоорганізації школярем своєї діяльності у навчальному процесі.
Під самоорганізацією ми розуміємо вміння учня без систематичного зовнішнього контролю, без допомоги і стимуляції з боку вчителя самостійно й раціонально організовувати й проводити свою навчальну діяльність щодо здійснення прийнятих цілей навчання.
У даному випадку завдання вчителя не вчити, а допомагати вчитися учням, тобто вчитель повинен лише ставити пере учнями загальні цілі навчання і надавати допомогу в разі необхідності. У свою чергу, школяр повинен вчитися сам.
Проаналізуємо зв’язок самоорганізації діяльності учня з формами його навчальної роботи.
Як відомо, діяльність учня при будь-якій формі навчальної роботи складається з навчальних дій.
У своїх працях П.І. Підласистий допускає, що всі навчальні дії учня можна розділити на дві групи. Дії першої групи П.І. Підласистий визначає як дії-навички, дії-операції. При виконанні цих дій власна поведінка характеризується школярем в основному з навчально-практичного боку. Цікаво відзначати, що в цьому випадку від учня вимагається вміння проаналізувати умову пізнавальної задачі і визначити способи і стратегію її розв’язання. У свою чергу, дії другої групи відрізняються від дій першої групи тим, що в цьому випадку учнем усвідомлюються способи розв’язання навчально-пізнавальної задачі, способи власної діяльності. Треба відзначити, що самостійними є дії другої групи, а дії першої групи треба вважати навчально-тренувальними діями.
Таким чином, до самостійних дій можна віднести: виділення школярем пізнавальної задачі, підбір і визначення адекватних її розв’язанню способів і дій, виконання операцій з контролю.
У своїй роботі ми розглянемо, за допомогою яких засобів роботи можна сприяти самостійним діям учня. Як одну із таких форм ми пропонуємо складання і використання опорних конспектів-схем.
Під опорними конспектами-схемами розуміють конспекти, що являють собою прості, зрозумілі і наочні схеми навчального матеріалу, в яких вказані основні поняття й зв’язки між ними.
Виділяють опорні конспекти-схеми двох моделей: знаково-символічні й образні (важливу роль відіграє принцип використання таких конспектів-схем). Розглянемо найбільш популярні з них:
1. Учитель складає опорні конспекти-схеми, щоб учні в узагальненому вигляді запам’ятали зміст навчальної теми (наприклад, основні положення хімічної теорії).
2. Учитель розробляє опорні конспекти-схеми, щоб учні, користуючись ними, могли виконувати більш складні завдання (наприклад, складання здійснюванню хімічних реакцій з урахуванням хімічних властивостей реагуючих речовин, при цьому хімічні властивості занесені в опорну схему.
3. Учні складають опорний конспект-схему разом з учителем. При цьому завдання вчителя – допомогти школяреві раціонально викласти матеріал, що вивчається.
4. Учень самостійно складає опорний конспект-схему. Учитель тільки перевіряє правильність складання (відповідність науковості) і коригує його.
Коротко зупинимося на особливостях кожного із наведених принципів.
У першому випадку акцент зроблено на запам’ятовуванні, однак завжди школяр при цьому розуміє зміст опорної схеми.
Так, Н.О. Курдюмова, аналізуючи різні підходи до запису навчального матеріалу, встановила, що загальне призначення таких опорних конспектів-схем полягає в тому, що допомогти запам’ятати матеріал. Ця допомога, на її погляд, здійснюється двома шляхами. Перший шлях інформація „організується”, тобто зі словесної форми видаляється все зайве, залишаються тільки головні слова і малюнки, які, завдяки звичним позначенням, „самі за себе говорять”. Другий шлях – інформація шифрується за допомогою яскравих образів. Якщо у записі ми все розуміємо, перед нами – конспект. Якщо інформація фіксується на папері таким чином, що без додаткового роз’яснення, без шифровки її ніхто не зрозуміє, значить, ми маємо справу з опорною схемою.
У другому принципі в основу складання опорних конспектів-схем, на думку Л.Я. Зоріної, покладений стандартизований тип викладення навчального матеріалу. Такий принцип допомагає стандартизувати контроль, посилити взаємоконтроль учнів, допускає жорстке керування розумовою діяльністю учнів. Але треба відзначити, що стандартизований зміст і жорсткий контроль забезпечують засвоєння мінімуму знань всіма школярами.
Характеризуючи третій принцип, треба відзначити, що тут частіше за все переважає асоціативна теорія пам’яті. Доведено, що використання асоціативних зв’язків в навчанні як засіб запам’ятовування є ефективним. Складаючи самостійно конспект-схему, учень, як правило, використовує різні асоціації.
Як відомо П.П. Блонський вважав, що всілякі асоціації за суміжністю, починаючи з просторових і тимчасових і закінчуючи логічними, дуже допомагають запам’ятовуванню: не страшно, якщо учень, пригадуючи, намагається уявити собі відповідну сторінку книги.
Використання конспектів-схем навчального матеріалу з метою створення в учнів чіткого, наочного, легко баченого і сприйнятого уявлення про цей матеріал є необхідним. Найлегше цього досягти, якщо учень складає ці конспекти-схеми самостійно. У школярів, що засвоюють матеріал у такий спосіб, не тільки зменшується кількість помилок, але й більш активно розвиваються розумові здібності: гнучкість розуму, кмітливість та інші якості розумової діяльності.
У своїй роботі ми розглянемо, як впливають опорні конспекти-схеми на розвиток пізнавальних процесів школяра.
В експерименті брали участь 20 учнів. Школярам було запропоновано один із варіантів складання опорних конспектів-схем з теми „Залізо і його сполуки”.
1. Використати готовим (розроблений учителем);
2. Скласти, використовуючи допомогу вчителя;
3. Розробити конспект-схему самостійно.
При цьому їм повідомляли, що при виконанні наступних завдань з даної теми вони зможуть скористатися обраним варіантом опорних конспектів-схем.
Мета даного дослідження полягала у визначенні зв’язку між вибором варіанту опорних конспектів-схем і рівнем виконання завдань за цими конспектами-схемами.
|
Варіант складання конспекту-схеми |
Рівень виконання завдання |
|||||
|
високий |
середній |
низький |
||||
|
к |
% |
к |
% |
к |
% |
|
|
1. |
2. |
3. |
4. |
5. |
6. |
7. |
|
І (використання готового). |
- |
- |
2 |
33 |
4 |
67 |
|
ІІ (складання за допомогою вчителя |
1 |
9 |
6 |
54,5 |
4 |
36,5 |
|
ІІІ (самостійне складання) |
2 |
67 |
- |
33 |
- |
- |
Примітка: „К” – кількісний показник; % - відсотковий показник.
Із 20 учнів, що перевірялися, 6 учнів (30%) віддали перевагу використанню уже готових конспектів-схем, 11 учнів (55%) при складанні конспектів-схем використали допомогу вчителя, і тільки 3 учні (15%) самостійно виконали опорні конспекти-схеми. (Результати виконання учнями завдання за конспектами-схемами винесені в таблицю.
За результатами виконання завдання з використанням учнями опорних конспектів-схем нами було виділено три групи школярів.
Першу групу склали учні, які самостійно і правильно виконали запропоновані їм завдання. Вони продемонстрували високий рівень розвитку розумових операцій, осмислення й розуміння навчального матеріалу.Другу групу становлять школярі, які в процесі виконання завдань припустилися помилок або звертались за допомогою до експериментатора. Треба відзначити, що всіх учнів можна розділити на дві групи: одні учні зверталися за допомогою до вчителя з питань виконання самого завдання, інші просили пояснити елементи у складеному ними конспекті-схемі. Учні цієї групи не завжди осмислювали навчальний матеріал, вони часто не могли узагальнити і систематизувати свої знання.
І, зрештою, третю групу склали учні, які із завданням не впорались або виконали завдання неправильно.
А тепер проаналізуємо одержані результати, які занесені до таблиці.
Як можна бачити з таблиці, учні, що самостійно розробили опорні конспекти-схеми, продемонстрували високий і середній рівень виконання завдання. Учні, що скористалися готовими конспектами-схемами, показали низький і середній рівень.
Таким чином, можна зробити висновок про те, що самостійне складання учнями опорних конспектів-схем і вміння скористатися ними сприяє не тільки осмисленню й запам’ятовуванню навчального матеріалу, але й розвиває різні пізнавальні процеси у школярів.
1.3 Тренінгові методики у вивченні хімії за лекційно-семінарською системою
Закон України „Про освіту” висунув перед учительством задачу – сприяти формуванню в учнів фахового рівня, тобто навчальна діяльність у підсумку має не просто дати людині суму знань, умінь і навичок, а сформувати рівень її компетенції.
Поняття компетенції не зводиться ані до знань, ані до навичок, а належить до сфери вмінь. Власне, вміння – це компетенція в дії. Отож, під компетенцією розуміють загальну здатність, що базується на знаннях, досвіді, цінностях, схильностях, набутих завдяки навчанню.
Таким чином, на сучасному етапі перед учителями постає ряд проблем, що потребують розв’язання: інтенсифікація навчального процесу з дефіцитом навчального часу; активізація пізнавальної активності; забезпечення (злісності, універсальності та системності знань з хімії. Саме з такою метою розробляються та впроваджуються нові технології навчання. Проте, звична для нас класно-урочна система повністю не вичерпала себе. Якщо чітко розпланувати вивчення кожної теми, відмовитися від тотального використання комбінованих занять, розділити навчальний процес на певні етапи, що забезпечуватимуться типами уроків, можна досягти бажаного результату.
Хімію традиційно вважають „важким” предметом, що взагалі цілком обґрунтовано. Але значною мірою це твердження можна позбавити підґрунтя, якщо дещо змінити підхід до формування знань та їх контролю, особливо на першому етапі вивчення хімії. Якщо учнями міцно засвоєні хімічні поняття, вони вільно володіють спеціальними навичками, то подальші кроки у вивченні хімії не будуть викликати в них особливих труднощів. Досягти цього можна за допомогою спеціальних тренувальних вправ – так званого хімічного тренінгу.
Тренінг – це метод засвоєння, активізації, коригування знань, умінь і навичок.
Програма тренінгу:
активізація й закріплення знань програмного матеріалу;
формування спеціальних умінь і навичок;
одержання нової інформації;
оволодіння прийомами практичного застосування інформації у новій навчальній ситуації.
Цілі тренінгової роботи:
навчити дітей усвідомлено оперувати поняттями, які вони одержують на уроках, застосувати їх у стандартних і нестандартних ситуаціях.
Розвивати уяву, оригінальність, критичність, варіативність мислення, неординарність бачення проблеми, дослідницький оптимізм.
Виховувати вміння працювати самостійно та у складі групи, не зупинятися на досягнутому.
Основна ідея тренінгу сприяти усвідомленню сутності хімічних понять,
довести спеціальні навички до автоматизму завдяки спілкуванню, взаємодопомозі та взаємоперевірці, робочій обстановці.
Правила тренінгу
Учителю:
1. Матеріал, що обирається для тренінгу, має бути дійсно вартим для запам’ятовування та посильним для учнів.
2. Треба намагатися знайти оптимальний варіант форми й змісту завдань.
3. Інструкції учням щодо об’єму, терміну, оцінювання роботи мають бути чіткими.
4. Треба продумати, якого складу мають бути групи учнів для виконання певних завдань.
5. Групи мають працювати самостійно під керівництвом лідера.
6. Необхідно продумати принцип, за яким учні будуть здійснювати само- та взаємоконтроль.
7. Аналізувати помилки (з’ясовувати, чи вірно зроблена робота) краще одразу після її виконання. Оцінку в журнал бажано виставляти тим учням, які досягли високого або достатнього рівня.
Учням:
1. Уважно ознайомтеся зі змістом роботи, яку потрібно виконати.
2. Усвідомте цілі роботи.
3.Прослухайте уважно інструктаж щодо виконання й оформлення роботи.
4. Критично оцініть свої можливості та визначте, яку частину роботи ви візьмете на себе, якщо це групова робота.
5. Під час роботи уважно слухайте товаришів і лідера групи.
6. У разі виникнення труднощів не соромтеся звертатися по допомогу.
7. Намагайтеся працювати швидко, не заважайте іншим.
8. Проаналізуйте отримані результати, зробіть висновки, оцініть власну діяльність.
Базові методи тренінгу:
Індивідуальна робота;
Робота у складі малої групи (два-чотири учні);
Рольова гра;
Форми тренінгу:
Робота у малих групах.
Презентація.
Дискусія.
Самостійна робота.
Вивчення конкретної ситуації.
Дидактичні ігри – тренажери.
Тестування.
Розв’язування задач.
Різноманітні вправи.
Складання опорного конспекту.
Озвучування готової схеми або її фрагмента.
Диктанти.
Усні рахунки.
Міні-лекція.
Ділові ігри.
Позитивні якості тренінгу:
Усі учні залучаються до активної навчальної праці.
Відбувається сприяння закріпленню набутих раніше й виробленню нових умінь і навичок.
Реалізується навчальне спілкування.
З’являється можливість перевірити й оцінити рівень знань усього класу.
Відсутнє перевантаження домашніми завданнями.
Підвищується інтерес до вивчення хімії.
Тренінг не потребує тривалої попередньої підготовки.
Оптимальні варіанти застосування тренінгу:
1. Спеціальні уроки-тренінги.
2. Урок-практикум.
3. Урок-семінар (навчаюча, контролююча частини).
4. Повторювально-узагальнюючі лекції, семінари.
Вправи хімічного тренінгу потрібні не для підсумкового оцінювання знань учнів, а саме для засвоєння матеріалу, оволодіння нового предмета – тому слід мати на увазі, що учень повинен виконувати їх у гарному настрої. У кожному разі можна допустити, щоб він боявся вчителя, намагався уникнути його критичної оцінки. Учитель повинен бути консультантом, тренером-помічником. Тому дуже важливо, щоб оцінки за тренувально-контрольні роботи були „робочими”. Не слід негайно виставляти їх у журнал.
Крім того, вправи тренінгу дають змогу контролювати знання та вміння учнів на кожному уроці та кожному етапі вивчення теми.
Найбільш вдалими прикладами хімічного тренінгу вважаю такі: з теми „Залізо та його сполуки”.
1. Різноманітні завдання на закріплення вивченого матеріалу. Тексти завдань, віддрукованих різними кольорами, роздаються на кожну парту. Логіка кольорів, що використовуються:
Чорний – початковий, репродуктивний рівень;
Блакитний – середній рівень;
Зелений – достатній рівень;
Синій – високий рівень.
Кольорові позначення допомагають учневі контролювати ступінь свого руху, здійснювати самоконтроль, об’єктивно оцінювати свої можливості, надають впевненості у своїх силах. Такі завдання можуть застосовуватися для індивідуальної, парної, групової роботи, використовуватися для учнів одного, двох або більшої кількості варіантів. Учитель може звертатися до них після пояснення нового матеріалу або після певного етапу пояснення. Учні можуть контролювати ступінь свого розуміння матеріалу, роблячи позначки олівцем на тексті тренувальних завдань. Їх можна застосовувати у вигляді самостійної роботи під час перевірки домашнього завдання або усного опитування під час „розминки”.
1.3.1 Картки-завдання для організації самостійної роботи учнів при вивченні теми „Залізо та його сполуки”
Організація самостійної роботи учнів на уроці – важлива складова роботи вчителя. Самостійну роботу учнів можна організувати на різних етапах процесу навчання: під час підготовки учнів до сприйняття нового матеріалу, вивчення нового матеріалу, удосконалення знань і вмінь учнів під час повторення вивченого матеріалу.
Кожна самостійна робота, будучи елементом загальної системи, тісно й органічно пов’язана зі всіма іншими її елементами. Такий зв’язок створюється завдяки тому, що всі форми роботи учнів на уроках підпорядковується єдиним принципам. Головний з них – спрямованість завдань на формування й розвиток в учнів у процесі навчання основних понять хімії. Другий важливий принцип, якому відповідають усі завдання для самостійної роботи, - це підпорядкованість їх цілям розвитку предметних та загально навчальних умінь. Систему самостійних робіт характеризує ще й те, що під час їх проведення передбачається послідовне ускладнення завдань як за змістом, так і за сукупністю використовуваних прийомів розумової діяльності. Самостійні роботи різних видів поєднуються одна з одною.
Взаємозв’язок усіх видів самостійних робіт учнів у системі зумовлюється тим, що всі вони слугують головні меті – створенню системи знань. Виконання одних завдань готує учнів до розгляду того чи іншого питання програми, виконання інших є підґрунтям для його вивчення, робота за третіми завданнями застосовується для закріплення та набуття необхідних умінь.
Як правило, до самостійних робіт з учнями з підручником включають роботи різних видів: складання плану переказу матеріалу; відбір матеріалу для відповіді на певне запитання; смислове групування частин тексту; виокремлення головного й другорядного матеріалу; порівняння відомостей за вихідними питаннями, що містяться в різних параграфах; завдання з аналізу рисунків, таблиць, графіків тощо. Іноді робота учнів з підручником може передувати поясненням учителя. Всі ці роботи мають містити конкретний матеріал, що вивчається школярами, відповідати цілям і задачам уроку, сприяти поступовому й цілеспрямованому формуванню пізнавальних потреб, розвитку знань та вмінь учнів, вироблення в учнів психологічної націленості на самостійне поповнення знань.
Нами складено картки-завдання з різних видів самостійної роботи учнів. У цій статті ми пропонуємо увазі вчителів хімії картки-завдання, які можна використати для вдосконалення знань і вмінь учнів.
Картки-завдання з теми “Ферум та його сполуки”.
1. Користуючись текстом параграфа підручника, приготуйте усні відповіді на такі запитання:
Якою є будова атома заліза?
Якою є поширеність заліза в природі?
Як одержують залізо з його руд? Вкажіть види залізних руд.
Опишіть фізичні властивості заліза.
2. Напишіть рівняння реакцій, за допомогою яких можна здійснити такі перетворення:
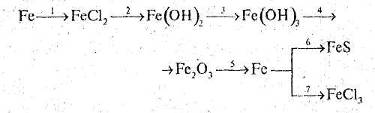
Які з цих реакцій та чому є окисно-відновними?
3. За схемами складіть рівняння реакцій практично здійснимих реакцій:
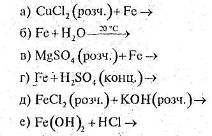
4. Розгляньте рис. 1 та дайте відповіді на запитання.
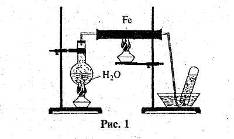
Яку хімічну реакцію проводять у приладі, зображеному на рисунку? Напишіть рівняння цієї реакції.
Які зміни відбудуться із залізом всередині залізної труби?
Яким газом заповнюється пробірка?
Укажіть що один-два метали, які аналогічно залізу можуть взаємодіяти з водою за подібних умов. Напишіть рівняння реакцій.
5. Складіть формули оксидів, гідроксидів і хлоридів Феруму, в яких виявляє
ступінь окиснення +2, +3. Чи можна перетворити ферум (ІІ) оксид на ферум (ІІІ) хлорид та навпаки?
6. Розв’яжіть задачу.
Суміш заліза та залізної окалини (Fe>3>O>4>) масою 32 г обробили надлишком хлоридної кислоти. При цьому виділилося 5,6 л водню. Обчисліть масову частку заліза та залізної окалини у вихідній суміші.
Перевірте роботи та обговоріть результати.
Додаткові завдання.
1. Які із заліза можна одержати ферум (ІІ) гідроксид та ферум (ІІІ) гідроксид? Напишіть рівняння відповідних реакцій.
2. Напишіть рівняння реакцій, що дозволяють здійснити такі перетворення:
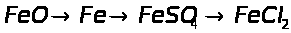
3. Маємо суміш ферум (ІІ) хлориду та алюміній (ІІІ) хлорид. Її розчинили у воді й до одержаного розчину додали надлишок розчину натрій гідроксиду, що з’явився, відфільтрували. Що міститься в осаді, а що – в розчині? Напишіть рівняння реакцій.
4. Ферум (ІІ) сульфат слід очистити від домішок купрум (ІІ) сульфату. Складіть план роботи та запишіть рівняння реакцій.
5. Яку масу заліза можна відновити за допомогою алюмінотермічного способу 1 кг ферум (ІІІ) оксиду, що містить 8% домішок?
6. Гра “хрестики-нолики”.
Визначте виграшні шляхи на схемах, якщо:
а) це хімічні сполуки, що входять до складу залізних руд;
б) це складні речовини, що належать до одного класу;
Схеми перекресліть у зошити.

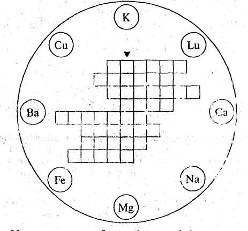
7. Розв’яжіть кросворд “Метали”.
У восьми колах зображені знаки хімічних елементів-металів. Розташуйте їх назви по горизонталі у клітинках таким чином, щоб у вертикальному стовпчику, виділеному жирними лініями, можна було прочитати назву найпоширенішого металу на Землі.
Схему кросворда перекресліть у зошит.
2. Уміння складати рівняння реакцій, базуючись на хімічних властивостях речовин, розставляти коефіцієнти, визначати тип і умови перебігу реакцій – важлива умова формування хімічних знань. Для набуття й доведення цієї навички до автоматизму використовують тренувальні вправи іншого типу.
Перед виконанням цих завдань учитель повинен дати учням чіткі інструкції щодо терміну виконання, критеріїв оцінювання та взагалі змісту завдання.
Завдання цього типу можна використовувати неодноразово зменшуючи час для їхнього виконання. Учням слід констатувати, що з часом вони виконуватимуть ці завдання швидше та правильніше.
1.3.2 Картки з хімії перетворень по темі “Залізо та його сполуки”
Рівень І.
1. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
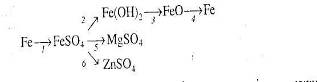
2. Напишіть рівняння трьох реакцій, у результаті яких можна одержати ферум (ІІІ) гідроксид. Вкажіть умови, які необхідні для пробігу цих реакцій.
3. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
Вкажіть умови, які необхідні для перебігу кожної реакції.
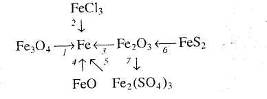
4. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІІ) сульфат, магній, калій гідроксид та вуглець, можна добути залізо кількома способами.
5. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення.
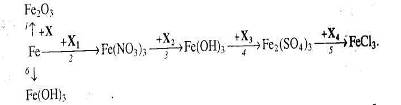
6.
Напишіть рівняння реакцій, за якими
можна з червоного залізняку добути: а)
Fe(OH)>3>;
б) Fe(OH)>2>NO>3> Вкажіть
назви цих речовин.
Вкажіть
назви цих речовин.
7.Напишіть рівняння реакцій, за якими можна здійснити такі перетворення.
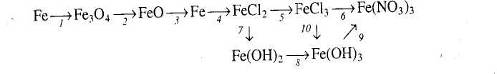
8. Напишіть рівняння реакцій, за якими, маючи лише залізо, воду, калій оксид і сульфатну кислоту, можна добути ферум (ІІІ) гідроксид кількома способами.
9. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
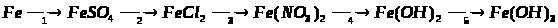
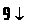
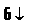

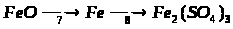
Вкажіть умови, які необхідні для перебігу кожної реакції.
10. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІІ) оксид, ферум (ІІ) оксид, ферум (ІІІ) сульфат, цинк та воду, можна добути: а) залізо; б) залізну окалину кількома способами.
11. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
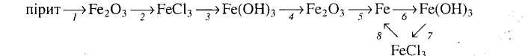
Вкажіть умови, які необхідні для перебігу кожної реакції.
12. Напишіть рівняння реакцій, за якими можна залізо перетворити у: а) ферум (ІІ) гідроксид; б) ферум (ІІІ) гідроксид.
13. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
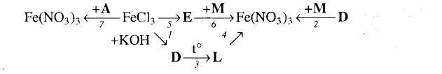
Врахуйте, що М – кислота, а Е – проста речовина, атоми якої входять до складу гемоглобіну крові.
14. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
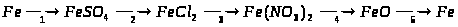
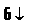
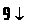

15. Напишіть шість рівнянь реакцій між наведеними речовинами та продуктами їх взаємодії: хлороводень, залізо, вода, калій гідроксид.
16. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
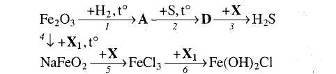
17. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІІ) нітрат, натрій карбонат та воду, можна добути три прості і чотири складні речовини. Вкажіть умови, які необхідні для перебігу кожної реакції.
18. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
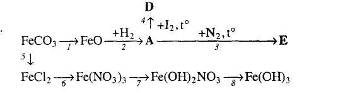
19. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІ) оксид, воду та вуглець, можна добути: а) ферум (ІІІ) оксид; б) оксид, який належить до змішаних оксидів.
20. Напишіть рівняння реакцій, за якими, маючи лише залізо, натрій карбонат, вуглець та хлоридну кислоту, можна добути ферум (ІІ) оксид трьома способами.

21. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
22. Напишіть рівняння реакцій, за якими, маючи лише залізну окалину, алюміній оксид, вуглець та воду, можна добути кількома способами металічне залізо.
23. Визначте невідому речовину і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
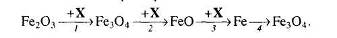
24. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІІ) гідроксид, воду та хлор, можна добути ферум (ІІІ) хлорид кількома способами.
25. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
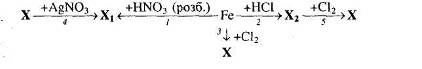
Рівень 2
1. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
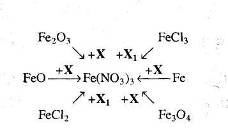
2. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІ) сульфат, калій перманганат і сульфатну кислоту, можна добути ферум (ІІІ) сульфат трьома способами. Вкажіть умови, які необхідні для перебігу кожної реакції. Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
3. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
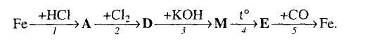
4. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІІ) хлорид, хлоридну кислоту та калій йодид, можна добути ферум (ІІ) хлорид трьома способами.
5. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
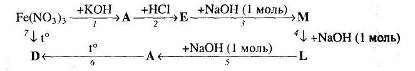
Вкажіть умови, необхідні для перебігу кожної реакції.
6. Напишіть рівняння реакцій, за якими, маючи лише залізо, сульфатну кислоту, воду та натрій оксид, можна добути: а) три гідроксиди; б) сім солей. Вкажіть умови, необхідні для перебігу реакцій.
7. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
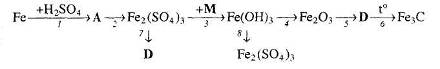
8. Напишіть рівняння реакцій, за якими із сидериту можна добути ферум (ІІІ) гексаціаноферат (ІІ). Вкажіть умови, необхідні для перебігу реакцій.
9. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
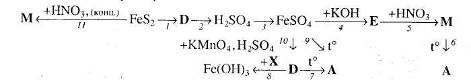
Перетворення 1 та 2 здійснюють у кілька стадій. Речовина D – сіль, а речовина А – оксид. Вкажіть умови, необхідні для перебігу реакцій.
10. Напишіть рівняння реакцій, за якими можна здійснити такі перетворення:

11. Напишіть рівняння реакцій, за якими з гематиту можна добути залізний купорос. Вкажіть умови, необхідні для перебігу цих реакцій.
12. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
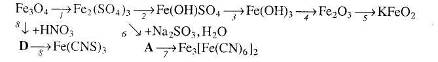
13. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
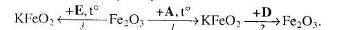
Відомо, що речовина Е утворюється при взаємодії речовини А з вуглекислим газом.
14. Напишіть рівняння реакцій, за якими можна із залізного колчедану добути ферум (ІІІ) гексаціаноферат (ІІ). Вкажіть умови, необхідні для перебігу цих реакцій.
15. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
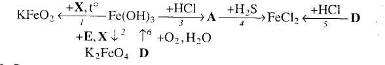
16. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
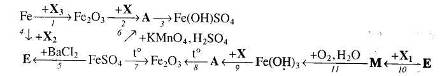
17. Напишіть рівняння реакцій, за якими з магнетиту можна добути ферум (ІІІ) хлорид. Вкажіть умови, необхідні для перебігу цих реакцій.
18. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
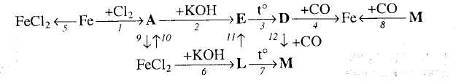
19. Напишіть рівняння реакцій, за якими маючи лише залізо, сірководень, нітратну кислоту та натрій гідроксид, можна добути ферум (ІІІ) оксид трьома способами.
20. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
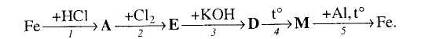
21. Напишіть рівняння реакцій, за якими маючи лише ферум (ІІ) гідроксид, гідроген пероксид, калій та натрій бромід, можна добути калій ферат (VI) K>2>FeO>4>. Вкажіть умови, необхідні для перебігу кожної реакції.
22. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
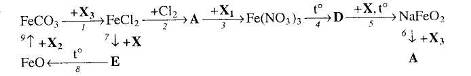
23. Напишіть рівняння реакцій, за якими маючи лише розбавлену сульфатну кислоту, хлор, натрій та воду, можна добути ферум (ІІІ) оксид кількома способами.
24. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
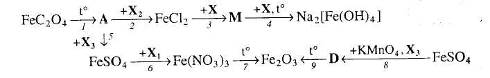
Напишіть структурну формулу речовини FeC>2>O>4> і вкажіть її назву.
25. Напишіть рівняння реакцій, за якими маючи лише ферум (ІІ) хлорид, гідроген пероксид, натрій та воду, можна добути ферум (ІІІ) гідроксид кількома способами.
26. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
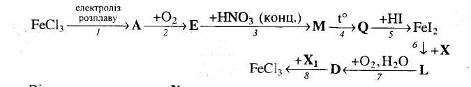
Відомо, що речовину Х можна одержати при взаємодії калій гідриду з водою, а речовина Е – це змішаний оксид.
27. Напишіть рівняння реакцій, за якими маючи лише ферум (ІІ) оксалат і кокс, можна добути ферум пентакарбоніл. Вкажіть умови, необхідні для перебігу реакцій.
28. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
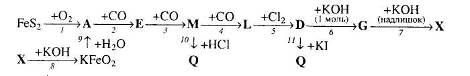
Вкажіть тип кожної реакції. Для рівнянь реакцій, що описують перетворення 1 та 11, складіть схеми електронного балансу.
29. Напишіть рівняння реакцій, за якими можна з ферум (ІІ) оксиду добути сполуку складу K>2>FeO>4> Вкажіть назву цієї сполуки і ступінь окиснення в ній Феруму.
30. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
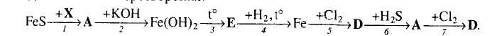
31. Напишіть рівняння реакцій, за якими можна з ферум (ІІ) сульфату добути калій гексагідроксоферат (ІІІ). Вкажіть умови, необхідні для перебігу цих реакцій.
32. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
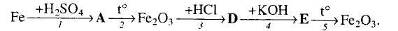
Вкажіть тип кожної реакції.
33. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІ) ціанід, гідроген ціанід і калій гідроксид, можна добути калій гексаціаноферат (ІІ).
Рівень 3
1. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
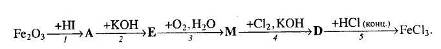
Вкажіть тип кожної хімічної реакції. Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
2. Визначте невідомі речовини, якщо відомо, що вони вступають у реакції, які описуються такими схемами:
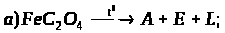
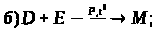
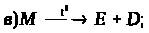
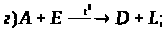
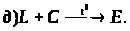
За наведеними схемами складіть рівняння реакцій.
3. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
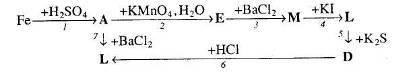
Вкажіть умови, необхідні для перебігу реакцій. Позначте окисно-відновні реакції.
4. Напишіть рівняння реакцій, за якими, маючи лише залізо, воду, калій хлорид та повітря, можна добути: а) два метали; б) п’ять газоподібних речовин; в) три кислоти; г) п’ять основних солей. Вкажіть умови, які необхідні для перебігу кожної реакції.
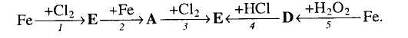
5. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
Для рівняння реакцій, що описує перетворення 5, складіть схему електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисник та відновник.
6. Визначте невідомі речовини, якщо відомо, що вони вступають у реакції, які описуються такими схемами:
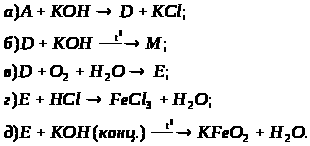
За наведеними схемами складіть рівняння реакцій. Вкажіть тип кожної реакції і назву речовини М.
7. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
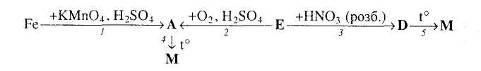
Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
8. Напишіть рівняння реакцій, за якими можна із залізного купоросу добути ферумамонійний галун. Вкажіть умови, які необхідні для перебігу цих реакцій.
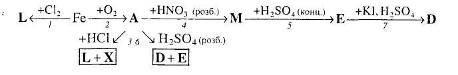
9. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
Відомо, що всі невідомі речовини, крім А, є солями. Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть її тип, процеси окиснення та відновлення, позначте окисники та відновники.
10. Визначте невідомі речовини, якщо відомо, що вони вступають у реакції, які описуються такими схемами:
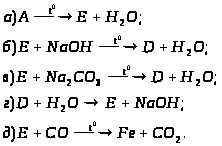
11. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
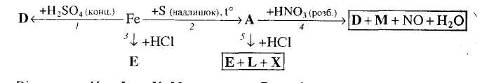
Відомо,
що Н>2>
+ L Х,
М – кислота, D – сіль.
Х,
М – кислота, D – сіль.
12. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
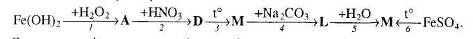
Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
13. Визначте невідомі речовини, якщо відомо, що вони вступають у реакції, які описуються такими схемами.
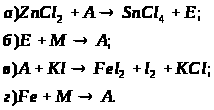
За наведеними схемами складіть рівняння реакцій.
14. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
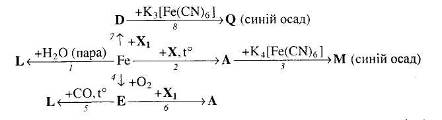
Врахуйте, що Х і Х>1> – це розчини однієї речовини, які значно відрізняються за масовою часткою розчиненої речовини.
15. Визначте невідомі речовини, якщо відомо, що вони вступають у реакції, які описуються такими схемами.
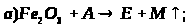
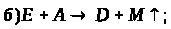
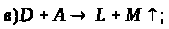
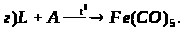
За наведеними схемами складіть рівняння реакцій.
16. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
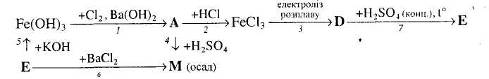
Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
17. Визначте невідомі речовини, якщо відомо, що вони вступають у реакції, які описуються такими схемами.
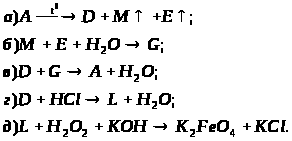
Відомо, що сполуки М та G містять нітроген. За наведеними схемами складіть рівняння реакцій. Для реакції, що описується схемою д), складіть схему електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
18. Напишіть рівняння реакцій, за якими, маючи лише ферум (ІІІ) хлорид, воду та сірку, можна добути: а) п’ять газоподібних речовин; б) чотири кислоти; в) п’ять оксидів; г) вісім солей.
19. Вкажіть ступені феруму в кожній сполуці, яка бере участь у перетвореннях, що відбуваються за такою схемою:
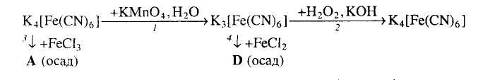
Вкажіть хімічні формули речовин А та D і два варіанти їхніх назв. Запропонуйте по дві назви для речовин А і D. Для окисно-відновних реакцій складіть схеми електронного балансу. Обґрунтуйте, чому калій гексаціаноферат (ІІ) проявляє відновні властивості.
20. Напишіть рівняння п’ятнадцяти реакцій за участю ферум (ІІ) оксиду, нітратної кислоти, води, сірки та продуктів їх взаємодії.
21. Визначте невідомі речовини і напишіть рівняння реакцій, за якими можна здійснити такі перетворення:
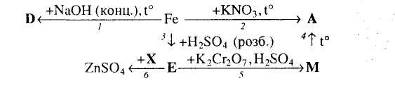
Для окисно-відновних реакцій складіть схеми електронного балансу, вкажіть процеси окиснення та відновлення, позначте окисники та відновники.
Розв’язування задач:

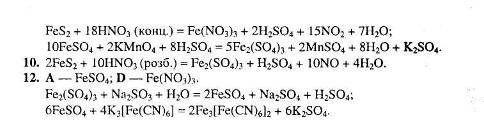
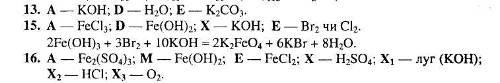
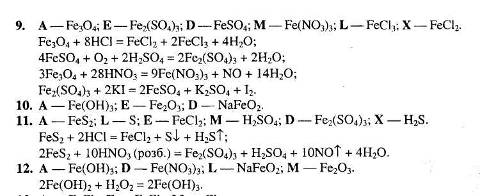
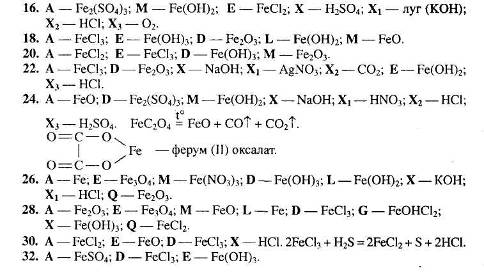
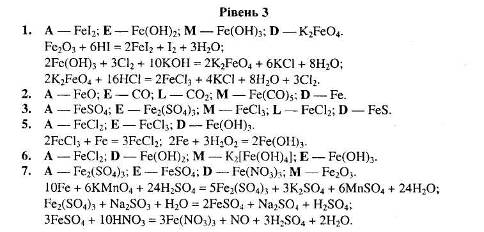
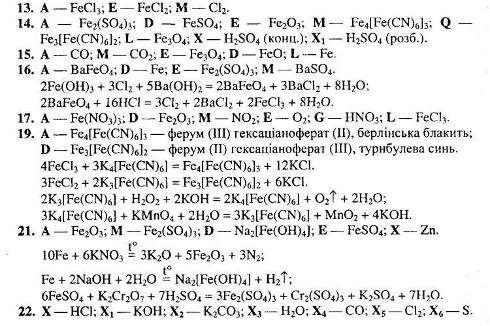
3. Навчити учнів розв’язувати задачі – важливий обов’язок учителя. Хімічний тренінг допоможе в цьому.
Цю роботу цікаво проводити у вигляді „хімічної регати”. Учням надається певний час для розв’язання всіх задач. Для цього кожному з них даються тексти задач і маленькі аркуші паперу за кількістю задач. На кожному папірці учні записують своє прізвище, номер задачі та розв’язання (без умови). Коли задачу розв’язано, учень кладе папір на край парти, учитель його одразу забирає. По закінченні роботи учні швидко здають аркуші, що залишились. Тепер діти звіряють свої відповіді з правильними, з’ясовують скільки задач вдалося розв’язати правильно, скільки балів зароблено та яку оцінку можливо отримати. Учитель під час перевірки розкладає роботи за прізвищами, перевіряє, підсумовує бали та оцінює роботу.
Важливе значення має те яким чином вчитель підбиває підсумки роботи. Вважаємо педагогічно невірним, якщо учитель одним – двома словами підсумує результати роботи й роздасть аркуші з оцінками. Підбиття підсумків і аналіз – важливий завершальний етап у проведенні будь-якої самостійної роботи. Практика свідчить, що учні серйозніше ставляться до написання робіт, з хвилюванням чекають на результати, якщо вчитель ретельно їх аналізує, радіють добрим результатам, успіху окремих учнів, засмучуються за товаришів, які невдало виконали роботу. Дозволяю сої порадити такий план аналізу роботи, яку виконували учні.
Нагадати, з якою метою виконувалася робота.
Які знання й уміння могли продемонструвати або вдосконалити учні.
Загальне враження від результатів виконаної роботи.
Типові помилки й недоліки.
Роздати роботи учням з коротким аналізом кожної і порадити.
Учитель не втратить серйозності якщо скаже учням: „Я дуже за вас радію”,
„Дуже добра робота”, „Ви молодець”, „Відмінний результат...”
Роботи перед видачею краще розкласти за збільшенням кількості отриманих балів, тобто останніми – найкращі роботи. Про це одразу треба сказати учням. Учні, які невдало виконали роботу, не будуть вважати себе останніми в класі, і кожен із завмиранням серця буде чекати на своє прізвище, а результати набудуть таким чином, рейтингового характеру. Особливо треба похвалити, підкреслити позитивне в останніх двох-трьох роботах. Ці оцінки робочі. До журналу можна поставити кращі оцінки. Одночасно треба намітити план коригування.
Повторення на уроках.
Індивідуальні завдання.
Організація роботи учнів-консультантів.
1.4 Психолого-педагогічні викладання хімії у спеціалізованих класах
Зміст сучасних навчально-виховних відносин потребує максимальної активізації кожного учня.
Раз у раз підвищується суспільне значення таких якостей особистості як творча активність, трудова активність, готовність до життєдіяльності в умовах нових економічних відносин. Ці якості в найбільшій мірі виховуються на уроках природничого циклу в результаті саморегуляції навчальних дій і поведінки учнів. Без цього неможливий вияв власного “Я”. В сучасній школі часто не враховується той факт, що людина за природою є саморегульованою системою, здатною до самокеруванням своїм навчанням, вихованням, розвитком, поведінкою.
В результаті цієї властивості людина, де б, у кого б і чому б не навчалася, вчиться сама.
Як суб’єкт власної діяльності, вона активно і самостійно визначає мету, обирає шляхи, способи і засоби її реалізації, самореалізовує, регулює і контролює виконання.
Формування саморегуляції діяльності повинно йти шляхом навчання школяра самостійно думати, зв’язно і логічно говорити, вирішувати проблеми, знаходити причини, робити висновки. Саме на цьому закладається фундамент уміння вчителя. Виховання саморегуляції навчальної діяльності розширює внутрішню свободу учня, сприяє формуванню способів навчання і самоорганізації учнів.
Для підвищення стійкості до стресу і розширення психологічних резервів учня щодо саморегуляції нами розроблена спеціальна методика, за допомогою якої зможуть самостійно впливати на свій емоційний, душевний, фізичний стан.
Це один із видів психотехніки (аутогенного тренування).
Його можна проводити ввечері-самостійно. На початку уроку – колективно, разом з учителем. Заняття проводиться 2-3 хвилини на день, 1 раз на кожному уроці.
Формулювання психотренінгу
“Тобі потрібні знання. Іноді вони здаються нудними, іноді навіть стає страшно: як у всьому розібратися! Не лякайся, не хвилюйся й не квапся. Навкруги тебе багато різних книг, вони тобі допоможуть вчитися. Коли нові знання “вляжуться” в твоїй голові, ти станеш сильнішим.
Знання дадуть тобі не лише силу, вони змінять свт навколо тебе. Усе стане яскравим, блискучим, цікавим”.
За допомогою аутогенного тренування учень може навчитися значною мірою розвивати і зміцнювати силу волі, керувати своїми почуттями, настроєм.
Сучасний урок – це процес спільної роботи вчителя і учнів задля досягнення спільної мети.
Успішність цієї роботи залежить від умов, що будуть створені, від особливого мікроклімату на уроці, від особистісних якостей педагога. Колись мені зустрівся вислів відомого індійського філософа і педагога: “Людину не можна навчити, людину можна тільки навчити вчитися”. Скільки існує педагогів, я маю на увазі видатних, і стільки ж і методів – як навчати.
Ну звичайно є один загальний прийом – від простого до складного. Коли “важне стає звичним, звичне стає легким, а легке стає красивим – і тоді перестаєш думати про деталі”. Це і буде творчість.
Але найголовніше, мені здається, це установка, психологічна установка, з якою дитина приходить на навчання:
“ Я зможу навчитися, бо я не боюся складнощів, те що можуть інші, зможу і я. І навіть краще – бо я розумний”.
Мабуть це і є найголовніше завдання педагога – дати не тільки знання, але й віру у власні сили і бажання вчитися і тоді девіз. “Можу, бо хочу!” допоможе здолати все.
На протязі уроку потрібно також підтримувати позитивне мислення учнів.
Початок уроку має створити відповідний настрій на навчальну діяльність.
Можна почати напівжартівливо, знайомлячи учнів із планом уроку: “Спочатку ми помилуємося вашими глибокими знаннями під час опитування, потім потренуємо мозок – порозв’язуємо задачі, нарешті витягнемо зі схованки дещо цінне (повторення)…”
Добрий настрій на роботу дає відповідна музична пауза.
Пам’ятайте, якщо діти регулярно подають домашнє завдання на перевірку, то ця процедура відпрацьовується і закріплується надовго.
Запропонуйте учням на початку й у кінці уроку сигналізувати про свій емоційний стан за допомогою спеціальних піктограм:

Якщо “посмішок” у кінці уроку стало більше – урок вийшов!
Отже, понад 2400 років тому Конфуцій наголошував:
Те, що я чую, я забуваю.
Те, що я бачу, я пам’ятаю.
Те, що я роблю, я розумію.
Ці, прості твердження обгрунтовують необхідність використання активних методів навчання. Дещо змінивши слово видатного китайського філософа можна сформулювати кредо лекційно-семінарського навчання.
Те, що я чую, я забуваю.
Те, що я, бачу й чую,
я трохи пам’ятаю.
Те, що я чую, бачу й обговорюю,
я починаю розуміти.
Коли я чую, бачу, обговорюю
й роблю, я набуваю знань і навичок.
Коли я передаю знання іншим,
я стаю майстром.
ІІ. Дидактичні основи навчання хімії у спеціалізованих класах. Розробка уроків-модулів з теми “Залізо та його сполуки”
2.1 Комплексна дидактична мета
1.На прикладі Феруму конкретизувати знання учнів про особливості будови атомів металів побічних підгруп.
2.Удосконалити вміння прогнозувати властивості елементів і сполук на основі положення в Періодичній системі, будови атома і типу зв’язку.
3.Вивчити фізичні та хімічні властивості заліза.
4.Вивчити фізичні та хімічні властивості оксидів, гідроксидів і солей Феруму (ІІ) і (ІІІ).
5.Удосконалити вміння розв’язувати розрахункові, розрахунково-експериментальні та експериментальні задачі.
6.Удосконалити вміння встановлювати причинно-наслідкові зв’язки між будовою, властивостями, застосуванням простих і складних речовин.
7.Здійснити дедуктивні умовиводи про склад, будову та властивості речовин, робити висновки та узагальнення.
Аналіз методичної літератури з неорганічної хімії показує, що тема „Залізо та його сполуки" гарно висвітлена як у 9 так і в 11 класі при повторенні теми „Метали".
Шкільні підручники [1, 23, 30, 28, 6, 8, 3, 16] науково і змістовноподають матеріал, мають малюнки і коротенькі схеми-описи Але зміст підручників орієнтується на учня з середніми, навіть низькими здібностями. А в класи з поглибленим вивченням хімії йдуть діти, що свідомо прагнуть більшого. їх не влаштовує звичайна програма, їм тісно в рамках 45 хв. уроку.
Взагалі тема „Залізо та його сполуки" викладається у 9 класі. Згідно програм (25, 26) на неї відводиться 2 годин.
Аналізувавши досвід роботи в 9 класі в спеціалізованій школі №5 та НВК (школі-ліцей) № 28 ми пропонуємо нову методику, розроблену нами.
Пропонована методика викладання даної теми ґрунтується на поєднанні модульного навчання з лекційно семінарською системою навчання, сприяє розвитку самостійності, логічного мислення, глибині засвоєння знань. Методика розрахована на те, щоб учні мали можливість повністю засвоїти стандарт і перейти на більш високий рівень навчання, досягати поставленої мети, планувати навчальний матеріал, організовувати навчальну діяльність, організовувати та контролювати свою роботу на уроці. Ця методика допомагає організувати самостійну роботу всього класу і кожного учня зокрема з урахуванням його здібностей і знань. З-поміж запропонованих завдань є і посильні, важкі для учнів, що викликає пізнавальний інтерес, бажання самостійно знайти істину.
Переваги модульної системи полягають ще й у тому, що вона дає можливість вчителеві та учню багато зробити на уроці, більше часу залишається на закріплення матеріалу, на розвиток логічного мислення учнів, зменшує обсяг домашніх завдань.
Основна одиниця навчального матеріалу при цій системі навчання - логічно завершений розділ програми, розрахований приблизно на І -2 години навчального часу, який поділяється на кілька етапів:
перший етап - мотивація навчальної діяльності та підготовка досприйняття нового матеріалу;
другий етап - одержання учнями нових знань та їх засвоєння;
третій етап - систематизація й узагальнення одержаних знань;
четвертий етап - контроль знань (завершення).
Послідовна реалізація етапів вивчення навчальної теми здійснюється за схемою:
І етап |
Вступне заняття |
1-й урок або частина першого уроку. |
|
ІІ етап |
Уроки - лекції |
2-4 уроки |
|
Практичні заняття для засвоєння знань |
3-5 години |
|
|
ІІІ етап |
Підсумкові уроки-семінари |
1-2 уроки |
|
IV етап |
Контрольно-залікові заняття |
1 урок |
І. Вступне заняття передбачає підготовку учнів до сприйняття нового матеріалу за рахунок повторення навчального матеріалу вивчених тем з предмету або тем інших навчальних предметів, які є базовими для засвоєння розділу, завдяки чому реалізуються принцип інтеграції навчальних предметів і між предметні зв'язки, що забезпечує цілісність шкільної освіти.
Наявність такого вступного заняття з теми є важливим елементом структури навчального процесу, за допомогою якого в учнів формується потрібна мотивація вчення. Таке заняття допомагає учням усвідомити себе як суб'єкт навчальної діяльності й тому свідомо вивчити навчальний матеріал
1-й модуль:
Звістово-інформаційний
За формою роботи передбачається лекція, але в чистому вигляді лекція не відбувається, адже учні вже добре знають, яким шляхом визначити властивості елементів за будовою їхніх атомів, самостійно складають електронну конфігурацію атомів, визначають ступені їх окиснення, складають формули основних сполук заліза. Учні самостійно працюють над вивченням властивостей заліза, тим паче, що вони певною мірою схожі з уже вивченими властивостями інших металів.
У ході уроку поступово складається опорний конспект.
2-4 Модуль:
Адаптивно-перетворюючий та коригувально-смисловий
Він відводиться на виконання практичної роботи, в процесі якої учні ще раз повторюють і закріплюють матеріал попереднього уроку, і на розв'язування задач однієї з форм попереднього контролю. На цьому уроці вже можна оцінити засвоєння учнями матеріалу першого модуля.
5 Модуль:
Змістово-інформаційний
У ньому розглядаються оксигеновмісні сполуки заліза. Форма проведення, як і першого модуля, - евристична бесіда, де більша частина матеріалу вивчається учнями самостійно. Знову демонструється кіно фрагмент і проводиться демонстраційний експеримент. Так вивчається та частина, де розглядаються спільні з іншими металами властивості заліза.
Створення проблемних ситуацій дозволяє підвести учнів до висновку сполук заліза. Вивчення матеріалу про компонентні сполуки можна винести на самостійне опрацювання за підручником або заслухати у вигляді учнівських доповідей, підготовлених заздалегідь. Завдання підготувати таку інформацію треба давати лише за власним бажанням учнів. Додому діти отримують невелике завдання: попрацювати з опорним конспектом, доповнити його своїми прикладами та висновками.
6-7Модуль:
Змістовно-пошуковий, адаптивно-перетворюючий та коригувально-смисловий
Передбачається у формі семінару-практикуму, на якому проводиться робота з опорним конспектом, відбувається поглиблення знань з теми, розв'язування задач. Тут же може проходити і попереднє оцінювання знань, наприклад, за вміння розв'язувати задачі, робити висновки за опорним конспектом, за наведення цікавої інформації чи іншу форму роботи. Все це проводиться у формі групової роботи.
8 Модуль:
Системно-узагальнюючий та контрольно-репродуктивний
Проводиться як семінар-контроль знань, іншими словами, - усна тематична атестація. План проведення такого семінару складається наперед, тому учні мають можливість вибрати питання, найбільш близькі їм за ступенем засвоєння; мають змогу повністю проявити свою творчість - діти готуються до цього уроку з бажанням проявити себе якимось чином, складають вірші, міні-оповідання, кросворди, казки, готують питання для брейн-рингів тощо. Уроки такого типу, як правило, проходять в атмосфері загального піднесення, кожен хоче висловити власну думку, тому вчителю проводити такі уроки дуже важко. Щоб встигнути зробити все заплановане, потрібна попередня серйозна підготовка. На цьому занятті оцінюються знання кожного учня не лише керівником-консультантом груп, але й учителем, який дає повну обгрунтовану мотивацію цієї оцінки.
9 Модуль:
Контрольно-репродуктивний
Може плануватися з орієнтацією на кількість навчального часу, необхідність підтвердження оцінки чи за планом вчителя. Ця контрольна робота або письмове тематичне оцінювання за різнорівневими диференційованими індивідуальними завданнями, тому в класі однакових завдань не буває, знання оцінюються повно та об'єктивно.
У процесі вивчення хімії блоки навчального матеріалу в більшості випадків збігаються з назвою теми, як, наприклад, пропонується в новому підручнику неорганічної хімії.
На початку вивчення кожного блоку навчального матеріалу учням дається змодульований за уроками план його вивчення, позначаються уроки практичних робіт, уроки попереднього контролю, терміни проведення самостійних робіт і тематичних атестацій. Користуючись таким планом, учні самостійно можуть визначити тему та мету уроку, відповідно підготуватися, щоб одержати кращу оцінку.
Для кожного модулю складені пакети пізнавальної діяльності, де розподілені завдання на кожний урок, наведені опорні конспекти, визначені різнорівневі індивідуальні завдання для самостійної роботи з підручником та дидактичним матеріалом на уроках. З такими пакетами учні можуть працювати після уроків додатково.
2.2 Ферум. Будова атома Феруму. Фізичні властивості заліза
Варіант І.
Мета: ознайомитись з положенням Феруму в Періодичній системі хімічних елементів і будовою його атома.
Прочитайте фрагмент підручника [1] (п.51, с.142).
Розкажіть про місце Феруму в Періодичній системі хімічних елементів і зобразіть будову його атома. Напишіть електронну формулу атома Феруму.
Опрацюйте фрагмент підручника [2] (п.37, с.138) – до пункту „Поширення в природі”.
У чому особливість будови атомів металів побічних підгруп? Заповніть запропоновану таблицю і зробіть висновок про будову атомів елементів побічних підгруп.
|
№ з/п |
Заряд ядра |
Розподіл електронів по енергетичних рівнях |
Електронна формула |
|
1 |
+12 |
||
|
2 |
+24 |
||
|
3 |
+21 |
||
|
4 |
+26 |
||
|
5 |
+11 |
||
|
6 |
+19 |
Запам’ятайте!
Метали побічних груп мають особливість у будові атомів: валентні електрони в атомі розташовуються не лише на зовнішньому, але й на передостанньому енергетичному рівні.
У металів побічних підгруп в утворенні зв’язків бере участь різна кількість валентних електронів.
Особливість будови атомів металів побічних підгруп має впливати на властивості елементів та їх сполук.
Зверніть увагу!
Ці висновки потрібні для вивчення Феруму та його сполук.
Мета: пригадати всі види хімічних зв’язків і типи кристалічних ґраток.
Визначте, яка з цих кристалічних ґраток є металічною.



































































Опрацюйте фрагмент „Фізичні властивості” у підручнику [1] (с. 143) й у підручнику [2] (с. 140), а також „Фізіологічну дію” у підручнику [2] (с. 139).
Які спільні фізичні властивості характерні для металів?
Опишіть Ферум за планом:
а)положення в Періодичній таблиці;
б)будова атома;
в)окисно-відновна здатність (схематично);
г)ступені окислення (передбачте);
д)сполуки (запропонуйте).
Перевірте один одного, виставте оцінки.
Варіант ІІ.
Тема: Ферум – представник елементів побічної підгрупи. Фізичні та хімічні властивості Феруму.
Мета уроку: повторити матеріал про особливості електронної будови атомів елементів побічних підгруп, на прикладі Феруму розширити знання про фізичні та хімічні властивості металів.
Тип уроку: комбінований.
Обладнання: Періодична система Д.І.Менделєєва, ряд напруг.
Хід уроку
І. Організаційний момент
Оголошення теми і мети уроку, постановка задач уроку.
ІІ. Перевірка домашнього завдання
Питання 8.
Задача 3.
Самостійна робота (виконується через копіювальний папір). Запишіть рівняння реакцій, за допомогою яких можна здійснити перетворення. Там, де необхідно, запишіть скорочені йонні рівняння реакцій. В реакції № 1 підберіть коефіцієнти методом електронного балансу (один з аркушів здається на перевірку).
Після закінчення роботи (7 хвилин) учні здають аркуші; звіряють результати самостійної і домашньої роботи з виконаним на дошці.
ІІІ. Вивчення нового матеріалу
В чому полягає особливість будови атома Феруму?
Які ступені окислення можливі для Феруму, виходячи з того, що це – метал?
Складаємо опорну схему-конспект.
Фізичні властивості:
сріблясто-білий метал, важкий, має магнітні власти-
вості.
Хімічні властивості:

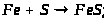
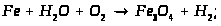
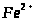
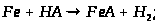
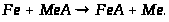
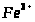
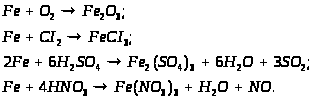
В природі:
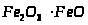 - магнетит;
- магнетит;
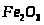 - гематит;
- гематит;
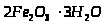 - лимоніт, бурий
залізняк;
- лимоніт, бурий
залізняк;
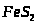 - пірит.
- пірит.
Одержання
Чистого заліза:
відновлення оксидів воднем, алюмінієм, електроліз водних розчинів солей.
Чавуну, сталі:
відновлення оксидів коксом або чадним газом.
IV. Домашнє завдання
В.Ф.Фельдман, Г.С.Рудзитис „Химия, 9”, п.51, 52 стор.143, пит.4 письмово.
2.3 Ферум в природі. Одержання заліза в лабораторії та промисловості.
Мета: засвоїти знання про знаходження заліза у природі, способи його одержання: закріпити вміння складати окисно-відновні реакції?
1. Опрацюйте фрагмент підручника [1] (п.52, с.142, 143) та підручником [2] (с.139). Користуючись мініпідручником, запишіть основні природні сполуки Феруму в зошиті.
Запам’ятайте їх!
1. Які сполуки Феруму найбільш поширені у природі?
2. Опрацюйте фрагмент мініпідручника та підручника [1] (с.143, п. ”Одержання”).
Запишіть рівняння реакцій:
а) відновлення оксидів воднем, визначте окисник та відновник:
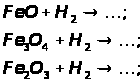
б) відновлення Феруму з його оксидів метало термічним способом:
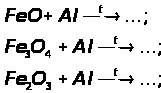
в) рівняння розкладу ферум пентакарбонілу;
г) відновлення Феруму за допомогою карбон (ІІ) оксиду:
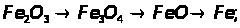
д) електроліз водного розчину ферум (ІІІ) сульфату та ферум (ІІ) хлориду.
Розв’яжіть задачі:
Варіант 1. В якій масі магнітного залізняку, що містить 0,22 масової частки домішок, міститься 5 т Феруму?
Варіант 2. Зразок сидериту містить 42% Феруму. Обчисліть масову частку ферум (ІІ) карбонату у зразку.
Перевірте всі самостійно виконані вправи. Взаємо оцініть один одного.
2.4. Хімічні властивості заліза.
Мета: на основі знань про загальні властивості металів вивчити властивості заліза: його взаємодію з простими і складними речовинами, закріпити вміння складати окисно-відновні реакції та реакції йонного обміну.
1. Опрацюйте фрагмент підручника [1] (п.52, с.143) “Хімічні властивості” та фрагмент підручника [2] (с.140-141).
Необхідну вам інформацію запишіть у зошити.
Напишіть рівняння реакцій, що відбуваються на поверхні залізного виробу у вологому повітрі.
Розкрийте суть корозії заліза. У разі потреби зверніться до п.26 (підручник [2], с.106-108).
Залізо – метал якої активності? П.37, с.14, абзац 6. Необхідну інформацію запишіть.
Домашнє завдання: підручник [2], п.28, задача 186; п.29, задача 193, п.22,30-32
Мета: відтворити одержані знання про хімічні властивості заліза.
2. Запишіть відношення заліза до:
а) простих речовин;

 металів
металів

 неметалів
неметалів
б) складних речовин:
в



 оди
оди
кислот
солей
Для кожної реакції покажіть перехід електронів і зазначте окисник і відновник.
3. Зверніть особливу увагу на взаємодію заліза з розбавленими і концентрованими сульфатною та нітратною кислотами, при нагріванні і без нагрівання.
4. Розв’яжіть задачу:
Варіант І. Підручник [2], с.142, № 230.
Варіант ІІ. Підручник [2], с.142, № 231.
Взаємо перевірте розв’язані задачі.
Мета: розв’язати задачі, в яких залізо-відновник частково відновлює інші метали.
5. Розв’яжіть задачу: залізну пластину масою 71,2 г опустили в розчин купруму (ІІ) сульфату. Якою буде маса Феруму, що не перейшов у розчин, коли маса пластинки стала дорівнювати 66 г?
6. Самостійна робота.
Варіант І. Залізо з вуглецем утворює карбід, в якому масова частка Феруму становить 93,3%. Визначте найпростішу формулу карбіду.
Варіант ІІ. Чавун містить Карбон у вигляді сполуки з Ферумом Fe>3>C (карбід). Масова частка Карбону в чавуні становить 3,6%. Обчисліть масову частку карбіду в чавуні.
Взаємо перевірте задачу, виставте оцінки.
Домашнє завдання: [1], п.53, вправа 5; підручник [2], п.37, задача 232, вправа 229.
2.5 Сполуки Феруму: оксиди, гідроксиди, солі. Якісні реакції на Fe2+ та Fe3+
Варіант І.
Мета: вивчити властивості заліза, сполуки Форуму, оксиди, гідроксиди, солі, їх характер та якісні реакції на Fe2+ та Fe3+.
1. Опрацюйте фрагменти підручників [1], (с.144, п.п. 1-4) та [2], (с. 142-143). Запишіть всі рівняння реакцій, які характеризують властивості сполук Феруму та способи їх одержання.
2. Звірте свої записи з інформацією міні-підручника „Будова та властивості ферум (ІІ) оксиду та ферум (ІІІ) оксиду”. Необхідну інформацію занотуйте в зошиті.
Мета: вивчити властивості ферум (ІІ) гідроксиду та ферум (ІІІ) гідроксиду.
3. Для досягнення поставленої мети виконайте лабораторну роботу, інструкція до якої подана на с.143 підручника [2].
Зверніть увагу на амфотерний характер ферум (ІІ) оксиду та ферум (ІІІ) гідроксиду.
Мета: вивчити якісні реакції на Fe2+ та Fe3+.
4. Опрацюйте пункти 5 і 6 підручника [1] (с. 145).
5. Додаткова інформація!
Якісною реакцією на Fe2+ є калій фероціанід (ІІІ).
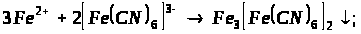
турнбулева синь
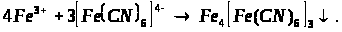
берлінська блакить
Напишіть повні молекулярні рівняння реакцій.
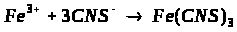
Проведіть експериментально якісні реакції.
Мета: вивчити хімічні властивості гідроксидів і солей Феруму, заповнити таблицю.
6. Опрацювавши тести підручників, виконавши лабораторні досліди, зробіть підсумок вивченого за планом:
1) Властивості ферум (ІІ) і ферум (ІІІ) гідроксидів:
а) колір;
б) взаємодія з кислотою і лугом;
|
№ з/п |
Властивості |
Речовини |
|||
|
Fe(OH)>2> |
Fe(OH)>3> |
FeCl>2> |
FeCl>3> |
||
|
1 |
Розчинність у воді |
||||
|
2 |
Взаємодія з кислотами |
||||
|
3 |
Взаємодія з лугами |
||||
|
4 |
Здатність до окислення |
||||
|
5 |
Гідроліз солей |
в) здатність до окислення (взаємодія з О>2> та іншими окисниками).
2) Властивості солей Феруму (ІІ) і (ІІІ):
а) гідроліз (для солей на індикатори);
б) взаємодія з лугами;
в) взаємодія Fe2+ з K>3 >[Fe (CN)>6>];
г) взаємодія Fe3+ з K>4 >[Fe (CN)>6>] та KCNS.
7. Виконайте самостійну роботу (підручник [2], с.144).
Варіант 1. № 223-а, 235.
Варіант 2. № 233-б, 236.
8. Взаємо перевірте один в одного всі види виконаної самостійної роботи.
Виставте оцінки.
Домашнє завдання: підручник [1], вправи 6, 10; підручник [2], п.38, вправи 237, 238.
Варіант ІІ.
Дидактична мета: вивчити властивості ферум гідроксидів, навчитися визначати у розчинах йони Fe2+ та Fe3+ за допомогою якісних реакцій.
Логічна мета: повторити властивості основних оксидів та основ з позиції теорії електролітичної дисоціації, продовжити складати повні та скорочені йонні рівняння.
Виховна мета: ознайомити учнів з професією хіміка-аналітика.
Тип уроку: одержання нових знань.
Метод: розповідь, бесіда, рішення задач, лабораторний досвід.
Обладнання:
 ,
,
штативи та обладнання для лабораторного досліду, програма-завдання з теми „Залізо та його сполуки”.
Хід уроку:
Гасло: „Тільки за допомогою теорії знання, об’єднуючись в єдине ціле, стає науковим знанням”.
О.М.Бутлеров
І. Актуалізація опорних знань.
Опитування учнів (за картками).
1. Розкажіть про властивості ферум (ІІ) та ферум (ІІІ) гідроксиду.
2. Складіть сумарні рівняння електролізу Fe SO>4.>
Які процеси відбуваються на катоді та аноді при електролізі даної солі? Дайте визначення поняттю електролізу.
3. Як відбувається гідроліз солі Fe Cl>3 >(ІІ стадії)? Назвіть продукти гідролізу і вкажіть умови його протікання.
4. За першим столом учні виконують експериментальне завдання.
Експериментальна задача: за допомогою характерних реакцій визначте, в якій з пробірок знаходяться розчини солей:
5. Як здійснити наступні перетворення:

або
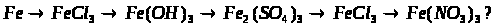
(Перевіряють експериментальне завдання та схему перетворень відповідальний виробничого відділу (прізвище, ім’я учня) та відповідальний експериментальної групи (прізвище, ім’я учня).
6. Задача. Скільки ферум (ІІІ) хлориду утвориться, якщо 16 г ферум (ІІІ) оксиду розчинити в 100 мл 20%-вої хлоридної кислоти, густина якої 1,1 г/мл.
Під час підготовки учнів біля дошки вчитель проводить з класом фронтальну бесіду.
Дайте характеристику елемента Ферум за його розташуванням у Періодичній системі хімічних елементів. До якої родини (за будовою атома) належить залізо?
Яка роль заліза в організмі людини? (коротке повідомлення учня „Арифметика крові”).
Чому концентровану H>2> SO>4> перевозять у сталевих цистернах? Складіть рівняння реагування заліза з концентрованою H>2> SO>4> при нагріванні, складіть рівняння електронного балансу. (Учні перевіряють роботи один одного та оцінюють їх).
Складіть рівняння електролітичної дисоціації комплексних солей
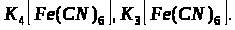
Заслухування відповідей учнів, які працюють біля дошки.
Відповіді цих учнів заслухує учень-рецензент (прізвище, ім’я учня). Рольова гра „Чи знаєте ви якісні реакції?”
Міні-змагання „Знавці хімії супроти математиків”
(Орієнтований зміст)
Вчитель. Через певну кількість років............................................(прізвище, ім’я учня) закінчивши Дніпропетровський хіміко-технічний інститут, повертається до рідного міста та починає працювати завідуючим лабораторією ДЕЗа. Під час прийому на роботу завідуючий лабораторією (прізвище, ім’я учня) для завдання своїм помічникам, яких сьогодні представляють знавці хімії, підібрати лаборантів для нової лабораторії. Лаборантів представляють зараз знавці математики, але, сподіваюсь, які полюбляють і хімію.(прізвище, ім’я учня). Зав. лабораторією виконує роль неупередженого журі (зав. лабораторією має емблему). Він запропонував своїм помічникам питання і провів конкурс:
Як визначити наявність йонів у розчинах солей:
При адаптації боксидів необхідно встановити процентний вміст домішок Fe в руді. Як визначити наявність заліза в руді та його процентний вміст?
Яким одним скороченим йонним рівнянням можна виразити суть цих двох хімічних реакцій:

Хімічні реакції записані великими літерами на ватмані. Після усних відповідей учнів ведучий рольової гри показує трафарет з відповіддю:
Наприкінці конкурсу зав. лабораторією.(прізвище, ім’я учня) роздає емблеми „Лаборант” кращим знавцям.
ІІ. Вивчення нового матеріалу.
1.Вступ
Розповідь вчителя.
Звертаю увагу учнів на те, що під час розпізнавання сполук заліза, які мають різний ступінь окислення, необхідно розрізняти розведені розчини солей Fe2+ та Fe3+. Повідомляю про застосування якісних реакцій у виробництві та інших сферах людської діяльності.
2.Самостійне вивчення програми-завдання „Якісні реакції сполук заліза”
(програма-завдання наявна на кожному столі) див. Додаток 5, 6.
3.Виконання лабораторної роботи
Тема: „Якісні реакції на двох – та трьохзарядні Йони Феруму”
Мета роботи: вивчити характерні реакції солей Феруму (ІІ) та (ІІІ); скласти рівняння реакції; зробити висновок.
1.
Реакції йонів
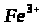 з
з
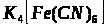
а)
до розчину солі заліза
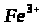 додамо
додамо
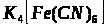 - жовту кров’яну сіль – калій
гексаціаноферат (ІІ). Розчин підкислюємо
1-2 краплинами хлоридної кислоти. В
результаті реакції утворюється:
- жовту кров’яну сіль – калій
гексаціаноферат (ІІ). Розчин підкислюємо
1-2 краплинами хлоридної кислоти. В
результаті реакції утворюється:
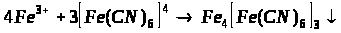
- темно-синій осад берлінської блакиті.
 застосовується
при виготовленні стійкої синьої фарби.
застосовується
при виготовленні стійкої синьої фарби.
б)
реакції йонів
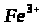 з амоній радонідом:
з амоній радонідом:
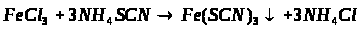
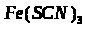 -
слабкодисоціюючі молекули, забарвлюють
розчин у кривово-червоний колір.
-
слабкодисоціюючі молекули, забарвлюють
розчин у кривово-червоний колір.
в)
реакція йонів
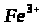 з гідроксидйонами (ОН):
з гідроксидйонами (ОН):
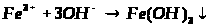 (буро-червоний
осад).
(буро-червоний
осад).
2.
Реакція
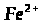 йонів.
йонів.
а)
до розчину солі
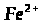 додаємо
додаємо
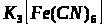 -
калій гексаціаноферат (ІІІ) – червону
кров’яну сіль. Внаслідок реакції
утворюється:
-
калій гексаціаноферат (ІІІ) – червону
кров’яну сіль. Внаслідок реакції
утворюється:
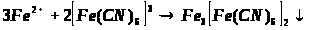
осад турнбулєва синь.
б)реакція йонів Fe2+ з гідроксидйонами (ОН):
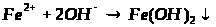
осад білого кольору.
Завдання:
1. Запишіть рівняння реакцій в молекулярному та повному йонному вигляді.
2.Виконайте досліди.
Після виконання дослідів три учні біля дошки записують:
Перший – рівняння реакції Fe Cl>2> з K>3>[Fe(CN)>6>];
Другий – FeCl>3> з NH>4>SCN;
Третій - Fe Cl>3> з K>4>[Fe(CN)>6>].
Називаємо продукти реакцій. Для перевірки правильності запису на дошці пропонується таблиця „Якісні реакції на Fe2+ та Fe3+ „. Вчитель демонструє продукти кольорових реакцій на Fe2+ та Fe3+ через підсвічування.
Спільно з учнями робимо висновок про те, які ж реакції є якісними на йони Fe2+ та Fe3+, і записуємо його в зошити.
Резервний час. Повідомлення учнів про розповсюдження заліза в природі.
1. Залізо в живій природі.
2. Залізо в морській воді.
3. Залізо в землі.
4. Залізо в космосі.
IV. Домашнє завдання: Фельдман Ф.Г., Рудзитис Г.Е. Химия 9 класс – М.: Просвещение, 1990 – п.51-53.
2.6 Семінарське заняття „Залізо та його сполуки”
Варіант 1.
Мета: закріпити знання про просту речовину – залізо і його властивості та про сполуки Феруму та їх властивості, а також якісні реакції на Fe2+ та Fe3+; удосконалити вміння розв’язувати розрахункові задачі вивчених типів.
Варіант А
1. Суміш порошків міді і заліза обробили 20% розчином хлоридної кислоти, густина якого 1,1 г/см3. Вміст заліза в суміші становить 20%. Обчисліть масу вихідної суміші, якщо в результаті реакції утворилося 224 мл газу (н.у.). Який об’єм хлоридної кислоти вступив в реакцію?
2. Визначте мінімальний об’єм розчину нітратної кислоти з масовою часткою чистої речовини 80% (густина розчину 1,45 г/см3), який потрібен для розчинення срібла, одержаного при взаємодії зразка заліза з розчином, який містить аргентум нітрат масою 24 г. Маса заліза, взята для реакції, становить 2,8 г.
3. Суміш ферум (ІІ) оксиду та ферум (ІІІ) оксиду масою 8 г розчинили у надлишку сульфатної кислоти. Для реакції з одержаним розчином використали розчин з масовою часткою калій перманганату KMnO>4> 5% та масою 31,6 г. Визначте масові частки оксидів у вихідній суміші.
4. Здійсніть перетворення.


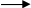





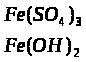

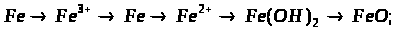
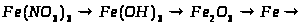

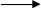


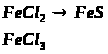
5. У трьох пробірках міститься солі:
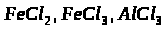
Визначте їх. Напишіть рівняння хімічних реакцій у повній та скороченій йонній формах.
6. Яким чином, маючи лише кристалічний ферум (ІІІ) сульфат, воду, натрій металічний, спиртівку, одержати залізо?
7. У чотирьох пробірках містяться осади:
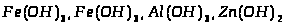
Як за допомогою хлоридної кислоти та калій гексаціоноферату (ІІ) можна їх розпізнати?
Варіант Б.
1. В результаті взаємодії 0,5 г двовалентного металу із сульфатною кислотою утворилося 200 мл водню (н.у.). Який це метал?
2. Залізо масою 14 г спалили із сіркою масою 4,8 г. До одержаної суміші речовин додали надлишок хлоридної кислоти. Які гази при цьому утворилися? Визначте об’єм цих газів, виміряних за н.у.
3. Зразок оксиду феруму масою 32 г відновили до металу карбон (ІІ) оксидом. Визначте формулу оксиду, якщо об’єм карбон (ІІ) оксиду, що прореагував, становить 13,44 л.
4. Здійсніть перетворення:
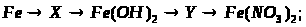
F


 e
e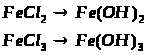

5. У двох пробірках містяться розчини солей Феруму (ІІ) і (ІІІ). Як їх
визначити? Напишіть відповідні рівняння реакцій в молекулярній та йонній формах.
6. Напишіть рівняння реакцій між концентрованою та розбавленою нітратною кислотою та залізом.
7. Зобразіть схематично будову атома Феруму та йонів Fe2+ та Fe3+.
Варіант В.
1. Який газ і в якому об’ємі (н.у.) утвориться при спалюванні піриту масою 40 г, що містить 12% домішок?
2. Які властивості проявляють ферум (ІІ) та ферум (ІІІ) гідроксиді. Напишіть відповідні рівняння реакцій.
3. Здійсніть перетворення:
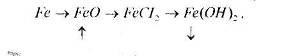
Варіант ІІ.
Тема: залізо та його сполуки.
План семінарського заняття.
1. Положення металів у періодичній системі.
2. Будова атома.
3. Хімічний зв’язок.
4. Металічна кристалічна гратка.
5. Фізичні властивості металів.
6. Класифікація металів за:
а) густиною;
б) температурою плавлення;
в) твердістю;
г) провідністю.
7. Ряд властивості металів.
8. Хімічні властивості металів відновників:
а) взаємодія з киснем;
б) взаємодія з воднем;
в) взаємодія з галогенами;
г) взаємодія з іншими неметалами;
д) взаємодія з водою;
е) взаємодія з розчинами кислот;
ж) взаємодія з розчинами солей.
9. Поширення в природі:
а) активних металів;
б) металів середньої активності;
в) благородних металів.
10. Способи одержання металів:
а) випалювання з подальшим відновленням;
б) електроліз розплавів;
в) електроліз розчинів.
Мета: поглибити та систематизувати знання учнів про властивості металів на прикладі заліза та його сполук; вивчити індивідуальні властивості заліза та його сполук, амфотерність цього металу на прикладі електронної будови атома; ознайомити учнів з професіями в металургійному виробництві на основі знань про застосування заліза та його сполук у народному господарстві, про способи їх видобутку та обробки; поглибити між предметні зв’язки (географія, біологія, історія).
Тип уроку: комбінований.
Методи та прийоми: індуктивний метод (розповідь бесіда з елементами індивідуальної, групової та фронтальної робіт, демонстраційних експериментів).
Обладнання: ферум (ІІІ) оксид, ферум (VI) оксид, KMnO>4>, ферум (ІІ) хлорид, ферум (ІІІ) оксид, колекція „Природні сполуки заліза”, таблиця „Специфічні властивості концентрованої сульфатної кислоти”.
Хід уроку:
Літературний вступ
Вчитель. Давні єгиптяни називали його „вааепера”, що означає „той, що народився у небі”. Давні копти називали його каменем неба. Вироби з нього цінувалися дорожче за золото. Один східний деспот навіть видав указ, яким під страхом смертної кари заборонялося всім, крім нього, носити зроблені з цього металу прикраси. В „Одіссеї” Гомера розповідається, що переможцям спортивних змагань вручали шматок цього металу та шматок золота – найбільші на той час коштовності. Алхіміки вважали його настільки неблагородним металом, що навіть займатися ним не хотіли.
Що ж це за метал? Які властивості він має? Про це ми дізнаємося на сьогоднішньому уроці.
І.Актуалізація опорних знань
1. Робота біля дошки за картками
1) при розкладі 18 г гідроксиду металу (ІІ) утворилося 14,4 г оксиду металу (ІІ). Визначте, про який метал ідеться.
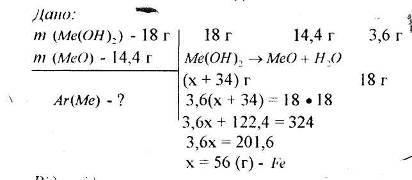
Відповідь: залізо
2) Складіть електронну конфігурацію хімічного елемента № 26. Які властивості він має? Спрогнозуйте можливі валентності цього елемента.
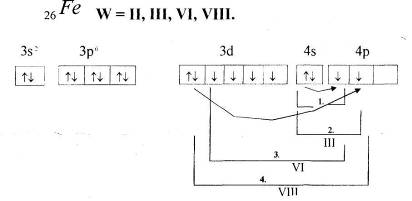
3) Знаючи загальні хімічні властивості металів, складіть рівняння реакцій заліза:
а) з простими речовинами
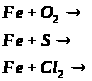
б) зі складними речовинами
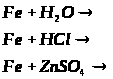
4) Знаючи способи одержання металів, напишіть рівняння реакцій одержання заліза з червоного залізняка та феруму (ІІ) хлориду:
а) відновлення воднем, коксом, чадним газом:
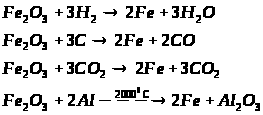
(алюмотерапія – демонстраційний експеримент)
б) відновлення електролізом розплаву ферум (ІІ) хлориду:
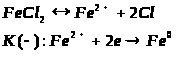
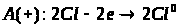
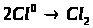

2. Робота на місцях за картками
1) Мінерал містить 72,36% заліза та 27,64% кисню. Визначте формулу мінералу.
2) За допомогою методу електронного балансу складіть рівняння реакцій, що протікають за такою схемою:
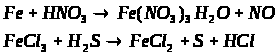
3) Здійсніть перетворення (випереджальне завдання):
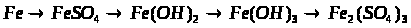
4) Здійсніть перетворення:
5) При електролізі розплаву FeCl>2> маса катоду збільшилася на 56 г. Визначте масу реагенту.
3.Питання на підвісній дошці
1) Чому в світовій енциклопедичній літературі залізо названо великим трудівником?
2) Чим небезпечний „Залізний голод?”
4.Фронтальне опитування
На які групи поділяються всі хімічні елементи?
Чим відрізняються метали від неметалів?
У чому суть будови металічної кристалічної гратки? (див. опорний конспект)
Чим пояснюються характерні властивості металів?
Як на основі електронної конфігурації, не знаючи конкретного хімічного елементу, визначити, метал це чи неметал?
ІІ. Виклад нового матеріалу.
У таблиці Менделєєва важко знайти другий такий метал, з яким так тісно була б пов’язана історія цивілізації. (Перевірка задачі № 1 біля дошки, повідомлення теми уроку.) Залізо належить до металів, відомих людству з глибокої давнини (VI-II ст. до н.е.). Ще в давньому Єгипті із заліза виготовляли різне хатнє начиння. Залізо є другим за поширеністю металом у природі (4,2%) після алюмінію. У вільному стані зустрічається лише в метеоритах (залізо космічного походження). Протягом останніх 50 років випало 453 метеоритних дощі, які принесли на Землю 672 т метеоритного заліза. Це залізо порівняно легко піддається обробці, й саме з нього людина почала виготовляти найпростіші знаряддя. Але, на жаль, метеорити за замовленням на Землю на падали, а потреба в залізі була постійною.
У перші роки свого царювання Петро І видав указ „искать всякому литому и кованому железу умноження, стороннего шведського железа пронять было мочно и стараться, чтобы русские люди тем мастерством были изучены, дабы то дело в Московском государстве было прочно».
А для тих, хто намагався приховати знайдені руди, указом передбачалися жорстокий гнів, невідкладне тілесне покарання та страта. Найважливішими природними сполуками заліза є (демонстрація колекцій):
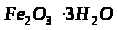 - бурий залізняк
(Крим – Керченське родовище);
- бурий залізняк
(Крим – Керченське родовище);
 - червоний
залізняк (Кривбас);
- червоний
залізняк (Кривбас);
 -
магнітний залізняк (Курська магнітна
аномалія, м.Магнітогорськ);
-
магнітний залізняк (Курська магнітна
аномалія, м.Магнітогорськ);
 - залізний
колчедан, пірит (Урал)
- залізний
колчедан, пірит (Урал)
Сполуки заліза входять до складу живих організмів.
Самостійна робота: Визначити масову частку заліза в:
Варіант І: Бурому залізняку
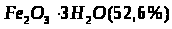
Варіант ІІ: Червоному залізняку
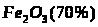
Варіант ІІІ: Магнітному залізняку
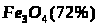
З наведених мінералів запропонуйте той, що є найбільш економічно вигідним для виробництва заліза (чавуна).
Робота з випереджальними завданнями
1. Перевірка завдання № 1.
2. Знаючи, що залізо – метал, опишіть його фізичні властивості. (Залізо – сріблясто-сірий метал, ковкий, пластичний, має магнітні властивості, с =7,87 г/см3, t>пл.>=15390С, при температурі 60000С переходить у газоподібний стан (на Сонці)).
3. Перевірка завдання № 2.
Чи лише металеві властивості має залізо? Визначте властивості заліза. (Основні, атмосферні, кислотні).
Для заліза валентністю ІІ і ІІІ майже однаковою мірою характерними є одні й ті самі властивості, тому залежно від умов сполуки Fe2+ можуть виступати в ролі відновників, а Fe3+ - окисників.
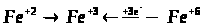
відновник окисник
ІІ
Fe(OH)>2>
ОсноваІІ
Fe(OH)>3>
Амфотерн
IV
FeO>2>(OH)>2> або (H>2>FeO>4>)
Фериста кислота
Висновок: залізу притаманні загальні властивості металів і в той самий час він, проявляючи валентність ІІІ, є амфотерним.
4. Перевірка завдання № 3
В яких же випадках залізо проявляє ступінь окислення +3?
Запам’ятайте!
1) При взаємодії з киснем утворюється змішаний оксид:
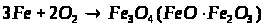
2) При взаємодії з галогенами Fe проявляє ступінь окислення +3:
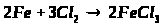
3) При взаємодії з водою:
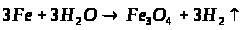
4) При взаємодії з кислотами:
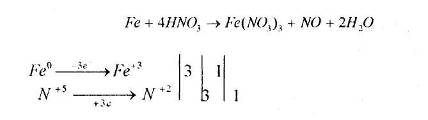
За н.у. Fe пасивує взаємодію з концентрованою кислотою H>2>SO>4> та HNO>3>, оскільки утворюється міцна оксидна плівка.
5. Питання.
Які властивості буде мати ферум (ІІІ) гідроксид? Де ми вже зустрічалися з поняттям „Амфотерні сполуки?” Які амфотерні елементи та сполуки ви знаєте? Доведіть амфотерний характер Fe(OH)>3>.
Демонстрація експерименту (проводять учні).
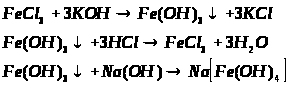
Отже, ми з вами дійшли висновку: сполуки заліза зі ступенем окислення +3 амфотерні.
6. Перевірка завдання № 4.
7. Знаючи, що для заліза ступені окислення +2 та +3 є характерними приблизно однаковою мірою, ідентифікуйте речовини: ферум (ІІ) хлорид та ферум (ІІІ) хлорид.
Демонстрація експерименту (проводять учні)
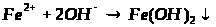
колір осаду?
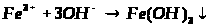
колір осаду?
8. Де використовується залізо?
Яким є його значення для організму?
ІІІ. Закріплення та узагальнення.
1. Відповіді на питання (на підвісній дошці)
Схеми на дошці коментує вчитель.
Металургія
Пірометалургія (огняний спосіб)
(+O>2>) (+H>2>, C, CO, Me)
Гідрометалургія
1) Мокрий спосіб:
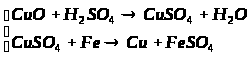
2) Електроліз
Електроліз
Что такое электролиз?
Рассказать я не боюсь.
Значит так: берется полюс.
Этот полюс будет «плюс».
Нужен нам и полюс «минус».
Это тоже электрод.
Если, соль в раствор закинув,
Цепь замкнуть, то ток пойдет.
У катода всем подряд
Выдаются электроны.
Металлический отряд
Получают из ионов.
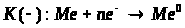
А анод, наоборот,
Электроны отберет.
В этом месте всякий раз
Выделяться будет газ.
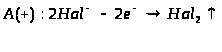
або
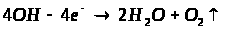
Результат всего процесса
Очень даже интересен:
Если ток включается –
Соли разлагаются.
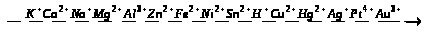
Хімічна активність зменшується
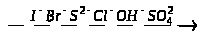
Хімічна активність зменшується
1. Питання до учнів.
Правила перевезення концентрованої сульфатної кислоти в стальних цистернах суворо вимагають, щоб після зливання кислоти з цистерн випускний кран і люк були негайно закриті. Чому? (концентрована сульфатна кислота за звичайної температури не вступає в реакцію із залізом і тому перевозиться в стальних цистернах. При відкритому крані та люку сульфатна кислота швидко поглинає вологу з повітря й перетворюється на розчин кислоти, що енергійно роз’їдає стінки цистерни).
2. Робота за міні-тестами.
Тест з теми „Залізо та його сполуки”.
Варіант І.
1.Назвіть сполуки, в яких залізо має ступінь окислення +2:
а) FeО; в) Fe(NO>3>)>2>;
б)NaFeO>2>; г) FeCl>3>
2. Назвіть речовини, з якими реагує залізо:
а) O>2>; в) H>2>SO>4>;
б) Na>2>O; г) CO>2>
3. Назвіть речовини, які утворюються при взаємодії Fe(OH)>3> з HNO>3>:
а) H>2>O;в) FeO;
б) Fe(NO>3>)>2>;г) Fe(NO>3>)>3>
4. Назвіть метали, які є більш активними за залізо:
а) Cu;в) Hg;
б) Caг) K.
5. Назвіть речовини, в яких розчиняється Fe>2>O>3>:
а) H>2>O;в) HCl;
б) NaOH (розч.);г) NaCl (розч.).
Варіант ІІ.
1. Назвіть сполуки, в яких залізо має ступінь окислення +3:
а) FeO;в) Fe>2>(SO>4>)>3>;
б) NaFeO>2>г) FeCl>2>.
2. Назвіть речовини, з якими реагує залізо:
а) Cl>2>;в) HNO>3 >(конц.)
б) H>2>O;г) CaO.
3. Назвіть речовини, що утворюються при взаємодії Fe(OH)>3> та H>2>SO>4>:
а) H>2>O;в) Fe>2>(SO>4>)>3>;
б) FeSO>4>г) FeS.
4. Назвіть метали, які є більш пасивними за залізо:
а) Cu;в) Hg;
б) Ca;г) K.
5. Назвіть речовини, в яких розчиняється Fe(OH)>3>:
а)H>2>O;в) HCl (розч.);
б) NaOH (розч.);г) NaCl (розч.).
IV. Підбиття підсумків
V. Домашнє завдання
Під час виплавки сульфатних руд (FeS>2>) у повітря потрапляє близько 0,8% усього (за масою) сульфур (IV) оксиду, що утворився. Обчисліть об’єм повітря, який буде забруднено при одержанні 100 т заліза ГДК SO>2> у повітрі – 0,5 мг/см3.
2.7 Сплави заліза: чавун і сталь. Застосування сплавів і сполук Феруму
Мета: ознайомитися з промисловим виробництвом чавуну і сталі.
1. Прочитайте текст підручника [2] п.29 зверніть увагу на сировину, з якої виплавляють чавун. Дайте відповіді на питання:
Що таке шихта, який її склад та призначення?
Які основні процеси відбуваються під час виплавки чавуну? Напишіть відповідні рівняння реакцій. Звірте з навчальним матеріалом міні-підручника.
Чому під час даного процесу утворюється метал з високим вмістом Карбону? Яка роль шлаку в доменному процесі?
Напишіть рівняння реакцій утворення шлаку.
Розв’яжіть задачу:
Варіант І. № 185
Варіант ІІ. № 187
2. Взаємо перевірте розв’язані задачі. Поясніть, що означає запис:
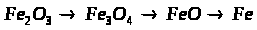
Мета: ознайомитися з процесом виплавки сталі.
3. Опрацюйте текст підручника [2] п.29, с. 114.
Зверніть увагу на принципову різницю виплавки чавуну та сталі. (Доменний процес – процес відновлення; виплавка сталі – процес окиснення).
мета виплавки сталі – зменшити вміст Карбону та інших домішок неметалів у металі.
4. Запишіть хімізм сталеплавильного процесу в зошит, використовуючи
підручник [2] та міні-підручник.
Мета: ознайомитись зі способами виплавки сталі.
які характерні ознаки кожного зі способів? Використайте міні-підручник.
Розв’яжіть задачу.
Варіант І. № 191
Варіант ІІ. № 192
5. Взаємо перевірте, оцініть виконане.
6. Прочитайте мету. Яку частину матеріалу вам необхідно опрацювати?
Мета: вивчити застосування металу заліза та його сплавів у техніці.
7. Ознайомтеся з текстом підручника [2] (п.31, с.119; п.37, с.141, абзац 6).
Необхідну інформацію запишіть.
Домашнє завдання: підручник [2] п. 29, задача 186; п.29, задача 193, п.п. 22, 30-32.
2.8 Практична робота „Розв’язування розрахункових задач з теми „Метали”
Мета: удосконалити знання про метали, їх властивості та способи одержання; розвинути знання про сполуки металів та їх хімічні властивості, якісні реакції; навчитися здійснювати перетворення одних речовин та інші; закріпити вміння складати окисно-відновні рівняння реакцій, реакції йонного обміну у молекулярному, повному та скороченому йонному вигляді.
Використовуючи підручник [3], виконати завдання:
Варіант І. Завдання 1, 5, 12;
Варіант ІІ. Завдання 2, 6, 10;
Варіант ІІІ. Завдання 3, 7, 11;
Варіант IV. Завдання 4, 8, 9.
Будьте обережні! Ви працюєте з кислотами, лугами, солями!
Згадайте:
а) правила поводження в хімічному кабінеті;
б) правила роботи з їдкими речовинами – кислотами, лугами;
в) правила поводження з відкритим полум’ям.
У разі необхідності прочитайте фрагменти тексту (підручник [3], с. 5-8). Після виконання практичної роботи запишіть у зошит висновки про виконану роботу та приберіть своє робоче місце.
2.9 Атестація з теми „Метали побічних підгруп. Залізо”
Мета: перевірити рівень знань, умінь і навичок, одержаних учнями при вивченні теми.
Завдання 1 (2 бали). Напишіть рівняння реакцій взаємодії заліза з простою та складною речовинами. Визначте окисник та відновник.
Варіант І.
а)хлор; б)сульфатна кислота.
Варіант ІІ.
а)хлоридна кислота; б)бром.
Варіант ІІІ.
а)купрум(ІІ)сульфат; б)гідроген флюорит.
Варіант IV.
а)сірка; б)меркурій(ІІ) нітрат.
Варіант V.
а)концентрована нітратна кислота; б)кисень.
Варіант VI.
а)водяна пара; б)йод.
Завдання 2 (3 бали). Напишіть рівняння реакцій, що лежать в основі схеми.
Варіант І.
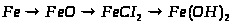 .
.
Варіант ІІ.
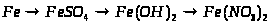 .
.
Варіант ІІІ.
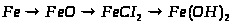 .
.
Варіант IV.
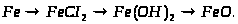
Варіант V.

Варіант VI.
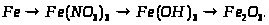
Завдання 3 (3 бали). Розв’яжіть розрахункові задачі на знаходження формул хімічних сполук.
Варіант І. Масові частки Феруму й Оксигену в природному мінералі становить відповідно 72,36% і 27,64%. Знайдіть формулу мінералу і назвіть його.
Варіант ІІ. Масові частки Феруму та Оксигену в природному мінералі становить відповідно 69,9% і 30,1%. Знайдіть хімічну формулу мінералу і назвіть його.
Варіант ІІІ. Масова частка кристалізаційної води у кристалогідраті Ферум(ІІІ) хлориду становить 39,92%. Знайдіть формулу кристалогідрату.
Варіант IV. Масова частка Феруму в природному мінералі піриті становить 46,67%. Крім Феруму, до складу піриту входить Сульфур. Визначте формулу піриту.
Варіант V. Хромовий залізняк містить хром(ІІІ) оксид і ферум(ІІ) оксид. Масова частка останнього в мінералі становить 32,14%. Визначте формулу мінералу.
Варіант VI. Масова частка Хлору в хлориді тривалентного металу становить 65,5%. Який це метал? Напишіть формулу хлориду.
Завдання 4 (4 бали). Розв’яжіть експериментально-розрахункові задачі.
Варіант І. Маючи ферум(ІІ) хлорид, одержіть ферум(ІІ) гідроксид. Обчисліть масу ферум(ІІ) гідроксиду, якщо в реакцію вступив ферум(ІІ) хлорид масою 1,27 г.
Варіант ІІ. Маючи ферум(ІІІ) сульфат, одержіть ферум(ІІІ) хлорид. Яка маса осаду, якщо в реакцію вступив ферум(ІІІ) сульфат масою 2 г?
Варіант ІІІ. Маючи ферум(ІІІ) оксид, одержіть ферум(ІІІ) хлорид. Яка маса солі утвориться, якщо в реакцію вступив ферум(ІІІ) оксид масою 1,6 г?
Варіант IV. Маючи ферум(ІІІ) оксид, одержіть ферум(ІІІ) нітрат. Яка маса солі утвориться, якщо в реакцію вступив ферум(ІІІ) оксид масою 0,8 г?
Варіант V. Маючи ферум(ІІ)гідроксид, одержіть ферум(ІІ)сульфат. Яка маса сульфатної кислоти витратиться, якщо в реакцію вступив ферум(ІІ) гідроксид масою 0,9 г?
Варіант VI. Маючи ферум(ІІ) сульфат, одержіть ферум(ІІІ) гідроксид. Яка маса натрій гідроксиду витратиться, якщо прореагував ферум(ІІ) сульфат масою 1,52 г?
Завдання 5. Розв’яжіть експериментальні задачі.
Варіант І. Маючи необхідні реактиви та обладнання, одержіть ферум(ІІ) хлорид.
Доведіть експериментально, що до оксиду одержаної солі входять катіони Феруму(ІІ) та хлорид-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант ІІ. Маючи необхідні реактиви й обладнання, одержіть ферум(ІІ) сульфат.
Доведіть експериментально, що до цієї солі входять катіони Феруму (ІІ) та сульфат-аніони. Опишіть свої спостереження. Напишіть рівняння реакцій.
Варіант ІІІ. Маючи необхідні реактиви й обладнання, одержіть ферум(ІІІ) хлорид.
Доведіть експериментально, що до складу одержаної солі входять катіони Феруму(ІІІ) та хлорид-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант IV. Маючи необхідні реактиви й обладнання, одержіть ферум(ІІІ) сульфат.
Доведіть експериментально, що до складу цієї солі входять катіони Феруму(ІІІ) та сульфат-аніони. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант V. Одержіть реакцію обміну ферум(ІІ) гідроксид.
Одержаний осад розлийте у дві пробірки. Одну залишіть на деякий час на повітрі. До другої долийте розчин кислоти. Опишіть спостереження. Напишіть рівняння реакцій.
Варіант VI. Одержіть реакцію обміну ферум(ІІІ) гідроксид.
Одержаний осад розлийте у дві пробірки. До однієї долийте розчин кислоти. Вміст другої пробірки перелийте до розчину лугу. Опишіть спостереження. Напишіть рівняння реакцій.
2.10 Методична розробка інтегрованого уроку хімії та географії “Металургійний комплекс чорна металургія України”
Тема уроку. Металургійний комплекс. Чорна металургія. Виробництво чавуну і сталі. Проблема безвідходних виробництв у металургії та охорона довкілля
Цілі: дати поняття про металургійний комплекс, його склад; виявити хімікотехнологічні особливості металургійного виробництва; вивчити виробництво чавуна та сталі; формувати вміння складати рівняння хімічних реакцій, що лежать в основі виробництва і чавуну та сталі; ілюструвати прикладами з металургії розв'язання проблеми безвідходних виробництв; ознайомиш з проблемами охорони довкілля на прикладі доменного виробництва; формувати -географічне та хімічне мислення; розвивати в учнів : самостійність у навчанні, здібності до активного застосування хімічних і географічних знань; виховувати загальну культуру, широту поглядів, інтерес до професії металургу любов до рідного краю.
Обладнання: картка «Металургійний комплекс України», географічні атласи; схема «Металургійний комбінат», таблиці «Доменне виробництво чавуну», Виробництво сталі».
Форми й методи: практичні, наочні, бесіда за опорними поняттями, розповідь, проблемна бесіда, проблемно-пошукові, пояснювально-ілюстративні, групова робота.
Метали – це світлі, тіла, які на вогні плавити й кувати можна.
М.В.Ломоносов
Я не знаю, що будет со мною …
Может, в новую жизнь не гожусь,
Но и все же хочу я стальною
Видеть бедную, нищую Русь…
С.Єсенін
Метали самотужки до двору не прийдуть: вимагають ока й рук людини для свого приходу.
М.В.Ломоносов
Хід уроку: І. Організаційний етап.
ІІ. Мотивація навчальної діяльності на уроці.
Учитель хімії. Ми живемо поблизу міста металургів. Усім вам добре відомі великі металургійні заводи м.Дніпропетровська. Що виробляють на цих заводах? Про це й піде розмова на уроці.
ІІІ. Актуалізація опорних знань і вмінь учнів.
Бесіда.
До якої сфери господарства належить металургія?
Які форми організації виробництва ви знаєте?
Що таке концентрація виробництва?
Що таке комбінування?
В якому вигляді зустрічаються метали в природі?
Назвіть найважливіші способи одержання металів із руд. Підтвердьте свою відповідь рівнянням реакцій.
IV. Оголошення теми, мети й завдань уроку
V. Сприйняття та усвідомлення нового матеріалу.
Робота з новими поняттями:
Кокс – С (вуглець), його використовують як паливо, джерело теплоти, як відновник.
Руда – природні матеріали, з яких одержують метали.
Шихта – суміш руди, коксу флюксів.
Шлак – це легкоплавкі сполуки, на які перетворюються тугоплавкі домішки.
Флюс – речовина, що допомагає перевести тугоплавкі домішки в легкоплавкі сполуки наприклад, вапняк CaCO>3>)
Учитель географії. Сьогодні ви ознайомилися зі структурою металургійного
комплексу.
Металургійний комплекс – це сукупність галузей, що виробляють різні метали. Понад 90% металів, які застосовують у сучасному виробництві, - це чорні метали (залізо та його сплави). Залізо відоме людям протягом майже 5 тис.років. Спочатку його цінили дорожче за золото, тому що використовували тільки метеоритне залізо, якого було дуже мало.
Сьогодні сплави заліза – найважливіший конструкційний матеріал. Основний їх споживач – машинобудування.
Характерні риси металургії.
Учитель географії. Чорна металургія – провідна гулузь промисловості в Україні? (Бесіда).
Відповідь:
Цьому сприяють такі фактори:
1). Гарна сировина база та вигідне розміщення;
2). Густа транспортна мережа;
3) достатня кількість висококваліфікованих кадрів;
4). Наявність важкого машинобудування;
5).Велика кількість металобрухту.
Галузева структура металургійного комплексу (МК)

Учитель хімії. Сьогодні ми ознайомимося з чорною металургією України. Але з чого ж усе почалося?
Випереджальне завдання учня.
Залізо почали видобувати скіфи у ІІ тис. до н.е., масове виготовлення зброї почалося у І тис. до н.е. Один із центрів з виробництва заліза існував з кінця І тис. до н.е. у Закарпатті. За часів Київської Русі набув поширення так званий сиродутний процес одержання заліза способом безпосереднього відновлення залізних руд деревним вугіллям у горнах.
У XIV – XVIII ст. на Поліссі, Київщині, у Прикарпатті й Галичині здійснювалося виробництво металу в горах і примітивних домицях.
Заводське виробництво чорних металів в Україні набуло розвитку наприкінці ХІХ ст. одночасно з промисловою розробкою покладів кам’яного вугілля в Донбасі й залізних руд – у Криворізькому та Керченському басейнах. Перша доменна піч, що працювала на кам’яному вугіллі, була споруджена на початку ХІХ ст. в Луганську. З 80-х рр. ХІХ ст. великі металургійні заводи, що використовували кокс, будувалися в Україні на Придніпров’ї. Перший такий завод став до ладу у 1872р. в Юзівці (нині Донецьк). У 1913р. в Україні була зосереджена переважна частина виробництва металу тодішньої Росії. Діяло 42 доменні та 72 мартенівські печі, 28 конвертерів.
Учитель географії. Чорна металургія – складна галузь. До неї належать виробництва, різні за організацією та технологією.

Учитель хімії (ставить проблемні питання).
1. Чому залізну руду одразу не можна відправляти на виплавку чавуну? (Потрібне очищення.
2. Навіщо її збагачують, тобто підвищують концентрацію сполук Феруму? (Для підвищення швидкості хімічної реакції одержання металів).
Робота з атласом.
Учитель географії. Що є сировиною для чорної металургії?
Учні знаходять на карті знаки:
Кам’яне вугілля.
Залізна руда.
Манган.
Флюси.
Учитель хімії. Назвіть залізні руди, напишіть їхні формули.
(Fe>3>O>4> – магнітний залізняк, магнетит; Fe>2>O>3> – червоний залізняк, гематит; Fe>2>O>3> – бурий залізняк, лимоніт; FeS>2> – пірит).
Учитель географії. Де на території України є родовища залізної руди? Манган Mn використовують для підвищення якості металу. Він надає твердість сталі, запобігаєокисненню заліза під час виробництва чавуну.
- флюси (вапняк, глинозем, кварц) додають до руди для очищення гарячого металу та отримання шлаків з певними властивостями).
Вогнетривкі глини (каолін, доломіт) використовують для запобігання руйнуванню доменних печей за умов роботи за дуже високої температури.
Робота в групах.
1. Які родовища залізної руди ви знаєте?
2. Складіть стислу характеристику кожного з них.
3. Які екологічні проблеми виникають під час видобування сировини?
Учитель хімії. Існує кілька способів виробництва чорних металів.
Способи виробництва чорних металів
Металургія повного циклу (виробництво чавуну, сталі прокату).
Переробна металургія (виробництво сталі, прокату з чавуну, металобрухту).
Електрометалургія (виробництво феросплавів, електросталей).
Для чорної металургії характерні комбінування та концентрація виробництва на великих підприємствах. Коли на підприємстві організовано виробництво повного циклу, тобто від чавуну до прокату, такі підприємства називаються комбінатами.
Практична робота.
Учитель хімії. Складайте схему комбінату чорної металургії.
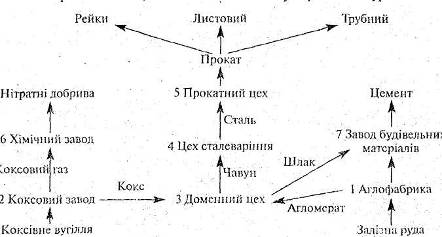
Учитель хімії. Що є сировиною у виробництві чавуну та сталі?
Сировиною у виробництві чавуну є залізна руда, що містить також порожню породу, до складу якої входять сполуки Силіцію (SiО>2>), Мангану (МnО>2>), Алюмінію (А1>2>О>3>), Фосфору (Са>3>(РО>4>)>3>), Сульфуру (FeS>2>, СаSО>4>) та ін. Перед плавкою руду збагачують — виділяють з неї певну частину порожньої породи, великі шматки руди подрібнюють, а пилоподібну руду спікають із вугіллям — піддають агломерації.
(Умовний знак 1. Залізна руда. Аглофабрика).
Сировиною у виробництві сталі є чавун переробний, кисень, флюси, руда (частково), металобрухт (частково).
Яка різниця між чавуном і сталлю? Чавун і сталь — сплави на основі заліза. Основна різниця між ними — вміст вуглецю. Якщо вміст вуглецю перевищує 4%, то сплав називають чавуном. Якщо ж уміст вуглецю пе-ребуває в межах 0,5—2 %, то сплав називають сталлю. Чавун є твердим і крихким, сталь — більш м'який і і пластичний сплав. Додавання до сталі мангану підвищує стійкість до опрацювання, що дозволяє, використовувати її для виготовлення залізничних рейок. Додавання хрому збільшує стійкість до корозії, таку сталь називають неіржавіючою і (13%Сr).
(Умовний знак 2. Коксівне вугілля, коксовий завод)
Для одержання заліза потрібен відновник. Які речовини можуть відновлювати залізо з його оксидів? (Водень, алюміній, чадний газ, вуглець)
Більш доцільним є використання |вуглецю. Таким чином, для виплавки чавуну потрібно кам'яне вугілля. Отже, воно містить лише 66 % вуглецю, тому використовують відновний кокс — твердий залишок, що одержують під час коксування, тобто нагрівання вугілля до температури 1 000 °С без доступу повітря протягом 14 годин. Кокс містить 90-98 % Карбону.
(Умовний знак 3. Доменний цех)
Процес відновлення заліза відбувається у доменній печі, де протікає велика кількість реакцій, які можна поділити на групи.
1-а група. Горіння коксу й утворення відновника — карбон(ІІ) оксиду з коксу та вуглекислого газу.
С + О>2>=СО>2>+Q; СО>2>+С = 2СО
2-а група. Відновлення ферум(Ш) оксиду карбон(ІІ) оксидом. Процес протікає упродовж трьох послідовних стадій за схемою:
Fе>2>О>3> ---> Fе>3>О>4> ---> FеО ---> F;w(Fе)70% 72% 76%
3-я група. Відновлення домішок. Завдяки цим реакціям багато елементів порожньої породи переходять у чавун.
4-а група. Утворення чавуну.
Залізо утворюється у твердому стані. Губчасті грудочки його легко вбирають Карбон та інші елементи й перетворюються на чавун.
ЗFе + С = Fе>3>С;ЗFе + 2СО = Fе>3>С + СО>2>
5-а група. Утворення шлаку.
У доменну піч разом з рудою потрапляє також порожня порола, що містить SіО>2> та інші речовини, що є дуже тугоплавкими й можуть закупорити піч. їх переводять у легкоплавкі сполуки і шлак за допомогою флюсів.
СаСО>3>=СаO+СO>2>
СаО + SіО>2>=СаSіО>3>
Робота з підручником і таблицею «Будова доменної печі»
Проблемні питання
Чому домна має вигляд башти?
Чому шихта доменної печі має форму зрізаного конуса з великою основою внизу?
3. Чим пояснити збільшення товщини стін домни в її нижній частині? 4. Чому заплечики домни мають форму зрізаного конусу з меншою основою внизу?
5. Габарити сучасної доменної печі її продуктів.
(Умовний знак 4. Цех сталеваріння)
Більшість реакцій, як і доменному процесі, є окисно-відновними.
1-а група реакцій – окиснення заліза.
2Fe+O>2>=2FeO+Q
Окисник – повітря, водяна пара.
Із залізної руди, металобрухту утворюються:
Fе + Fе>3>О>4>--->4FеО
2-а група реакцій — окиснення домішок (Sі, Мn, Р) ферум(ІІ) оксидом протікає за типом заміщення.
3-я група реакцій — усунення сполук Сульфуру та Фосфору негашеним і вапном СаО (утворення шлаків):
ЗСаО + Р>2>О>5>=Са>3>(РО>4>)>2>
СаО + SіО>2>--->СаSiO>3>
Шлак спливає на поверхню, а ферум(ІІ) оксид залишається в розплаві сталі.
Усунення оксиду FеО називають розкисненням сталі. (Відновник — А1, Мn.)
Позадоменне виробництво сталі:
• киснево-конвертерний спосіб;
• електрометалургійний спосіб;
• порошкова металургія.
Киснево-конвертерний спосіб виплавки сталі використовується з 1956 року. Він значно економніший, дозволяє переплавляти металобрухт, дає можливість контролювати кількість та якість сталі. Не потребує додаткового палива у вигляді природного газу. Процес виплавки триває до 50 хвилин (мартенівська плавка триває 6—12 годин)
Електрометалургія виробляє найякіснішу сталь за умов низького забруднення навколишнього середовища. За технологією виплавки в дугових та індуктивних печах, крім рудного агломерату, використовують металобрухт.
Завдяки запровадженню електричних та конвертерних печей виникла порошкова металургія, яка дозволяє використовувати порошки металів, виробляти сплави з різними властивостями, що за звичайних умов виробити неможливо.
Учитель хімії. Залізо та його сплави є основними технічними матеріалами. Без них не обходиться жодна галузь. З них виготовляють верстати й автомобілі, кораблі й мости, арматуру-для залізобетонних конструкцій і жерсть для консервних банок, дахове залізо і сільськогосподарські машини, труби та інструменти, побутові вироби тощо.
{Умовний знак 5. Прокатний цех)
Проблеми та перспективирозвитку чорної металургії
Проблемна бесіда
Які екологічні проблеми має чорна металургія?
1. Підчас:
а)шахтного способу видобування руд просідає земля, залишаються терикони;
б)кар'єрного способу видобування знижується рівень ґрунтових вод, зникає вода з криниць.
Із сільськогосподарського обігу вилучається багато родючих земель.
2. Металургійні заводи забруднюють довкілля чадним і вуглскислим газом. Коксовий газ містить пил, пару, сірководень, чадний і сірчистий гази. Але коксовий газ використовують для одержання наприклад добрив.
(Умовний знак 6. Хімічний завод),
3. У процесі одержання сталі у сталеплавильних печах, особливо конвертерах, виділяється багато і димових газів, що також містять отруйний чадний газ.
Проблемна бесіда
.1. Які економічні проблеми має чорна металургія?
(• Погіршення сировинної та паливної баз.
• Велика зношеність промислового обладнання.
•Неефективна технологія видобування та виробництва.
• Неконкурентноздатність продукції на світовому ринку)
2.Які шляхи розв'язання економічних проблем ви знаєте?
(• Підвищення обсягу конкурентноздатної продукції шляхом зниження собівартості.
Зменшення витрат матеріалів та електроенергії на виробництво продукції.
Проведення реконструкції та модернізації виробництва.
Залучення крупних інвестицій.
Впровадження у виробництво нових високопродуктивних, енергозберігаючих та екологічних технологій, реконструкція прокатних станів)
3.Які шляхи розв'язання екологічних проблем ви знаєте?
(• На сучасних заводах встановлюють фільтри, тепло- й газовлов-лювачі, інші очисні споруди.
•Створення комбінатів, на яких відходи одного виробництва вико- ристовуються як сировина для іншого (безвідходне виробництво)
{Умовний знак 7. Завод будівельних матеріалів).
Учитель географії. В Україні сформовані три головні райони чорної металургії: Донецький; Придніпровський; Приазовський.VI. ЗакріпленняРобота в групахДидактична гра1-а група. Складіть логічні пари між:

Назвіть інші центри виробництва чорної металургії..
2-а група. Аналізуючи карту, виявіть принципи розміщення підприємств галузі. Зробіть висновок.
Основні принципи:
сировинний, паливний — основні фактори;
наявність води, електроенергії, споживачів;
екологічні — з'явилися останнім часом)
3-а група. За допомогою атласу скласти схеми двох районів чорної металургії в Україні.
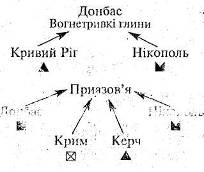
Обговорюється також питання «Чорна металургія на Дніпропетровщині».
4-а група. Складіть рівняння реакції відновлення Феруму під час виплавки чавуну згідно зі схемою:
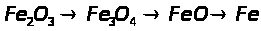
VII. Підбиття підсумків уроку.
2.12 Методична розробка дидактичного модуля за темою “Заліза та його сполуки” для класів з поглибленим вивченням математики й фізики
Тема: “Залізо – предствавник елементів побічної підгрупи восьмої групи Періодичної системи хімічних елементів Д.І.Менделеєва”
Мотиваційно-установчий модуль (модуль 1-й, 1 х 30 хв.)
Дидактичні цілі: прищеплення учням інтересу до теми, розвиток внутрішньої мотивації.
Розвивають цілі розвиток ерудиції учнів, пам’ять, уваги, вміння переходити від окремого до загального.
На дошці:
И железная лопата
В каменную грудь,
Добывая медь и злато,
Взрежет страшный путь
М.Ю.Лермонтов
І. Залізо в поезії
Торговали мы булатом,
Чистым серебром и златом
А.С.Пушкин
ІІ. Чи знаєте ви, що…
Людство протягом року використовує близько 500 тонн заліза.
...в організмі дорослої людини міститься 4 г заліза. Залізо входить до складу гемоглобіну крові (75 %). Багато заліза міститься в печінці, селезінці, кістковому мозку. Чимало його і в протоплазмі, де за його участі здійснюється процес внутрішнього дихання. Жіночий організм потребує удвічі більше заліза, ніж чоловічий, якому на добу потрібіїо лише 5 г заліза (жіночому, відповідно,— 10 г).:
>…..>у земній корі Місяця, в місячних породах поширене залізо двовалентне тому що на Місяці відсутні вода й кисень. У земній корі поширене трьохвалентне залізо.
...у Франції на честь 100-річчя французької революції в 1889 р. за проектом Густава Ейфеля було побудовано відому башту. Її будували протягом двох років, двох місяців і двох днів. її висота — 326 м, маса металевої частини — 7 тис. тонн. На неї було витрачено 1 050 846 залізних заклепок.
III. Хімічна вікторина
1. Среди металлов самый главный,
Важнейший, древний элемент,
В тяжелой индустрии славный,
Знаком с ним школьник и студент
Родился в огненной стихии,
Расплав его течет рекой.
Важнее нет в металургии,
Он нужен всей стране родной
(Залізо)
2. Що означає вираз: “Метал, який принесли в жертву Рудому дияволу”?
(Залізо, а також сталі, що перетворюються на іржу при корозії)
3. Чому морську воду називають “рідкою залізною рудою”?
(Якщо вилучити все залізо, розчинене в морській воді, то його буде стільки, що на кожного жителя планети припадатиме по 35 тонн, у той час як протягом всього існування людства його було вироблено стільки, що на кожну сучасну людину припадає лише по 6 тонн)
4. Хто розкрив таємницю булату?
(Російський металург Аносов).
5. Кому належать слова: “Залізо не лише основа всього світу, найголовніший метал оточуючої нас природи, але основа культури та промисловості, воно знаряддя праці й війни. І важко в усій таблиці Менделєєва знайти інший такий елемент, який був би так тісно пов’язаний з минулими, сучасними та майбутніми долями людства”?
(Академіку А.Є.Ферсману)
IV. Повідомлення
Вальтер Скотт у своєму романі «Талісман» розповідає про змагання у спритності між султаном Саладіном та Ричардом Левове Серце. Під час змагання Ричард мечем розрубав на дві частини спис одного з лицарів. Усі бачили величезну міцність сталі та величезну силу вдарів короля. У відповідь Саладін підкинув у повітря тонке покривало та розсік його шаблею — чудовий доказ гостроти клинка та спритності воїна. Клинок султана був булатний. Це одна з багатьох легенд, що розповідає про чудесні властивості булату.
Булат — знаменита сталь. Перші відомості про булат дійшли до нас від учасників походу Олександра Македонського до Індії — за 2300 років до нашої ери.
Індія була батьківщиною булату. Східні майстри ретельно оберігали таємницю виробництва булату, передаючи її з роду в рід.Таємницю булатної сталі розкрив російський металург Павло Петрович Анасов. Після тривалих дослідів він виготовив у Злотоусі перший булатний клинок. “Лезо булату згиналося без найменших ушкоджень, видаючи чистий і високий дзвін. Відполірований кінець кришив найкращі англійські зубила”, - писав Аносов у “Гірничому журналі”.
Так що ж таке булат, над таємницею якого так довго й завзято билося багато людей? “Залізо й карбон – і нічого більше, - відповідав Аносов, - уся справа в чистоті вихідних матеріалів, у методі охолодження та кристалізації”. А якщо ви хочете дізнатися про десятки тисяч цікавих властивостей заліза та його сплавів, прочитайте книгу Н.А.Мезеніна “Цікаво про залізо”.
Змістовно-пошуковий модуль з використанням особистісно-рольового підходу (модуль 1-й, 2 х 30 хв.)
Дидактичні цілі: ознайомити учнів з основними властивостями заліза та його оксидів і гідроксидів на основі будови атомів та положення в періодичній системі.
Розвиваючі цілі: розвивати почуття відповідальності, хімічну мову, пам’ять, уміння виокремлювати істотне в матеріалі, що вивчається, розширювати ерудицію учнів.
Обладнання:
кристалічні гратки,
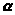 -
та
-
та
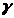 -
залізо, колекція “Метали та сплави”,
корозійні цвяхи, залізний дріт, порошок
заліза, розчин мідного купоросу, сірка,
хлор, спиртівка, ферум (ІІ) сульфат, ферум
(ІІІ) сульфат, алюміній роданід, розчин
лугу, Fe>2>O>3>,
аппарат Кіппа, пробірки, цинк.
-
залізо, колекція “Метали та сплави”,
корозійні цвяхи, залізний дріт, порошок
заліза, розчин мідного купоросу, сірка,
хлор, спиртівка, ферум (ІІ) сульфат, ферум
(ІІІ) сульфат, алюміній роданід, розчин
лугу, Fe>2>O>3>,
аппарат Кіппа, пробірки, цинк.
Тип уроку: виклад нового матеріалу за допомогою особистісно-рольового підходу.
Організатор групи. Сьогодні ми розглянемо залізо та його сполуки за таким планом:
1. Положення Феруму в періодичній системі та будова його атома. Тип кристалічної гратки.
2. Залізо в природі. Способи одержання заліза.
3. Хімічні властивості заліза як простої речовини.
4. Властивості оксидів і гідроксидів феруму (ІІ) і (ІІІ). Якісні реакції на йони Fe2+ та Fe3+
1-й
доповідач. Ферум
знаходиться в побічній групі VIII групи.
На зовнішньому енергетичному рівні в
нього міститься два електрони, а на
передостанньому — 14. (Показує
будову атома Феруму за допомогою
динамінного посібника.) Коли
в утворенні хімічних зв'язків беруть
участь два електрони зовнішнього рівня,
Ферум виявляє ступінь окиснення +2; а
іноді й один d-електрон передостаннього
рівня бере участь в утворенні зв'язків,
тоді Ферум виявляє ступінь оксиснення
+3. Залізо існує в природі в кількох
алотропних модифікаціях: α-залізо —
кубічна об'ємноцентрована гратка
(демонстру
є гратку);
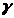 -залізо
—
кубічна гранецентрована ґратка, що має
більшу густину упаковки та менший об'єм.
(Демонструє
гратку.)
-залізо
—
кубічна гранецентрована ґратка, що має
більшу густину упаковки та менший об'єм.
(Демонструє
гратку.)
1-й опонент. Доповідач правильно й докладно висвітлив положення заліза в періодичній системі, будову атома та можливі ступені окиснення: +2 та +3. Сказано було й про те, що залізо має об'ємноцентровану та гранецентровану кристалічну ґратку. Я хочу задати питання: як нагрівання впливає на властивості заліза та його кристалічну ґратку?
1-й доповідач. Свою відповідь я хочу почати з невеликого коригування і запитання: як нагрівання впливає на кристалічну ґратку, а потім уже на властивості як наслідок.
При
910 °С
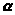 -залізо
переходить у
-залізо
переходить у
 -
залізо, а вже при 710 °С залізо втрачає
свої магнітні властивості, тому
-
залізо, а вже при 710 °С залізо втрачає
свої магнітні властивості, тому
 -залізо
немагнітне. (Демонструє
кристалічну гратку
-залізо
немагнітне. (Демонструє
кристалічну гратку
 -заліза.)
-заліза.)
2-й доповідач. Залізо в природі.Способи одержання заліза. Первісна людина почала використовувати залізні знаряддя за кілька тисячоліть до н. є. Тоді єдиним джерелом цього металу були метеорити, що впали на землю. В середині II тисячоліття в Єгипті було освоєно металургію одержання заліза з його залізних руд. Це стало початком залізного віку в історії людства. На території нашої країни початок залізного віку відносять до рубежу II та І тисячолітті до н.е.
Залізо — один з найпоширеніших у природі елементів. У земній корі і його масова частка становить 5,1%, і воно поступається лише кисню, силіцію та алюмінію. Залізо міститься й у небесних тілах, що встановлено методом спектрального аналізу. У зразках місячного ґрунту, які було доставлено радянською автоматичною станцією «Луна», підтверджено наявність заліза.
Для одержання заліза використовують руди з вмістом заліза 30-70 %. Основними залізними рудами є магнітний, бурий та червоний залізняки. (Показує на карті найбільш багаті родовища в європейській частині: Курська магнітна аномалія, Криворізький залізорудний басейн, а також родовища на Уралі, в Казахстані, Західному Сибіру.)
Залізо можна також одержувати з його оксидів. Демонструє досліди відновлення заліза.
ІІІ. Експериментальні дослідження впровадження лекційно-семінарської системи при вивченні теми “Залізо та його сполуки”
3.1 Хід та організація дослідження у класах з поглибленим вивченням хімії
В нашому дослідженні ми обмежились розробкою і лекційно-семінарського комплексу по темі “Залізо та його сполуки”, шляхів його впровадження і перевіркою ефективності отриманих результатів.
Вся досліджена робота проводилась нами з метою покращення методики викладання хімії, активізації методів навчання, розвитку творчих здібностей учнів, що повинно було в цілому привести до підвищення якості знань учні 9 класу.
Експериментальна робота проводилась протягом 2002-2003рр. навчальних років на базі навчально-виховного комплексу (НВК № 28) м. Полтава. Всього було охоплено понад 66 учнів 9 класів.
Нами було створено систему хімічної освіти побудованому на лекційно-семінарській базі та модульному підході.
Розроблені методичні рекомендації щодо її використання. При створенні методики організації цієї діяльності ми спиралися на педагогічні та методичні надбання М.П.Рузина, О.Т.Ярошенко тощо.
В ході педагогічного експерименту ми користувалися такими показниками:
якість знань учнів (правильність, глибина, міцність, усвідомлення).
якість умінь учнів (глибина, широта, самостійність).
Для виконання даного педагогічного експерименту обрали такі критерії:
Мета дослідження: полягає у розробіці, та впровадженні в педагогічну практику лекційно-семінарської системи в поєднанні з модульним розподілом урочної діяльності. Обгрунтувати дослідження використання тих методів і форм навчання, які найбільш повно враховують особливості прояву пізнавального інтересу і активізують пізнавальну діяльність учнів при вивченні теми “Залізота його сполуки”, а також зорієнтовані на їх загальний розвиток.
Об’єкт дослідження: процес вивчення теми “Залізо та його сполуки” у класах з поглибленим вивченням хімії,мтворчо та інтелектуально обдарованими учнями.
Предмет дослідження: навчання особливості організації та змісту урочної навчальної діяльності учнів.
Дане педагогічне дослідження має переваги над існуючою традиційною технологією, яка побудована на пасивному інформаційному змістові і методах навчання і стимулює систематичну навчальну діяльність учнів. Маємо надію, що реалізація ціїє системи дасть змогу суттєво підвищити ефективність навчально-виховного процесу.
Назвемо основні засади розробленої системи:
творча, інтелектуальна, соціально-активна особистість – це вища педагогічна цінність, яку має виховувати сучасна школа;
сформовані якості хіміка-дослідника – це результат хімічної освіти, яка створює сприятливі умови для постійного розвитку творчого мислення й пізнаввального інтересу до хімії;
хімічна-освіта – це навчально-дослідницька та науково-дослідницька діяльність, у якій учні – дослідники, а вчитель – педагог-дослідник; учні і вчитель – співпрацівники, а останній – керівник досліджень;
навчально-дослідницька діяльність – це співтворчість, яка заперечує будь-які форми примусу і базується на постійному заохоченні;
навчальна діяльність – це пізнавальний процес, що організовується за допомогою органічно пов’язаних типів уроків:лекцій, практичних робіт, дискусій, практично-наукових занять, семінарів різних типів.
Глибоке усвідомлення й осмислення хімічної інформації здійснюється на підгрупі екологічних, валеологічних та історичних знань.
Практичне значення проведеного дослідження полягає в тому, що розроблена
і впроваджена система креативної освіти дала змогу значно поліпшити умови та результати освіти обдарованих дітей у НВК (школі-ліцеї) № 28.
Методи анкетування, тестування та спостереження навчального процесу з участю 66 ліцеїстів експериментальних класів засвідчили порівняно з контрольними класами:
- зростання пізнавального інтересу учнів до хімії, розуміння її соціальної значущості та професійної «хімічної» орієнтованості;
- розвиток творчого мислення, спостережливості та усвідомленості знань законів, теорій, уміння користуватися аналізом, порівнянням, виділяти головне в змісті, робити узагальнення;
- застосування різних видів доведень (прямих, опосередкованих, індуктивних, дедуктивних);
- готовність до свідомих і точних дій, а в окремих випадках — і автоматичних (наприклад, під час складання хімічних рівнянь тощо);
- розвиток кругозору та мови, в тому числі спеціальної хімічної, здатності аналізувати виступи свої та інших, брати участь у дискусіях, семінарах, конференціях тощо;
- розвиток самосвідомості та громадянської зрілості, розуміння нагальних проблем розвитку суспільства та життя природи.
Психологічно ліцеїсти експериментальних класів виявляли вишу цілеспрямованість, упевненість у собі, етичність і разом з тим безкомпромісність.
В ході дослідження ми ввели види уроків, які принципово відрізняють новітню педагогіку від авторитарної саме наявністю спеціальних тренінгових методик і особливим підходом до учня, як творчої особистості. Потім ми розробили структуру уроків за лекційно-семінарською системою, а також апробували психологічні і педагогічні прийоми організації навчально-дослідницької діяльності ліцеїстів, встановили її ефективність.
3.2 Результати експериментального навчання в класах з поглибленим вивченням хімії
Для педагогічного експерименту ми взяли 9 хіміко-біологічний клас НВК (школи ліцею) № 28, що навчався в 2003 році і провели в ньому зріз знань. Потім взяли результати цбого ж зрізу знань, але отримані в 2002 році при роботі з таким же 9 класом, що поглиблено вивчав хімію.
Перелік учнів подається в додатках.
Доекспериментальний рівень активності учнів був приблизно однаковий, учні добре засвоїли попередній матеріал. Курс викладався і в 2002-2003рр. за однією схемою і зріз знань давався за однаковими завданнями.
Потім ми взяли розроблену нами комплексну програму навчання по темі «Залізо та його сполуки» і запропонували її до вивчення у 9 класі 2003 року навчання. Перед цим учням пояснили суть експерименту, дали чіткі вказівки по проведенню підготовки до занять за новою системою. В класі були вивішені правила по проведенню семінарських занять.
Перед кожним семінаром чи дискусією в методичному куточку класу вивішувалась його тема, література для самопідготовки, ключові питання, основні терміни. Перед початком експерименту учням повідомили комплексну дидактичну мету.
Також в хімічному кабінеті була вивішена схема психотренінгу і діти на початку кожного уроку її повторювали, а при великих семінарських чи практичних заняттях її використовували під час валеологічної хвилини чи на перервах між модулями.
Заняття проводились по такій схемі (див. Розділ 2).
1. Ферум, будова атому Феруму. Фізичні властивості заліза.
2. Ферум в природі. Одержання заліза в лабораторії і промисловості.
Хімічні властивості заліза.
Сполуки феруму: оксиди, гідроксиди, солі. Якісні реакції на Fe2+ та Fe3+.
Семінарське заняття “Залізо та його сполуки”.
Сплави заліза: чавун і сталь. Застосування сплавів і сполук феруму.
Практична робота “Розв’язування розрахункових задач з теми “Метали”, “Залізо та його сполуки”.
Атестація з теми “Метали побічних підгруп. “Залізо”.
Також був проведений інтегрований урок хімії з географією “Металургійний
комплекс. Чорна металургія України”.
Впродовж всіх уроків йшла оцінка психологічного стану учнів за допомогою спеціальних піктограм.
На прикінці експерименту проведене психолого педагогічне дослідження “Відкритий мікрофон” в усній та письмовій формі.
Питання опитування:
Які якості особистості формуються, розвиваються, удосконалдюються в процесі виконання подібних завдань?
На яких або якому етапі уроку варто застосовувати такі методи?
Чи зацікавили вас ці вправи, завдання, якщо так, то чим?
Чи потрібно надалі проводити такі уроки тренінгу?
Після опрацювання психолого-педагогічних анкет ми отримали дуже схвальні
відповіді. Учням дуже сподобалося працювати у групах, створювати опорні конспекти, мати змогу самостійно покращити свою оцінку, зробити це в найкращій (найзручнішій) формі. Яку кожен обере сам.
Найбільше схвальних вигуків отримала дискусія, як форма проведення занять отже можна привести такий загальний реєстр відповідей.
“Відкритий мікрофон” Реєстр відповідей
|
Питання |
Відповіді |
|
1. Які якості особистості формуються, розвиваються та удосконалюються в процесі виконання подібних вправ? |
Самостійність, можливість вільно висловлювати свої думки, розвивається інтелект, спостережливість, логіка мислення, покращуються відносини з однокласниками, підвищується почуття власної гідності. “ідчуваєш себе розумнішим”розвивається мова, кругозір, починаєш краще розуміти природу, її екологічні проблеми: я навчився бути більш безкомпромісним відстоювати свою думку. Тепер я не боюся урока хімії, а йду на нього з радістю, бо я все зможу вивчити і зрозуміти – я ж не гірший від інших. |
|
2. На яких або якому етапі уроку варто застосовувати такі методи? |
На уроках всіх предметів, семінари проводити під час повторення великих тем. Дискусії – при вивченні спірних питань пов’язаних з виробництвом та економією. Опорні конспекти треба складати по всім темам, а потім можливо навіть створити свою книжку. |
|
3. Чи зацікавили вас ці вправи, якщо так, то чим? |
Було дуже цікаво, якщо раніше я боялася говорити, то зараз можу вільно спілкуватися. Дуже сподобався психотренінг та діаграми. Вчитися стало не так нудно, я зрозумів, що не такий це вже і страшний предмет – хімія, його легко зрозуміти якщо все розділити на частини і вивчити. Весело і зрозуміло. Можна швидко покращити оцінки. |
|
4. Чи потрібно надалі проводити такі тренінги? |
Так, побільше. |
Говорячи навчальну успішність учнів можна зробити такі висновки: в порівнянні з традиційним викладанням новий лекційно-семінарський комплекс викликав у учнів підвищений інтерес, всплеск активності, що позначилося на якості знань.
По результатам атестаційної роботи 9 клас 2003 року навчання підвищив свій останній рівень майже на 20%.
Результати показують, що успішність учнів змінилася в кращу сторону.
Кількість учнів, що навчалися на 10-12 балів збільшилася 25%, а кількість невстигаючих учнів зменшилася на 25%. Якість навчання учнів середнього рівня залишилася майже сталой.
3.3 Хід та організація дослідження в фізико-математичних класах
Проходивши педагогічну практику в НВК (школі-ліцею) № 28 ми виявили певну закономірність досліджуючі архівні документи школи і провівши опитування вчителів – більшість учнів фізико-математичних класів після закінчення школи пов’язують своє життя з хімічними, хіміко-технологічними спеціальностями. Це пов’язано з дуже сильною педагогічною, методичною базою школи. Тут працює вчитель вищої категорії Стародубцева Євдокія Григоріївна, яка з перших уроків змогла привити своїм учням любов до хімії. Діти добре навчаються, швидко освоюють хімічні знання.
Взагалі фізико-математичні класи вважаються в школі найбільш сильними, цікавляться факультативами з хімії, беруть участь в усіх природничих акціях. Дослідивши рівень знань 9 фізико-математичного класу 2003 року навчання ми запропонували їм провести такий же експеримент як і в хімічному класі.
Ми спеціально для математичного класу розробили лекційно-семінарський комплекс з теми “Залізо та його сполуки” з урахуванням особливостей класу та зменшеною кількістю годин.
Учням також пропонувалася система психотренінгу та діограм. Активно проводилася робота з опорними конспектами.
Наприкінці експерименту проводилася психолого-педагогічне дослідження “Відкритий мікрофон”. Також був проведений інтегрований урок хімії з географією “Металургайний комплекс”. Чорна металургія України”.
3.4 Результати дослідження в фізико-математичних класах
Після проведення експерименту в 9 фізико-математичному класі ми отримали гарні результати.
Успішність навчання покращилася на 25%. Діти дуже схвально відгукували про нову систему їм сподобалося спілкуватися, відстоювати свої думки.
Висновки
В цілому по дипломній роботі можна зробити такі висновки:
1. Наведено загальні відомості про шляхи й засоби підвищення ефективності навчальної діяльності в спеціалізованих класах з поглибленим вивченням хімії.
2. Розроблена методика модульного навчання у поєднанні з лекційно-семінарською системою при вивченні теми “Залізо та його сполуки”.
3. Описано зв’язки при викладанні математики й хімії при вивченні теми “Залізо та його сполуки”.
4. Здійснена розробка уроків модулів з теми “Залізо та його сполуки”.
5. Відмічені особливості використання опорних конспектів-схем на уроках хімії в спеціалізованих класах.
6. Розроблений конспект уроків, що дозволяє викладати хімію по лекційно-семінарській системі у фізико математичних класах
7. Створена особлива методика психотехніки, що дозволяє покращити психологічний клімат на уроці.
8. Запропоновані тренінгові методики, що активізують і інтенсифікують вивчання хімії за лекційно-семінарською системою.
9. Проведені експериментальні дослідження по впровадженню лекційно-семінарської системи при вивченні теми “Залізо та його сполуки”:
в класах з поглибленим вивченням хімії.
В фізико-математичних класах.
По матеріалам дипломної роботи написана стаття: “Шляхи і засоби
інтенсифікації навчального процесу при викладанні хімії за лекційно-семінарською системою в класах з поглибленим вивченням цього предмету”.
Література
Алентьєв Періодична система елементів Д.І. Менделєєва.- К.: "Рад.Школа", 1965-42,40с.
Ахметов Н.С. Актуальные вопросы курса неорганической химии: Кн. дляучителя.- М.: Просвещение, 1991.-224с.
Ахметов Н.С Неорганическая химия. Учеб.пособие для учащихся шк. суглубл. изуч. химии 8-9 кл В 2ч. 41. -3-е изд. - М.: Просвещение, 1992.-208с.
Ахметов Н.С О построении школьного курса химии и некоторыхфундаментальных понятиях науки// Химия в. шк. — 1995.- №5.-с. 11-15
Бондарь СП. Дидактичні засади гуманізацію процесу навчання// Біологія іхімія в шк. -1999. -№;.-с.13-17
Гольдфарб Я.Л. та ін. Збірник задач і вправ з хімії. Навчальний посібник дляучнів 8-11 кл.серед.шк./Я.Л. Гольдфарб, Ю.В. Ходаков, Ю.Б. Додонов.- 7 вид.,перероб - к.: Освіта, 1993.-221 с
Горский М.В. Обучение основам общей химии: Кн. для учителя: Из опытаработы,-М.: Просвещение.- 1991.-95с.
Кушнарёв А.А. Учимся решать задачи по химии задачи по физической
химии// Химия в шк. - 1995.-№2.-с.51-57
Методика викладання шкільного курсу хімії: Посібник для вчтеля/ Н.М.
Буринська, Л.П. Величко, Л.А. Липова та ін.; Під ред. Н.М. Буринської.-К.:
Методика преподавания хими: (Уч. пособие для пед ин-тов по хим. и биол.спец.) Н.Е. Кузнецова, В.П. Гаркунов, Д.П. Ерыгин и др.); под ред. Н.Е. Кузнецовой. М.: Просвещение, 1984.-415с.
Чайченко Н.Н. Методична система формування у школярів теоретичних знань на уроках хімії// Біологія і хімія в школе.- 1999.-№5.- с.35-39
Чернобельская Г.М. основы методики обучения химии: Учеб. пособие для студентов пед ин-тов.-М.6 Просвещение, 1987.-256с.
Шелинский Г.И. Основы теории химических процессов: Пособие для учителя.- М: Просвещение, 1989.-192с.
Шелінський Г.І. Удосконалювати зміст шкільного курсу хімії// Біологія і хімія в шк.-1999.-№2.-с. 12-18.
Ярошенко О.Г. Групова навчальна діяльність школярів: теорія і методика: (На матеріалі вивчення хімії).-К.: Партнёр, 1997.-208с.
Эрдниев п.м., Эрдниев Б.П Укрупнённые дидактические единицы в обучении математики: Книга для учителя.-М.: Просвещение, 1986.-255с.
Ярошенко О.Г., Коршак Т.Є. Перевір, як ти знаєш неорганічну хімію: Збірник тестів і тестових завдань для 8-10кл.-К.: Курс, 1998.-64с.
Момот Л.Л. Розвивальне навчання : методи і прийоми // Біологія і хімія в шк. -1999.-№2.-с.9-12
Програми для середніх загальноосвітніх шкіл. Фізика, Астрономія. 7-11 кл.-Київ: Перун, 1996.-140с.
Романова Н.В. Загальна та неорганічна хімія: Підручник для студентів вищ.навч.закладів.-Київ; Ірпінь: ВТП "Перун", 1998.-480с.
Супоницкая И.И., Гогоевская Н.И., Жантиева Н.А. Опорные схемы при систематизации знаний//Химия в.шк.-1998.-№ 6.-с.48-51
Усва А.В. Формирование у школьников научных понятий в процессе обучения.- М.: Педагогика, 1986.-173с.
Фельдман Ф.Г., Рудзітіс Г.Є. Хімія: Неорг.хімія: Підручник для 9 кл. серед.шк.- Рад. Шк.,1991 -175с.
Буринська Н. М. Тренувальні вправи з неорганічної хімії. — К.: Радянськашкола, 1979. — 153 с.
Голуб А. М. Загальна та неорганічна хімія. — Ч. І. — К.: ВидавництвоКиївського університету, 1971.
Голуб А. М. Загальна та неорганічна хімія. —Ч. II. — К.: Вища школа, 1971.
Капуцкий Ф. М., Тикавьш В. Ф. Пособие по химии для поступающих ввузы. — Минск: Вышейшая школа, 1986. — 416 с.
Кузьменко Н. Е., Еремин В. В., Попков В. А. Начала химии. Т. І, II. — М.:ОНИКС 21 век, 2001.
Кузьменко Н. Е., Еремин В. В. Сборник задач и упражнений по химии. — М.:ОНИКС 21 век, 2001. — 543 с.
Кузьменко Н. Е., Еремин В. В. Чуранов С. С. Сборник конкурсных задачпо химии. — М.: ОНИКС 21 век, 2001. — 575 с.
Луцевич Д. Д. Березан О. В. Конспект-довідник з хімії. — К.: Вища школа,1997.— 240с.
Пилипенко А. Т., Починок В. Я. и др. Справочник по элементарной химии. — К., 1985. — 559 с.
Романова Н. В. Загальна та неорганічна хімія. — К.: Ірпінь ВТФ «Перун»,1998. —742 с.
Свиридов В. В., Васильева Г. И. Сборник вопросов й упражнений по неорганической химии.— Минск: Вышейшая школа, 1967. — 233 с.
Степин Б. Д., Цветков А. А. Неорганическая химия. — М.: Высшая школа,1994. — 607 с.
Хомченко Г.П., Севастьянова К. И. Окислительно-восстановительныереакции. — М.: Просвещение, 1975. — 140 с.
Химия. Справочное руководство (перевод с немецкого). — Л.: Химия,1975. —573 с.
Шиманович Й. Е., Павлович М. Л. и другие. Общая химия в формулах,определениях, схемах. — Минск: Універсітзцкае, 1996. — 527 с.
Глинка Н.Л. Общая химия: Учебное пособие для вузов.-27 изд., стереотипное/Под редакцией Рабиновича-Л.: Химия, 1988.-704.с
Програми для середніх загальноосвітніх шкіл. Хімія. 8-11 кл.-Київ.: Перун, 1997.-31с.
Некрасов Б.В. Основы общей химии. — Т. I, И, III. — М.: Химия,1967.
Хоменко 1.Г. Збірник задач і вправ з хімії. Навч. посібник для середніх спец. навч. закладів. -К.: Вища шк.,1992.-246с.
Ахметов А.С. Общая и неорганическая химия. — М.: Высшая школа, 1998. —742 с.
Сухан В.В. та ін. Хімія для вступників до вузів. — Л.: Либідь, 1993. —406 с
Хомченко I.П. Хімія для вступників до вузів. -—Л.: Вища школа, 1991. —423 с.
Буринська Н.М., Величко Л.П. Хімія, 1 1 кл.: Підручник для середн.їзагальноосвіт. закладів. - Київ; Ірпінь: ВТФ "Перун", 1991.-176с.
Химическая энциклопедия В 5 т. Т.З Изд."Сов. энциклоп."
Василега М.Д. Окисно-відновні реакції. — К.: Радянська школа, 1992. — 117
Химия. Приложение к газете "Первое сентября 1988 год" № 25-28.-с.6-7 15.Філософський словник/ За ред. В.І. Шинкарука.- 2-е изд. перераб. 1 доп..-К: Голов.ред. УРЕ 1986-с. 506-507
Кузьменко Н.Е. Конкурсный екзамен по химии. — М: МГУ, 1994. —123 с.
Освіта, 1991.-с.350с
Неницеску К. Общая химия. — М. Мир, 1968. — 813 с.