Термодинамическое и статистическое описание классических равновесных ансамблей
Термодинамическое и статистическое описание классических равновесных ансамблей
Основания молекулярно-кинетической теории.
В настоящее время не вызывают сомнений утверждения, лежащие в основе молекулярно-кинетической теории:
1. Все тела состоят из относительно устойчивых частиц (молекул и атомов);
2. Молекулы находятся в постоянном хаотическом движении;
3. Молекулы взаимодействуют друг с другом.
Эти утверждения носят настолько общий характер, что невозможно указать небольшой набор каких-либо конкретных экспериментов, полностью их доказывающих.
В пользу первого положения прежде всего свидетельствуют сами факты существования таких разделов естествознания, как химия и молекулярная физика, в которых на оснолве гипотезы о молекулярном строении вещества делается множество конкретных выводов, прекрасно согласующихся с экспериментом. В физике имеется множество косвенных методов, позволяющих определять форму, размеры и расположение молекул, данные этих методов согласуются друг с другом. Созданный сравнительно недавно туннельный микроскоп позволяет визуализовать отдельные атомы и молекулы, расположенные на гладкой поверхности проводящего кристалла.
Предположение о хаотическом движении молекул впервые было высказано ботаником Броуном, наблюдавшим незначительные перемещения частичек пыльцы цветка, помещенных в жидкость. Методами своей науки Броун убедился в ошибочности своего исходного предположения, что частицы пыльцы являются живыми существами, обладающими способностью самостоятельного движения, и отнес причину их случайных блужданий к передаче импульса в результате случайных ударов со стороны хаотически перемещающихся молекул. Движением молекул объясняется явления диффузии (постепенного перемешивания различающихся веществ вблизи границы их соприкосновения), теплопередачи (постепенное выравнивание температур при соприкосновении горячих и холодных тел), распространения звука и др. В опыте Штерна была осуществлена непосредственная демонсрация движения молекул горячих паров металла и получена информация о скоростях этого движения.
Наличием взаимодействия молекул объясняется факт возможности существования вещества в различных агрегатных состояниях. Природа сил, возникающих между молекулами - электрическая. На больших расстояниях полярные молекулы притягиваются друг к другу как электрические диполи, на малых - притяжения сменяется отталкиванием близкорасположенных ядер (рис. 7_1). Как видно, существует два значения межмолекулярных расстояний, при которых любая пара молекул будет находиться в равновесии: Ro и бесконечность. В природе реализуются оба типа равновесных состояний. Первое относится к конденсированным состояниям вещества (т.е. жидкостям и твердым телам; различие между ними состоит в наличии кристаллической решетки у последних), второе - к газообразным состояниям. Очевидно, что при изменении объемов, занимаемых конденсированным веществом, неизбежно возникновение больших внутренних сил, обусловленных взаимодействиями между молекулами. Возрастание давления газов при изменении объема связано не с наличием сил взаимодействия между его молекулами, а с увеличением частоты ударов молекул о стенки сосуда.
Основные подходы к
описанию макроскопических порций
вещества. Поскольку вещество состоит
из частиц - молекул, возникает очевидное
желание получить описание его свойств
в результате решения динамической
задачи о движении всех частиц. Как уже
отмечалось, адекватное описание движения
микроскопических частиц возможно лишь
на языке вантовой механики. Однако в
случаях, когда частицы оказываются
почти свободными, описывающие их
уравнения квантовой механики переходят
в законы движения ньютона. Т.о. возникает
принципиальная возможность получить
правильное описание поведения вещества
в газообразной форме, используя подходы
классической физики. Реально подобная
динамическая задача не может быть решена
из-за фантастически большого числа
частиц, образующих макроскопические
порции вещества (например, в 1кг
молекулярного водорода число молекул
составляет
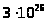
 ,
т.е. настолько огромно, что одна только
проблема записи результатов расчета
всех координат оказывается заведомо
невыполнимой).
,
т.е. настолько огромно, что одна только
проблема записи результатов расчета
всех координат оказывается заведомо
невыполнимой).
Более плодотворным оказался феноменологический подход к созданию теории вещества, состоящий в введении новых термодинамических характеристик, удобных для описания макроскопических ансамблей (массы, давления, температуры, объема и энтропии), и экспериментального исследования связей между ними. Основным результатом такого подхода была формулировка уравнения состояния идеального газа (уравнения Менделеева-Клайперона):
(1)
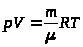
и уравнений теплового баланса, долгое время вполне удовлетворявших практическим потребностям теплофизики.
Несмотря на успехи, описанный подход не мог считаться удовлетворительным, поскольку не соответствовал принципу экономии мышления и содержал новые величины и понятия, никак не связанные с уже имевшимися в фундаментальных теориях. В результате был разработан статистический подход, являющийся своеобразным компромиссом между двумя рассмотренными. В его рамках ставится задача вычисления не набора динамических переменных всех частиц системы, а их средних значений. Эти средние сказываются тесно связанными с термодинамическими характеристиками вещества. Т.о. статистический подход позволяет установить более глубокий физический смысл феноменологически введенных термодинамических величин и объяснить природу связывающих их закономерностей.
Распределение Максвелла.
Первым удачным опытом реализации статистического подхода в теории вещества было решение задачи о распределении по скоростям молекул идеального газа (газа, расстояния между молекулами которого значительно превышают размеры молекул, и в котором притяжение молекул играет существенно меньшую роль, чем межмолекулярное отталкивание). Исходными предпосылками, позволившими решить задачу, были:
1.) Газ находится в состоянии термодинамического равновесия (т.е. его макроскопические параметры и средние значения микроскопических параметров не изменяются во времени).
2.) Все столкновения молекул происходят по законам упругого удара (т.е. при каждом столкновении выполняются законы сохранения импульса и механической энергии).
3.) Пространство, заполненное газом, является однородным и изотропным (это требование, например, предполагает отсутствие силы тяжести и каких-либо других внешних силовых полей).
4.) Молекулы обладают тремя степенями свободы (т.е. не способны вращаться и совершать колебаний).
5.) Движение молекул происходит независимо вдоль каждой из координатных осей.
Перечисленные
допущения позволили чисто математически
(без каких-либо дополнительных физических
требований) рассчитать функцию
распределения молекул по скоростям
 f(v),
с помощью которой вероятность обнаружения
молекулы, составляющие вектора скорости
которой лежат в интервалах
f(v),
с помощью которой вероятность обнаружения
молекулы, составляющие вектора скорости
которой лежат в интервалах
(1)
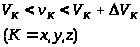 ,
,
вычисляется по формуле:
(2)
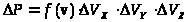 .
.
Найденное Максвеллом распределение имело вид:
(3)
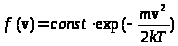 .
.
Соответствующие графики при различных абсолютных температурах приведены на рис. 7_1, из которых видно, что при любых температурах наибольшая вероятность соответствует скоростям молекул, лежащим в области нуля. Увеличение температуры вызывает лишь относительное увеличение доли быстрых молекул. При T->0 распределение локализуется в раионе точки v=0, что означает исчезновение теплового движения молекул.
Из полученного Максвеллом распределения (3) непосредственно следуют выражения, связывающие термодинамические величины (температуру и давление) с механическими (кинетическая энергия и концентрация частиц):
(4)
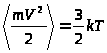 ,
,
(5)
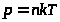 .
.
Из уравнений молекулярно-кинетической теории (4) и (5), в свою очередь, следует уравнение состояния идеального газа (1) и объясняются все имперически - найденные газовые законы (например, увеличение давления при нагревании происходит из-за того, что появившаяся группа более быстрых молекул чаще ударяет о стенки сосуда и передает им при каждом ударе больший импульс).
Разработанный Максвеллом подход позволил не только объяснить уже известные законы поведения газа, но и обобщить их на случаи, не описываемые уравнением состояния (1) (поведение газа в силовом поле и при концентрациях, когда приближение идеального газа становится неприменимым).
Распределение Больцмана является естественным обобщением (3) на случай газа, находящегося под действием внешних сил. При их отсутствии (и, следовательно, равной нулю потенциальной энергии) экспоненциальный множитель содержал отношение кинетической и средней тепловой энергий. Учет наличия сил, очевидно, может быть осуществлен заменой (3) на
(6)
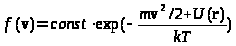 .
.
Так, поскольку вблизи поверхности Земли потенциальная энергия молекулы с массо m равна U=mgh, из (6) следует, что вероятность найти молекулу на определенной высоте (а вместе с ней и плотность и давление газа) уменьшается по экспоненциальному закону:
(7)
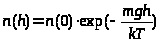
тем быстрее, чем больше масса молекул газа (рис. 7_2). На этом свойстве основаны многочисленные методы разделения смесей веществ с различными молекулярными весами (отстаивание и центрифугирование).
Нестабильность атмосфер планет. Предсказываемый формулой (7) экспоненциально-быстрый спад до 0 концентрации газа на больших высотах (сравнимых с радиусом планеты) оказывается ошибочным из-за того, что в указанной области приближеной выражение для потенциальной энергии U=mgh становится неприменимым. Подстановка точного выражения
(8)
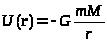
в (7) показывает, что даже при бесконечно-большом удалении от планеты концентрация газа не должна падать до нуля. Физически это означает, что газ из атмосфер планет должен перетекать в открытый космос до тех пор, пока там не установится конечное давление. Учитывая колоссальное различие объемов пустого космического пространства и атмосфер планет, из сказанного легко понять, что равновесные атмосферы у шарообразных космических тел невозможны. Скорость потери планетой ее атмосферы сильно зависит от ее температуры и массы: в космос улетают лишь те молекулы, чья скорость превосходит вторую космическую. Как видно из распределения Максвелла, вероятность обнаружить быструю молекулу весьма быстро спадает с увеличением скорости. Поэтому более массивные планеты (Земля, Венера) теряют свою атмосферу значительно медленнее, чем легкие (Марс, Луна).
Молекулярно-кинетическая теория и “первое начало термодинамики”.
Молекулярно-кинетическая теория позволила дать простое объяснение так называемому первому началу термодинамики. Этот весьма общий закон первоначально был сформулирован в результате обобщения опыта многочисленных неудачных попыток создания вечного двигателя первого рода - весьма привлекательного с экономической точки зрения технического устройства, способного производить механическую работу, большую чем подведенная к нему тепловая (или другая) энергия. Одной из формулировок первого начала является утверждение о невозможности подобного устройства, другой - закон сохранения энергии, записываемый в виде:
(9)

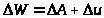 ,
,
где второе слагаемое описывает “невосполнимую потерю” части подведенной к устройству энергии.
Согласно общему закону сохранения, энергия не исчезает, а переходит в другие формы. С точки зрения молекулярно-кинетической теории введенная в (9) дополнительная величина u (т.н. внутренней энергия) имеет простой механический смысл и представляет собой сумму кинетических энергий теплового движения всех молекул и потенциальных энергий их взаимодействия. Т.о. часть подводимой к двигателю (или любой другой термодинамической системе) энергии тратится на ее нагревание.
Применение статистического подхода в других областях естествознания. Впоследствии объединенное распределении Максвелла-Больцмана было получено из весьма общих соображений, справедливых не только для идеальных газов, но и для других равновесных статистических ансамблей, в которых вероятность нахождения объекта в рассматриваемом состоянии не зависит от числа уже имеющихся объектов в этом состоянии. Так распределения типа (6) часто встречаются в физике плазмы, физике растворов, в химии, имеется опыт их успешного применения в таких мало похожих на идеальный газ системах, как, например, не связанные с атомами электроны в проводящих кристаллах и даже электронные оболочки атомов с большими порядковыми номерами. Представляется весьма вероятным, что сходные подходы могут быть плодотворными и в других областях, где сложность рассматриваемых систем не позволяет производить точные расчеты поведения каждого отдельного элемента - биологии, экономике, социологии (например, автору известны не претендующие на большую серьезность попытки физиков вывести аналогичные максвелловским функции распределения людей по деньгам, городов по населению и т.п.).
Список литературы
Для подготовки данной применялись материалы сети Интернет из общего доступа