Інсулін
Вищий навчальний заклад
ЗАПОРІЗЬКИЙ НАЦІОНАЛЬНИЙ
УНІВЕРСИТЕТ
Міністерства освіти та науки України
Реферат:
На тему: " Інсулін"
Підготувала: студентка 3го курсу
Біологічного факультету
Гр. 7336-Б
Уляніцька Г. В.
Перевірила: Генчева Вікторія
Іванівна
Запоріжжя 2009
Зміст
Вступ 3
Відкриття та дослідження молекули інсуліну 6
Будова молекули інсуліну 9
Біосинтез інсуліну, регуляція секреції інсуліну 10
Перетворення інсуліну в організмі 13
Біологічна дія інсуліну 17
Порушення в синтезі, і секреції інсуліну 19
Методи визначення інсуліну 26
Препарати інсуліну 28
Інсулінова проба 29
Висновок 31
Список використаної літератури 32
Вступ
Основною ознакою будови залоз внутрішньої секреції є відсутність вивідних проток, тому їхні секрети виділяються безпосередньо у кров або лімфу, що їх омиває. Кількість цих секретів невелика, називаються вони гормонами (від грецького слова, яке означає «збудження»). Науку, що вивчає будову, функції і захворювання залоз внутрішньої секреції, називають ендокринологією.
До залоз внутрішньої секреції відносяться: гіпофіз, щитовидна, прищитовидні, шишковидна (епіфіз), вилочкова (тімус), наднирники, статеві і підшлункова. Останні дві одночасно є і залозами зовнішньої секреції, тому їх називають змішаними. Значення залоз внутрішньої секреції. Поняття про гормони. Роль гормональної регуляції в організмі. Гормони — це біологічно активні речовини, які в невеликих кількостях здатні робити на організм значний вплив.
Гормони характеризуються специфічністю, тобто кожний гормон виконує певну функцію і не торкається інших. Гормони, надходячи в кров, виконують свою роль далеко від місця синтезу. В швидкості виникнення ефекту гормони поступаються лише нервовій системі.
Хімічна природа гормонів неоднорідна: видозмінені амінокислоти, білки, поліпептиди, стероїди (органічні сполуки, які належать до групи складних ліпідів, що не піддаються омиленню) та ін. Так, тироксин щитовидної залози є йодованою амінокислотою; інсулін, глюкагон підшлункової залози, соматотропний гормон (росту) гіпофізу — білки; адреналін, норадреналін наднирників — катехоламіни (азотомісні органічні сполуки, що утворюються в клітинах організмів з амінокислот у процесі декарбоксилювання) гормони статевих залоз: естрадіол, тестостерон — стероїди.
Гормони мають сильний вплив на регуляцію обміну речовин, росту, статевого розвитку, функцій окремих органів. Одні гормони здатні підсилювати функцію, а інші — послаблювати. Отже, завдяки гормонам, що виробляються в залозах внутрішньої секреції, здійснюється регуляція життєдіяльності організму.
У круглоротих залозисті клітини, гомологічні ендокринним панкреацитам, локалізуються в епітелії слизової оболонки кишки, а інсулярний апарат - у власному шарі або в сполучній тканині, яка оточує кишку. Проте у міксин інсулярний апарат утворюється за рахунок скупчення ендокринних клітин і навколо протоки жовчного міхура.
У риб клітинний матеріал, який секретує травні ферменти і гормони, виходить за межі стінки кишки і формується як самостійний орган. У підшлунковій залозі ендокринні клітини розміщуються вздовж середніх і дрібних вивідних проток, оточують їх у вигляді муфти. Чітко ідентифікуються три самостійні типи гормонопродукувальних клітин - А-, В- і В-клітини.
У земноводних ендокринна частина підшлункової залози утворена панкреатичними острівцями, які переважно локалізуються у хвостовій частині залози.
Як і у земноводних, у плазунів ендокринна частина підшлункової залози утворена гормонопродукувальними клітинами, проте залишаються й елементи, властиві хрящовим і костистим рибам.
У підшлунковій залозі птахів значно зростає контрінсулярний компонент її ендокринної частини; це призводить до того, що глюкагону в ній міститься в 10 разів більше, ніж інсуліну. У птахів відбувається повне розділення інсулярного і контрінсулярного апарату, яке розпочалося у рептилій. Очевидно, зазначені зміни забезпечують підтримання високого рівня глікемії і створення певного метаболізму, викликаних екологічними особливостями птахів.
Підшлункова залоза ссавців утворена різними клітинами. Проте тільки А-, В- і В-клітини властиві ссавцям. А-клітини секретують глюкагон, В-клітини секретують інсулін. У всіх ссавців ендокринна частина залози структурно організована у вигляді панкреатичних острівців.
Більш детально я б хотіла розглянути гормон підшлункової залози – інсулін.
Інсулін (від лат. insula — острів) — гормон пептидної природи, що утворюється в бета-клітинах острівців Лангерганса підшлункової залози. Робить багатогранний вплив на обмін речовин практично у всіх тканинах. Основна дія інсуліну полягає в зниженні концентрації глюкози в крові.
Ключеві слова: ендокринологія, залози внутрішньої секреції, гормони, інсулін, острівці Лангерганса, амінокислотний залишок, поліпептид, інсулоцити, цукровий діабет, інсулома, гіпоглікемія, синдром 3оллінгера—Еллісона інсулінова проба, обмін речовин, біосинтез, секреція.
Відкриття та дослідження молекули інсуліну
У 1869 році в Берліні 22-річний студент-медик Поль Лангерганс досліджуючи за допомогою нового мікроскопу будову підшлункової залози, звернув увагу на раніше не відомі клітини, створюючі групи, які були рівномірно розподілені по всій залозі. Призначення цих «маленьких купок клітин», надалі відомих як «острівці Лангерганса», було не зрозуміле, але пізніше Едуад Лагус показав, що в них утворюється секрет, який грає роль в регуляції травлення.
У 1889 році німецький фізіолог Оскар Мінковський (Oscar Minkowski) щоб показати, що значення підшлункової залози в травленні надумане, поставив експеримент, в якому провів видалення залози у здорового собаки. Через декілька днів після початку експерименту, помічник Мінковські, який стежив за лабораторними тваринами, звернув увагу на велику кількість мух, які зліталися на сечу піддослідного собаки. Дослідивши сечу, він виявив, що собака з сечею виділяє цукор. Це було перше спостереження, що дозволило зв'язати роботу підшлункової залози і цукровий діабет. У 1901 році був зроблений наступний важливий крок, Евген Опі (Eugene Opie) чітко показав, що «цукровий діабет обумовлений руйнуванням острівців підшлункової залози, і виникає тільки коли ці тільця частково або повністю зруйновані». Зв'язок між цукровим діабетом і підшлунковою залозою був відомий і раніше, але до цього не було ясно, що діабет пов'язаний саме з острівцями Лангерганса.
У наступні два десятиліття було зроблено декілька спроб виділити острівковий секрет як потенційні ліки. У 1906 році Георг Цюльцер (Georg Ludwig Zülzer) досяг деякого успіху в зниженні рівня глюкози в крові піддослідних собак панкреатичним екстрактом, але не міг продовжити свою роботу. Е Скотт (E.L. Scott) між 1911 і 1912 роками в Чиказькому університеті використовував водний екстракт підшлункової залози і відзначав «деяке зменшення глікози», але він не зміг переконати свого керівника у важливості своїх досліджень, і незабаром ці експерименти були припинені. Такий же ефект демонстрував і Ізраель Кляйнер в Рекфелірівському університеті в 1919 році, але його робота була перервана початком Першої світової війни, і він не зміг її завершити. Схожу роботу після дослідів у Франції в 1921 році опублікував і професор фізіології Румунської школи медицини Никола Паулеско, і багато хто, особливо в Румунії, вважають саме його першовідкривачем інсуліну.
Проте практичне виділення інсуліну належить групі вчених Торонтського університету. У жовтні 1920 року Фредерик Бантінг прочитав в роботах Мінковського про те, що якщо у собак перешкоджати виділенню травного соку з підшлункової залози, то залізисті клітки незабаром гинуть, а острівці залишаються живими, і цукровий діабет у тварин не розвивається. Цей цікавий факт примусив його задуматися над можливістю виділення із залози невідомого чинника, сприяючого зниженню рівня цукру в крові. З його записок: «Перев'язати собаці панкреатичну протоку. Залишити собаку, поки не руйнуватимуться ацинуси і залишаться тільки острівці. Спробувати виділити внутрішній секрет і подіяти на глікозурію»
У Торонто Бантінг зустрівся з Дж. Маклаудом (J. Macleod) і виклав йому свої міркування в надії заручитися його підтримкою і отримати необхідне для роботи устаткування. Ідея Бантінга спершу здалася професорові абсурдною і навіть смішною. Але молодому ученому таки вдалося переконати Маклауда підтримати проект. І літом 1921 року він надав Бантінгу університетську лабораторію і асистента, 22-річного Чарльза Беста, а також виділив йому 10 собак. Їх метод полягав в тому, що навколо вивідної протоки підшлункової залози затягувалася лігатура, перешкоджаючи виділенню із залози панкреатичного соку, і опісля декілька тижнів, коли зовнішнєсекреторні клітини загинули, в живих залишалися тисячі острівців, з яких їм вдалося виділити білок, який достовірно знижував рівень цукру в крові у собак з видаленою підшлунковою залозою. Спершу його назвали «айлетін».
Після повернення з Європи, Маклауд оцінив значення всії виконанної його підлеглим роботи, проте для того, щоб бути повністю упевненим в ефективності методу, професор зажадав ще раз переробити експеримент при собі. І опісля декілька тижнів, було ясно, що друга спроба також успішна. Проте виділення і очищення «айлетіну» з підшлункових залоз собак було надзвичайно трудомісткою і тривалою роботою. Бантінг вирішив спробувати використовувати як джерело підшлункові залози ембріони телят, в яких ще не виробляються травні ферменти, але вже синтезується достатня кількість інсуліну. Це істотно полегшило роботу. Після рішення проблеми з джерелом інсуліну, наступним важливим завданням стало очищення білку. Для її вирішення в грудні 1921 року Маклауд привернув блискучого біохіміка, Джеймса Колліпа, який у результаті зумів розробити ефективний метод очищення інсуліну.
11 січня 1922 року, після безлічі успішних випробувань з собаками, страждаючому діабетом 14-річному Леонарду Томпсону була зроблена перша в історії ін'єкція інсуліну. Проте перший досвід застосування інсуліну виявився невдалим. Екстракт опинився недостатньо очищеним, і це привело до розвитку алергії, тому ін'єкції інсуліну були припинені. Наступні 12 днів Колліп напружено працював в лабораторії над поліпшенням екстракту. А 23 січня Леонарду була введена друга доза інсуліну. Цього разу, успіх був повним, не тільки не було явних побічних дій, але і у хворого перестав прогресувати діабет. Проте надалі Бантінг і Бест не спрацьовували з Колліпом і незабаром з ним розлучилися.
Було потрібно навчитися отримувати великі кількості чистого інсуліну. І перш ніж був знайдений ефективний спосіб швидкого промислового отримання інсуліну, була проведена дуже велика робота. Важливу роль в цьому зіграло знайомство Бантінга з Елі Ліллі, майбутнім засновником найбільшої фармакологічної компанії.
За це революційне відкриття Маклауд і Бантінг в 1923 році були удостоєні Нобелевскої премії з фізіології і медицини. Бантінг спершу був сильно обурений, що його помічник Бест не був представлений до нагороди разом з ним, і спочатку навіть демонстративно відмовився від грошей, але потім все ж таки погодився прийняти премію, і свою частину урочисто розділив з Бестом. Також поступив і Маклауд, поділивши свою премію з Колліпом. А патент на інсулін був проданий Торонтскому університету за один долар, і незабаром почалося виробництво інсуліну в промислових масштабах.
Заслуга за визначення точної послідовності амінокислот, створюючих молекулу інсуліну (так звана первинна структура) належить британському молекулярному біологові Фредеріку Сенгеру. Інсулін став першим білком, для якого була повністю визначена первинна структура. За виконану роботу в 1958 році він був удостоєний Нобелівської премії з хімії. А через майже 40 років Дороті Кроуфут Ходжкин за допомогою методу рентгенівської дифракції визначила просторову будову (третинну структуру) молекули інсуліну. Її роботи також відмічені Нобелівською премією.
Будова молекули інсуліну
Відносна молекулярна маса мономера інсуліну складає близько 6000.
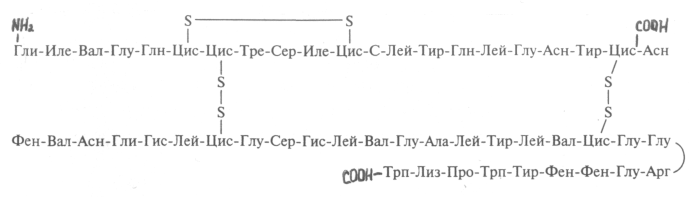
Молекула інсуліну утворена двома поліпептіднимі ланцюжками, що містять 51 амінокислотний залишок: ланцюг з N-кінцевим гліцином називається A-ланцюжок, складається з 21 амінокислотного залишку, B-ланцюжок утворений 30 амінокислотними залишками. Поліпептідні ланцюжки з'єднуються двома дисульфідними містками через залишки цистєїну, третій дисульфідний зв'язок розташований в A-ланцюжку.
Цілісність дисульфідного зв’язку грає велику роль у збереженні біологічної активності молекули інсуліну.
Первинна структура інсуліну у різних біологічних видів трохи відрізняється, як відрізняється і його важливість в регуляції обміну вуглеводів. Найбільш близьким до людського є інсулін свині, який розрізняється всього одним амінокислотним залишком: у 30 положенні B-ланцюжка свинячого інсуліну розташований аланін, а в інсуліні людини — треонін; бичачий інсулін відрізняється трьома амінокислотними залишками; а у риб у порівнянні з тваринним В-ланцюг більше і має 32 амінокислотних залишки.
Близько 25 амінокислот ідентичні у всіх хребетних. У зв’язку з цим імунологічні відмінності інсулінів людини і тварин невеликі, що дає можливість застосовувати в клініці інсуліни тваринного походження (бичий, свинячий).
Проте при тривалому застосуванні препаратів чужерідного походження інсуліну може все ж проявлятись антигенність гормону, в результаті чого у хворих розвивається високий титр антиінсулінових антитіл і ефективність інсуліну різко падає. У таких випадках необхідно застосовувати інсулін іншого походження.
Молекула інсуліну людини
Біосинтез інсуліну, регуляція секреції інсуліну
Інсулін синтезується у базофільних інсулоцитах ( β-клітинах)острівців Лангерганса підшлункової залози із свого попередника – проінсуліну.
Синтез інсуліну відбувається в β-клітках і починається з утворення на рибосомах одноланцюжкового пептиду, що складається з 104—110 амінокислотних залишків, — препроінсуліну. Ця молекула включає А-ланцюг, В-ланцюг і розташований між ними вставний С-пептид. Препроінсулін потрапляє в шорсткий ендоплазматичний ретікулум, по якому пересувається до секреторних гранул. У цистернах шорсткого ендоплазматичного ретікулума відбувається відщеплювання частини молекули і залишається преінсулін, що складається з 81—86 амінокислотних залишків. У комплексі Гольджі відбувається упаковка гормону в секреторні гранули, в яких проінсулін піддається подальшому протеолітичному розщепленню. В результаті відщеплюються С-псптид і два діпептида, сполучаючі С-пептид з фрагментами А і В, а ланцюги А і В з'єднуються дисульфідними містками, утворюючи молекулу двохланцюгового інсуліну. У секреторних гранулах виявляються проінсулін, частково розщеплений проінсулін, інсулін і С-пептид. Всі вони виводяться з β-клітин в кров.
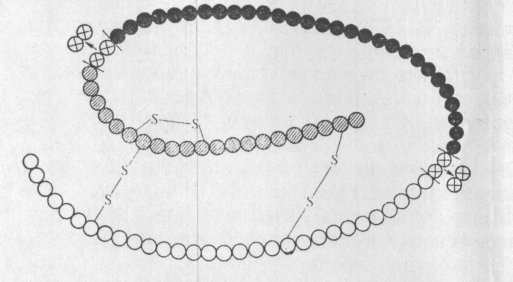
Схема розщеплення проінсуліну.
Кожен кружок показує амінокислотний залишок.
Чорні кружки – С-ланцюг, сірі – А-ланцюг, білі – В-ланцюг, перехрещені – дипептиди, вищепленні в процесі утворення активного гормона.
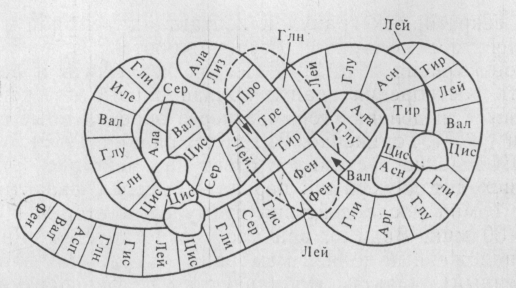
Поліпептидна основа молекули інсуліну (первинна структура) згорнута спіралеобразно (вторинна структура), а спіралі, у свою чергу, згущуються в складні утворення, що визначають просторову конфігурацію молекули інсуліну або її третинну структуру.
Просторова конфігурація молекули бичого інсуліну
Інсулін і проінсулін легко полімеризуються, утворюючи димери, тримери, гексамери. Полімеризація відбувається шляхом комплексирування з цинком. При цьому утворюються малорозчинні комплекси, і гормон депонується в секреторних гранулах. Гормон, що депонує, — резерв, який може бути швидко реалізований під впливом відповідного стимулу.
Секреторні гранули (тример Zn-інсулін)
Секреторні гранули забезпечують і внутриклітинний транспорт гормону. Гранули пересуваються за системою мікротрубочок і мікрофіламентів у напрямку до плазматичної мембрани (Леци і соавт., 1973). Мембрана гранули і плазматична мембрана з'єднуються, а матеріал, що міститься в гранулах, викидається в позаклітинний простір, тобто відбувається еміоцитоз.

Секреторний процес в інсулоциті ( за Леці, 1972)
Важливо відзначити, що рух секреторних гранул і контакт їх мембран з плазматичною мембраною здійснюються за участю іонів кальцію і цАМФ. Не можна виключити і можливість розчинення гранул поблизу плазматичної мембрани і виділення гормону через певні її ділянки (У. М. Гордієнко, В. Р. Козиріцкий, 1978).
Виведення інсуліну у відповідь на дію стимулу відбувається двофазний: перша — швидка фаза (протягом 1хв після дії стимулу) і друга — через 20—30хв. Мабуть, спочатку секретується інсулін, розташований поблизу мембрани (у гранулах або розчинений), а потім мобілізуються і транспортуються секреторні гранули за системою мікротрубочок і мікрофіламентов.
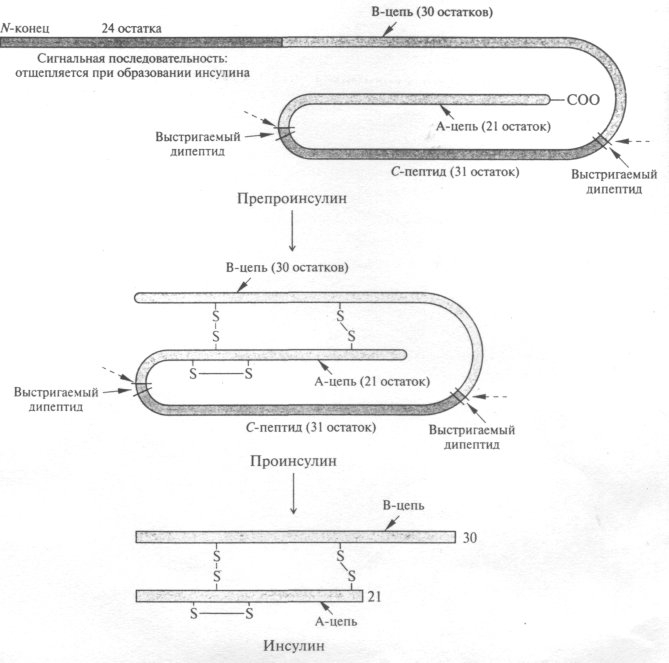
Процесинг інсуліну у підшлунковій залозі
Перетворення інсуліну в організмі
З β-клітин інсуліну поступає в кров, де міститься у двох формах: вільною і зв'язаною з білками (Антоніаді, 1961 — 1964). Вільний інсулін проявляє дію на всі інсуліночуттєві тканини (м'язи, жирова тканина, печінка, мозок), а зв'язаний — тільки на жирову тканину, що володіє здатністю звільняти інсулін від зв'язку з білком. Між змістом вільного і зв'язаного інсуліну існує динамічна рівновага: при підвищеній потребі організму в інсуліні (наприклад, після їжі солодкої їжі) збільшується кількість вільної фракції і зменшується зміст зв'язаного інсуліну, а натщесерце переважає зв'язаний інсулін.
Скріплення інсуліну має великий фізіологічний сенс. По-перше, якби інсулін знаходився тільки у вільному вигляді, то він захоплювався б головним чином м'язовою тканиною і не встигав поступати в жирову тканину, де украй необхідний. По-друге, з’єднання інсуліну створює певний резерв гормону, який може бути мобілізований при надмірному постачанні або утворенні вільних вуглеводів. І, по-третє, скріплення інсуліну оберігає тканини від його надмірної дії, оскільки зв'язаний інсулін, що має молекулярну масу 50000—100000, не володіє такою здатністю проходити через судинну стінку, як вільний.
Крім вільного і зв'язаного інсуліну, описана ще одна форма гормону, умовно названа формою А (Л. До. Старосельцева, 1971—1972). Ця форма за біологічними і физико-хімічними властивостями займає як би проміжне положення між вільним і зв’язаним інсуліном. Передбачається, що форма А уцтворюється в тих випадках, коли потрібне швидке задоволення потребі організму в інсуліні.
Як указувалося, разом з інсуліном в кров поступають проінсулін і С-пептид.
Проінсулін реагує зі всіма інсулінчуттєвими тканинами, але биологічна активність його значно менша, ніж у инсуліна. У нормі в периферичній крові проінсулін складає не більше 20% загального іммунореактивного інсуліну, а в патологічних умовах кількість його і С-пептида може значно зростати. Відповідно знижується біологічний ефект інсуліну.
У здорової людини вміст інсуліну в плазмі крові натщесерце, визначуване радіоімунологічними методами, складає приблизно 5—26 мк МЕ/мл або 1,25±0,08 нг/мл. Попереднє голодування знижує його, а тривале надмірне введення їжі, особливо багатої на вуглеводи, збільшує.
Секретованний підшлунковою залозою інсулін поступає по комірній вені спочатку в печінку, де затримується близько 50% гормону.
Руйнування інсуліну здійснюється ферментом інсуліназою, що знаходиться в найбільшій кількості в печінці і нирках, а продукти розпаду виводяться з сечею. Біологічне значення цього ферменту полягає в тому, що він оберігає організм від надмірного надходження інсуліну в загальний круг кровообігу і пов’язаних з цим порушень обміну вуглеводів (гіпоглікемія). Цікаво, що активність інсулінузи виявляє вікові відмінності. У молодих статевонезрілих щурів активність інсулінузи значно менша, ніж у дорослих тварин. Мабуть, це має важливий фізіологічний сенс, оскільки «зберігає» інсулін для підвищених потреб організму, що росте (З. М. Лейтес, Н. П. Смирнов, 1959).
При старінні активність інсулінузи знижується (В. В. Фролькис і ін., 1968), що розцінюється як своєрідний пристосовний механізм, направлений на підтримку постійного рівня цукру в крові.
Регуляція секреції інсуліну здійснюється головним чином гуморальним шляхом. Найважливішим стимулом секреції інсуліну є рівень глюкози в крові. Підвищення його підсилює секрецію інсуліну, а зниження — гальмує. Це можна показати навіть на ізольованій з організму підшлунковій залозі, поміщеною в живильне середовище. З цією метою через судини ізольованої залози пропускають розчини глюкози різної концентрації і визначають кількість виділеного інсуліну. При пропусканні рідини з концентрацією глюкози 40—50 мг% інсулін не виділяється, а при перфузії рідиною із змістом глюкози 300— 500 мг% підшлункова залоза активно секретує його. Таким чином β-клітини острівців Лангерганса чутливі до рівня цукру в крові. Після внутрішньовенного введення глюкози вміст інсуліну в крові підвищується вже через 1 хв.
Механізм стимулюючого впливу на секрецію інсуліну вивчений ще не повністю. Вважають, що глюкоза служить первинним сигналом, що запускає клітинні механізми секреції (Гродські і соавт., 1975). Разом з цим в β-клітині утворюються метаболіти глюкози, які підтримують рівень секреції. Дія глюкози на секрецію інсуліну опосередкує через цАМФ і іонізований кальцій. Окрім глюкози секрецію інсуліну може збільшувати введення деяких амінокислот, особливо аргініну.
Показано також, що інтенсивність секреції інсуліну залежить від його рівня в крові: зниження служить могутнім стимулом секреції нових кількостей інсуліну. Отже, можна говорити про ауторегуляцю секреції інсуліну (Різер, 1967).
Виражений активуючий вплив на секрецію інсуліну роблять гормони травної системи — секретін, гастрін, кишковий глюкагон (ентероглюкагон), холецистокинін — панкреозимін.
З гормонів інших залоз внутрішньої секреції до стимуляторів секреції інсуліну відносять соматотропін, кортікотропін, глюкокортикоїди (гормони кори надниркових). Гальмують секрецію інсуліну соматостатін, кальцитонін, адреналін і норадреналін.
Нервова регуляція секреції інсуліну здійснюється через посредство блукаючого і симпатичного нервів. Збудження блукаючого нерва стимулює секрецію інсуліну, а симпатичних нервових волокон— гальмує його.
Багатьма дослідниками вивчався вплив вищих відділів нервової системи на секрецію інсуліну. М. І. Митюшов (1964) отримав зниження рівня глюкози в крові у відповідь на дію умовних подразників, що сигналізують про харчове введення цукру. Їм же було показано, що гіпнотичне навіювання прийому цукру викликає пониження концентрації глюкози в крові. Оскільки зменшення рівня глюкози в крові — типовий ефект інсуліну, ці результати тлумачили як показник стимулюючого впливу кіркових центрів на секрецію інсуліну. Виявлена також певна роль гіпоталамуса у впливі на островковий апарат. Проте до цих пір важко визначити, якою мірою відбувається передача нервових впливів до β-кліток прямим нервово-провідниковим шляхом, в якій опосередковано через гуморальну ланку (зміна секреторній активності інших залоз, зрушення концентрації глюкози в крові). Потрібно вважати, що основоположне значення для секреції інсуліну має все ж таки гуморальна регуляція, оскільки перерізання гілок блукаючих нервів іннервуючих підшлункову залозу, а также хімічна блокада проведення нервових по вегетативним нервам тільки загальмовує, але не вимикає повністю секрецію інсуліну у відповідь на внутрішньовенне введення глюкози (І. А. Држевецкая, Н. Н. Транквілітаті, 1973).
Біологічна дія інсуліну
Інсулін володіє широким спектром дії на обмін речовин. Коротко узагальню аспекти його впливу.
Перш за все слід вказати, що інсулін — єдиний цукрознижуючий гормон. Після його введення в організм рівень глюкози в крові знижується, тобто виникає інсулінова гіпоглікемія, ступінь якої залежить значною мірою від дози гормону. Слідує, проте, обмовитися, що величину і тривалість зниження рівня глюкози визначає не тільки доза інсуліну, але і противорегуляторний ефект, що надається іншими гормонами, а також чутливість тканин до інсуліну. У основі гіпоглікемічної дії інсуліну лежить багато конкретних ефектів цього гормону. Так, він підсилює утилізацію глюкози в м'язах, печінці, жировій і інших тканинах; стимулює відкладення глікогену в м'язах і печінці і гальмує його розпад. У скелетних м'язах і міокарді сприяє накопиченню АТФ, тим самим підсилюючи їх енергетичний потенціал.
Інсулін надає важливий регуляторний вплив і на обмін ліпідів: стимулює утворення тригліцеридів і депонування ліпідів в жировій тканині, гальмує ліполіз. За сучасними уявленнями в основі деяких форм ожиріння лежить підвищена секреція інсуліну (гиперінсулінізм) або наднормальне скріплення інсуліну жировими клітками.
Інсуліну належить істотне значення в регуляції обміну білків. Він підсилює транспорт амінокислот через мембрани кліток (особливо м’язових ), стимулює синтез білка, виступає як синергіст системи соматотропії — соматомедіни в протеосинтезі. Він не тільки сприяє реалізації впливу анаболізму соматотропіна, але і активує його секрецію.
Підраховано, що інсулін бере участь принаймні в 22 реакціях обміну речовин. Ця різноманітність і незалежність окремих ефектів інсуліну примушує думати про існування єдиного механізму його дії. Питання це ще не вивчене повною мірою. В даний час найбільш визнана гіпотеза про мембранну дію інсуліну. Відповідно до цієї гіпотези (Родбелл і соавт., 1968) інсулін, як і всі гормони пептидної структури, взаємодіє з рецептором плазматичної мембрани. В результаті активується аденілциклазний механізм, що приводить зрештою до появи ряду ефектів.
1. Збільшується проникність клітинних мембран для моносахаридів (особливо глюкози) і амінокислот, унаслідок чого проникнення їх з позаклітинного середовища в клітку збільшується. У основі цього ефекту лежить зміна структур плазматичних мембран інсуліночуттевих клітин, можливо, завдяки пов'язанню сульфгідрильних груп гормону з компонентами мембрани (Різер, 1967). Одночасно виникає гиперполяризація мембран.
2. Змінюється внутрішньоклітинна концентрація цАМФ — основного посередника, що передає гормональний сигнал до внутріклітинних ферментів. Це приводить до активування ключових ферментів гліколізу, індукції синтезу глюкокінази, активуванню окислення глюкози пентозофосфатним шляхом (У. З. Ільін, 1965; З. М. Лейтес, Н. Н. Лаптева, 1967). Підвищується активність глікогенсинтетази печінки і м'язів, а також ліпосинтетичних ферментів. Навпаки, знижується активність ряду ферментів катаболічної дії.
Приведена схема, зрозуміло, не розкриває достатньо детально механізм дії інсуліну. Вивчення його вимагає проведення подальших досліджень як на організменому, так і клітинному і субклітинному рівнях.
Порушення в синтезі, і секреції інсуліну
Порушення можуть бути різного характеру і мати різне походження. Так, недостатня секреції інсуліну приводить до гіперглікемії і розвитку цукрового діабету. Надлишкове утворення інсуліну, спостерігається, напр.. при гормонально-активній пухлині, витікаючою з β-клітин панкріатичних острівців (див. далі Інсулома) і виражається клінічно симптомами гіперінсулінізма.
Цукровий діабет, (лат. diabetes mellitus) часто просто діабет ( «надмірне сечовипускання») — синдром, який характеризується порушенням обміну речовин і високим рівнем цукру в крові натще (гіперглікемія), що відбувається внаслідок низького рівня гормону інсуліну чи патологічній протидії ефектам інсуліну разом з недостатнім рівнем його секреції. Характерні симптоми – надмірне виділення сечі (поліурія), збільшене відчуття спраги та затьмарений зір. Ці симптоми можуть бути відсутні, якщо рівень цукру в крові не надмірно великий.
Всесвітня Організація Охорони Здоров’я визначає три основні форми цукрового діабету: тип 1, тип 2, та гестаційний діабет (трапляється під час вагітності), які мають різні причини й поширення серед населення. Незважаючи на те, що, зрештою, усі обумовлені нездатністю бета клітин підшлункової залози виробляти інсулін, щоб запобігти гіперглікемії, причини різні. Тип 2 діабету характеризується опором до інсуліну «тканин-мішеней». Це спричинює потребу в дуже високій кількості інсуліну й діабет розвивається, коли бета клітини не можуть задовольнити потребу. Гестаційний діабет подібний до типу 2 і також викликає опір до інсуліну; гормони під час вагітності спричинюють опір до інсуліну в жінок, які генетично схильні до цього.
Гестаційний діабет звичайно зникає з народженням дитини, однак діабет типів 1 і 2 — хронічні захворювання. Всі типи піддаються лікуванню з 1921 р., коли став доступний інсулін у вигляді ліків. Типом 2 можна керувати поєднанням із дієтичного харчування, таблеток, ін'єкцій та частим поповненням інсуліну. У ХХ ст. інсулін виготовляли з натуральних джерел, таких як свинячі підшлункові залози. Зараз більшість інсуліну виробляють, використовуючи генетичну інженерію, як точну копію людського інсуліну чи людського інсуліну з модифікованими молекулами, що дозволяє регулювати силу та тривалість дії. Інсулін також можна доставляти в організм, використовуючи спеціальну помпу, яка вводить інсулін через катетер.
Діабет може спричинити багато ускладнень. Гострі ускладнення (гіпоглікемія, кетоацидоз чи гіперосмолярна кома) можуть статися, якщо хворобу недостатньо контролюють. Серйозні довгострокові ускладнення можуть включаючи подвійний ризик серцево-судинної хвороби, хронічну ниркову недостатність, пошкодження сітківки ока (що може призвести до сліпоти), пошкодження капілярних судин, що призводить до імпотенції та поганого загоєння ран. Погане загоєння ран, особливо на ступнях, може призвести до гангрени з подальшою ампутацією. Достатній догляд за діабетом, так само як і посилений контроль за кров’яним тиском і факторами стилю життя (такі як некуріння й догляд за здоров’ям) може зменшити ризик більшості вищеназваних ускладнень. У сучасному світі діабет — одна з найзначніших причин, яка спричинює сліпоту в дорослих у нелітньому віці, причина нетравматичних ампутацій, а також діабетична нефропатія – основна хвороба, яка потребує гемодіаналізу.
Термін діабет без уточнення часто вживають для цукрового діабету, який зв’язаний із дуже високим рівнем цукру в сечі, але є й інші хвороби, які називають діабет. Найвідоміший із них нецукровий діабет, при якому цукру в сечі немає: він може бути викликаний порушенням нирок або гіпофізу.
Дві найвідоміші ідіопатичні форми діабету це типи 1 і 2. Термін діабет першого типу замінив деякі попередні терміни, такі як дитячо-юнацький діабет та інсулінозалежний діабет. Так само, як термін діабет другого типу замінив терміни дорослий діабет, діабет, пов'язаний з ожирінням та інсулінонезалежний діабет. Крім цих двох типів існує також так звана неузгоджена термінологія. Деякі джерела розрізняють діабет третього типу, який прийнято називати гестаціний діабет, інсуліностійкий діабет типу 1 («подвійний діабет»), діабет типу 2, який прогресує до потреби вводу інсуліну й прихований автоімунний діабет у дорослих. Також існує особливий діабет у молоді, який виникає через поодинокі генні порушення.
Цукровий діабет був відомий ще з часів античності і в Середній Азії. Проте справжнє вивчення хвороби розпочалося аж 1900 році. Вперше виявили і оцінили роль підшлункової залози у цукровому діабеті вчені Йозеф фон Мерінг і Оскар Мінковскі.
Інсулома - (insuloma; лат. insula острів + -oma; син. незидиобластома) — гормонально-активна пухлина панкреатичних острівців (острівців Лангерганса). Вперше була виявлена в 1902 р. Николлсом (A. Nicholls) при аутопсії. У 1904г. Л. В. Соболев описав гіпертрофію і гіперплазію островкових кліток, позначивши це явище як «струма острівців Лангерганса». Прижиттєво інсулін вперше діагностована в 1127 р. Уайлдером (R. Wildcr) і сотр. Перша успішна операція видалення інсуломи виконана Е.Грэмом в 1929 р. У СРСР першими досліджували клин, прояви інсулома і запропонували її хірургічне лікування В. Р. Клячко, О. В.Николаев, А. Д.Очкин.
Статистика. За даними Палюмбо і Греко (L. Paluinbo. L. Greco, 1953), гормонально-активні пухлини панкреатичних острівців зустрічаються дуже рідко. В. В. Виноградов (1959), базуючись на результатах дослідження 21 056 аутопсії, встановив, що одна інсулома зустрічається на 3509 аутопсій. Але даним С. Г. Генеса (1973), одну інсулому знаходить на кожні 900 розтинів.
Серед хворих, інсулярний апарат котрих виділяє велику кількість інсуліну, у 70% виявлена аденома, а у 30%— аденокарцинома. За даними різних авторів, злоякісні інсуломи спостерігаються в 10—60% випадків. О. В. Николаев і Е. Г. Вейнберг (1968) встановили, що жінки хворіють інсуломою майже в два рази частіше за чоловіків. Інсулома зустрічається в основному у віці 35—55 років; у дітей — виключно рідко.
Етіологія неясна. За походженням інсулому ділять на альфа-клітинні, бета-клітинні і дельта-клітинні. Альфа-клітинні пухлини зустрічаються дуже рідко; вони секретують надмірну кількість глюкагона. Пухлина, витікаюча з дельта-клітин, секретує гастриноподібні речовини; клінічно виявляється синдромом Золлінгера — Еллісона, описаним в 1955 р.
У сучасній літературі найбільш вивчена інсулінома; вона розвивається з базофільних інсулоцитів (бета-клітин) панкреатичних острівців і продукує надмірну кількість інсуліну.
Патологічна анатомія. Диференціювати І. різного походження на основі тільки морфологічної картини неможливо. Пухлина частіше локалізується в хвості або тілі підшлункової залози, зрідка поза нею, виходячи в таких випадках з эктопированної тканини підшлункової залози.
Макроскопічно І. є щільним вузлом від 0,5 до 7,0см в діаметрі, чітко відмежований капсулою; колір пухлини варіює від білувато-сірого до бурого. В більшості випадків зустрічається одинична пухлина; у 12—14% хворих виявляється декілька первинних пухлин. У деяких випадках І. має інфільтруючий зростання і дає метастази. По консистенції І. значно щільніша навколишньої тканини.
При мікроскопічному дослідженні пухлина складається з клітин полігональної, круглої або овоїдной форми. Кількість цитоплазми різна, забарвлення її може бути базофільною або ацидофільною. Ядра зазвичай округлої або овальної форми з тонким розпиленим хроматином, рідше наголошується компактне розташування хроматина. У дрібніших клітках ядра круглої форми розташовуються центрально, в кубічних і призматичних вони частіші за овальну форму, розташовуються у одного з полюсів клітки. У цитоплазмі іншого полюса скупчуються гранули секрету. Багатоядерні клітки — виключення. Кількість різна — від одиничних до множинних; атипові мітози рідкісні навіть в очевидно злоякісній пухлині. Одній з основних особливостей пухлини, витікаючої з базофільних инсулоцитов, — інсуліноми, є дегрануляція бета-клітин, втрата ними специфічної зернистості.
Кількість дегранулірованих кліток відображає ступінь гормональної активності цих пухлин.
Незалежно від походження І. підрозділяють по трабекулярному і альвеолярному типам будови. Частіше зустрічається трабекулярноє будова, для якої характерне утворення трабекул, оточених судинами; у стінках судин нерідко наголошується значне розростання фіброзної тканини, накопичення гіалінових мас і амілоїда. Альвеолярна будова інсуліноми характеризується формуванням з пухлинних кліток альвеол, оточених сполучною тканиною і кровоносними судинами.
Типовим для інсуліноми є формування так званих розеток. Одні розетки складаються з центральної судини, навколо якої розташовуються циліндрової або кубічної форми клітки з апікально розташованими ядрами; частина їх цитоплазми (біля судини) виразно вакуолізірована, між цитоплазмою і стінкою судини нерідко наголошуються зернисті маси, які, на думку Е. В. Уранової (1971), є секретом пухлинних кліток. Ряд авторів вважає, що переважання таких розеток характерне для пухлини, витікаючої з альфа-клітин. Розетки іншого вигляду утворюються з таких же кліток, але без центральної судини, з базальними розташованими ядрами; у апікальному відділі цитоплазми скупчується секрет, при виділенні якого формується центрально розташована порожнина. Вважається, що переважання таких розеток характерне для пухлин з бета-клітинами. Проте в І. можлива наявність обох структур.
Строма пухлини може бути утворена як рихлою, так і фіброзною сполучною тканиною. Залежно від вираженості строми І. можуть бути паренхиматозного, фіброзного і змішаного типу. Зрідка в центрі І. утворюються некрози, іноді в І. можна виявити гігантські острівці Лангерганса, оточені гіалінізірованою фіброзною тканиною.
Інсуломи, як правило, ростуть чітко оточені капсулою, і провести диференціювання між злоякісними і доброякісними варіантами буває дуже важко, часто неможливо. Тільки наявність віддалених метастазів (у печінці, легенів, лімфи, вузлах) дозволяє з достовірністю говорити про злоякісність пухлини. В той же час інсуліноми, маючі гістол. ознаки злоякісності, можуть не мати метастазів. За даними Прістлі (J. Priestley, 1902), метастазуючі інсуліноми складають 10%. Метастатичні вогнища також можуть бути гормонально-активні.
Клінічна картина. Клінічні прояві при І. залежать від гормональної активності пухлини і кількості гормону, яким вона продукує.
При глюкагономі у хворих розвивається цукровий діабет.
Синдром 3оллінгера—Еллісона клінічно характеризується утворенням рецидивуючих пептичних виразок шлунково-кишкового тракту, гіперсекрецією шлункового соку, гіперацидностю, диспепсією. Спонтанної гіпоглікемії, як правило, не виникає; порушень секреції інсуліну і глюкагона не наголошується.
Інсулінома характеризується синдромом гіперінсулінізма обумовлено дуже великою кількістю інсуліну (1 г пухлини містить до 80 ЕД інсуліну, нормальна тканина залози — 2 ЕД). Гиперінсулінізм приводить до важких нападів гіпоглікемії. О. В, Николаев до Э. Г. Вейнберг(1968) розрізняють три варіанти клин, перебіг інсуліноми: галопуюча течія, напади гіпоглікемії з тривалим проміжком між першим і подальшими і варіант з тривалим періодом передвісників до першого нападу гіпоглікемії. У жінок можливий атиповий перебіг хвороби, коли напади спостерігаються тільки в менструальний період або при вагітності.
Напади гіпоглікемії найчастіше розвиваються в ранній уранішній годинник натщесерце або через 3—4 години після їжі, особливо при фізичному навантаженні, психічних травмах. Глікемія зменшується до 50 мг% і нижче, проте при прийомі їжі симптоми гіпоглікемії швидко зникають. Гипоглікемічний синдром при інсуліномі розвивається раптово і протікає важко. Напад характеризується сильною слабкістю, неспокоєм, збудженням, що доходить до марення, сильним потовиділенням, скороминущою геміплегією, зоровими порушеннями, втратою пам'яті, сонливістю, непритомніє. Напад триває 15—20 хв.; на початку його може виникнути різкий руховий неспокій; нерідко виникають епілептіформниє припадки, іноді хворі впадають в коматозний стан.
Епілептиформні припадки, і відмінність, від дійсної епілепсії можуть тривати годинами, супроводжуючись нейровегетативною симптоматикою. Гіпоглікемічний напад відносно легко купірується введенням хворому легкозасвоюваних вуглеводів, у важчих випадках — внутрішньовенним вливанням глюкози.
У міру почастішання нападів гіпоглікемії і зменшення змісту цукру в крові посилюються ознаки поразки кори головного мозку. У періоді міжнападу на перший план виступають нервово-психічні розлади (зниження пам'яті, байдужість до того, що оточує, втрата професійних навиків, імпотенція, асиметрія сухожильних і перпостальних рефлексів, поява патологічних рефлексів і ін.).
Як правило, хворі мають підвищений апетит, що веде до ожиріння, проте у зв'язку з порушенням функції нервової системи деякі хворі втрачають у вазі.
Діагностика скрутна в клінічних і морфологічних аспектах. Для диференціальної діагностики І. різного походження застосовується спеціальне забарвлення і електронний-мікроскопічне дослідження патологоанатомічних препаратів, порівняння отриманих даних з нормальними структурами панкреатичних острівців підшлункової залози.
Поліморфізм симптомів часто веде до діагностичних помилок. При глюкагономі діагностичне значення має визначення змісту цукру в крові і сечі, глюкагона в крові. При синдромі Золлінгера — Еллісона важливим є ендоскопічне і рентгенологічне визначення виразок шлунково-кишкового тракту у поєднанні з різкою гіпертрофією слизистої оболонки.
При інсуліномі важливе діагностичне значення має визначення інсуліну в крові під час спонтанного нападу, а також проба з голодуванням (краще у поєднанні з легким фіз. навантаженням). Під час проби хворим дають тільки чай без цукру або воду; вміст цукру в крові визначають кожні 2 — 3 години. Майже у всіх хворих інсуліномою виражена гіпоглікемія. Розвивається протягом 12—16 годин. Ця проба дозволяє виявити патогномонічну для інсуліноми тріаду Уіппла: 1) виникнення нападів гіпоглікемії при голодуванні; 2) зменшення глікемії до 50 міліграма і нижче; 3) швидке припинення нападу після введення глюкози. Застосовують також і деякі інші діагностичні проби (з толбутамідом, лейцином, глюкагоном, інсуліном, кортизоном, з навантаженням глюкозою).
Лікування оперативне. Для доступу до підшлункової залози застосовують верхню серединну або поперечну лапаротомію з підходом до залози через шлунково-ободову зв'язку. Малі розміри пухлини, можливість її залягання в товщі залози обумовлюють необхідність при операції ретельної ревізії всіх відділів підшлункової залози. Видалення І. найдоцільніше шляхом енуклеації, менш бажана часткова резекція підшлункової залози. Для профілактики післяопераційного панкреатиту, який є найбільш грізним ускладненням, показано застосування антиферментних препаратів (трасилол, контрікал і ін.).
У випадках неоперабельності злоякісної інсуломи хворих переводять на білково-жирову дієту; кожні 2—3 години вони повинні отримувати небагато харчів для попередження нападу.
Прогноз. Своєчасне видалено пухлини приводить до одужання; рецидиви I. після операцій відносно рідкісні. При виявленні віддалених метастазів прогноз поганий.
Методи визначення інсуліну
Методи визначеня інсуліну умовно можна розділити на біологічні та радіоіммунні. Біологічні методи засновані на стимуляції поглинання глюкози інсулін чутливими тканинами під дією інсуліну. Для біологічного метода використовують діафрагмальний м’яз і епідидимальна жирова тканина, отримана від крис чистих ліній. Кристалічний інсулін або досліджувана сироватка крові людини і препарати діафрагмального м’язу або епідидимальної жирової тканини (краще ізольовані жирові клітини, отримані із епідидимальна жирова тканина) в буферному розчині , що містить певну концентрацію глюкози, поміщають до інкубатора. По ступеню поглинання глюкози тканиною і відповідно убули її з інкубованого середовища розраховують зміст І. у крові, використовуючи при цьому стандартну криву.
Вільна форма інсуліну підсилює поглинання глюкози в основному на діафрагмальной м'язі, з яким практично не реагує зв'язана форма інсуліну, тому, використовуючи діафрагмальний метод, можна визначити кількість вільного інсуліну. Поглинання глюкози епідидимальною жировою тканиною стимулюється в основному зв'язаною формою інсулінуале з жировою тканиною частково може реагувати і вільний І., тому дані, отримані при інкубації з жировою тканиною, можна називати загальною інсулінною активністю. Фізіологічні рівні вільного і зв'язаного І. коливаються в дуже широких межах, що, мабуть, пов'язано з індивідуальним типом гормональної регуляції обмінних процесів, і можуть в середньому складати в нормі 150—200 мкед/мл вільного І. і 250—400 мкед/мл зв'язаного І.
Радіонммунний метод визначення І. заснований на конкуренції міченого і неміченого І. у реакції з антитілом до I. у аналізованій пробі. Кількість радіоактивного І., пов'язаного з антитілами, буде обернено пропорційно до концентрації I. у аналізованій пробі. Найбільш вдалим варіантом радіоімунного методу виявився метод подвійних антитіл, який умовно (схематично) можна представити таким чином. Антитіла проти І. отримують на морських свинках (так наз. антитіла першого порядку) і сполучають їх з міченим інсуліном. Отриманий комплекс повторно сполучають з антитілами другого порядку (отриманими від кролика). Це забезпечує стабільність комплексу і можливість реакції заміщення міченого інсуліну на немічений. В результаті цієї реакції немічений інсулін зв'язується з антитілами, а мічений інсулін переходить у вільний розчин.
Численні модифікації цього методу засновані на етапі відділення міченого інсуліну від комплексу з неміченим інсуліном. Метод подвійних антитіл покладений в основу приготування готових наборів для радіоімунного методу визначення інсуліну (фірмами Англії і Франції).
Препарати інсуліну
Для медичних цілей І. отримують з підшлункової залози великого рогатого скота, свиней, китів.
Активність інсуліну визначають біологічним шляхом (по здатності знижувати вміст цукру в крові у здорових кроликів). За одиницю дії (ЕД), або інтернаціональну одиницю (И.Е), приймають активність 0,04082 міліграм кристалічного інсуліну (стандарту). Інсулін легко з'єднується з двовалентними металами, особливо з цинком, кобальтом, кадмієм, і може утворювати комплекси з поліпептидами, зокрема з протаміном. Ця властивість була використана при створенні препаратів І. пролонгованої дії.
По тривалості дії розрізняють три типи препаратів І. Препаратом короткої дії (близько 6 годин) є інсулін вітчизняного виробництва (І. великої рогатої худоби і свиней). Препарат середньої тривалості дії (10—12 година.) — суспензія цинк-інсуліну аморфного — вітчизняний препарат, аналогічний зарубіжному препарату семіленте.
До препаратів тривалої дії відносяться протамін-цинк-інсулін для ін'єкцій (16—20 годин дії), суспензія інсулін-протаміна (18— 24 годин), суспензія цинк-інсуліну (до 24 годин), суспензія цинк-інсуліну кристалічного (до 30—36 годин дії).
Свідчення і протипоказання. Інсулін є специфічним протіводіабетним засобом і застосовується в основному при цукровому діабеті; абсолютним свідченням є наявність кетоацидоза і діабетичної коми. Вибір препарату і його дозування залежать від форми і тяжкості перебігу хвороби, віку і загального стану хворого. Підбір доз і лікування інсуліну проводиться під контролем вмісту цукру в крові і в сечі і спостереженням за станом хворого. Передозування І. загрожує різким падінням змісту цукру в крові, гіпоглікемічною комою.
Препарати І. застосовуються для лікування деяких психічних хвороб. У СРСР інсуліношокове лікування шизофренії було застосоване в 1936 р. А. С. Конфельдом і Е. Л. Штернбергом. З появою нейролептиків лікування І. стало методом вибору.
У невеликих дозах інсулін іноді призначають при загальному виснаженні, фурункульозі, блювоті вагітних, гепатитах і ін.
Всі препарати інсуліну пролонгованої дії вводять тільки йод шкіру (або внутрішньом'язовий). Внутрішньовенно (напр. при діабетичній комі) можна вводити тільки розчин інсулінукристалічного для ін'єкцій. Не можна вводити суспензії цинк-інсуліну (і інші препарати інсуліну пролонгованої дії в одному шприці з розчином інсуліну для ін'єкцій; у разі потреби вводять розчин інсуліну для ін'єкцій окремим шприцом).
Протипоказання — алергія до інсуліну; відносні протипоказання — захворювання, що протікають з гіпоглікемією. Необхідна обережність при лікуванні І. хворих у яких спостерігаються коронарна недостатність і порушення мозкового кровообігу.
Інсулінова проба
Інсулінова проба (сип.: реакція на інсулін, інсуліновий тест) — метод діагностики ендокринних захворювань, супроводжуючихся порушенням вуглеводного обміну. В основі проби лежить властивість інсуліну викликати зниження вміст цукру в крові і чуттевість організму до інсуліну. Інсулінова проба була запропонована Хімсвортом (Н. P. Hirasworth) в 1936 р.
Обстежуваному натщесерце вводять під шкіряний 0,2 або внутрішньовенно 0.1 ЕД інсуліну на 1 кг ваги тіла і через -20, 30, 45, 60, 90 і 120 хв. після ін'єкції визначають вміст цукру в крові. Інсулінова проба більш специфічна, якщо застосовують монокомпонентні інсуліни — препарати інсуліну, вільні від глюкагона.
При підозрі на гіпофункцію передньої частки гіпофіза і кори наднирників інсулінову пробу проводять особливо обережно щоб уникнути гіпоглікемічного шоку, при атом вища допустима доза інсуліну складає 0,03 ЕД на 1 кг ваги тіла.
У здорової людини через 20— 45 хв. після ін'єкції інсуліну рівень цукру в крові складає близько 50% вихідного, потім підвищується і через 90—120 хвилин досягає початкового показника або перевищує його.
При ендокринній патології спостерігають два типи цукрових кривих. Перший тип демонструє резистентність організму до інсуліну: після ін'єкції рівень глікемії не міняється або змінюється трохи (менше 30%). Резистентність до інсуліну наголошується при акромегалії, хвороби Іценко — Кушинга, синдромі Кушинга, тиреотоксикозі і інших захворюваннях, пов'язаних з гіперфункцією контрінсулярних залоз внутрішньої секреції (передньої частки гіпофіза, кіркової речовини надниркових, щитовидної залози). Другий тип цукрової кривої відображає високу чутливість до інсуліну і уповільнення реакції організму на гіпоглікемію: через 40 хв. рівень глікемії знижується на 50% і більше та залишається низьким протягом 2-3 годин.
Висока чутливість до інсуліну спостерігається при гипофізарній кахексії, аддісоновій хворобі, гіпотіреозі, гіперінсулінізмі та ін.
При цукровому діабеті інсулінова проба неспецифічна, чутливість до інсуліну у хворих може бути виражена, а за наявності синдрому інсулінрезістентності — понижена або відсутня.
Висновок
Підшлункова залоза належить до залоз змішаної секреції. Основна маса її виробляє травні ферменти, які виділяються протокою в порожнину дванадцятипалої кишки.
Ендокринна функція належить острівцям Лангерганса, які знаходяться серед екзокринної паренхіми залози.
Гормони: інсулін і глюкагон. Це основні гормони. Проте нещодавно виділено соматостатин, який регулює секрецію інсуліну, глюкагону та інших гормонів. Знайдено аналоги гормонів травної системи панкреагастрин і секретин.
Функції інсуліну: інсулін - єдиний цукрознижувальний гормон, стимулює утворення тригліцеридів і депонування ліпідів у жировій тканині, гальмує ліполіз, регулює обмін білків, підсилює транспорт амінокислот крізь мембрани, активує секрецію соматостатину. Інсулін бере участь у 22 реакціях обміну речовин.
Список використаної літератури
Колб В. Г., Камышников В. С. Клиническая биохимия. – Минск, 1976.
Петровський Б. В. Большая медицинская энциклопедия. – М.: 1978. - 483с.
Држевецкая И. А. Основы физиологии обмена веществ и эндокринной системы: Учебное пособие для биологыческих специальностей университетов и институтов. – М.: Высшая школа, 1983. – 272 с.
Ефимов А. С., Боднар П. Н., Зелинский Б. А. Эндокринология. – К: Вища школа, 1983. – 328 с.
Лакин Г. Ф. Биометрия: Учебн. Пособие для биол. спец. ВУЗов. – М.: Высшая школа, 1990. – 352 с.
Ефимов А. С., Щербак Ю. В. Сахарный диабет: проблемы наших дней. – К.: Наукова думка, 1991. – 153 с.
Комов В. П., Шведов В. Н. Биохимия: учебник для вузов. – М: Дрофа, 2004. – 638с.
Пішак В. П., Бажора Ю. І. Медична біологія. – Вінниця: Нова книга, 2004.
Гунський Ю. І. Біоорганічна хімія: підручник для вищих медичних та фармацевтичних закладів освіти. – Вінниця: Нова книга, 2005. – 464 с.
1