Участь мікроорганізмів в кругообігу азоту
Міністерство освіти і науки України
Чернігівський державний педагогічний університет імені Т.Г. Шевченка
Хіміко-біологічний факультет
Кафедра загальної біології
КУРСОВА РОБОТА
Участь мікроорганізмів у кругообігу N>2>
Виконала:
студент ІV курсу
Несторенко В.С.
Науковий керівник:
к. б. н, доц. кафедри
загальної біології
Смикун Н.В.
Чернігів - 2007
ЗМІСТ
ВСТУП
РОЗДІЛ 1. Суть процесу перетворення азоту мікроорганізмами
Розділ 2. Групи бактерій, які приймають участь у кругообігу азоту
2.1 Бульбочкові бактерії
2.2 Вільноживучі азот фіксатори
РОЗДІЛ 3. Шляхи перетворення азоту
3.1 Процеси амоніфікації як перший етап перетворення азоту
3.2 Процеси нітрифікації
3.3 Денітрифікація
3.4 Шляхи фіксації азоту
РОЗДІЛ 4. Використання бактеріальних препаратів в сільському господарстві
ВИСНОВКИ
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
ВСТУП
Молекула азоту є однією із найінертніших. Д.Резерфорд, який вперше (1772) виділив азот з повітря, назвав його нежиттєвим тому, що він не підтримує ні дихання, ні горіння. Проте тепер усім відомо, що азот є необхідною складовою частиною нуклеїнових кислот, амінокислот, білків, фосфоліпідів, численних ферментів і вітамінів, АТФ, НАД і НАДФ та інших важливих сполук усіх живих організмів.
Більшу частину азоту біосфери становить молекулярний азот N>2>, на долю якого припадає до 80 % усіх, молекул повітря. Молекулярний азот атмосфери не може засвоюватися більшістю вищих рослин. Ці рослини можуть використовувати для свого живлення переважно мінеральні сполуки цього елемента, які знаходяться у ґрунті. Однак існує велика група ґрунтових вільноживучих і симбіотичних мікроорганізмів, які, завдяки наявності у них нітрогеназної системи, мають здатність засвоювати молекулярний азот атмосфери.
Процес зв'язування атмосферного азоту посідає важливе місце в системі великого кругообігу речовин і біологічної рівноваги на Землі. Азот є основним елементом, від якого значною мірою залежить доля урожаю сільськогосподарських культур, а тому проблема перетворення його мікроорганізмами привертає до себе велику увагу як вчених, так і практиків сільськогосподарського виробництва.
Мета роботи – проаналізувати участь мікроорганізмів у кругообігу азоту.
Завданнями роботи є:
1) охарактеризувати суть процесів перетворення азоту;
2) дати характеристика груп бактерій;
3) розглянути основні шляхи перетворення азоту;
4) використання біопрепаратів у сільському господарстві.
РОЗДІЛ 1. ГРУПИ БАКТЕРІЙ, ЯКІ ПРИЙМАЮТЬ УЧАСТЬ У КРУГООБІГУ АЗОТУ
1.1 Бульбочкові бактерії
Бульбочки утворюються тільки у представників родини бобових (Fabaceae). У різних рослин бульбочки розрізняються тільки за формою і величиною. Утворюються вони після проникнення в кореневу систему бульбочкових бактерій.
Численні дослідження показали, що бульбочкові бактерії відрізняються між собою, а тому рід Rhizobium треба розглядати як групу споріднених мікроорганізмів. У молодому віці ці бактерії рухливі, мають паличковидну форму, завдовжки від 1,2 до 3 мкм, розміщення джгутиків в одних видів перетрихальне, в інших — субполярне. Бульбочкові бактерії є грамнегативними, неспороносними аеробними організмами.
Старіючи, бульбочкові бактерії втрачають джгутики, перестають бути рухливими і набувають вигляду оперезаних паличок, оскільки з віком бактеріальна клітина наповнюється жировими включеннями, які не забарвлюються. Зі старінням у бульбочках культури Rhizobium часто виникають потовщені, розгалужені, сферичні та іншої форми утворення, які значно більші за звичайні клітини. Ці поліморфні утворення дістали назву бактероїдів (рис. 1). Вони нерухомі і не здатні до розмноження. Проте найбільш енергійно відбувається засвоєння азоту в бульбочках саме тоді, коли бульбочкові бактерії перетворюються на бактероїди.
Бульбочкові бактерії можуть асимілювати різні вуглеводи, органічні кислоти і багатоатомні спирти. Як джерело азоту їм доступні амінокислоти. Для більшості культур Rhizobium оптимальне значення рН середовища дорівнює 6,5-7,5, а оптимальна температура становить 24—26 °С.
Встановлено, що бульбочкові бактерії можуть заражати лише певну групу бобових рослин. Вибіркова здатність цих бактерій відносно рослин дістала назву специфічності. Ця властивість стала головною ознакою для розробки систематики бульбочкових бактерій.
За Л.М.Доросинським, рід Rhizobium поділяють на такі групи: R. leguminosarum — бактерії гороху, вики, кормових бобів, чини; R. phaseoli — квасолі; R. japonicum — сої; R. vigna — вігни, арахісу, машу; R. сісеr — нугу; R. lupini — люпину, серадели; R. trifolii — еспарцету; R. lotus — лядвенцю; R. robinii — акації.
В окремих випадках спостерігається не тільки видова, а й сортова специфічність бульбочкових бактерій. Крім специфічності, цим бактеріям властива вірулентність — здатність проникати в тканину кореня, розмножуватися там і спричиняти утворення бульбочок. За певних умов ці бактерії можуть знижувати або зовсім втрачати активність.
Істотною властивістю бульбочкових бактерій є також їхня активність, тобто здатність у симбіозі з рослинами асимілювати молекулярний азот. У ґрунті трапляються штами активних і неактивних бульбочкових бактерій. Зараження бобових рослин активною расою бактерій веде до утворення великої кількості бульбочок на головному корені та зумовлює енергійний процес фіксації атмосферного азоту. Неактивні раси цих бактерій спричинюють утворення бульбочок, але азот не фіксується.
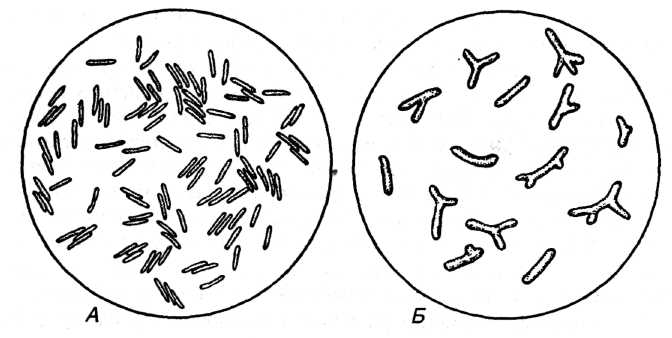
Рис. 1. Бульбочкові бактерії з роду Rhizobium:
А — клітини, виділені з бульбочок конюшини; X 15 000-25 000 (за Зільгером); Б — бактероїди з бульбочок конюшини
Бульбочки, які утворюються активними расами бактерій, мають рожеве забарвлення. Пігмент, що надає їм такого забарвлення, за хімічним складом близький до гемоглобіну крові та називається леггемоглобіном (фітоглобін). Вважають, що цей пігмент сприяє процесу засвоєння азоту, підтримуючи окислювально-відновний потенціал на певному рівні. Бульбочки, які утворюють неактивні раси бактерій, мають зеленкуватий колір.
Механізм проникнення бактерій у кореневий волосок досі ще недостатньо вивчено. Встановлено, що на поверхні клітинної оболонки бобових рослин є особливий вид білка, до якого вибірково "приклеюються" специфічні бульбочкові бактерії завдяки наявності в їхній, оболонці специфічного ліпополісахариду. Припускають, що саме у відповідь на появу цього ліпополісахариду на оболонці кореневого волоска з'являється білок лектин, який зв'язує полісахариди оболонки ризобіїв. Це своєрідний механізм "впізнавання" перед виникненням бобово-ризобіального симбіозу.
Після проникнення бактерій у клітину кореневого волоска вони починають посилено розмножуватись і утворюють суцільний тяж, так звану інфекційну нитку (слизовий тяж), в якій скупчується величезна кількість бульбочкових бактерій. Останні можуть розмножуватися тільки в тетраплоїдних клітинах рослин.
Як в інфікованих бактеріями, так і в сусідніх клітинах починається активний поділ, і утворюються бульбочки. В однорічних рослин бульбочки є тимчасовим утворенням. У багаторічних вони можуть функціонувати протягом кількох років. Контакт бактерії з рослиною встановлюється через судинні пучки, які обплітають тканину бульбочки. Провідними шляхами до бульбочок надходять вуглеводи та інші поживні речовини, де вони використовуються бактеріями, а рослина одержує із бульбочок зв'язані сполуки азоту. Доведено, що найінтенсивніша віддача зв'язаного азоту із тканин бульбочки відбувається тоді, коли бактероїди перебувають у життєдіяльному стані.
Транспорт азотовмісних речовин із бульбочок у рослину здійснюється у формі амінокислот. Незначна кількість засвоєного рослиною азоту виділяється внаслідок екзоосмосу коренями в ґрунті переважно у вигляді аспарагінової кислоти.
Після відмирання і розкладу бульбочок бактерії потрапляють у ґрунт і живуть там як сапрофіти, поки знову не проникнуть у корені рослин. Питання про те, що лежить в основі взаємовідносин бактерій і бобових рослин (паразитизм чи співжиття), ще повністю не з'ясовано. Важливим є той факт, що бульбочкові бактерії, проникаючи в рослину, стимулюють розвиток у неї імунітету, який перешкоджає подальшому зараженню коренів.
Окремі бобові культури збагачують ґрунти різною кількістю азоту. При сприятливих умовах симбіозу кількість азоту, який фіксується горохом, за рік сягає 100—300 кг/га, кормовими бобами — 160-200, люпином білим — до 300, люцерною — до 500 кг/га і більше. Бобові рослини нагромаджують до 60 % азоту внаслідок фіксації молекулярного азоту. Решту азоту вони використовують із ґрунту у вигляді мінеральних сполук. Отже, вклад бобових рослин у забезпечення ґрунтів доступними формами азоту досить відчутний.
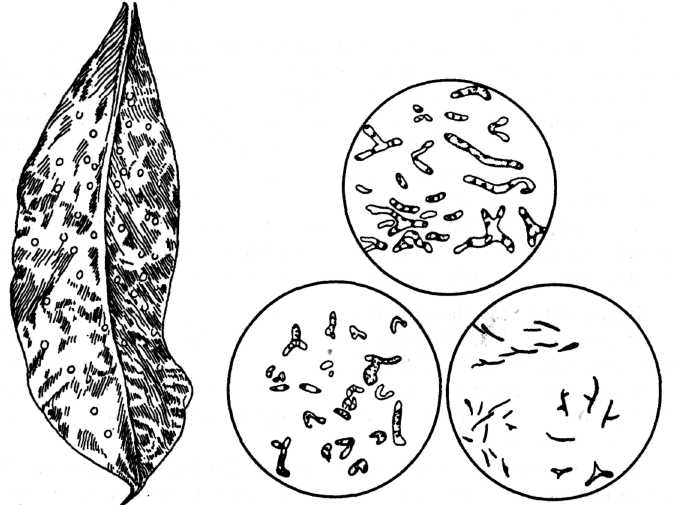
Рис. 2. Бульбочки на листках Pavetta.
Праворуч — препарат бактерій з бульбочок (за Є.М.Мішустіним, 1968)
Утворення, які нагадують бульбочки, знайдено у багатьох рослин, що не належать до родини бобових. Серед покритонасінних бульбочки виявлено на коренях представників порядків Cycadales, Ginkgoales і Coniferales. У дводольних бульбочки найчастіше бувають у представників родин Согіагіасеае, Betulaceae, Casuarinaceae тощо. В окремих випадках їх знаходили на коренях рослин із родин Brassicaceae, Rosaceae, Scrophulariaceae тощо, з однодольних рослин бульбочки описано лише у представників родини Роасеае.
Нещодавно з'явилися цікаві дані про те, що бактерії роду Azospirillum, які асоціюються з коренями злаків, мають здатність інтенсивно фіксувати азот. Вони поширені в тропічних і помірних кліматичних зонах. Природу збудників, які зумовлюють утворення бульбочок у цих рослин, повністю ще не вивчено. Так, у бульбочках вільхи знайдено актиноміцети.
Досліди з використанням міченого азоту показали, що у більшості рослин із родів вільхи (Alnus L.), обліпихи (Hippophae L.), лоху (Elaeagnus L.) мічений азот зв'язується тільки тоді, коли є бульбочки. Ці дані свідчать про те, що зв'язування молекулярного азоту небобовими рослинами також відбувається в симбіозі з мікроорганізмами.
Бульбочки можуть утворюватися не тільки на коренях рослин, а й на інших органах. їх знайдено на листках майже 400 різних видів рослин, наприклад деяких дводольних тропічних, зокрема у павети (Pavetta indica L.) із родини маренових (Rubiaceae). Найдокладніше досліджено такі бульбочки у рослин павети і психотрії (рис. 4).
1.2 Вільноживучі азот фіксатори
Крім бульбочкових бактерій, у ґрунті є багато інших видів мікроорганізмів, які можуть засвоювати молекулярний азот атмосфери. В 1893 р. С. М. Виноградський вперше виділив і вивчив вільноживучий азотфіксатор — анаеробну спороносну бактерію веретеноподібної форми, яку було названо на честь Л. Пастера — Clostridium pasteurianum.
Описано багато азотфіксаторів з роду Clostridium (C.buturicum, C.acetobutylicum, C.pectinovorum, C.felsineum, Cl.beijerinckii та ін.). Ці бактерії можуть використовувати різні джерела азоту: солі амонію і азотної кислоти, а також багато різних органічних азотовмісних сполук. Із вуглецевих сполук вони використовують моноцукри, дицукри, поліцукри, органічні кислоти тощо.
Енергійним фіксатором азоту серед цієї групи бактерій є Clostridium pasteurianum. Він може зв'язувати до 10—12 мг азоту на 1 г збродженого цукру.
Іншим дуже поширеним вільноживучим азотфіксатором є аеробна, овальної форми, бактерія — Azotobacter chroococcum, відкрита у 1901 p. M. Бейєрінком. Розмір клітин азотобактера коливається в межах 2—3 х 4—6 мкм. Він розмножується простим поділом з утворенням поперечної перегородки. Молоді клітини азотобактера рухливі, перетрихи з віком втрачають рухливість, набувають майже коковидної форми і покриваються товстим шаром слизу (капсулою). Іноді клітини азотобактера можуть бути вкритими товстою оболонкою і перетворюватися на цисти.
Серед представників азотобактера найґрунтовніше вивчено A.chroococcum, A.vinelandii, A.agilis, A.beijerinckii (рис. 3). Ці види різняться за формою і розмірами клітин, пігментацією колоній.
На відміну від клостридія азотобактер інтенсивніше зв'язує молекулярний азот. Активні культури азотобактера зв'язують 15—20 мг азоту на 1 г використаного цукру або іншої органічної речовини. Він не засвоює клітковини. Однак при наявності її в ґрунті розмножується більш інтенсивно, оскільки між целюлозорокладачами і азотобактером існує явище метабіозу. Азотобактер потребує нейтрального середовища. В кислих ґрунтах він не розвивається.
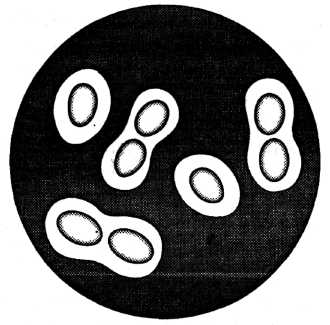
Рис. 3. Азотобактер (Azotobacter chroococcum)
Близькі до азотобактера вільноживучі азотфіксатори з роду Beijerinckia. На відміну від азотобактера, вони можуть рости навіть при рН = 3. Ці бактерії мають різну форму, бувають рухливими і нерухливими; за енергією фіксації азоту вони близькі до азотобактера.
Серед вільноживучих азотфіксуючих бактерій слід згадати про види роду Derxia і Azotomonas fluorescens.
Пошуки вільноживучих азотфіксаторів дали змогу виявити їх і в інших родинах — Spirillaceae, Rhizobiaceae, Achromobacteriaceae, Enterobacteriaceae, Bacillaceae та ін. Здатність до фіксації молекулярного азоту мають анаеробні пурпурні та зелені фототрофні бактерії, що живуть у заболочених озерах і мулі, деякі мікобактерії, спірохети, проактиноміцети і навіть окремі види грибів, у тому числі дріжджі.Використання методу мічених атомів дозволило підтвердити припущення, висловлене ще в 1889 p., про те, що одна з найбільших груп мікроорганізмів, які населяють ґрунти, — мікроскопічні водорості — можуть засвоювати атмосферний азот. Серед них близько 40 видів синьозелених водоростей. До найпоширеніших належать Anabaena, Amorphonostoc, Aulosira, Calothrix, Nostoc, Scytonema тощо.
В Японії використання штучного зараження ґрунтів синьозеленими водоростями Tolypothrix tennuis виявилось ефективним при вирощуванні рису. Подібних результатів досягли також в Індії від застосування на рисових полях синьозелених водоростей — Aulosira fertilisima.
Досліди, проведені в Інституті мікробіології Російської АН, показали, що синьозелені водорості (ціанобактерії) під час інтенсивного розвитку можуть нагромаджувати за вегетаційний період до 50—70 кг азоту на 1 га.
Останніми роками вчені різних країн приділяють велику увагу вивченню процесу фіксації азоту мікроорганізмами, які містяться на корінні і в прикореневій зоні небобових рослин. Ці мікроби дістали назву ризосферних, а процес зв'язування ними молекулярного азоту називається асоціативною азотфіксацією.
Азотфіксуюча активність виявлена у представників багатьох родів ризосферних бактерій: Agrobacterium, Achromobacter, Aquaspi-rillum, Azospirillum, Arthrobacter, Bacillus, Flavobacterium, Enterobac-ter, Erwina, Flavobacterium, Klebsiella, Mycobacterium, Pseudomonas, Rhodospirillum та ін.
Хімізм фіксації молекулярного азоту. Метод Габера—Боша, до якого вдаються нині, щоб одержати з атмосферного повітря NH>3>, потребує високих температур і тиску. Натомість біологічна фіксація азоту відбувається за звичайних умов.
Але процес зв'язування молекулярного азоту досить енергоємний. Щоб розірвати три зв'язки, між двома атомами в молекулі азоту необхідно затратити 941 кДж/моль. Експериментально доведено, що під час розвитку азотфіксатори, які зв'язують молекулярний азот, на одиницю маси новоутворених клітин витрачають більше енергії, ніж при рості на сполуках азоту.
Зв'язування молекулярного азоту може відбуватися двома шляхами: відновленням або окисленням. Кожен з цих шляхів є багатоступінчастим і каталізується своїми ферментативними системами. Більшість дослідників вважають, що фіксація N>2> здійснюється за відновним шляхом.
Перші досліди з вивчення ферментного комплексу, який забезпечує процес фіксації N>2>, було проведено ще в 1934 p., коли відомий російський біохімік О.М.Бах (із співробітниками) зробив спробу одержати безклітинний препарат, який містить ферментний комплекс, що зв'язує молекулярний азот. Однак це складне завдання завдяки зусиллям багатьох вчених було розв'язано значно пізніше.
Ферментна система, яка відповідає за фіксацію N>2>, називається нітрогеназою. Вона складається з двох білкових компонентів. Один із них містить Мо і Fe і називається молібдофередоксином, а другий містить тільки Fe і називається азофередоксином. У складі останнього, як і в молібдофередоксині, є сульфідні групи. Молібдофередоксин (Mo-Fd) інактивується киснем, а азофередоксин, навпаки, чутливий до кисню (Azo-Fd). Нітрогеназа здійснює процес, при якому водень відновної сполуки переноситься на N>2> з утворенням NH>3>. Активування азоту і водню в клітинах азотфіксаторів, необхідних для перетворення N>2> на NH>3>, здійснюється також фередоксином — білком негемінової природи (Fid). Водень у мікробній клітині може утворюватися у низці процесів. Молекулярний азот і водень активуються електронами, які утворюються в ланцюзі окислювально-відновних процесів.
Незалежно від безпосереднього джерела електронів вони повинні передаватись в нітрогеназну систему відновником з низьким потенціалом, який містить негемінове залізо, — переносником електронів (Fd):
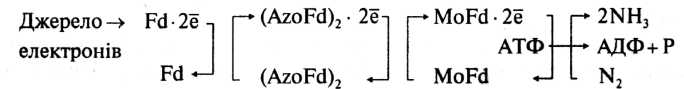
У ланцюгу перенесення електронів, який складається із фередоксину (Fd), азофередоксину (AzoFd), і молібдофередоксину (MoFd), за один раз переносяться тільки два електрони (для останнього перенесення потрібно витратити одну молекулу АТФ). Але для відновлення N>2> до NH>3> потрібно шість електронів, а тому реакція повинна складатися із послідовних двоелектронних стадій. Характерно, що в реакційній суміші ніколи не знаходили частково відновлених проміжних продуктів. Вважають, що вони залишаються зв'язаними з ферментом, і відновлення відбувається через такі проміжні стадії:
Встановлено, що нітрогеназа може відновлювати не тільки молекулярний азот, а й інші сполуки. На здатності нітрогенази відновлювати ацетилен до етилену ґрунтується непрямий метод її визначення, який знайшов широке застосування на практиці (R.Hardy, 1973).
Аміак, який утворюється при відновленні молекулярного азоту, реагує з кетокислотами бактеріальної клітини (піровиноградною, щавлевооцтовою тощо), в результаті чого утворюються амінокислоти.
При наявності сполук перехідних металів — титану, ванадію, хрому, молібдену і заліза — відбувається активація N>2> у звичайних умовах. При цьому утворюються комплексні сполуки, які розкладаються водою до аміаку. Отже, дані, одержані вітчизняними і зарубіжними вченими, дають змогу сподіватися на те, що через певний час буде розроблено промисловий метод м'якої хімічної фіксації молекулярного азоту.
Функціонування мультиферментного комплексу нітрогенази визначається особливими генами (nif-генами). Інтенсивно проводяться роботи з вивчення можливості штучної передачі цих генів від азотфіксуючих мікробів іншим мікроорганізмам, які не здатні фіксувати N>2>.
Цікаві дані щодо цього одержано при перенесенні групи nif-генів бактерії Klebsiella pneumoniae до клітини Е.соіі. Спочатку перенесення здійснювалося введенням nif-генів до плазмід, які потім було введено в Е.соlі. Відомо, що Е.соlі не фіксує N>2>. Новий штам Е.соlі набув властивостей синтезувати нітрогеназу і завдяки цьому виявився здатним до фіксації N>2>.
Успіх цього експерименту вселяє надію, що методами генної інженерії незабаром вдасться створити рослини пшениці, кукурудзи та інших культур, які матимуть здатність фіксувати N>2>. Значення цього відкриття для агровиробництва важко переоцінити.
РОЗДІЛ 2. ШЛЯХИ ПЕРЕТВОРЕННЯ АЗОТУ
2.1 Процеси амоніфікації як перший етап перетворення азоту
Одним із основних шляхів перетворення азоту в ґрунті є гниття, або розклад білків мікроорганізмами, який дістав назву процесу амоніфікації. Це складний багатофазовий процес, кінцеві результати якого залежать від будови й складу білка, умов, у яких відбувається розклад, і від збудників, що спричинюють його. Гниття білків починається з їхнього гідролізу під впливом протеолітичних ферментів, які виділяються мікроорганізмами в оточуюче середовище. Процесу амоніфікації піддаються не тільки білки, а й їхні похідні — пептони, пептиди, амінокислоти, а також нуклеїнові кислоти та їхні похідні — пуринові і піримідинові основи, сечовина, сечова кислота, складний азотовмісний цукор хітин і гумусові кислоти.
Первинними продуктами гідролізу білків є пептони і пептиди, які далі розщеплюються до кінцевих продуктів гідролізу — амінокислот, останні використовуються мікробами або перетворюються ними на аміак і інші сполуки залежно від природи самих амінокислот і ферментів мікроорганізмів. Перетворення амінокислот найчастіше відбувається через дезамінування. Наприклад, гідролітичне дезамінування супроводжується утворенням оксикислот і аміаку:
R - CHNH>2>COOH + Н>2>О → R - СНОНСООН + NH>3>.
Після дезамінування вуглецевий залишок перетворюється мікробами в аеробних або анаеробних умовах до утворення СО>2> і різних органічних сполук. В аеробних умовах продукти розкладу білків повністю мінералізуються, утворюються СО>2>, Н>2>О, NH>3>, H>2>S, H>2>. В анаеробних умовах повної мінералізації проміжних продуктів розкладу амінокислот не відбувається. У цьому випадку поряд з СО>2> і NH>3 >нагромаджуються різні органічні кислоти, спирти, аміни тощо.
При розкладі амінокислот ароматичного ряду утворюються проміжні продукти: фенол, крезол, скатол, індол, які мають дуже неприємний запах. Сірководень та його похідні — меркаптани — утворюються під час гідролізу сірковмісних амінокислот.
При амоніфікації білків в анаеробних умовах можуть утворюватися і токсичні речовини, наприклад діаміни, до яких належать кадаверин і путресцин.
Амоніфікацію білків зумовлюють різні види аеробних і анаеробних мікроорганізмів. Особливо активними амоніфікаторами є представники роду Bacillus (В. sub>tilis, В. cereus, В. mycoides), Pseudomonas (P. fluorescens, P. aeruginosa), Clostridium (C. sporogenes, C. putrificus), Proteus vulgaris та інші.
Разом з бактеріями активну участь в амоніфікації білкових речовин беруть ґрунтові гриби й актиноміцети — Aspergillus, Penicillium, Mucor, Trichoderma, Cladosporium тощо. Оскільки амоніфікацію білків спричиняють різні групи мікроорганізмів, то вона може відбуватися в широкому інтервалі кислотності.
Рис. 4. Найпоширеніші спороносні бактерії-амоніфікатори та їхні колонії:
І — палички; II — колонії (1 — В. megaterium; 2 — В. sub>tilis; 3 — В. mycoides; 4 — В. mesentericus)
Амоніфікація гумусових сполук — процес дуже повільний. Наприклад, у помірному кліматі протягом року розкладається приблизно 1—3% загального запасу ґрунтового гумусу. Амоніфікацію гумінових речовин мікробами можна зобразити такою спрощеною схемою: гумінові речовини + О>2> → СО>2> + Н>2>О +NH>3>. У цьому важливому процесі беруть участь аеробні і анаеробні мікроорганізми (рис. 4).
Розклад нуклеїнових кислот. Під впливом ферментів рибонуклеази і дезоксирибонуклеази, які синтезуються деякими видами грибів, актиноміцетів і бактерій, нуклеїнові кислоти розкладаються до мононуклеотидів. Останні під дією нуклеотидів розщеплюються на фосфорну кислоту, цукор, пуринові і піримідинові основи.
Далі, залежно від типу обміну речовин мікроорганізмів, цукор може окислюватися до кінцевих продуктів СО>2>, Н>2>О або піддаватися процесу бродіння з утворенням відповідних органічних речовин.
Азотовмісні основи розкладаються спочатку до сечовини і амінокислот, а далі до аміаку і органічних кислот.
Гідроліз сечовини. До поширених у природі азотовмісних сполук належать також сечовина, сечова і гіпурова кислоти, які містяться в сечі людини і тварин. Сечовина може синтезуватись також грибами. Наприклад, у шампіньйонів до 13 % сухої маси припадає на сечовину. Розклад сечовини у ґрунті зумовлює особлива група уробактерій. Найенергійнішими збудниками цього процесу є Micrococcus ureae, Sporosarcina ureae, Bacillus pasteurii (рис. 5).
Рис. 5. Уробактерії:
A — Bacillus pasteurii; В — Sporosarcina ureae
Уробактерії здебільшого належать до аеробів, добре розвиваються при рН = 9. Виділяючи фермент уреазу, ці бактерії перетворюють сечовину на аміак і вуглекислий газ. Фізіологічний смисл розкладу сечовини зводиться до переведення амінної форми азоту в аміачну, яка легше засвоюється рослинами.
2.2 Процеси нітрифікації
Другим етапом перетворення азоту в ґрунті є нітрифікація. Аміак, який утворюється при розкладі органічних речовин у ґрунті, воді та інших середовищах, досить швидко окислюється до азотистої, а потім азотної кислот. Цей процес і дістав назву нітрифікації. У 1890-1892 pp. С.М.Виноградський, застосувавши розроблену ним методику елективних культур, виділив чисту культуру бактерій цього процесу.
До дослідів С. М. Виноградського припускалось, що причиною нітрифікації є один вид мікроорганізмів, які окислюють амонійні сполуки до нітратів. Проте працями С. М. Виноградського було доведено, що цей процес є результатом послідовної дії двох груп мікроорганізмів і відбувається він у дві фази, а саме: спочатку амонійні сполуки окислюються першою групою бактерій до азотистої кислоти, яка другою групою бактерій окислюється до азотної:
NH>4> + 1/2О>2> = NO>2> + H>2>O+2H+;
NO>2>+1/2O>2> = NO>3>-.
Першу фазу нітрифікації здійснюють нітрозобактерії (Nitrosomonas, Nitrosocystis, Nitrosolobus, Nitrosospira, Nitrosovibrio). У другій фазі нітрифікації азотисту кислоту окислюють Nitrobacter, Nitrospira, Nitrococcus. Найкраще серед нітрифікаторів вивчено Nitrobacter winogradskyi, однак описано й інші види збудників цього процесу, серед деяких є навіть гетеротрофні представники з родів Pseudomonas, Achromobacter, Corynebacterium, Nocardia, Bacillus тощо.
Нітрифікуючі бактерії переважно належать до типових хемолітотрофів. Між ними існують метаболітичні взаємовідносини. Саме етапність процесу нітрифікації є характерною рисою таких взаємовідносин між мікроорганізмами. Метабіоз існує також між нітрифікуючими і гнильними (амоніфікуючими) бактеріями. Як уже зазначалось, у нітрифікуючих та інших хемолітотрофних бактерій С.М.Виноградським було відкрито процес хемосинтезу.
Вважають, що великі поклади селітри в деяких країнах — результат процесів нітрифікації, які відбувалися на нашій планеті протягом мільйонів років.
У різних ґрунтах інтенсивність процесів нітрифікації є різною. Чим багатший ґрунт, тим більше може нагромаджуватися азотної кислоти. Проте не слід забувати, що солі азотної кислоти (нітрати), на відміну від амонійних (іон амонію поглинається ґрунтовим комплексом), можуть легко вимиватися з ґрунту, а це істотно впливає на зниження коефіцієнта використання нітратів рослинами.
Крім того, в самій рослині нітрати повинні відновитися, щоб рослина змогла використати їх у процесах біосинтезу, а для цього потрібна енергія; амоній може використовуватися рослинами й безпосередньо. Все це змушує дослідників вирішувати питання про штучне зниження інтенсивності процесу нітрифікації завдяки використанню специфічних інгібіторів.
2.3 Денітрифікація
Нітрати, які утворюються в ґрунті, використовуються не тільки рослинами, а й окремими видами мікроорганізмів.
Особлива роль при цьому належить групі мікробів, які можуть відновлювати нітрати до молекулярного азоту; цей процес називається денітрифікацією. Він спричиняється до істотних втрат із ґрунту доступних для рослин форм азоту.
Розрізняють пряму і непряму денітрифікацію. Пряма — це процес відновлення нітратів, безпосередньо пов'язаний із життєдіяльністю денітрифікуючих бактерій. Вона буває двох типів — асиміляторна і дисиміляторна. При асиміляторній денітрифікації нітрати відновлюються до аміаку, який використовується як джерело азоту для побудови тіла мікробів. У дисиміляторній денітрифікації нітрати використовуються як окислювачі органічних речовин замість молекулярного кисню, що забезпечує мікроорганізми потрібною енергією (див. нітратне дихання). Здатність до дисиміляторної денітрифікації мають тільки специфічні аеробні бактерії.
Збудниками прямої асиміляторної денітрифікації є представники родів Pseudomonas, Paracoccus (Pseudomonas aeruginosa, Pseudomonas fluorescens, Pseudomonas stutzeri, Paracoccus denitrificans). Денітрифікацію можуть зумовити і термофільні бактерії з роду Bacillus.
Денітрифікуючі бактерії використовують нітрати як акцептор водню при відсутності О>2> для окислення органічних речовин. У присутності нітратів денітрифікатори ростуть анаеробно, а без них — аеробно.
Відновлювати нітрати можуть також деякі хемолітоавтотрофи, зокрема Thiobacillus denitrificans, яка розмножується в анаеробних умовах і є сіркоокислюючою бактерією.
Початковий етап відновлення нітратів при дисиміляторній денітрифікації каталізується ферментом нітратредуктазою, який утворюється в мікробній клітині під впливом нітратів тільки в анаеробних умовах.
Крім прямої денітрифікації, в ґрунті може відбуватися і непряма. У цьому разі молекулярний азот виділяється внаслідок суто хімічних реакцій між азотистою кислотою і амінними або амідними сполуками:
R - NH>2> + HNO>2> = N>2> + R - OH + H>2>O.
Денітрифікація збіднює ґрунт на мінеральні форми азоту. Особливо помітні втрати азоту в процесі денітрифікації спостерігаються, зокрема, в перезволожених ґрунтах.
Запаси газоподібного азоту в атмосфері величезні: над кожним квадратним кілометром земної поверхні в повітрі міститься близько 8 млн т азоту. Проте цей азот ні для рослин, ні для тварин недоступний. Лише деякі мікроорганізми, які вільно живуть у ґрунті або перебувають у симбіозі з рослинами, можуть засвоювати азот безпосередньо з повітря і будувати з нього білкові сполуки свого тіла.
Процеси зв'язування молекулярного азоту атмосфери мікроорганізмами мають винятково велике значення в азотному балансі ґрунту, підвищуючи значною мірою його родючість.
2.4 Шляхи фіксації азоту
Відомо два основних природних шляхи зв'язування молекулярного азоту — фізико-хімічний і біологічний. Перший пов'язаний з впливом на молекулярний азот електричних розрядів, які бувають під час грози. Кількість зв'язаного таким чином азоту незначна і не відіграє великої ролі в живленні рослин.
Другий шлях фіксації молекулярного азоту пов'язаний з життєдіяльністю мікроорганізмів, що належать до двох груп: мікроби, які перебувають у симбіозі з рослинами, та азотфіксатори, що вільно живуть у ґрунті та воді.
Відомо, що вирощування бобових рослин підвищує родючість виснажених ґрунтів. Першу спробу з'ясувати причину цього зробив у 1838 р. французький агрохімік Ж.Бусенго. У своїх дослідах з конюшиною і горохом, добрий урожай яких було вирощено при невеликій кількості азоту в піщаному ґрунті, він припустив, що висока врожайність бобових рослин пов'язана з їхньою здатністю асимілювати атмосферний азот. При повторному досліді у 1858 р. Ж.Бусенго дістав протилежні наслідки, цього разу він прожарював пісок і поливав рослини тільки дистильованою водою, бажаючи видалити сліди азотних сполук. Проте Ж.Бусенго не здогадувався, що так він знищує мікроорганізми в піску.
Тільки через 30 років німецькі дослідники Г.Гельрігель і Г.Вільфарт розкрили причину невдачі цього видатного вченого. їм вдалося довести, що бобові рослини, посіяні в прожарений пісок (де вбито всіх мікробів), не утворюють бульбочок на коренях і не можуть фіксувати молекулярний азот атмосфери. Тоді вже було відомо, що в бульбочках на коренях бобових рослин міститься дуже багато бактерій.
Ще в 1858 р. І.Лахман, а дещо пізніше М.С.Воронін, незалежно один від одного, відкрили наявність мікробних клітин у бульбочкахбобових рослин. У 1888 р. голландський мікробіолог М. Бейєрінк вперше виділив у чистій культурі бактерії з бульбочок гороху, квасолі, вики та інших культур.
РОЗДІЛ 3. ВИКОРИСТАННЯ БАКТЕРІАЛЬНИХ ПРЕПАРАТІВ В СІЛЬСЬКОМУ ГОСПОДАРСТВІ
Поряд з іншими добривами в агровиробництві широко використовують бактеріальні препарати, виготовлені на культурах відповідних бактерій. Думка про використання бульбочкових бактерій для посилення фіксації N>2> виникла після того, як М.Бейєрінку (1888) вдалося виділити чисту культуру цих бактерій з бобових рослин. Вперше препарат бульбочкових бактерій під назвою нітрагін було виготовлено в 1896 р. Ґрунтовий нітрагін — це розмножена культура бульбочкових бактерій на стерильному ґрунті.
Масове виготовлення цього бактеріального добрива в нашій країні почалося з 1929 р. Нині нітрагін випускають у двох формах — нітрагін сухий (ризорбін) та нітрагін торфовий (ризоторфін).
Багаторічна практика використання цього бактеріального добрива як в Україні, так і за кордоном свідчить про значну його ефективність. При цьому слід зазначити, що застосування нітрагіну веде не тільки до збільшення врожаю бобових рослин (пересічно на 10—15 %), а й до поліпшення їхньої якості, оскільки в оброблених рослинах виявлено помітне збільшення вмісту білка і вітамінів.
Вдаються й до інших видів бактеріального добрива. На пропозицію С.П.Костичева, ще в 30-х роках почали застосовувати препарати для удобрення ґрунту, які містили культуру Azotobacter chroo-coccum.
Виробництво азотобактерину ґрунтується на розмноженні чистої культури азотобактера і змішуванні її з будь-яким субстратом (ґрунтом, торфом, агаром тощо). Азотобактерин використовують для підвищення врожайності зернових, технічних, овочевих та інших культур. У ґрунт його вносять разом з посівним матеріалом. Дія азотобактерину ґрунтується на використанні властивостей азотобактера,який крім фіксації молекулярного азоту може виробляти фізіологічно активні речовини, які стимулюють ріст рослин і цим сприяють підвищенню їхньої продуктивності. Середній приріст врожаю від застосування азотобактерину становить близько 10 %.
Ризоагрин — екологічно безпечний препарат асоціативних азот-фіксаторів, призначений для обробки насіння озимої пшениці та рису.
Екологічно чистий агрофіл використовують для підвищення врожайності овочевих культур, а біодобриво бамім — під картоплю і багаторічні трави. Для розкладання пестицидів і стимуляції росту рослин застосовують бактеріальний препарат агрофор.
Рівень ефективності застосування того чи іншого препарату залежить від реакції виду чи навіть сорту рослин на інокуляцію і від умов вирощування культури. Тому додержання рекомендацій з технології вирощування рослин із застосуванням препаратів є запорукою одержання очікуваних результатів. Враховуючи те, що біопрепарати мають низькі ціни, застосування мікробіологічних препаратів при вирощуванні овочевих культур та зменшення при цьому доз мінеральних добрив веде до зростання економічної ефективності одержання овочів. Незначне зростання затрат дозволяє знизити собівартість продукції, а рівень рентабельності одержання помідорів сорту Шанс підвищується на 6% при обробці біопрепаратом ФМБ 32- 3 і на 8% — препаратом БСП відносно контролю без використання біопрепаратів. Показники економічної ефективності застосування біопрепаратів при вирощуванні капусти білоголової ранньої більш вагомі, що пояснюється особливостями культури, зокрема її одноразовим збиранням. Рівень рентабельності одержання капусти сорту Дітмаршер фрюер при застосуванні біопрепарату ФМБ 32- 3 зростає на 19%, а при обробці БСП — на 35% відносно технології без внесення біопрепаратів.
ВИСНОВКИ
У природі постійно відбувається кругообіг азоту, в якому беруть участь рослини, тварини і мікроорганізми. Це досить складний процес.
Деяка частина атмосферного азоту зв'язується вільноживучими і симбіотичними мікроорганізмами. Цей процес збагачує ґрунт і рослини азотом. Органічні рештки рослинних і тваринних організмів, які потрапляють у ґрунт, розкладаються (мінералізуються) амоніфікуючими мікробами і перетворюються на амонійні сполуки — аміак та інші.
Амонійна форма азоту в ґрунті далі окислюється нітрифікуючими бактеріями і перетворюється на сполуки азотистої і азотної кислот (нітрити і нітрати). За певних умов нітрати і нітрити під впливом денітрифікуючих бактерій можуть відновлюватися до молекулярного азоту (денітрифікація), в результаті чого зберігається відносна рівновага між вмістом молекулярного азоту в атмосфері і зв'язаним азотом ґрунту, рослин і тварин.
Отже, коли зіставити кількість амонійного, нітритного і нітратного азоту, який потрапляє в ґрунт у результаті фотохімічних процесів і електричних розрядів в атмосфері, з тією кількістю, що вноситься в ґрунт завдяки його фіксації мікроорганізмами, то стає зрозумілою виняткова важливість цього процесу на нашій планеті. Адже загальна продуктивність мікробної фіксації азоту становить від 270 до 330 млн. т на рік.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
Атабеков И.Г. Практикум по общей вирусологии. — М.: Из-во Московского университета, 1981. — 191 с.
Білявський Г.О., Падун М.М., Фурдуй Р.С. Основи загальної екології. — К: Либідь, 1993. — 303 с.
Бойко А Л. Экология вирусов растений. — К.: Вища шк., 1990. — 165 с.
Бондаренко Н. В. Биологическая защита растений. — М.: Агропромиздат, 1987.-278 с.
Борьба с вирусными болезнями растений. / Под ред. Х.Кеглер. М.: Агропромиздат. — 1986. — 326 с.
Будзанівська І.Г., Поліщук В.П., Тивончук Т.П., Бойко А.Л. Зв'язок між наявністю антигенів фітовірусів в грунті, структурою грунтів та екологічним станом зовнішнього середовища // Вісник аграрної науки. — 1998. — №9. — С 61-63.
Вавилов Н.И. Иммунитет растений к инфекционным заболеваниям. - М: Наука, 1986. — 520 с.
Векірчик К.М. Практикум з мікробіології: Навч. посібник. – К.: Либідь, 2001. – 144 с.
Вершигора А.Ю., Бранцевич Л.Г., Василевская И.А. и др. Общая микробиология. — К.: Вища шк. Головное изд-во, 1988. — 342 с.
Вирощування екологічно чистої продукції рослинництва. /Под ред. Дегодюка Е.Г. — К.: Урожай, 1992. — 318 с.
Віруси і вірусні хвороби бобових культур на Україні. / Московець СМ., Краев В.Г., Порембська Н.Б. та ін. — К.: Наукова думка 1971.— 136 с.
Вірусні та мікоплазмові хвороби польових культур. / Під ред. Ж.П.Шевченко. — К.: Урожай, 1995. — 304 с
Вірусні хвороби сільськогосподарських культур/ Московець С.Н., Бобирь А.Д., Глушак Л.Е. / Під ред. Бобиря А.Д. — К.: Урожай, 1975. — С.72-80.
Власов Ю.И. Вирусные и микоплазменые болезни растений. — М.: Колос, 1992. — 207 с.
Власов Ю.И., Ларина Э.И. Сельскохозяйственная вирусология. — М.: Колос, 1982. — С. 150-156.
Генкель Л. А. Микробиология с основами вирусологии. — М.: Просвещение, 1974. — 270 с.
Гиббс А., Харрисон Б. Основы вирусологии растений: Пер. с англ. — М.: Мир, 1978. — 430 с.
Гнутова Р.В. Серология и иммунохимия вирусов растений. — М.: Наука, 1993. — 300 с.
Груздева Л.П., Яекин А.А. Почвоведение с основами геоботаники. — М.: Агропромиздат, 1991. — 448 с.
Гусев М. В., Минова Л. А. Микробиология. М.: Изд-во Моск. ун-та, 1992. - 448 с.
Ижевский С. С, Гулий В. В. Словарь по биологической защите растений. — М.: Россельхозиздат, 1986.— 223 с.
Максимов Н.А. Краткий курс физиологии растений, 1958
Мишустин Е.Н., Емцев В.Т. Микробиология. – М.: Агропромиздат, 1987. – 368 с.