Организационно-экономические аспекты внедрения фармакогенетического тестирования в практическое здравоохранение
Дипломная работа
"Организационно-экономические аспекты внедрения фармакогенетического тестирования в практическое здравоохранение"
Содержание
Аннотация
Введение
Цель и задачи исследования
Гипотезы исследования
Обзор литературы
Предмет и задачи клинической фармакогенетики
История развития фармакогенетики
Материалы и методы
Результаты и обсуждение
Выводы
Практические рекомендации
Литература
фармакогенетический тестирование дозирование варфарин
Аннотация
Несмотря на достижения медицинской науки, проблемы эффективной и безопасной фармакотерапии сохраняют свою актуальность и в настоящее время. Внедрение фармакогенетических тестов в клиническую практику - это реальный путь к персонализированной медицине и, как следствие, повышение эффективности и безопасности фармакотерапии.
Целью данного исследования является проведение комплексной оценки организационных проблем внедрения фармакогенетического тестирования в практическое здравоохранение.
Материалы и методы: Было организовано и проведено одномоментное исследование, состоящее из нескольких этапов: исследование уровня знаний у студентов медицинских вузов, врачей и организаторов здравоохранения в области фармакогенетического тестирования; исследование российского рынка коммерческих лабораторий, выполняющих фармакогенетическое тестирование для подбора дозы варфарина; анализ доступности фармакогенетического тестирования в субъектах РФ; оценка экономического преимущества фармакогенетического подхода к дозированию варфарина по сравнению с традиционным.
Результаты:Среди всех опрошенных отмечается недостаток необходимой и полной информированности о современных возможностях фармакогенетики и способах ее внедрения в клиническую практику. Анализ российского рынка лабораторий показал, что в РФ отмечается недостаток информации о лабораториях, проводящих фармакогенетическое тестирование для выявления индивидуальной чувствительности к варфарину. Анализ доступности фармакогенетического тестирования в субъектах РФ свидетельствует об очень низком уровне применения тестирования практически по всей территории РФ. Подбор дозы при назначении лекарственной терапии варфарином, осуществляемый традиционным методом без фармакогенетического тестирования, сопровождается повышением частоты кровотечений, что может сказаться на затратах на ведение больных.
Введение
Несмотря на достижения медицинской науки и внедрение огромного количества новых лекарственных средств (ЛС), проблемы эффективной и безопасной фармакотерапии сохраняют свою актуальность и в настоящее время. Одним из путей повышения эффективности и безопасности фармакотерапии является внедрение в клиническую практику технологий т.н. персонализированной (персонифицированной) медицины. В основе этих технологий лежит индивидуальный подход к выбору ЛС и его режима дозирования с учетом факторов, влияющих на фармакологический ответ, которые имеются у конкретного пациента. Клиническая фармакогенетика предоставляет реальную возможность индивидуализации выбора ЛС и режимов их дозирования на основании изучения генотипа конкретного пациента. В основе фармакогенетических тестов лежит выявление аллельных вариантов генов системы биотрансформации и транспортеров ЛС, определяющих фармакологический ответ (генотипирование пациентов). Однако существование ряда пока неразрешенных проблем, связанных с фармакогенетикой является причиной того, что фармакогенетические тесты в клинической практике применяются крайне редко. Серьезным препятствием к внедрению фармакогененетических тестов в клиническую практику является их высокая стоимость и низкая доступность, а также недостаточный уровень знаний в области клинической фармакогенетики у врачей и организаторов здравоохранения. В настоящее время уже нет никаких сомнений в том, что внедрение фармакогенетических тестов в клиническую практику является реальным путем к персонализированной медицине, и, как следствие повышением эффективности и безопасности фармакотерапии. Уже разработан ряд фармакогенетических тестов.Однако темпы внедрения фармакогенетики в реальную клиническую практику неоправданно низки.
Цель и задачи исследования
Целью данного исследования является проведение комплексной оценки организационных проблем внедрения фармакогенетического тестирования в практическое здравоохранение и разработка путей (подходов) их решения. В ходе исследования планировалось решить следующие задачи:
Оценить уровень компетентности в области фармакогенетического тестирования у студентов, ординаторов, врачей и организаторов здравоохранения.
Провести анализ российского рынка коммерческих услуг проведения фармакогенетического тестирования.
Провести анализ доступности фармакогенетического тестирования в субъектах РФ.
Оценить стоимость лечения пациентов с постоянной формой мерцательной аритмии варфарином в зависимости от генетических особенностей больных: носительство различных генотипов по CYP2C9, VKORC1.
Оценить экономическое преимущество фармакогенетического подхода к дозированию варфарина по сравнению с традиционным.
Гипотезы исследования
Имеется недостаточный уровень знаний в области фармакогенетики у медицинских работников.
Доступность фармакогенетического тестирования для врачей и пациентов в РФ ограничена
Назначение варфарина без фармакогенетического тестирования сопровождается повышением частоты кровотечений и увеличением общих затрат на ведение больных
Обзор литературы
Предмет и задачи клинической фармакогенетики
Клиническая фармакогенетика представляет собой раздел клинической фармакологии и клинической генетики, изучающий генетические особенности пациента, влияющие на фармакологический ответ. Эти генетические особенности, как правило, представляют собой полиморфные участки генов белков, участвующих в фармакокинетике или фармакодинамике лекарственных средств (ЛС) [13]. К первой группе относятся гены, кодирующие ферменты биотрансформации и гены транспортеров, участвующих во всасывании, распределении и выведении ЛС из организма. В настоящее время, активно изучается роль генов, контролирующих синтез и работу ферментов метаболизма ЛС, в частности изоферментов цитохрома Р-450 (CYP2D6, CYP2C9, CYP2C19). В последние годы начато изучение влияния на фармакокинетику ЛС полиморфизма генов т.н. транспортеров ЛС [Бочков Н.П., 2002, Кукес В.Г., 2004]. Ко второй группе отнесены гены, кодирующие «молекулы-мишени» ЛС (рецепторы, ферменты, ионные каналы) и гены, продукты которых вовлечены в патогенетические процессы [12]. Именно выявление конкретных аллельных вариантов этих генов и является сутью фармакогенетических тестов. Очевидно, что применение таких тестов позволит заранее прогнозировать фармакологический ответ на ЛС, а, следовательно, индивидуализировано подойти к выбору ЛС и его режима дозирования, а, в некоторых случаях и тактику ведения пациентов [8, 9, 10][Ляхович В.В., 2004, Середенин С.Б., 2004].
Преимущества фармакогенетического тестирования следующие:
тест не требует приема ЛС-маркеров т.е. может прогнозировать фармакологический ответ до приема ЛС;
необходим однократный забор крови или, даже другого биологического материала (соскоб с внутренней поверхности щеки, волосы) в любое время (!);
тест не требует определения в нескольких временных «точках»;
результаты не изменяются во времени в течение всей жизни, что создает перспективу для создания т.н. «фармакогенетического паспорта» пациента;
тесты оценивают только «генетический» компонент, влияющий на фармакологический ответ;
тесты относительно не дороги (требуется оборудование только для выполнения ПЦР);
с помощью этих тестов можно проводить крупные популяционные исследования.
История развития фармакогенетики
Разными авторами дается разная информация о том, кто ввел термин фармакогенетика: по одним источникам это был VogelF. (1959), по другим – MotulskyAG (1957). С этого времени фармакогенетика прошля ряд условно выделяемых этапов:
I этап- накопление фармакогенетических феноменов (1932- начало 1960-х);
II этап- становление фармакогенетики как фундаментальной науки (начало 1960-х -1990-е годы);
III этап- становление фармакогенетики как прикладной клинической науки, переход от фармакогенетики к фармакогеномике (начало 2000-х годов).
Наиболее важные события в развитии фармакогенетики представлены в таблице 1. Однако, фармакогенетика активно развивалась и в СССР, и в России: в ее развитие внесли большой вклад отечественные фармакологи, генетики и клиницисты. Интерес отечественных исследователей к фармакогенетике появляется уже в 60-х годах ХХ века. В основном это были публикации, касающиеся таких фармакогенетических феноменов как повышенная чувствительность к суксаметонию и дефицит глюкозо-6-фосфатдегидрогеназы.
В декабре 1973 года во 2-м МОЛГМИ им. Н.И. Пирогова создается первая в СССР лаборатория фармакологической генетики в которой начинают активно проводится фармакогенетические исследования психотропных ЛС. До 1986 года это научное подразделение работало в составе 2-го ММИ им. Н.И. Пирогова, а затем, по настоящее время, в ГУ НИИ фармакологии РАМН. Главным итогом работы лаборатории фармакогенетики в 1975-1980 годах явилась формулировка научного положения о закономерности индивидуальных реакций на феназепам и сиднокарб [Вальдман А.В., 1979],создание ЛС афобазол, успешно прошедшего клинические испытания и применяющегося в клинической практике [Середенин С.Б., 2004]. Другой важной проблемой лаборатории явились исследования по мутагенезу. Проведен большой объем работ по скринингу более 50 вновь разрабатываемых лекарств на мутагенность. Значимым событием явилось доказательство индукции хромосомных повреждений у млекопитающих при эмоционально-стрессовых воздействиях [Середенин С.Б., Дурнев А.Д., 1998]. В 2000 году на базе отдела фармакогенетики ГУ НИИ фармакологии им. В.В. Закусова была организована первая, и пока единственная в России кафедра фармакогенетики РГМУ, возглавляемая Середениным С.Б., на которой читаются лекции, проводятся занятия со студентами Медико-биологического факультета РГМУ.
В 1974 году Бочков Н.П. в статье «Состояние и перспективы развития медицинской генетики», опубликованной в Вестнике АМН СССР, подчеркивает большое значения проведения фармакогенетических исследования для оптимизации применения ЛС [Бочков Н.П., 1974]. В этом же году выходит первые подробные обзоры на русском языке, посвященные состоянию фармакогенетики на тот период времени: «Основные направления генетических исследований в фармакологии», написанный Мхеидзе М.О., опубликованный в журнале «Клиническая медицина» [Мхеидзе М.О., 1974] и «Фармакогенетика, ее достижения и перспективы (обзор литературы)», опубликованный в журнале «Врачебное дело» и написанный Скакуном Н.П., который двумя годами позже опубликовал первую монографию по фармакогенетике на русском языке «Основы фармакогенетики» [Скакун Н.П., 1974, 1976]. В этой монографии были изложены основные принципы этой новой науки. Эта монография была переиздана со значительными дополнениями в 1981 и 2002 годах, в течение многих лет оставаясь единственным пособием по фармакогенетике на русском языке. В этом же 1976 году вышло еще несколько обзорных статей по фармакогенетике, написанных коллективом авторов под руководством Скакуна Н.П.. [Кудрин А.Н. и соавт., 1976].
В 1984 году выходит еще 2 монографии по фармакогенетике: «Введение в современную фармакогенетику» [Лильин Е.Т., Трубников В.И., Ванюков М.М.] и «Основы и педиатрические аспекты фармакогенетики» [Соради И. (пер. с венгерского), 1984]. В настоящее время главы по фармакогенетике присутствуют во всех крупных учебниках и руководствах по фармакологии и клинической фармакологии [Белоусов Ю.Б., 1997, 2002, Кукес В.Г., 1999, 2004, 2006].
С конца 1990-х годов на кафедре клинической фармакологии ММА им. И.М. Сеченова и Институте клинической фармакологии НЦ ЭСМП Росздравнадзора, возглавляемые Кукесом В.Г. активно ведутся клинические фармакогенетические исследования системы биотрансформации (CYP2C9, CYP2D6, CYP3A4) и транспортеров (гликопротеин-Р) лекарственных средств, целью которых является разработка алгоритмов выбора ЛС (непрямые антикоагулянты, сердечные гликозиды, β-адреноблокаторы, статины и др.) и их режимов дозирования в зависимости от генетических особенностей пациентов. Кроме того, у представителей различных этнических групп России и стран СНГ проводятся исследования, направленные на изучение частот аллелей и генотипов по клинически значимым аллельным вариантам генов, кодирующих изоферменты цитохрома Р-450 и транспортеры ЛС, различия в которых являются основой этнической чувствительности к ЛС. Первым подобным исследованием русского населения г. Воронежа было исследование, выполненное под руководством Чернова Ю.Н., в котором участвовали русские Воронежа [GaikovitchEA, 2003].
Изучению влияния носительства различных аллельных вариантов генов, кодирующих ферменты I и II фаз биотрансформации на эффективность фармактерапии бронхиальной астмы и эндометриоза проведены под руководством Баранова В.С. [Баранов В.С., 2002]. Этим же коллективом создан первый отечественный фармакогенетический чип [Глотов А.С., 2005]. Роль полиморфизма гена MDR1, кодирующего гликопротеин-Р, в течении лейкозов изучается под руководством Ляховича В.В. [Ляхович В.В., 2004]. Под руководством Носикова В.В. и Затещикова Д.А. выполнен ряд работ по изучению влияния полиморфизма генов, кодирующих изоферменты цитохрома Р-450 и различные молекулы-мишени ЛС, на эффективность ЛС, применяемых в кардиологической практике [Носиков В.В., Затейщиков Д.А., 2005].
Таким образом, в России в течении нескольких десятков лет проведен целый ряд фармакогенетических исследований и интерес к ней в нашей стране возрастает с каждым годом. Однако, на пути к реальной клинической практике фармакогенетика в России, также как и во всем мире, сталкивается с пока не решенными пролемами о которых пойдет речь ниже.
Таблица 1.1 Важнейшие события и открытия в области фармакогенетики
-
Год
Событие
1932
Описание семейных случаев гемолитической анемии при применении примахина (Cherman, 1932)
1952
Описание семейного случая акаталаземии (Takahara, 1952)
Описание случая повышенной чувствительности к суксаметонию (Bourne, 1952)
1957
Выдвинуто предположение, что повышенная чувствительность к суксаметонию в следствии сниженной активности бутрилхолиэстеразы (Kalow, Genest, 1957)
Выдвинуто предположение, что «идиосинкразия по отношению к лекарственным средствам может быть вызвана генетическими особенностями и дефицитом ферментов, ничем другим себя не проявляющими» (Motulsky A.G., 1957)
1959
Выявлено, что причиной гемолиза при применении некоторых ЛС является наследственный дефицит глюкозо-6-фосфатдегидрогеназы (Marks, Gross, 1959)
Введен термин «фармакогенетика», означающий «изучение клинически значимых наследственных особенностей» (Vogel F., 1959)
1960
Выявлено, что вариабельность концентрации изониазида в плазме крови обусловлена различной скоростью его ацетилирования (Evansetal., 1960, Blumetal., 1990)
1962
Опубликована книга «Фармакогенетика — наследственность и ответ на лекарственные средства» (Kalow W., 1962)
1969
Определено, что частоты «медленных» ацетиляторов среди европеоидов и монголоидов различаются (Evans, 1969)
1970
Описана низкая активность параоксаназы в плазме крови (Humbert et al., 1970)
Описано повышение частоты полиневритов при применении изониазида у «медленных» ацетиляторов (Karnow, 1970)
Установлен тип наследования дефицита глюкозо-6-фосфатдегидрогеназы (Artus, 1970)
1975
Описан фенотип медленного метаболизма дебризохина (Eichelbaum, 1975)
1977
Установлено, что фенотип медленного метаболизма дебризохина связан с полиморфизмом гена CYP2D6 (Iddle и Mahgoub, 1977)
ВОЗ выпускает серию технических докладов №524 «Фармакогенетика»
1980
Описан наследственный дефицит тиопуринметилтрансферазы, связанный с токсическим действием 6-меркаптопурина (Weinshilboum, Sladek, 1980)
1985
Описан генетический полиморфизм дигидропиримидиндегидрогеназы как причину повышенной чувствительности к 5-фторуацилу (Touchman, 1985)
1987
Описан генетический полиморфизм CYP2C9 (Aithal, 1988)
1988
Охарактеризованы аллельные варианты гена СYP2D6 (Gonzalez et al., 1988)
1990-е годы по настоящее время
Исследования ассоциаций между носительством аллельных вариантов различных генов и изменения фармакокинетики и фармакодинамики ЛС.
Исследования частот аллелей и генотипов по аллельным вариантам различных генов, ответственных за изменения фармакокинетики и фармакодинамики ЛС в различных этнических группах
2000
Национальный институт здоровья (National Institute of Health — NIH) (США) объявил о создании исследовательской сети по фармакогеномике (Pharmacogenetics Research Network)
Начало 2000 годов
Разработка и внедрение в клиническую практику фармакогенетических тестов для выбора ЛС и их режимов дозирования
2003
Завершение проекта «Геном человека»
2004
FDA одобрено применение первого фармакогенетического чипа AmpliChip P450
2005
Совет международных организаций по научной медицине (Council for International Organizations of Medical Sciences — CIOMS) (создан ВОЗ и ЮНЕСКО в 1949 г.) издал руководство «Фармакогенетика: предстоящее улучшение применения лекарственных средств» (февраль 2005 г.)
2005
FDA утверждено руководство для фармацевтической отрасли по разработке и исследованиям фармакогенетических тестов (март 2005 г.)
По данным ВОЗ, ежегодно болезни систем кровообращения (БСК) становятся причиной более 17 миллионов смертей во всем мире. В России смертность от болезней системы кровообращения занимает первое место. Ежегодно в России регистрируется 19–20 млн. больных сердечно-сосудистыми заболеваниями. На их долю приходится 55,4% всех случаев смерти, 43,3% – инвалидизации, 9% – временной утраты нетрудоспособности. Основными причинами, формирующими высокий уровень смертности от болезней системы кровообращения, являются ишемическая болезнь сердца и цереброваскулярные заболевания. Наиболее опасными сердечно-сосудистыми заболеваниями являются инфаркт и инсульт, в основе которых лежит атеротромбоз–тромбоз основных артерий (коронарных и цереброваскулярных).
Непрямые антикоагулянты являются высокоэффективными препаратами для профилактики тромбоэмболических осложнений у больных с постоянной формой фибрилляции предсердий. Метаанализ 6 рандомизированных исследований показал, что назначение непрямых антикоагулянтов снижает риск всех инсультов на 61%, при этом снижение риска одинаково как для первичной, так и для вторичной профилактики. Несмотря на внедрение в повседневную практику технологии подбора дозы непрямых антикоагулянтов под контролем величины международного нормализованного отношения (МНО), геморрагические осложнения остаются основной опасностью при применении непрямых антикоагулянтов. При этом частота кровотечений при применении этого варфарина составляет до 26,5%, из них больших (требующих переливания крови, хирургического вмешательства или повлекших за собой смерть) - до 4,2% в год. С этих позиций, актуальным представляется разработка новых подходов для повышения безопасности терапии непрямыми антикоагулянтами. Подобным подходом может быть индивидуализированный выбор начальной дозы непрямых антикоагулянтов по результатам фармакогенетических исследований[1].
Генетическое тестирование всё чаще рекомендуется к использованию в клинической практике. При этом стоимость генетических тестов достаточно высока, в связи с чем необходимо оценить их экономическую целесообразность и возможность их широкого применения в практическом здравоохранении.
При внедрении фармакогенетического тестирования в реальную медицинскую практику возникает ряд клинических и организационных вопросов. Например, как должен формулироваться фармакогенетический тест, чтобы максимально отражать для врача его возможности оптимизации лечения пациентов? Каковы потенциальные преимущества использования фармакогенетического теста для выявления пациентов, которые «ответят» на лекарственные средства (ЛС) и каков риск «ошибочного отказа» от этих ЛС. Должны ли фармакогенетические тесты использоваться рутинно или только в «пошаговом подходе» к применению ЛС? Следует ли применять фармакогенетические тесты для всех пациентов с заболеванием или только в группах с высоким риском неэффективности лечения или развития нежелательных лекарственных реакций (НЛР), и как эти группы будут определены? Какова ориентировочная потребность в тестировании и каков оптимальный вариант его организации: обеспечение возможности обследования в каждом крупном медицинском учреждении (сразу встает вопрос, насколько крупном?) или только в специализированных лабораториях? И, наконец, какова должна быть стоимость этих фармакогенетических тестов, чтобы они были доступными для пациентов в системе здравоохранения?
С позиции фармакоэкономики при внедрении фармакогенетического тестирования в реальную клиническую практику важными представляются следующие 5 характеристик:
Стоимость фармакогенетического тестирования. В связи с быстрым прогрессом в области разработки генетических технологий стоимость генетического тестирования уменьшилась в последние годы, что в свою очередь приводит к быстрому увеличению числа исследований в этой области и способствует повышению доступности фармакогенетического тестирования для пациентов. Цена подобных тестов обычно включает издержки, непосредственно связанные с фармакогенетическим тестом (проведением полимеразной цепной реакции) и получением проб (образцов биологического материала: кровь, соскоб слизистой щеки и т.д.). Однако реальные издержки этим не ограничиваются, они включают еще время и ресурсы, необходимые для консультирования пациента по результатам тестирования (консультация врача, клинического фармаколога или другого специалиста), изменения в лечении пациента, сделанные на основании результатов фармакогенетического тестирования. Если фармакогенетическое тестирование предотвращает госпитализации (из-за более эффективного лечения или предотвращения НЛР), также следует учесть снижение затрат вследствие этих предотвращенных госпитализаций.
Стоимость лекарственного лечения, для которого используется фармакогенетическое тестирование. Дорогое медикаментозное лечение будет выгодно, только если соответствующий фармакогенетический тест очень точно предсказывает высокую эффективность и безопасность данного ЛС и доступны некоторые альтернативные варианты эффективного лечения, на случай если фармакогенетический тест прогнозирует низкую эффективность или развитие НЛР при применении данного ЛС.
Эффективность фармакогенетического теста оценивается чувствительностью, специфичностью, положительной и отрицательной прогностической ценностью. Если тест имеет низкую чувствительность для предсказания «ответа» на ЛС, он не будет экономически выгодным, потому что многие пациенты, которые не «ответят» на ЛС и прекратят лечение, могут быть не идентифицированы с помощью этого теста. Высокая специфичность также является важной характеристикой фармакогенетического теста. Например, эрлотиниб (Тарцева) ингибирует активность протеинкиназы рецептора EGFR, которая вовлечена во многие внутриклеточные процессы и представлена в большом количестве на поверхностях клеток немелкоклеточнога рака лёгкого. Чувствительность теста по выявлению мутации рецептора EGFR для прогнозирования положительного «ответа» пациента на лечение эрлотинибом составляет всего 32%, в то время как специфичность – 87%. Стоимость лечения эрлотинибом (в США) составляет 40 000 долларов США в год и имеется риск возникновения существенных нежелательных реакций, включая интерстициальное поражение лёгких. Однако эрлотиниб используется для избранных пациентов (носители мутации рецептора EGFR) из-за высокой специфичности данного фармакогенетического теста, который может выявлять пациентов «ответчиков» на лечение [3].
Распространенность заболевания, при котором используется фармакогенетическое тестирование. Если заболевание встречается часто и у большинства пациентов тест даёт положительный результат (достижение необходимого эффекта, профилактика НЛР), тем самым принося им пользу, более вероятно, что тест будет экономически выгоден.
Преимущества подхода к применению ЛС на основе фармакогенетического тестирования перед эмпирическим лечением. К таким преимуществам могут быть отнесены возможности выявления 3 групп пациентов:
которые «не ответят» на ЛС (низкая эффективность) или которым могут понадобиться высокие дозы ЛС для достижения необходимого терапевтического эффекта;
у которых наиболее вероятно разовьются НЛР или для которых безопасным будет применение малых доз ЛС;
которым необходимо другое лечение.
Таким образом, фармакогенетическое тестирование может помочь врачу предсказать фармакологический ответ пациента на ЛС, что позволяет персонализировано применять фармакотерапию. Далее в данной статье мы остановимся на фармакоэкономических аспектах тестирования по генам, кодирующим CYP2C9 (метаболизирует оральные антикоагулянты) и витамин К эпоксид-редуктазный комплекс 1(VKORC1, является молекулой-мишенью для оральных антикоагулянтов) для персонализированного выбора режима дозирования варфарина.
Варфарин — непрямой антикоагулянт, эффективность которого в плане профилактики тромботических осложнений доказана в рандомизированных исследованиях и не подвергается сомнению. Начало и проведение терапии варфарином сопряжены со сложностями, связанными с индивидуальной чувствительностью к этому препарату: достижение адекватных значений гипокоагуляции, развитие чрезмерной гипокоагуляции, кровотечения. Доза варфарина подбирается по показателям международного нормализованного отношения (МНО) до достижения его терапевтических значений, при которых снижается риск тромботических осложнений и не повышается риск кровотечений. Варфарин является одним из первых ЛС, для которых Администрация по контролю за пищевыми продуктами и лекарствами США (FDA) внесла в инструкцию информацию о существовании индивидуальных генетических особенностей, которые могут влиять на фармакологический ответ, а также о возможностях фармакогенетического тестирования (выявление полиморфизмов CYP2C9 и VKORC1) для персонализации дозирования варфарина. [3]
В отчёте AEI-BrookingJointCenterforRegulatoryStudies [4], основанном на результатах ретроспективных исследований, указывается на то, что фармакогенетическое тестирование по CYP2C9 и VKORC1 уменьшит расходы здравоохранения в США на 1,1 млрд долларов ежегодно за счет оптимизации применения варфарина. В этом отчете высказывалось предположение о том, что фармакогенетическая тактика дозирования варфарина будет со 100% эффективностью снижать уровень возникновения «больших» т.е. опасных для жизни, кровотечений. Данный анализ также предполагал, что 10% всех инсультов в США возможно предотвратить за счет более широкого применения варфарина в условиях использования фармакогенетического тестирования и что более «агрессивная» антикоагулянтная терапия у пациентов с «диким» генотипом (у которых не выявляется полиморфизмов генов CYP2C9 и VKORC1) позволит снизить число инсультов на 50%. Однако этот отчет был сделан до того, как были опубликованы какие-либо результаты сравнительных проспективных клинических исследований, демонстрирующих, что фармакогенетическое тестирование по CYP2C9 иVKORC1 улучшило результаты лечения пациентов. Формальные исследования «затраты-эффективность» должны быть дополнены результатами хотя бы одного сравнительного проспективного клинического исследования.
Рассмотрим пять характеристик для оценки экономической целесообразности применения фармакогенетического тестирования по CYP2C9 и VKORC1 в клинической практике.
Стоимость фармакогенетического тестирования. Стоимость фармакогенетического тестирования по CYP2C9 и VKORC1 в США колеблется от 250 до 630 долларов за 1 исследование, что кажется относительно недорогим [3]. В России подобные тестирования проводятся в ряде коммерческих лабораторий, однако, часто в неполном объеме (не определяют полиморфизм VKORC1).
Стоимость лекарственного лечения, для которого используется фармакогенетическое тестирование. Варфарин сам по себе является недорогим ЛС (средняя стоимость Варфарин Никомед тб 2.5мг конт N50х1 Никомед Дания в аптеках Москвы 108р 28коп) [http://www.aptechka.ru/]. Главной составляющей стоимости его применения является ущерб от возможных НЛР и, прежде всего кровотечений. Так, в 2003 и 2004 г. в США антикоагулянты занимали первое место среди ЛС, которые вызвали НЛР, приводящие к смерти. D. Hughes и соавт. (2008) [5] оценивали стоимость лечения варфарином у 257 пациентов в зависимости от генотипа по CYP2C9 иVKORC1, которая включала: первичную помощь (в т.ч. скорую медицинскую помощь), специализированную медицинскую помощь (стационарное и амбулаторное лечение), стоимость препарата. Также были учтены вмешательства, проводимые из-за возникновения НЛР (в основном кровотечений) и недостаточной эффективности лечения варфарином. Средняя стоимость лечения пациента варфарином в течение шестимесячного периода составляла 249,50 фунтов стерлингов. Значимые различия были у пациентов, перенесших НЛР 889,00 фунтов стерлингов (n = 76) по сравнению с теми, у кого лечение проходило без осложнений 171,70 фунтов стерлингов (95% ДИ 155.2 - 188.3) (n = 181). Для 168 пациентов с генотипом CYP2C9*1/*1, средняя стоимость шестимесячного лечения варфарином составляла 249,80 фунтов стерлингов, что оказалось значительно меньше по сравнению с пациентами с генотипами CYP2C9*1/*2 или CYP2C9*1/*3, для которых стоимость лечения составила 271,70 фунт стерлингов. Для пациентов с полиморфизмом гена VKORC1 (полиморфный маркер G1629A) средняя шестимесячная стоимость лечения варфарином составляла 266,80 фунтов стерлингов (у больных с генотипом AA) и 363,90 фунтов стерлингов (у больных с генотипом GA), что оказалось значительно больше по сравнению с больными с генотипом GG для которых этот показатель был 300,30 фунтов стерлингов. Таким образом, можно ожидать, что персонализированный подход к дозированию варфарина может оказаться экономически выгодным.
Эффективность фармакогенетического теста. Многочисленные исследования доказали, что полиморфизм генов CYP2C9 иVKORC1 влияют на особенности дозирования варфарина, риск развития кровотечений и чрезмерной гипокоагуляции, однако существуют единичные исследования, посвященные изучению преимуществ фармакогенетического подхода к дозированию варфарина перед эмпирическим. Имеющиеся результаты исследований говорят о том, что используя фармакогенетическое тестирование, можно уменьшить время достижения терапевтических значений МНО при применении варфарина.
Распространенность заболевания, при котором используется фармакогенетическое тестирование. В США около 2 млн пациентов имеют показания для применения варфарина, при этом до 800 пациентов ежегодно могут столкнуться с НЛР варфарина в виде опасных для жизни кровотечений вплоть до смертельных исходов. Поэтому количество людей, которые могут извлечь выгоду из фармакогенетического тестирования по CYP2C9 и VKORC1 велико.
Преимущества подхода к применению ЛС на основе фармакогенетического тестирования перед эмпирическим лечением. В настоящее время в США только половина пациентов, которым показано применение варфарина, получает его, из них терапевтические значения МНО достигаются только в 50% случаев. Одной из причин для не назначения варфарина является нежелание пройти сложный период подбора дозы. Поэтому выявленное в сравнительных проспективных исследованиях преимущество фармакогенетического тестирования в плане уменьшения времени достижения терапевтических значений МНО может оказаться достаточным для того чтобы данное тестирование оказалось экономически оправданным [3].
В настоящее время выполнено 3 рандомизированных исследования, сравнивающих фармакогенетический подход к дозированию варфарина с традиционным. В исследовании Caraco и соавт. (2008) [6], в котором участвовал 191 пациент, было показано, что дозирование варфарина на основе фармакогенетического тестирования уменьшило время достижения терапевтических значений МНО (4,8 и 7,5 дней, соответственно) и стабильного антикоагулянтного эффекта. «Малые» кровотечения (носовые, гематурия, кровоизлияния в кожу, склеру и т.д.) возникали гораздо реже в фармакогенетической группе по сравнению с группой контроля (3,2 и 12,5%, p< 0,02), но статистически значимых различий в частотах «больших» кровотечений не наблюдалось. В более крупном рандомизированном исследовании CoumaGen (2007) [7, 8] в фармакогенетической и контрольной группах было по 200 пациентов. У пациентов в фармакогенетической группе «большие» кровотечения развивались реже, по сравнению с группой контроля (4,0 и 5,1%, р = 0,71), однако различия оказались статистически не значимыми. В третьем рандомизированном исследовании, выполненном M.A. Hillman и соавт. (2005) [9] из 18 пациентов которым применялся фармакогенетический подход к дозированию варфарина «большие» кровотечения не развивались ни у одного пациента, а в контрольной группе - у 1 из 20 пациентов. При проведении метаанализа [10] на основе этих 3 исследований было выявлено, что риск развития «больших» кровотечений при фармакогенетическом дозировании варфарина, на 32% меньше по сравнению с традиционным. Предполагается, что применение фармакогенетического тестирование уменьшает риск развития «больших» кровотечений в течение первого месяца (т.е. периода подбора дозы варфарина – так называемый период индукции).
В настоящее время выполнен ряд исследований, посвященных фармакоэкономическому анализу фармакогенетического подхода к дозированию варфарина. Самым первым подобным исследованием является работа J.H. You и соавт. (2004) [11]. Авторы проанализировали стоимость лечения варфарином больных, включенных в 23 клинических исследования (исследования отбирались по определенным критериям), в которых проводилось генотипирование пациентов по CYP2C9 и VKORC1: в 13 исследований дозирование варфарина осуществлялось традиционным методом, а в 10 - с использованием результатов фармакогенетического тестирования. Оказалось, что число кровотечений на 100 пациентов, пролеченных в течение года, составило 9,58 в группе фармакогенетичекского дозирования и 10,48 в группе традиционного дозирования. Стоимость лечения варфарином больных с использованием фармакогенетичексого подхода оказалась несколько выше по сравнению с больными, у которых применялось традиционное дозирование: 155 700 и 150 500 долларов США, соответственно. При этом маржинальные затраты на одно дополнительно предотвращенное «большое» кровотечение, в группе фармакогенетического подхода к дозированию, составили 5 778 долларов США.
Иной подход к фармакоэкономической оценке фармакогенетичексого тестирования для персонализированного дозирования варфарина был применен M.H. Eckman и соавт. (2009) [7]. Авторы оценивали экономические преимущества фармакогенетического подхода к дозированию варфарина перед традиционным с использованием анализа «затраты-полезность (утилитарность)», рассчитав затраты на 1 сохраненный год качественной жизни (англ. QALY – quality-adjustedlifeyear). Оказалось, что при стоимости одного фармакогенетического теста 400 долларов США и длительности его выполнения в течение 5 дней затраты на 1 QALY составили 170 000 долларов США, что неприемлемо дорого. Авторы утверждают, что в таких условиях только у 10% пациентов с высоким риском развития кровотечения на фоне применения варфарина стоимость QALY для фармакогенетического тестирования может составить менее 50 000 долларов США. Для того, чтобы стоимость QALY при использовании фармакогенетического тестирования для дозирования варфарина был меньше 50 000 долларов США, должны соблюдаться следующие условия:
предотвращение более 32 % «больших» кровотечений,
длительность выполнения фармакогенетического теста не более 24 часов,
стоимость фармакогенетического теста менее 200 долларов США.
Результаты этих исследований показывают, что экономические преимущества использования фармакогенетического тестирования у больных, принимающих варфарин, пока не очевидны. Однако фармакогенетический подход к дозированию варфарина может оказаться экономически обоснованным при определенных условиях и для определенной группы пациентов, а значит, может «найти» нишу в реальной клинической практике. Поскольку результаты фармакоэкономических исследований не могут быть перенесены из страны в страну из-за отличий в организации медицинской помощи, ценах на ЛС и медицинские услуги, необходимо проведение отечественных исследований применения фармакогенетического тестирования для оптимизации дозирования варфарина.
Очевидно, что выявление экономических преимуществ фармакогенетического тестирования особенно значимо для тестов, которые уже могут быть интегрированы в реальную клиническую практику. Экономическая оценка должна учитывать стоимость фармакогенетических тестов, стоимость препаратов, эффективность теста и преимущества тестирования по сравнению с традиционным лечением. Все это должно быть основанием для принятия решений об использовании фармакогенетического тестирования в реальной клинической практике [1, 3].
Cуществование ряда пока неразрешенных проблем связанных с фармакогенетикой является причиной того, что фармакогенетические тесты в клинической практике применяются крайне редко [KirchheinerJ, Kirchheiner J, 2005]. По данным Gardiner SJ, Begg EJ. (2005) в Австралии и Новой Зеландии за 1 год проводится не больше 1000 тестов. В России фармакогенетические тесты в клинической практике также редко используются. Хотя, в России существует законодательная база для использования фармакокгенетических тестов в практическом здравоохранении. Так в приказе Минздрава №494 от 22.10.03 «О совершенствовании деятельности врачей- клинических фармакологов» говорится о том, что в крупных ЛПУ должны быть организованы специальные лаборатории фармакогенетики в которых будут проводиться подобные исследования, результаты которых должны использовать клиницисты для персонализированного подхода к выбору ЛС и его режима дозирования [http://www.pharmvestnik.ru]. Однако, в приказе нет указаний на то какие именно фармакогенетические тесты должны быть использованы и как они должны интерпретироваться. Кроме того, не указана техническая база подобной лаборатории (примерный перечень оборудования и расходных материалов). Поэтому пока, указанный приказ носит лишь декларативный характер.
Однако, несмотря на это перспективность фармакогенетического тестирования для практического здравоохранения настолько очевидна, что нашло свое отражение в специальных Рекомендациях по этическим, юридическим и социальным последствиям генетического тестирования, составленных экспертами Европейской комиссии [http://europa.eu.int/comm/research/conferences/2004/genetic/pdf/recommendations_en.pdf].
Серьезным препятствием к внедрению фармакогененетических тестов в клиническую практику является и недостаточный уровень знаний в области клинической фармакогенетики у врачей и организаторов здравоохранения. Профессор FelixW. Fruech, являющийся директором Офиса геномики в клинической фармакологии и биоинформатики FDA, утверждает, что фармакогенетике уделяется недостаточное внимание как в рамках додипломного, так и последипломного образования [http://www.fda.gov/cder/genomics/presentations.htm]. По результатом специальной программы по изучению додипломного преподавания фармакогенетики, организованной FDA, было отмечено следующее:
чаще всего основы фармакогенетики преподают на 2 курсе в рамках курса фармакологии;
лишь в некоторых медицинских вузах на старших курсах имеется электив по клинической фармакогенетики;
приоритетным является изучение аллельных вариантов генов изоферментов цитохрома Р-450 (CYP2D6, CYP2C9, CYP2C19) и аллельных вариантов, использующиеся для индивидуализации фармакотерапии в онкологии (ТРМТ,DPDG);
недостаточно учебников и учебных пособий по клинической фармакогенетики;
имеется много медицинских вузов, в которых фармакогенетика вообще не преподается .
В качестве идеала, FelixW. Fruech приводит систему додипломного преподавания в Израиле, где основы фармакогенетики преподают в рамках курса фармакологии в течении 4 часов, а на старших курсах имеется электив по клинической фармакогенетики. В медицинских вузах России фармакогенетике также уделяется недостаточно внимания. Так, только в одном вузе России создана кафедра фармакогенетики (РГМУ), однако на ней обучаются только студенты медико-биологического факультета. В единичных вузах имеются элективы по фармакогенетике [Сычев Д.А., 2005]. Что касается современной учебной литературы, то в России издано пособие «Лекции по фармакогенетике» (под редакцией академика РАМН, профессора С.Б. Середенина), а также учебник «Клиническая фармакология» (под редакцией академика РАМН, профессора Кукеса В.Г.), в котором имеется большая глава «Клиническая фармакогенетика» [Середенин С.Б., 2004, Кукес В.Г., 2004].
За последние несколько десятков лет фармакогенетика достигла серьезных успехов. Количество фармакогенетических исследований растет как снежный ком. В сети Internet даже существует постоянно обновляемый ресурс, на котором собраны результаты всех проведенных фармакогенетических исследований: www.pharmgkb.org [12]. И в настоящее время уже нет никаких сомнений в том, что внедрение фармакогенетических тестов в клиническую практику, является реальным путем к персонализированной медицине, и, как следствие повышение эффективности и безопасности фармакотерапии. Уже разработан ряд фармакогенетических тестов. Кроме того, активно ведется разработка генетических микрочипов (microarray-technology), позволяющих выявлять одновременно целые серии мутантных аллелей, ответственных за изменение фармакологического ответа. Однако, темпы внедрения фармакогенетики в реальную клиническую практику нельзя признать удовлетворительными.
Материалы и методы
Нами было проведено одномоментное исследование, которое включало в себя несколько этапов:
исследование уровня знаний у студентов медицинских вузов, врачей и организаторов здравоохранения в области фармакогенетического тестирования;
исследование коммерческого российского рынка лабораторий, выполняющих фармакогенетическое тестирование для подбора дозы варфарина;
анализ доступности фармакогенетического тестирования в субъектах РФ;
оценка экономического преимущества фармакогенетического подхода к дозированию варфарина по сравнению с традиционным.
Для изучения уровня компетентности медицинских работников в области фармакогенетики был проведен анонимный опрос 316 студентов 5-го и 6-го курсов лечебного факультета ММА им. И.М. Сеченова и РГМУ им. Н.И. Пирогова (118 мужчин и 198 женщин, средний возраст 23,08 ± 2,005 года) и 178 врачей и организаторов здравоохранения из различных субъектов Российской Федерации (70 мужчин и 108 женщин, средний возраст 40,83 ± 11,1 лет). Среди опрошенных врачей и организаторов здравоохранения, 33,6% работают в городских больницах на территории РФ, 11,7% - в городских поликлиниках, 9,5 % - в центральных районных больницах, 7,9 % - в ФГУ, 7,3% - в научно-исследовательских институтах, 5 % - в высших учебных заведениях, остальные участники исследования – в других лечебных учреждениях (диспансеры, диагностические центры, ведомственные больницы и больницы восстановительного лечения).
Участникам исследования предлагалось ответить на 17 (для студентов) и 15 (для врачей и организаторов) вопросов анонимной анкеты, на предмет осведомленности о фармакогенетическом тестировании. Перед началом тестирования всем участникам давались четкие инструкции о правильности заполнения анкет, после чего начиналось анкетирование. После сбора анкет данные вводились в общую базу и обрабатывались при помощи программы SPSS для Windows v. 15.
Для анализа коммерческого рынка фармакогенетического тестирования осуществлялся поиск в сети Интернет с помощью поисковой системы Google лабораторий и медицинских центров, предлагающих на коммерческой основе фармакогенетическое тестирование больных для выявления индивидуальной чувствительности к варфарину (при этом использовались ключевые слова: «варфарин», «фармакогенетика», «фармакогенетическое тестирование», «CYP2C9», «VKORC1»). Далее оценивались характеристики фармакогенетического тестирования для выявления индивидуальной чувствительности к варфарину, которое предлагалось лабораториями, исходя из информации на официальных сайтах лабораторий и телефонного интервьюирования их справочной службы по специально разработанной схеме:
Проводится ли в лаборатории фармакогенетический тест на выявление у пациента полиморфизмов генов CYP2C9 и VKORC?
Какова его стоимость?
Сроки выполнения?
Какой тип заключения выдаётся лабораторией?
Даются ли рекомендации по дозированию варфарина?
В исследование доступности фармакогенетического тестирования в субъектах РФбыли включены 20 ведущих клинических фармакологов из разных субъектов РФ. Им были направлены письма (по электронной почте и почте России), содержащие экспертную карту, включающую в себя вопросы на темудоступности фармакогенетического тестирования в данном регионе,с предложением заполнить карту и отправить обратно адресату. На данный момент времени, разосланы 25 экспертных карт и получено 8 ответов из следующих областей: Владимирская, Челябинская, Смоленская, Московская, Белгородская, Ленинградская, из Приморского и Хабаровского края.
Обработка и анализ полученных ответов проводился при помощи программы SPSSforWindowsv. 13
Далее проводилась оценка стоимости лечения пациентов с постоянной формой мерцательной аритмии варфарином.В ретроспективное исследование (группа 1) были включены 82 человека (женщин - 47,56%, мужчин – 52,43 %) с постоянной формой мерцательной аритмии, при которой показан прием варфарина. Средний возраст больных, включенных в исследование, составил 63,4 ± 10,3 года. Сопутствующие заболевания – тромбоэмболия легочной артерии, тромбоз ЛЖ, ревматоидный порок, ишемическая болезнь сердца, инфаркт миокарда. Пациентам, включенным в исследование, назначалась терапия варфарином с начальной дозы – 5 мг. Далее по схеме (см. схема № 1) производилась коррекция дозы до достижения нормы уровня МНО.
Таблица Подбор дозы варфарина
-
1-й день
Назначается расчетная доза варфарина
2-й день
Назначается расчетная доза варфарина
3-й день
Определение МНО
МНО менее 1,5
Увеличить суточную дозу варфарина на 1/2 таблетки
МНО 1,5-2
Увеличить суточную дозу варфарина на 1/2 таблетки
МНО 2-3
Оставить суточную дозу варфарина без изменений
МНО 3-4
Уменьшить суточную дозу на ¼ таблетки
МНО более 4
Пропустить 1 дозу варфарина, далее суточную дозу варфарина уменьшить на ½ таблетки
5-й день
Определение МНО.
Действовать по алгоритму 3-го дня.
В проспективное исследование (группа 2) было включено 77 пациентов (33 женщины (42,9 %) и 44 мужчины (57,1 %)) с постоянной формой мерцательной аритмии, при которой показан прием варфарина. Средний возраст пациентов составил 60 ± 12 лет. Сопутствующие заболевания – сахарный диабет, тромбоз глубоких вен, тромбоз поверхностных вен, острое нарушение мозгового кровообращения, острый инфаркт миокарда. После включения в исследование у пациентов производился забор крови для проведения генетического тестирования с целью выявления «медленных» аллельных генов CYP2C9. После завершения тестирования проводилось определение международного нормализованного отношения (МНО), которое необходимо для дальнейшего подбора и коррекции дозы варфарина. После этого, определялась расчетная доза, с которой необходимо начинать лечение пациента. При выявлении гетерозиготного носительства медленных аллельных вариантов начинали терапию варфарином с дозы 2,5 мг\сутки, при выявлении гомозиготного носительства – 1,25 мг\сутки. Далее производилась коррекция дозы по уровню МНО для достижения целевых значений МНО в двух смежных анализах.
Нами рассчитывались затраты на лечение пациентов в обеих группах.
Для изучения экономических затрат на лечение кровотечений были разработаны карты экспертной оценки ведения пациентов скровотечениями следующих локализаций, отмеченными у исследуемых групп: геморроидальным, гемофтальмом и гемартрозом, в связи с отсутствием федеральных стандартов оказания медицинской помощи по данным видам кровотечений. По каждой из нозологий карты заполнялись ведущими специалистами (3-4 специалиста по каждому кровотечению) федеральных лечебных учреждений. Далее стоимость медицинских услуг рассчитывалась по тарифам ОМС. Также в исследуемых группах отмечены желудочно-кишечные кровотечения и острое нарушение мозгового кровообращения, стоимость которых (за законченный случай) получена из тарифов ОМС на оказание стационарной помощи. С учётом произведенных калькуляций была посчитана средняя стоимость лечения по каждому кровотечению и общие расходы на лечение пациентов (с учётом кровотечений) в обеих группах.
Результаты и обсуждение
Согласно опросу, проведенному среди врачей и организаторов здравоохранения, получены следующие результаты. Знают о существовании фармакогенетических тестов, используемых в клинической практике, 65,4 % опрошенных. 28,5 % узнали о тестах из медицинской периодики, 23,5 % - из цикла обучения, 22,9 % - от коллег, 18,4 % - из Интернета и 10,6% - из средств массовой информации (рис. 1). Для объективной оценки осведомленности опрашиваемых о фармакогенетическом тестировании в анкету был включен вопрос, знает ли респондент о существовании 5 конкретных тестов, при этом в перечень было включено 2 теста, которых на самом деле не существует. Большинство опрошенных (31,8%) ответили, что знают о существовании теста для определения генетических маркеров риска нарушений метаболизма варфарина (полиморфизмы CYP2C9*2 и CYP2C9*3 или мутации в гене VKORC1), 15,1 % - знают про тест для определения чувствительности к трастузумабу/герцептину (выявление экспрессии рецепторов эпидермального фактора роста человека 2 типа – HER2 – в опухоли молочной железы) и 23,5 % - про тест для определения чувствительности к трициклическим антидепрессантам (выявление медленных аллельных вариантов гена CYP2D6). Однако48,6% опрошенных«знают» о существовании ложных тестов (несуществующих): теста для определения чувствительности к метамизолу натрия/анальгину (19,0%) и теста для определения генетической предрасположенности к развитию аллергических реакций на пенициллины (29,6%) (рис. 2).
78 участников исследования (43,16%) согласились с тем, что при подборе дозы варфарина необходимо использовать фармакогенетический тест. Однако большинство опрошенных (40,8%) полагают, что в настоящее время использование фармакогенетических тестов в здравоохранении экономически не приемлемо (36,9% участников затруднились ответить на этот вопрос). При ответе на вопрос о стоимости одного теста мнения участников характеризовались большим разнообразием, 45,3% не ответили на вопрос, а остальные варианты включают в себя разброс от 10 до 6000 рублей. Среди причин, затрудняющих внедрение фармакогенетики в клиническую практику, 69,8 % опрошенных видят плохую информированность медицинских работников о возможностях фармакогенетики, 72,1 % - отсутствие лабораторий, 48,6 % - высокую стоимость фармакогенетического тестирования, 43,6 % - отсутствие квалифицированных кадров (рис. 3). Почти половина участников исследования совершенно согласны с утверждением, что внедрение фармакогенетического тестирования будет способствовать повышению эффективности (43,0 %) и безопасности (47,5%) лекарственной терапии. 56,4% анкетируемых высказались за внедрение обучения фармакогенетике врачей всех специальностей, 53,1% - клинических фармакологов, и 50,3% - за обучение всех студентов медицинских вузов.

Рисунок 1. Источники информации о фармакогенетических тестах (доля респондентов, отметивших каждый источник, % ).
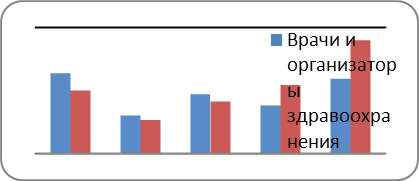
Рисунок 2. Осведомлённость опрошенных о существовании некоторых фармакогенетических тестов (включая несуществующие) (доля респондентов, знающих о существовании теста, % )
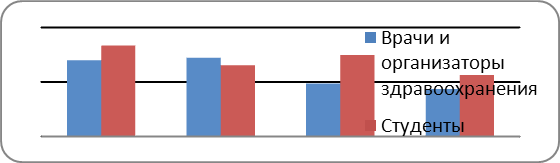
Рисунок 3. Причины, препятствующие внедрению фармакогенетических тестов в клиническую практику (ответы респондентов, на 100 опрошенных).
Среди опрошенных студентов получены следующие результаты. На вопрос, что изучает фармакогенетика, 62,7% опрошенных студентов выбрали правильный вариант ответа, т.е. влияние генетических особенностей человека на фармакологические эффекты лекарственного средства. Остальные ответили неправильно, либо затруднились ответить на этот вопрос (4,4% считает, что фармакогенетика изучает всасывание, распределение, метаболизм и выведение лекарственных средств, 19,6% - влияние лекарственных средств на геном человека, 9,5% - все вышеуказанное и 2,5% затрудняются ответить). На вопрос об осведомленности о существовании в настоящее время фармакогенетических тестов, используемых в клинической практике, положительно ответили 44,6% участников исследования. 21,2% узнали о тестах из Интернета, 15,8% - из средств массовой информации, 14,2% - от коллег, 13,6 % - из цикла обучения и 11,4 % - из медицинской периодики (см. рис.1). Таким образом, Интернет и СМИ чаще являлись источниками информации о фармакогенетическом тестировании для студентов, чем для врачей и организаторов здравоохранения, в то время как последние чаще, чем студенты, получали информацию из медицинской периодики, на обучающих циклах и от коллег.
Большая часть студентов (72,1%) ответили, что знают о существовании ложных тестов (несуществующих): для определения чувствительности к метамизолу натрия/анальгина (27,2%) и для определения генетической предрасположенности к развитию аллергических реакций на пенициллины (44,9%). Знают о существовании тестов для определения генетических маркеров риска нарушений метаболизма варфарина (полиморфизмы CYP2C9*2 и CYP2C9*3 или мутации в гене VKORC1) 25% опрошенных, для определения чувствительности к трастузумабу/герцептину (выявление экспрессии рецепторов эпидермального фактора роста человека 2 типа – HER2 – в опухоли молочной железы) - 13,3% и для определения чувствительности к трициклическим антидепрессантам (выявление медленных аллельных вариантов гена CYP2D6) – 20,6% опрошенных (см. рис. 2). В целом выявилось, что студенты гораздо чаще «знают» о несуществующих тестах, чем работающие врачи, и менее информированы о реально существующих тестах.
56% студентов считают, что фармакогенетическое тестирование недоступно для больных в настоящее время и 49,1% - что оно экономически неприемлемо для системы здравоохранения в настоящее время. При ответе на вопрос: «Сколько должен стоить один фармакогенетический тест для одного пациента?»,- 68,7% протестированных студентов затруднились ответить. Основными причинами, которые затрудняют внедрение фармакогенетики в клиническую практику, по мнению студентов, являются в целом те же, что и были обозначены врачами и организаторами здравоохранения: отсутствие лабораторий проводящих тестирование (65,2%), плохая информированность медицинских работников и организаторов здравоохранения о возможностях фармакогенетики (83,5%), высокая стоимость тестирования (74,7%), отсутствие квалифицированных кадров (56,3%) (рис. 3). За необходимость обучения фармакогенетике врачей всех специальностей высказались 76,9% опрошенных, за обучение клинических фармакологов – 58,5%, студентов медицинских вузов - 47,5%.
Таким образом, среди всех опрошенных отмечается недостаток необходимой и полной информированности о современных возможностях фармакогенетики и способах ее внедрения в клиническую практику. Пока студенты слабо представляют себе, что такое клиническая фармакогенетика и зачем она нужна. Половина медицинских работников не знают о существовании фармакогенетического тестирования и не имеют понятия о его стоимости. Поэтому важным представляется повышение компетентности врачей в области фармакогенетики и приобретение навыков практического использования фармакогенетического тестирования, для чего необходимо наладить обучение персонала фармакогенетических лабораторий. При этом, как показал опрос, проведенный среди специалистов здравоохранения, координировать проведение фармакогенетического тестирования у пациентов в ЛПУ должны именно врачи - клинические фармакологи. Полученные данные указывают на необходимость существенной переработки учебных программ как на до-дипломном, так и на послевузовском этапах обучения врачей. Необходима разработка отдельных практических, лабораторных занятий, лекций и прочих форм обучения, посвященных современным возможностям клинической фармакогенетики, позволяющим оптимизировать фармакотерапию пациентов.
Однако даже если сформировать компетенции в области фармакогенетики у специалистов здравоохранения, очевидно, что внедрение клинической фармакогенетики в клиническую практику возможно только при доступности фармакогенетических тестов для врачей и пациентов. Поэтому на следующем этапе был исследован российский рынок лабораторий и медицинских центров, предлагающих на коммерческой основе фармакогенетическое тестирование у больных для выявления индивидуальной чувствительности к варфарину. Всего было найдено 18 лабораторий, выполняющих фармакогенетические тесты для выявления индивидуальной чувствительности к варфарину, из них 10 (55,5%) в Москве, 2 (11,1) в Санкт-Петербурге, по 1 (5,5%) в Ростове-на-Дону, Пензе, Нижнем Новгороде, Волоколамске, Новосибирске и Екатеринбурге (рис. 4). В 11 (61,1%) лабораториях фармакогенетическое тестирование выполняется в полном объеме, т.е. определяются полиморфизмы и гена CYP2C9 и VKORC1. При этом средняя стоимость полного варианта фармакогенетического тестирования составила 5987 ± 3786 рублей. Самое дорогое тестирование проводится в Москве (12000 рублей), а самое дешевое в Новосибирске (850 рублей). Фармакогенетическое тестирование выполняется 18 ± 9 дней. Заключение о типе установленного в ходе тестирования генотипа выдают все найденные лаборатории, однако, клиническую интерпретацию с конкретными рекомендациями по дозированию варфарина лишь 10 (55,5%) лабораторий и 1 (5,5%) за отдельную плату (таблица 1).
Проведенный анализ показал, что в Российской Федерации отмечается недостаток информации о лабораториях, проводящих фармакогенетическое тестирование для выявления индивидуальной чувствительности к варфарину. При оптимальном сроке выполнения теста в 2 – 4 дня, все лаборатории слишком долго проводят данную процедуру. Стоимость тестирования широко варьирует даже в лабораториях, расположенных в одном городе и чаще высока, что делает фармакогенетическое тестирование недоступным для большинства пациентов. Большинство учреждений, способных провести данный вид тестирования, расположены в Центральном федеральном округе, тогда как в других регионах страны это единицы. Не во всех лабораториях даются четкие клинические рекомендации для врача по дозированию варфарина на основе результатов фармакогенетического тестирования.
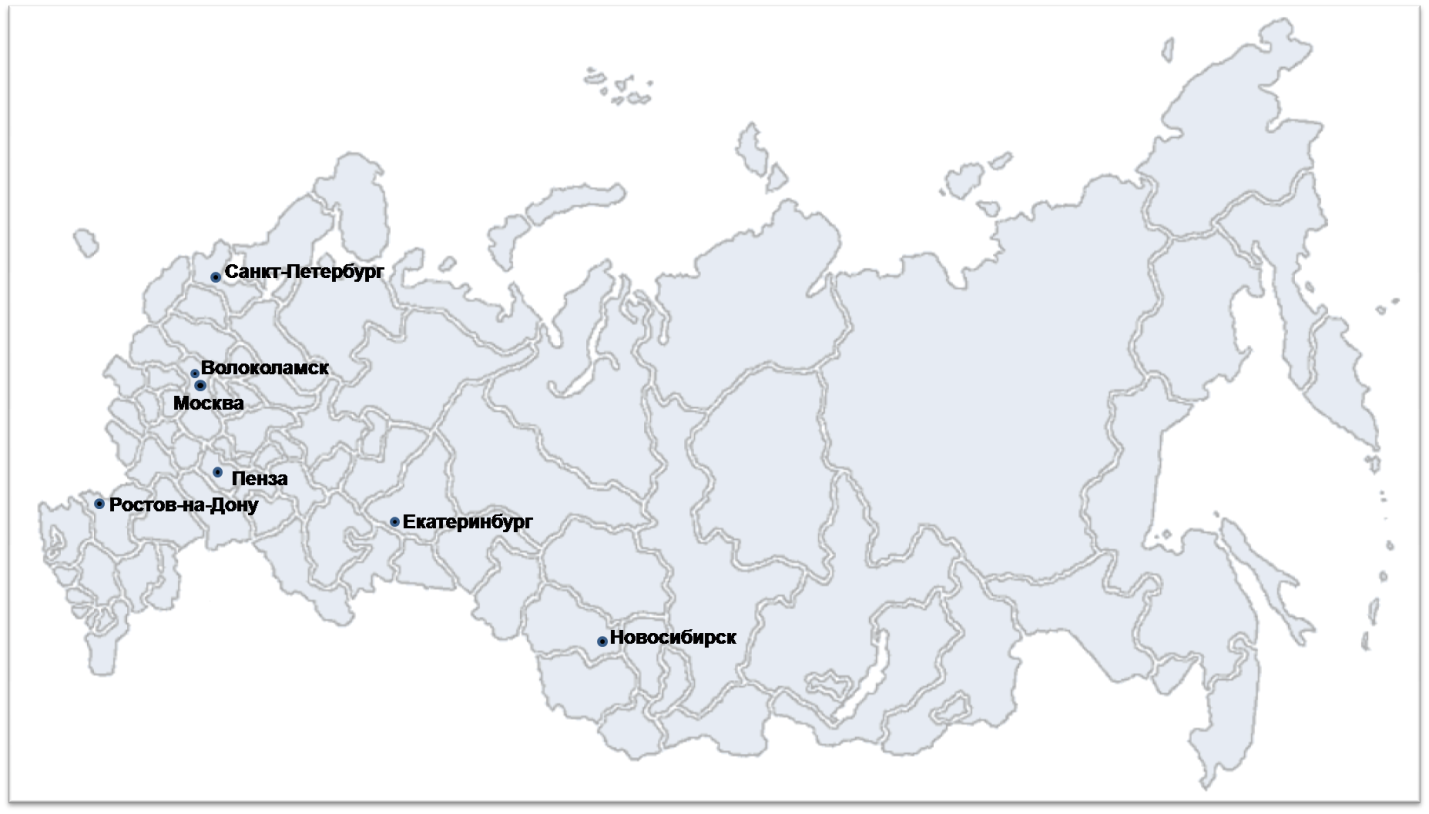
Рисунок 4. Города Российской Федерации, в которых имеются коммерческие лаборатории, выполняющие фармакогенетическое тестирование для выявления индивидуальной чувствительности к варфарину.
Таблица. Коммерческие лаборатории, выполняющие фармакогенетическое тестирование для выявления индивидуальной чувствительности к варфарину и условия его выполнения
-
Название лаборатории
Стоимость
Сроки проведения
Тип заключения
Сайт лаборатории
Клиника "Примамедика", г. Москва
CYP2C9 - 1200 р, VKORC - 6000 р.
VKORC - 21 день, CYP2C9 - 14 дней
Генотип + генетическая карта
www.primamedica.ru
Мед.центр "Новомедицина", г. Ростов-на-Дону
CYP2C9 - 2200р. VKORC - 6200 р.
7 дней
Через 7 дней электронный вариант, через 14 в письменном виде на фирменном бланке с рекомендациями
www.novomedicina.ru
"Ситилаб", г. Москва
CYP2C9 - 1000 р.
10 дней
Вид генотипа
www.citilab.ru
"Инвитро", г. Москва
СYP2C9 - 2000р. VKORC - 10000 р.
VKORC - 21 день, CYP2C9 - 21 день
Вид генотипа + генетическая карта здоровья
www.invitro.ru
ЗАО "Постгеномные и нанотехнологические инновации", г. Москва
CYP2C9 - 2700 р.
CYP2C9 - 15 дней
Вид генотип + генетическая карта
www.pynny.ru
Лабораторная служба Хеликс, г. Москва
Оба полиморфизма вместе
2 100р.
21 день
E-mail, курьером, фирменный бланк, генотип + рекомендации
www.helix.ru
ИммуноБиоСервис, г. Санкт-Петербург
CYP2C9 - 1050 р.
14 дней
Вид генотипа
www.immunobios.ru
Диагностический центр "Гемотес", г. Нижний Новгород
CYP2C9 - 3600 р.
14 дней
Вид генотипа
www.gemotes.ru
Мед.центр "Земский врач", г. Волоколамск
CYP2C9 - 1800 р., VKORC - 9000 р.
21 день
Вид генотипа на фирменной бланке
www.zemvrach.ru
"Литех", г. Москва
CYP2C9 - 1800 р.
15 дней
Вид генотипа
www.lytech.ru
Центр молекулярной генетики, г. Москва
CYP2C9 - 1000 р., VKORC - 5000 р.
CYP2C9 - 14 дней, VKORC - 21 день
Вид генотипа при обоих исследованиях
www.dnalab.ru
"Центр Здоровья" г.Пенза
CYP2C9 - 1800 р., VKORC - 6000 р.
CYP2C9 - 35 дней, VKORC - 42 дня
Вид генотипа на фирменном бланке + рекомендации
www.sdoctor.ru
Центр новых медицинских технологий в Академгородке
Оба полиморфизма вместе
850р.
10 дней
Вид генотипа + интерпретация генетика
www.cnmt.ru
"Оптитест", г.Москва
Оба полиморфизма вместе 3 261р.
10 рабочих дней
Вид генотипа
www.optitest.ru/
Северо-Западный Центр Доказательной Медицины (СЗ ЦДМ), г. Санкт-Петербург.
Выполняется только в комплексе "нарушения свертываемости крови" - 2000р., или в компл. "нарушения переносимости лек.средств" - 3200р.
21 день
Вид генотипа
www.gosmed.ru/
Центр эндохирургии и литотрипсии (ЦЭЛТ). Клинико-биохимическая лаборатория, г.Москва.
CYP2C9 - 1200 р, VKORC - 5200 р.
2-3 недели
Вид генотипа
www.celt.ru
"ПрогрессЛаб", г.Москва
общая - 1050р. (CYP2C9 - 700р, VKORC - 350р.)
в течение недели
Вид генотипа
http://www.progress-lab.ru
Медицинский центр "Уральский", г.Екатеринбург
CYP2C9 - 500р.
в течение недели
Генотип + рекомендации
http://uralmc.ru
При исследованиидоступности фармакогенетического тестирования в субъектах РФполучены следующие результаты. На вопрос «Какие фармакогенетические тесты можно выполнить в лабораториях вашего региона?» были получены следующие ответы:
Определение генетических маркёров риска нарушений метаболизма варфарина (полиморфизмы CYP2C9*2 и CYP2C9*3 или мутации в гене VKORC1) – половина (50 %) участников исследования ответили положительно.
Определение чувствительности к трастузумабу / герцептину (выявление экспрессии рецепторов эпидермального фактора роста человека 2 типа – HER2 - в опухоли молочной железы) – все (100%) опрошенные ответили отрицательно
Определение чувствительности к трициклическим антидепрессантам (выявление «медленных» аллельных вариантов гена CYP2D6) – выполняется только в одном (12,5%) из опрошенных регионов.
Помимо стандартных тестов, в Хабаровском краедополнительно проводится определение типа ацетилирования и окисления, в Ленинградской области – определение полиморфизма гена CYP2C19.
Тестирование можно выполнить в центральной научно-исследовательской лаборатории (Ленинградская обл.), в городской больнице (Ленинградская обл.), в медико-генетическом центре (Приморский край), в платной независимой лаборатории (Смоленская и Челябинская обл.), в центре клинической фармакологии (Хабаровский край).Во всех опрошенных субъектах тест недоступен за счет средств муниципального бюджета.
В 7 регионах из 8(87,5%) перед назначением лекарственного препарата не назначают ФГ тестирование.62,5%опрошенных считают ФГ тесты экономически приемлемыми для системы здравоохранения в настоящее время.62,5 % затруднились ответить на вопрос о стоимости ФГ теста в РФ.Основными причинами, мешающими внедрению ФГ тестов в здравоохранение по мнению участников исследования, являются: отсутствие лабораторий, проводящих ФГ тестирование(75%), плохая информированность медицинских работников (62,5%), высокая стоимость ФГ тестов (50%).87,5% опрошенных считают, что фармакогенетике необходимо обучать врачей всех специальностей.
При оценке экономического преимущества фармакогенетического подхода к дозированию варфарина по сравнению с традиционнымполучены следующие результаты. Общее число наблюдений в первой группе (без тестирования) составило 702 человеко-месяца и во второй группе (после тестирования) 443 человеко-месяца. Число измерений МНО в первой группе составило 808, во второй - 646. Число выходов МНО за пределы нормы в первой группе составило 83 (10,3%), во второй группе 8 (1,2%) (рис. 5). Число кровотечений (на 100 чел-мес. наблюдений) в группе без тестирования составило 56, а в группе после тестирования 3 (рис. 6). Частота кровотечений (на 100 чел-мес. наблюдений) в первой группе также в несколько раз больше (22), чем в группе после тестирования (3) (рис. 7).
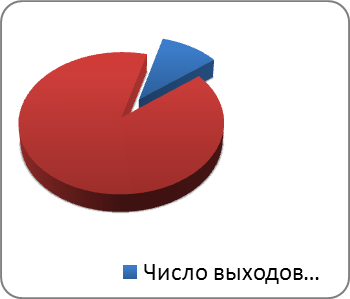
Рисунок 5. Число выходов МНО за пределы нормы от общего числа измерений в группах 1 и 2.
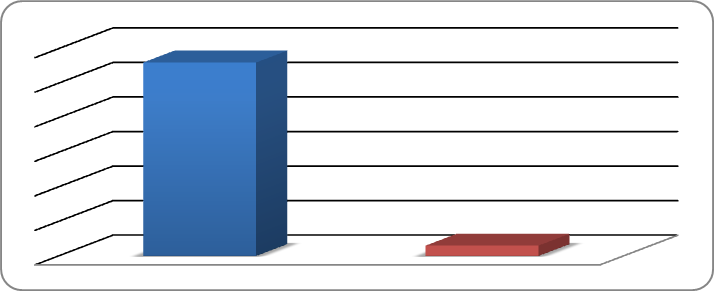
Рисунок 6. Число кровотечений (на 100 чел-мес наблюдений).
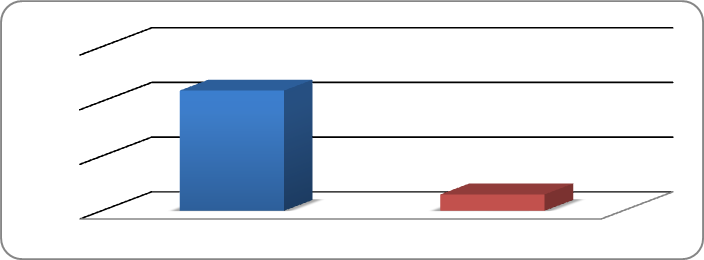
Рисунок 7. Частота кровотечений (на 100 чел-мес наблюдений).
Затраты на варфарин на 1 человеко-месяц в обеих группах оказались практически идентичными –в первой группе (без тестирования) затраты составили 134,97 (± 67,6)руб., во второй (после тестирования) – 134,46 (± 53,69) руб. Также и затраты на МНО на 1 человеко-месяц в первой группе составили 10,68 (± 13,25) руб., а во второй – 10,01 (± 3,07) руб. Однако затраты на визиты к врачу снижаются во второй группе более чем в 5 раз: в первой группе составили 18,73 (± 45,3) руб., во второй – 3,51(± 7,74) руб. (рис. 8). За счёт этого снижаются и общие затраты в группе с применением тестирования до 147,99 (± 55,09) руб., при этом в группе без тестирования они составили 164,38 (± 71,2) руб. Общие расходы на суммарное количество наблюдений (с учётом средней стоимости кровотечений) в первой группе составили 257 руб., при этом во второй группе расходи снизились почти на сто рублей и составили 170,4 руб. (Р = 0,032)(таблица 2).
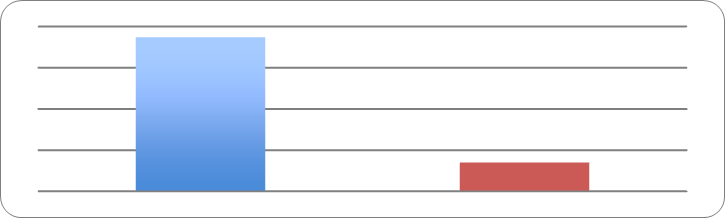
Рисунок 8. Затраты на визиты к врачу на 1 чел-мес, руб.
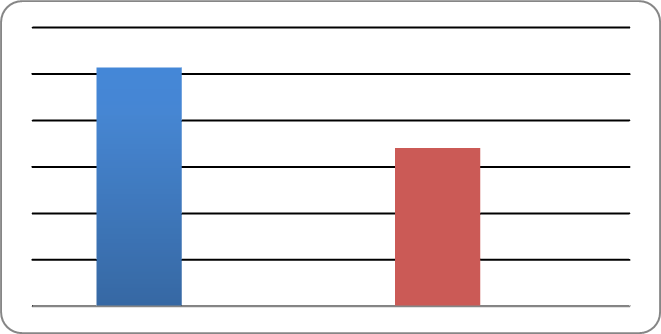
Рисунок 9.Общие расходы на суммарное количество наблюдений (руб.)
Были также расчитаны затраты на варфарин на 1 человеко-месяц в первой группе у пациентов, наблюдавшихся менее года, и составили 142,72 (± 61,2) руб. и в первой группе с периодом наблюдения год – 131,36 (± 70,69) руб. Затраты на МНО на 1 человеко-месяц для наблюдавшихся менее года составили 18,15 (± 21,98) руб., для наблюдавшихся год – 7,21 (± 0,62) руб. Затраты на визиты к врачу в группе с наблюдением менее года составили 45,1 (± 74,15) руб., в группе с наблюдением год 6,48 (± 6,5) руб. Общие затраты в группе с наблюдением менее года составили 205,98 (± 61,87) руб., а в группе с периодом наблюдения год – 145,06 (± 67,4) руб. Общие расходы на суммарное количество наблюдений (с учётом кровотечений) у наблюдавшихся менее года составили 183,6 руб., у наблюдавшихся год – 248,11 руб. (Р = 0,0001) (таблица 3). Полученные результаты позволяют предполагать, что первые месяцы терапией варфарином являются самыми «дорогими» за счёт частых измерений и выходов МНО за пределы нормы при подборе доз препарата без проведения фармакогенетического тестирования. При этом общие расходы с учётом кровотечений у наблюдавшихся менее года меньше, т.к.в первой группе крупные кровотечения отмечены только у наблюдавшихся в течение года, что и увеличило общую стоимость в данной группе.
Таблица 2. Затраты в группах без применения тестирования и после на 1 чел-мес, руб.
-
Показатель
Группа 1, без тестирования
Группа 2, после тестирования
Затраты на варфарин на 1 чел-мес, руб. (М±σ)
134,97±67,6
134,46±53,69
Затраты на МНО на 1 чел-мес, руб. (М±σ)
10,68±13,25
10,01±3,07
Затраты на визиты к врачу на 1 чел-мес, руб. (М±σ)
18,73±45,3
3,51±7,74
Общие затраты на 1 чел-мес, руб. (М±σ)
164,38±71,2
147,99±55,09
Общие затраты на 1 чел-мес, руб. (с учётом кровотечений)
257
170,4
P=0,032 (P< 0,05 при 5% уровне значимости, различия достоверны)
Таблица 3. Затраты в группе без применения тестирования для наблюдавшихся год и менее года на 1 чел-мес, руб.
-
Показатель
Группа 1, наблюдение менее года
Группа 1, наблюдение год
Затраты на варфарин на 1 чел-мес, руб. (М±σ)
142,72±61,2
131,36±70,69
Затраты на МНО на 1 чел-мес, руб. (М±σ)
18,15±21,98
7,21±0,62
Затраты на визиты к врачу на 1 чел-мес, руб. (М±σ)
45,1±74,15
6,48±6,5
Общие затраты на 1 чел-мес, руб. (М±σ)
205,98±61,87
145,06±67,4
Общие затраты на 1 чел-мес, руб. (с учётом кровотечений)
183,6
248,11
P=0,0001 (P< 0,05 при 5% уровне значимости, различия достоверны)
В ходе последнего исследования мы столкнулись со следующими методическими проблемами:
Недостаток информации о стоимости лечения больных с некоторыми нозологиями.
Точки зрения экспертов на лечение пациентов часто несовпадают.
Экспертам сложно представить «среднего» больного (они считают, что всё индивидуально).
Выводы
1) Среди практикующих медицинских работников и студентов старших курсов медицинских вузов отмечается недостаток необходимой и полной информированности о современных возможностях фармакогенетики и способах ее внедрения в клиническую практику: почти половина медицинских работников (34,6% врачей и организаторов здравоохранения и 55,4% студентов) не знают о существовании фармакогенетического тестирования и не имеют понятия о его стоимости (45,3% врачей и организаторов здравоохранения и 68,7% студентов не ответили на вопрос о стоимости ФГ тестирования),48,6% опрошенных врачей и организаторов и 72,1% студентов «знают» о существовании ложных тестов (несуществующих).
2) Опрос главных клинических фармакологов в 8 субъектах РФ показал низкий уровень доступности фармакогенетического тестирования на их территории. В некоторых из опрошенных субъектов вообще не проводятся фармакогенетические исследования. Если же говорить о проведении теста за счет муниципальных средств, такого нет ни в одном из опрошенных субъектов РФ.Во всех субъектах врачи очень редко или никогда не рекомендуют фармакогенетический тест перед назначением варфарина.
3) Проведенный анализ показал, что в Российской Федерации отмечается недостаток информации о коммерческих лабораториях, проводящих фармакогенетическое тестирование для выявления индивидуальной чувствительности к варфарину, а в имеющихся лабораториях при оптимальном сроке выполнения теста в 2 – 4 дня, слишком долго осуществляют данную процедуру. Стоимость тестирования широко варьирует даже в лабораториях, расположенных в одном городе и чаще высока (средняя стоимость полного варианта фармакогенетического тестирования 5987 ± 3786 рублей), что делает фармакогенетическое тестирование недоступным для большинства пациентов. Большинство учреждений, способных провести данный вид тестирования, расположены в Центральном федеральном округе, тогда как в других регионах страны это единицы. Не во всех лабораториях даются четкие клинические рекомендации для врача по дозированию варфарина на основе результатов фармакогенетического тестирования.
4) Подбор дозы при назначении лекарственной терапии варфарином, осуществляемый традиционным методом без фармакогенетического тестирования, сопровождается повышением частоты кровотечений, что может сказаться на затратах на ведение больных. Без учета затрат на кровотечения стоимость лекарственного лечения за 1 человеко-месяц, включая необходимый контроль показателей свертываемости крови, без проведения и после проведения фармакогенетического тестирования практически одинакова, однако если учитывать затраты на кровотечения, 1 человеко-месяц в группе проходивших тестирование, значимо дешевле.
Практические рекомендации
Важным представляется повышение компетентности врачей в области фармакогенетики и приобретение навыков практического использования фармакогенетического тестирования, для чего необходимо наладить обучение персонала фармакогенетических лабораторий. Полученные данные указывают на необходимость кафедрам клинической фармакологии медицинских вузов существенной переработки учебных программ как на до-дипломном, так и на послевузовском этапах обучения врачей. Институтам последипломной подготовки врачей необходимо разработать отдельные практические, лабораторные занятия, лекции и прочие формы обучения, посвященные современным возможностям клинической фармакогенетики, позволяющим оптимизировать фармакотерапию пациентов.
Однако даже если сформировать компетенции в области фармакогенетики у специалистов здравоохранения, очевидно, что внедрение клинической фармакогенетики в клиническую практику возможно только при доступности фармакогенетических тестов для врачей и пациентов. Для увеличения эффективности внедрения фармакогенетического тестирования необходимо увеличение количества лабораторий в целом по территории России. Необходимо организовать ряд региональных программ, направленных как на улучшение информированности населения о возможностях данных лабораторий, так и на обучение специалистов соответствующего профиля, для проведения качественных исследований. Своевременное и качественное проведение этих программ позволить повысить спрос на фармакогенетические тесты, тем самым, их цена, несомненно, снизится.
Необходимо повышать уровень осведомленности о тестировании по всей территории РФ. Руководству субъектов РФ необходимо разработать и принять на муниципальном уровне четкие, не содержащие двоякого толкования рекомендации по внедрению и назначению тестирования на своей территории. Так же необходимо оказать содействие, упростив процедуру регистрации таких лабораторий, выделить рекламное пространство и обеспечить эффективную работу.
При поддержке Российской академии медицинских Наук необходимо проведение числа отечественных исследований применения фармакогенетического тестирования для оптимизации дозирования варфарина, с целью подтверждения экономических преимуществ. Экономическая оценка должна учитывать стоимость фармакогенетических тестов, стоимость препаратов, эффективность теста и преимущества тестирования по сравнению с традиционным лечением. Все это должно быть основанием для принятия решений об использовании фармакогенетического тестирования в реальной клинической практике.
Литература
Сычев Д.А., Раменская Г.В., Игнатьев И.В., Кукес В.Г. Клиническая фармакогенетика. Под ред. В.Г. Кукеса, Н.П. Бочкова. М.: Гэотар-Медиа, 2007, 248с.
Anderson JL, Horne BD, Stevens SM, Grove AS, Barton S, Nicholas ZP, et al. Couma-Gen Investigators. Randomized trial of genotype-guided versus standard warfarin dosing in patients initiating oral anticoagulation. Circulation. 2007;116:2563-70.
Hillman MA, Wilke RA, Yale SH, Vidaillet HJ, Caldwell MD, Glurich I et al. A prospective, randomized pilot trial of model-based warfarin dose initiation using CYP2C9 genotype and clinical data. Clin Med Res. 2005;3:137-45.
Eckman MH, Rosand J, Greenberg SM, Gage BF. Cost-effectiveness of using pharmacogenetic information in warfarin dosing for patients with nonvalvular atrial fibrillation. Ann Intern Med. 2009 Jan 20;150(2):73-83.
McWilliam A, Lutter R, Nardinelli C. Health Care Savings from Personalizing Medicine Using Genetic Testing: The Case of Warfarin. Clin Pharmacol Ther. 2006; 76: 6-23.
Sychev D., Antonov I., Ignatev I., Kasakov R., Gerasimova K., Dmitriev V., Kukes V. Advantages of pharmacogenetic approach (polimorphisms of genes CYP2C9 and VKORC1 study) to warfarin dosing, against the standard method for Russian patients with contestant form atrial fibrilation. J Basic and Clinical Pharmacology.- 2009.- v.105.- p. 73-74.
You JH, Chan FW, Wong RS, Cheng G. The potential clinical and economic outcomes of pharmacogenetics-oriented management of warfarin therapy - a decision analysis. Thromb Haemost. 2004 Sep;92(3):590-7.
Kalow W., Medical practice, race, and drug use. Clin Pharmacol Ther. 2003 Jan;73(1):132-4.
Evans WE. Pharmacogenomics: marshalling the human genome to individualise drug therapy.St Jude Children's Research Hospital, Memphis, TN 38101-0318, USA.
10. Lindpaintner K. Pharmacogenetics: ethical problems and solutions. 2004
11. Thorn CF. PharmGKB: the pharmacogenetics and pharmacogenomics knowledge base. UK Medicines and Healthcare products Regulatory Agency., Klein TE, Altman RB. Methods Mol Biol. 2005;311:179-91. Review.
12. Weinshilboum R. Pharmacogenetics: The future is here!Mol Interv. 2003 May;3(3):118-22.
13. McLeod HL.Pharmacogenetic analysis of clinically relevant genetic polymorphisms.Clin Infect Dis. 2005 Nov 15;41 Suppl 7:S449-52. Review.